引用本文: 張惟, 王月欣, 陳松, 段紅濤, 孔佳慧, 董蒙, 畢雪, 宋建. 玻璃體腔注射人臍帶間充質干細胞誘導分化的神經干細胞對糖尿病大鼠視網膜腦源性神經營養因子表達及視網膜神經節細胞計數的影響. 中華眼底病雜志, 2016, 32(6): 601-604. doi: 10.3760/cma.j.issn.1005-1015.2016.06.009 復制
糖尿病視網膜病變(DR)是一種神經血管性病變,其微血管系統出現病變前已經存在神經組織損傷,病理改變主要包括神經元凋亡、神經膠質細胞活躍及內層視網膜變薄[1]。探討DR神經損傷機制以阻止其發生發展是目前眼科研究的前沿與焦點。間充質干細胞(MSC)是來源于中胚層的一類多能干細胞,具有定向分化替代受損細胞、神經營養保護、抗炎、抑制血管新生等多種生物學作用,是治療視網膜神經退行性病變理想的種子細胞之一[2]。MSC還具有較強增生、分化及免疫調節能力,其分泌的各種細胞因子能夠抑制細胞凋亡,促進神經修復及加強神經穩定[3]。體外實驗已證實人臍帶MSC (hUCMSC)在一定誘導條件下能夠定向分化為神經干細胞(NSC),而NSC能夠通過分泌神經營養因子發揮更強的神經保護作用[4]。但NSC能否有效緩解DR早期視網膜神經節細胞(RGC)數目減少目前尚不清楚。為此,我們對hUCMSC進行傳代培養和神經分化,觀察玻璃體腔注射hUCMSC誘導分化的NSC對糖尿病大鼠視網膜腦源性神經營養因子(BDNF)表達及RGC計數的影響,以期為DR的臨床防治提供實驗依據。
1 材料和方法
1.1 hUCMSC分離培養及其向NSC誘導分化
hUCMSC分離培養,獲得的hUCMSC呈形態相對均一的梭形細胞;經流式細胞儀檢測hUCMSC均表達CD105、CD73和CD90,陽性率不低于95%;不表達CD34、CD45、CD11b、CD19,陽性率不高于2%[5]。取第4代hUCMSC進行誘導分化,誘導分化的hUCMSC細胞簇逐漸變大形成懸浮的典型神經球樣細胞;免疫熒光檢測高表達NSC特異性標志物巢蛋白和神經源性分化因子1[5]。
1.2 誘導分化的NSC對糖尿病模型大鼠干預效果觀察
體重200~250 g的2月齡雄性Sprague-Dawley大鼠52只,隨機數字表法分為正常對照組(A組)、假干預組(B組)、玻璃體腔注射hUCMSC組(C組)、玻璃體腔注射NSC組(D組),每組13只大鼠。B、C、D組39只大鼠腹腔注射鏈尿佐菌素(STZ)建立糖尿病模型[6]。以建模72 h后尾靜脈隨機血糖值 > 16.7 mmol/L為糖尿病模型建模成功,每周測量血糖1~2次以判斷是否為持續高血糖。共計38只大鼠建模成功,占建模組大鼠總數的97.44%。A組大鼠隨機血糖值為(5.12±0.97) mmol/L,B、C、D組大鼠隨機血糖值為(20.19±1.64) mmol/L。A組與B、C、D組大鼠隨機血糖值比較,差異有統計學意義(F=30.378,P=0.000)。B、C、D組大鼠在建模后1個月,左眼玻璃體腔分別注射無菌磷酸鹽緩沖液、hUCMSC、NSC各2 μl。hUCMSC與NSC細胞密度均為2×104個/ml。剔除建模過程中麻醉意外死亡以及玻璃體腔注射過程中發生玻璃體積血的大鼠共4只,最終各組均為12只大鼠納入統計。
玻璃體腔注射干預后2、4、6、8周,各組隨機抽取3只大鼠處死,摘除眼球置于4%多聚甲醛中,4℃固定24 h。鋸齒緣后0.5 mm處剪開眼球壁,去除眼前節和玻璃體,眼杯梯度乙醇脫水,二甲苯透明,浸蠟,石蠟包埋,制成4 mm厚切片。采用鏈霉素抗生物素蛋白-過氧化物酶法檢測視網膜組織中BDNF、胸腺肽-1(Thy-1)蛋白的表達[7]。實驗操作按試劑盒說明書要求進行。
每只眼球隨機選取5張結構完整的視網膜切片,每張切片隨機選取2個400倍視野,Image-Pro Plus 6.0圖像處理分析軟件分析染色區平均累積吸光度[A,舊稱光密度(OD)](IA)值,每只眼球取10個視野平均IA值進行統計學分析。每只眼球隨機抽取5張完整切片,每張切片取2個400倍視野進行Thy-1表達陽性RGC計數,取10個視野RGC數量平均值進行統計學分析。
1.3 統計學方法
采用SPSS 10.0統計學軟件進行統計分析,計量數據以均數±標準差(x±s)表示。兩組間比較采用獨立樣本t檢驗;多組間比較采用單因素方差分析;組間多重比較采用最小顯著差法t檢驗;糖尿病大鼠視網膜染色區BDNF與Thy-1陽性RGC計數相關性分析采用Pearson相關系數檢驗。P < 0.05為差異有統計學意義。
2 結果
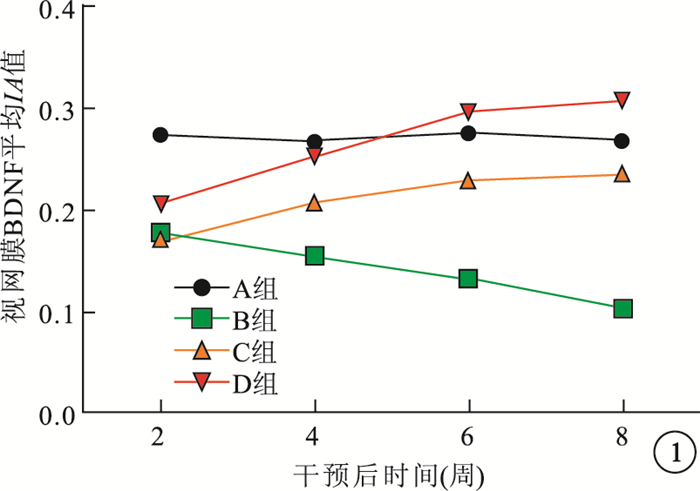
免疫組織化學染色觀察發現,A組大鼠BDNF呈陽性染色。B組大鼠BDNF呈弱陽性染色,隨干預后時間延長視網膜各層染色強度呈下降趨勢。C組大鼠干預后2周時BDNF染色與B組同期一致,干預后4周時染色強度開始加深,隨干預后時間延長染色強度逐漸增加。D組大鼠干預后2、4、6、8周時BDNF染色與C組同期相比明顯增高。干預后2、4、6、8周,B組大鼠視網膜染色區BDNF平均IA值較A組明顯降低,差異有統計學意義(t=3.55、6.15、5.72、5.43, P < 0.05)。干預后2周,C組大鼠視網膜染色區BDNF平均IA值與B組同期相當,差異無統計學意義(t=1.63, P > 0.05);與A組同期比較,差異有統計學意義(t=3.61, P < 0.05)。干預后4、6、8周,C組大鼠視網膜染色區BDNF平均IA值較B組明顯升高,差異均有統計學意義(t=3.85、5.47、4.52, P < 0.05);但較A組同期仍然偏低,差異有統計學意義(t=6.53、2.32、4.76, P < 0.05)。D組大鼠視網膜染色區BDNF平均IA值隨干預后時間延長而升高,于干預后6周時達高峰,各時間點較C組同期明顯升高,差異有統計學意義(t=5.36、5.64、3.67、2.74, P < 0.05)(圖 1)。
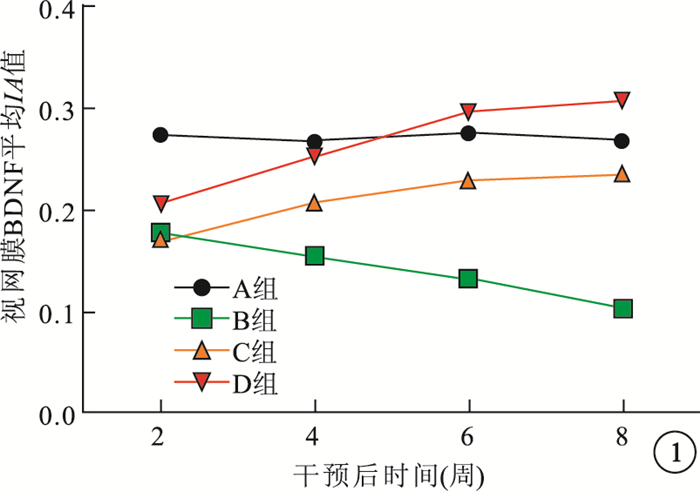 圖1
干預后不同時間點各組大鼠視網膜BDNF平均IA值折線圖
圖1
干預后不同時間點各組大鼠視網膜BDNF平均IA值折線圖
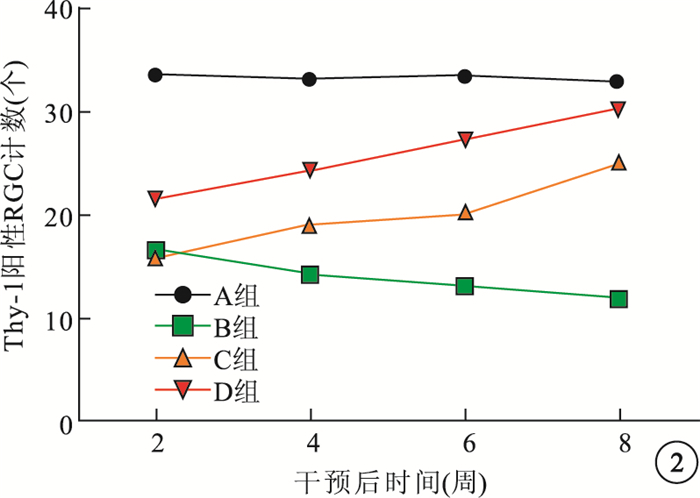
免疫組織化學染色觀察發現,A組大鼠Thy-1呈陽性染色。B組大鼠視網膜Thy-1染色明顯減弱,隨干預后時間延長染色強度呈下降趨勢。C組大鼠于干預后2周時視網膜Thy-1陽性染色強度較低,與B組同期一致;干預后4、6、8周染色強度逐漸增強。D組大鼠干預后2、4、6、8周時Thy-1染色與C組同期相比明顯增高。B組大鼠視網膜Thy-1陽性RGC計數隨干預后時間延長呈減少趨勢,較同期A組明顯減少,差異有統計學意義(t=3.84、5.42、4.95、4.53, P < 0.05)。C組大鼠干預后2周視網膜Thy-1陽性RGC計數較同期B組無明顯差異(t=1.73, P > 0.05);而干預后4、6、8周時較B組明顯增多,差異有統計學意義(t=5.42、7.57、9.38, P < 0.05)。D組大鼠視網膜Thy-1陽性RGC計數較同期C組明顯增多,差異均有統計學意義(t=6.92、7.21、5.43、3.19,P < 0.05)(圖 2)。
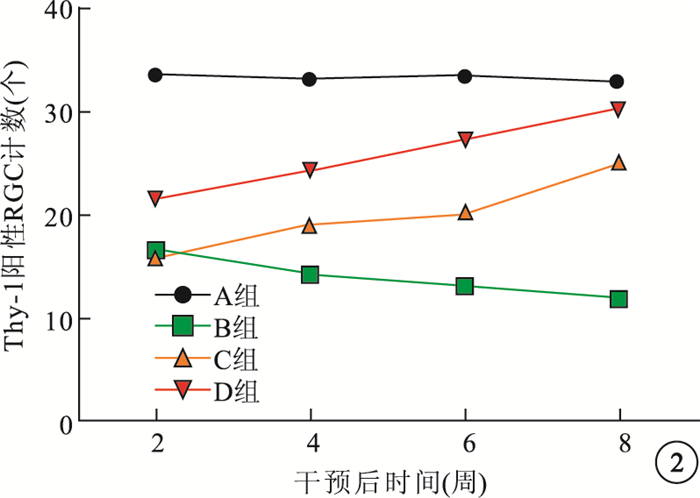 圖2
各組大鼠干預后不同時間視網膜Thy-1陽性RGC計數比較
圖2
各組大鼠干預后不同時間視網膜Thy-1陽性RGC計數比較
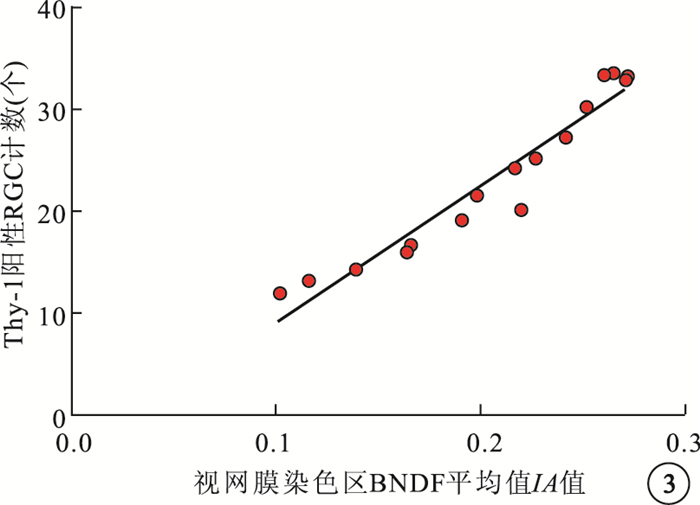
相關性分析結果顯示,糖尿病大鼠視網膜染色區BDNF平均IA值與Thy-1陽性RGC計數呈明顯正相關(r=0.964,P=0.000)(圖 3)。
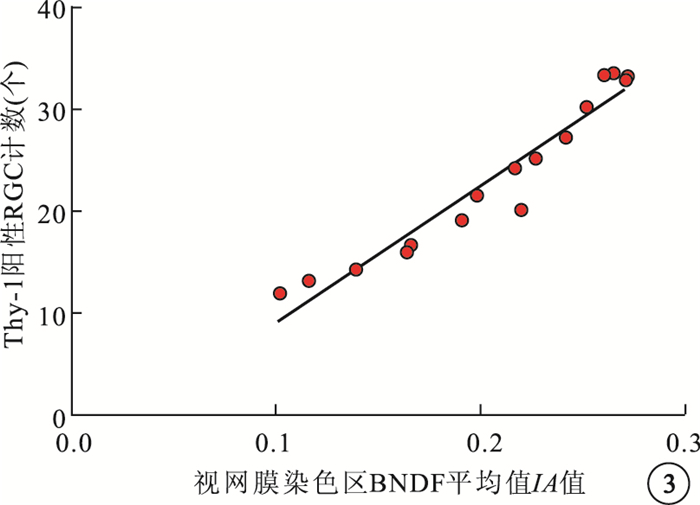 圖3
糖尿病大鼠視網膜染色區BDNF平均IA值與Thy-1陽性RGC計數相關性分析散點圖
圖3
糖尿病大鼠視網膜染色區BDNF平均IA值與Thy-1陽性RGC計數相關性分析散點圖
3 討論
MSC是治療視網膜變性類疾病的理想種子細胞,但由于大多數輸注的MSC無法到達靶器官,導致治療效果較差[8]。因此,提高干細胞歸巢是應用MSC治療疾病的關鍵。另一方面,MSC能否在體內分化成受損的視網膜細胞和旁分泌神經營養因子也是關系MSC治療DR的重要問題。為了解決hUCMSC體內分化率低、歸巢能力差的問題,本研究在體外將hUCMSC分化為NSC,經免疫熒光檢測特異性表面標記物后再注射入大鼠玻璃體腔。Koh等[9]研究結果顯示,77.4%的hUCMSC可經體外誘導分化為神經樣細胞,誘導后細胞表達TU-20、酪氨酸激酶受體A、巢蛋白和神經絲蛋白等神經細胞表面標志物,并分泌BDNF、血管內皮生長因子、神經膠質衍生因子等神經營養因子。本研究將hUCMSC誘導分化的NSC注射入大鼠玻璃體腔,發現其能夠促進視網膜內BDNF表達,且其促BDNF表達的作用較hUCMSC更強,起效時間更早。NSC注射后,我們檢測到大鼠視網膜RGC計數增加,且其增加幅度與BDNF表達量的增加呈正相關。
BDNF是RGC存活不可缺少的神經營養因子[10]。糖尿病患者和糖尿病動物模型研究均顯示早期視網膜組織內BDNF含量減少,同時下調視網膜內TrkB受體蛋白表達,介導細胞凋亡和神經炎癥的發生[11]。神經損傷發生后,視網膜內源性BDNF維持時間較短,不足以促進神經修復和阻止RGC凋亡[12]。動物實驗研究結果顯示,補充外源性BDNF可以有效緩解視神經橫斷、視網膜缺血以及天門冬氨酸介導的RGC損傷[13]。本研究亦發現,C組大鼠干預后4周時視網膜BDNF蛋白表達量開始升高,持續到干預后8周仍維持在高度表達狀態。而D組大鼠視網膜BDNF表達量于干預后6周時達高峰,同時BDNF表達量亦較C組高,這一高表達狀態持續整個檢測過程。說明體外hUCMSC誘導分化的NSC經玻璃體腔注射到糖尿病大鼠眼內,能夠早期、高效、持久的分泌神經營養因子BDNF,其療效較單純注射hUCMSC更佳。
本研究采用體外Thy-1抗原抗體對RGC進行免疫標記,Thy-1陽性RGC計數結果顯示,B組大鼠干預后6周時RGC計數較A組明顯減少。說明糖尿病大鼠模型在高血糖持續狀態下其視網膜神經組織已經出現損傷,RGC也已經出現丟失。隨糖尿病病程延長,Thy-1陽性RGC計數越少。而C組大鼠RGC計數在干預后4周開始增加,但增長幅度明顯低于D組同期。證實hUCMSC誘導分化的NSC可促進糖尿病大鼠RGC計數增加,其作用效果較hUCMSC起效更短,效果更強。
本研究結果表明,玻璃體腔注射hUCMSC誘導分化的NSC能促進糖尿病大鼠視網膜BDNF表達并提高RGC計數,且二者呈明顯正相關;為進一步研究hUCMSC對DR神經損傷的治療機制奠定了基礎。但由于客觀條件限制,未能進行誘導的hUCMSC多濃度及視網膜下腔注射的對照研究;并且MSC針對DR治療后的遠期效果還需觀察和探討,其安全性和有效性還有待進一步評估。
糖尿病視網膜病變(DR)是一種神經血管性病變,其微血管系統出現病變前已經存在神經組織損傷,病理改變主要包括神經元凋亡、神經膠質細胞活躍及內層視網膜變薄[1]。探討DR神經損傷機制以阻止其發生發展是目前眼科研究的前沿與焦點。間充質干細胞(MSC)是來源于中胚層的一類多能干細胞,具有定向分化替代受損細胞、神經營養保護、抗炎、抑制血管新生等多種生物學作用,是治療視網膜神經退行性病變理想的種子細胞之一[2]。MSC還具有較強增生、分化及免疫調節能力,其分泌的各種細胞因子能夠抑制細胞凋亡,促進神經修復及加強神經穩定[3]。體外實驗已證實人臍帶MSC (hUCMSC)在一定誘導條件下能夠定向分化為神經干細胞(NSC),而NSC能夠通過分泌神經營養因子發揮更強的神經保護作用[4]。但NSC能否有效緩解DR早期視網膜神經節細胞(RGC)數目減少目前尚不清楚。為此,我們對hUCMSC進行傳代培養和神經分化,觀察玻璃體腔注射hUCMSC誘導分化的NSC對糖尿病大鼠視網膜腦源性神經營養因子(BDNF)表達及RGC計數的影響,以期為DR的臨床防治提供實驗依據。
1 材料和方法
1.1 hUCMSC分離培養及其向NSC誘導分化
hUCMSC分離培養,獲得的hUCMSC呈形態相對均一的梭形細胞;經流式細胞儀檢測hUCMSC均表達CD105、CD73和CD90,陽性率不低于95%;不表達CD34、CD45、CD11b、CD19,陽性率不高于2%[5]。取第4代hUCMSC進行誘導分化,誘導分化的hUCMSC細胞簇逐漸變大形成懸浮的典型神經球樣細胞;免疫熒光檢測高表達NSC特異性標志物巢蛋白和神經源性分化因子1[5]。
1.2 誘導分化的NSC對糖尿病模型大鼠干預效果觀察
體重200~250 g的2月齡雄性Sprague-Dawley大鼠52只,隨機數字表法分為正常對照組(A組)、假干預組(B組)、玻璃體腔注射hUCMSC組(C組)、玻璃體腔注射NSC組(D組),每組13只大鼠。B、C、D組39只大鼠腹腔注射鏈尿佐菌素(STZ)建立糖尿病模型[6]。以建模72 h后尾靜脈隨機血糖值 > 16.7 mmol/L為糖尿病模型建模成功,每周測量血糖1~2次以判斷是否為持續高血糖。共計38只大鼠建模成功,占建模組大鼠總數的97.44%。A組大鼠隨機血糖值為(5.12±0.97) mmol/L,B、C、D組大鼠隨機血糖值為(20.19±1.64) mmol/L。A組與B、C、D組大鼠隨機血糖值比較,差異有統計學意義(F=30.378,P=0.000)。B、C、D組大鼠在建模后1個月,左眼玻璃體腔分別注射無菌磷酸鹽緩沖液、hUCMSC、NSC各2 μl。hUCMSC與NSC細胞密度均為2×104個/ml。剔除建模過程中麻醉意外死亡以及玻璃體腔注射過程中發生玻璃體積血的大鼠共4只,最終各組均為12只大鼠納入統計。
玻璃體腔注射干預后2、4、6、8周,各組隨機抽取3只大鼠處死,摘除眼球置于4%多聚甲醛中,4℃固定24 h。鋸齒緣后0.5 mm處剪開眼球壁,去除眼前節和玻璃體,眼杯梯度乙醇脫水,二甲苯透明,浸蠟,石蠟包埋,制成4 mm厚切片。采用鏈霉素抗生物素蛋白-過氧化物酶法檢測視網膜組織中BDNF、胸腺肽-1(Thy-1)蛋白的表達[7]。實驗操作按試劑盒說明書要求進行。
每只眼球隨機選取5張結構完整的視網膜切片,每張切片隨機選取2個400倍視野,Image-Pro Plus 6.0圖像處理分析軟件分析染色區平均累積吸光度[A,舊稱光密度(OD)](IA)值,每只眼球取10個視野平均IA值進行統計學分析。每只眼球隨機抽取5張完整切片,每張切片取2個400倍視野進行Thy-1表達陽性RGC計數,取10個視野RGC數量平均值進行統計學分析。
1.3 統計學方法
采用SPSS 10.0統計學軟件進行統計分析,計量數據以均數±標準差(x±s)表示。兩組間比較采用獨立樣本t檢驗;多組間比較采用單因素方差分析;組間多重比較采用最小顯著差法t檢驗;糖尿病大鼠視網膜染色區BDNF與Thy-1陽性RGC計數相關性分析采用Pearson相關系數檢驗。P < 0.05為差異有統計學意義。
2 結果
免疫組織化學染色觀察發現,A組大鼠BDNF呈陽性染色。B組大鼠BDNF呈弱陽性染色,隨干預后時間延長視網膜各層染色強度呈下降趨勢。C組大鼠干預后2周時BDNF染色與B組同期一致,干預后4周時染色強度開始加深,隨干預后時間延長染色強度逐漸增加。D組大鼠干預后2、4、6、8周時BDNF染色與C組同期相比明顯增高。干預后2、4、6、8周,B組大鼠視網膜染色區BDNF平均IA值較A組明顯降低,差異有統計學意義(t=3.55、6.15、5.72、5.43, P < 0.05)。干預后2周,C組大鼠視網膜染色區BDNF平均IA值與B組同期相當,差異無統計學意義(t=1.63, P > 0.05);與A組同期比較,差異有統計學意義(t=3.61, P < 0.05)。干預后4、6、8周,C組大鼠視網膜染色區BDNF平均IA值較B組明顯升高,差異均有統計學意義(t=3.85、5.47、4.52, P < 0.05);但較A組同期仍然偏低,差異有統計學意義(t=6.53、2.32、4.76, P < 0.05)。D組大鼠視網膜染色區BDNF平均IA值隨干預后時間延長而升高,于干預后6周時達高峰,各時間點較C組同期明顯升高,差異有統計學意義(t=5.36、5.64、3.67、2.74, P < 0.05)(圖 1)。
 圖1
干預后不同時間點各組大鼠視網膜BDNF平均IA值折線圖
圖1
干預后不同時間點各組大鼠視網膜BDNF平均IA值折線圖
免疫組織化學染色觀察發現,A組大鼠Thy-1呈陽性染色。B組大鼠視網膜Thy-1染色明顯減弱,隨干預后時間延長染色強度呈下降趨勢。C組大鼠于干預后2周時視網膜Thy-1陽性染色強度較低,與B組同期一致;干預后4、6、8周染色強度逐漸增強。D組大鼠干預后2、4、6、8周時Thy-1染色與C組同期相比明顯增高。B組大鼠視網膜Thy-1陽性RGC計數隨干預后時間延長呈減少趨勢,較同期A組明顯減少,差異有統計學意義(t=3.84、5.42、4.95、4.53, P < 0.05)。C組大鼠干預后2周視網膜Thy-1陽性RGC計數較同期B組無明顯差異(t=1.73, P > 0.05);而干預后4、6、8周時較B組明顯增多,差異有統計學意義(t=5.42、7.57、9.38, P < 0.05)。D組大鼠視網膜Thy-1陽性RGC計數較同期C組明顯增多,差異均有統計學意義(t=6.92、7.21、5.43、3.19,P < 0.05)(圖 2)。
 圖2
各組大鼠干預后不同時間視網膜Thy-1陽性RGC計數比較
圖2
各組大鼠干預后不同時間視網膜Thy-1陽性RGC計數比較
相關性分析結果顯示,糖尿病大鼠視網膜染色區BDNF平均IA值與Thy-1陽性RGC計數呈明顯正相關(r=0.964,P=0.000)(圖 3)。
 圖3
糖尿病大鼠視網膜染色區BDNF平均IA值與Thy-1陽性RGC計數相關性分析散點圖
圖3
糖尿病大鼠視網膜染色區BDNF平均IA值與Thy-1陽性RGC計數相關性分析散點圖
3 討論
MSC是治療視網膜變性類疾病的理想種子細胞,但由于大多數輸注的MSC無法到達靶器官,導致治療效果較差[8]。因此,提高干細胞歸巢是應用MSC治療疾病的關鍵。另一方面,MSC能否在體內分化成受損的視網膜細胞和旁分泌神經營養因子也是關系MSC治療DR的重要問題。為了解決hUCMSC體內分化率低、歸巢能力差的問題,本研究在體外將hUCMSC分化為NSC,經免疫熒光檢測特異性表面標記物后再注射入大鼠玻璃體腔。Koh等[9]研究結果顯示,77.4%的hUCMSC可經體外誘導分化為神經樣細胞,誘導后細胞表達TU-20、酪氨酸激酶受體A、巢蛋白和神經絲蛋白等神經細胞表面標志物,并分泌BDNF、血管內皮生長因子、神經膠質衍生因子等神經營養因子。本研究將hUCMSC誘導分化的NSC注射入大鼠玻璃體腔,發現其能夠促進視網膜內BDNF表達,且其促BDNF表達的作用較hUCMSC更強,起效時間更早。NSC注射后,我們檢測到大鼠視網膜RGC計數增加,且其增加幅度與BDNF表達量的增加呈正相關。
BDNF是RGC存活不可缺少的神經營養因子[10]。糖尿病患者和糖尿病動物模型研究均顯示早期視網膜組織內BDNF含量減少,同時下調視網膜內TrkB受體蛋白表達,介導細胞凋亡和神經炎癥的發生[11]。神經損傷發生后,視網膜內源性BDNF維持時間較短,不足以促進神經修復和阻止RGC凋亡[12]。動物實驗研究結果顯示,補充外源性BDNF可以有效緩解視神經橫斷、視網膜缺血以及天門冬氨酸介導的RGC損傷[13]。本研究亦發現,C組大鼠干預后4周時視網膜BDNF蛋白表達量開始升高,持續到干預后8周仍維持在高度表達狀態。而D組大鼠視網膜BDNF表達量于干預后6周時達高峰,同時BDNF表達量亦較C組高,這一高表達狀態持續整個檢測過程。說明體外hUCMSC誘導分化的NSC經玻璃體腔注射到糖尿病大鼠眼內,能夠早期、高效、持久的分泌神經營養因子BDNF,其療效較單純注射hUCMSC更佳。
本研究采用體外Thy-1抗原抗體對RGC進行免疫標記,Thy-1陽性RGC計數結果顯示,B組大鼠干預后6周時RGC計數較A組明顯減少。說明糖尿病大鼠模型在高血糖持續狀態下其視網膜神經組織已經出現損傷,RGC也已經出現丟失。隨糖尿病病程延長,Thy-1陽性RGC計數越少。而C組大鼠RGC計數在干預后4周開始增加,但增長幅度明顯低于D組同期。證實hUCMSC誘導分化的NSC可促進糖尿病大鼠RGC計數增加,其作用效果較hUCMSC起效更短,效果更強。
本研究結果表明,玻璃體腔注射hUCMSC誘導分化的NSC能促進糖尿病大鼠視網膜BDNF表達并提高RGC計數,且二者呈明顯正相關;為進一步研究hUCMSC對DR神經損傷的治療機制奠定了基礎。但由于客觀條件限制,未能進行誘導的hUCMSC多濃度及視網膜下腔注射的對照研究;并且MSC針對DR治療后的遠期效果還需觀察和探討,其安全性和有效性還有待進一步評估。