引用本文: 鄒媛媛, 汪建濤, 李筱榮. 玻璃體腔移植人臍帶間充質干細胞對糖尿病大鼠視網膜形態及膠質細胞原纖維酸性蛋白和視紫紅質表達的影響. 中華眼底病雜志, 2016, 32(6): 596-600. doi: 10.3760/cma.j.issn.1005-1015.2016.06.008 復制
隨著臨床對糖尿病視網膜病變(DR)發病機制認識的不斷加深,其神經變性病理改變越來越受到重視[1]。間充質干細胞(MSC)具有自我更新和多向分化的能力,可通過多效機制促進組織再生,這為DR的治療帶來了希望[2]。目前相關研究更多從移植途徑、移植濃度、分化程度等角度對MSC應用效果進行了探討[3-5]。而關于有效示蹤細胞、檢測更多神經相關基因對人臍帶間充質干細胞(hUCMSC)的眼移植效果還缺乏更深入客觀地評價、分析。為此,我們通過紅色熒光染料標記hUCMSC并將其移植到糖尿病大鼠玻璃體腔,對hUCMSC在視網膜的存活、遷移情況進行示蹤觀察,分析其對糖尿病大鼠視網膜形態、膠質細胞原纖維酸性蛋白(GFAP)、視紫紅質(RHO)表達的影響,以期為hUCMSC在DR治療中的可能作用探討提供一定的理論依據。現將結果報道如下。
1 材料和方法
鏈脲佐菌素(STZ)、4′, 6二脒基-2-苯基吲哚(DAPIL)、紅色熒光染料PKH-26(美國Sigma公司);GFAP抗體(美國Cell Signaling Technology公司);RHO抗體(美國Abcam公司);β-肌動蛋白(actin)(美國Abmart公司)。hUCMSC由天津協和干細胞基因工程有限公司提供,細胞形態呈梭形,強表達CD29、CD105、CD73,不表達CD14、CD34、CD31、CD45、人類白細胞DR抗原。根據試劑盒說明書對hUCMSC進行PKH-26標記,并將PKH-26標記的hUCMSC重懸于Dulbecco改良Eagle (DMEM)/F12培養基中,配置hUCMSC細胞懸液。
動物實驗完全遵照眼科視覺研究中有關動物使用聲明的相關準則。8周齡健康雄性Sprague-Dwaley大鼠78只,清潔級,體重250~300 g,購自中國軍事醫學科學院動物中心;飼養于天津中國醫學科學院放射研究所,飼養環境符合醫學實驗動物環境設施要求。所有大鼠半禁食。70只大鼠按40 mg/kg劑量尾靜脈注射STZ建立糖尿病模型,另8只大鼠以相同劑量尾靜脈注射0.1 mol/L pH 4.0檸檬酸緩沖液作為正常對照組。以建模1周后尾靜脈隨機血糖值≥16.7 mmol/L為糖尿病模型建模成功,每周測量血糖1~2次以判斷是否為持續高血糖。建模大鼠每日飲水、飲食及尿量明顯增加,體重明顯減輕。建模10周后經裂隙燈顯微鏡及眼科手術顯微鏡觀察確認建模大鼠晶狀體均出現不同程度混濁。建模6周后,在建模大鼠中取10只作為糖尿病模型對照組;其余60只建模大鼠右眼玻璃體腔注射移植細胞密度為3×104個的hUCMSC細胞懸液2 μl作為實驗眼,左眼玻璃體腔注射等量DMEM/F12培養基作為對照眼。注射移植后1、2、4周分別進行后續實驗。實驗眼記作U1、U2、U4組,對照眼記作D1、D2、D4組,每組各20只眼。
各組隨機選取2只大鼠過量麻醉處死,將眼組織固定于4%酸性福爾馬林溶液中,石蠟包埋切片,進行蘇木精-伊紅(HE)染色,光學顯微鏡下觀察視網膜形態。每只眼球選擇恰好經過視神經的4張切片,每張切片選擇距離視盤500 μm范圍內5個視野,采用計算機圖像分析系統測量視網膜外核層(ONL)及內核層(INL)的厚度。采用冰凍切片-組織免疫熒光方法觀察PKH26標記的hUCMSC在視網膜的分布、遷移情況,以DAPIL標記視網膜。
各組隨機選取4只大鼠過量麻醉處死,取眼球剝離視網膜組織。參照文獻[6]的方法,采用實時定量聚合酶鏈反應(PCR)和蛋白免疫印跡法(Western blot)分別檢測大鼠視網膜中GFAP、RHO的mRNA和蛋白相對表達量。以β-actin作為內參。
采用SPSS 16.0統計軟件進行統計學分析。各組量化的實驗數據經Shapiro-Wilk檢驗呈正態分布。組間比較用單因素方差分析Student-Newman-Keuls檢驗。P < 0.05為差異有統計學意義。
2 結果
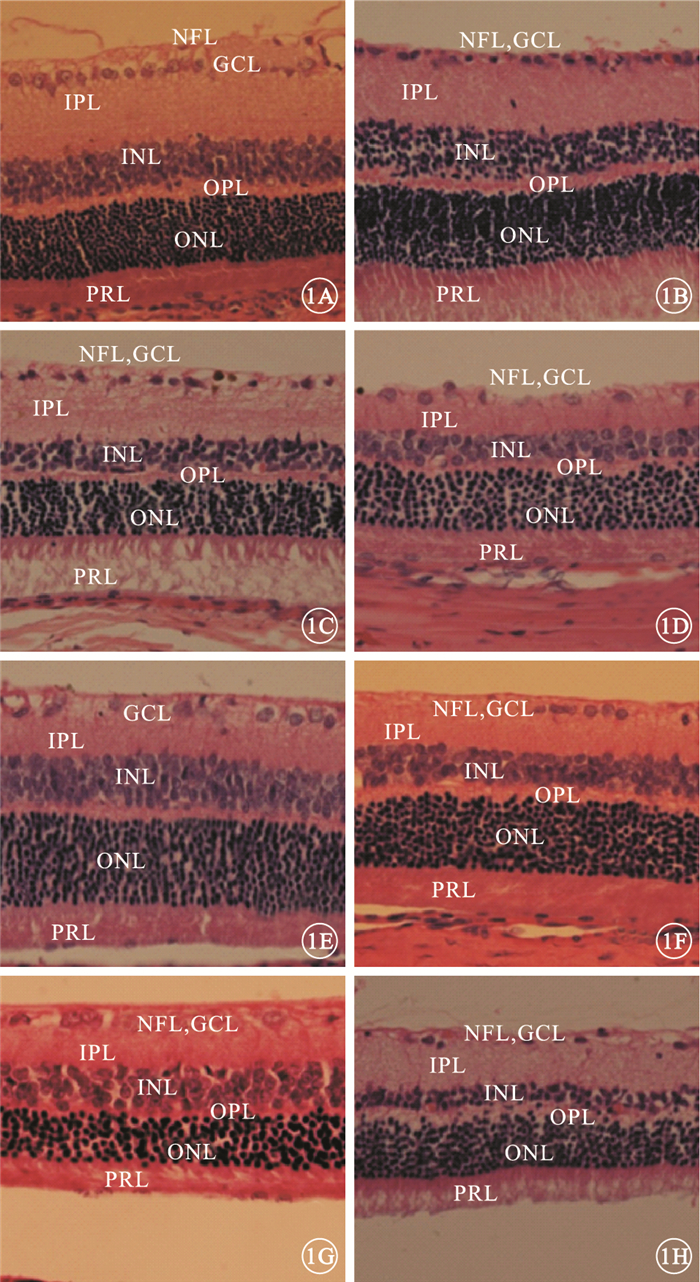
光學顯微鏡觀察發現,正常對照組大鼠視網膜內界膜結構清晰,神經纖維層(NFL)、神經節細胞層(GCL)、內叢狀層(IPL)、INL、外叢狀層(OPL)、ONL、光感受器細胞層(PRL)均正常(圖 1A)。糖尿病模型對照組大鼠視網膜內界膜結構不明顯,NFL變薄,視網膜神經節細胞(RGC)數量減少且細胞邊界不清,INL細胞密度減小,ONL內側細胞密集、外側相對稀疏(圖 1B)。U1、D1組大鼠視網膜結構相似,均可見RGC數量減少、排列紊亂,IPL變薄(圖 1C,1D)。U2、U4、D2、D4組大鼠RGC數量不斷減少(圖 1E~1H)。與D4組比較,U4組大鼠視網膜ONL結構紊亂程度稍有改善,INL厚度有一定程度增加。
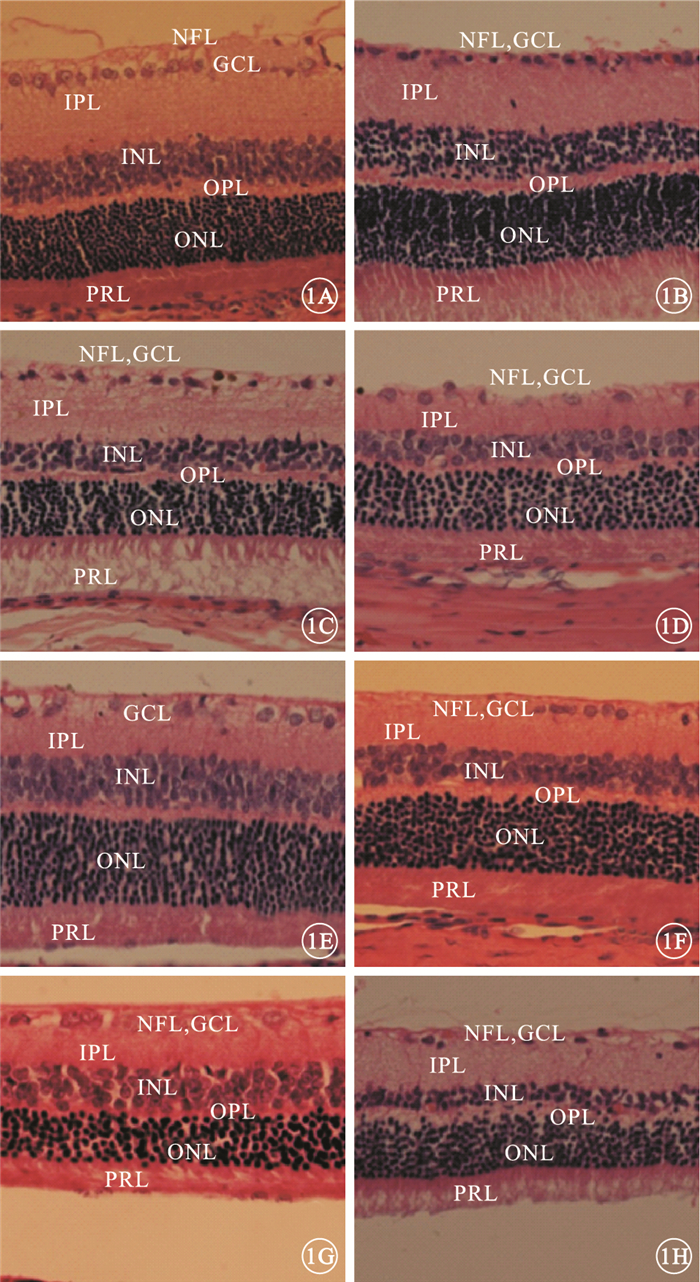 圖1
各組大鼠視網膜光學顯微鏡像。1A.正常對照組;1B.糖尿病模型對照組;1C.U1組;1D.D1組;1E.U2組;1F.D2組;1G.U4組;1H.D4組。正常對照組大鼠視網膜各層結構正常;糖尿病模型對照組大鼠視網膜NFL變薄,RGC數量減少,INL細胞密度減小,ONL內側細胞密集、外側相對稀疏;U1、D1組大鼠RGC數量減少、排列紊亂,IPL變薄;U2、U4、D2、D4組大鼠RGC數量不斷減少HE ×400
圖1
各組大鼠視網膜光學顯微鏡像。1A.正常對照組;1B.糖尿病模型對照組;1C.U1組;1D.D1組;1E.U2組;1F.D2組;1G.U4組;1H.D4組。正常對照組大鼠視網膜各層結構正常;糖尿病模型對照組大鼠視網膜NFL變薄,RGC數量減少,INL細胞密度減小,ONL內側細胞密集、外側相對稀疏;U1、D1組大鼠RGC數量減少、排列紊亂,IPL變薄;U2、U4、D2、D4組大鼠RGC數量不斷減少HE ×400
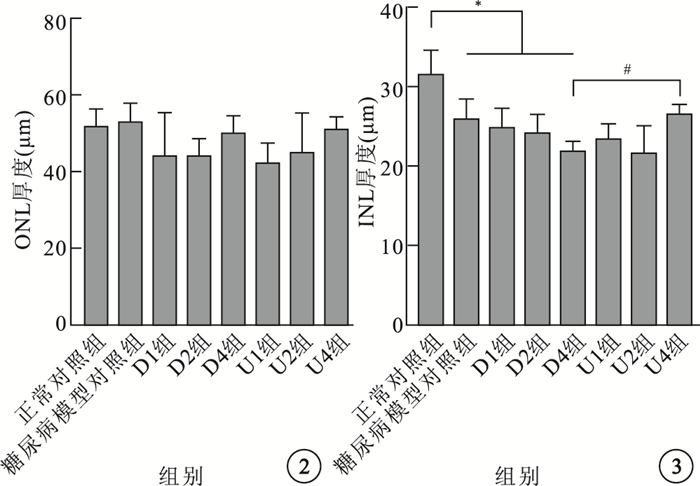
各組大鼠視網膜ONL厚度比較,差異無統計學意義(F=1.506,P > 0.05);INL厚度比較,差異有統計學意義(F=6.603,P < 0.05)。與正常對照組比較,糖尿病模型組以及U1、U2、U4、D1、D2、D4組大鼠視網膜INL厚度明顯降低,差異有統計學意義(P < 0.05)。與D4組比較,U4組大鼠視網膜INL厚度明顯增加,差異有統計學意義(P < 0.05)(圖 2,3)。
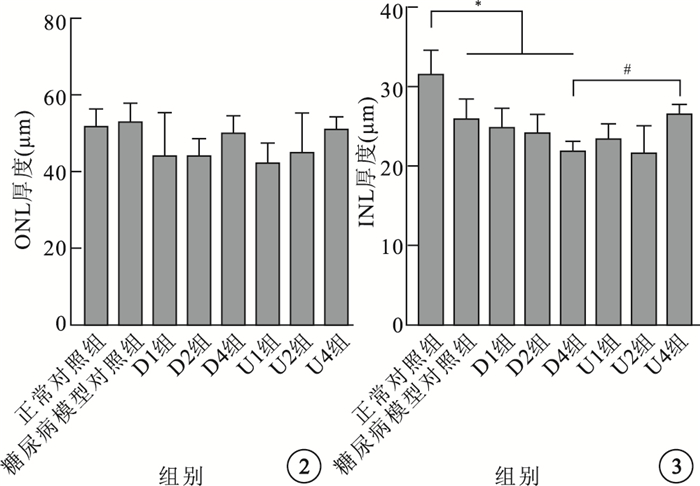 圖2
各組大鼠視網膜ONL厚度比較??圖 3?各組大鼠視網膜INL厚度比較。*P < 0.05;# P < 0.05
圖2
各組大鼠視網膜ONL厚度比較??圖 3?各組大鼠視網膜INL厚度比較。*P < 0.05;# P < 0.05
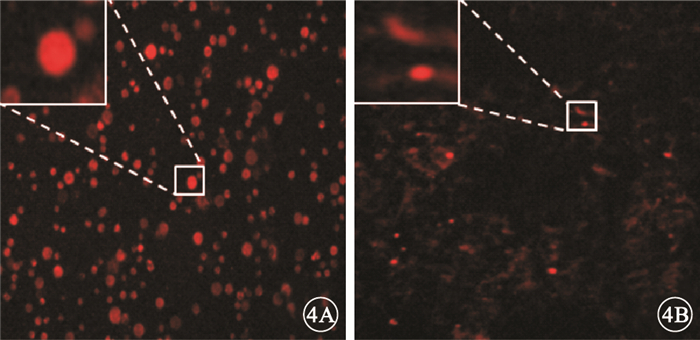
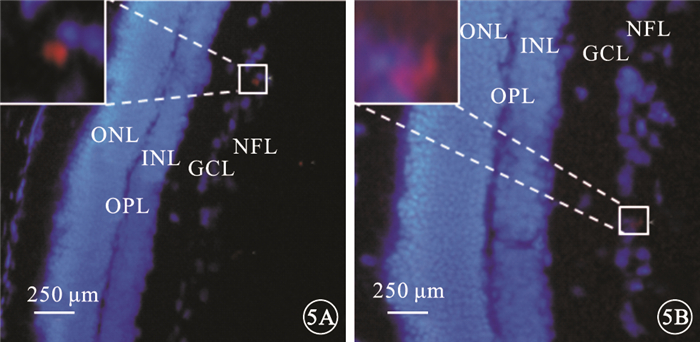
熒光顯微鏡觀察發現,PKH-26標記的懸浮hUCMSC呈紅色熒光(圖 4A);體外培養3 d后,仍可見呈紅色熒光的hUCMSC (圖 4B)。冰凍切片-組織免疫熒光實驗結果顯示,U1組大鼠視網膜可見沿內界膜分布的hUCMSC (圖 5A);U2組大鼠視網膜hUCMSC數量逐漸減少,主要位于NFL和GCL (圖 5B)。
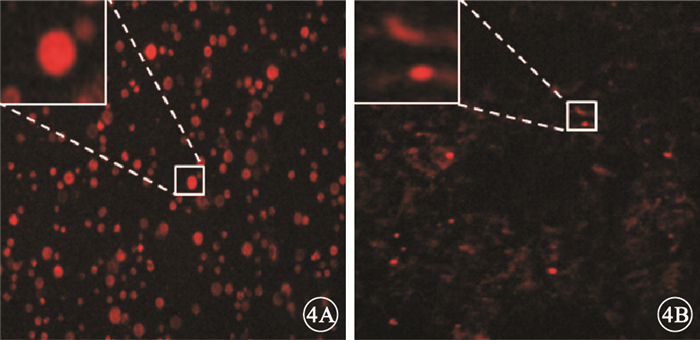 圖4
PKH-26標記的懸浮hUCMSC免疫熒光染色像。4A.可見懸浮hUCMSC呈紅色熒光;4B.體外培養3 d后,仍可見呈紅色熒光的hUCMSC ×100
圖4
PKH-26標記的懸浮hUCMSC免疫熒光染色像。4A.可見懸浮hUCMSC呈紅色熒光;4B.體外培養3 d后,仍可見呈紅色熒光的hUCMSC ×100
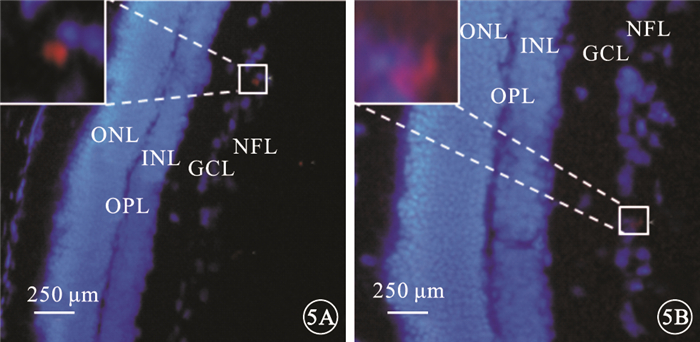 圖5
大鼠視網膜熒光顯微鏡像。5A.U1組,可見沿內界膜分布的hUCMSC;5B.U2組,hUCMSC數量逐漸減少,主要位于NFL和GCL
圖5
大鼠視網膜熒光顯微鏡像。5A.U1組,可見沿內界膜分布的hUCMSC;5B.U2組,hUCMSC數量逐漸減少,主要位于NFL和GCL
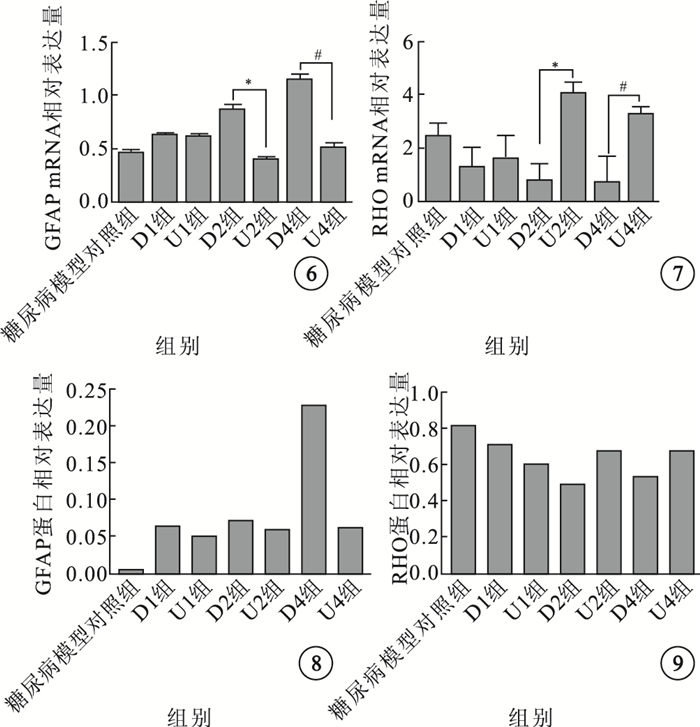
實時定量PCR及Western blot檢測結果顯示,各組大鼠視網膜中GFAP及RHO mRNA、蛋白相對表達量間差異有統計學意義(P < 0.01)。隨建模時間延長,糖尿病模型對照組及D1、D2、D4組大鼠視網膜中GFAP mRNA、蛋白相對表達量逐漸升高;RHO mRNA、蛋白相對表達量逐漸降低。分別與D2、D4組比較,U2、U4組大鼠視網膜GFAP mRNA、蛋白相對表達量均降低,RHO mRNA、蛋白相對表達量均升高,差異均有統計學意義(P < 0.01)(圖 6~9)。
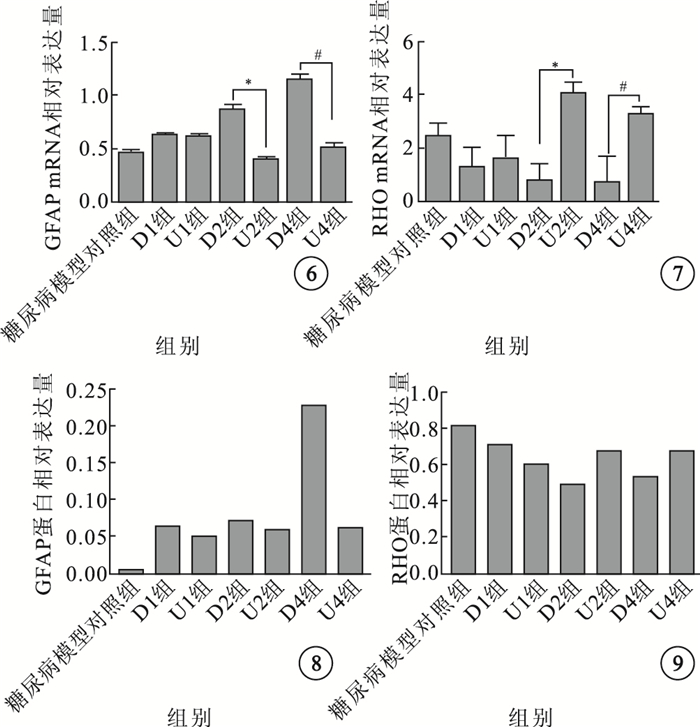 圖6
各組大鼠視網膜中GFAP mRNA相對表達量比較。*P < 0.01;#P < 0.01 ??圖 7?各組大鼠視網膜中RHO mRNA相對表達量比較。*P < 0.01;#P < 0.01 ??圖 8?各組大鼠視網膜中GFAP蛋白相對表達量比較??圖 9?各組大鼠視網膜中RHO蛋白相對表達量比較
圖6
各組大鼠視網膜中GFAP mRNA相對表達量比較。*P < 0.01;#P < 0.01 ??圖 7?各組大鼠視網膜中RHO mRNA相對表達量比較。*P < 0.01;#P < 0.01 ??圖 8?各組大鼠視網膜中GFAP蛋白相對表達量比較??圖 9?各組大鼠視網膜中RHO蛋白相對表達量比較
3 討論
PKH-26是一種親脂性的紅色熒光染料,可與細胞膜脂質雙分子層發生不可逆結合,可通過熒光顯微鏡有效觀察hUCMSC的細胞輪廓及運動軌跡[7]。我們采用PKH-26對hUCMSC進行示蹤標記,發現hUCMSC移植到糖尿病大鼠玻璃體腔后能夠遷移,整合至視網膜。
作為骨架蛋白的特有成分,GFAP被認為是神經系統星形膠質細胞的標志蛋白,可參與機體發育、創傷愈合等過程[8]。研究發現,糖尿病大鼠在病程第1個月時,視網膜Müller細胞中GFAP不表達;但在病程12周時GFAP表達[9]。本研究也觀察到類似現象,即未經hUCMSC移植干預的糖尿病大鼠視網膜中GFAP mRNA、蛋白表達均隨著建模時間延長而升高;而經hUCMSC移植干預的糖尿病大鼠視網膜中GFAP mRNA、蛋白表達明顯降低。說明移植hUCMSC可能通過影響GFAP的表達發揮對視網膜的保護作用。提示hUCMSC可能向神經元樣細胞方向分化,使膠質細胞中的表達量較低。
有研究已證實由于糖尿病造成的光感受器細胞改變,通過測定視網膜電圖a波的最高峰,光感受器細胞暗電流強度在STZ注射12周后降低16%~24%;RHO作為其標志物,表達下降[10]。亦有研究觀察發現,隨著糖尿病病情加重,患者外周循環血中RHO mRNA表達呈升高趨勢,增生期DR RHO mRNA表達驟降[11]。與之不同的是,本研究結果顯示,糖尿病大鼠視網膜中RHO mRNA表達隨著建模時間延長而降低。我們分析認為,導致結果差異的原因可能與大鼠與人類的DR程度進展不同有關,且本研究是提取視網膜組織中的mRNA進行測定。我們推測眼內移植的hUCMSC定位到視網膜后,在特定微環境下可能通過調控GFAP、RHO等多種神經相關因子的表達,分化為神經節或神經膠質細胞,重建或增加神經元通路,促進損傷視網膜修復,從而起到一定的治療作用。
本研究雖然從形態學和分子生物學水平初步觀察了hUCMSC移植后糖尿病大鼠視網膜組織結構及GFAP、RHO表達變化,但仍無法最終確定hUCMSC是否分化為神經細胞,這有待于進一步研究證實。此外,關于hUCMSC長期培養傳代后有無惡變傾向及惡變標志;如何優化細胞采集技術,提高分離效率和純度;如何有效控制hUCMSC的生長和分化;分化后細胞表面抗原如何變化等多方面問題仍需要進一步探討。
隨著臨床對糖尿病視網膜病變(DR)發病機制認識的不斷加深,其神經變性病理改變越來越受到重視[1]。間充質干細胞(MSC)具有自我更新和多向分化的能力,可通過多效機制促進組織再生,這為DR的治療帶來了希望[2]。目前相關研究更多從移植途徑、移植濃度、分化程度等角度對MSC應用效果進行了探討[3-5]。而關于有效示蹤細胞、檢測更多神經相關基因對人臍帶間充質干細胞(hUCMSC)的眼移植效果還缺乏更深入客觀地評價、分析。為此,我們通過紅色熒光染料標記hUCMSC并將其移植到糖尿病大鼠玻璃體腔,對hUCMSC在視網膜的存活、遷移情況進行示蹤觀察,分析其對糖尿病大鼠視網膜形態、膠質細胞原纖維酸性蛋白(GFAP)、視紫紅質(RHO)表達的影響,以期為hUCMSC在DR治療中的可能作用探討提供一定的理論依據。現將結果報道如下。
1 材料和方法
鏈脲佐菌素(STZ)、4′, 6二脒基-2-苯基吲哚(DAPIL)、紅色熒光染料PKH-26(美國Sigma公司);GFAP抗體(美國Cell Signaling Technology公司);RHO抗體(美國Abcam公司);β-肌動蛋白(actin)(美國Abmart公司)。hUCMSC由天津協和干細胞基因工程有限公司提供,細胞形態呈梭形,強表達CD29、CD105、CD73,不表達CD14、CD34、CD31、CD45、人類白細胞DR抗原。根據試劑盒說明書對hUCMSC進行PKH-26標記,并將PKH-26標記的hUCMSC重懸于Dulbecco改良Eagle (DMEM)/F12培養基中,配置hUCMSC細胞懸液。
動物實驗完全遵照眼科視覺研究中有關動物使用聲明的相關準則。8周齡健康雄性Sprague-Dwaley大鼠78只,清潔級,體重250~300 g,購自中國軍事醫學科學院動物中心;飼養于天津中國醫學科學院放射研究所,飼養環境符合醫學實驗動物環境設施要求。所有大鼠半禁食。70只大鼠按40 mg/kg劑量尾靜脈注射STZ建立糖尿病模型,另8只大鼠以相同劑量尾靜脈注射0.1 mol/L pH 4.0檸檬酸緩沖液作為正常對照組。以建模1周后尾靜脈隨機血糖值≥16.7 mmol/L為糖尿病模型建模成功,每周測量血糖1~2次以判斷是否為持續高血糖。建模大鼠每日飲水、飲食及尿量明顯增加,體重明顯減輕。建模10周后經裂隙燈顯微鏡及眼科手術顯微鏡觀察確認建模大鼠晶狀體均出現不同程度混濁。建模6周后,在建模大鼠中取10只作為糖尿病模型對照組;其余60只建模大鼠右眼玻璃體腔注射移植細胞密度為3×104個的hUCMSC細胞懸液2 μl作為實驗眼,左眼玻璃體腔注射等量DMEM/F12培養基作為對照眼。注射移植后1、2、4周分別進行后續實驗。實驗眼記作U1、U2、U4組,對照眼記作D1、D2、D4組,每組各20只眼。
各組隨機選取2只大鼠過量麻醉處死,將眼組織固定于4%酸性福爾馬林溶液中,石蠟包埋切片,進行蘇木精-伊紅(HE)染色,光學顯微鏡下觀察視網膜形態。每只眼球選擇恰好經過視神經的4張切片,每張切片選擇距離視盤500 μm范圍內5個視野,采用計算機圖像分析系統測量視網膜外核層(ONL)及內核層(INL)的厚度。采用冰凍切片-組織免疫熒光方法觀察PKH26標記的hUCMSC在視網膜的分布、遷移情況,以DAPIL標記視網膜。
各組隨機選取4只大鼠過量麻醉處死,取眼球剝離視網膜組織。參照文獻[6]的方法,采用實時定量聚合酶鏈反應(PCR)和蛋白免疫印跡法(Western blot)分別檢測大鼠視網膜中GFAP、RHO的mRNA和蛋白相對表達量。以β-actin作為內參。
采用SPSS 16.0統計軟件進行統計學分析。各組量化的實驗數據經Shapiro-Wilk檢驗呈正態分布。組間比較用單因素方差分析Student-Newman-Keuls檢驗。P < 0.05為差異有統計學意義。
2 結果
光學顯微鏡觀察發現,正常對照組大鼠視網膜內界膜結構清晰,神經纖維層(NFL)、神經節細胞層(GCL)、內叢狀層(IPL)、INL、外叢狀層(OPL)、ONL、光感受器細胞層(PRL)均正常(圖 1A)。糖尿病模型對照組大鼠視網膜內界膜結構不明顯,NFL變薄,視網膜神經節細胞(RGC)數量減少且細胞邊界不清,INL細胞密度減小,ONL內側細胞密集、外側相對稀疏(圖 1B)。U1、D1組大鼠視網膜結構相似,均可見RGC數量減少、排列紊亂,IPL變薄(圖 1C,1D)。U2、U4、D2、D4組大鼠RGC數量不斷減少(圖 1E~1H)。與D4組比較,U4組大鼠視網膜ONL結構紊亂程度稍有改善,INL厚度有一定程度增加。
 圖1
各組大鼠視網膜光學顯微鏡像。1A.正常對照組;1B.糖尿病模型對照組;1C.U1組;1D.D1組;1E.U2組;1F.D2組;1G.U4組;1H.D4組。正常對照組大鼠視網膜各層結構正常;糖尿病模型對照組大鼠視網膜NFL變薄,RGC數量減少,INL細胞密度減小,ONL內側細胞密集、外側相對稀疏;U1、D1組大鼠RGC數量減少、排列紊亂,IPL變薄;U2、U4、D2、D4組大鼠RGC數量不斷減少HE ×400
圖1
各組大鼠視網膜光學顯微鏡像。1A.正常對照組;1B.糖尿病模型對照組;1C.U1組;1D.D1組;1E.U2組;1F.D2組;1G.U4組;1H.D4組。正常對照組大鼠視網膜各層結構正常;糖尿病模型對照組大鼠視網膜NFL變薄,RGC數量減少,INL細胞密度減小,ONL內側細胞密集、外側相對稀疏;U1、D1組大鼠RGC數量減少、排列紊亂,IPL變薄;U2、U4、D2、D4組大鼠RGC數量不斷減少HE ×400
各組大鼠視網膜ONL厚度比較,差異無統計學意義(F=1.506,P > 0.05);INL厚度比較,差異有統計學意義(F=6.603,P < 0.05)。與正常對照組比較,糖尿病模型組以及U1、U2、U4、D1、D2、D4組大鼠視網膜INL厚度明顯降低,差異有統計學意義(P < 0.05)。與D4組比較,U4組大鼠視網膜INL厚度明顯增加,差異有統計學意義(P < 0.05)(圖 2,3)。
 圖2
各組大鼠視網膜ONL厚度比較??圖 3?各組大鼠視網膜INL厚度比較。*P < 0.05;# P < 0.05
圖2
各組大鼠視網膜ONL厚度比較??圖 3?各組大鼠視網膜INL厚度比較。*P < 0.05;# P < 0.05
熒光顯微鏡觀察發現,PKH-26標記的懸浮hUCMSC呈紅色熒光(圖 4A);體外培養3 d后,仍可見呈紅色熒光的hUCMSC (圖 4B)。冰凍切片-組織免疫熒光實驗結果顯示,U1組大鼠視網膜可見沿內界膜分布的hUCMSC (圖 5A);U2組大鼠視網膜hUCMSC數量逐漸減少,主要位于NFL和GCL (圖 5B)。
 圖4
PKH-26標記的懸浮hUCMSC免疫熒光染色像。4A.可見懸浮hUCMSC呈紅色熒光;4B.體外培養3 d后,仍可見呈紅色熒光的hUCMSC ×100
圖4
PKH-26標記的懸浮hUCMSC免疫熒光染色像。4A.可見懸浮hUCMSC呈紅色熒光;4B.體外培養3 d后,仍可見呈紅色熒光的hUCMSC ×100
 圖5
大鼠視網膜熒光顯微鏡像。5A.U1組,可見沿內界膜分布的hUCMSC;5B.U2組,hUCMSC數量逐漸減少,主要位于NFL和GCL
圖5
大鼠視網膜熒光顯微鏡像。5A.U1組,可見沿內界膜分布的hUCMSC;5B.U2組,hUCMSC數量逐漸減少,主要位于NFL和GCL
實時定量PCR及Western blot檢測結果顯示,各組大鼠視網膜中GFAP及RHO mRNA、蛋白相對表達量間差異有統計學意義(P < 0.01)。隨建模時間延長,糖尿病模型對照組及D1、D2、D4組大鼠視網膜中GFAP mRNA、蛋白相對表達量逐漸升高;RHO mRNA、蛋白相對表達量逐漸降低。分別與D2、D4組比較,U2、U4組大鼠視網膜GFAP mRNA、蛋白相對表達量均降低,RHO mRNA、蛋白相對表達量均升高,差異均有統計學意義(P < 0.01)(圖 6~9)。
 圖6
各組大鼠視網膜中GFAP mRNA相對表達量比較。*P < 0.01;#P < 0.01 ??圖 7?各組大鼠視網膜中RHO mRNA相對表達量比較。*P < 0.01;#P < 0.01 ??圖 8?各組大鼠視網膜中GFAP蛋白相對表達量比較??圖 9?各組大鼠視網膜中RHO蛋白相對表達量比較
圖6
各組大鼠視網膜中GFAP mRNA相對表達量比較。*P < 0.01;#P < 0.01 ??圖 7?各組大鼠視網膜中RHO mRNA相對表達量比較。*P < 0.01;#P < 0.01 ??圖 8?各組大鼠視網膜中GFAP蛋白相對表達量比較??圖 9?各組大鼠視網膜中RHO蛋白相對表達量比較
3 討論
PKH-26是一種親脂性的紅色熒光染料,可與細胞膜脂質雙分子層發生不可逆結合,可通過熒光顯微鏡有效觀察hUCMSC的細胞輪廓及運動軌跡[7]。我們采用PKH-26對hUCMSC進行示蹤標記,發現hUCMSC移植到糖尿病大鼠玻璃體腔后能夠遷移,整合至視網膜。
作為骨架蛋白的特有成分,GFAP被認為是神經系統星形膠質細胞的標志蛋白,可參與機體發育、創傷愈合等過程[8]。研究發現,糖尿病大鼠在病程第1個月時,視網膜Müller細胞中GFAP不表達;但在病程12周時GFAP表達[9]。本研究也觀察到類似現象,即未經hUCMSC移植干預的糖尿病大鼠視網膜中GFAP mRNA、蛋白表達均隨著建模時間延長而升高;而經hUCMSC移植干預的糖尿病大鼠視網膜中GFAP mRNA、蛋白表達明顯降低。說明移植hUCMSC可能通過影響GFAP的表達發揮對視網膜的保護作用。提示hUCMSC可能向神經元樣細胞方向分化,使膠質細胞中的表達量較低。
有研究已證實由于糖尿病造成的光感受器細胞改變,通過測定視網膜電圖a波的最高峰,光感受器細胞暗電流強度在STZ注射12周后降低16%~24%;RHO作為其標志物,表達下降[10]。亦有研究觀察發現,隨著糖尿病病情加重,患者外周循環血中RHO mRNA表達呈升高趨勢,增生期DR RHO mRNA表達驟降[11]。與之不同的是,本研究結果顯示,糖尿病大鼠視網膜中RHO mRNA表達隨著建模時間延長而降低。我們分析認為,導致結果差異的原因可能與大鼠與人類的DR程度進展不同有關,且本研究是提取視網膜組織中的mRNA進行測定。我們推測眼內移植的hUCMSC定位到視網膜后,在特定微環境下可能通過調控GFAP、RHO等多種神經相關因子的表達,分化為神經節或神經膠質細胞,重建或增加神經元通路,促進損傷視網膜修復,從而起到一定的治療作用。
本研究雖然從形態學和分子生物學水平初步觀察了hUCMSC移植后糖尿病大鼠視網膜組織結構及GFAP、RHO表達變化,但仍無法最終確定hUCMSC是否分化為神經細胞,這有待于進一步研究證實。此外,關于hUCMSC長期培養傳代后有無惡變傾向及惡變標志;如何優化細胞采集技術,提高分離效率和純度;如何有效控制hUCMSC的生長和分化;分化后細胞表面抗原如何變化等多方面問題仍需要進一步探討。