引用本文: 閆瑾, 賈淑杰, 劉美欣, 韓泉洪, 張毅. 單次玻璃體腔注射不同劑量伏立康唑對兔眼角膜和視網膜的影響. 中華眼底病雜志, 2016, 32(2): 191-196. doi: 10.3760/cma.j.issn.1005-1015.2016.02.018 復制
新型三唑類抗真菌藥物伏立康唑 (voriconazole)抗菌譜廣、毒性低、抗菌效力強,通過玻璃體腔注射給藥對真菌性眼內炎具有較好治療效果[1-6]。但藥物經玻璃體腔注射后隨房水流動可到達前房,是否對眼前節組織具有毒性尚報道不多;此外,伏立康唑的半衰期較短,如連續玻璃體腔注射給藥,可能導致玻璃體積血、增生機化和視網膜脫離等并發癥。因此,玻璃體腔單次注射負荷量伏立康唑,在盡可能提高和維持藥物在玻璃體有效的治療濃度,又不造成眼內毒性的同時控制眼內真菌感染,成為伏立康唑治療眼內炎的關鍵問題。探討最佳藥物劑量和給藥頻率以達到合理的眼內濃度,保證眼內安全同時有效控制病情具有重要臨床意義。為此,我們采用功能和組織學方法,評估了單次玻璃體腔注射不同劑量伏立康唑對兔眼角膜及視網膜的影響,以期為伏立康唑單次玻璃體腔注射安全劑量選擇提供參考。現將結果報道如下。
1 材料和方法
新西蘭大白兔25只,體重1.5~2.0 kg,雌雄不限,天津市醫藥科學研究所提供[許可證號:SCXK(京)2014-0003]。注射用伏立康唑(麗珠集團麗珠制藥廠),戊巴比妥鈉(美國 Sigma公司),0.5%鹽酸丙美卡因滴眼液(美國 Alcon公司),鹽酸左氧氟沙星滴眼液(日本參天制藥),0.5%復方托吡卡胺滴眼液(日本參天制藥),氧氟沙星眼膏(沈陽興齊制藥有限公司)。共聚焦顯微鏡(德國海德堡公司),羅蘭視覺電生理儀(德國Roland公司),光學顯微鏡(日本Olympus公司),透射電子顯微鏡(日本Hitachi公司)。
按隨機數字表法將兔分為對照組和伏立康唑50、100、200、400 μg組,每組各5只兔。每只兔選取一側眼作為實驗眼。以0.5%鹽酸丙美卡因滴眼液表面麻醉后,安爾碘常規眼周消毒及沖洗結膜囊,無菌貼膜覆蓋手術眼,開瞼器開瞼,用一次性1 ml 注射器于顳上象限角膜緣后 3.0 mm 處向玻璃體中央刺入,在直視下進行玻璃體腔注射。對照組注射0.1 ml生理鹽水,伏立康唑各濃度組單次注射含伏立康唑50、100、200、400 μg的注射用伏立康唑0.1 ml。注藥后3 d,左氧氟沙星滴眼液點眼,3次/d。
注藥前和注藥后1、7、14 d,采用裂隙燈顯微鏡和直接檢眼鏡對實驗眼進行一般觀察,并使用非接觸式眼壓計測量眼壓。以30 mg/kg的劑量經耳緣靜脈注射3%戊巴比妥鈉全身麻醉后,使用共聚焦顯微鏡計數角膜內皮細胞數量,測量角膜厚度。采用全視野視網膜電圖(ERG)檢查行最大混合反應(Max-R)檢測。檢查前以0.5%復方托吡卡胺滴眼液充分散瞳,暗適應30 min,側位固定于電生理儀實驗臺上,使受檢眼處于全視野刺激球內中央,對側眼用不透光眼罩遮蓋,參考電極和接地電極分別置于額部正中和同側耳緣部皮下。兔眼以0.5%鹽酸丙美卡因滴眼液表面麻醉,角膜接觸鏡電極內滴入迪可羅眼膏后安放于角膜上,刺激光為白光。最大混合反應刺激光強度 0 dB,刺激頻率 0.1 Hz,刺激間隔 7 s,繪圖時間 150 ms,各種刺激條件均重復3次,記錄Max-R b 波振幅。
注藥后14 d,各組隨機取2只兔,摘取實驗眼眼球。1只眼置入10%福爾馬林液中固定,常規脫水,石臘包埋,制成石蠟切片,蘇木精-伊紅(HE)染色,光學顯微鏡觀察角膜和視網膜組織結構;1只眼立即置入4℃、2.5%戊二醛液中固定,采用透射電子顯微鏡觀察角膜和視網膜細胞超微結構。選取中央角膜和距視盤0.5 mm處視網膜進行病理性觀察并采集圖像。
采用SPSS 18.0軟件進行統計學分析。計量資料均以均數±標準差(
2 結果
注藥后1 d,伏立康唑200、400 μg組各有1只眼玻璃體腔略見混濁,但均于注藥后7 d消失。其他各組各時間點裂隙燈顯微鏡和直接檢眼鏡檢查均正常。
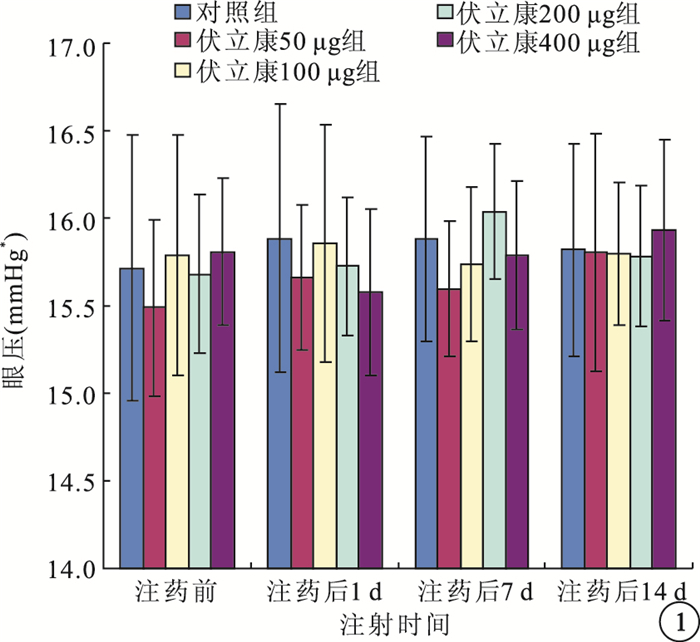
注藥前及注藥后1、7、14 d,伏立康唑各濃度組與對照組兔眼眼壓比較,差異均無統計學意義(F=0.241、0.260、0.673、0.065,P>0.05)(圖 1)。
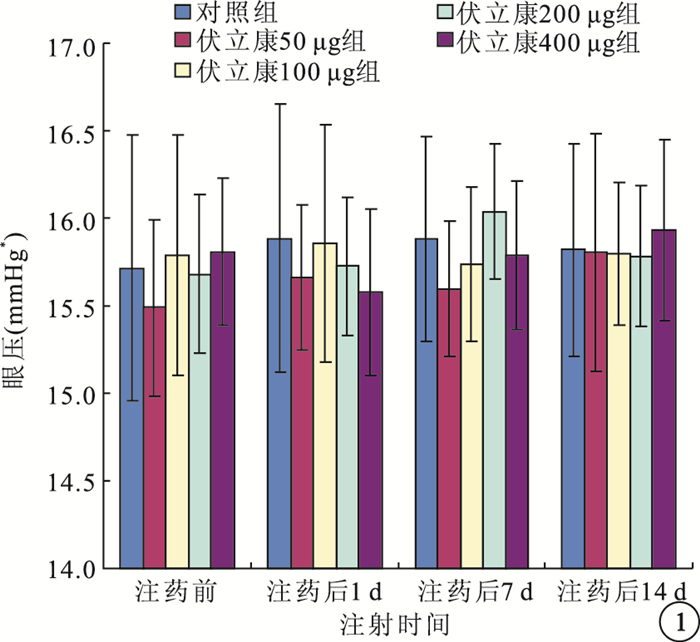 圖1
伏立康唑各濃度組與對照組兔眼眼壓比較。*1 mmHg=0.133 kPa
圖1
伏立康唑各濃度組與對照組兔眼眼壓比較。*1 mmHg=0.133 kPa
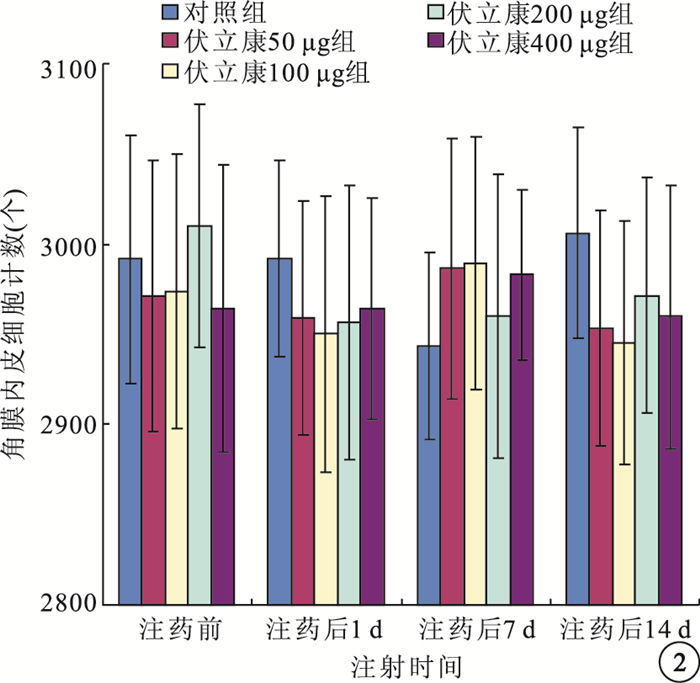
注藥前及注藥后1、7、14 d,伏立康唑各濃度組與對照組兔眼角膜內皮細胞計數比較,差異均無統計學意義(F=0.320、0.291、0.467、0.649,P>0.05)(圖 2)。
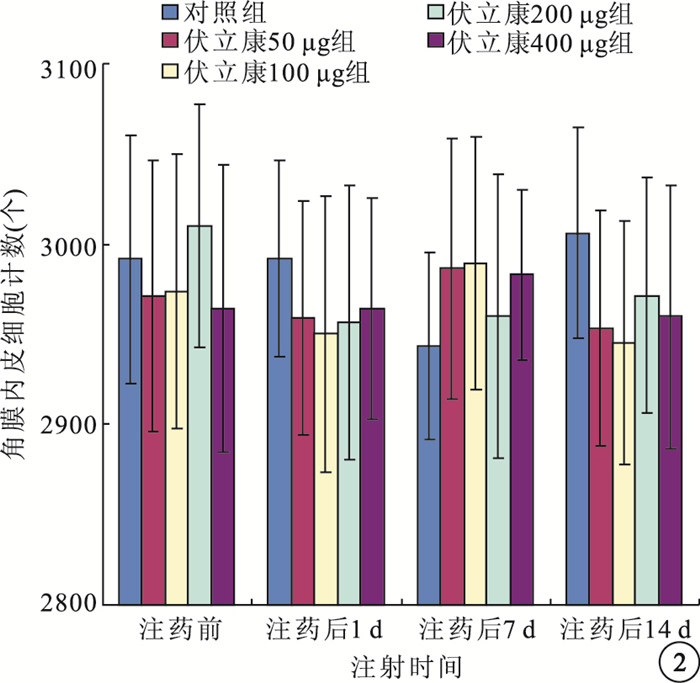 圖2
伏立康唑各濃度組與對照組兔眼角膜內皮細胞計數比較
圖2
伏立康唑各濃度組與對照組兔眼角膜內皮細胞計數比較
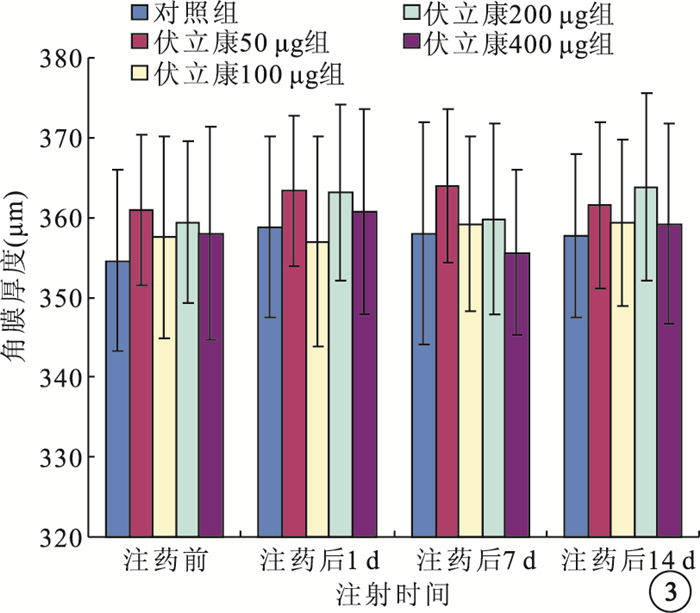
注藥前及注藥后1、7、14 d,伏立康唑各濃度組與對照組兔眼角膜厚度比較,差異均無統計學意義(F=0.214、0.284、0.360、0.225,P>0.05)(圖 3)。
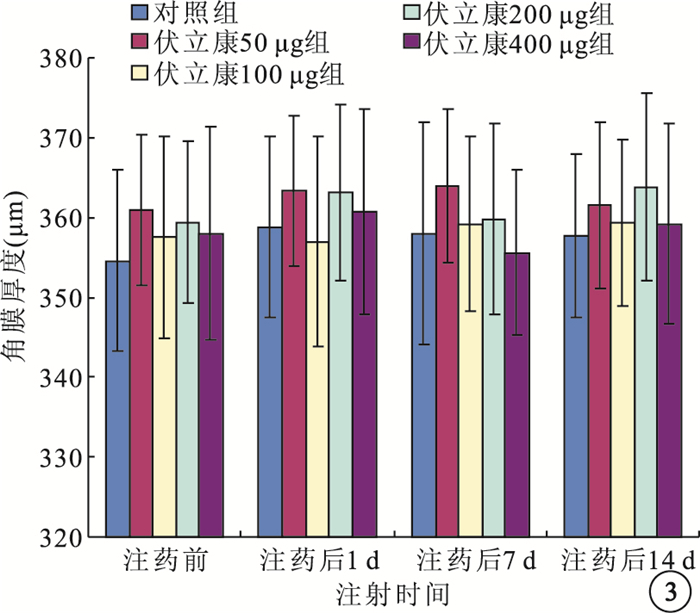 圖3
伏立康唑各濃度組與對照組兔眼角膜厚度比較
圖3
伏立康唑各濃度組與對照組兔眼角膜厚度比較
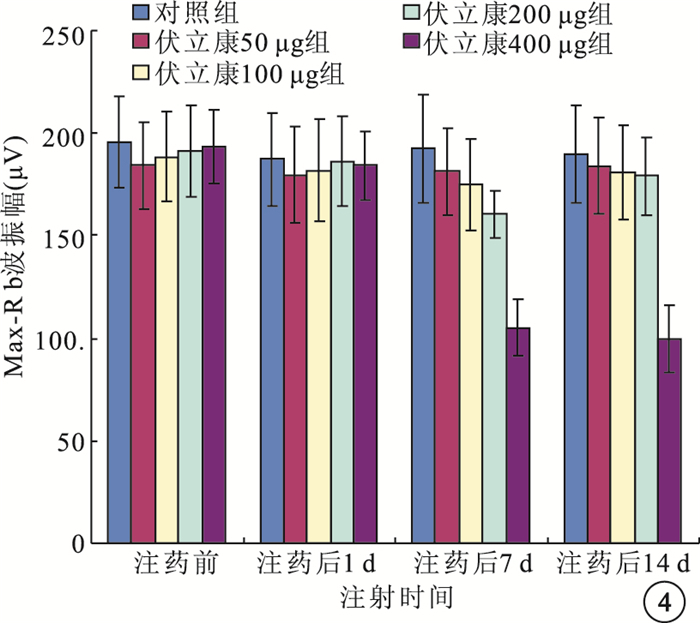
注藥前及注藥后1 d,伏立康唑各濃度組與對照組Max-R b波振幅比較,差異均無統計學意義(F=0.220、0.106,P>0.05)。注藥后7 d,伏立康唑200、400 μg組Max-R b波振幅較對照組明顯下降,差異有統計學意義(t=2.550、6.950,P<0.05);其余濃度組與對照組之間的差異無統計學意義(t=0.895,1.400,P>0.05)。注藥后14 d,伏立康唑 50、100、200 μg組與對照組Max-R b 波振幅比較,差異無統計學意義(t=0.420、0.640,0.790,P>0.05); 伏立康唑400 μg組Max-R b波振幅較對照組明顯下降,差異有統計學意義(t=6.690,P<0.05)(圖 4)。
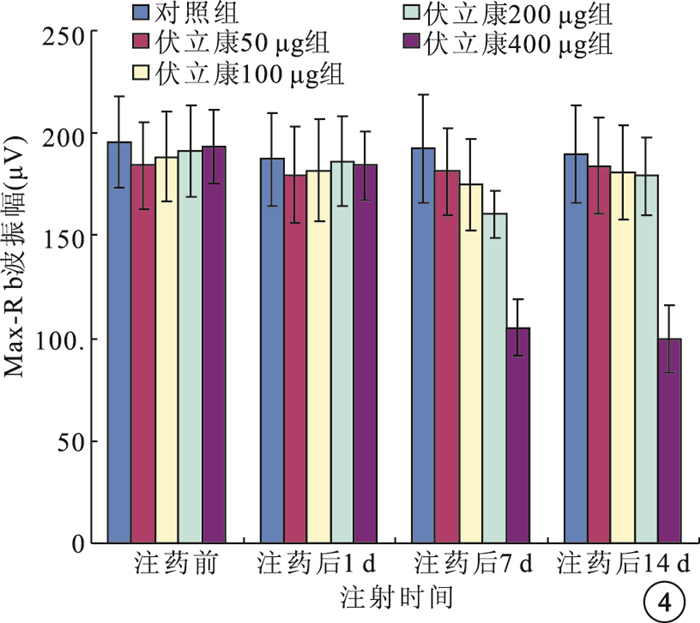 圖4
伏立康唑各濃度組與對照組Max-R b波振幅比較。*與對照組比較,P<0.05;** 與對照組比較,P<0.01
圖4
伏立康唑各濃度組與對照組Max-R b波振幅比較。*與對照組比較,P<0.05;** 與對照組比較,P<0.01
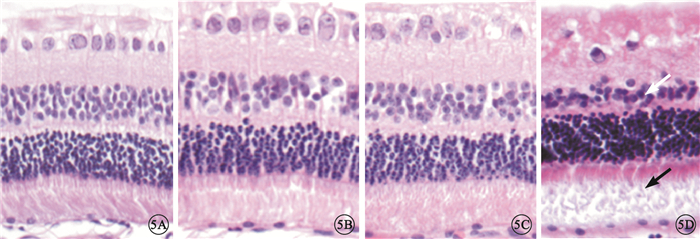
光學顯微鏡觀察發現,對照組及伏立康唑各濃度組兔角膜組織結構完整,各層結構清晰;角膜上皮層排列規則,角膜基質層纖維排列整齊,角膜后彈力層清晰可見,角膜內皮細胞層完整,無明顯水腫。對照組及伏立康唑50、100、200 μg組兔視網膜各層結構清晰,排列規整。視網膜內界膜表面光滑,神經纖維層清晰,無水腫,神經節細胞數量和排列正常,內叢狀層及外叢狀層無水腫,內外核層細胞及光感受器細胞完整,排列規則(圖 5A~5C)。伏立康唑400 μg組兔視網膜神經纖維層水腫,神經節細胞萎縮、數量減少,核固縮;內叢狀層水腫;內核層空泡樣變性、變薄,細胞排列不整齊,細胞間界限不清;外叢狀層排列紊亂;外核層腫脹,排列不規則;光感受器細胞外節變性,排列紊亂,可見細胞碎解(圖 5D)。
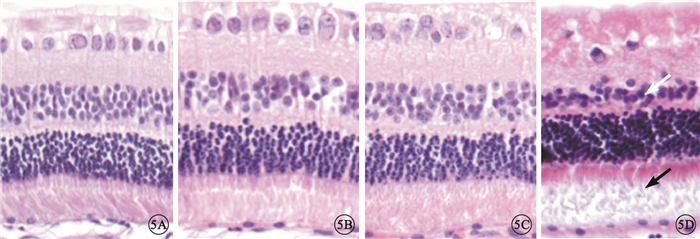 圖5
兔視網膜光學顯微鏡像。5A.對照組,視網膜結構清晰,細胞排列整齊;5B. 伏立康唑100 μg組,視網膜結構清晰,細胞排列整齊; 5C.伏立康唑200 μg組,視網膜結構清晰,細胞排列整齊;5D. 伏立康唑400 μg組,內核層變薄,細胞排列不整齊,細胞間界限不清(白箭),光感受器細胞內外節欠整齊,可見細胞碎解(黑箭) HE ×200
圖5
兔視網膜光學顯微鏡像。5A.對照組,視網膜結構清晰,細胞排列整齊;5B. 伏立康唑100 μg組,視網膜結構清晰,細胞排列整齊; 5C.伏立康唑200 μg組,視網膜結構清晰,細胞排列整齊;5D. 伏立康唑400 μg組,內核層變薄,細胞排列不整齊,細胞間界限不清(白箭),光感受器細胞內外節欠整齊,可見細胞碎解(黑箭) HE ×200
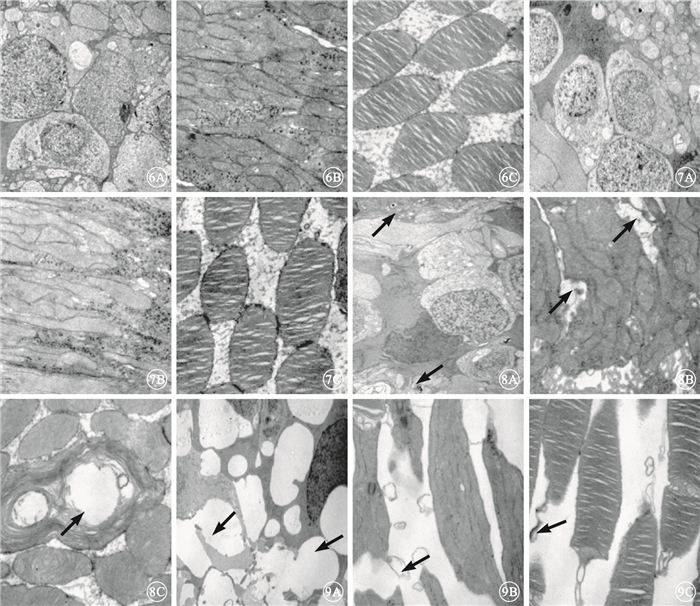
透射電子顯微鏡觀察發現,對照組及伏立康唑各濃度組兔角膜組織結構完整,各層結構清晰;角膜內皮細胞與基膜連接緊密,無明顯水腫;上皮細胞、基質細胞和內皮細胞層未見異常。對照組及伏立康唑50、100 μg組兔視網膜內核層細胞、光感受器細胞內外節超微結構基本正常;各層細胞膜完整,結構清晰,未見核碎裂、核染色質消失、胞漿空泡變性、線粒體腫脹等損害(圖 6,7)。伏立康唑200 μg組兔視網膜內核層細胞排列尚規整,部分線粒體輕度腫脹,基質電子密度低,嵴變少變短,膜間或胞膜內可見少量髓磷體結構;光感受器細胞內節細胞間隙擴張,水腫,稍有空泡變性,外膜之間有少量電子致密物沉積;光感受器細胞外節部分膜盤粘連,外膜局灶性降解,部分形成大的環形層狀結構,其中央部位電子密度空白(圖 8)。伏立康唑400 μg組兔視網膜內核層細胞結構破壞,胞膜溶解,細胞間隙出現大量空泡和髓磷體結構,細胞內細胞器減少,線粒體中度腫脹,嵴減少且排列紊亂;光感受器細胞內節間隙擴大,水腫明顯,膜間或胞膜有較多的髓磷體結構存在;光感受器細胞外節部分排列紊亂,膜盤疏松,盤間平行度較差,腫脹缺損(圖 9)。
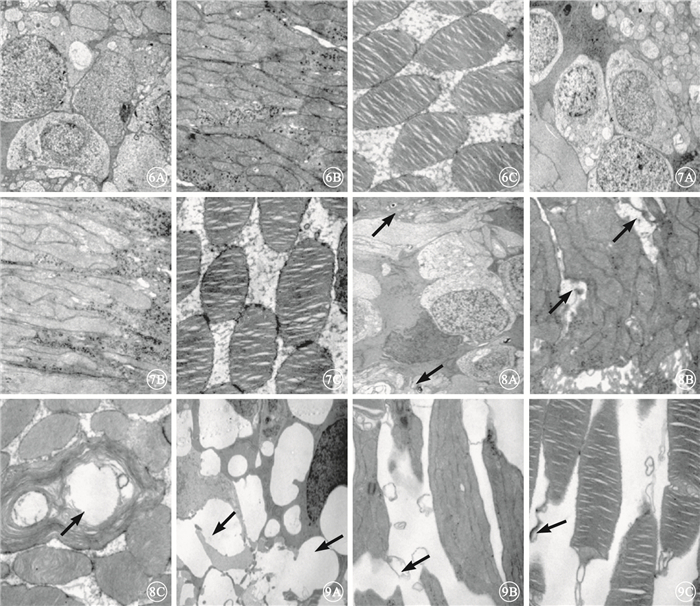 圖6
對照組兔視網膜透射電子顯微鏡像。6A.內核層細胞間連接緊密 醋酸鈾枸櫞酸鉛 ×5000;6B.光感受器細胞內節排列規則 醋酸鈾枸櫞酸鉛 ×15 000;6C.光感受器細胞外節排列整齊 醋酸鈾枸櫞酸鉛 ×15 000 圖 7 伏立康唑100 μg組兔視網膜透射電子顯微鏡像。7A.內核層細胞間連接緊密 醋酸鈾枸櫞酸鉛 ×5000;7B.光感受器細胞內節排列規則 醋酸鈾枸櫞酸鉛 ×15 000;7C.光感受器細胞外節排列整齊 醋酸鈾枸櫞酸鉛 ×15 000 圖 8 伏立康唑200 μg組兔視網膜透射電子顯微鏡像。8A.內核層細胞輕度腫脹,膜間或胞膜內可見少量髓磷體結構(黑箭) 醋酸鈾枸櫞酸鉛 ×5000;8B.光感受器細胞內節細胞間隙擴張,水腫,稍有空泡變性,外膜之間有少量電子致密物沉積(黑箭) 醋酸鈾枸櫞酸鉛 ×15 000;8C.光感受器細胞外節部分膜盤粘連,外膜局灶性降解,部分形成大的環形層狀結構,其中央部位電子密度空白(黑箭) 醋酸鈾枸櫞酸鉛 ×15 000 圖 9 伏立康唑400 μg組兔視網膜透射電子顯微鏡像。9A. 內核層細胞結構破壞,胞膜溶解,細胞間隙出現大量空泡和髓磷體結構(黑箭),細胞內細胞器減少,線粒體中度腫脹,嵴減少且排列紊亂 醋酸鈾枸櫞酸鉛 ×5000;9B.光感受器細胞內節內節間隙擴大,水腫明顯,膜間或胞膜有較多的髓磷體結構存在(黑箭) 醋酸鈾枸櫞酸鉛 ×15 000;9C.光感受器細胞外節部分排列紊亂,膜盤疏松,盤間平行度較差,腫脹缺損(黑箭) 醋酸鈾枸櫞酸鉛 ×15 000
圖6
對照組兔視網膜透射電子顯微鏡像。6A.內核層細胞間連接緊密 醋酸鈾枸櫞酸鉛 ×5000;6B.光感受器細胞內節排列規則 醋酸鈾枸櫞酸鉛 ×15 000;6C.光感受器細胞外節排列整齊 醋酸鈾枸櫞酸鉛 ×15 000 圖 7 伏立康唑100 μg組兔視網膜透射電子顯微鏡像。7A.內核層細胞間連接緊密 醋酸鈾枸櫞酸鉛 ×5000;7B.光感受器細胞內節排列規則 醋酸鈾枸櫞酸鉛 ×15 000;7C.光感受器細胞外節排列整齊 醋酸鈾枸櫞酸鉛 ×15 000 圖 8 伏立康唑200 μg組兔視網膜透射電子顯微鏡像。8A.內核層細胞輕度腫脹,膜間或胞膜內可見少量髓磷體結構(黑箭) 醋酸鈾枸櫞酸鉛 ×5000;8B.光感受器細胞內節細胞間隙擴張,水腫,稍有空泡變性,外膜之間有少量電子致密物沉積(黑箭) 醋酸鈾枸櫞酸鉛 ×15 000;8C.光感受器細胞外節部分膜盤粘連,外膜局灶性降解,部分形成大的環形層狀結構,其中央部位電子密度空白(黑箭) 醋酸鈾枸櫞酸鉛 ×15 000 圖 9 伏立康唑400 μg組兔視網膜透射電子顯微鏡像。9A. 內核層細胞結構破壞,胞膜溶解,細胞間隙出現大量空泡和髓磷體結構(黑箭),細胞內細胞器減少,線粒體中度腫脹,嵴減少且排列紊亂 醋酸鈾枸櫞酸鉛 ×5000;9B.光感受器細胞內節內節間隙擴大,水腫明顯,膜間或胞膜有較多的髓磷體結構存在(黑箭) 醋酸鈾枸櫞酸鉛 ×15 000;9C.光感受器細胞外節部分排列紊亂,膜盤疏松,盤間平行度較差,腫脹缺損(黑箭) 醋酸鈾枸櫞酸鉛 ×15 000
3 討論
伏立康唑玻璃體腔注射可成功治愈對常規治療無效的真菌性眼內炎[6, 7]。臨床應用伏立康唑玻璃體腔注射劑量一般為1000 μg/ml,療效顯著[1, 4, 7]。但很少有研究考察其對眼內組織的影響。雖然已有體外實驗證實伏立康唑質量濃度≤250 mg/L時,不會對視網膜色素上皮細胞及神經膠質細胞產生毒性[8];但由于眼內代謝等原因,體外實驗結果與體內實驗不能等同。本研究參考臨床常用劑量并結合預實驗結果,設計了50、100、200、400 μg共4種濃度,通過動物實驗來評估伏立康唑玻璃體腔單次給藥對兔眼內組織的安全性,探討其對角膜和視網膜的影響,推導合適的眼內用藥濃度,從而進一步擴展伏立康唑抗真菌性眼內炎的臨床應用。
本研究采用活體共聚焦顯微鏡進行角膜內皮細胞計數,并進行角膜厚度測量。雖然有研究顯示該儀器測量值較測量角膜厚度的金標準A型超聲偏小[9],但其誤差對各組實驗眼的影響是一致的。因此,它雖然可能影響單個角膜厚度的絕對數值,但是對各組之間統計學檢驗的結果并不會產生影響。本研究結果顯示,注藥前及注藥后各時間點,伏立康唑各濃度組與對照組兔眼角膜厚度及內皮細胞計數差異均無統計學意義。我們還通過光學顯微鏡和電子顯微鏡對角膜進行病理性觀察,發現伏立康唑各濃度組兔眼在玻璃體腔注射后角膜組織結構均未見損害。提示單次玻璃體腔注射伏立康唑400 μg以內對兔眼角膜形態沒有影響,但藥物隨房水流動到達前房,在角膜組織的藥物濃度及其是否對角膜功能產生影響有待進一步考察。
ERG是反映視網膜功能的有效指標,其b波起自光感受器與神經節細胞之間的神經通路,可能起源于Müller細胞或雙極細胞,反映視網膜內核層區域細胞的電活動,所以b波振幅變化能靈敏、可靠的客觀判 斷視網膜功能。因此,本研究選用此指標評價玻璃體腔注射伏立康唑對視網膜的毒副作用。結果顯示,伏立康唑 200 μg組 Max-Rb波振幅值于注藥后7 d變化明顯,之后又回升,但與對照組之間的差異不明顯;伏立康唑 400 μg 組Max-R b波振幅值于注藥后7、14 d明顯下降,與對照組之間具有明顯差異。說明200 μg伏立康唑可造成視網膜功能的一過性損害,但這種損害是可恢復的,至觀察期末恢復至注藥前水平。但當劑量達400 μg時,其對兔視網膜的損害是不可逆的。提示伏立康唑對光感受器及視網膜內核層有一定作用,這與視網膜組織學檢查結果相吻合。我們還發現,注藥后14 d伏立康唑200 μg組雖然ERG及光學顯微鏡檢查無異常,但通過透射電子顯微鏡可見視網膜內核層細胞輕度腫脹,膜間或胞膜內有少量髓磷體結構,光感受器細胞內節細胞間隙擴張,水腫,稍有空泡變性,外節部分膜盤粘連,外膜局灶性降解。因此在研究視網膜毒性時,我們認為透射電子顯微鏡較視覺電生理檢查更為敏感,與文獻報道結果一致[10]。伏立康唑 400 μg組于透射電子顯微鏡下可見內核層細胞結構破壞,出現大量空泡,光感受器細胞內節明顯水腫,外節排列紊亂,膜盤疏松,腫脹缺損。這也解釋了該濃度組兔視網膜在光學顯微鏡下內核層空泡樣變性、變薄,光感受器細胞變性,排列紊亂的原因。
本研究結果表明,玻璃體腔注射濃度100 μg以內的伏立康唑對兔眼角膜和視網膜組織形態及功能均無損害。由于人眼玻璃體腔容積約為兔眼的 2~3 倍,假設人眼與兔眼視網膜毒性閥值相當,人眼玻璃體腔注射100 μg的伏立康唑應該更安全。研究顯示,伏立康唑的最低抑菌濃度(MIC90)值為0.5~5.0 μg/ml[11]。按兔眼玻璃體腔容積約1.2~1.5 ml估算,伏立康唑此劑量給藥后玻璃體腔藥物峰值濃度約為 66.7~83.3 μg/ml,大大超過了該藥對各種常見致病菌的MIC90值。即使按人眼玻璃體腔容積4.0 ml估算,以此劑量注射后的藥物濃度也遠遠超過該藥的MIC90值。作為新一代的抗真菌藥物,伏立康唑治療真菌性眼內炎已顯示出一定的優越性,本研究結果可進一步為最大限度減少伏立康唑眼內用藥可能引起的不良反應提供參考。有關該藥玻璃體腔注射眼內藥代動力學有待今后繼續關注,以進一步證實其眼內用藥安全性及療效。
新型三唑類抗真菌藥物伏立康唑 (voriconazole)抗菌譜廣、毒性低、抗菌效力強,通過玻璃體腔注射給藥對真菌性眼內炎具有較好治療效果[1-6]。但藥物經玻璃體腔注射后隨房水流動可到達前房,是否對眼前節組織具有毒性尚報道不多;此外,伏立康唑的半衰期較短,如連續玻璃體腔注射給藥,可能導致玻璃體積血、增生機化和視網膜脫離等并發癥。因此,玻璃體腔單次注射負荷量伏立康唑,在盡可能提高和維持藥物在玻璃體有效的治療濃度,又不造成眼內毒性的同時控制眼內真菌感染,成為伏立康唑治療眼內炎的關鍵問題。探討最佳藥物劑量和給藥頻率以達到合理的眼內濃度,保證眼內安全同時有效控制病情具有重要臨床意義。為此,我們采用功能和組織學方法,評估了單次玻璃體腔注射不同劑量伏立康唑對兔眼角膜及視網膜的影響,以期為伏立康唑單次玻璃體腔注射安全劑量選擇提供參考。現將結果報道如下。
1 材料和方法
新西蘭大白兔25只,體重1.5~2.0 kg,雌雄不限,天津市醫藥科學研究所提供[許可證號:SCXK(京)2014-0003]。注射用伏立康唑(麗珠集團麗珠制藥廠),戊巴比妥鈉(美國 Sigma公司),0.5%鹽酸丙美卡因滴眼液(美國 Alcon公司),鹽酸左氧氟沙星滴眼液(日本參天制藥),0.5%復方托吡卡胺滴眼液(日本參天制藥),氧氟沙星眼膏(沈陽興齊制藥有限公司)。共聚焦顯微鏡(德國海德堡公司),羅蘭視覺電生理儀(德國Roland公司),光學顯微鏡(日本Olympus公司),透射電子顯微鏡(日本Hitachi公司)。
按隨機數字表法將兔分為對照組和伏立康唑50、100、200、400 μg組,每組各5只兔。每只兔選取一側眼作為實驗眼。以0.5%鹽酸丙美卡因滴眼液表面麻醉后,安爾碘常規眼周消毒及沖洗結膜囊,無菌貼膜覆蓋手術眼,開瞼器開瞼,用一次性1 ml 注射器于顳上象限角膜緣后 3.0 mm 處向玻璃體中央刺入,在直視下進行玻璃體腔注射。對照組注射0.1 ml生理鹽水,伏立康唑各濃度組單次注射含伏立康唑50、100、200、400 μg的注射用伏立康唑0.1 ml。注藥后3 d,左氧氟沙星滴眼液點眼,3次/d。
注藥前和注藥后1、7、14 d,采用裂隙燈顯微鏡和直接檢眼鏡對實驗眼進行一般觀察,并使用非接觸式眼壓計測量眼壓。以30 mg/kg的劑量經耳緣靜脈注射3%戊巴比妥鈉全身麻醉后,使用共聚焦顯微鏡計數角膜內皮細胞數量,測量角膜厚度。采用全視野視網膜電圖(ERG)檢查行最大混合反應(Max-R)檢測。檢查前以0.5%復方托吡卡胺滴眼液充分散瞳,暗適應30 min,側位固定于電生理儀實驗臺上,使受檢眼處于全視野刺激球內中央,對側眼用不透光眼罩遮蓋,參考電極和接地電極分別置于額部正中和同側耳緣部皮下。兔眼以0.5%鹽酸丙美卡因滴眼液表面麻醉,角膜接觸鏡電極內滴入迪可羅眼膏后安放于角膜上,刺激光為白光。最大混合反應刺激光強度 0 dB,刺激頻率 0.1 Hz,刺激間隔 7 s,繪圖時間 150 ms,各種刺激條件均重復3次,記錄Max-R b 波振幅。
注藥后14 d,各組隨機取2只兔,摘取實驗眼眼球。1只眼置入10%福爾馬林液中固定,常規脫水,石臘包埋,制成石蠟切片,蘇木精-伊紅(HE)染色,光學顯微鏡觀察角膜和視網膜組織結構;1只眼立即置入4℃、2.5%戊二醛液中固定,采用透射電子顯微鏡觀察角膜和視網膜細胞超微結構。選取中央角膜和距視盤0.5 mm處視網膜進行病理性觀察并采集圖像。
采用SPSS 18.0軟件進行統計學分析。計量資料均以均數±標準差(
2 結果
注藥后1 d,伏立康唑200、400 μg組各有1只眼玻璃體腔略見混濁,但均于注藥后7 d消失。其他各組各時間點裂隙燈顯微鏡和直接檢眼鏡檢查均正常。
注藥前及注藥后1、7、14 d,伏立康唑各濃度組與對照組兔眼眼壓比較,差異均無統計學意義(F=0.241、0.260、0.673、0.065,P>0.05)(圖 1)。
 圖1
伏立康唑各濃度組與對照組兔眼眼壓比較。*1 mmHg=0.133 kPa
圖1
伏立康唑各濃度組與對照組兔眼眼壓比較。*1 mmHg=0.133 kPa
注藥前及注藥后1、7、14 d,伏立康唑各濃度組與對照組兔眼角膜內皮細胞計數比較,差異均無統計學意義(F=0.320、0.291、0.467、0.649,P>0.05)(圖 2)。
 圖2
伏立康唑各濃度組與對照組兔眼角膜內皮細胞計數比較
圖2
伏立康唑各濃度組與對照組兔眼角膜內皮細胞計數比較
注藥前及注藥后1、7、14 d,伏立康唑各濃度組與對照組兔眼角膜厚度比較,差異均無統計學意義(F=0.214、0.284、0.360、0.225,P>0.05)(圖 3)。
 圖3
伏立康唑各濃度組與對照組兔眼角膜厚度比較
圖3
伏立康唑各濃度組與對照組兔眼角膜厚度比較
注藥前及注藥后1 d,伏立康唑各濃度組與對照組Max-R b波振幅比較,差異均無統計學意義(F=0.220、0.106,P>0.05)。注藥后7 d,伏立康唑200、400 μg組Max-R b波振幅較對照組明顯下降,差異有統計學意義(t=2.550、6.950,P<0.05);其余濃度組與對照組之間的差異無統計學意義(t=0.895,1.400,P>0.05)。注藥后14 d,伏立康唑 50、100、200 μg組與對照組Max-R b 波振幅比較,差異無統計學意義(t=0.420、0.640,0.790,P>0.05); 伏立康唑400 μg組Max-R b波振幅較對照組明顯下降,差異有統計學意義(t=6.690,P<0.05)(圖 4)。
 圖4
伏立康唑各濃度組與對照組Max-R b波振幅比較。*與對照組比較,P<0.05;** 與對照組比較,P<0.01
圖4
伏立康唑各濃度組與對照組Max-R b波振幅比較。*與對照組比較,P<0.05;** 與對照組比較,P<0.01
光學顯微鏡觀察發現,對照組及伏立康唑各濃度組兔角膜組織結構完整,各層結構清晰;角膜上皮層排列規則,角膜基質層纖維排列整齊,角膜后彈力層清晰可見,角膜內皮細胞層完整,無明顯水腫。對照組及伏立康唑50、100、200 μg組兔視網膜各層結構清晰,排列規整。視網膜內界膜表面光滑,神經纖維層清晰,無水腫,神經節細胞數量和排列正常,內叢狀層及外叢狀層無水腫,內外核層細胞及光感受器細胞完整,排列規則(圖 5A~5C)。伏立康唑400 μg組兔視網膜神經纖維層水腫,神經節細胞萎縮、數量減少,核固縮;內叢狀層水腫;內核層空泡樣變性、變薄,細胞排列不整齊,細胞間界限不清;外叢狀層排列紊亂;外核層腫脹,排列不規則;光感受器細胞外節變性,排列紊亂,可見細胞碎解(圖 5D)。
 圖5
兔視網膜光學顯微鏡像。5A.對照組,視網膜結構清晰,細胞排列整齊;5B. 伏立康唑100 μg組,視網膜結構清晰,細胞排列整齊; 5C.伏立康唑200 μg組,視網膜結構清晰,細胞排列整齊;5D. 伏立康唑400 μg組,內核層變薄,細胞排列不整齊,細胞間界限不清(白箭),光感受器細胞內外節欠整齊,可見細胞碎解(黑箭) HE ×200
圖5
兔視網膜光學顯微鏡像。5A.對照組,視網膜結構清晰,細胞排列整齊;5B. 伏立康唑100 μg組,視網膜結構清晰,細胞排列整齊; 5C.伏立康唑200 μg組,視網膜結構清晰,細胞排列整齊;5D. 伏立康唑400 μg組,內核層變薄,細胞排列不整齊,細胞間界限不清(白箭),光感受器細胞內外節欠整齊,可見細胞碎解(黑箭) HE ×200
透射電子顯微鏡觀察發現,對照組及伏立康唑各濃度組兔角膜組織結構完整,各層結構清晰;角膜內皮細胞與基膜連接緊密,無明顯水腫;上皮細胞、基質細胞和內皮細胞層未見異常。對照組及伏立康唑50、100 μg組兔視網膜內核層細胞、光感受器細胞內外節超微結構基本正常;各層細胞膜完整,結構清晰,未見核碎裂、核染色質消失、胞漿空泡變性、線粒體腫脹等損害(圖 6,7)。伏立康唑200 μg組兔視網膜內核層細胞排列尚規整,部分線粒體輕度腫脹,基質電子密度低,嵴變少變短,膜間或胞膜內可見少量髓磷體結構;光感受器細胞內節細胞間隙擴張,水腫,稍有空泡變性,外膜之間有少量電子致密物沉積;光感受器細胞外節部分膜盤粘連,外膜局灶性降解,部分形成大的環形層狀結構,其中央部位電子密度空白(圖 8)。伏立康唑400 μg組兔視網膜內核層細胞結構破壞,胞膜溶解,細胞間隙出現大量空泡和髓磷體結構,細胞內細胞器減少,線粒體中度腫脹,嵴減少且排列紊亂;光感受器細胞內節間隙擴大,水腫明顯,膜間或胞膜有較多的髓磷體結構存在;光感受器細胞外節部分排列紊亂,膜盤疏松,盤間平行度較差,腫脹缺損(圖 9)。
 圖6
對照組兔視網膜透射電子顯微鏡像。6A.內核層細胞間連接緊密 醋酸鈾枸櫞酸鉛 ×5000;6B.光感受器細胞內節排列規則 醋酸鈾枸櫞酸鉛 ×15 000;6C.光感受器細胞外節排列整齊 醋酸鈾枸櫞酸鉛 ×15 000 圖 7 伏立康唑100 μg組兔視網膜透射電子顯微鏡像。7A.內核層細胞間連接緊密 醋酸鈾枸櫞酸鉛 ×5000;7B.光感受器細胞內節排列規則 醋酸鈾枸櫞酸鉛 ×15 000;7C.光感受器細胞外節排列整齊 醋酸鈾枸櫞酸鉛 ×15 000 圖 8 伏立康唑200 μg組兔視網膜透射電子顯微鏡像。8A.內核層細胞輕度腫脹,膜間或胞膜內可見少量髓磷體結構(黑箭) 醋酸鈾枸櫞酸鉛 ×5000;8B.光感受器細胞內節細胞間隙擴張,水腫,稍有空泡變性,外膜之間有少量電子致密物沉積(黑箭) 醋酸鈾枸櫞酸鉛 ×15 000;8C.光感受器細胞外節部分膜盤粘連,外膜局灶性降解,部分形成大的環形層狀結構,其中央部位電子密度空白(黑箭) 醋酸鈾枸櫞酸鉛 ×15 000 圖 9 伏立康唑400 μg組兔視網膜透射電子顯微鏡像。9A. 內核層細胞結構破壞,胞膜溶解,細胞間隙出現大量空泡和髓磷體結構(黑箭),細胞內細胞器減少,線粒體中度腫脹,嵴減少且排列紊亂 醋酸鈾枸櫞酸鉛 ×5000;9B.光感受器細胞內節內節間隙擴大,水腫明顯,膜間或胞膜有較多的髓磷體結構存在(黑箭) 醋酸鈾枸櫞酸鉛 ×15 000;9C.光感受器細胞外節部分排列紊亂,膜盤疏松,盤間平行度較差,腫脹缺損(黑箭) 醋酸鈾枸櫞酸鉛 ×15 000
圖6
對照組兔視網膜透射電子顯微鏡像。6A.內核層細胞間連接緊密 醋酸鈾枸櫞酸鉛 ×5000;6B.光感受器細胞內節排列規則 醋酸鈾枸櫞酸鉛 ×15 000;6C.光感受器細胞外節排列整齊 醋酸鈾枸櫞酸鉛 ×15 000 圖 7 伏立康唑100 μg組兔視網膜透射電子顯微鏡像。7A.內核層細胞間連接緊密 醋酸鈾枸櫞酸鉛 ×5000;7B.光感受器細胞內節排列規則 醋酸鈾枸櫞酸鉛 ×15 000;7C.光感受器細胞外節排列整齊 醋酸鈾枸櫞酸鉛 ×15 000 圖 8 伏立康唑200 μg組兔視網膜透射電子顯微鏡像。8A.內核層細胞輕度腫脹,膜間或胞膜內可見少量髓磷體結構(黑箭) 醋酸鈾枸櫞酸鉛 ×5000;8B.光感受器細胞內節細胞間隙擴張,水腫,稍有空泡變性,外膜之間有少量電子致密物沉積(黑箭) 醋酸鈾枸櫞酸鉛 ×15 000;8C.光感受器細胞外節部分膜盤粘連,外膜局灶性降解,部分形成大的環形層狀結構,其中央部位電子密度空白(黑箭) 醋酸鈾枸櫞酸鉛 ×15 000 圖 9 伏立康唑400 μg組兔視網膜透射電子顯微鏡像。9A. 內核層細胞結構破壞,胞膜溶解,細胞間隙出現大量空泡和髓磷體結構(黑箭),細胞內細胞器減少,線粒體中度腫脹,嵴減少且排列紊亂 醋酸鈾枸櫞酸鉛 ×5000;9B.光感受器細胞內節內節間隙擴大,水腫明顯,膜間或胞膜有較多的髓磷體結構存在(黑箭) 醋酸鈾枸櫞酸鉛 ×15 000;9C.光感受器細胞外節部分排列紊亂,膜盤疏松,盤間平行度較差,腫脹缺損(黑箭) 醋酸鈾枸櫞酸鉛 ×15 000
3 討論
伏立康唑玻璃體腔注射可成功治愈對常規治療無效的真菌性眼內炎[6, 7]。臨床應用伏立康唑玻璃體腔注射劑量一般為1000 μg/ml,療效顯著[1, 4, 7]。但很少有研究考察其對眼內組織的影響。雖然已有體外實驗證實伏立康唑質量濃度≤250 mg/L時,不會對視網膜色素上皮細胞及神經膠質細胞產生毒性[8];但由于眼內代謝等原因,體外實驗結果與體內實驗不能等同。本研究參考臨床常用劑量并結合預實驗結果,設計了50、100、200、400 μg共4種濃度,通過動物實驗來評估伏立康唑玻璃體腔單次給藥對兔眼內組織的安全性,探討其對角膜和視網膜的影響,推導合適的眼內用藥濃度,從而進一步擴展伏立康唑抗真菌性眼內炎的臨床應用。
本研究采用活體共聚焦顯微鏡進行角膜內皮細胞計數,并進行角膜厚度測量。雖然有研究顯示該儀器測量值較測量角膜厚度的金標準A型超聲偏小[9],但其誤差對各組實驗眼的影響是一致的。因此,它雖然可能影響單個角膜厚度的絕對數值,但是對各組之間統計學檢驗的結果并不會產生影響。本研究結果顯示,注藥前及注藥后各時間點,伏立康唑各濃度組與對照組兔眼角膜厚度及內皮細胞計數差異均無統計學意義。我們還通過光學顯微鏡和電子顯微鏡對角膜進行病理性觀察,發現伏立康唑各濃度組兔眼在玻璃體腔注射后角膜組織結構均未見損害。提示單次玻璃體腔注射伏立康唑400 μg以內對兔眼角膜形態沒有影響,但藥物隨房水流動到達前房,在角膜組織的藥物濃度及其是否對角膜功能產生影響有待進一步考察。
ERG是反映視網膜功能的有效指標,其b波起自光感受器與神經節細胞之間的神經通路,可能起源于Müller細胞或雙極細胞,反映視網膜內核層區域細胞的電活動,所以b波振幅變化能靈敏、可靠的客觀判 斷視網膜功能。因此,本研究選用此指標評價玻璃體腔注射伏立康唑對視網膜的毒副作用。結果顯示,伏立康唑 200 μg組 Max-Rb波振幅值于注藥后7 d變化明顯,之后又回升,但與對照組之間的差異不明顯;伏立康唑 400 μg 組Max-R b波振幅值于注藥后7、14 d明顯下降,與對照組之間具有明顯差異。說明200 μg伏立康唑可造成視網膜功能的一過性損害,但這種損害是可恢復的,至觀察期末恢復至注藥前水平。但當劑量達400 μg時,其對兔視網膜的損害是不可逆的。提示伏立康唑對光感受器及視網膜內核層有一定作用,這與視網膜組織學檢查結果相吻合。我們還發現,注藥后14 d伏立康唑200 μg組雖然ERG及光學顯微鏡檢查無異常,但通過透射電子顯微鏡可見視網膜內核層細胞輕度腫脹,膜間或胞膜內有少量髓磷體結構,光感受器細胞內節細胞間隙擴張,水腫,稍有空泡變性,外節部分膜盤粘連,外膜局灶性降解。因此在研究視網膜毒性時,我們認為透射電子顯微鏡較視覺電生理檢查更為敏感,與文獻報道結果一致[10]。伏立康唑 400 μg組于透射電子顯微鏡下可見內核層細胞結構破壞,出現大量空泡,光感受器細胞內節明顯水腫,外節排列紊亂,膜盤疏松,腫脹缺損。這也解釋了該濃度組兔視網膜在光學顯微鏡下內核層空泡樣變性、變薄,光感受器細胞變性,排列紊亂的原因。
本研究結果表明,玻璃體腔注射濃度100 μg以內的伏立康唑對兔眼角膜和視網膜組織形態及功能均無損害。由于人眼玻璃體腔容積約為兔眼的 2~3 倍,假設人眼與兔眼視網膜毒性閥值相當,人眼玻璃體腔注射100 μg的伏立康唑應該更安全。研究顯示,伏立康唑的最低抑菌濃度(MIC90)值為0.5~5.0 μg/ml[11]。按兔眼玻璃體腔容積約1.2~1.5 ml估算,伏立康唑此劑量給藥后玻璃體腔藥物峰值濃度約為 66.7~83.3 μg/ml,大大超過了該藥對各種常見致病菌的MIC90值。即使按人眼玻璃體腔容積4.0 ml估算,以此劑量注射后的藥物濃度也遠遠超過該藥的MIC90值。作為新一代的抗真菌藥物,伏立康唑治療真菌性眼內炎已顯示出一定的優越性,本研究結果可進一步為最大限度減少伏立康唑眼內用藥可能引起的不良反應提供參考。有關該藥玻璃體腔注射眼內藥代動力學有待今后繼續關注,以進一步證實其眼內用藥安全性及療效。