引用本文: 曹博雯, 孟旭霞, 周賢慧, 付浴東, 胡迭, 郭慶敏. 軸突導向因子netrin-1對早期糖尿病大鼠膠質細胞活化的影響. 中華眼底病雜志, 2016, 32(2): 197-199. doi: 10.3760/cma.j.issn.1005-1015.2016.02.019 復制
正常生理情況下,膠質細胞對視網膜起支撐、營養作用,膠質細胞終板還參與血視網膜屏障(BRB)的構成[1]。研究表明,膠質細胞活化和功能障礙是糖尿病視網膜病變(DR)BRB受損的關鍵因素[2, 3];其活化改變的發生早于微血管病變[4],是早期DR神經改變的重要表現[5]。在DR早期,干預膠質細胞活化及神經元變性和微血管異常對阻止DR進展有重要意義[5]。軸突導向因子netrin-1是一種分泌蛋白[6],在神經發育及細胞遷移中發揮雙重導向功能,同時對血管生成也發揮重要作用[7]。我們前期研究結果證實,netrin-1對糖尿病(DM)大鼠BRB有保護作用[8],但其機制是否為影響膠質細胞活化尚不清楚。 為此,我們進一步觀察了外源性netrin-1玻璃體腔注射后DM大鼠視網膜膠質細胞活化的改變情況。現將結果報道如下。
1 材料和方法
健康雄性Sprague-Dawley大鼠49只,體重約200 g,清潔級,青島市動物中心提供。實驗遵循國家科學技術委員會發布的《實驗動物管理條例》。 隨機數字表法將大鼠分為正常對照組(A組)、DM組,分別為10、39只大鼠。DM組大鼠按60 mg/kg 劑量鏈脲佐菌素(STZ)誘導DM動物模型。48 h后血糖≥16.5 mmol/L為DM造模成功,繼續高糖高脂飼養3個月,剔除死亡或血糖恢復大鼠,最終DM組30只大鼠納入研究。采用隨機數字表法將DM組大鼠再分為DM組(B組)、DM+平衡鹽溶液(BSS)組(C組)、DM+netrin-1組(D組),每組均為10只大鼠。DM 3個月時,D組大鼠玻璃體腔注射100 μg/ml的外源性netrin-1 2 μl;C組大鼠玻璃體腔注射等體積BSS;A組、 B組大鼠不做任何處理。繼續飼養1個月即DM 4個月時進行后續實驗。
免疫組織化學法檢測視網膜中膠質原纖維酸性蛋白(GFAP)的表達。大鼠過量麻醉處死后迅速摘除眼球,4%多聚甲醛固定24 h,常規脫水,石蠟包埋,作5 μm厚度的連續切片。石蠟切片常規脫蠟和水化后,抗原修復,5%山羊血清封閉,一抗兔抗GFAP(1:80),二抗羊抗兔IgG-Cy3(1:200),3,3′-二氨基聯苯胺(DAB)顯色,蘇木精復染,封片,光學顯微鏡下觀察。以血管內皮細胞膜呈棕黃色為陽性表達。以平均積分吸光度[A,舊稱光密度(OD)](IA)值表示視網膜中GFAP的表達量。Image pro plus 6.0軟件進行圖像分析。
熒光定量聚合酶鏈反應(RT-PCR)檢測視網膜中GFAP mRNA表達。大鼠過量麻醉處死,每50~100 mg視網膜加1 ml RNAiso plus,裂解視網膜組織;提取視網膜總RNA,DNase試劑盒去除RNA內殘留DNA,逆轉錄成eDNA,從Pubmed的GeneBank檢索GFAP mRNA序列,上游基因:5′-TGCTAGGCCCAATTCCCATC-3′; 下游基因:5′TCCATG AGACTCCGCACTGAC-3′;擴增片段大小85堿基對(bp)。以β-肌動蛋白(actin)基因作為內參,β-actin上游引物序列:5′-TG GCACCCAGCACAATGAA-3′;下游引物序列:5′-CTAAGTC ATAGTCCGCCTAGAAGCA-3′。退火溫度為60℃,40個循環后形成擴增曲線,記錄熒光值到達閾值時所經歷的循環數,即Ct值。正常對照組大鼠視網膜GFAP mRNA表達量設為1。
采用SPSS 17.0統計軟件進行統計學分析處理。定量資料結果以均數±標準差(
2 結果
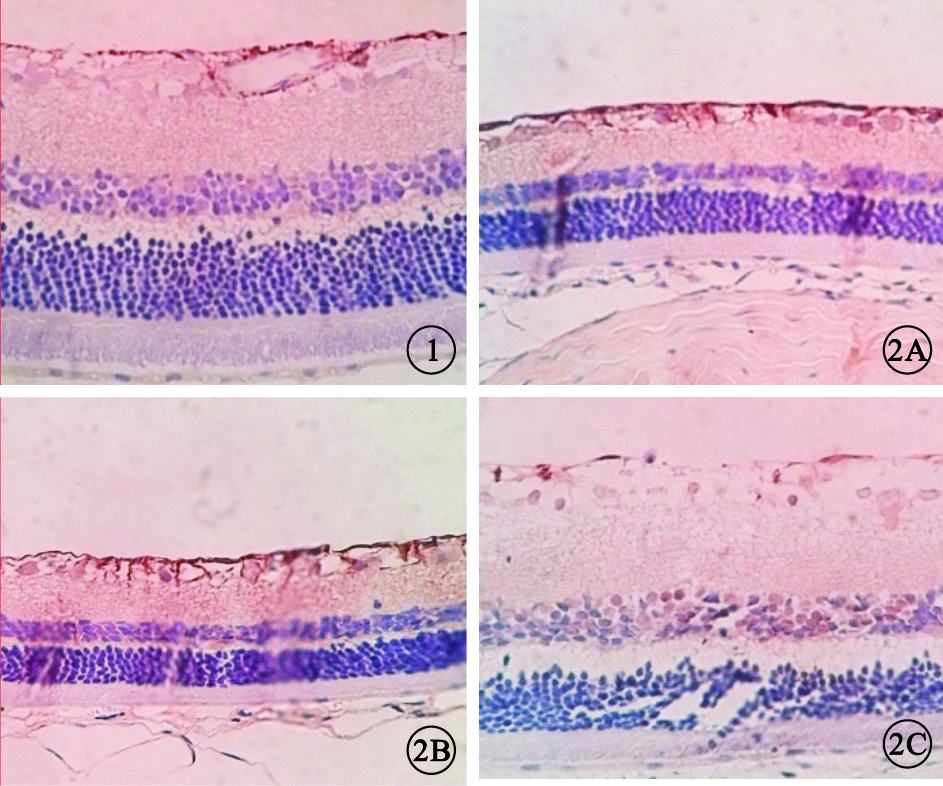
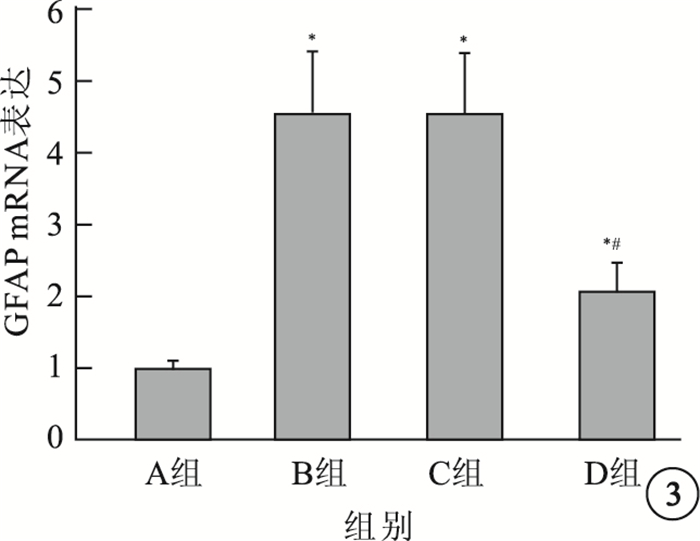
A組大鼠視網膜GFAP陽性表達主要見于視網膜神經節細胞層(GCL)及視網膜神經纖維層(RNFL),呈棕黃色顆粒著染,色淡(圖 1);B組、C組大鼠視網膜GFAP陽性表達范圍擴大,接近全層,RNFL、GCL棕黃色顆粒著染加深(圖 2A,2B);D組大鼠視網膜GFAP陽性表達范圍較B組、C組小,顏色變淡,但仍較A組范圍大(圖 2C)。A組、B組、C組、D組大鼠視 網膜IA值分別為0.95±0.02、4.52±1.21、4.53 ± 1.19、1.56±0.53。A組大鼠視網膜IA值與B組、C組、D組大鼠視網膜IA值比較,差異均有統計學意義(t=9.419、9.595、0.257,P<0.05);D組大鼠視網膜IA值與B組、C組大鼠視網膜IA值比 較,差異有統計學意義(t=7.425、7.048,P<0.05);B組、C組大鼠視網膜IA值比較,差異無統計學意義(t=0.018,P>0.01)。
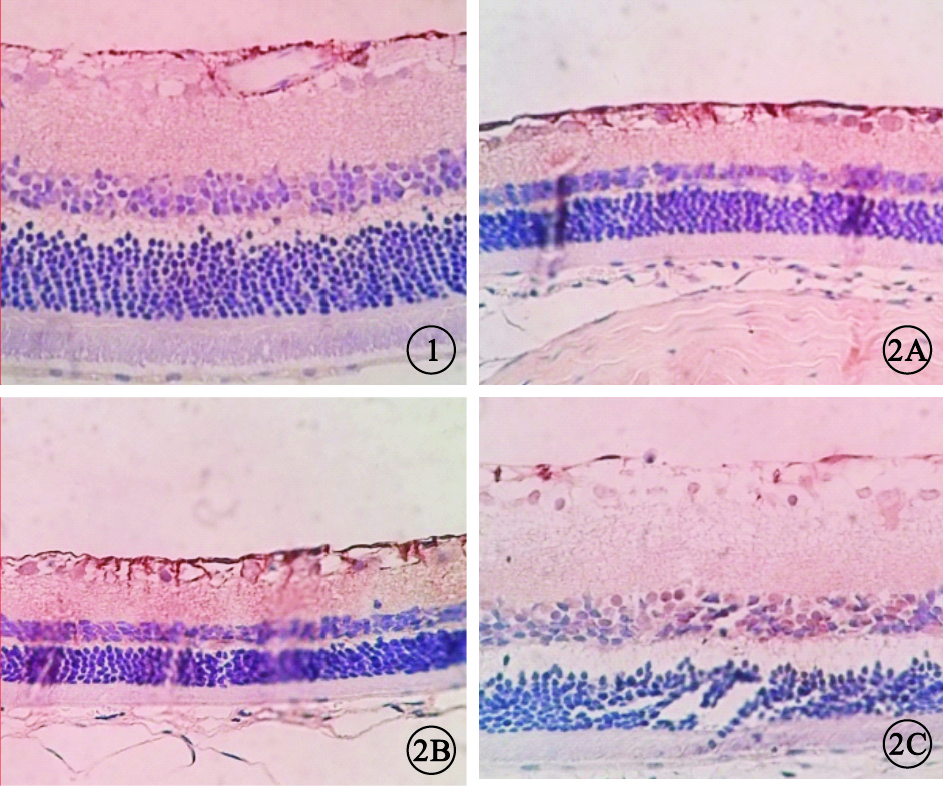 圖1
A組大鼠視網膜免疫組織化學染色像。視網膜棕黃色顆粒主要集中于RNFL、GCL DAB ×40 圖 2B組、C組、D組大鼠視網膜免疫組織化學染色像。2A~2C.分別為B組、C組、D組。B組、C組大鼠視網膜棕黃色顆粒染色范圍增加,RNFL、GCL棕黃色染色加深;D組大鼠視網膜棕黃色染色范圍較B組、C組大鼠明顯減小,染色變淡 DAB ×40
圖1
A組大鼠視網膜免疫組織化學染色像。視網膜棕黃色顆粒主要集中于RNFL、GCL DAB ×40 圖 2B組、C組、D組大鼠視網膜免疫組織化學染色像。2A~2C.分別為B組、C組、D組。B組、C組大鼠視網膜棕黃色顆粒染色范圍增加,RNFL、GCL棕黃色染色加深;D組大鼠視網膜棕黃色染色范圍較B組、C組大鼠明顯減小,染色變淡 DAB ×40
RT-PCR檢測結果顯示,與A組大鼠視網膜中GFAP mRNA表達比較,其余各組大鼠視網膜中GFAP mRNA表達均增加,差異有統計學意義(P<0.05)(圖 3)。D組大鼠視網膜中GFAP mRNA表達與B組、C組大鼠視網膜GFAP mRNA表達比較,差異均有統計學意義(t=1.108、1.111,P<0.05)。 B組、C組大鼠視網膜中GFAP mRNA表達比較,差異無統計學意義(t=0.0714,P>0.01)。
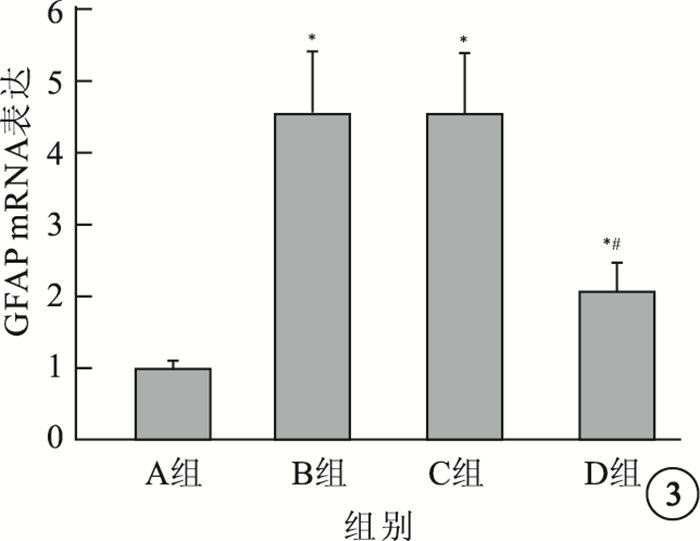 圖3
各組大鼠視網膜中GFAP mRNA表達比較。*與A組比較;#與B組、C組比較,P<0.05
圖3
各組大鼠視網膜中GFAP mRNA表達比較。*與A組比較;#與B組、C組比較,P<0.05
3 討論
既往認為,早期DR主要臨床特征是BRB破壞和微血管瘤的出現。隨著對DR發病機制研究的不斷深入,發現DM患者在出現血管病變之前已經出現視網膜神經元變性[9]。膠質細胞活化是神經元退行性變的重要組成部分。膠質細胞參與視網膜構成,對視網膜起到支撐和營養作用,同時膠質細胞終板也參與內層BRB的構成[1],與內皮細胞、緊密連接蛋白一起維持BRB的完整和穩定。
Netrin-1是從胚胎雞腦組織中提取的一種相對分子質量為78×103的分泌型蛋白質[10]。由底板細胞分泌,是一種吸引聯絡神經元到脊髓底板的可擴散因子,在多器官系統的發育廣泛表達并發揮作用[11] 。在脊髓損傷模型中,netrin-1在病灶部位的巨噬細胞、活化的小膠質細胞或成纖維細胞等顯著表達,并可持續數月之久,被認為可能通過參與膠質瘢痕形成而抑制損傷后軸突再生[12]。然而,關于外源性netrin-1在DR膠質細胞活化中的作用鮮有報道。
本研究通過對大鼠視網膜神經膠質細胞特異性標志物GFAP變化作為netrin-1的評判標準。結果顯示,A組大鼠無Müller細胞活化,GFAP僅在星形膠質細胞中表達,主要集中在GCL及RNFL;而B組大鼠膠質細胞出現活化,GFAP表達量增加,免疫組織化學染色表現為棕黃色物質顏色加深,染色范圍擴大。Masser等[13]也觀察到在血糖不受控制后的1~3個月糖尿病患者的膠質細胞中GFAP含量顯著增加。而D組大鼠視網膜棕黃色染色較B組大鼠色淡,染色范圍減小;RT-PCR檢測結果也顯示D組視網膜中GFAP mRNA表達量較B組、C組大鼠減少,但仍較A組大鼠表達增多。說明netrin-1 對視網膜膠質細胞的活化具有一定的抑制作用,但不能完全逆轉DR進展。
根據預實驗結果,我們選取100 μg/ml濃度的外源性netrin-1對DM大鼠進行干預。結果顯示外源性netrin-1對DR進展起到一定抑制作用,但不能完全逆轉DR進展,可能與我們所選濃度單一、用藥時間較短有關;高玉等[14]發現STZ誘導的DM大鼠在病程10周時即已出現類似人類早期背景型DR的相關形態學改變,為本研究的干預時機提供了更為確切的依據。
隨著DM進展,膠質細胞活化增多,當注入外源性netrin-1后,D組大鼠視網膜中GFAP表達量、GFAP mRNA含量均較B組大鼠明顯減少,說明netrin-1對DM大鼠早期視網膜神經膠質細胞活化具有抑制作用,且該作用發生在血管病變之前。前期研究表明,netrin-1對BRB 具有保護作用,且在一定程度呈劑量依賴性。膠質細胞終板參與BRB構成,且膠質細胞釋放血管內皮生長因子(VEGF),活化后的膠質細胞產生更多的VEGF,并且呈時間依賴性[15]。Netrin-1也許通過抑制膠質細胞活化來減少VEGF生成,從而抑制BRB通透性增加所致的后續并發癥。但需進一步研究加以驗證。
正常生理情況下,膠質細胞對視網膜起支撐、營養作用,膠質細胞終板還參與血視網膜屏障(BRB)的構成[1]。研究表明,膠質細胞活化和功能障礙是糖尿病視網膜病變(DR)BRB受損的關鍵因素[2, 3];其活化改變的發生早于微血管病變[4],是早期DR神經改變的重要表現[5]。在DR早期,干預膠質細胞活化及神經元變性和微血管異常對阻止DR進展有重要意義[5]。軸突導向因子netrin-1是一種分泌蛋白[6],在神經發育及細胞遷移中發揮雙重導向功能,同時對血管生成也發揮重要作用[7]。我們前期研究結果證實,netrin-1對糖尿病(DM)大鼠BRB有保護作用[8],但其機制是否為影響膠質細胞活化尚不清楚。 為此,我們進一步觀察了外源性netrin-1玻璃體腔注射后DM大鼠視網膜膠質細胞活化的改變情況。現將結果報道如下。
1 材料和方法
健康雄性Sprague-Dawley大鼠49只,體重約200 g,清潔級,青島市動物中心提供。實驗遵循國家科學技術委員會發布的《實驗動物管理條例》。 隨機數字表法將大鼠分為正常對照組(A組)、DM組,分別為10、39只大鼠。DM組大鼠按60 mg/kg 劑量鏈脲佐菌素(STZ)誘導DM動物模型。48 h后血糖≥16.5 mmol/L為DM造模成功,繼續高糖高脂飼養3個月,剔除死亡或血糖恢復大鼠,最終DM組30只大鼠納入研究。采用隨機數字表法將DM組大鼠再分為DM組(B組)、DM+平衡鹽溶液(BSS)組(C組)、DM+netrin-1組(D組),每組均為10只大鼠。DM 3個月時,D組大鼠玻璃體腔注射100 μg/ml的外源性netrin-1 2 μl;C組大鼠玻璃體腔注射等體積BSS;A組、 B組大鼠不做任何處理。繼續飼養1個月即DM 4個月時進行后續實驗。
免疫組織化學法檢測視網膜中膠質原纖維酸性蛋白(GFAP)的表達。大鼠過量麻醉處死后迅速摘除眼球,4%多聚甲醛固定24 h,常規脫水,石蠟包埋,作5 μm厚度的連續切片。石蠟切片常規脫蠟和水化后,抗原修復,5%山羊血清封閉,一抗兔抗GFAP(1:80),二抗羊抗兔IgG-Cy3(1:200),3,3′-二氨基聯苯胺(DAB)顯色,蘇木精復染,封片,光學顯微鏡下觀察。以血管內皮細胞膜呈棕黃色為陽性表達。以平均積分吸光度[A,舊稱光密度(OD)](IA)值表示視網膜中GFAP的表達量。Image pro plus 6.0軟件進行圖像分析。
熒光定量聚合酶鏈反應(RT-PCR)檢測視網膜中GFAP mRNA表達。大鼠過量麻醉處死,每50~100 mg視網膜加1 ml RNAiso plus,裂解視網膜組織;提取視網膜總RNA,DNase試劑盒去除RNA內殘留DNA,逆轉錄成eDNA,從Pubmed的GeneBank檢索GFAP mRNA序列,上游基因:5′-TGCTAGGCCCAATTCCCATC-3′; 下游基因:5′TCCATG AGACTCCGCACTGAC-3′;擴增片段大小85堿基對(bp)。以β-肌動蛋白(actin)基因作為內參,β-actin上游引物序列:5′-TG GCACCCAGCACAATGAA-3′;下游引物序列:5′-CTAAGTC ATAGTCCGCCTAGAAGCA-3′。退火溫度為60℃,40個循環后形成擴增曲線,記錄熒光值到達閾值時所經歷的循環數,即Ct值。正常對照組大鼠視網膜GFAP mRNA表達量設為1。
采用SPSS 17.0統計軟件進行統計學分析處理。定量資料結果以均數±標準差(
2 結果
A組大鼠視網膜GFAP陽性表達主要見于視網膜神經節細胞層(GCL)及視網膜神經纖維層(RNFL),呈棕黃色顆粒著染,色淡(圖 1);B組、C組大鼠視網膜GFAP陽性表達范圍擴大,接近全層,RNFL、GCL棕黃色顆粒著染加深(圖 2A,2B);D組大鼠視網膜GFAP陽性表達范圍較B組、C組小,顏色變淡,但仍較A組范圍大(圖 2C)。A組、B組、C組、D組大鼠視 網膜IA值分別為0.95±0.02、4.52±1.21、4.53 ± 1.19、1.56±0.53。A組大鼠視網膜IA值與B組、C組、D組大鼠視網膜IA值比較,差異均有統計學意義(t=9.419、9.595、0.257,P<0.05);D組大鼠視網膜IA值與B組、C組大鼠視網膜IA值比 較,差異有統計學意義(t=7.425、7.048,P<0.05);B組、C組大鼠視網膜IA值比較,差異無統計學意義(t=0.018,P>0.01)。
 圖1
A組大鼠視網膜免疫組織化學染色像。視網膜棕黃色顆粒主要集中于RNFL、GCL DAB ×40 圖 2B組、C組、D組大鼠視網膜免疫組織化學染色像。2A~2C.分別為B組、C組、D組。B組、C組大鼠視網膜棕黃色顆粒染色范圍增加,RNFL、GCL棕黃色染色加深;D組大鼠視網膜棕黃色染色范圍較B組、C組大鼠明顯減小,染色變淡 DAB ×40
圖1
A組大鼠視網膜免疫組織化學染色像。視網膜棕黃色顆粒主要集中于RNFL、GCL DAB ×40 圖 2B組、C組、D組大鼠視網膜免疫組織化學染色像。2A~2C.分別為B組、C組、D組。B組、C組大鼠視網膜棕黃色顆粒染色范圍增加,RNFL、GCL棕黃色染色加深;D組大鼠視網膜棕黃色染色范圍較B組、C組大鼠明顯減小,染色變淡 DAB ×40
RT-PCR檢測結果顯示,與A組大鼠視網膜中GFAP mRNA表達比較,其余各組大鼠視網膜中GFAP mRNA表達均增加,差異有統計學意義(P<0.05)(圖 3)。D組大鼠視網膜中GFAP mRNA表達與B組、C組大鼠視網膜GFAP mRNA表達比較,差異均有統計學意義(t=1.108、1.111,P<0.05)。 B組、C組大鼠視網膜中GFAP mRNA表達比較,差異無統計學意義(t=0.0714,P>0.01)。
 圖3
各組大鼠視網膜中GFAP mRNA表達比較。*與A組比較;#與B組、C組比較,P<0.05
圖3
各組大鼠視網膜中GFAP mRNA表達比較。*與A組比較;#與B組、C組比較,P<0.05
3 討論
既往認為,早期DR主要臨床特征是BRB破壞和微血管瘤的出現。隨著對DR發病機制研究的不斷深入,發現DM患者在出現血管病變之前已經出現視網膜神經元變性[9]。膠質細胞活化是神經元退行性變的重要組成部分。膠質細胞參與視網膜構成,對視網膜起到支撐和營養作用,同時膠質細胞終板也參與內層BRB的構成[1],與內皮細胞、緊密連接蛋白一起維持BRB的完整和穩定。
Netrin-1是從胚胎雞腦組織中提取的一種相對分子質量為78×103的分泌型蛋白質[10]。由底板細胞分泌,是一種吸引聯絡神經元到脊髓底板的可擴散因子,在多器官系統的發育廣泛表達并發揮作用[11] 。在脊髓損傷模型中,netrin-1在病灶部位的巨噬細胞、活化的小膠質細胞或成纖維細胞等顯著表達,并可持續數月之久,被認為可能通過參與膠質瘢痕形成而抑制損傷后軸突再生[12]。然而,關于外源性netrin-1在DR膠質細胞活化中的作用鮮有報道。
本研究通過對大鼠視網膜神經膠質細胞特異性標志物GFAP變化作為netrin-1的評判標準。結果顯示,A組大鼠無Müller細胞活化,GFAP僅在星形膠質細胞中表達,主要集中在GCL及RNFL;而B組大鼠膠質細胞出現活化,GFAP表達量增加,免疫組織化學染色表現為棕黃色物質顏色加深,染色范圍擴大。Masser等[13]也觀察到在血糖不受控制后的1~3個月糖尿病患者的膠質細胞中GFAP含量顯著增加。而D組大鼠視網膜棕黃色染色較B組大鼠色淡,染色范圍減小;RT-PCR檢測結果也顯示D組視網膜中GFAP mRNA表達量較B組、C組大鼠減少,但仍較A組大鼠表達增多。說明netrin-1 對視網膜膠質細胞的活化具有一定的抑制作用,但不能完全逆轉DR進展。
根據預實驗結果,我們選取100 μg/ml濃度的外源性netrin-1對DM大鼠進行干預。結果顯示外源性netrin-1對DR進展起到一定抑制作用,但不能完全逆轉DR進展,可能與我們所選濃度單一、用藥時間較短有關;高玉等[14]發現STZ誘導的DM大鼠在病程10周時即已出現類似人類早期背景型DR的相關形態學改變,為本研究的干預時機提供了更為確切的依據。
隨著DM進展,膠質細胞活化增多,當注入外源性netrin-1后,D組大鼠視網膜中GFAP表達量、GFAP mRNA含量均較B組大鼠明顯減少,說明netrin-1對DM大鼠早期視網膜神經膠質細胞活化具有抑制作用,且該作用發生在血管病變之前。前期研究表明,netrin-1對BRB 具有保護作用,且在一定程度呈劑量依賴性。膠質細胞終板參與BRB構成,且膠質細胞釋放血管內皮生長因子(VEGF),活化后的膠質細胞產生更多的VEGF,并且呈時間依賴性[15]。Netrin-1也許通過抑制膠質細胞活化來減少VEGF生成,從而抑制BRB通透性增加所致的后續并發癥。但需進一步研究加以驗證。