引用本文: 馮宇梁, 張明, 王春明, 李佳, 旦巧榮. IBI302對實驗性脈絡膜新生血管的干預作用及機制研究. 中華眼底病雜志, 2016, 32(2): 177-183. doi: 10.3760/cma.j.issn.1005-1015.2016.02.015 復制
玻璃體腔注射抗血管內皮生長因子(VEGF)藥物是目前治療滲出型老年性黃斑變性(AMD)的常用方法,但存在需反復注射、停藥后病變易復發,長期注射后視網膜出血、瘢痕形成以及接受治療眼遠期視力仍有下降可能等問題;此外,對萎縮型AMD無效[1-5]。研究發現,補體通路異常活化在AMD發生發展過程中具有重要作用,可能是導致抗VEGF藥物臨床不良后果的原因;因而成為AMD治療研究的又一熱點[6-10]。IBI302為重組人VEGF受體(VEGFR)-抗體-人補體受體1融合蛋白注射液,包含VEGF抑制結構域(VID)端、人IgG1的Fc段和補體抑制結構域(CID)端,一次給藥可同時抑制VEGF和補體兩個通路激活,起到聯合治療、減少眼內注射頻率的作用。為了進一步驗證探索IBI302對VEGF和補體通路的作用效果及其作用機制,本研究通過體外實驗觀察了IBI302對VEGF和補體生物活性的抑制作用,并通過與抗VEGF藥物貝伐珠單抗治療效果比較,觀察探討了IBI302對激光誘導的恒河猴脈絡膜新生血管(CNV)的干預作用及其機制。現將結果報道如下。
1 材料和方法
1.1 實驗材料
普通級恒河猴,生產許可證號SCXK(川) 2014-027(雅安普萊美生物科技有限公司)。IBI302(相對分子質量140 388.8 Da)、VID和CID[信達生物制藥(蘇州)有限公司];貝伐珠單抗注射液(羅氏制藥)。胎盤生長因子(PlGF)、VEGF-A165、VEGF-A121(美國R&D公司);C3b、C4b(南京肯特復合材料有限公司);人臍靜脈血管內皮細胞(HUVEC,美國模式菌種收集中心);HUVEC基礎培養基(美國Allcells公司);胎牛血清(美國Hyclone公司);細胞計數(CCK-8)顯色試劑盒(日本同仁化學研究所);96孔板、Transwell板、6孔板(美國Corning公司);抗VEGFR、磷酸化VEGFR(P-VEGFR)、細胞外信號調節激酶 (Erk)、磷酸化Erk(P-Erk)、絲蘇氨酸蛋白激酶(Akt)、磷酸化Akt(P-Akt)、磷酸甘油醛脫氫酶(GAPDH)抗體(美國Cell Signaling Technology公司);結晶紫染色液(上海碧云天生物技術研究所);聚偏氟乙烯(PVDF)膜、增強化學發光(ECL)試劑盒(美國Millipore公司);綿陽紅細胞、兔抗綿羊紅細胞血清(鄭州百基生物科技有限公司)。人血清補體(美國Sigma公司)。酶標儀、臺式冷凍離心機、CO2培養箱(美國Thermo公司);紫外分光光度計(日本島津公司);倒置顯微鏡(德國徠卡公司)。
1.2 IBI302與VEGF、補體家族細胞因子親和力試驗
酶聯免疫吸附測定法觀察IBI302與VEGF家族細胞因子和補體蛋白的親和力。碳酸鹽緩沖液溶解VEGF-A165、VEGF-A121、PlGF至終濃度0.5 μg/ml和C3b、C4b至終濃度2.5 μg/ml。取96孔板5塊板分別用于上述5種因子溶液,每板80孔加入一種因子溶液100 μl、另16孔加入磷酸鹽緩沖液(PBS),4℃條件下孵育過夜。然后用1%牛血清白蛋白溶液封閉1 h,棄去封閉液,每板已用的80孔加入IgG、VID、CID、IBI302溶液(每種10個不同濃度,每種每個濃度兩份復孔)各100 μl,4℃條件下孵育過夜。每孔用PBS洗滌3次,加入辣根過氧化物酶-羊抗人二抗孵育1 h,PBS洗滌后加入四甲基聯苯胺溶液顯色,用酶標儀測定450 nm波長下的吸光度[A,舊稱光密度(OD)]值。
1.3 IBI302對VEGF誘導HUVEC增生、遷移、管腔形成以及信號通路的影響
取對數生長期HUVEC調整細胞懸液密度為2×104個/ml,96孔板中每孔加入100 μl,用HUVEC基礎培養基在37℃、5% CO2培養箱中培養24 h。將濃度為35 nmol/L的IgG、IBI302、VID、CID與濃度為0.3 nmol/L的VEGF-A165預孵育30 min,再作用于HUVEC,在37℃、5% CO2條件下再培養24 h。加入10%的CCK-8溶液,37℃放置4 h。酶標儀450 nm波長下測定A值。取對數生長期HUVEC,以細胞密度3×106個/μl 懸于含1% 胎牛血清的HUVEC基礎培養基中并接種于Transwell板內室。將濃度為35 nmol/L的IgG、IBI302、VID、CID與濃度為0.3 nmol/L 的VEGF-A165預孵育30 min,加入Transwell外室。37℃孵育24 h后,棄孔中培養液乙醇固定細胞。棉簽擦去內室上層未遷移的細胞,結晶紫常溫染色,顯微鏡下觀察HUVEC遷移情況并拍照。取對數生長期HUVEC以細胞密度3×106個/μl 懸于含1% 胎牛血清的HUVEC基礎培養基中,加入濃度為350 nmol/L的IgG、IBI302、VID、CID,再加入濃度為0.3 nmol/L的VEGF-A165,混合均勻后接種于基質膠表面,在37℃、5% CO2條件下培養6 h后照相觀察。取對數生長期HUVEC以細胞密度5×105個/孔 接種于6孔板,37℃、5% CO2條件下培養24 h后加入3 nmol/L的IgG、IBI302、VID、CID,作用30 min后再加入0.3 nmol/L的VEGF-A165,作用10 min后收集細胞。細胞用十二烷基磺酸鈉(SDS)凝膠上樣緩沖液裂解,沸水浴中加熱解熱變性。取上清液進行SDS-聚丙烯酰胺凝膠電泳。電泳結束后濕轉系統將蛋白轉移至PVDF膜,將膜置于一抗溶液中溫育。用洗膜緩沖液洗滌。將膜置于二抗溶液中室溫反應2 h,洗膜緩沖液洗滌3次后,ECL試劑發色顯影。
1.4 IBI302對補體經典途徑、補體旁路途徑介導溶血的抑制作用
調整綿羊紅細胞密度至1×109個/ml與1:1000稀釋的兔抗綿羊紅細胞血清等體積混合。置37℃恒溫搖床180 r/min條件下震搖45 min后置于冰上45 min,致敏后用PBS洗滌并懸浮于PBS中,取0.5 ml細胞懸液加入7 ml超純水中,541 nm波長下測定A值并按公式1×109個/ml×A541/0.7計算致敏綿羊紅細胞密度。將0~500 nmol/L的IBI302、VID、CID加到96孔板中,每孔100 μl,以50 μl/孔加入10倍稀釋的補體置于37℃恒溫搖床,在180 r/min條件下震搖45 min。每孔以4×108個/ml細胞密度 加入致敏綿羊紅細胞50 μl,置于37℃恒溫搖床180 r/min 條件下震搖45 min。15℃溫度下以1000×g離心3 min,取上清液100 μl加到另一96孔板中,用酶標儀測量405 nm波長下A值。取兔紅細胞PBS洗滌至澄清后再重新懸浮,取0.5 ml細胞懸液加到7 ml超純水中,紫外分光計在541 nm波長測定A值并按公式1×109個/ml×A541/0.7計算紅細胞密度。將0~500 nmol/L的IBI302、VID、CID加到96孔板中,每孔100 μl,再以25 μl/孔加入補體置于37℃恒溫搖 床180 r/min條件下震搖45 min。每孔以3×108個/ml 細胞密度加入兔紅細胞50 μl,置于37℃恒溫搖床180 r/min條件下震搖45 min。15℃溫度下以1000×g 離心3 min,取上清液100 μl加到另一96孔板中,用酶標儀測量405 nm波長下A值。
1.5 IBI302對激光誘導恒河猴CNV的干預作用
恒河猴麻醉、散瞳,經全視網膜鏡行激光光凝。光斑直徑50 μm,能量0.6 W,曝光時間0.05 s,圍繞黃斑中心凹之外共9個點。以提示Bruch膜被擊破的氣泡產生為CNV模型建立成功。激光光凝前以及激光光凝后20d分別采用TOPCON眼底造影系統行眼底彩色照相、熒光素眼底血管造影(FFA)檢查。選擇雙眼造模成功的25只恒河猴分為模型對照組、貝伐珠單抗注射組以及IBI302 0.25、0.50、1.25 mg組,每組5只猴,雌雄兼有。激光光凝后21 d,模型對照組、貝伐珠單抗注射組恒河猴分別經玻璃體腔單次注射0.9%氯化鈉注射液或1.25 mg貝伐珠單抗注射液,每只眼注射50 μl;IBI302 0.25、0.50、1.25 mg組恒河猴經玻璃體腔單次注射相應濃度IBI302,每只眼注射50 μl。給藥后14、28 d行FFA,并采用海德堡光相干斷層掃描(OCT)儀行OCT檢查。觀察IBI302對激光誘導恒河猴CNV模型眼底熒光素滲漏面積及視網膜厚度的影響。其中,滲漏面積以TOPCON眼底造影系統自帶測量工具及計算軟件進行測量計算;視網膜厚度以海德堡OCT5.3版本軟件自帶測量工具直接測量而得。給藥后29 d,對比分析各組恒河猴房水中VEGF水平;同時對眼球標本蘇木精-伊紅(HE)及馬松三色染色,觀察IBI302對激光誘導恒河猴CNV模型眼組織病理學改變的影響。
1.6 統計學方法
SPSS 13.0統計軟件行統計學分析。單因素方差分析對數據行方差齊性檢驗。方差齊性時,組間比較采用Dunnet-T檢驗;方差不齊時,組間比較采用Dunnet-T3檢驗。P<0.05為差異有統計學意義。
2 結果
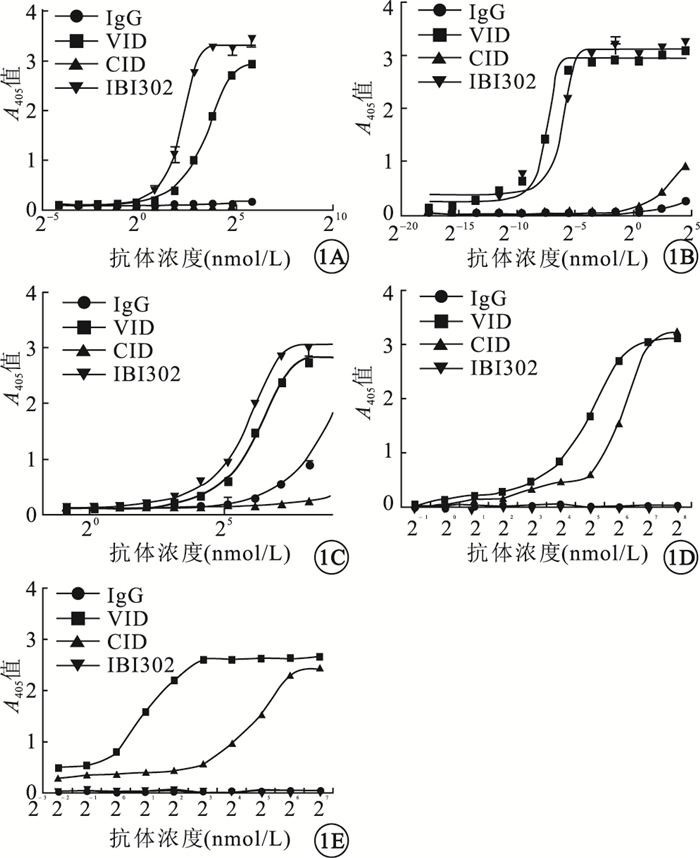
IBI302和VID對VEGF-A121和PlGF均有較強的親和性,且兩者親和力相當,差異無統計學意義(P>0.05)。IBI302和VEGF-A165有特異性高度親和,其親和力略低于VID,但差異無統計學意義(P>0.05)。IBI302和CID對C3b和C4b蛋白有一定的親和性;兩者對C3b的親和力相當,差異無統計學意義(P>0.05);IBI302對C4b的親和力明顯高于CID,差異有統計學意義(P<0.05)(圖 1)。
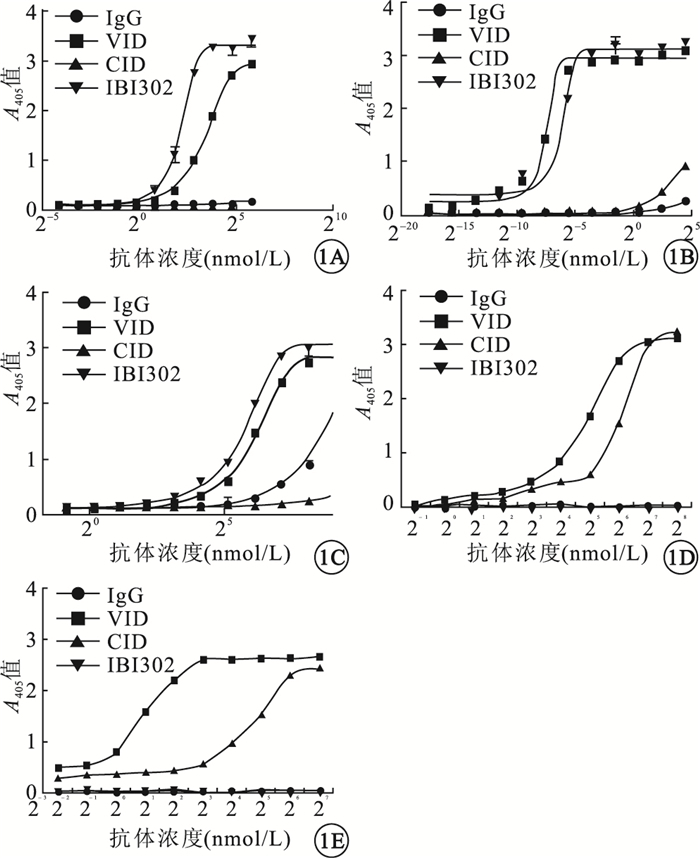 圖1
IBI302與VEGF家族蛋 白、補體家族蛋白的親和曲線。1A.VEGF-A121;1B.VEGF-A165;1C.PIGF;1D.C3b;1E.C4b
圖1
IBI302與VEGF家族蛋 白、補體家族蛋白的親和曲線。1A.VEGF-A121;1B.VEGF-A165;1C.PIGF;1D.C3b;1E.C4b
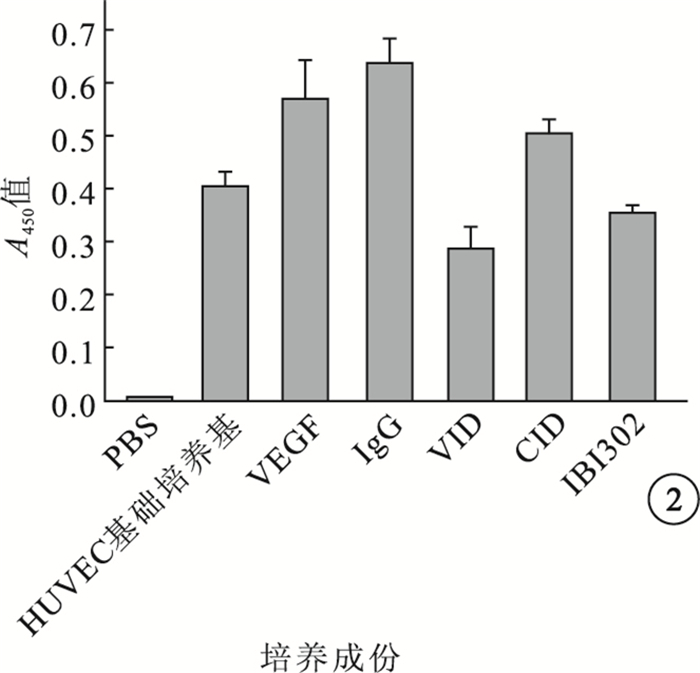
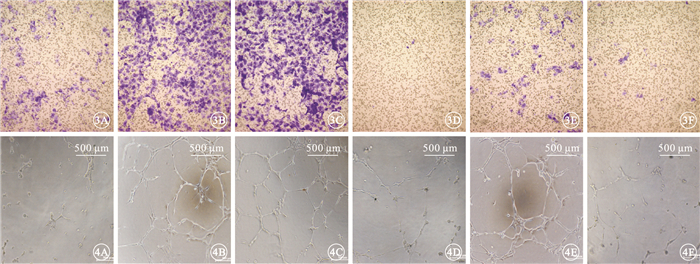
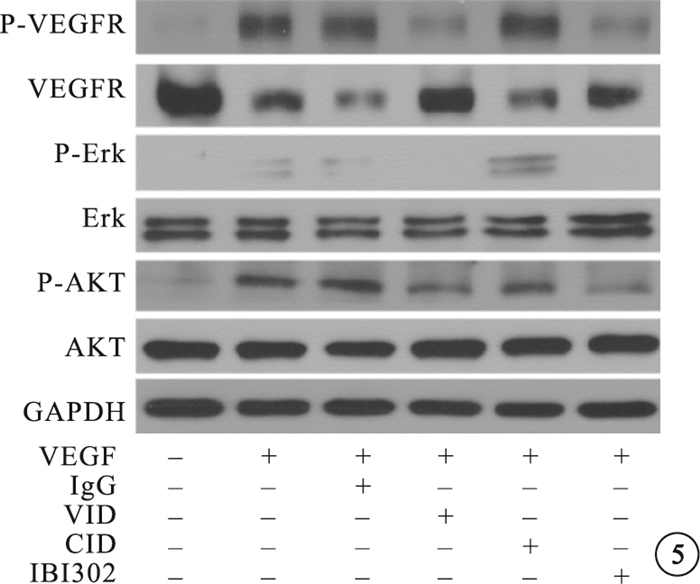
IBI302和VID均能明顯抑制VEGF誘導的HUVEC增生;兩者作用效果相當,差異無統計學意義(P>0.05)(圖 2)。IBI302、VID、CID對VEGF誘導的HUVEC遷移均具有明顯的抑制作用;IBI302和VID作用效果相當,差異無統計學意義(P>0.05);IBI302和VID的作用效果均明顯優于CID,差異有統計學意義(P<0.05)(圖 3)。IBI302和VID均能明顯抑制VEGF誘導的HUVEC管腔形成;兩者作用效果相當,差異無統計學意義(P>0.05)。CID對VEGF誘導的HUVEC管腔形成無明顯作用(圖 4)。IBI302和VID均可抑制VEGF誘導的HUVEC的VEGFR、Erk和Akt磷酸化,降低p-VEGFR、p-Erk、p-Akt與VEGFR、Erk、Akt的比值;兩者作用效果相當,差異無統計學意義(P>0.05)。CID對VEGF誘導的HUVEC信號通路無明顯影響(圖 5)。
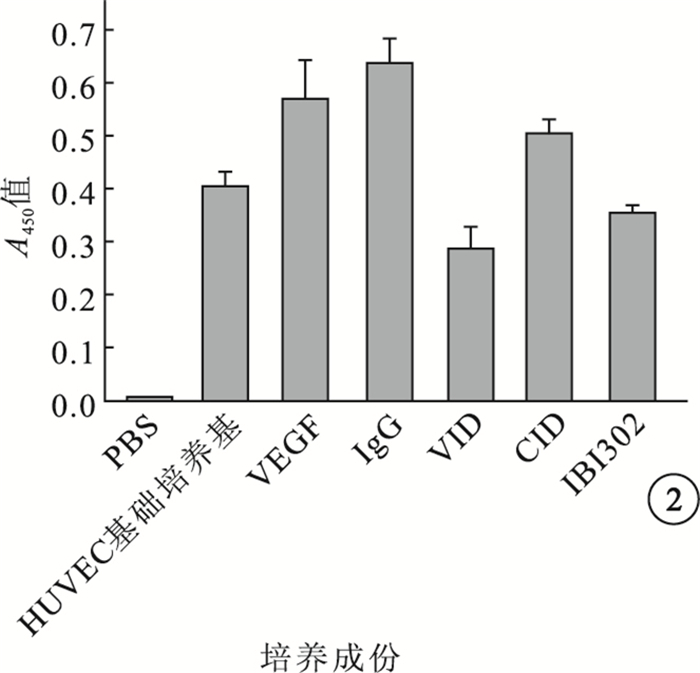 圖2
不同藥物對VEGF誘導HUVEC增生的抑制作用比較
圖2
不同藥物對VEGF誘導HUVEC增生的抑制作用比較
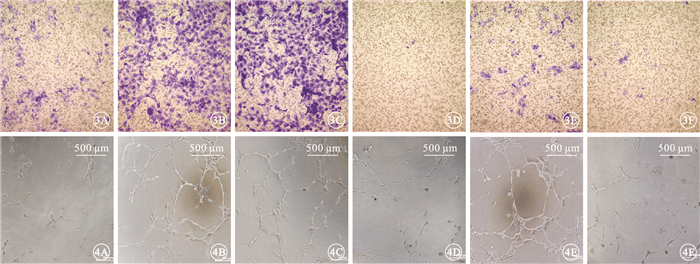 圖3
不同藥物抑制VEGF誘導HUVEC遷移染色像。3A.HUVEC基礎培養基;3B.VEGF;3C.IgG+VEGF;3D.VID+VEGF;3E.CID+VEGF;3F.IBI302+VEGF。可見經IBI302、VID、CID培養后,遷移的HUVEC明顯減少 結晶紫 ×20 圖 4 不同藥物抑制VEGF誘導HUVEC管腔形成實驗像。4A.HUVEC基礎培養基;4B.VEGF;4C.IgG+VEGF;4D.VID+VEGF;4E.CID+VEGF;4F.IBI302+VEGF。可見經IBI302、VID培養后,HUVEC管腔形成明顯減少 ×20
圖3
不同藥物抑制VEGF誘導HUVEC遷移染色像。3A.HUVEC基礎培養基;3B.VEGF;3C.IgG+VEGF;3D.VID+VEGF;3E.CID+VEGF;3F.IBI302+VEGF。可見經IBI302、VID、CID培養后,遷移的HUVEC明顯減少 結晶紫 ×20 圖 4 不同藥物抑制VEGF誘導HUVEC管腔形成實驗像。4A.HUVEC基礎培養基;4B.VEGF;4C.IgG+VEGF;4D.VID+VEGF;4E.CID+VEGF;4F.IBI302+VEGF。可見經IBI302、VID培養后,HUVEC管腔形成明顯減少 ×20
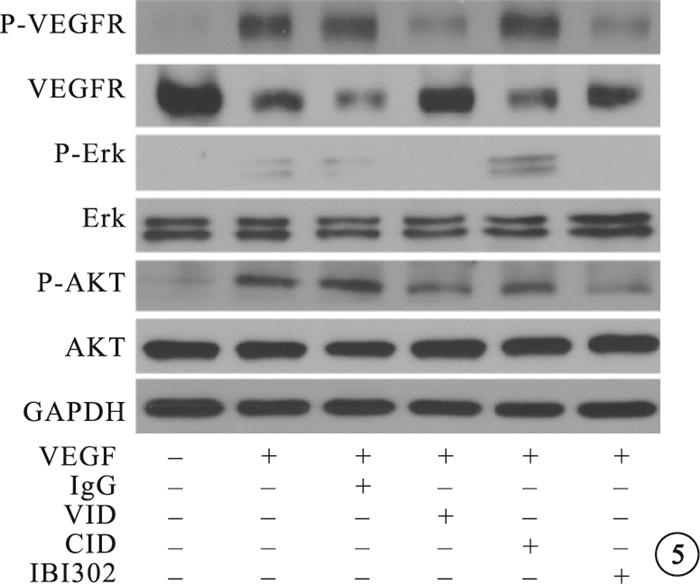 圖5
不同藥物阻斷VEGF誘導HUVEC信號通路電泳像
圖5
不同藥物阻斷VEGF誘導HUVEC信號通路電泳像
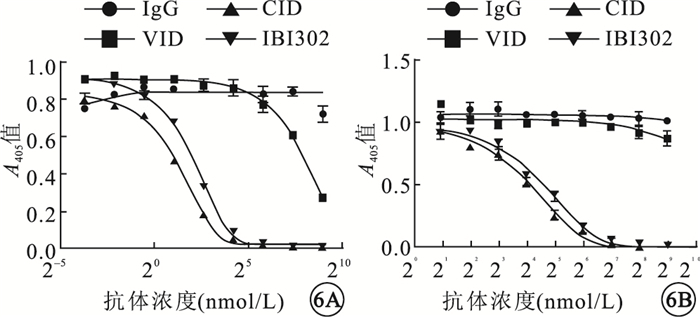
IBI302和CID均可抑制補體經典途徑介導的綿羊紅細胞溶血;兩者作用效果相當,差異無統計學意義(P>0.05)。VID對補體經典途徑介導的綿羊紅細胞溶血沒有影響。IBI302和CID均可抑制補體旁路途徑介導的兔紅細胞溶血;兩者作用效果相當,差異無統計學意義(P>0.05)。VID對補體旁路途徑介導的兔紅細胞溶血沒有影響(圖 6)。
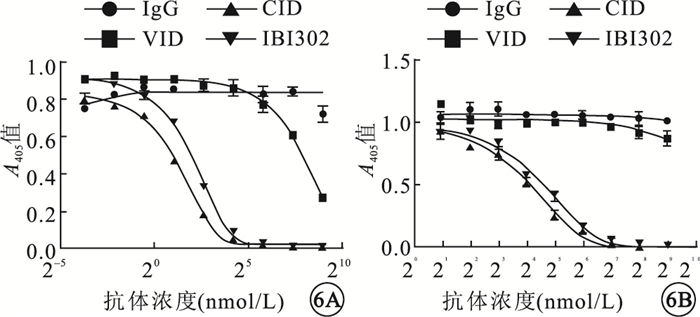 圖6
不同藥物對補體經典途徑和旁路途徑介導溶血的抑制作用比較
圖6
不同藥物對補體經典途徑和旁路途徑介導溶血的抑制作用比較
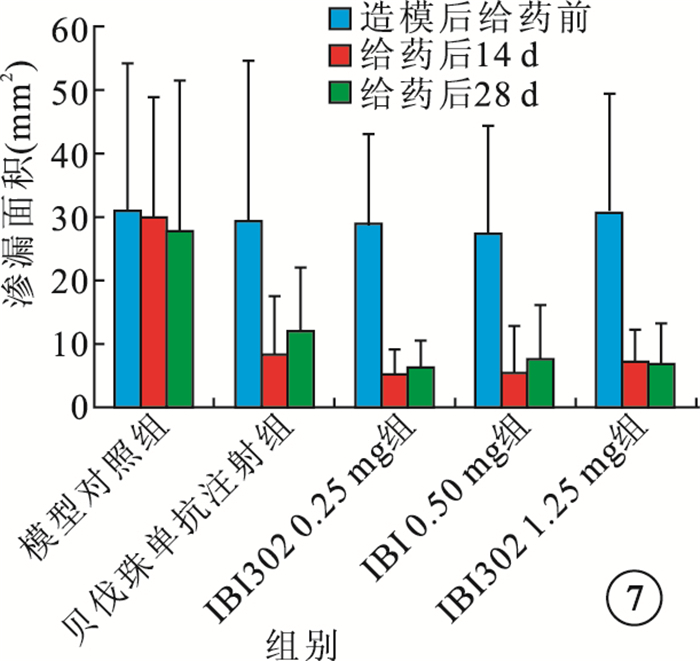
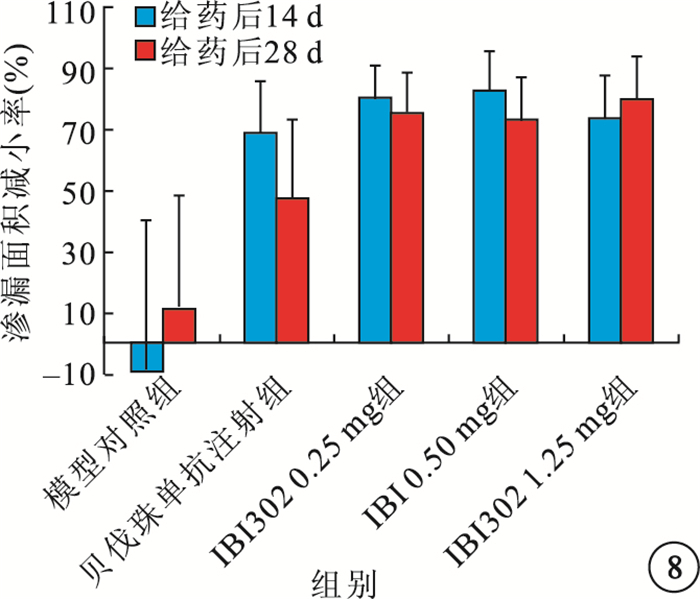
給藥后14、28 d,IBI302 0.25、0.50、1.25 mg組恒河猴眼底熒光斑及熒光素滲漏面積明顯減小;3組之間熒光素滲漏面積及滲漏面積減小率比較,差異無統計學意義(P>0.05)。貝伐珠單抗注射組恒河猴眼底 的熒光斑和熒光素滲漏面積也明顯減小,其熒光素滲漏面積減小率較IBI302各濃度組偏小,但差異無統計學意義(P>0.05)(圖 7,8)。
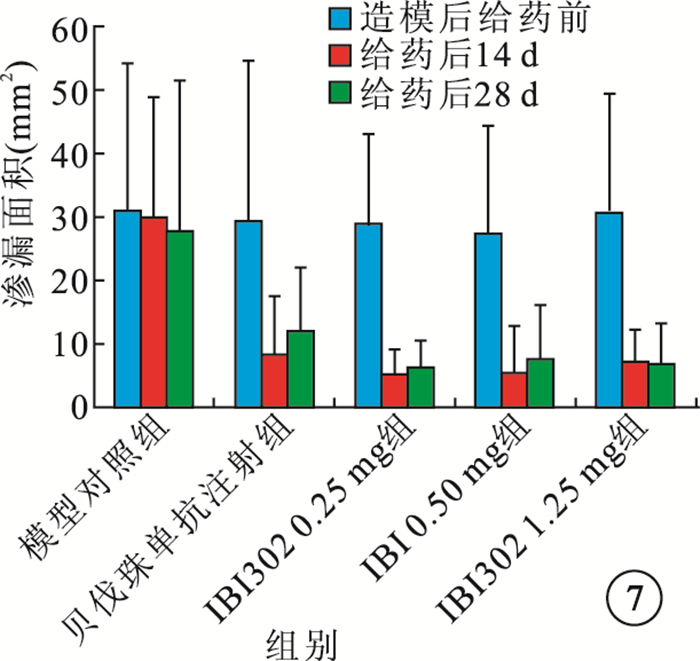 圖7
各組熒光素滲漏面積比較
圖7
各組熒光素滲漏面積比較
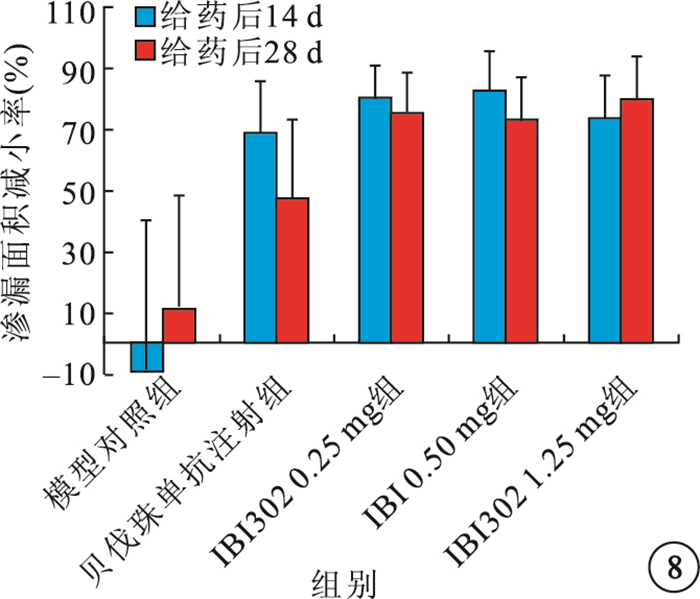 圖8
各組熒光素滲漏面積改善率比較
圖8
各組熒光素滲漏面積改善率比較
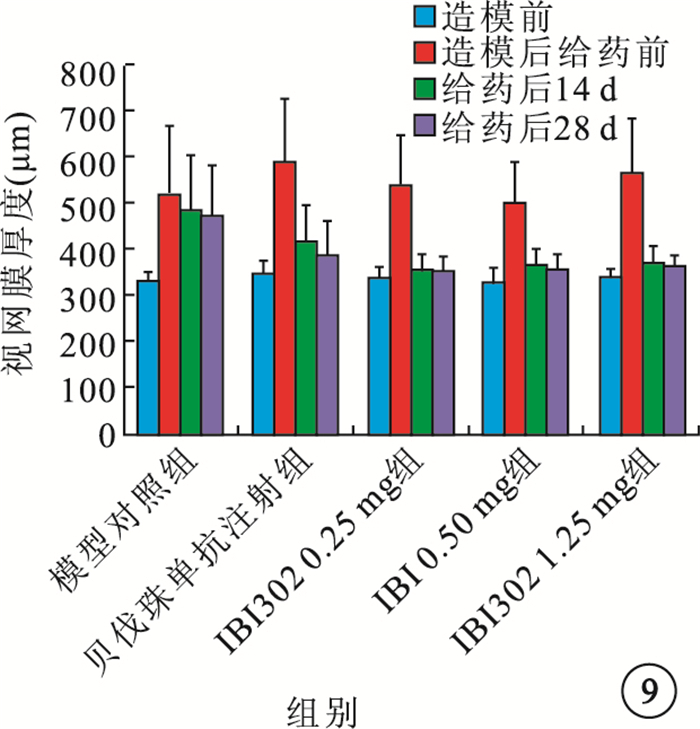
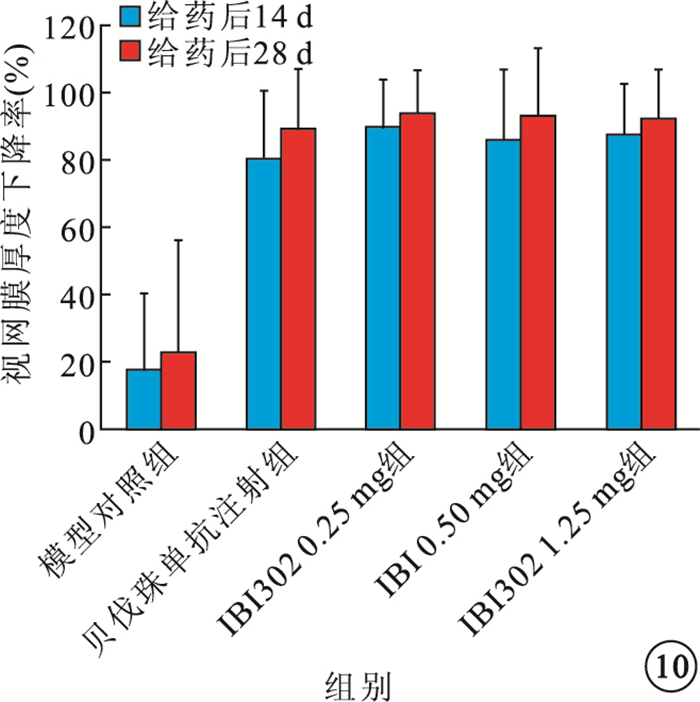
給藥后14、28 d,IBI302 0.25、0.50、1.25 mg組恒河猴視網膜厚度均明顯下降;3組之間視網膜厚度比較,差異無統計學意義(P>0.05)。貝伐珠單抗注射組恒河猴視網膜厚度也明顯下降,其視網膜厚度下降率較IBI302各濃度組偏小,差異有統計學意義(P<0.05)(圖 9,10)。
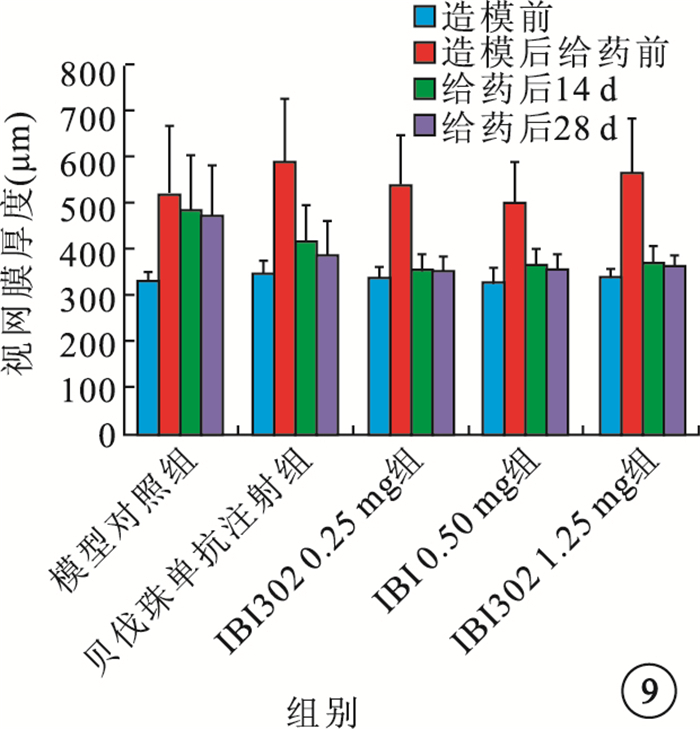 圖9
各組視網膜厚度比較
圖9
各組視網膜厚度比較
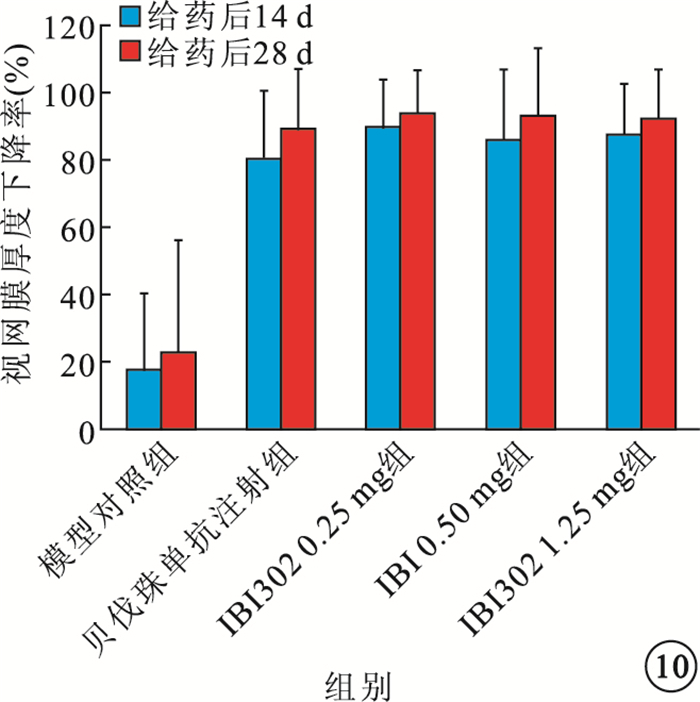 圖10
各組視網膜厚度下降率比較
圖10
各組視網膜厚度下降率比較
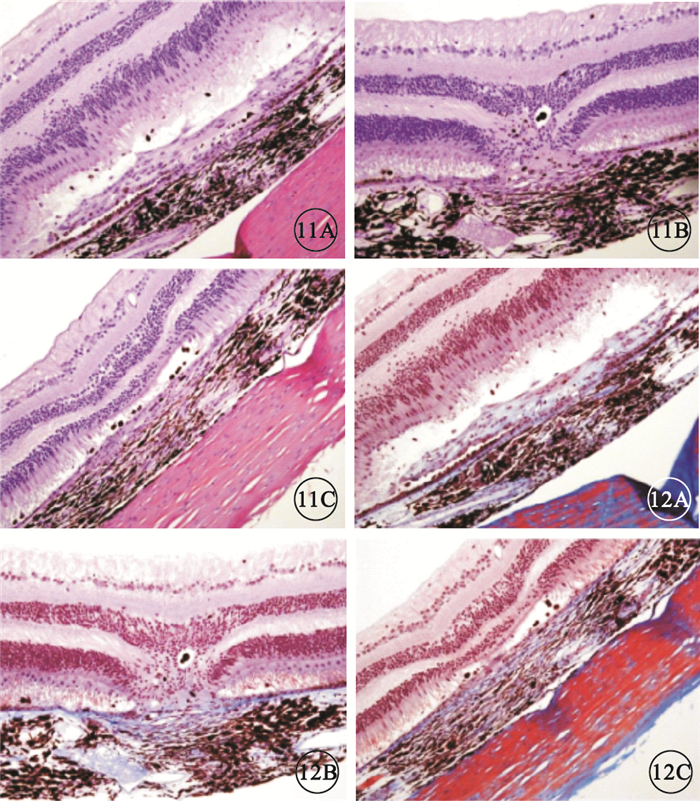
給藥后29 d,模型對照組、貝伐珠單抗注射組恒河猴房水VEGF濃度分別為(94.203±17.360)、(38.644±6..21) pg/ml;貝伐珠單抗注射組恒河猴房水VEGF濃度較模型對照組明顯降低,差異有統計學意義(P<0.05)。IBI302各濃度組恒河猴房水VEGF濃度均低于定量下限31.300 pg/ml。HE染色結果顯示,模型對照組、貝伐珠單抗注射組及IBI302各濃度組所有眼球標本均出現了灶性視網膜脈絡膜纖維組織增生,分別有3、4、1、0、4只眼球出現灶性神經上皮脫離。貝伐珠單抗注射組及IBI302各濃度組上述病變的嚴重程度均較模型對照組輕(圖 11)。馬松三色染色結果顯示,與模型對照組比較,貝伐珠單抗注射組及IBI302各濃度組增生纖維組織陽性強度無明顯差異;貝伐珠單抗注射組及IBI302 各濃度組的陽性分布明顯減少,其中IBI302 1.25 mg組1 只眼球未見陽性染色(圖 12)。
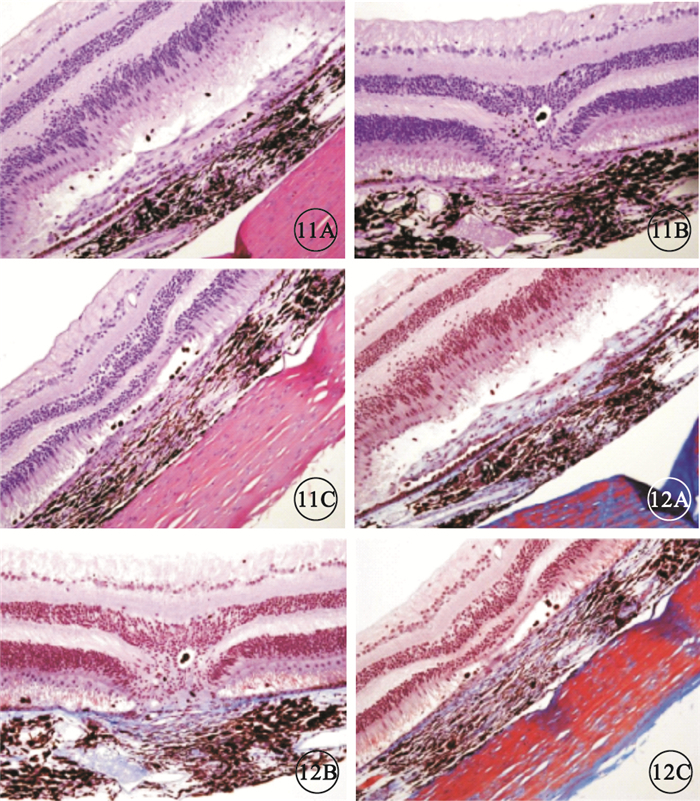 圖11
眼球標本HE染色像。11A.模型對照組;11B.貝伐珠單抗注射組;11C.IBI302 1.25 mg組。均可見局灶性視網膜脈絡膜纖維組織增生和局灶性神經上皮脫離,貝伐珠單抗注射組和IBI302 1.25 mg組病變程度更輕 HE ×200 圖 12 眼球標本馬松三色染色像。12A.模型對照組;12B.貝伐珠單抗注射組;12C.IBI302 1.25 mg組。均可見病灶內增生纖維組織呈藍色染色,貝伐珠單抗注射組及IBI302 1.25 mg組藍色染色分布較模型對照組明顯減少 馬松三色 ×200
圖11
眼球標本HE染色像。11A.模型對照組;11B.貝伐珠單抗注射組;11C.IBI302 1.25 mg組。均可見局灶性視網膜脈絡膜纖維組織增生和局灶性神經上皮脫離,貝伐珠單抗注射組和IBI302 1.25 mg組病變程度更輕 HE ×200 圖 12 眼球標本馬松三色染色像。12A.模型對照組;12B.貝伐珠單抗注射組;12C.IBI302 1.25 mg組。均可見病灶內增生纖維組織呈藍色染色,貝伐珠單抗注射組及IBI302 1.25 mg組藍色染色分布較模型對照組明顯減少 馬松三色 ×200
3 討論
AMD可以分為萎縮型和滲出型。萎縮型與滲出型AMD之間可以相互轉化,二者甚至可以同時出現在同一患眼中。大約10%~15%的輕度萎縮型AMD可以發展為滲出型AMD。盡管兩種形式的AMD臨床表現存在一定差異,但其主要病變組織位點是相同的,即視網膜色素上皮(RPE)和Bruch膜之間有細胞外物質沉積以及血視網膜屏障和Bruch膜完整性喪失[11]。補體系統的激活對RPE損傷有直接作用,一方面導致RPE萎縮,誘導視網膜中心細胞萎縮,從而形成地圖樣萎縮;另一方面破壞血視網膜屏障,導致炎癥發生,VEGF-A高表達,新生血管生成,從而形成滲出型AMD。雖然目前以雷珠單抗為代表的抗VEGF藥物已經成為AMD的一線治療藥物,但仍然存在很多問題[2, 12-14],如有效率低、長期用藥后療效降低、停藥后復發以及對萎縮型AMD無效等。
IBI302為雙特異性重組全人源融合蛋白,包含VID端和CID端。VID端由VEGFR-1的免疫球蛋白樣區域2和VEGFR-2的免疫球蛋白樣區域3構成;CID端由CR1的免疫球蛋白樣區域1、2、3組成,CR1是補體活化調節因子家族成員之一,通過特異性結合C4b和C3b而抑制C3和C5轉化酶的活性并阻斷補體通路的過度活化。VID端能夠阻斷VEGF的活性,抑制VEGF誘導的血管新生;CID端能夠阻斷補體通路的活化,抑制補體介導的炎癥反應。IBI302同時具有抗VEGF和抗補體的活性,預期對AMD的治療作用優于單純的VEGF抑制劑。
本研究通過抗VEGF和抗補體兩方面的實驗考察了IBI302對VEGF通路和補體通路的雙重抑制作用,并與VID和CID進行比較。結果表明,IBI302與VEGF家族細胞因子VEGF-A165、VEGF-A121和PlGF的親和力與VID基本相同,IBI302與C3b和C4b的親和力與CID基本相同。提示IBI302的分子結構符合預期設計目標。IBI302對VEGF誘導的HUVEC增生、遷移和管腔形成具有明顯的抑制作用,其作用機制可能與抑制VEGFR、Erk和Akt的磷酸化有關。IBI302的作用效果與VID基本相同,但是CID對VEGF的生物活性沒有明顯影響。IBI302對補體經典途徑和旁路途徑介導溶血的抑制作用與CID基本相同,但是VID對補體介導的溶血沒有明顯影響。提示IBI302的作用機制符合預期,能夠雙重阻斷VEGF和補體的生物活性。在激光誘導恒河猴CNV模型中,IBI302能夠顯著降低熒光斑的大小、減小滲漏面積和降低視網膜厚度、降低房水內VEGF的水平和減輕眼組織的病理組織學損傷,且IBI302的作用效果優于貝伐珠單抗注射液。提示IBI302不僅通過抑制VEGF的活性而治療CNV,而且可能通過阻斷補體活性治療CNV。由于IBI302的雙重作用機制,使其作用效果優于貝伐珠單抗注射液。以上結果提示IBI302不僅能夠通過VID結合并阻斷VEGF與VEGFR-1和VEGFR-2的結合,抑制VEGF介導的血管新生;而且能夠通過CID結合C3b和C4b并阻斷補體異常活化介導的炎癥反應,對AMD的治療效果可能優于現有的抗VEGF藥物。
本研究結果表明,IBI302作為一種雙靶向生物藥物,具有對VEGF通路和補體通路的雙重抑制作用,不僅可能對滲出型AMD具有非常好的治療前景,而且可能用于萎縮型AMD的治療,有望成為新一代抗AMD藥物。但我們在體內研究中未探索IBI302對補體指標的作用效果,也未設計萎縮型AMD動物模型探索IBI302對萎縮型AMD的干預作用。此外,本研究未直接比較IBI302的作用效果與VID和CID聯合作用的效果,這主要是考慮本實驗中所用的體外模型通常是由VEGF或者補體中一種因素誘導。上述的研究缺陷有待后期通過恰當的動物模型進行深入研究。
玻璃體腔注射抗血管內皮生長因子(VEGF)藥物是目前治療滲出型老年性黃斑變性(AMD)的常用方法,但存在需反復注射、停藥后病變易復發,長期注射后視網膜出血、瘢痕形成以及接受治療眼遠期視力仍有下降可能等問題;此外,對萎縮型AMD無效[1-5]。研究發現,補體通路異常活化在AMD發生發展過程中具有重要作用,可能是導致抗VEGF藥物臨床不良后果的原因;因而成為AMD治療研究的又一熱點[6-10]。IBI302為重組人VEGF受體(VEGFR)-抗體-人補體受體1融合蛋白注射液,包含VEGF抑制結構域(VID)端、人IgG1的Fc段和補體抑制結構域(CID)端,一次給藥可同時抑制VEGF和補體兩個通路激活,起到聯合治療、減少眼內注射頻率的作用。為了進一步驗證探索IBI302對VEGF和補體通路的作用效果及其作用機制,本研究通過體外實驗觀察了IBI302對VEGF和補體生物活性的抑制作用,并通過與抗VEGF藥物貝伐珠單抗治療效果比較,觀察探討了IBI302對激光誘導的恒河猴脈絡膜新生血管(CNV)的干預作用及其機制。現將結果報道如下。
1 材料和方法
1.1 實驗材料
普通級恒河猴,生產許可證號SCXK(川) 2014-027(雅安普萊美生物科技有限公司)。IBI302(相對分子質量140 388.8 Da)、VID和CID[信達生物制藥(蘇州)有限公司];貝伐珠單抗注射液(羅氏制藥)。胎盤生長因子(PlGF)、VEGF-A165、VEGF-A121(美國R&D公司);C3b、C4b(南京肯特復合材料有限公司);人臍靜脈血管內皮細胞(HUVEC,美國模式菌種收集中心);HUVEC基礎培養基(美國Allcells公司);胎牛血清(美國Hyclone公司);細胞計數(CCK-8)顯色試劑盒(日本同仁化學研究所);96孔板、Transwell板、6孔板(美國Corning公司);抗VEGFR、磷酸化VEGFR(P-VEGFR)、細胞外信號調節激酶 (Erk)、磷酸化Erk(P-Erk)、絲蘇氨酸蛋白激酶(Akt)、磷酸化Akt(P-Akt)、磷酸甘油醛脫氫酶(GAPDH)抗體(美國Cell Signaling Technology公司);結晶紫染色液(上海碧云天生物技術研究所);聚偏氟乙烯(PVDF)膜、增強化學發光(ECL)試劑盒(美國Millipore公司);綿陽紅細胞、兔抗綿羊紅細胞血清(鄭州百基生物科技有限公司)。人血清補體(美國Sigma公司)。酶標儀、臺式冷凍離心機、CO2培養箱(美國Thermo公司);紫外分光光度計(日本島津公司);倒置顯微鏡(德國徠卡公司)。
1.2 IBI302與VEGF、補體家族細胞因子親和力試驗
酶聯免疫吸附測定法觀察IBI302與VEGF家族細胞因子和補體蛋白的親和力。碳酸鹽緩沖液溶解VEGF-A165、VEGF-A121、PlGF至終濃度0.5 μg/ml和C3b、C4b至終濃度2.5 μg/ml。取96孔板5塊板分別用于上述5種因子溶液,每板80孔加入一種因子溶液100 μl、另16孔加入磷酸鹽緩沖液(PBS),4℃條件下孵育過夜。然后用1%牛血清白蛋白溶液封閉1 h,棄去封閉液,每板已用的80孔加入IgG、VID、CID、IBI302溶液(每種10個不同濃度,每種每個濃度兩份復孔)各100 μl,4℃條件下孵育過夜。每孔用PBS洗滌3次,加入辣根過氧化物酶-羊抗人二抗孵育1 h,PBS洗滌后加入四甲基聯苯胺溶液顯色,用酶標儀測定450 nm波長下的吸光度[A,舊稱光密度(OD)]值。
1.3 IBI302對VEGF誘導HUVEC增生、遷移、管腔形成以及信號通路的影響
取對數生長期HUVEC調整細胞懸液密度為2×104個/ml,96孔板中每孔加入100 μl,用HUVEC基礎培養基在37℃、5% CO2培養箱中培養24 h。將濃度為35 nmol/L的IgG、IBI302、VID、CID與濃度為0.3 nmol/L的VEGF-A165預孵育30 min,再作用于HUVEC,在37℃、5% CO2條件下再培養24 h。加入10%的CCK-8溶液,37℃放置4 h。酶標儀450 nm波長下測定A值。取對數生長期HUVEC,以細胞密度3×106個/μl 懸于含1% 胎牛血清的HUVEC基礎培養基中并接種于Transwell板內室。將濃度為35 nmol/L的IgG、IBI302、VID、CID與濃度為0.3 nmol/L 的VEGF-A165預孵育30 min,加入Transwell外室。37℃孵育24 h后,棄孔中培養液乙醇固定細胞。棉簽擦去內室上層未遷移的細胞,結晶紫常溫染色,顯微鏡下觀察HUVEC遷移情況并拍照。取對數生長期HUVEC以細胞密度3×106個/μl 懸于含1% 胎牛血清的HUVEC基礎培養基中,加入濃度為350 nmol/L的IgG、IBI302、VID、CID,再加入濃度為0.3 nmol/L的VEGF-A165,混合均勻后接種于基質膠表面,在37℃、5% CO2條件下培養6 h后照相觀察。取對數生長期HUVEC以細胞密度5×105個/孔 接種于6孔板,37℃、5% CO2條件下培養24 h后加入3 nmol/L的IgG、IBI302、VID、CID,作用30 min后再加入0.3 nmol/L的VEGF-A165,作用10 min后收集細胞。細胞用十二烷基磺酸鈉(SDS)凝膠上樣緩沖液裂解,沸水浴中加熱解熱變性。取上清液進行SDS-聚丙烯酰胺凝膠電泳。電泳結束后濕轉系統將蛋白轉移至PVDF膜,將膜置于一抗溶液中溫育。用洗膜緩沖液洗滌。將膜置于二抗溶液中室溫反應2 h,洗膜緩沖液洗滌3次后,ECL試劑發色顯影。
1.4 IBI302對補體經典途徑、補體旁路途徑介導溶血的抑制作用
調整綿羊紅細胞密度至1×109個/ml與1:1000稀釋的兔抗綿羊紅細胞血清等體積混合。置37℃恒溫搖床180 r/min條件下震搖45 min后置于冰上45 min,致敏后用PBS洗滌并懸浮于PBS中,取0.5 ml細胞懸液加入7 ml超純水中,541 nm波長下測定A值并按公式1×109個/ml×A541/0.7計算致敏綿羊紅細胞密度。將0~500 nmol/L的IBI302、VID、CID加到96孔板中,每孔100 μl,以50 μl/孔加入10倍稀釋的補體置于37℃恒溫搖床,在180 r/min條件下震搖45 min。每孔以4×108個/ml細胞密度 加入致敏綿羊紅細胞50 μl,置于37℃恒溫搖床180 r/min 條件下震搖45 min。15℃溫度下以1000×g離心3 min,取上清液100 μl加到另一96孔板中,用酶標儀測量405 nm波長下A值。取兔紅細胞PBS洗滌至澄清后再重新懸浮,取0.5 ml細胞懸液加到7 ml超純水中,紫外分光計在541 nm波長測定A值并按公式1×109個/ml×A541/0.7計算紅細胞密度。將0~500 nmol/L的IBI302、VID、CID加到96孔板中,每孔100 μl,再以25 μl/孔加入補體置于37℃恒溫搖 床180 r/min條件下震搖45 min。每孔以3×108個/ml 細胞密度加入兔紅細胞50 μl,置于37℃恒溫搖床180 r/min條件下震搖45 min。15℃溫度下以1000×g 離心3 min,取上清液100 μl加到另一96孔板中,用酶標儀測量405 nm波長下A值。
1.5 IBI302對激光誘導恒河猴CNV的干預作用
恒河猴麻醉、散瞳,經全視網膜鏡行激光光凝。光斑直徑50 μm,能量0.6 W,曝光時間0.05 s,圍繞黃斑中心凹之外共9個點。以提示Bruch膜被擊破的氣泡產生為CNV模型建立成功。激光光凝前以及激光光凝后20d分別采用TOPCON眼底造影系統行眼底彩色照相、熒光素眼底血管造影(FFA)檢查。選擇雙眼造模成功的25只恒河猴分為模型對照組、貝伐珠單抗注射組以及IBI302 0.25、0.50、1.25 mg組,每組5只猴,雌雄兼有。激光光凝后21 d,模型對照組、貝伐珠單抗注射組恒河猴分別經玻璃體腔單次注射0.9%氯化鈉注射液或1.25 mg貝伐珠單抗注射液,每只眼注射50 μl;IBI302 0.25、0.50、1.25 mg組恒河猴經玻璃體腔單次注射相應濃度IBI302,每只眼注射50 μl。給藥后14、28 d行FFA,并采用海德堡光相干斷層掃描(OCT)儀行OCT檢查。觀察IBI302對激光誘導恒河猴CNV模型眼底熒光素滲漏面積及視網膜厚度的影響。其中,滲漏面積以TOPCON眼底造影系統自帶測量工具及計算軟件進行測量計算;視網膜厚度以海德堡OCT5.3版本軟件自帶測量工具直接測量而得。給藥后29 d,對比分析各組恒河猴房水中VEGF水平;同時對眼球標本蘇木精-伊紅(HE)及馬松三色染色,觀察IBI302對激光誘導恒河猴CNV模型眼組織病理學改變的影響。
1.6 統計學方法
SPSS 13.0統計軟件行統計學分析。單因素方差分析對數據行方差齊性檢驗。方差齊性時,組間比較采用Dunnet-T檢驗;方差不齊時,組間比較采用Dunnet-T3檢驗。P<0.05為差異有統計學意義。
2 結果
IBI302和VID對VEGF-A121和PlGF均有較強的親和性,且兩者親和力相當,差異無統計學意義(P>0.05)。IBI302和VEGF-A165有特異性高度親和,其親和力略低于VID,但差異無統計學意義(P>0.05)。IBI302和CID對C3b和C4b蛋白有一定的親和性;兩者對C3b的親和力相當,差異無統計學意義(P>0.05);IBI302對C4b的親和力明顯高于CID,差異有統計學意義(P<0.05)(圖 1)。
 圖1
IBI302與VEGF家族蛋 白、補體家族蛋白的親和曲線。1A.VEGF-A121;1B.VEGF-A165;1C.PIGF;1D.C3b;1E.C4b
圖1
IBI302與VEGF家族蛋 白、補體家族蛋白的親和曲線。1A.VEGF-A121;1B.VEGF-A165;1C.PIGF;1D.C3b;1E.C4b
IBI302和VID均能明顯抑制VEGF誘導的HUVEC增生;兩者作用效果相當,差異無統計學意義(P>0.05)(圖 2)。IBI302、VID、CID對VEGF誘導的HUVEC遷移均具有明顯的抑制作用;IBI302和VID作用效果相當,差異無統計學意義(P>0.05);IBI302和VID的作用效果均明顯優于CID,差異有統計學意義(P<0.05)(圖 3)。IBI302和VID均能明顯抑制VEGF誘導的HUVEC管腔形成;兩者作用效果相當,差異無統計學意義(P>0.05)。CID對VEGF誘導的HUVEC管腔形成無明顯作用(圖 4)。IBI302和VID均可抑制VEGF誘導的HUVEC的VEGFR、Erk和Akt磷酸化,降低p-VEGFR、p-Erk、p-Akt與VEGFR、Erk、Akt的比值;兩者作用效果相當,差異無統計學意義(P>0.05)。CID對VEGF誘導的HUVEC信號通路無明顯影響(圖 5)。
 圖2
不同藥物對VEGF誘導HUVEC增生的抑制作用比較
圖2
不同藥物對VEGF誘導HUVEC增生的抑制作用比較
 圖3
不同藥物抑制VEGF誘導HUVEC遷移染色像。3A.HUVEC基礎培養基;3B.VEGF;3C.IgG+VEGF;3D.VID+VEGF;3E.CID+VEGF;3F.IBI302+VEGF。可見經IBI302、VID、CID培養后,遷移的HUVEC明顯減少 結晶紫 ×20 圖 4 不同藥物抑制VEGF誘導HUVEC管腔形成實驗像。4A.HUVEC基礎培養基;4B.VEGF;4C.IgG+VEGF;4D.VID+VEGF;4E.CID+VEGF;4F.IBI302+VEGF。可見經IBI302、VID培養后,HUVEC管腔形成明顯減少 ×20
圖3
不同藥物抑制VEGF誘導HUVEC遷移染色像。3A.HUVEC基礎培養基;3B.VEGF;3C.IgG+VEGF;3D.VID+VEGF;3E.CID+VEGF;3F.IBI302+VEGF。可見經IBI302、VID、CID培養后,遷移的HUVEC明顯減少 結晶紫 ×20 圖 4 不同藥物抑制VEGF誘導HUVEC管腔形成實驗像。4A.HUVEC基礎培養基;4B.VEGF;4C.IgG+VEGF;4D.VID+VEGF;4E.CID+VEGF;4F.IBI302+VEGF。可見經IBI302、VID培養后,HUVEC管腔形成明顯減少 ×20
 圖5
不同藥物阻斷VEGF誘導HUVEC信號通路電泳像
圖5
不同藥物阻斷VEGF誘導HUVEC信號通路電泳像
IBI302和CID均可抑制補體經典途徑介導的綿羊紅細胞溶血;兩者作用效果相當,差異無統計學意義(P>0.05)。VID對補體經典途徑介導的綿羊紅細胞溶血沒有影響。IBI302和CID均可抑制補體旁路途徑介導的兔紅細胞溶血;兩者作用效果相當,差異無統計學意義(P>0.05)。VID對補體旁路途徑介導的兔紅細胞溶血沒有影響(圖 6)。
 圖6
不同藥物對補體經典途徑和旁路途徑介導溶血的抑制作用比較
圖6
不同藥物對補體經典途徑和旁路途徑介導溶血的抑制作用比較
給藥后14、28 d,IBI302 0.25、0.50、1.25 mg組恒河猴眼底熒光斑及熒光素滲漏面積明顯減小;3組之間熒光素滲漏面積及滲漏面積減小率比較,差異無統計學意義(P>0.05)。貝伐珠單抗注射組恒河猴眼底 的熒光斑和熒光素滲漏面積也明顯減小,其熒光素滲漏面積減小率較IBI302各濃度組偏小,但差異無統計學意義(P>0.05)(圖 7,8)。
 圖7
各組熒光素滲漏面積比較
圖7
各組熒光素滲漏面積比較
 圖8
各組熒光素滲漏面積改善率比較
圖8
各組熒光素滲漏面積改善率比較
給藥后14、28 d,IBI302 0.25、0.50、1.25 mg組恒河猴視網膜厚度均明顯下降;3組之間視網膜厚度比較,差異無統計學意義(P>0.05)。貝伐珠單抗注射組恒河猴視網膜厚度也明顯下降,其視網膜厚度下降率較IBI302各濃度組偏小,差異有統計學意義(P<0.05)(圖 9,10)。
 圖9
各組視網膜厚度比較
圖9
各組視網膜厚度比較
 圖10
各組視網膜厚度下降率比較
圖10
各組視網膜厚度下降率比較
給藥后29 d,模型對照組、貝伐珠單抗注射組恒河猴房水VEGF濃度分別為(94.203±17.360)、(38.644±6..21) pg/ml;貝伐珠單抗注射組恒河猴房水VEGF濃度較模型對照組明顯降低,差異有統計學意義(P<0.05)。IBI302各濃度組恒河猴房水VEGF濃度均低于定量下限31.300 pg/ml。HE染色結果顯示,模型對照組、貝伐珠單抗注射組及IBI302各濃度組所有眼球標本均出現了灶性視網膜脈絡膜纖維組織增生,分別有3、4、1、0、4只眼球出現灶性神經上皮脫離。貝伐珠單抗注射組及IBI302各濃度組上述病變的嚴重程度均較模型對照組輕(圖 11)。馬松三色染色結果顯示,與模型對照組比較,貝伐珠單抗注射組及IBI302各濃度組增生纖維組織陽性強度無明顯差異;貝伐珠單抗注射組及IBI302 各濃度組的陽性分布明顯減少,其中IBI302 1.25 mg組1 只眼球未見陽性染色(圖 12)。
 圖11
眼球標本HE染色像。11A.模型對照組;11B.貝伐珠單抗注射組;11C.IBI302 1.25 mg組。均可見局灶性視網膜脈絡膜纖維組織增生和局灶性神經上皮脫離,貝伐珠單抗注射組和IBI302 1.25 mg組病變程度更輕 HE ×200 圖 12 眼球標本馬松三色染色像。12A.模型對照組;12B.貝伐珠單抗注射組;12C.IBI302 1.25 mg組。均可見病灶內增生纖維組織呈藍色染色,貝伐珠單抗注射組及IBI302 1.25 mg組藍色染色分布較模型對照組明顯減少 馬松三色 ×200
圖11
眼球標本HE染色像。11A.模型對照組;11B.貝伐珠單抗注射組;11C.IBI302 1.25 mg組。均可見局灶性視網膜脈絡膜纖維組織增生和局灶性神經上皮脫離,貝伐珠單抗注射組和IBI302 1.25 mg組病變程度更輕 HE ×200 圖 12 眼球標本馬松三色染色像。12A.模型對照組;12B.貝伐珠單抗注射組;12C.IBI302 1.25 mg組。均可見病灶內增生纖維組織呈藍色染色,貝伐珠單抗注射組及IBI302 1.25 mg組藍色染色分布較模型對照組明顯減少 馬松三色 ×200
3 討論
AMD可以分為萎縮型和滲出型。萎縮型與滲出型AMD之間可以相互轉化,二者甚至可以同時出現在同一患眼中。大約10%~15%的輕度萎縮型AMD可以發展為滲出型AMD。盡管兩種形式的AMD臨床表現存在一定差異,但其主要病變組織位點是相同的,即視網膜色素上皮(RPE)和Bruch膜之間有細胞外物質沉積以及血視網膜屏障和Bruch膜完整性喪失[11]。補體系統的激活對RPE損傷有直接作用,一方面導致RPE萎縮,誘導視網膜中心細胞萎縮,從而形成地圖樣萎縮;另一方面破壞血視網膜屏障,導致炎癥發生,VEGF-A高表達,新生血管生成,從而形成滲出型AMD。雖然目前以雷珠單抗為代表的抗VEGF藥物已經成為AMD的一線治療藥物,但仍然存在很多問題[2, 12-14],如有效率低、長期用藥后療效降低、停藥后復發以及對萎縮型AMD無效等。
IBI302為雙特異性重組全人源融合蛋白,包含VID端和CID端。VID端由VEGFR-1的免疫球蛋白樣區域2和VEGFR-2的免疫球蛋白樣區域3構成;CID端由CR1的免疫球蛋白樣區域1、2、3組成,CR1是補體活化調節因子家族成員之一,通過特異性結合C4b和C3b而抑制C3和C5轉化酶的活性并阻斷補體通路的過度活化。VID端能夠阻斷VEGF的活性,抑制VEGF誘導的血管新生;CID端能夠阻斷補體通路的活化,抑制補體介導的炎癥反應。IBI302同時具有抗VEGF和抗補體的活性,預期對AMD的治療作用優于單純的VEGF抑制劑。
本研究通過抗VEGF和抗補體兩方面的實驗考察了IBI302對VEGF通路和補體通路的雙重抑制作用,并與VID和CID進行比較。結果表明,IBI302與VEGF家族細胞因子VEGF-A165、VEGF-A121和PlGF的親和力與VID基本相同,IBI302與C3b和C4b的親和力與CID基本相同。提示IBI302的分子結構符合預期設計目標。IBI302對VEGF誘導的HUVEC增生、遷移和管腔形成具有明顯的抑制作用,其作用機制可能與抑制VEGFR、Erk和Akt的磷酸化有關。IBI302的作用效果與VID基本相同,但是CID對VEGF的生物活性沒有明顯影響。IBI302對補體經典途徑和旁路途徑介導溶血的抑制作用與CID基本相同,但是VID對補體介導的溶血沒有明顯影響。提示IBI302的作用機制符合預期,能夠雙重阻斷VEGF和補體的生物活性。在激光誘導恒河猴CNV模型中,IBI302能夠顯著降低熒光斑的大小、減小滲漏面積和降低視網膜厚度、降低房水內VEGF的水平和減輕眼組織的病理組織學損傷,且IBI302的作用效果優于貝伐珠單抗注射液。提示IBI302不僅通過抑制VEGF的活性而治療CNV,而且可能通過阻斷補體活性治療CNV。由于IBI302的雙重作用機制,使其作用效果優于貝伐珠單抗注射液。以上結果提示IBI302不僅能夠通過VID結合并阻斷VEGF與VEGFR-1和VEGFR-2的結合,抑制VEGF介導的血管新生;而且能夠通過CID結合C3b和C4b并阻斷補體異常活化介導的炎癥反應,對AMD的治療效果可能優于現有的抗VEGF藥物。
本研究結果表明,IBI302作為一種雙靶向生物藥物,具有對VEGF通路和補體通路的雙重抑制作用,不僅可能對滲出型AMD具有非常好的治療前景,而且可能用于萎縮型AMD的治療,有望成為新一代抗AMD藥物。但我們在體內研究中未探索IBI302對補體指標的作用效果,也未設計萎縮型AMD動物模型探索IBI302對萎縮型AMD的干預作用。此外,本研究未直接比較IBI302的作用效果與VID和CID聯合作用的效果,這主要是考慮本實驗中所用的體外模型通常是由VEGF或者補體中一種因素誘導。上述的研究缺陷有待后期通過恰當的動物模型進行深入研究。