引用本文: 范玲玲, 顏華. FTY720對糖尿病大鼠視網膜血管內白細胞粘附和血管通透性的影響. 中華眼底病雜志, 2016, 32(2): 163-168. doi: 10.3760/cma.j.issn.1005-1015.2016.02.012 復制
炎癥在糖尿病視網膜病變(DR)發生發展過程中起重要作用[1]。DR早期,粘附分子表達增加引起視網膜血管內白細胞粘附增加,形成局部炎癥環境;進而導致白細胞瘀滯,介導內皮細胞損傷及死亡、血視網膜屏障(BRB)破壞和毛細血管阻塞[2]。最終導致視網膜毛細血管無灌注、視網膜缺血缺氧,誘導病理性新生血管形成,病變進展到增生期。研究表明,抑制粘附因子表達可以明顯降低白細胞瘀滯和BRB破壞[3],從而延緩DR進展。FTY720是一種新型免疫調節劑,可以下調炎癥誘導的粘附分子表達,減少炎性細胞與內皮粘附以及繼發的炎性滲出[4]。但FTY720是否可以減輕DR視網膜白細胞瘀滯,保護BRB目前尚不明確。為此,我們觀察了FTY720對糖尿病大鼠視網膜血管內白細胞粘附和血管通透性的影響,探討FTY720對DR發生過程中炎癥損傷的干預作用并初步探討其相關機制。現將結果報道如下。
1 材料和方法
雄性Wistar大鼠90只,鼠齡12~14周,體重220~250 g,天津醫科大學動物中心提供。均飼養于標準化動物中心且無特定病原體級動物房,自由飲水攝食。將大鼠隨機分為正常對照組、糖尿病組及FTY720組,每組30只。正常對照組大鼠不作任何處理。糖尿病組及FTY720組大鼠適應性飼養5 d后,采用腹腔注射鏈脲佐菌素(STZ)的方法建立糖尿病模型[5]。注射后48 h檢測兩組大鼠空腹血糖,連續3次大于16.7 mmol/L為建模成功[6]。建模成功后,糖尿病組大鼠不干預。FTY720組大鼠以0.3 mg/kg的劑量灌胃給予FTY720,1次/d,連續3個月[7]。于FTY720組大鼠干預后1、2、3個月,檢測各組大鼠體重和血糖變化。于FTY720組大鼠干預后3個月,各組大鼠均取材用于相關實驗。
各組取7只大鼠麻醉后處死,摘除眼球,制作石蠟切片。采用蘇木精-伊紅(HE)染色觀察大鼠視網膜組織病理學改變。采用抗大鼠細胞間粘附分子1(ICAM-1)、血管細胞粘附分子1(VCAM-1)抗體進行石蠟切片免疫組織化學染色,觀察視網膜各層ICAM-1和VCAM-1表達。采用雙盲法,由兩名病理醫師獨立計數ICAM-1和VCAM- 1的陽性細胞數。每組選取10張切片,每張切片計數5個40倍視野。
各組取5只大鼠麻醉后處死,采用Trizol法提取視網膜總RNA,并用紫外線分光光度計檢測RNA濃度。逆轉錄合成cDNA后,采用SYBR熒光法進行逆轉錄聚合酶鏈反應(RT-PCR)反應。引物由生工生物工程(上海)股份有限公司設計并合成。ICAM-1:上游引物5′-GCCTGGGGTTGGAGACTAAC-3′,下游引物5′-CTCGCTCTGGGAACGAATACA-3′,擴增片段長度為174堿基對(bp);VCAM-1:上游引物5′-GGAAATGCCACCCTCACCTT-3′,下游引物5′-AACAGTAAATGGTTTCTCTTGAACA-3′,擴增片段長度132 bp;β肌動蛋白(β-actin):上游引物5′-CCCATCTTAGAGGGTTACGC-3′,下游引物5′-TTTAATGTCACGCACGATTTC-3′,擴增片段長度150bp。采用2-ΔΔCT法計算目的基因相對表達量。
參照文獻[8]的方法檢測大鼠視網膜血管內白細胞粘附情況。各組取5只大鼠麻醉后,打開胸腔,從左心室插入20G灌注針頭至主動脈并固定。灌注磷酸鹽緩沖液(PBS)沖去血管中紅細胞和未粘附的白細胞,灌注40 g/ml的異硫氰酸熒光素標記的刀豆素蛋 白(FITC-ConA)30 ml,循環5 min以標記視網膜血管及粘附的白細胞,再用PBS將血管中多余的FITC-ConA 去除。灌注完成后,摘除眼球浸入4%多聚甲醛中固定2 h。分離視網膜鋪片,在共聚焦熒光顯微鏡下觀察視網膜血管內白細胞粘附情況,并由同一研究者計數。從視盤處開始計數,沿著12點方向的大血管及其分支走向進行直至視網膜周邊部,然后再按順時針方向逐個血管計數,結果以每個視網膜中粘附的總白細胞數表示。
各組取8只大鼠麻醉后,以45 mg/kg的劑量尾靜脈注射3%伊凡思藍(EB)。循環2 h后處死大鼠,摘除眼球浸入4%多聚甲醛中固定2 h。分離視網膜鋪片,在共聚焦熒光顯微鏡下觀察視網膜血管EB滲漏情況。參照文獻[9]的方法進行EB滲漏定量檢測。分別測量樣品在620、740 nm處的吸光度[A,舊稱光密度(OD)]值,兩者之差即為凈A值。建立EB染料濃度在甲酰胺中的標準曲線。根據EB濃度與凈A值的關系計算實際溶液中EB濃度,乘以120 μl即為EB滲漏量。最后用視網膜干重(mg)標化EB滲漏量(ng),結果表示為ng/mg。
各組取5只大鼠麻醉后處死,摘除眼球,制作冰凍切片。采用抗大鼠CD45、CD11b和CD3抗體進行冰凍切片免疫熒光染色,熒光顯微鏡下觀察大鼠視網膜各層全部炎性細胞、巨噬細胞和(或)活化的小膠質細胞、T淋巴細胞的浸潤情況。
采用SPSS 17.0進行統計學分析,數據用均數±標準差(
2 結果
糖尿病組及FTY720組大鼠建模成功率均為100%。干預后1、2、3個月,與正常對照組比較,糖尿病組大鼠體重明顯降低,差異有統計學意義(t=-5.46、 -11.28、-22.38,P<0.05);血糖明顯升高,差異有統計學意義(t=25.96、27.39、22.64,P<0.05)。與正常對照組比較,干預后1個月FTY720組大鼠體重無明顯變化,差異無統計學意義(t=-1.42,P>0.05);干預后2、3個月FTY720組大鼠體重明顯降低,差異有統計學意義(t=-5.06、-8.12,P<0.05);干預后1、2、3個月FTY720組大鼠血糖明顯升高,差異有統計學意義(t=27.46、29.89、26.92,P<0.05)。干預后1、2、3個月,糖尿病組與FTY720組大鼠血糖比較,差異無統計學意義(t=0.17、-1.29、1.24,P>0.05)。
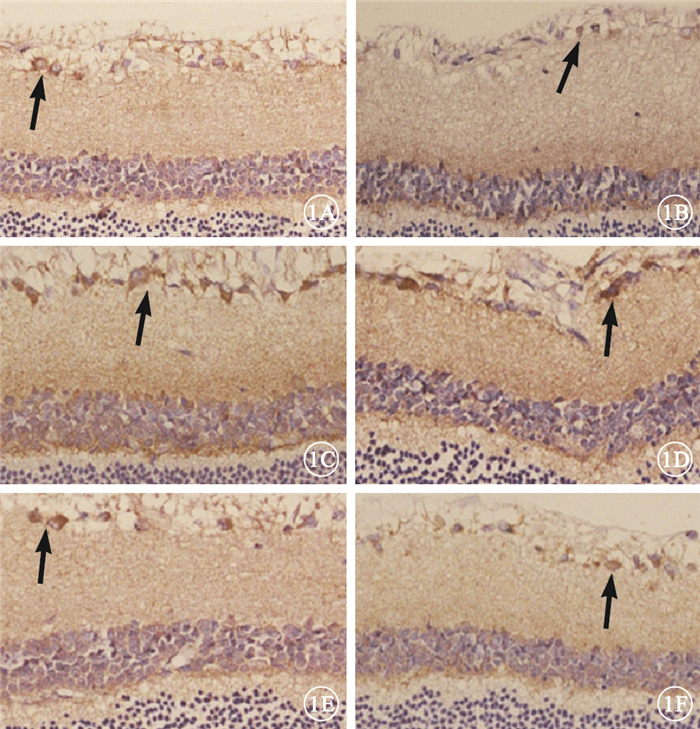
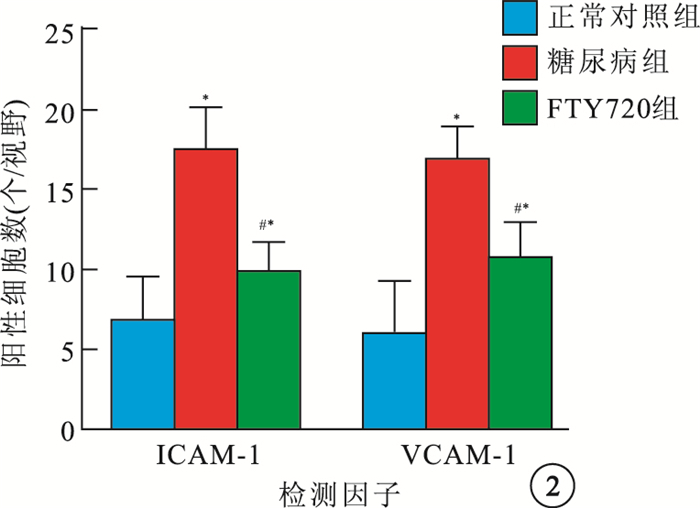
正常對照組大鼠視網膜可見極少量ICAM-1、VCAM-1 陽性細胞(圖 1A,1B)。糖尿病組大鼠視網膜可見大量ICAM-1、VCAM-1陽性細胞,呈深棕色且主要分布于神經節細胞層(圖 1C,1D)。FTY720組大鼠視網膜可見少量ICAM-1、VCAM-1陽性細胞(圖 1E,1F)。3組大鼠視網膜ICAM-1、VCAM-1陽性細胞數比較,差異有統計學意義(F=236.27、46.54,P< 0.05)。組間兩兩比較,糖尿病組大鼠視網膜ICAM-1、 VCAM-1陽性細胞數較正常對照組明顯增加,差異有統計學意義(t=12.81、11.75,P<0.05);FTY720組大鼠視網膜ICAM-1、VCAM-1陽性細胞數較糖尿病組明顯減少,差異有統計學意義(t=-9.93,-6.61、P<0.05)(圖 2)。
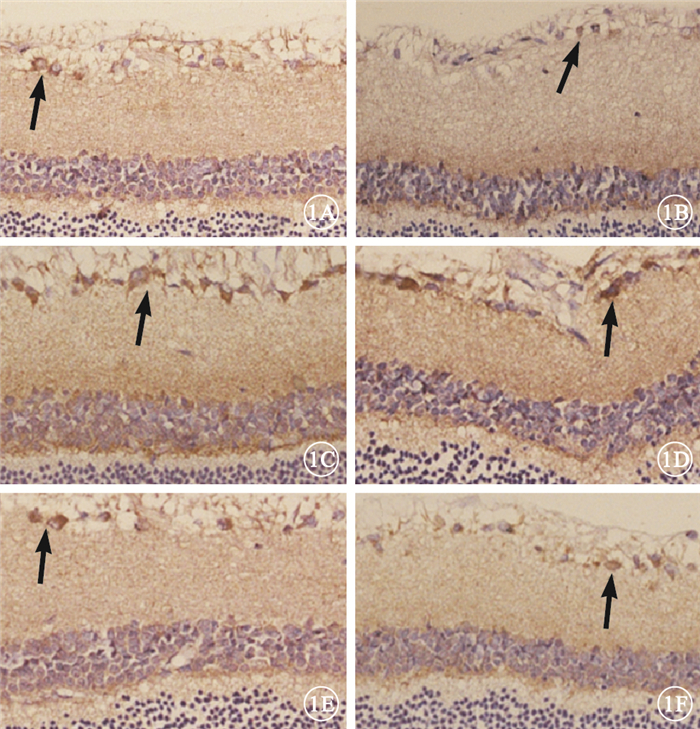 圖1
3組大鼠視網膜光學顯微鏡像。1A.正常對照組ICAM-1;1B.正常對照組VCAM-1。可見極少量ICAM-1、VCAM-1 陽性細胞(黑箭)。1C.糖尿病組ICAM-1;1D.糖尿病組VCAM-1。可見大量ICAM-1、VCAM-1陽性細胞,呈深棕色且主要分布于神經節細胞層(黑箭)。1E.FTY720組ICAM-1;1F.FTY720組VCAM-1。 可見少量ICAM-1、VCAM-1陽性細胞(黑箭) 免疫組織化學 ×20
圖1
3組大鼠視網膜光學顯微鏡像。1A.正常對照組ICAM-1;1B.正常對照組VCAM-1。可見極少量ICAM-1、VCAM-1 陽性細胞(黑箭)。1C.糖尿病組ICAM-1;1D.糖尿病組VCAM-1。可見大量ICAM-1、VCAM-1陽性細胞,呈深棕色且主要分布于神經節細胞層(黑箭)。1E.FTY720組ICAM-1;1F.FTY720組VCAM-1。 可見少量ICAM-1、VCAM-1陽性細胞(黑箭) 免疫組織化學 ×20
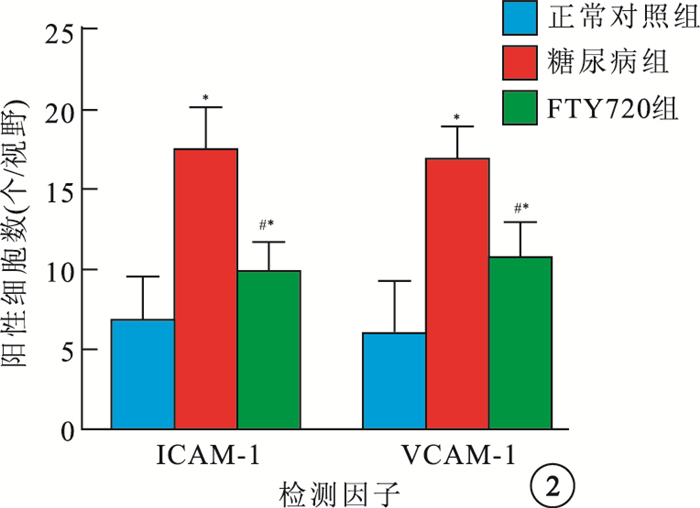 圖2
3組大鼠視網膜ICAM-1、VCAM-1陽性細胞數比較。* 與正常對照組比較,P<0.05;#與糖尿病組比較,P<0.05
圖2
3組大鼠視網膜ICAM-1、VCAM-1陽性細胞數比較。* 與正常對照組比較,P<0.05;#與糖尿病組比較,P<0.05
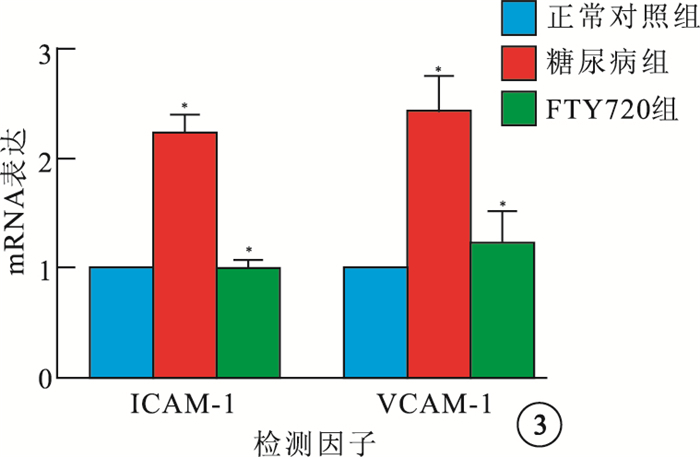
RT-PCR檢測結果顯示,3組大鼠視網膜中ICAM-1、VCAM-1 mRNA表達比較,差異有統計學意義(F=92.38、69.73,P<0.05)。組間兩兩比較,糖尿病組大鼠視網膜中ICAM-1、VCAM-1 mRNA表達較正常對照組明顯增高,差異有統計學意義(t=16.14、9.59,P<0.05);FTY720組大鼠視網膜中ICAM-1、VCAM-1 mRNA表達較糖尿病組明顯減少,差異有統計學意義(t=-15.28、-6.10,P<0.05)(圖 3)。
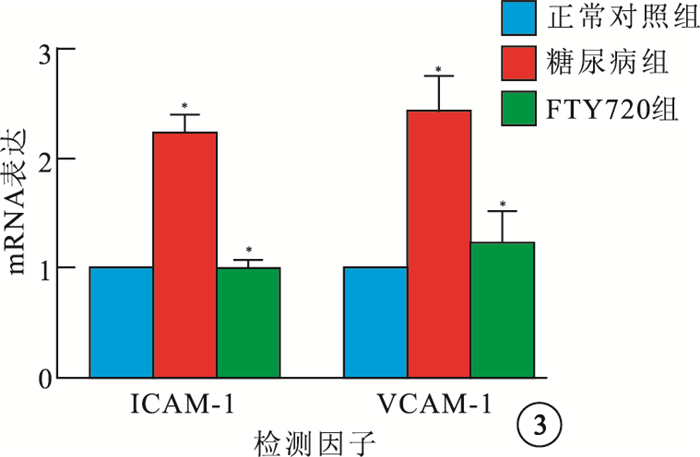 圖3
3組大鼠視網膜中ICAM-1、VCAM-1 mRNA表達比較。* 與正常對照組比較,P<0.05;#與糖尿病組比較,P<0.05
圖3
3組大鼠視網膜中ICAM-1、VCAM-1 mRNA表達比較。* 與正常對照組比較,P<0.05;#與糖尿病組比較,P<0.05
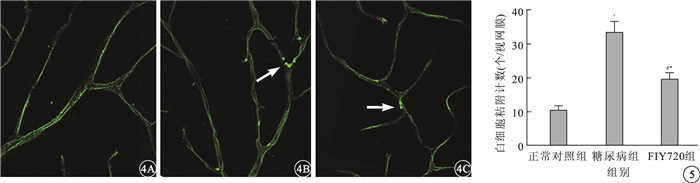
正常對照組大鼠視網膜血管未見明顯的白細胞粘附(圖 4A)。糖尿病組大鼠視網膜血管內可見大量白細胞粘附,且在血管分叉處多見(圖 4B)。FTY720組大鼠視網膜血管內可見少量白細胞粘附(圖 4C)。正常對照組、糖尿病組、FTY720組大鼠視網膜血管內粘附的白細胞計數比較,差異有統計學意義(F=135.24,P<0.05)。組間兩兩比較,糖尿病組大鼠視網膜血管內粘附的白細胞計數較正常對照組明顯增加,差異有統計學意義(t=16.32,P<0.05); FTY720組大鼠視網膜血管內粘附的白細胞計數較糖尿病組明顯減少,差異有統計學意義(t=-9.93,P<0.05)(圖 5)。
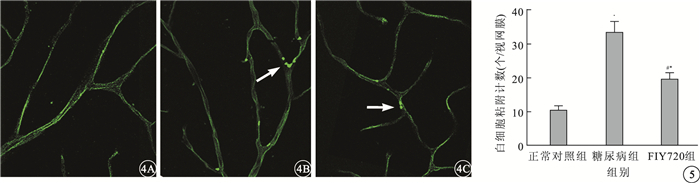 圖4
大鼠視網膜熒光顯微鏡像。4A.正常對照組,視網膜血管內無明顯白細胞粘附;4B.糖尿病組,視網膜血管內大量白細胞粘附且血管分叉處多見(白箭);4C.FTY720組,視網膜血管內少量白細胞粘附(白箭) FITC-ConA ×40 圖 5 3組大鼠視網膜血管內白細胞粘附計數比較。*與正常對照組比較,P<0.05;#與糖尿病組比較,P<0.05。
圖4
大鼠視網膜熒光顯微鏡像。4A.正常對照組,視網膜血管內無明顯白細胞粘附;4B.糖尿病組,視網膜血管內大量白細胞粘附且血管分叉處多見(白箭);4C.FTY720組,視網膜血管內少量白細胞粘附(白箭) FITC-ConA ×40 圖 5 3組大鼠視網膜血管內白細胞粘附計數比較。*與正常對照組比較,P<0.05;#與糖尿病組比較,P<0.05。
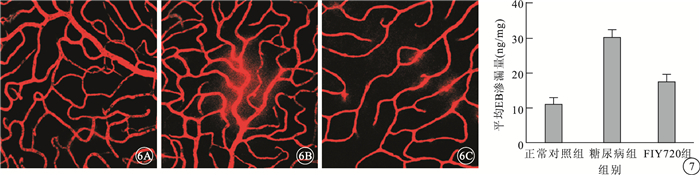
正常對照組大鼠視網膜血管未見EB滲漏(圖 6A)。 糖尿病組大鼠視網膜血管可見大量EB滲漏(圖 6B)。FTY720組大鼠視網膜血管可見少量EB滲漏(圖 6C)。正常對照組、糖尿病組、FTY720組大鼠視網膜血管平均EB滲漏量比較,差異有統計學意義(F=163.93,P<0.05)。組間兩兩比較,糖尿病組大鼠視網膜血管平均EB滲漏量較正常對照組明顯增高,差異有統計學意義(t=17.83,P<0.05);FTY720組大鼠視網膜血管平均EB滲漏量較糖尿病組明顯減少,差異有統計學意義(t=-11.82,P<0.05)(圖 7)。
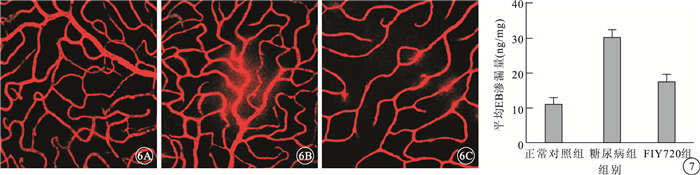 圖6
大鼠視網膜熒光顯微鏡。6A.正常對照組,視網膜血管無明顯EB滲漏;6B.糖尿病組,視網膜血管大量EB滲漏;6C.FTY720組,視網膜血管少量EB滲漏 ×20 圖 73組大鼠視網膜血管平均EB滲漏量比較。*與正常對照組比較,P<0.05;#與糖尿病組比較,P<0.05
圖6
大鼠視網膜熒光顯微鏡。6A.正常對照組,視網膜血管無明顯EB滲漏;6B.糖尿病組,視網膜血管大量EB滲漏;6C.FTY720組,視網膜血管少量EB滲漏 ×20 圖 73組大鼠視網膜血管平均EB滲漏量比較。*與正常對照組比較,P<0.05;#與糖尿病組比較,P<0.05
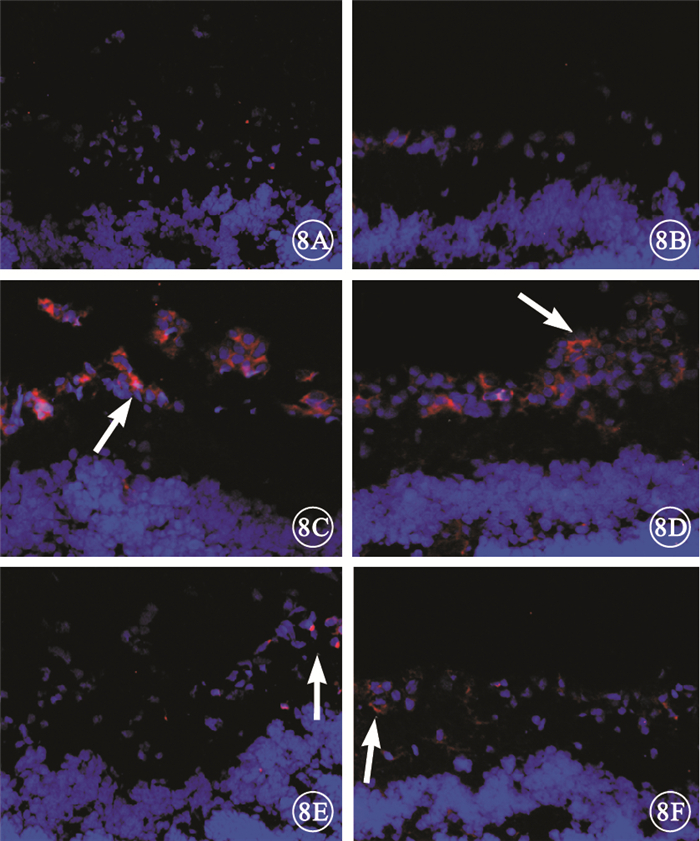
正常對照組大鼠視網膜未見炎性細胞浸潤(圖 8A、8B)。糖尿病組大鼠視網膜可見大量CD45陽性的白細胞浸潤(圖 8C),其中CD11b陽性的巨噬細胞和(或)活化的小膠質細胞數量明顯增多(圖 8D)。 FTY720組大鼠視網膜可見少量CD45陽性的白細胞浸潤(圖 8E)以及少量CD11b陽性的巨噬細胞和(或)活化的小膠質細胞(圖 8F)。3組大鼠視網膜中CD3陽性的淋巴細胞浸潤少。
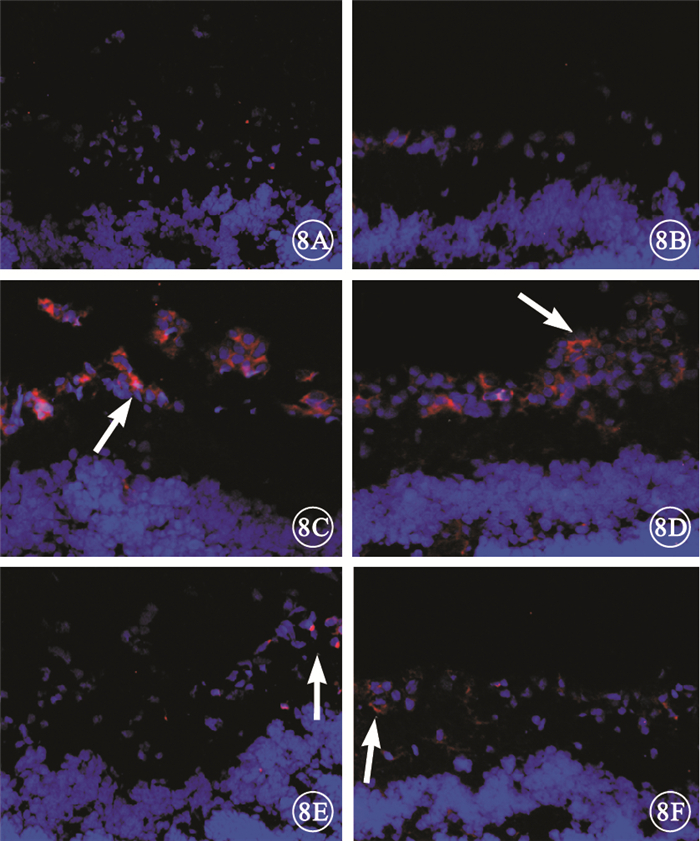 圖8
3組大鼠視網膜熒光顯微鏡像。8A.正常對照組CD45;8B.正常對照組CD11b。未見CD45、CD11b陽性細胞。8C.糖尿病組CD45;8D.糖尿病組CD11b。可見大量CD45、CD11b陽性細胞(白箭)。8E.FTY720組CD45;8F.FTY720組CD11b。可見少量CD45、CD11b陽性細胞(白箭) ×20
圖8
3組大鼠視網膜熒光顯微鏡像。8A.正常對照組CD45;8B.正常對照組CD11b。未見CD45、CD11b陽性細胞。8C.糖尿病組CD45;8D.糖尿病組CD11b。可見大量CD45、CD11b陽性細胞(白箭)。8E.FTY720組CD45;8F.FTY720組CD11b。可見少量CD45、CD11b陽性細胞(白箭) ×20
3 討論
STZ誘導糖尿病大鼠模型是目前應用最廣泛的造模方法。本研究糖尿病組及FTY720組大鼠血糖均達到16.7 mmol/L,建模成功率100%,且多飲、多食、多尿及體重減輕癥狀明顯。研究表明,0.3 mg/kg的FTY720灌胃給藥可以抑制視網膜炎癥反應并保護BRB[7]。因此,本研究按0.3 mg/kg的劑量給予糖尿病大鼠FTY720灌胃給藥。FTY720通過阻斷免疫細胞入血而抑制胰島炎性細胞浸潤,減少胰島β細胞破壞,發揮降糖作用[10]。本研究結果表明,FTY720組和糖尿病組大鼠于干預后1、2、3個月的血糖均無明顯差異,故可排除FTY720降糖作用對實驗的干擾,研究結果可靠。
目前,多數學者認為DR的發病機制與慢性炎癥反應有關;長期暴露于高血糖環境導致血管內皮細胞活化,表現為細胞表面粘附分子表達增加,介導白細胞 瘀滯[11]。研究表明,DR患者玻璃體及血清中ICAM-1和VCAM-1 的表達顯著升高[12, 13]。與之相似,本研究結果顯示糖尿病組大鼠視網膜ICAM-1和VCAM-1表達明顯增加。粘附分子表達增加可以介導白細胞遷移并粘附于視網膜血管壁,釋放多種促炎性因子、生長因子及血管滲透性因子,最終導致內皮損傷及死亡,BRB 破壞,血管通透性增加并繼發視網膜炎性細胞浸潤。我們還發現,糖尿病大鼠視網膜血管內粘附白細胞數量顯著增加,視網膜血管通透性增強且視網膜中出現明顯的炎性細胞浸潤。ICAM-1基因敲除后可以明顯減輕糖尿病大鼠視網膜白細胞瘀滯和血管損傷[3]。因此,抑制視網膜粘附因子表達,對于減輕白細胞瘀滯,降低BRB破壞具有重要意義。
FTY720是一種新型免疫抑制劑,通過與淋巴細胞表面的S1P受體(S1PR)結合發揮強大的抗炎作用,用于多發性硬化癥(MS)的治療。FTY720還可以與內皮細胞表面的S1PR1/S1PR3直接結合,發揮降低血管通透性的作用。 急性肺損傷模型中,FTY720通過S1PR1信號降低了肺組織血管通透性[14]。近年有研究表明,FTY720通過結合內皮細胞表面的S1PR3,下調ICAM-1和VCAM-1表達,減少白細胞粘附及繼發的炎性細胞浸潤[4]。另外,FTY720通過直接調節內皮細胞表面的S1PR1,抑制白細胞遷移、粘附及穿透血腦屏障[15]。提示FTY720治療MS 的新機制,即通過直接作用與內皮細胞表面S1PR1/S1PR3受下調內皮細胞表面粘附分子表達,直接發揮保護血腦屏障的作用。與此類似,本研究結果顯示,FTY720組大鼠視網膜ICAM-1和VCAM-1表達明顯下降,白細胞粘附減少,視網膜血管滲透性下降且視網膜炎性細胞浸潤減少。提示FTY720可以抑制糖尿病大鼠視網膜炎癥損傷,保護BRB,且與下調視網膜粘附分子表達有關。另有研究表明,FTY720下調粘附分子表達的同時可以上調內皮細胞緊密連接蛋白的表達,并抑制炎癥環境下內皮細胞凋亡,保護血腦屏障[15, 16]。據此我們推測FTY720保護糖尿病大鼠BRB的機制還可能與上調緊密連接蛋白、抑制內皮細胞凋亡的作用有關,但尚需進一步實驗驗證。
本研究結果表明,FTY720可以減輕糖尿病大鼠視網膜白細胞粘附,降低視網膜血管通透性,其機制與下調粘附分子表達有關。但本研究僅為初步探討,尚有許多不足之處。實驗結果僅限于建模后3個月,未設置多個時間點進行研究,不清楚FTY720對不同病程、不同病變程度的糖尿病大鼠白細胞粘附和BRB的影響。糖尿病模型剛建成后即開始給予FTY720干預,并在整個飼養過程中持續進行,故不能明確FTY720的遠期療效。FTY720保護糖尿病大鼠BRB的具體機制仍不明確,將進一步在體外實驗中進行探討。另外,FTY720是一種免疫抑制劑,其長期用藥的安全性及肝腎毒性需要進一步評估。
炎癥在糖尿病視網膜病變(DR)發生發展過程中起重要作用[1]。DR早期,粘附分子表達增加引起視網膜血管內白細胞粘附增加,形成局部炎癥環境;進而導致白細胞瘀滯,介導內皮細胞損傷及死亡、血視網膜屏障(BRB)破壞和毛細血管阻塞[2]。最終導致視網膜毛細血管無灌注、視網膜缺血缺氧,誘導病理性新生血管形成,病變進展到增生期。研究表明,抑制粘附因子表達可以明顯降低白細胞瘀滯和BRB破壞[3],從而延緩DR進展。FTY720是一種新型免疫調節劑,可以下調炎癥誘導的粘附分子表達,減少炎性細胞與內皮粘附以及繼發的炎性滲出[4]。但FTY720是否可以減輕DR視網膜白細胞瘀滯,保護BRB目前尚不明確。為此,我們觀察了FTY720對糖尿病大鼠視網膜血管內白細胞粘附和血管通透性的影響,探討FTY720對DR發生過程中炎癥損傷的干預作用并初步探討其相關機制。現將結果報道如下。
1 材料和方法
雄性Wistar大鼠90只,鼠齡12~14周,體重220~250 g,天津醫科大學動物中心提供。均飼養于標準化動物中心且無特定病原體級動物房,自由飲水攝食。將大鼠隨機分為正常對照組、糖尿病組及FTY720組,每組30只。正常對照組大鼠不作任何處理。糖尿病組及FTY720組大鼠適應性飼養5 d后,采用腹腔注射鏈脲佐菌素(STZ)的方法建立糖尿病模型[5]。注射后48 h檢測兩組大鼠空腹血糖,連續3次大于16.7 mmol/L為建模成功[6]。建模成功后,糖尿病組大鼠不干預。FTY720組大鼠以0.3 mg/kg的劑量灌胃給予FTY720,1次/d,連續3個月[7]。于FTY720組大鼠干預后1、2、3個月,檢測各組大鼠體重和血糖變化。于FTY720組大鼠干預后3個月,各組大鼠均取材用于相關實驗。
各組取7只大鼠麻醉后處死,摘除眼球,制作石蠟切片。采用蘇木精-伊紅(HE)染色觀察大鼠視網膜組織病理學改變。采用抗大鼠細胞間粘附分子1(ICAM-1)、血管細胞粘附分子1(VCAM-1)抗體進行石蠟切片免疫組織化學染色,觀察視網膜各層ICAM-1和VCAM-1表達。采用雙盲法,由兩名病理醫師獨立計數ICAM-1和VCAM- 1的陽性細胞數。每組選取10張切片,每張切片計數5個40倍視野。
各組取5只大鼠麻醉后處死,采用Trizol法提取視網膜總RNA,并用紫外線分光光度計檢測RNA濃度。逆轉錄合成cDNA后,采用SYBR熒光法進行逆轉錄聚合酶鏈反應(RT-PCR)反應。引物由生工生物工程(上海)股份有限公司設計并合成。ICAM-1:上游引物5′-GCCTGGGGTTGGAGACTAAC-3′,下游引物5′-CTCGCTCTGGGAACGAATACA-3′,擴增片段長度為174堿基對(bp);VCAM-1:上游引物5′-GGAAATGCCACCCTCACCTT-3′,下游引物5′-AACAGTAAATGGTTTCTCTTGAACA-3′,擴增片段長度132 bp;β肌動蛋白(β-actin):上游引物5′-CCCATCTTAGAGGGTTACGC-3′,下游引物5′-TTTAATGTCACGCACGATTTC-3′,擴增片段長度150bp。采用2-ΔΔCT法計算目的基因相對表達量。
參照文獻[8]的方法檢測大鼠視網膜血管內白細胞粘附情況。各組取5只大鼠麻醉后,打開胸腔,從左心室插入20G灌注針頭至主動脈并固定。灌注磷酸鹽緩沖液(PBS)沖去血管中紅細胞和未粘附的白細胞,灌注40 g/ml的異硫氰酸熒光素標記的刀豆素蛋 白(FITC-ConA)30 ml,循環5 min以標記視網膜血管及粘附的白細胞,再用PBS將血管中多余的FITC-ConA 去除。灌注完成后,摘除眼球浸入4%多聚甲醛中固定2 h。分離視網膜鋪片,在共聚焦熒光顯微鏡下觀察視網膜血管內白細胞粘附情況,并由同一研究者計數。從視盤處開始計數,沿著12點方向的大血管及其分支走向進行直至視網膜周邊部,然后再按順時針方向逐個血管計數,結果以每個視網膜中粘附的總白細胞數表示。
各組取8只大鼠麻醉后,以45 mg/kg的劑量尾靜脈注射3%伊凡思藍(EB)。循環2 h后處死大鼠,摘除眼球浸入4%多聚甲醛中固定2 h。分離視網膜鋪片,在共聚焦熒光顯微鏡下觀察視網膜血管EB滲漏情況。參照文獻[9]的方法進行EB滲漏定量檢測。分別測量樣品在620、740 nm處的吸光度[A,舊稱光密度(OD)]值,兩者之差即為凈A值。建立EB染料濃度在甲酰胺中的標準曲線。根據EB濃度與凈A值的關系計算實際溶液中EB濃度,乘以120 μl即為EB滲漏量。最后用視網膜干重(mg)標化EB滲漏量(ng),結果表示為ng/mg。
各組取5只大鼠麻醉后處死,摘除眼球,制作冰凍切片。采用抗大鼠CD45、CD11b和CD3抗體進行冰凍切片免疫熒光染色,熒光顯微鏡下觀察大鼠視網膜各層全部炎性細胞、巨噬細胞和(或)活化的小膠質細胞、T淋巴細胞的浸潤情況。
采用SPSS 17.0進行統計學分析,數據用均數±標準差(
2 結果
糖尿病組及FTY720組大鼠建模成功率均為100%。干預后1、2、3個月,與正常對照組比較,糖尿病組大鼠體重明顯降低,差異有統計學意義(t=-5.46、 -11.28、-22.38,P<0.05);血糖明顯升高,差異有統計學意義(t=25.96、27.39、22.64,P<0.05)。與正常對照組比較,干預后1個月FTY720組大鼠體重無明顯變化,差異無統計學意義(t=-1.42,P>0.05);干預后2、3個月FTY720組大鼠體重明顯降低,差異有統計學意義(t=-5.06、-8.12,P<0.05);干預后1、2、3個月FTY720組大鼠血糖明顯升高,差異有統計學意義(t=27.46、29.89、26.92,P<0.05)。干預后1、2、3個月,糖尿病組與FTY720組大鼠血糖比較,差異無統計學意義(t=0.17、-1.29、1.24,P>0.05)。
正常對照組大鼠視網膜可見極少量ICAM-1、VCAM-1 陽性細胞(圖 1A,1B)。糖尿病組大鼠視網膜可見大量ICAM-1、VCAM-1陽性細胞,呈深棕色且主要分布于神經節細胞層(圖 1C,1D)。FTY720組大鼠視網膜可見少量ICAM-1、VCAM-1陽性細胞(圖 1E,1F)。3組大鼠視網膜ICAM-1、VCAM-1陽性細胞數比較,差異有統計學意義(F=236.27、46.54,P< 0.05)。組間兩兩比較,糖尿病組大鼠視網膜ICAM-1、 VCAM-1陽性細胞數較正常對照組明顯增加,差異有統計學意義(t=12.81、11.75,P<0.05);FTY720組大鼠視網膜ICAM-1、VCAM-1陽性細胞數較糖尿病組明顯減少,差異有統計學意義(t=-9.93,-6.61、P<0.05)(圖 2)。
 圖1
3組大鼠視網膜光學顯微鏡像。1A.正常對照組ICAM-1;1B.正常對照組VCAM-1。可見極少量ICAM-1、VCAM-1 陽性細胞(黑箭)。1C.糖尿病組ICAM-1;1D.糖尿病組VCAM-1。可見大量ICAM-1、VCAM-1陽性細胞,呈深棕色且主要分布于神經節細胞層(黑箭)。1E.FTY720組ICAM-1;1F.FTY720組VCAM-1。 可見少量ICAM-1、VCAM-1陽性細胞(黑箭) 免疫組織化學 ×20
圖1
3組大鼠視網膜光學顯微鏡像。1A.正常對照組ICAM-1;1B.正常對照組VCAM-1。可見極少量ICAM-1、VCAM-1 陽性細胞(黑箭)。1C.糖尿病組ICAM-1;1D.糖尿病組VCAM-1。可見大量ICAM-1、VCAM-1陽性細胞,呈深棕色且主要分布于神經節細胞層(黑箭)。1E.FTY720組ICAM-1;1F.FTY720組VCAM-1。 可見少量ICAM-1、VCAM-1陽性細胞(黑箭) 免疫組織化學 ×20
 圖2
3組大鼠視網膜ICAM-1、VCAM-1陽性細胞數比較。* 與正常對照組比較,P<0.05;#與糖尿病組比較,P<0.05
圖2
3組大鼠視網膜ICAM-1、VCAM-1陽性細胞數比較。* 與正常對照組比較,P<0.05;#與糖尿病組比較,P<0.05
RT-PCR檢測結果顯示,3組大鼠視網膜中ICAM-1、VCAM-1 mRNA表達比較,差異有統計學意義(F=92.38、69.73,P<0.05)。組間兩兩比較,糖尿病組大鼠視網膜中ICAM-1、VCAM-1 mRNA表達較正常對照組明顯增高,差異有統計學意義(t=16.14、9.59,P<0.05);FTY720組大鼠視網膜中ICAM-1、VCAM-1 mRNA表達較糖尿病組明顯減少,差異有統計學意義(t=-15.28、-6.10,P<0.05)(圖 3)。
 圖3
3組大鼠視網膜中ICAM-1、VCAM-1 mRNA表達比較。* 與正常對照組比較,P<0.05;#與糖尿病組比較,P<0.05
圖3
3組大鼠視網膜中ICAM-1、VCAM-1 mRNA表達比較。* 與正常對照組比較,P<0.05;#與糖尿病組比較,P<0.05
正常對照組大鼠視網膜血管未見明顯的白細胞粘附(圖 4A)。糖尿病組大鼠視網膜血管內可見大量白細胞粘附,且在血管分叉處多見(圖 4B)。FTY720組大鼠視網膜血管內可見少量白細胞粘附(圖 4C)。正常對照組、糖尿病組、FTY720組大鼠視網膜血管內粘附的白細胞計數比較,差異有統計學意義(F=135.24,P<0.05)。組間兩兩比較,糖尿病組大鼠視網膜血管內粘附的白細胞計數較正常對照組明顯增加,差異有統計學意義(t=16.32,P<0.05); FTY720組大鼠視網膜血管內粘附的白細胞計數較糖尿病組明顯減少,差異有統計學意義(t=-9.93,P<0.05)(圖 5)。
 圖4
大鼠視網膜熒光顯微鏡像。4A.正常對照組,視網膜血管內無明顯白細胞粘附;4B.糖尿病組,視網膜血管內大量白細胞粘附且血管分叉處多見(白箭);4C.FTY720組,視網膜血管內少量白細胞粘附(白箭) FITC-ConA ×40 圖 5 3組大鼠視網膜血管內白細胞粘附計數比較。*與正常對照組比較,P<0.05;#與糖尿病組比較,P<0.05。
圖4
大鼠視網膜熒光顯微鏡像。4A.正常對照組,視網膜血管內無明顯白細胞粘附;4B.糖尿病組,視網膜血管內大量白細胞粘附且血管分叉處多見(白箭);4C.FTY720組,視網膜血管內少量白細胞粘附(白箭) FITC-ConA ×40 圖 5 3組大鼠視網膜血管內白細胞粘附計數比較。*與正常對照組比較,P<0.05;#與糖尿病組比較,P<0.05。
正常對照組大鼠視網膜血管未見EB滲漏(圖 6A)。 糖尿病組大鼠視網膜血管可見大量EB滲漏(圖 6B)。FTY720組大鼠視網膜血管可見少量EB滲漏(圖 6C)。正常對照組、糖尿病組、FTY720組大鼠視網膜血管平均EB滲漏量比較,差異有統計學意義(F=163.93,P<0.05)。組間兩兩比較,糖尿病組大鼠視網膜血管平均EB滲漏量較正常對照組明顯增高,差異有統計學意義(t=17.83,P<0.05);FTY720組大鼠視網膜血管平均EB滲漏量較糖尿病組明顯減少,差異有統計學意義(t=-11.82,P<0.05)(圖 7)。
 圖6
大鼠視網膜熒光顯微鏡。6A.正常對照組,視網膜血管無明顯EB滲漏;6B.糖尿病組,視網膜血管大量EB滲漏;6C.FTY720組,視網膜血管少量EB滲漏 ×20 圖 73組大鼠視網膜血管平均EB滲漏量比較。*與正常對照組比較,P<0.05;#與糖尿病組比較,P<0.05
圖6
大鼠視網膜熒光顯微鏡。6A.正常對照組,視網膜血管無明顯EB滲漏;6B.糖尿病組,視網膜血管大量EB滲漏;6C.FTY720組,視網膜血管少量EB滲漏 ×20 圖 73組大鼠視網膜血管平均EB滲漏量比較。*與正常對照組比較,P<0.05;#與糖尿病組比較,P<0.05
正常對照組大鼠視網膜未見炎性細胞浸潤(圖 8A、8B)。糖尿病組大鼠視網膜可見大量CD45陽性的白細胞浸潤(圖 8C),其中CD11b陽性的巨噬細胞和(或)活化的小膠質細胞數量明顯增多(圖 8D)。 FTY720組大鼠視網膜可見少量CD45陽性的白細胞浸潤(圖 8E)以及少量CD11b陽性的巨噬細胞和(或)活化的小膠質細胞(圖 8F)。3組大鼠視網膜中CD3陽性的淋巴細胞浸潤少。
 圖8
3組大鼠視網膜熒光顯微鏡像。8A.正常對照組CD45;8B.正常對照組CD11b。未見CD45、CD11b陽性細胞。8C.糖尿病組CD45;8D.糖尿病組CD11b。可見大量CD45、CD11b陽性細胞(白箭)。8E.FTY720組CD45;8F.FTY720組CD11b。可見少量CD45、CD11b陽性細胞(白箭) ×20
圖8
3組大鼠視網膜熒光顯微鏡像。8A.正常對照組CD45;8B.正常對照組CD11b。未見CD45、CD11b陽性細胞。8C.糖尿病組CD45;8D.糖尿病組CD11b。可見大量CD45、CD11b陽性細胞(白箭)。8E.FTY720組CD45;8F.FTY720組CD11b。可見少量CD45、CD11b陽性細胞(白箭) ×20
3 討論
STZ誘導糖尿病大鼠模型是目前應用最廣泛的造模方法。本研究糖尿病組及FTY720組大鼠血糖均達到16.7 mmol/L,建模成功率100%,且多飲、多食、多尿及體重減輕癥狀明顯。研究表明,0.3 mg/kg的FTY720灌胃給藥可以抑制視網膜炎癥反應并保護BRB[7]。因此,本研究按0.3 mg/kg的劑量給予糖尿病大鼠FTY720灌胃給藥。FTY720通過阻斷免疫細胞入血而抑制胰島炎性細胞浸潤,減少胰島β細胞破壞,發揮降糖作用[10]。本研究結果表明,FTY720組和糖尿病組大鼠于干預后1、2、3個月的血糖均無明顯差異,故可排除FTY720降糖作用對實驗的干擾,研究結果可靠。
目前,多數學者認為DR的發病機制與慢性炎癥反應有關;長期暴露于高血糖環境導致血管內皮細胞活化,表現為細胞表面粘附分子表達增加,介導白細胞 瘀滯[11]。研究表明,DR患者玻璃體及血清中ICAM-1和VCAM-1 的表達顯著升高[12, 13]。與之相似,本研究結果顯示糖尿病組大鼠視網膜ICAM-1和VCAM-1表達明顯增加。粘附分子表達增加可以介導白細胞遷移并粘附于視網膜血管壁,釋放多種促炎性因子、生長因子及血管滲透性因子,最終導致內皮損傷及死亡,BRB 破壞,血管通透性增加并繼發視網膜炎性細胞浸潤。我們還發現,糖尿病大鼠視網膜血管內粘附白細胞數量顯著增加,視網膜血管通透性增強且視網膜中出現明顯的炎性細胞浸潤。ICAM-1基因敲除后可以明顯減輕糖尿病大鼠視網膜白細胞瘀滯和血管損傷[3]。因此,抑制視網膜粘附因子表達,對于減輕白細胞瘀滯,降低BRB破壞具有重要意義。
FTY720是一種新型免疫抑制劑,通過與淋巴細胞表面的S1P受體(S1PR)結合發揮強大的抗炎作用,用于多發性硬化癥(MS)的治療。FTY720還可以與內皮細胞表面的S1PR1/S1PR3直接結合,發揮降低血管通透性的作用。 急性肺損傷模型中,FTY720通過S1PR1信號降低了肺組織血管通透性[14]。近年有研究表明,FTY720通過結合內皮細胞表面的S1PR3,下調ICAM-1和VCAM-1表達,減少白細胞粘附及繼發的炎性細胞浸潤[4]。另外,FTY720通過直接調節內皮細胞表面的S1PR1,抑制白細胞遷移、粘附及穿透血腦屏障[15]。提示FTY720治療MS 的新機制,即通過直接作用與內皮細胞表面S1PR1/S1PR3受下調內皮細胞表面粘附分子表達,直接發揮保護血腦屏障的作用。與此類似,本研究結果顯示,FTY720組大鼠視網膜ICAM-1和VCAM-1表達明顯下降,白細胞粘附減少,視網膜血管滲透性下降且視網膜炎性細胞浸潤減少。提示FTY720可以抑制糖尿病大鼠視網膜炎癥損傷,保護BRB,且與下調視網膜粘附分子表達有關。另有研究表明,FTY720下調粘附分子表達的同時可以上調內皮細胞緊密連接蛋白的表達,并抑制炎癥環境下內皮細胞凋亡,保護血腦屏障[15, 16]。據此我們推測FTY720保護糖尿病大鼠BRB的機制還可能與上調緊密連接蛋白、抑制內皮細胞凋亡的作用有關,但尚需進一步實驗驗證。
本研究結果表明,FTY720可以減輕糖尿病大鼠視網膜白細胞粘附,降低視網膜血管通透性,其機制與下調粘附分子表達有關。但本研究僅為初步探討,尚有許多不足之處。實驗結果僅限于建模后3個月,未設置多個時間點進行研究,不清楚FTY720對不同病程、不同病變程度的糖尿病大鼠白細胞粘附和BRB的影響。糖尿病模型剛建成后即開始給予FTY720干預,并在整個飼養過程中持續進行,故不能明確FTY720的遠期療效。FTY720保護糖尿病大鼠BRB的具體機制仍不明確,將進一步在體外實驗中進行探討。另外,FTY720是一種免疫抑制劑,其長期用藥的安全性及肝腎毒性需要進一步評估。