引用本文: 邵珺, 姚勇. 高糖缺氧環境下轉甲狀腺素蛋白對視網膜血管內皮細胞的影響. 中華眼底病雜志, 2016, 32(2): 159-162. doi: 10.3760/cma.j.issn.1005-1015.2016.02.011 復制
轉甲狀腺素蛋白(TTR)主要由肝臟、脈絡叢、胰腺的內分泌腺以及視網膜色素上皮(RPE)和脈絡膜等分泌[1]。參與甲狀腺素蛋白T4和視黃醇結合蛋白轉運并存在蛋白酶活性及酯酶活性等一些特殊的生物學功能[2, 3]。我們前期觀察發現,正常條件下TTR對視網膜血管內皮細胞(REC)生長有一定作用[4] 。在此基礎上,本研究進一步觀察了高糖缺氧環境下TTR下對REC的影響。現將結果報道如下。
1 材料和方法
人REC(hREC)、人RPE細胞(hRPEC,上海拜力生物科技有限公司);Dulbecco改良Eagle(DMEM)培養基、胎牛血清(FBS)、磷酸鹽緩沖液(PBS,美國生命技術公司);CoCl2(美國Sigma公司);葡萄糖(國藥集團);24孔Transwell培養板(美國 Corning公司);8000 WJ細胞培養箱(美國Thermo Scientific公司);實時無標記細胞功能分析儀(瑞士Roche公司)。
不同培養條件下細胞生長指數檢測。分別于5.5 mmol/L葡萄糖(低糖,LG)、25.0 mmol/L葡萄糖(高糖,HG)以及200 μmol/L CoCl2誘導的缺氧環境[5, 6]中培養hREC、hRPEC。根據培養條件不同,將hREC、hRPEC分為LG組、LG缺氧組、HG組、HG缺氧組。LG組、HG組細胞分別置于含5.5、25.0 mmol/L葡萄糖和10%FBS DEME培養基,37℃,8000 WJ培養箱中培養;LG缺氧組、HG缺氧組DMED培養基中10%FBS更換為200 μmol/L CoCl2,其余培養條件相同。當細胞覆蓋率達到80%~90%,PBS洗滌hREC、hRPEC 2次,0.05%胰蛋白酶消化2~3 min,隨后加入含有5.5 mmol/L葡萄糖的DMEM培養終止胰蛋白酶反應。3000個/孔細胞培養于平板中的5.5 mmol/L葡萄糖DMEM培養基中,過夜培養后,將附周細胞加洗2次,各組細胞200 μl新鮮DMEM基溫育。將更換新鮮DMED培養基時間點設置為0 h,應用實時無標記細胞功能分析儀檢測細胞培養后4、8、16、24、36、48、60、72 h的細胞生長指數。每一時間點均為4組細胞平行培養。
hREC、hRPEC細胞0.05%胰蛋白酶消化2~3 min,隨后加入含有5.5 mmol/L葡萄糖的DMEM培養基終止胰蛋白酶反應。收獲細胞,離心,洗滌后將3000個/孔的細胞培養于平板上。保溫過夜后,將附周細胞洗滌2次,各組細胞均采用200 μl新鮮DMEM培養;培養基中分別加入4 μmol/L的TTR[7],即LG組+TTR、LG缺氧組+TTR、HG組+TTR、HG缺氧組+TTR[7]。檢測細胞培養后4、8、16、24、36、48、60、72 h的細胞生長指數。每一時間點均為4組細胞平行培養。
Transwell共培養體系觀察hRPEC對hREC生長的影響。5.5 mmol/L葡萄糖DEME培養基中制備8000個/50 μl hREC細胞懸液;在可拆卸細胞培養板每孔加入50 μl細胞懸液,室溫放置30 min后置于培養箱中培養和并實時監測;5.5 mmol/L葡萄糖的DEME培養基中制備2000個/50 μl的hRPEC細胞懸液;在接受小室的普通培養板每個孔中加入130 μl 5.5 mmol/L葡萄糖的DMEM培養基,放入小室,并在每個小室中分別加入50 μl hRPEC細胞懸液,再加入10 μl培養基使得液體達到60 μl/孔,將加入小室的培養板放入培養箱培養過夜;hREC和hRPEC培養過夜,培養hREC細胞的培養板取出后吸去培養液,各組分別加入110 μl新鮮培養液;各組細胞從每個小室取出吸去培養基后分別加入60 μl新鮮DMEM基,將含有hRPEC的小室放入與含有hREC的細胞培養板中,放回細胞功能分析儀中繼續培養。檢測細胞共培養后4、8、16、24、36、48 h的細胞生長指數。每一時間點均為4組細胞平行培養。
應用SPSS 22.0統計學軟件進行行統計學分析處理。以單獨培養72 h及共培養48 h為統計分析時間點,比較各組細胞生長指數。方差齊性檢驗<0.05時運用最小顯著法行單因素方差檢驗,方差齊性檢驗>0.05時運用tamhane行單因素方差檢驗。P<0.05為差異有統計學意義。
2 結果
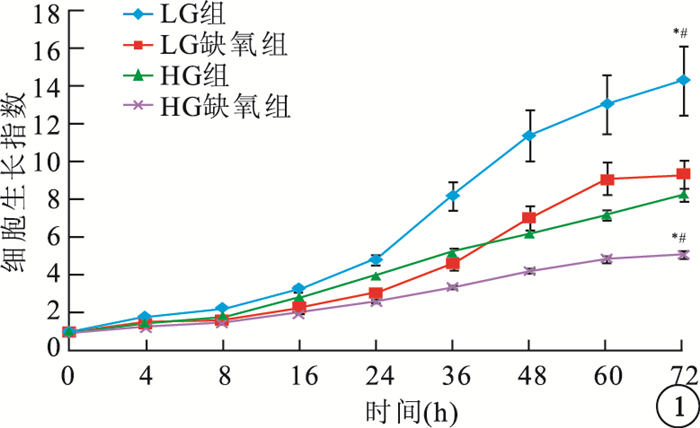
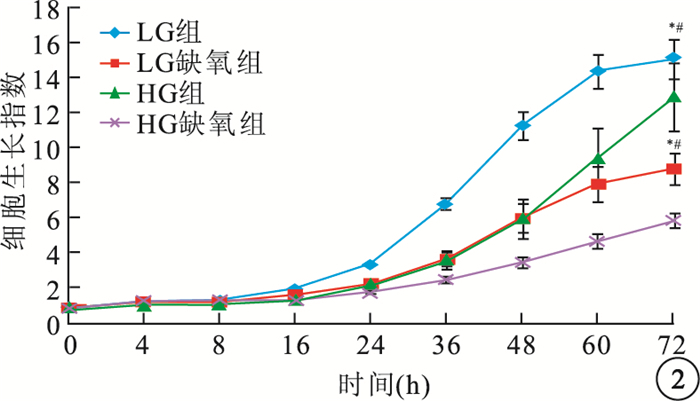
LG組hREC、hRPEC細胞生長指數明顯高于LG缺氧組、HG組,差異均有統計學意義(hREC:F=17.098、22.970,P<0.05;hRPEC:F=45.442、9.011,P<0.05)。HG組、HG缺氧組hREC(F=146.184)、hRPEC(F=27.907)生長受到抑制,生長指數顯著降低,差異均有統計學意義(P<0.05)(圖 1,2)。
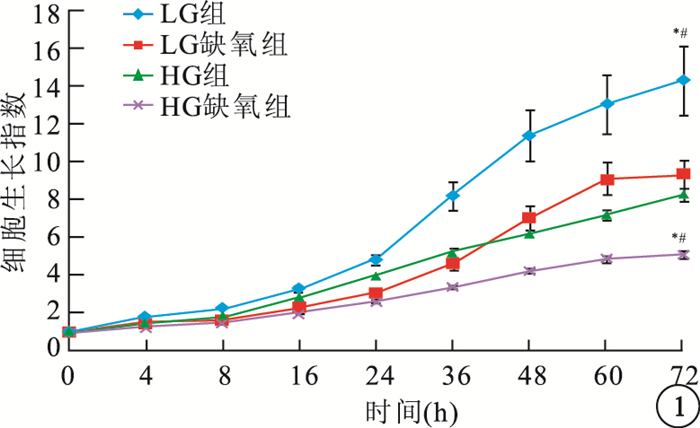 圖1
各組hREC生長情況。*LG組與LG缺氧組比較,P<0.05;#LG組與HG組比較,P<0.05;**HG組與HG缺氧組比較,P<0.05
圖1
各組hREC生長情況。*LG組與LG缺氧組比較,P<0.05;#LG組與HG組比較,P<0.05;**HG組與HG缺氧組比較,P<0.05
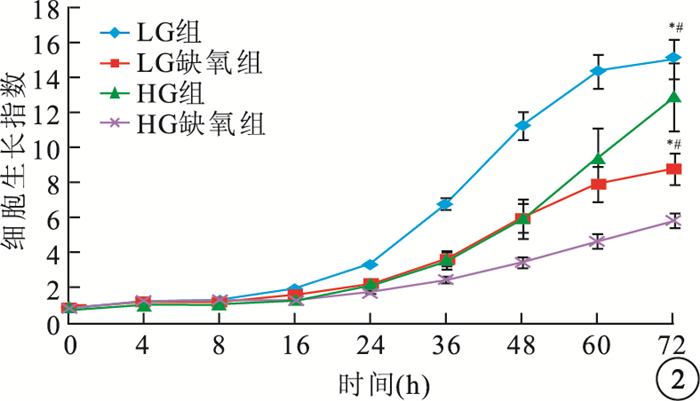 圖2
各組hRPEC生長情況。*LG組與LG缺氧組比較,P<0.05;#LG組與HG組比較,P<0.05;**HG組與HG缺氧組比較,P<0.05
圖2
各組hRPEC生長情況。*LG組與LG缺氧組比較,P<0.05;#LG組與HG組比較,P<0.05;**HG組與HG缺氧組比較,P<0.05
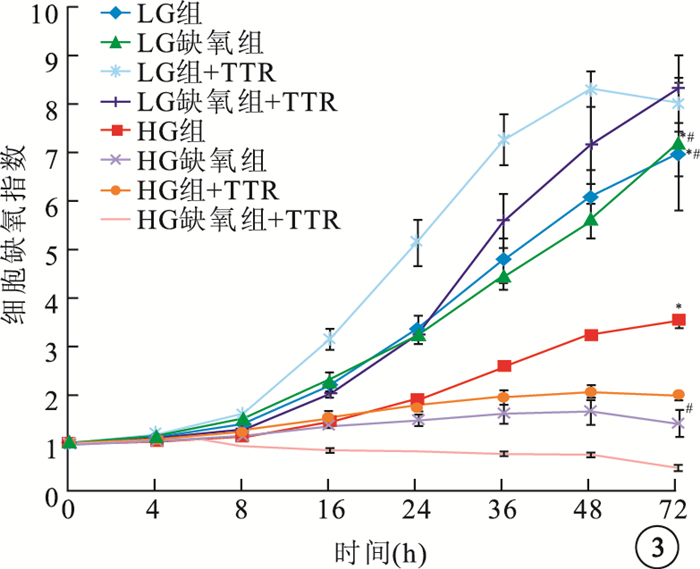
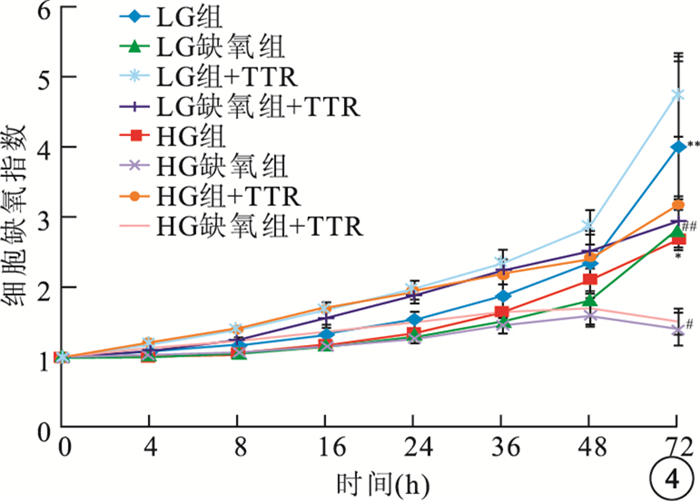
HG組+TTR、HG缺氧組+TTR hREC生長受到抑制,細胞生長指數顯著低于HG組、HG缺氧組,差異有統計學意義(F=161.430、24.106,P<0.05);LG組+TTR、LG缺氧組+TTR hREC細胞生長指數高于LG組、LG缺氧組,差異有統計學意義(F=200.486、48.662,P<0.05)(圖 3)。LG組+TTR、LG缺氧組+TTR、HG組+TTR、HG缺氧組+TTR hRPEC細胞生長指數均較LG組、LG缺氧組、HG組、HG缺氧組的細胞生長指數提高,但差異無統計學意義(HG組:F=0.482,P>0.05;HG缺氧組:F=0.673,P>0.05;LG組:F=0.902,P>0.05; LG缺氧組:F=0.832,P>0.05)(圖 4)。
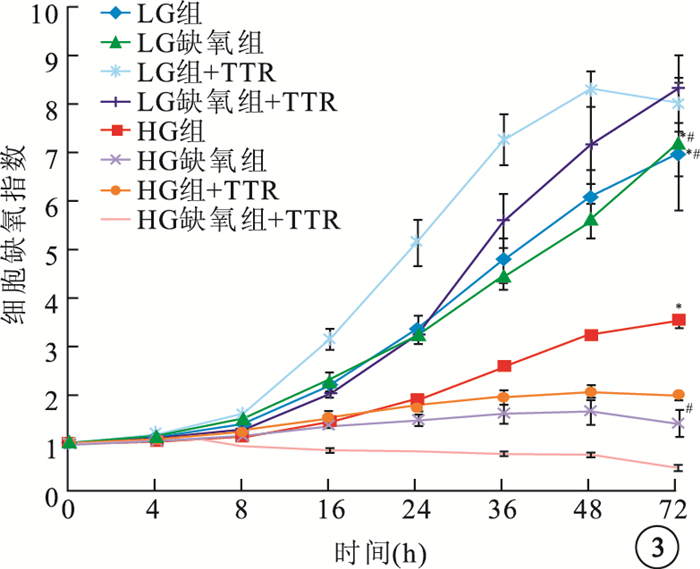 圖3
TTR對各組hREC生長影響。*HG組與HG組+TTR比較,P<0.05;#HG缺氧組與HG缺氧+TTR比較,P<0.05;**LG組與LG組+TTR比較,P<0.05;##LG缺氧組與LG缺氧組+TTR比較, P<0.05
圖3
TTR對各組hREC生長影響。*HG組與HG組+TTR比較,P<0.05;#HG缺氧組與HG缺氧+TTR比較,P<0.05;**LG組與LG組+TTR比較,P<0.05;##LG缺氧組與LG缺氧組+TTR比較, P<0.05
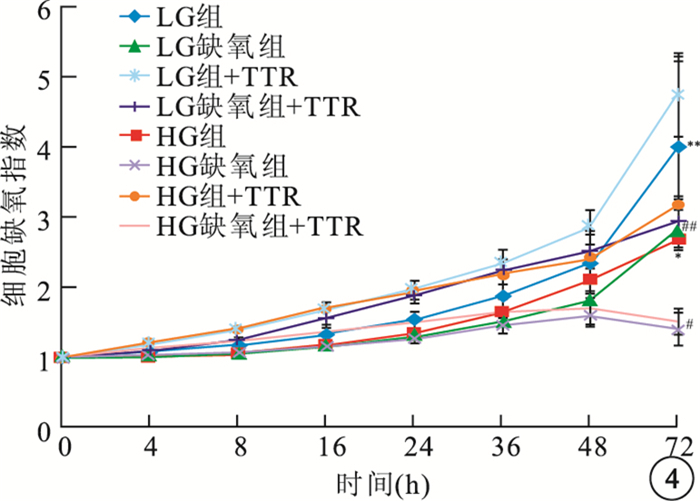 圖4
TTR對各組hRPEC生長影響。*HG組與HG組+TTR比較,P>0.05;#HG缺氧組與HG缺氧組+TTR比較,P>0.05;**LG組與LG組+TTR比較,P>0.05;##LG缺氧組與LG缺氧組+TTR比較,P>0.05
圖4
TTR對各組hRPEC生長影響。*HG組與HG組+TTR比較,P>0.05;#HG缺氧組與HG缺氧組+TTR比較,P>0.05;**LG組與LG組+TTR比較,P>0.05;##LG缺氧組與LG缺氧組+TTR比較,P>0.05
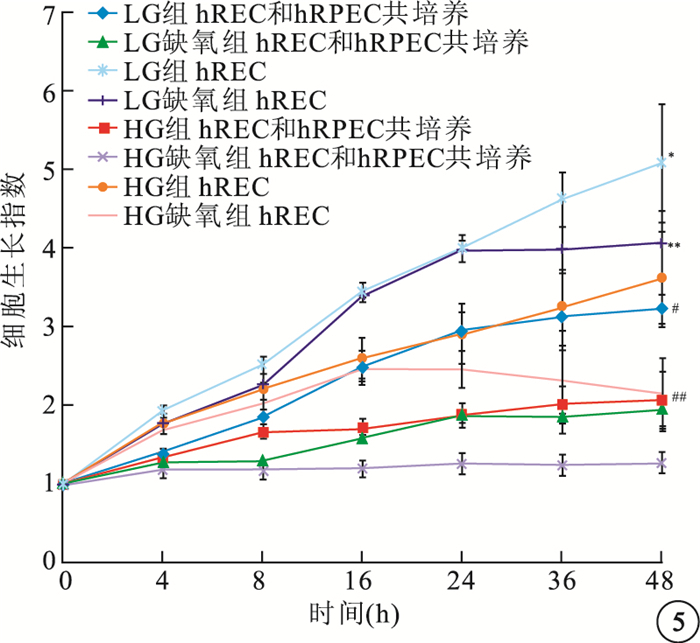
與單獨生長細胞相比,共培養hRPEC對hREC生長有顯著抑制作用,差異有統計學意義(LG組:F=15.711,P<0.05; LG缺氧組:F=45.659,P<0.05;HG,F=7.857,P<0.05;HG缺氧組;F=6.348,P<0.05)(圖 5)。
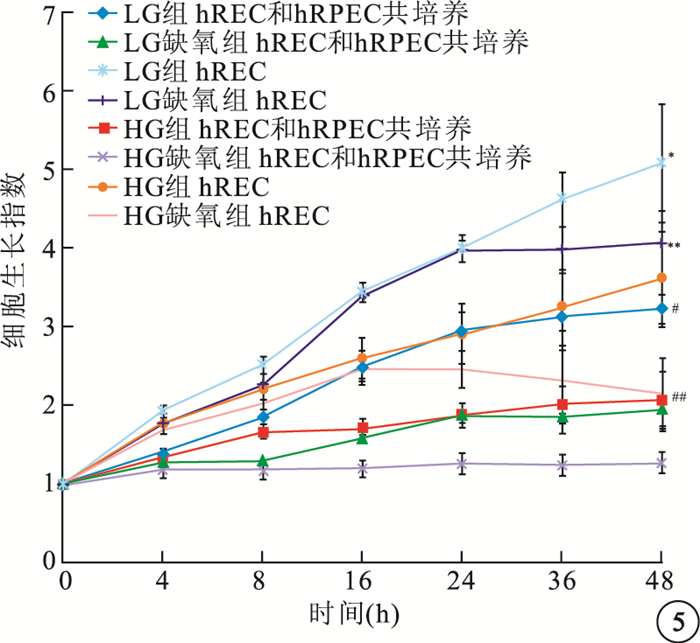 圖5
hRPEC與hREC共培養后細胞生長指數。*LG組hREC與LG組hRPEC比較,P<0.05;#HG組hREC與HG組hRPEC比較,P<0.05;**LG缺氧組hREC與LG缺氧組hRPEC比較,P<0.05;##HG缺氧組hREC與HG缺氧組hRPEC比較,P<0.05
圖5
hRPEC與hREC共培養后細胞生長指數。*LG組hREC與LG組hRPEC比較,P<0.05;#HG組hREC與HG組hRPEC比較,P<0.05;**LG缺氧組hREC與LG缺氧組hRPEC比較,P<0.05;##HG缺氧組hREC與HG缺氧組hRPEC比較,P<0.05
3 討論
本研究設定5.5 mmol/L葡萄糖為正常條件,25.0 mmol/l葡萄糖為異常條件,同時利用200 μmol/L CoCl2誘導細胞達到缺氧條件。結果顯示,在HG缺氧條件下hREC、hRPEC生長均受到顯著抑制。而當加入4 μmol/L的外源性TTR后,LG組及LG缺氧組hREC增生得到顯著提升;HG組及HG缺氧組hREC受到顯著抑制。說明TTR對hREC發揮抑制作用的必要條件是HG;而在LG環境中,缺氧條件并不能引發TTR對hREC的抑制作用。
由于眼部TTR主要由hRPEC表達,為此我們對hREC及hRPEC進行了transwell共培養,解析hRPEC對hREC的影響。結果顯示,TTR對hRPEC的生長略有提升,但差異無統計學意義。而在transwell共培養體系中,hRPEC均能抑制hREC的增生,這和外源性TTR在LG環境中對hREC的促進作用相悖。由于TTR可以由hRPEC分泌,此結果可能與培養過程中TTR的表達量相關。因此,在進一步的實驗中,我們將觀察hRPEC細胞中TTR基因在各種環境中的轉錄水平,以及檢測TTR蛋白在培養液中的實時當量。
我們的前期研究發現,高度近視患者玻璃體內TTR含量大幅增長[8-10],而糖尿病患者體液TTR當量大幅下降[11],即糖尿病患者和高度近視患者體液內的TTR含量變化趨勢相反;此外,也有臨床報道顯示高度近視患者不易發生DR[12, 13]。這些臨床表象的背后,可能存在一些與TTR相關的機制。在我們的進一步研究中,擬在生物功能方面全面探索TTR對細胞信號通路的介入,進一步探索TTR對hREC細胞的作用機制。
轉甲狀腺素蛋白(TTR)主要由肝臟、脈絡叢、胰腺的內分泌腺以及視網膜色素上皮(RPE)和脈絡膜等分泌[1]。參與甲狀腺素蛋白T4和視黃醇結合蛋白轉運并存在蛋白酶活性及酯酶活性等一些特殊的生物學功能[2, 3]。我們前期觀察發現,正常條件下TTR對視網膜血管內皮細胞(REC)生長有一定作用[4] 。在此基礎上,本研究進一步觀察了高糖缺氧環境下TTR下對REC的影響。現將結果報道如下。
1 材料和方法
人REC(hREC)、人RPE細胞(hRPEC,上海拜力生物科技有限公司);Dulbecco改良Eagle(DMEM)培養基、胎牛血清(FBS)、磷酸鹽緩沖液(PBS,美國生命技術公司);CoCl2(美國Sigma公司);葡萄糖(國藥集團);24孔Transwell培養板(美國 Corning公司);8000 WJ細胞培養箱(美國Thermo Scientific公司);實時無標記細胞功能分析儀(瑞士Roche公司)。
不同培養條件下細胞生長指數檢測。分別于5.5 mmol/L葡萄糖(低糖,LG)、25.0 mmol/L葡萄糖(高糖,HG)以及200 μmol/L CoCl2誘導的缺氧環境[5, 6]中培養hREC、hRPEC。根據培養條件不同,將hREC、hRPEC分為LG組、LG缺氧組、HG組、HG缺氧組。LG組、HG組細胞分別置于含5.5、25.0 mmol/L葡萄糖和10%FBS DEME培養基,37℃,8000 WJ培養箱中培養;LG缺氧組、HG缺氧組DMED培養基中10%FBS更換為200 μmol/L CoCl2,其余培養條件相同。當細胞覆蓋率達到80%~90%,PBS洗滌hREC、hRPEC 2次,0.05%胰蛋白酶消化2~3 min,隨后加入含有5.5 mmol/L葡萄糖的DMEM培養終止胰蛋白酶反應。3000個/孔細胞培養于平板中的5.5 mmol/L葡萄糖DMEM培養基中,過夜培養后,將附周細胞加洗2次,各組細胞200 μl新鮮DMEM基溫育。將更換新鮮DMED培養基時間點設置為0 h,應用實時無標記細胞功能分析儀檢測細胞培養后4、8、16、24、36、48、60、72 h的細胞生長指數。每一時間點均為4組細胞平行培養。
hREC、hRPEC細胞0.05%胰蛋白酶消化2~3 min,隨后加入含有5.5 mmol/L葡萄糖的DMEM培養基終止胰蛋白酶反應。收獲細胞,離心,洗滌后將3000個/孔的細胞培養于平板上。保溫過夜后,將附周細胞洗滌2次,各組細胞均采用200 μl新鮮DMEM培養;培養基中分別加入4 μmol/L的TTR[7],即LG組+TTR、LG缺氧組+TTR、HG組+TTR、HG缺氧組+TTR[7]。檢測細胞培養后4、8、16、24、36、48、60、72 h的細胞生長指數。每一時間點均為4組細胞平行培養。
Transwell共培養體系觀察hRPEC對hREC生長的影響。5.5 mmol/L葡萄糖DEME培養基中制備8000個/50 μl hREC細胞懸液;在可拆卸細胞培養板每孔加入50 μl細胞懸液,室溫放置30 min后置于培養箱中培養和并實時監測;5.5 mmol/L葡萄糖的DEME培養基中制備2000個/50 μl的hRPEC細胞懸液;在接受小室的普通培養板每個孔中加入130 μl 5.5 mmol/L葡萄糖的DMEM培養基,放入小室,并在每個小室中分別加入50 μl hRPEC細胞懸液,再加入10 μl培養基使得液體達到60 μl/孔,將加入小室的培養板放入培養箱培養過夜;hREC和hRPEC培養過夜,培養hREC細胞的培養板取出后吸去培養液,各組分別加入110 μl新鮮培養液;各組細胞從每個小室取出吸去培養基后分別加入60 μl新鮮DMEM基,將含有hRPEC的小室放入與含有hREC的細胞培養板中,放回細胞功能分析儀中繼續培養。檢測細胞共培養后4、8、16、24、36、48 h的細胞生長指數。每一時間點均為4組細胞平行培養。
應用SPSS 22.0統計學軟件進行行統計學分析處理。以單獨培養72 h及共培養48 h為統計分析時間點,比較各組細胞生長指數。方差齊性檢驗<0.05時運用最小顯著法行單因素方差檢驗,方差齊性檢驗>0.05時運用tamhane行單因素方差檢驗。P<0.05為差異有統計學意義。
2 結果
LG組hREC、hRPEC細胞生長指數明顯高于LG缺氧組、HG組,差異均有統計學意義(hREC:F=17.098、22.970,P<0.05;hRPEC:F=45.442、9.011,P<0.05)。HG組、HG缺氧組hREC(F=146.184)、hRPEC(F=27.907)生長受到抑制,生長指數顯著降低,差異均有統計學意義(P<0.05)(圖 1,2)。
 圖1
各組hREC生長情況。*LG組與LG缺氧組比較,P<0.05;#LG組與HG組比較,P<0.05;**HG組與HG缺氧組比較,P<0.05
圖1
各組hREC生長情況。*LG組與LG缺氧組比較,P<0.05;#LG組與HG組比較,P<0.05;**HG組與HG缺氧組比較,P<0.05
 圖2
各組hRPEC生長情況。*LG組與LG缺氧組比較,P<0.05;#LG組與HG組比較,P<0.05;**HG組與HG缺氧組比較,P<0.05
圖2
各組hRPEC生長情況。*LG組與LG缺氧組比較,P<0.05;#LG組與HG組比較,P<0.05;**HG組與HG缺氧組比較,P<0.05
HG組+TTR、HG缺氧組+TTR hREC生長受到抑制,細胞生長指數顯著低于HG組、HG缺氧組,差異有統計學意義(F=161.430、24.106,P<0.05);LG組+TTR、LG缺氧組+TTR hREC細胞生長指數高于LG組、LG缺氧組,差異有統計學意義(F=200.486、48.662,P<0.05)(圖 3)。LG組+TTR、LG缺氧組+TTR、HG組+TTR、HG缺氧組+TTR hRPEC細胞生長指數均較LG組、LG缺氧組、HG組、HG缺氧組的細胞生長指數提高,但差異無統計學意義(HG組:F=0.482,P>0.05;HG缺氧組:F=0.673,P>0.05;LG組:F=0.902,P>0.05; LG缺氧組:F=0.832,P>0.05)(圖 4)。
 圖3
TTR對各組hREC生長影響。*HG組與HG組+TTR比較,P<0.05;#HG缺氧組與HG缺氧+TTR比較,P<0.05;**LG組與LG組+TTR比較,P<0.05;##LG缺氧組與LG缺氧組+TTR比較, P<0.05
圖3
TTR對各組hREC生長影響。*HG組與HG組+TTR比較,P<0.05;#HG缺氧組與HG缺氧+TTR比較,P<0.05;**LG組與LG組+TTR比較,P<0.05;##LG缺氧組與LG缺氧組+TTR比較, P<0.05
 圖4
TTR對各組hRPEC生長影響。*HG組與HG組+TTR比較,P>0.05;#HG缺氧組與HG缺氧組+TTR比較,P>0.05;**LG組與LG組+TTR比較,P>0.05;##LG缺氧組與LG缺氧組+TTR比較,P>0.05
圖4
TTR對各組hRPEC生長影響。*HG組與HG組+TTR比較,P>0.05;#HG缺氧組與HG缺氧組+TTR比較,P>0.05;**LG組與LG組+TTR比較,P>0.05;##LG缺氧組與LG缺氧組+TTR比較,P>0.05
與單獨生長細胞相比,共培養hRPEC對hREC生長有顯著抑制作用,差異有統計學意義(LG組:F=15.711,P<0.05; LG缺氧組:F=45.659,P<0.05;HG,F=7.857,P<0.05;HG缺氧組;F=6.348,P<0.05)(圖 5)。
 圖5
hRPEC與hREC共培養后細胞生長指數。*LG組hREC與LG組hRPEC比較,P<0.05;#HG組hREC與HG組hRPEC比較,P<0.05;**LG缺氧組hREC與LG缺氧組hRPEC比較,P<0.05;##HG缺氧組hREC與HG缺氧組hRPEC比較,P<0.05
圖5
hRPEC與hREC共培養后細胞生長指數。*LG組hREC與LG組hRPEC比較,P<0.05;#HG組hREC與HG組hRPEC比較,P<0.05;**LG缺氧組hREC與LG缺氧組hRPEC比較,P<0.05;##HG缺氧組hREC與HG缺氧組hRPEC比較,P<0.05
3 討論
本研究設定5.5 mmol/L葡萄糖為正常條件,25.0 mmol/l葡萄糖為異常條件,同時利用200 μmol/L CoCl2誘導細胞達到缺氧條件。結果顯示,在HG缺氧條件下hREC、hRPEC生長均受到顯著抑制。而當加入4 μmol/L的外源性TTR后,LG組及LG缺氧組hREC增生得到顯著提升;HG組及HG缺氧組hREC受到顯著抑制。說明TTR對hREC發揮抑制作用的必要條件是HG;而在LG環境中,缺氧條件并不能引發TTR對hREC的抑制作用。
由于眼部TTR主要由hRPEC表達,為此我們對hREC及hRPEC進行了transwell共培養,解析hRPEC對hREC的影響。結果顯示,TTR對hRPEC的生長略有提升,但差異無統計學意義。而在transwell共培養體系中,hRPEC均能抑制hREC的增生,這和外源性TTR在LG環境中對hREC的促進作用相悖。由于TTR可以由hRPEC分泌,此結果可能與培養過程中TTR的表達量相關。因此,在進一步的實驗中,我們將觀察hRPEC細胞中TTR基因在各種環境中的轉錄水平,以及檢測TTR蛋白在培養液中的實時當量。
我們的前期研究發現,高度近視患者玻璃體內TTR含量大幅增長[8-10],而糖尿病患者體液TTR當量大幅下降[11],即糖尿病患者和高度近視患者體液內的TTR含量變化趨勢相反;此外,也有臨床報道顯示高度近視患者不易發生DR[12, 13]。這些臨床表象的背后,可能存在一些與TTR相關的機制。在我們的進一步研究中,擬在生物功能方面全面探索TTR對細胞信號通路的介入,進一步探索TTR對hREC細胞的作用機制。