引用本文: 趙立宇, 柯曉云. 視網膜下腔注射視網膜色素上皮細胞對小鼠視網膜色素上皮層的影響. 中華眼底病雜志, 2016, 32(1): 58-61. doi: 10.3760/cma.j.issn.1005-1015.2016.01.014 復制
視網膜色素上皮(RPE)細胞移植有助于修復視網膜損傷及重建功能[1, 2]。目前有細胞懸液移植及片層移植兩種方式[3]。RPE65、斑萎蛋白(Bestrophin)、緊密連接蛋白(ZO)-1及其調控基因在維持RPE細胞的視覺周期、吞噬功能和結構穩定方面有重要作用,其表達的變化可以反映RPE細胞的存活情況[4-6]。為觀察探討RPE細胞移植后的存活情況,為治療視網膜損傷疾病提供新的思路與方法,我們采用外路視網膜下腔注射小鼠RPE細胞移植對氧誘導視網膜病變(OIR)小鼠模型進行干預,觀察了小鼠RPE層的厚度變化以及RPE65、Bestrophin、ZO-1蛋白和mRNA的表達變化。現將結果報道如下。
1 材料和方法
7日齡C57/BL-6J新生小鼠30只(南方醫科大學動物中心)。原代C57/BL-6J小鼠RPE細胞(深圳百恩維生物技術有限公司)。Dulbecco改良Eagle培養基(DMEM)、1%青霉素/鏈霉素(美國Gibco公司);胎牛血清(FBS)、PBS、RPE65、Bestrophin和ZO-1抗體(美國Sigma公司);Trizol試劑(美國Invitrogen公司),SYBRgreenPCR試劑盒(日本Takara公司),實時熒光定量PCR(RT-PCR)檢測儀(RocheLightCycler480,瑞士羅氏制藥),冰凍切片機(德國Leica公司),Hema9600基因擴增儀(珠海黑馬醫學儀器有限公司)。
從液氮中取出冰凍的小鼠RPE細胞凍存管,立即投入37℃水浴中快速旋轉解凍1 min;取出凍存管,酒精棉球擦拭管壁,將細胞轉移至一個預裝有2 ml小鼠RPE細胞培養液(含DMEM、20%FBS及1%青霉素/鏈霉素)的15 ml離心管中混勻,以離心半徑16 cm、1000 r/min離心5 min,吸棄上清液后用4 ml小鼠RPE細胞培養液重懸細胞沉淀,轉移懸浮液至T25瓶中,補加小鼠RPE細胞培養液至6 ml。復蘇后小鼠RPE細胞狀態不穩定,需傳代2次后方可行視網膜下腔移植。當細胞融合度達90%以上時傳代,從培養瓶中吸出舊的小鼠RPE細胞培養液,加入1~2 ml PBS洗滌細胞1次,吸棄PBS溶液,立即加入0.25%胰蛋白酶1 ml溶液到瓶中,輕輕搖晃培養瓶使其可以覆蓋全部細胞。顯微鏡下觀察到細胞變圓,有細胞開始脫離瓶壁時,加入5 ml小鼠RPE細胞培養液停止消化。離心、重懸后按照1:8的比例傳代至新的T25瓶中,輕輕搖勻后放入37℃、CO2培養箱中。小鼠RPE細胞傳代2次后顯微鏡下觀察,當細胞融合度達90%以上時,用0.25%胰蛋白酶1 ml消化,離心重懸細胞后加入1 ml小鼠RPE細胞培養液混勻,制備成濃度約1×106個/ml的小鼠RPE細胞注射液。
采用隨機數字表法將30只7日齡C57BL/6J新生小鼠分成正常組、OIR模型組及OIR模型細胞移植組,每組10只小鼠。OIR模型組及OIR模型細胞移植組參照文獻[7]的方法建立OIR模型:將小鼠與母鼠共同置于氧濃度(75±2)%的氧箱內,箱內溫度(23±2)℃,每天日光照射12 h,飼養5 d后轉移至正常環境中飼養5 d。正常組小鼠與母鼠共同置于密閉箱內,溫度(23±2)℃,每天日光照射12 h,飼養5 d。參照文獻[8]的方法對OIR模型細胞移植組小鼠行外路視網膜下腔移植手術。采用1%戊巴比妥鈉腹腔麻醉小鼠,切開眼球上方結膜少許,暴露鞏膜,用顯微鏟針刺穿前房放出少許房水,在角膜緣后2 mm處用顯微注射器向著眼球后方稍平行鞏膜斜向刺入球壁,注入細胞液約1μl。手術顯微鏡下如清楚看到眼底局部視網膜呈圓形隆起證明注射成功,如不能看到視網膜隆起或看到視網膜有出血則另選小鼠重新注射。OIR模型組小鼠注射1×10-3PBS溶液約1μl。注射完畢時涂紅霉素眼膏以防止感染。OIR模型組、OIR模型細胞移植組分別有8、7只小鼠注射成功。注射20 d后,脊髓脫臼法處死各組小鼠并摘除雙眼眼球備后續實驗。
采用熒光顯微鏡觀察各組小鼠RPE層的厚度。取正常組、OIR模型組、OIR模型細胞移植組各4只小鼠右眼視網膜樣本行視網膜冰凍切片。4%多聚甲醛固定液固定24 h,4℃冷藏及30%蔗糖溶液脫水24 h,OCT膠包埋,冰凍切片機切片,厚度10μm,切片置于濕盒內,加入1:50稀釋的熒光標記RPE65、Bestrophin、ZO-1一抗,4℃過夜,PBS沖洗5 min,加入1:500稀釋的辣根過氧化物酶二抗,室溫孵育2 h,PBS沖洗5 min,4′, 6-二脒基-2-苯基吲哚(DAPI)染核,15 min后漂洗,轉移至載玻片上,避光自然晾干,蓋上蓋玻片熒光顯微鏡下觀察并拍照。
采用蛋白免疫印跡法(Western blot)檢測各組小鼠RPE層RPE65、Bestrophin、ZO-1蛋白相對表達量。取OIR模型組、OIR模型細胞移植組各4只小鼠左眼視網膜樣本,提取蛋白后酶標儀測蛋白濃度。計算含40μg蛋白的溶液體積為上樣量,與蛋白上樣緩沖液混合后100℃加熱5 min使其變性,之后加入十二烷基硫酸鈉聚丙烯酰胺凝膠電泳分離,電轉至硝酸纖維素膜,脫脂封閉后加入1:100稀釋的RPE65、Bestrophin、ZO-1一抗以及1:10 000稀釋的β-肌動蛋白(β-actin)一抗進行免疫雜交,4℃過夜后洗膜,加入1:500稀釋的大鼠抗山羊以及山羊抗兔抗體,室溫下孵育2 h,洗膜10 min,然后進行化學發光,顯影和定影。最后采用Bandscan 5.0軟件分析條帶的吸光度[A,舊稱光密度(OD)]值。目的蛋白相對表達量=目的蛋白A值/內參β-actinA值。
采用RT-PCR檢測各組小鼠RPE層RPE65、Bestrophin、ZO-1mRNA相對表達量。取OIR模型組、OIR模型細胞移植組各3只小鼠雙眼視網膜樣本,Trizol試劑提取總RNA,分光光度計測定A260、A280及其濃度。根據A260/A280的比值鑒定總RNA純度,后每組每個視網膜樣本根據測得的總RNA濃度取2μg總RNA,20μl體系逆轉錄合成cDNA第一鏈,設計引物序列。RPE65:上游引物5′-AGGGCGCCTGCATATCT-3′,下游引物5′-GCCATTTTTGCTGACCTGGA-3′,擴增片段長度156堿基對(bp);Bestrophin:上游引物5′-ACA GGAGCCCACGTTAC-3′,下游引物5′-CTGG TTCCACCATCGGTTCA-3′,擴增片段長度126 bp;ZO-1:上游引物5′-TTCCGGGGAAGTTACGTGC-3′,下游引物5′-AAGTGGGACGTCCGGG-3′,擴增片段長度218 bp;磷酸甘油醛脫氫酶(GAPDH):上游引物5′-AGCCTCCTCCAATTCAACCC-3′,下游引物5′-CGGGACGAGGAAACACTCTC-3′,擴增片段長度533 bp。引物設計合成后用SYBRgreenPCR試劑盒使目的基因和管家基因的擴增效率保持一致,反應完成后得到所有標本的擴增曲線,軟件自動進行數據分析。
采用SPSS 19.0統計學軟件行統計分析。結果數據以均數±標準差(
2 結果
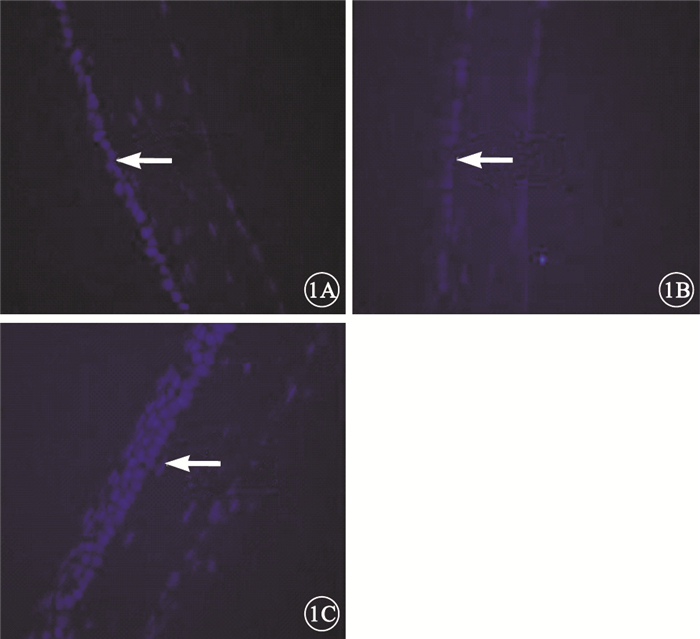
熒光顯微鏡觀察發現,OIR模型組小鼠RPE層較正常組連續性中斷,排列紊亂,部分位置缺失RPE細胞;OIR模型細胞移植組小鼠RPE層較OIR模型組明顯增厚,RPE層細胞排列整齊,細胞存活良好(圖 1)。
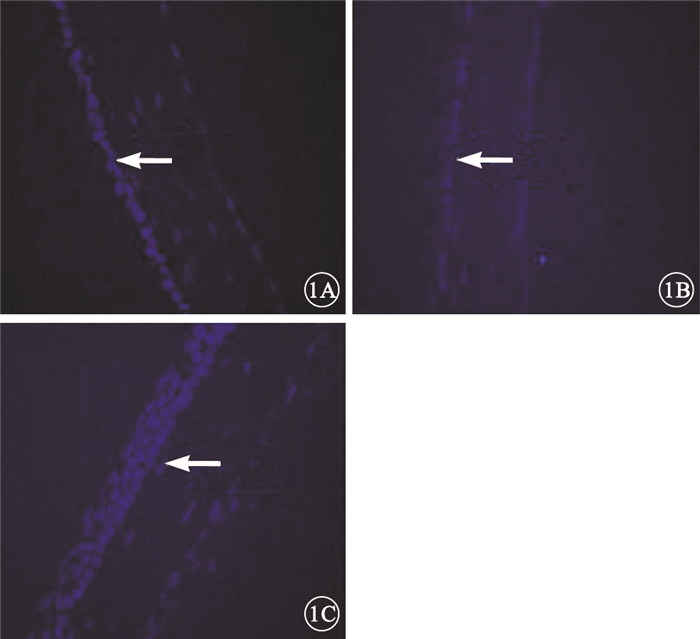 圖1
小鼠視網膜熒光顯微鏡像。1A.正常組,RPE細胞呈單層排列,細胞結構整齊(白箭);1B.OIR模型組,RPE細胞排列連續性中斷,排列紊亂,部分位置缺失RPE細胞;1C.OIR模型細胞移植組,RPE細胞呈雙層或三層生長,細胞排列清晰(白箭),移植細胞存活RPE65抗體染色×400
圖1
小鼠視網膜熒光顯微鏡像。1A.正常組,RPE細胞呈單層排列,細胞結構整齊(白箭);1B.OIR模型組,RPE細胞排列連續性中斷,排列紊亂,部分位置缺失RPE細胞;1C.OIR模型細胞移植組,RPE細胞呈雙層或三層生長,細胞排列清晰(白箭),移植細胞存活RPE65抗體染色×400
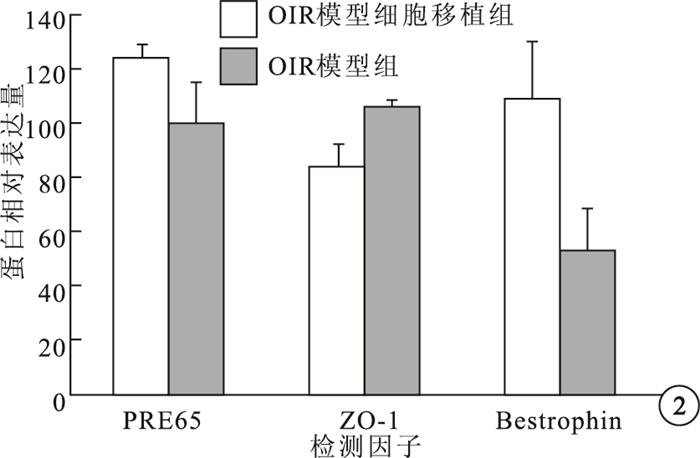
Western blot檢測結果顯示,OIR模型組、OIR模型細胞移植組小鼠RPE層RPE65蛋白相對表達量分別為100.00±15.49、124.00±5.29;Bestrophin蛋白相對表達量分別為52.75±15.39、109.00±20.83;ZO-1蛋白相對表達量分別為106.25±2.63、83.50±8.58。兩組小鼠RPE層的RPE65、Bestrophin、ZO-1蛋白相對表達量比較,差異均有統計學意義(F=8.597、18.864、25.691,P<0.05)(圖 2)。
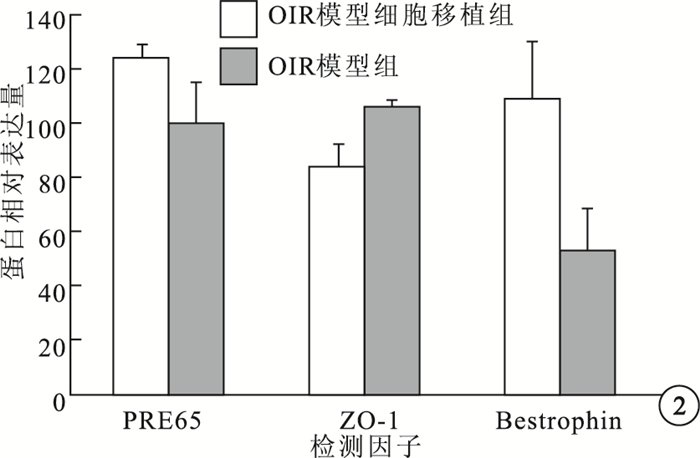 圖2
OIR模型組與OIR模型細胞移植組各因子蛋白相對表達量比較
圖2
OIR模型組與OIR模型細胞移植組各因子蛋白相對表達量比較
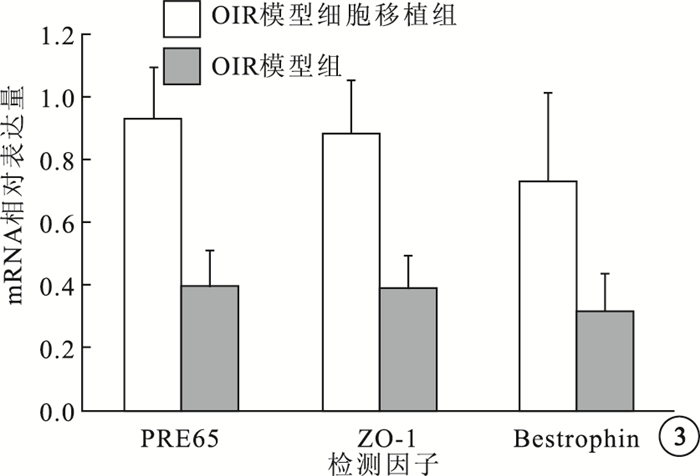
RT-PCR檢測結果顯示,OIR模型組、OIR模型細胞移植組小鼠RPE層RPE65mRNA相對表達量分別為0.393±0.123、0.928±0.169;Bestrophin mRNA相對表達量分別為0.317±0.120、0.735±0.278;ZO-1 mRNA相對表達量分別為0.391±0.103、0.883±0.176。兩組小鼠RPE層的RPE65、Bestrophin、ZO-1 mRNA相對表達量比較,差異均有統計學意義(F=39.458、11.461、34.796,P<0.05)(圖 3)。
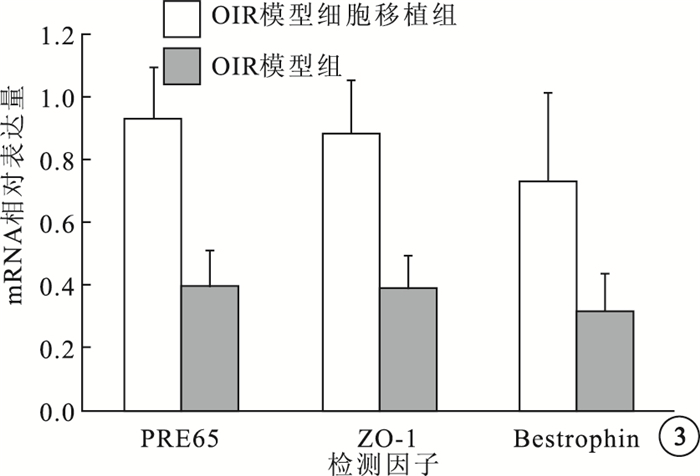 圖3
OIR模型組與OIR模型細胞移植組各因子mRNA相對表達量比較
圖3
OIR模型組與OIR模型細胞移植組各因子mRNA相對表達量比較
3 討論
視網膜下腔是一特殊的免疫赦免區,RPE細胞移植后其免疫排斥反應程度很低,而視網膜移植細胞的生存和功能發揮依賴于適宜的正常生理微環境,準確的注入部位可控制移植細胞在視網膜下腔生長。本研究結果顯示,OIR模型細胞移植組小鼠RPE層較OIR模型組明顯增厚。說明經外路視網膜下腔移植后的RPE細胞可在小鼠原有RPE層上形成另外一層,并未受小鼠免疫排斥反應,移植細胞存活。
在視覺周期中,維生素A的光敏異構體不斷再循環是正常視力產生的重要條件,其中RPE65蛋白及其調控基因在調節維生素A的反式-順式異構化起到關鍵作用[4]。Bestrophin是位于RPE細胞上的膜蛋白,Bestrophin調控細胞內Ca2+動態平衡,從而在調節RPE細胞的吞噬能力方面起重要作用[5]。ZO-1蛋白與RPE細胞屏障功能的完整性有密切關系,RPE細胞間緊密連接構成血視網膜外屏障[6]。以上3種蛋白和其調控基因在維持RPE細胞的視覺周期、吞噬功能和結構穩定方面起到重要作用,其表達的變化可以反映RPE細胞的存活情況[4-6]。我們采用Westernblot檢測發現,與OIR模型組比較,OIR模型細胞移植組小鼠RPE層的RPE65、Bestrophin蛋白相對表達量增高,而ZO-1蛋白相對表達量降低。提示OIR模型細胞移植組小鼠RPE細胞表達了更強的調控維生素A的反式-順式異構化能力及吞噬能力,移植的RPE細胞存活并表達了這兩種生物學功能。Fischer等[9]對缺氧狀態下豬腦分離的血管內皮細胞研究發現,ZO-1的連續性表達在缺氧24 h內被破壞,蛋白含量下降至24%~40%,ZO-1磷酸化增加了2倍。與之相似,本研究發現的OIR模型細胞移植組ZO-1蛋白相對表達量下降可能說明移植的RPE細胞與受體細胞間的緊密連接未完全形成,其原因可能與外路視網膜下腔注射引起的視網膜局部缺血缺氧狀態有關。
我們應用RT-PCR檢測發現,OIR模型細胞移植組RPE65、Bestrophin、ZO-1mRNA相對表達量較OIR模型組明顯增高。說明在基因層面上移植的RPE細胞在維持RPE細胞的視覺周期、吞噬功能和結構穩定方面起到了作用。Fischer等[10]應用ZO-1探針雜交全部RNA,發現缺氧并沒有改變ZO-1的mRNA表達水平;同時Western blot檢測結果顯示ZO-1的總蛋白含量是不變的。結合本研究結果,我們認為小鼠RPE層的局部缺血缺氧狀態可能與腦分離的血管內皮細胞缺血缺氧狀態有相似表現,但今后需要進一步完善實驗數據后才能明確。
本研究通過視網膜下腔注射將小鼠RPE細胞移植入OIR小鼠模型的RPE層,發現視網膜下腔移植RPE細胞可以促進小鼠RPE層的增厚,增強了調控維生素A的反式-順式異構化能力及吞噬能力,而在移植細胞與受體細胞的緊密連接形成中尚有不明確之處。再加上本研究缺乏正常小鼠的RPE65、Bestrophin、ZO-1蛋白和基因表達情況以及細胞移植后小鼠視功能恢復情況的相關數據,有關外路視網膜下腔移植手術對促進RPE層增生的具體作用機制還有待今后進一步完善事實驗數據來探討。
視網膜色素上皮(RPE)細胞移植有助于修復視網膜損傷及重建功能[1, 2]。目前有細胞懸液移植及片層移植兩種方式[3]。RPE65、斑萎蛋白(Bestrophin)、緊密連接蛋白(ZO)-1及其調控基因在維持RPE細胞的視覺周期、吞噬功能和結構穩定方面有重要作用,其表達的變化可以反映RPE細胞的存活情況[4-6]。為觀察探討RPE細胞移植后的存活情況,為治療視網膜損傷疾病提供新的思路與方法,我們采用外路視網膜下腔注射小鼠RPE細胞移植對氧誘導視網膜病變(OIR)小鼠模型進行干預,觀察了小鼠RPE層的厚度變化以及RPE65、Bestrophin、ZO-1蛋白和mRNA的表達變化。現將結果報道如下。
1 材料和方法
7日齡C57/BL-6J新生小鼠30只(南方醫科大學動物中心)。原代C57/BL-6J小鼠RPE細胞(深圳百恩維生物技術有限公司)。Dulbecco改良Eagle培養基(DMEM)、1%青霉素/鏈霉素(美國Gibco公司);胎牛血清(FBS)、PBS、RPE65、Bestrophin和ZO-1抗體(美國Sigma公司);Trizol試劑(美國Invitrogen公司),SYBRgreenPCR試劑盒(日本Takara公司),實時熒光定量PCR(RT-PCR)檢測儀(RocheLightCycler480,瑞士羅氏制藥),冰凍切片機(德國Leica公司),Hema9600基因擴增儀(珠海黑馬醫學儀器有限公司)。
從液氮中取出冰凍的小鼠RPE細胞凍存管,立即投入37℃水浴中快速旋轉解凍1 min;取出凍存管,酒精棉球擦拭管壁,將細胞轉移至一個預裝有2 ml小鼠RPE細胞培養液(含DMEM、20%FBS及1%青霉素/鏈霉素)的15 ml離心管中混勻,以離心半徑16 cm、1000 r/min離心5 min,吸棄上清液后用4 ml小鼠RPE細胞培養液重懸細胞沉淀,轉移懸浮液至T25瓶中,補加小鼠RPE細胞培養液至6 ml。復蘇后小鼠RPE細胞狀態不穩定,需傳代2次后方可行視網膜下腔移植。當細胞融合度達90%以上時傳代,從培養瓶中吸出舊的小鼠RPE細胞培養液,加入1~2 ml PBS洗滌細胞1次,吸棄PBS溶液,立即加入0.25%胰蛋白酶1 ml溶液到瓶中,輕輕搖晃培養瓶使其可以覆蓋全部細胞。顯微鏡下觀察到細胞變圓,有細胞開始脫離瓶壁時,加入5 ml小鼠RPE細胞培養液停止消化。離心、重懸后按照1:8的比例傳代至新的T25瓶中,輕輕搖勻后放入37℃、CO2培養箱中。小鼠RPE細胞傳代2次后顯微鏡下觀察,當細胞融合度達90%以上時,用0.25%胰蛋白酶1 ml消化,離心重懸細胞后加入1 ml小鼠RPE細胞培養液混勻,制備成濃度約1×106個/ml的小鼠RPE細胞注射液。
采用隨機數字表法將30只7日齡C57BL/6J新生小鼠分成正常組、OIR模型組及OIR模型細胞移植組,每組10只小鼠。OIR模型組及OIR模型細胞移植組參照文獻[7]的方法建立OIR模型:將小鼠與母鼠共同置于氧濃度(75±2)%的氧箱內,箱內溫度(23±2)℃,每天日光照射12 h,飼養5 d后轉移至正常環境中飼養5 d。正常組小鼠與母鼠共同置于密閉箱內,溫度(23±2)℃,每天日光照射12 h,飼養5 d。參照文獻[8]的方法對OIR模型細胞移植組小鼠行外路視網膜下腔移植手術。采用1%戊巴比妥鈉腹腔麻醉小鼠,切開眼球上方結膜少許,暴露鞏膜,用顯微鏟針刺穿前房放出少許房水,在角膜緣后2 mm處用顯微注射器向著眼球后方稍平行鞏膜斜向刺入球壁,注入細胞液約1μl。手術顯微鏡下如清楚看到眼底局部視網膜呈圓形隆起證明注射成功,如不能看到視網膜隆起或看到視網膜有出血則另選小鼠重新注射。OIR模型組小鼠注射1×10-3PBS溶液約1μl。注射完畢時涂紅霉素眼膏以防止感染。OIR模型組、OIR模型細胞移植組分別有8、7只小鼠注射成功。注射20 d后,脊髓脫臼法處死各組小鼠并摘除雙眼眼球備后續實驗。
采用熒光顯微鏡觀察各組小鼠RPE層的厚度。取正常組、OIR模型組、OIR模型細胞移植組各4只小鼠右眼視網膜樣本行視網膜冰凍切片。4%多聚甲醛固定液固定24 h,4℃冷藏及30%蔗糖溶液脫水24 h,OCT膠包埋,冰凍切片機切片,厚度10μm,切片置于濕盒內,加入1:50稀釋的熒光標記RPE65、Bestrophin、ZO-1一抗,4℃過夜,PBS沖洗5 min,加入1:500稀釋的辣根過氧化物酶二抗,室溫孵育2 h,PBS沖洗5 min,4′, 6-二脒基-2-苯基吲哚(DAPI)染核,15 min后漂洗,轉移至載玻片上,避光自然晾干,蓋上蓋玻片熒光顯微鏡下觀察并拍照。
采用蛋白免疫印跡法(Western blot)檢測各組小鼠RPE層RPE65、Bestrophin、ZO-1蛋白相對表達量。取OIR模型組、OIR模型細胞移植組各4只小鼠左眼視網膜樣本,提取蛋白后酶標儀測蛋白濃度。計算含40μg蛋白的溶液體積為上樣量,與蛋白上樣緩沖液混合后100℃加熱5 min使其變性,之后加入十二烷基硫酸鈉聚丙烯酰胺凝膠電泳分離,電轉至硝酸纖維素膜,脫脂封閉后加入1:100稀釋的RPE65、Bestrophin、ZO-1一抗以及1:10 000稀釋的β-肌動蛋白(β-actin)一抗進行免疫雜交,4℃過夜后洗膜,加入1:500稀釋的大鼠抗山羊以及山羊抗兔抗體,室溫下孵育2 h,洗膜10 min,然后進行化學發光,顯影和定影。最后采用Bandscan 5.0軟件分析條帶的吸光度[A,舊稱光密度(OD)]值。目的蛋白相對表達量=目的蛋白A值/內參β-actinA值。
采用RT-PCR檢測各組小鼠RPE層RPE65、Bestrophin、ZO-1mRNA相對表達量。取OIR模型組、OIR模型細胞移植組各3只小鼠雙眼視網膜樣本,Trizol試劑提取總RNA,分光光度計測定A260、A280及其濃度。根據A260/A280的比值鑒定總RNA純度,后每組每個視網膜樣本根據測得的總RNA濃度取2μg總RNA,20μl體系逆轉錄合成cDNA第一鏈,設計引物序列。RPE65:上游引物5′-AGGGCGCCTGCATATCT-3′,下游引物5′-GCCATTTTTGCTGACCTGGA-3′,擴增片段長度156堿基對(bp);Bestrophin:上游引物5′-ACA GGAGCCCACGTTAC-3′,下游引物5′-CTGG TTCCACCATCGGTTCA-3′,擴增片段長度126 bp;ZO-1:上游引物5′-TTCCGGGGAAGTTACGTGC-3′,下游引物5′-AAGTGGGACGTCCGGG-3′,擴增片段長度218 bp;磷酸甘油醛脫氫酶(GAPDH):上游引物5′-AGCCTCCTCCAATTCAACCC-3′,下游引物5′-CGGGACGAGGAAACACTCTC-3′,擴增片段長度533 bp。引物設計合成后用SYBRgreenPCR試劑盒使目的基因和管家基因的擴增效率保持一致,反應完成后得到所有標本的擴增曲線,軟件自動進行數據分析。
采用SPSS 19.0統計學軟件行統計分析。結果數據以均數±標準差(
2 結果
熒光顯微鏡觀察發現,OIR模型組小鼠RPE層較正常組連續性中斷,排列紊亂,部分位置缺失RPE細胞;OIR模型細胞移植組小鼠RPE層較OIR模型組明顯增厚,RPE層細胞排列整齊,細胞存活良好(圖 1)。
 圖1
小鼠視網膜熒光顯微鏡像。1A.正常組,RPE細胞呈單層排列,細胞結構整齊(白箭);1B.OIR模型組,RPE細胞排列連續性中斷,排列紊亂,部分位置缺失RPE細胞;1C.OIR模型細胞移植組,RPE細胞呈雙層或三層生長,細胞排列清晰(白箭),移植細胞存活RPE65抗體染色×400
圖1
小鼠視網膜熒光顯微鏡像。1A.正常組,RPE細胞呈單層排列,細胞結構整齊(白箭);1B.OIR模型組,RPE細胞排列連續性中斷,排列紊亂,部分位置缺失RPE細胞;1C.OIR模型細胞移植組,RPE細胞呈雙層或三層生長,細胞排列清晰(白箭),移植細胞存活RPE65抗體染色×400
Western blot檢測結果顯示,OIR模型組、OIR模型細胞移植組小鼠RPE層RPE65蛋白相對表達量分別為100.00±15.49、124.00±5.29;Bestrophin蛋白相對表達量分別為52.75±15.39、109.00±20.83;ZO-1蛋白相對表達量分別為106.25±2.63、83.50±8.58。兩組小鼠RPE層的RPE65、Bestrophin、ZO-1蛋白相對表達量比較,差異均有統計學意義(F=8.597、18.864、25.691,P<0.05)(圖 2)。
 圖2
OIR模型組與OIR模型細胞移植組各因子蛋白相對表達量比較
圖2
OIR模型組與OIR模型細胞移植組各因子蛋白相對表達量比較
RT-PCR檢測結果顯示,OIR模型組、OIR模型細胞移植組小鼠RPE層RPE65mRNA相對表達量分別為0.393±0.123、0.928±0.169;Bestrophin mRNA相對表達量分別為0.317±0.120、0.735±0.278;ZO-1 mRNA相對表達量分別為0.391±0.103、0.883±0.176。兩組小鼠RPE層的RPE65、Bestrophin、ZO-1 mRNA相對表達量比較,差異均有統計學意義(F=39.458、11.461、34.796,P<0.05)(圖 3)。
 圖3
OIR模型組與OIR模型細胞移植組各因子mRNA相對表達量比較
圖3
OIR模型組與OIR模型細胞移植組各因子mRNA相對表達量比較
3 討論
視網膜下腔是一特殊的免疫赦免區,RPE細胞移植后其免疫排斥反應程度很低,而視網膜移植細胞的生存和功能發揮依賴于適宜的正常生理微環境,準確的注入部位可控制移植細胞在視網膜下腔生長。本研究結果顯示,OIR模型細胞移植組小鼠RPE層較OIR模型組明顯增厚。說明經外路視網膜下腔移植后的RPE細胞可在小鼠原有RPE層上形成另外一層,并未受小鼠免疫排斥反應,移植細胞存活。
在視覺周期中,維生素A的光敏異構體不斷再循環是正常視力產生的重要條件,其中RPE65蛋白及其調控基因在調節維生素A的反式-順式異構化起到關鍵作用[4]。Bestrophin是位于RPE細胞上的膜蛋白,Bestrophin調控細胞內Ca2+動態平衡,從而在調節RPE細胞的吞噬能力方面起重要作用[5]。ZO-1蛋白與RPE細胞屏障功能的完整性有密切關系,RPE細胞間緊密連接構成血視網膜外屏障[6]。以上3種蛋白和其調控基因在維持RPE細胞的視覺周期、吞噬功能和結構穩定方面起到重要作用,其表達的變化可以反映RPE細胞的存活情況[4-6]。我們采用Westernblot檢測發現,與OIR模型組比較,OIR模型細胞移植組小鼠RPE層的RPE65、Bestrophin蛋白相對表達量增高,而ZO-1蛋白相對表達量降低。提示OIR模型細胞移植組小鼠RPE細胞表達了更強的調控維生素A的反式-順式異構化能力及吞噬能力,移植的RPE細胞存活并表達了這兩種生物學功能。Fischer等[9]對缺氧狀態下豬腦分離的血管內皮細胞研究發現,ZO-1的連續性表達在缺氧24 h內被破壞,蛋白含量下降至24%~40%,ZO-1磷酸化增加了2倍。與之相似,本研究發現的OIR模型細胞移植組ZO-1蛋白相對表達量下降可能說明移植的RPE細胞與受體細胞間的緊密連接未完全形成,其原因可能與外路視網膜下腔注射引起的視網膜局部缺血缺氧狀態有關。
我們應用RT-PCR檢測發現,OIR模型細胞移植組RPE65、Bestrophin、ZO-1mRNA相對表達量較OIR模型組明顯增高。說明在基因層面上移植的RPE細胞在維持RPE細胞的視覺周期、吞噬功能和結構穩定方面起到了作用。Fischer等[10]應用ZO-1探針雜交全部RNA,發現缺氧并沒有改變ZO-1的mRNA表達水平;同時Western blot檢測結果顯示ZO-1的總蛋白含量是不變的。結合本研究結果,我們認為小鼠RPE層的局部缺血缺氧狀態可能與腦分離的血管內皮細胞缺血缺氧狀態有相似表現,但今后需要進一步完善實驗數據后才能明確。
本研究通過視網膜下腔注射將小鼠RPE細胞移植入OIR小鼠模型的RPE層,發現視網膜下腔移植RPE細胞可以促進小鼠RPE層的增厚,增強了調控維生素A的反式-順式異構化能力及吞噬能力,而在移植細胞與受體細胞的緊密連接形成中尚有不明確之處。再加上本研究缺乏正常小鼠的RPE65、Bestrophin、ZO-1蛋白和基因表達情況以及細胞移植后小鼠視功能恢復情況的相關數據,有關外路視網膜下腔移植手術對促進RPE層增生的具體作用機制還有待今后進一步完善事實驗數據來探討。