脈絡膜新生血管(CNV)形成是新生血管性老年性黃斑變性(nAMD)的主要病理改變。針對CNV發生發展過程中具有重要作用的血管內皮細胞生長因子(VEGF)的各種眼內抗VEGF藥物靶向治療是目前nAMD治療的一線選擇。但如何以更低的治療負擔, 進一步提高抑制CNV的持續有效性, 獲得更好的視功能改善仍然是nAMD藥物治療面臨的挑戰。抗VEGF藥物緩釋裝置以及抗VEGF之外新的治療策略探索是優化改進現有nAMD藥物治療方案的發展趨勢, 為充滿挑戰而任重道遠的nAMD治療研究治療帶來了又一輪曙光。
引用本文: 白玉婧, 黎曉新. 新生血管性老年性黃斑變性藥物治療面臨的挑戰與未來的發展趨勢. 中華眼底病雜志, 2016, 32(1): 3-7. doi: 10.3760/cma.j.issn.1005-1015.2016.01.002 復制
老年性黃斑變性(AMD)是由遺傳和環境因素共同誘發的與年齡相關的一組黃斑疾病。根據患者眼底表現不同,AMD可分為早期和進展期。早期表現為玻璃膜疣;進展期又分干性AMD和濕性AMD。其中,干性AMD以地圖樣萎縮為特征;濕性AMD以脈絡膜新生血管(CNV)為特征,合并液體滲出,所以又稱為新生血管性(nAMD)、滲出型AMD。CNV形成是nAMD的主要病理改變,其CNV又可分為隱匿型CNV、經典為主型CNV。由于CNV的血管壁發育不完整,血管脆性大,極易發生滲出和破裂出血,繼而結締組織增生形成瘢痕,最終導致不可逆性盲的發生[1]。雖然nAMD僅占AMD發病率的20%,但其中90%以上患者視力受損,對視功能危害極大[1-3]。在CNV發生發展過程中,血管內皮生長因子(VEGF)高表達發揮了重要作用。因此,抗VEGF藥物治療成為近年來nAMD治療領域令人矚目的焦點,并取得了一系列突破性進展[4-16]。
1 nAMD治療研究歷程以及治療方案選擇共識
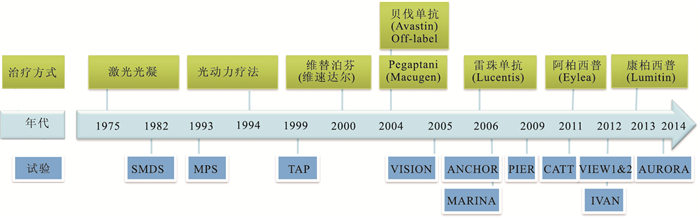
nAMD治療從最初的激光光凝、光動力療法,到目前的抗VEGF藥物治療,經過了30余年的探索。其中,Anti-VEGF Antibody for the Treatment of Predominantly Classic Choroidal Neovascularization in Age-Related Macular Degeneration(ANCHOR)[6]、Comparisons of Age-Related Macular Degeneration Treatments Trials (CATT)[7]、A Randomised Control-led Trial of Alternative Treatments to Inhibit VEGF in Age-Related Choroidal Neovascularisation (IVAN)[8]、 Minimally Classic/Occult Trial of the Anti-VEGF Antibody Ranibizumab in the Treatment of Neovascular Age-Related Macular Degeneration(MARINA)[5]、Macular Photocoagulation Study Group. Laser Photocoagulation of Subfoveal Neovas-cular Lesions of Age-Related Macular Degeneration (MPS)[9]、 Phase Ⅲb,Multi-center,Randomized,Double-Masked,Sham Injection-Controlled Study of Efficacy and Safety of Ranibizumab in Subjects With Subfoveal CNV With or Without Classic CNV Secondary to AMD(PIER)[10]、 Senile Macular Degenera-tion Study(SMDS)[11]、 Treatment of AMD With Photodynamic Therapy (TAP)[12]、 VEGF Inhibition Study in Ocular Neovascularization(VISION)[13]、 Vascular Endothelial Growth Factor Trap-Eye for Neovascular Age-Related Macular Degeneration (VIEW)[14]、Safety and Efficacy of Conbercept in Neovascular Age-Related Macular Degeneration; (AURORA)[15]等經典試驗代表了這一探索歷程(圖 1)。
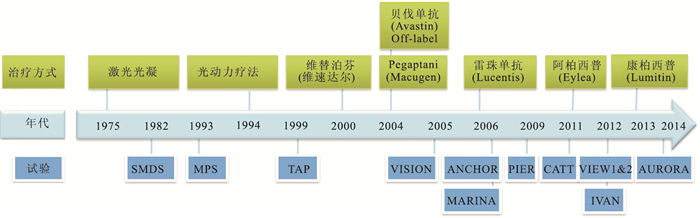 圖1
nAMD治療研究歷程示意圖
圖1
nAMD治療研究歷程示意圖
目前nAMD 治療方案選擇已基本形成共識。無論是隱匿型CNV還是經典為主型CNV,抗VEGF藥物治療已成為一線選擇。不同類型的抗VEGF藥物能靶向阻斷VEGF或VEGF信號通路中的不同環節,抑制VEGF與受體結合后引發的級聯反應,抑制CNV生長及滲漏,維持并一定程度改善視力。進入眼科臨床使用的各種抗VEGF藥物統稱結合VEGF類藥品(VEGF binding agents)。其中,貝伐單抗(商品名Avastin) 是人源化抗VEGF的IgG單克隆抗體;雷珠單抗(商品名Lucentis)作用于VEGF抗體片段;阿柏西普VEGF-Trap Eye(商品名Etlea,艾力亞)和康柏西普KH902(商品名朗沐)是同時結合VEGF受體1和受體2。
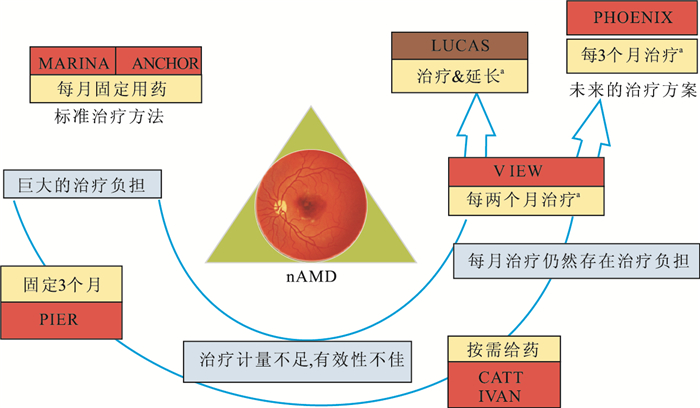
在治療選擇逐漸規范的基礎上,各國學者還對其治療策略進行了探索。其探索的焦點主要集中在每1個月、每2個月、每3個月固定給藥;按需給藥;治療延長等給藥方式[5-7, 9-10, 13-16] (圖 2)。但最佳給藥方式仍需要綜合不同藥物、患者的治療反應等因素個性化考慮。其中,對患者病情密切觀察仍然是判斷是否需要再治療的重要指標。
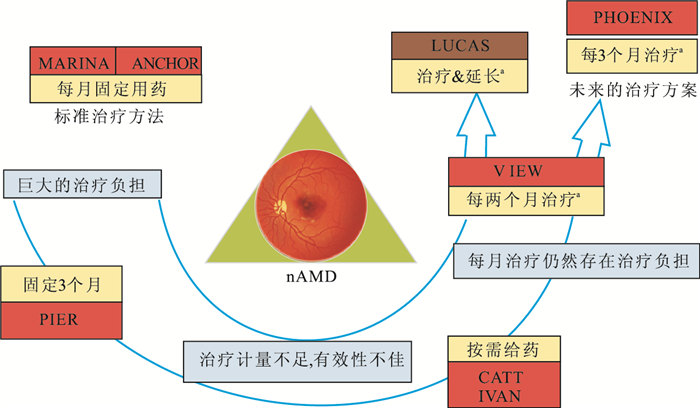 圖2
nAMD治療方案演變示意圖。其中,黃色為治療方案;紅色為試驗名稱。a:為每1個月1次,連續3次抗VEGF藥物的初始治療后
圖2
nAMD治療方案演變示意圖。其中,黃色為治療方案;紅色為試驗名稱。a:為每1個月1次,連續3次抗VEGF藥物的初始治療后
2 抗VEGF藥物治療面臨的挑戰
ANCHOR、CATT、VIEW等經典的臨床研究向醫生和患者展示了良好的治療效果。但在實際應用中,以上治療方案表現如何?英國AMD電子病案記錄系統對入組前未接受任何抗VEGF藥物治療的11 135例患者進行了為期3年的隨訪,統計數據顯示,患者在隨訪1年時,平均注射雷珠單抗5.7次,糖尿病視網膜病變早期治療研究視力表(ETDRS)檢測,平均視力提高2個字母;隨訪2年時,患者平均注射雷珠單抗3.7次,平均視力提高1個ETDRS字母;而隨訪3年時,患者平均注射次數仍然為3.7次,但是視力下降了2個字母[17]。無獨有偶,ANCHOR及MARINA臨床研究隨訪7.3年的數據與基線數據相比,整體最佳矯正視力(BCVA)平均下降8.6個字母。其中,43%的研究眼能夠維持原有視力或提高;34%的研究眼視力丟失≥15個字母[18, 19]。此外,LUMINOUS、AURA、HELIOS等臨床研究的數據也提示,抗VEGF藥物治療在實際使用中,無論是1年期治療結果還是長期療效結果,都不盡如人意[20-24]。
既然抗VEGF藥物治療在現實應用中并未顯現 出令人振奮的如意結果,那么,有哪些因素和問題是目前臨床醫生普遍關注并需要著力改進的呢?依據國際眼科屈光外科學會的調查結果,臨床醫生普遍認為,nAMD治療亟需解決的問題其前五位依次分別為:(1)減少治療費用、治療次數及治療負擔;(2)提高抑制新生血管的有效性;(3)提供長效、持續、緩釋的臨床治療;(4)更好的改善視功能;(5)新的抑制新生血管的治療機制。由此可見,在中國目前的國情下,醫生更需要在療效、經濟和治療間隔等因素之間進行平衡性優化選擇。
3 nAMD治療未來發展趨勢
除了結合VEGF單克隆抗體片段及VEGF受體融合蛋白藥物以外,目前nAMD治療的其他探索包括基因療法,如AVA-101 (rAAV.sFlt-1)[25];放射療法,如黃斑前近距離放射療法(Epimacular brachyth- erapy)、立體定位放射治療(Stereota-ctic Radiotherapy)等[26-28]。除此之外,抗VEGF治療藥物劑型及給藥方式多樣化探索也是研究熱點。其中,包括滴眼劑,如:OHR-102 (Squalamine角鯊胺乳酸鹽滴眼液)[29];口服制劑,如:X-82[30]以及抗VEGF藥物緩釋材料裝置的使用。為減少抗VEGF藥物臨床應用的給藥次數帶來了新的希望[31, 32]。這些新興的治療方法、藥物劑型與給藥方式改進以及研究開發的其他藥物,均有望成為新的治療靶點或是現有抗VEGF藥物治療的有力補充和改進[29-41](表 1)。
在目前對nAMD認識以及藥物臨床治療探索基礎上,眼科醫生逐步開始關注除抗VEGF藥物治療外的其他治療靶點。其中,PDGF在nAMD的發生發展中的作用逐步受到重視。研究發現,抗VEGF藥物治療后,玻璃體及視網膜中的PDGF表達升高,促進了周細胞在新生血管表面的覆蓋,穩定了新生血管,導致抗VEGF藥物治療不敏感。而同時聯合抗VEGF和抗PDGF藥物治療,不但可以抑制內皮細胞形成新生血管,同時還可以抑制新生血管的周細胞成熟,增強對抗VEGF藥物治療的敏感性。即抗PDGF可以輔助抗VEGF臨床療效[31, 34]。其中,口服藥物X-82及眼內注射藥物FOVISTA均是作用于PDGF的靶點,相關臨床試驗結果也顯現出抗PDGF的優勢。即不但可以減少抗VEGF的用藥次數,同時針對抗VEGF藥 物治療不敏感的患者可以維持或提高視力、改善光相干斷層掃描檢查所顯示的視網膜厚度[31, 34]。
玻璃體腔注射抗VEGF藥物有很多種方法可以實現其藥物緩釋。其中,持續釋放的固化植入體是現階段最常用的方法。隨著新技術的研發,更多的藥物緩釋技術將大批量的呈現。其中包括生物降解聚合物,如植入式棒和(或)桿、微米和(或)納米顆粒;脂質為基礎的載體,如多層次脂質體;緩釋系統植入,如可填充式眼內植入泵、脈絡膜持久緩釋微管、微針載體;封裝細胞技術,如NT-503等[29-35]。
無論是國內還是國外,無論是患者、醫生還是藥物研發機構,降低治療負擔、減少眼內注射次數、延長治療間隔、增強療效以及不同給藥方式與機制依然是nAMD治療研究關注的熱點與難點。已有的新藥研究結果盡管分別從不同層面上顯示出一些較好的結果,但更優的治療方案仍需未來更多的探索。nAMD治療研究的道路仍然充滿挑戰而任重道遠。
老年性黃斑變性(AMD)是由遺傳和環境因素共同誘發的與年齡相關的一組黃斑疾病。根據患者眼底表現不同,AMD可分為早期和進展期。早期表現為玻璃膜疣;進展期又分干性AMD和濕性AMD。其中,干性AMD以地圖樣萎縮為特征;濕性AMD以脈絡膜新生血管(CNV)為特征,合并液體滲出,所以又稱為新生血管性(nAMD)、滲出型AMD。CNV形成是nAMD的主要病理改變,其CNV又可分為隱匿型CNV、經典為主型CNV。由于CNV的血管壁發育不完整,血管脆性大,極易發生滲出和破裂出血,繼而結締組織增生形成瘢痕,最終導致不可逆性盲的發生[1]。雖然nAMD僅占AMD發病率的20%,但其中90%以上患者視力受損,對視功能危害極大[1-3]。在CNV發生發展過程中,血管內皮生長因子(VEGF)高表達發揮了重要作用。因此,抗VEGF藥物治療成為近年來nAMD治療領域令人矚目的焦點,并取得了一系列突破性進展[4-16]。
1 nAMD治療研究歷程以及治療方案選擇共識
nAMD治療從最初的激光光凝、光動力療法,到目前的抗VEGF藥物治療,經過了30余年的探索。其中,Anti-VEGF Antibody for the Treatment of Predominantly Classic Choroidal Neovascularization in Age-Related Macular Degeneration(ANCHOR)[6]、Comparisons of Age-Related Macular Degeneration Treatments Trials (CATT)[7]、A Randomised Control-led Trial of Alternative Treatments to Inhibit VEGF in Age-Related Choroidal Neovascularisation (IVAN)[8]、 Minimally Classic/Occult Trial of the Anti-VEGF Antibody Ranibizumab in the Treatment of Neovascular Age-Related Macular Degeneration(MARINA)[5]、Macular Photocoagulation Study Group. Laser Photocoagulation of Subfoveal Neovas-cular Lesions of Age-Related Macular Degeneration (MPS)[9]、 Phase Ⅲb,Multi-center,Randomized,Double-Masked,Sham Injection-Controlled Study of Efficacy and Safety of Ranibizumab in Subjects With Subfoveal CNV With or Without Classic CNV Secondary to AMD(PIER)[10]、 Senile Macular Degenera-tion Study(SMDS)[11]、 Treatment of AMD With Photodynamic Therapy (TAP)[12]、 VEGF Inhibition Study in Ocular Neovascularization(VISION)[13]、 Vascular Endothelial Growth Factor Trap-Eye for Neovascular Age-Related Macular Degeneration (VIEW)[14]、Safety and Efficacy of Conbercept in Neovascular Age-Related Macular Degeneration; (AURORA)[15]等經典試驗代表了這一探索歷程(圖 1)。
 圖1
nAMD治療研究歷程示意圖
圖1
nAMD治療研究歷程示意圖
目前nAMD 治療方案選擇已基本形成共識。無論是隱匿型CNV還是經典為主型CNV,抗VEGF藥物治療已成為一線選擇。不同類型的抗VEGF藥物能靶向阻斷VEGF或VEGF信號通路中的不同環節,抑制VEGF與受體結合后引發的級聯反應,抑制CNV生長及滲漏,維持并一定程度改善視力。進入眼科臨床使用的各種抗VEGF藥物統稱結合VEGF類藥品(VEGF binding agents)。其中,貝伐單抗(商品名Avastin) 是人源化抗VEGF的IgG單克隆抗體;雷珠單抗(商品名Lucentis)作用于VEGF抗體片段;阿柏西普VEGF-Trap Eye(商品名Etlea,艾力亞)和康柏西普KH902(商品名朗沐)是同時結合VEGF受體1和受體2。
在治療選擇逐漸規范的基礎上,各國學者還對其治療策略進行了探索。其探索的焦點主要集中在每1個月、每2個月、每3個月固定給藥;按需給藥;治療延長等給藥方式[5-7, 9-10, 13-16] (圖 2)。但最佳給藥方式仍需要綜合不同藥物、患者的治療反應等因素個性化考慮。其中,對患者病情密切觀察仍然是判斷是否需要再治療的重要指標。
 圖2
nAMD治療方案演變示意圖。其中,黃色為治療方案;紅色為試驗名稱。a:為每1個月1次,連續3次抗VEGF藥物的初始治療后
圖2
nAMD治療方案演變示意圖。其中,黃色為治療方案;紅色為試驗名稱。a:為每1個月1次,連續3次抗VEGF藥物的初始治療后
2 抗VEGF藥物治療面臨的挑戰
ANCHOR、CATT、VIEW等經典的臨床研究向醫生和患者展示了良好的治療效果。但在實際應用中,以上治療方案表現如何?英國AMD電子病案記錄系統對入組前未接受任何抗VEGF藥物治療的11 135例患者進行了為期3年的隨訪,統計數據顯示,患者在隨訪1年時,平均注射雷珠單抗5.7次,糖尿病視網膜病變早期治療研究視力表(ETDRS)檢測,平均視力提高2個字母;隨訪2年時,患者平均注射雷珠單抗3.7次,平均視力提高1個ETDRS字母;而隨訪3年時,患者平均注射次數仍然為3.7次,但是視力下降了2個字母[17]。無獨有偶,ANCHOR及MARINA臨床研究隨訪7.3年的數據與基線數據相比,整體最佳矯正視力(BCVA)平均下降8.6個字母。其中,43%的研究眼能夠維持原有視力或提高;34%的研究眼視力丟失≥15個字母[18, 19]。此外,LUMINOUS、AURA、HELIOS等臨床研究的數據也提示,抗VEGF藥物治療在實際使用中,無論是1年期治療結果還是長期療效結果,都不盡如人意[20-24]。
既然抗VEGF藥物治療在現實應用中并未顯現 出令人振奮的如意結果,那么,有哪些因素和問題是目前臨床醫生普遍關注并需要著力改進的呢?依據國際眼科屈光外科學會的調查結果,臨床醫生普遍認為,nAMD治療亟需解決的問題其前五位依次分別為:(1)減少治療費用、治療次數及治療負擔;(2)提高抑制新生血管的有效性;(3)提供長效、持續、緩釋的臨床治療;(4)更好的改善視功能;(5)新的抑制新生血管的治療機制。由此可見,在中國目前的國情下,醫生更需要在療效、經濟和治療間隔等因素之間進行平衡性優化選擇。
3 nAMD治療未來發展趨勢
除了結合VEGF單克隆抗體片段及VEGF受體融合蛋白藥物以外,目前nAMD治療的其他探索包括基因療法,如AVA-101 (rAAV.sFlt-1)[25];放射療法,如黃斑前近距離放射療法(Epimacular brachyth- erapy)、立體定位放射治療(Stereota-ctic Radiotherapy)等[26-28]。除此之外,抗VEGF治療藥物劑型及給藥方式多樣化探索也是研究熱點。其中,包括滴眼劑,如:OHR-102 (Squalamine角鯊胺乳酸鹽滴眼液)[29];口服制劑,如:X-82[30]以及抗VEGF藥物緩釋材料裝置的使用。為減少抗VEGF藥物臨床應用的給藥次數帶來了新的希望[31, 32]。這些新興的治療方法、藥物劑型與給藥方式改進以及研究開發的其他藥物,均有望成為新的治療靶點或是現有抗VEGF藥物治療的有力補充和改進[29-41](表 1)。
在目前對nAMD認識以及藥物臨床治療探索基礎上,眼科醫生逐步開始關注除抗VEGF藥物治療外的其他治療靶點。其中,PDGF在nAMD的發生發展中的作用逐步受到重視。研究發現,抗VEGF藥物治療后,玻璃體及視網膜中的PDGF表達升高,促進了周細胞在新生血管表面的覆蓋,穩定了新生血管,導致抗VEGF藥物治療不敏感。而同時聯合抗VEGF和抗PDGF藥物治療,不但可以抑制內皮細胞形成新生血管,同時還可以抑制新生血管的周細胞成熟,增強對抗VEGF藥物治療的敏感性。即抗PDGF可以輔助抗VEGF臨床療效[31, 34]。其中,口服藥物X-82及眼內注射藥物FOVISTA均是作用于PDGF的靶點,相關臨床試驗結果也顯現出抗PDGF的優勢。即不但可以減少抗VEGF的用藥次數,同時針對抗VEGF藥 物治療不敏感的患者可以維持或提高視力、改善光相干斷層掃描檢查所顯示的視網膜厚度[31, 34]。
玻璃體腔注射抗VEGF藥物有很多種方法可以實現其藥物緩釋。其中,持續釋放的固化植入體是現階段最常用的方法。隨著新技術的研發,更多的藥物緩釋技術將大批量的呈現。其中包括生物降解聚合物,如植入式棒和(或)桿、微米和(或)納米顆粒;脂質為基礎的載體,如多層次脂質體;緩釋系統植入,如可填充式眼內植入泵、脈絡膜持久緩釋微管、微針載體;封裝細胞技術,如NT-503等[29-35]。
無論是國內還是國外,無論是患者、醫生還是藥物研發機構,降低治療負擔、減少眼內注射次數、延長治療間隔、增強療效以及不同給藥方式與機制依然是nAMD治療研究關注的熱點與難點。已有的新藥研究結果盡管分別從不同層面上顯示出一些較好的結果,但更優的治療方案仍需未來更多的探索。nAMD治療研究的道路仍然充滿挑戰而任重道遠。