引用本文: 楊偉, 張琰, 孫靖, 韓倩, 賈育蓉, 張紅. 腺病毒介導Tum5重組基因對高糖刺激下恒河猴視網膜血管內皮細胞增生、遷移及管腔形成的影響. 中華眼底病雜志, 2015, 31(5): 467-471. doi: 10.3760/cma.j.issn.1005-1015.2015.05.014 復制
腫瘤抑素(Tumstatin)是來源于人基膜的內源性血管抑制因子[1, 2]。全長腫瘤抑素通過抑制血管內皮細胞蛋白合成、促進血管內皮細胞凋亡,發揮抑制新生血管形成的作用[3]。但由于全長腫瘤抑素包含了自身免疫病Goodpasture綜合征的致病抗原Ⅳ型膠原蛋白3鏈NC1結構域,有誘發此病的風險[4]。而位于腫瘤抑素第54~132位序列的Tum5片段是腫瘤抑素抗血管生成的活性片段,與全長腫瘤抑素有著等效的抗血管生成活性,且不包含潛在致病性抗原[5]。基因治療可以將外源性具有較強治療作用的基因片段導入眼內,使其在眼內表達治療基因產物,以達到持久而高效地治療眼內疾病的目的。腺病毒載體擁有裝載外源基因片段容量大、感染能力強、表達效率高、安全性高等優點,作為基因載體已被廣泛的應用于基礎及臨床研究[6-10]。本研究以腺病毒為載體,將重組的Tum5基因感染至高糖狀態下的恒河猴視網膜血管內皮細胞(RF/6A細胞),觀察Tum5肽對高糖狀態下RF/6A細胞增生、移行及管腔形成的影響。現將結果報道如下。
1 材料和方法
RF/6A細胞購自中國科學院典型培養物保藏委員會細胞庫。用含10%胎牛血清(FBS)及1%青霉素、鏈霉素混合液和1‰谷氨酰胺的RPMI 1640培養基,常規培養細胞。FBS(德國PAN公司),RPMI 1640培養液(美國HyClone公司),RNA提取試劑盒(GeneJET RNA Purification Kit,美國Thermo公司)、定量聚合酶鏈反應(Q-PCR)試劑盒、逆轉錄試劑盒(美國Thermo公司),50%葡萄糖注射液(中國大冢制藥有限公司),細胞計數試劑盒(CCK-8,日本Dojindo公司),細胞裂解液、蛋白提取試劑盒、二喹啉甲酸(BCA)試劑盒(中國康為世紀公司),血球凝集素(HA-tag)單克隆抗體(美國Sigma公司),羊抗兔二抗、β-微管蛋白(β-tubulin)抗體(美國Abcom公司),基質膠(Matrigel,美國BD公司),侵襲小室(Transwell)細胞培養板(美國Corning公司)。重組Tum5質粒構建在天津醫科大學第二醫院完成。腺病毒包裝和純化由上海漢恒科技生物公司協助完成。
構建攜帶綠色熒光蛋白的對照空載體病毒(rAd-GFP)和攜帶Tum5基因的重組腺病毒表達載體(rAd-Tum5)。將帶有HA-Tag及分泌型熒光素酶(Gluc)信號肽的原重組Tum5質粒載體(pCMV-Tum5-MCS)進行腺病毒載體構建和包裝(5型腺病毒)。以BamHⅠ、EcoRⅠ為插入位點,從原質粒中酶切含有HA-tag和Gluc信號肽的Tum5基因序列并連接到腺病毒載體中,得到重組Tum5腺病毒過表達載體質粒(pHBAd-MCMV-Tum5-GFP)。將其與腺病毒Admax大骨架(pHBAd-BHG)共同轉染人胚腎細胞(293A細胞)進行病毒擴增,以獲得第3代rAd-GFP和rAd-Tum5。
應用rAd-GFP、rAd-Tum5分別感染RF/6A細胞。常規培養RF/6A細胞,消化離心去上清,用RPMI 1640培養液重懸,調整細胞密度至4×105個/ml。rAd-GFP、rAd-Tum5各設3個復孔,終體積2 ml,接種至6孔板。培養24 h后按1×1010個/ml加入腺病毒20μl,2 h后換液。于感染36 h后在倒置熒光顯微鏡下觀察熒光表達情況,并通過流式細胞儀檢測感染效率。
細胞分成正常對照組、高糖刺激對照組(HG組)、空載體對照組(HG+rAd-GFP組)、Tum5基因組(HG+rAd-Tum5組),接種于6孔板。rAd-GFP、rAd-Tum5分別感染HG+rAd-GFP組、HG +rAd-Tum5組細胞,正常對照組與HG組不處理。24 h后HG組、HG +rAd-GFP組、HG +rAd-Tum5組換用含葡萄糖33 mmol/L、1% FBS的RPMI 1640培養基培養細胞,正常組用含1% FBS的RPMI 1640培養基培養細胞。
采用蛋白免疫印跡法(Western blot)檢測Tum5重組基因體外表達。24 h后提取總蛋白,BCA法測定蛋白濃度。各組取30μg蛋白進行凝膠電泳分離、轉膜、封閉。以β-tubulin為內參抗體,抗HA-Tag一抗4℃孵育過夜,洗膜緩沖液(TBST)洗膜,二抗室溫孵育2 h,TBST洗膜,顯影定影。
采用CCK-8分析Tum5重組基因對高糖刺激下RF/6A細胞增生的抑制作用。細胞轉染24 h后消化細胞并接種于96孔板,8000個/孔,各組按上述條件繼續培養。48 h后每孔加入CCK-8液10μl,分別在37℃孵箱孵育1、2、3 h后,酶標儀檢測450 nm的吸光度[A,舊稱光密度(OD)]值。根據標準曲線計算各組細胞數量。
采用Transwell實驗分析Tum5重組基因對高糖刺激下RF/6A細胞遷移的影響。細胞接種于6孔板培養24 h后分別進行病毒感染,24 h后換用高糖培養液刺激細胞。培養24 h后將刺激細胞以1×105個/孔消化接種于Transwell上層小室中,均用含1% FBS的RPMI 1640培養基培養。HG組、HG+rAd-GFP組、HG+rAd-Tum5組下層放入高糖刺激液,正常對照組下層放入1% FBS培養基,繼續培養24 h后結晶紫染色,計數,拍照。
采用Metrigel實驗分析Tum5對高糖刺激下RF/6A細胞管腔形成的影響。細胞接種,感染病毒,并用高糖培養基刺激。刺激24 h后以5×104個/孔將細胞接種于鋪有Metrigel的24孔板中,6~8 h后觀察管腔形成情況,并拍照。
采用SPSS 17.0統計軟件行統計學分析,計量數據以均數±標準差(
2 結果
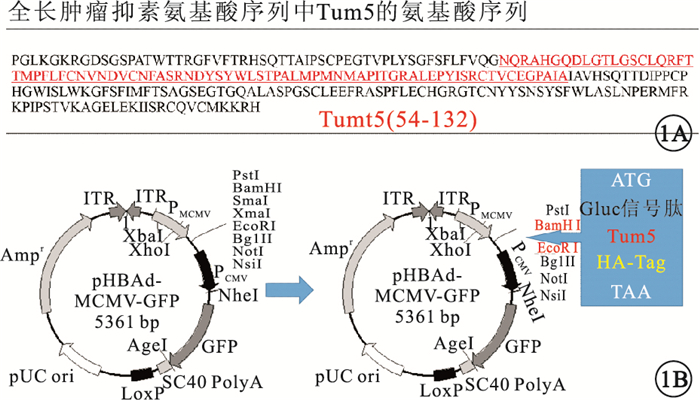
將pHBAd-MCMV-GFP、pHBAd-MCMV-Tum5-GFP分別與pHBAd-BHG腺病毒骨架質粒共同轉染293A細胞進行擴增,最終獲得第3代rAd-GFP與rAd-Tum5(圖 1)。
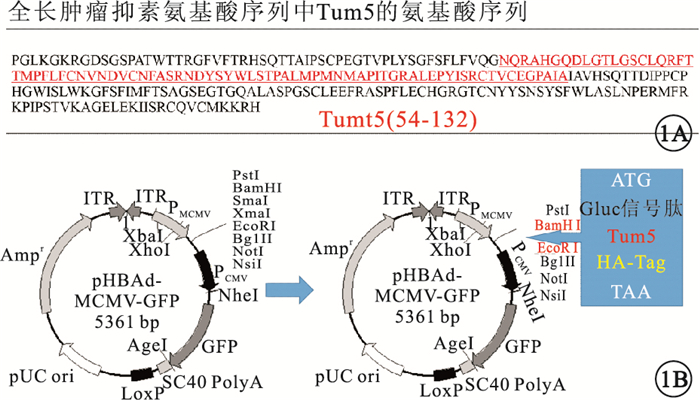 圖1
重組Tum5腺病毒表達載體。1A. Tum5的氨基酸序列(紅色)及其在全長腫瘤抑素中的位置(黑色);1B. rAd-Tum5的結構示意圖qq
圖1
重組Tum5腺病毒表達載體。1A. Tum5的氨基酸序列(紅色)及其在全長腫瘤抑素中的位置(黑色);1B. rAd-Tum5的結構示意圖qq
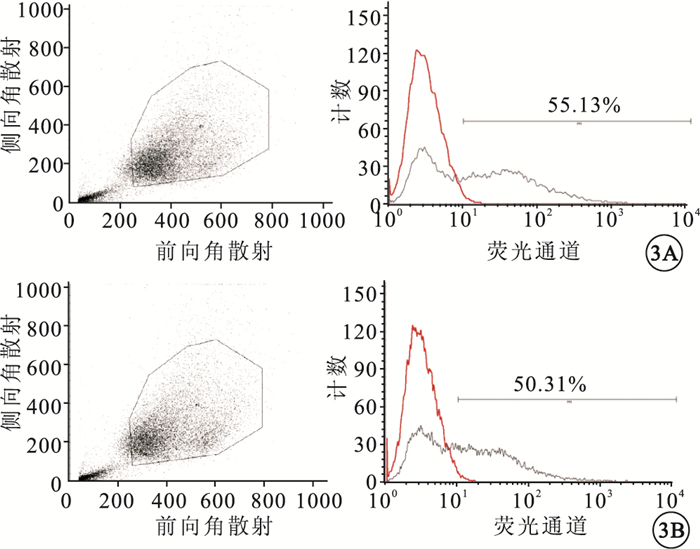
倒置熒光顯微鏡觀察發現,大量被rAd-GFP、rAd-Tum5感染的細胞呈綠色熒光(圖 2)。流式細胞儀檢測結果顯示,rAd-GFP、rAd-Tum5感染細胞的效率分別為55.13%、50.31%(圖 3)。
 圖2
倒置熒光顯微鏡像。2A. rAd-GFP;2B. rAd-Tum5。可見大量被感染的細胞呈綠色熒光標尺:100μm
圖2
倒置熒光顯微鏡像。2A. rAd-GFP;2B. rAd-Tum5。可見大量被感染的細胞呈綠色熒光標尺:100μm
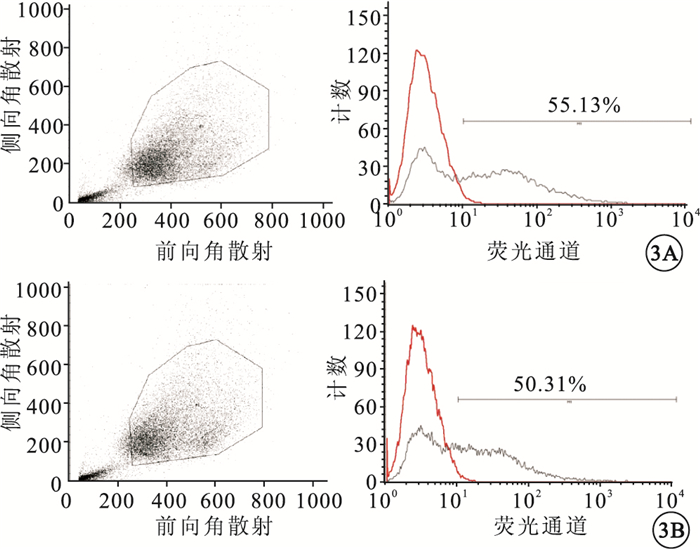 圖3
流式細胞計數結果。3A. rAd-GFP;3B. rAd-Tum5
圖3
流式細胞計數結果。3A. rAd-GFP;3B. rAd-Tum5
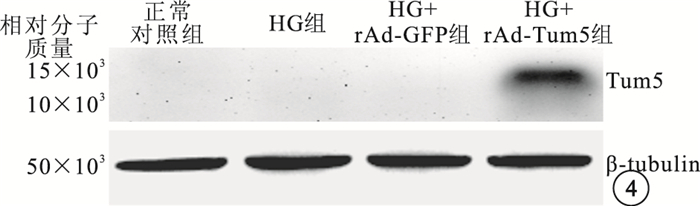
Western blot檢測結果顯示,HG+rAd-Tum5組在相對分子質量14×103左右處可見Tum5蛋白表達條帶;正常對照組、HG組、HG+rAd-GFP組均未見Tum5蛋白表達條帶(圖 4)。
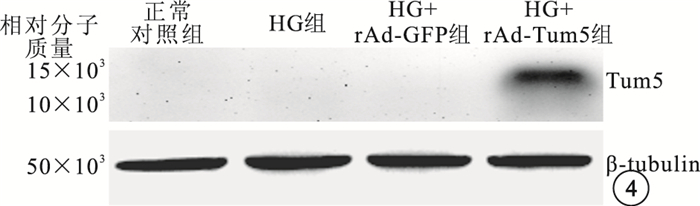 圖4
Western blot檢測像
圖4
Western blot檢測像
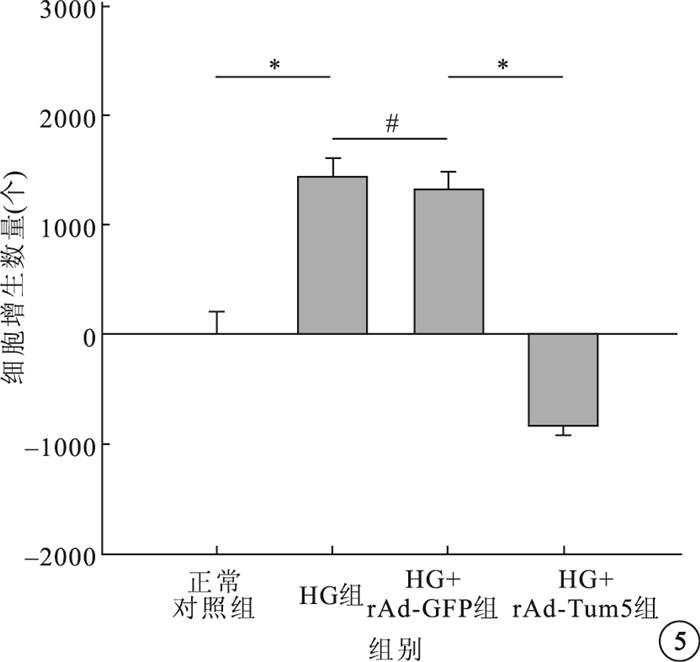
CCK-8分析結果顯示,4組間的細胞增生數量比較,差異有統計學意義(F=44.484,P<0.05)。組間兩兩比較,HG組及HG+rAd-GFP組細胞增生數量均高于正常對照組,差異有統計學意義(P<0.05);HG組與HG+rAd-GFP組細胞增生數量比較,差異無統計學意義(P>0.05);HG+rAd-Tum5組細胞增生數量較HG組、HG+rAd-GFP組明顯減少,差異有統計學意義(P<0.05)(圖 5)。
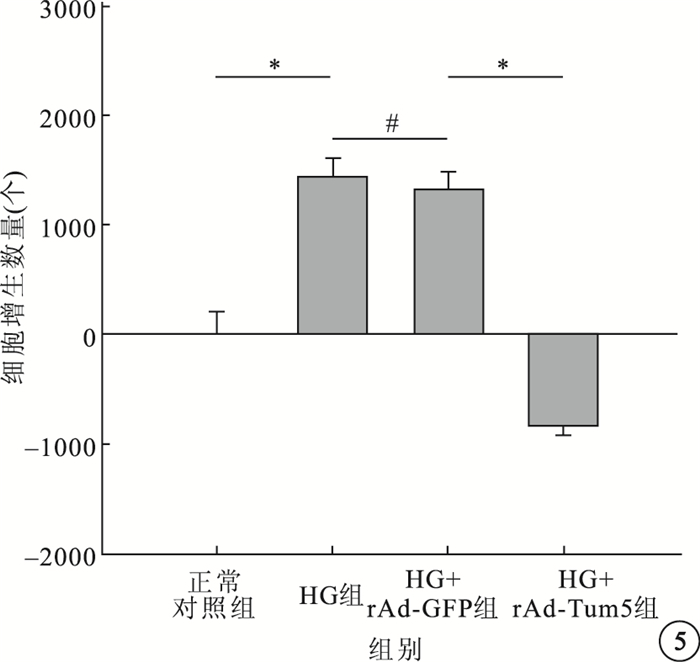 圖5
各組細胞增生數量比較。*P<0.05,#P>0.05
圖5
各組細胞增生數量比較。*P<0.05,#P>0.05
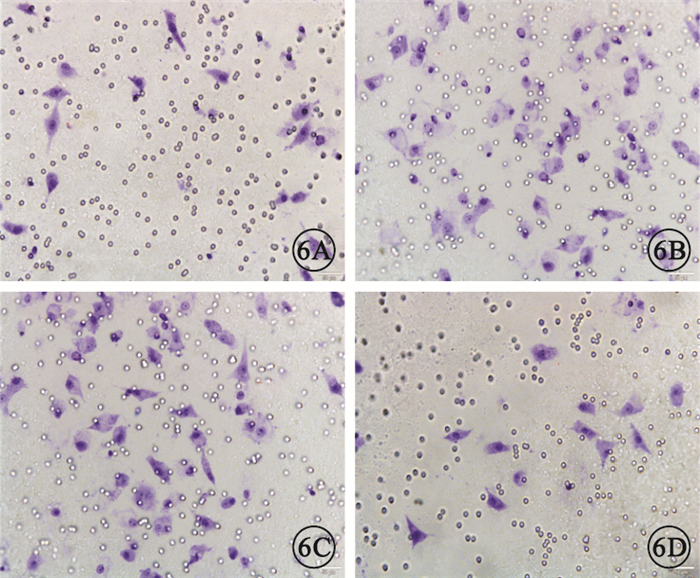
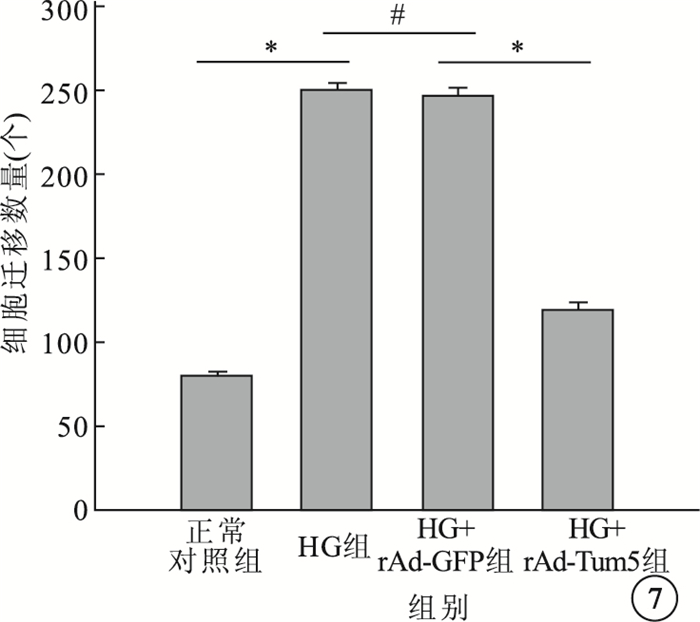
Transwell實驗結果顯示,4組間細胞遷移數量比較,差異有統計學意義(F=772.666,P<0.05)。組間兩兩比較,HG組、HG+rAd-GFP組細胞遷移數量較正常對照組明顯增加,差異有統計學意義(P<0.05);HG組與HG+rAd-GFP組細胞遷移數量比較,差異無統計學意義(P>0.05);HG+rAd-Tum5組細胞遷移數量較HG組、HG+rAd-GFP組明顯減少,差異有統計學意義(P<0.05)(圖 6,7)。
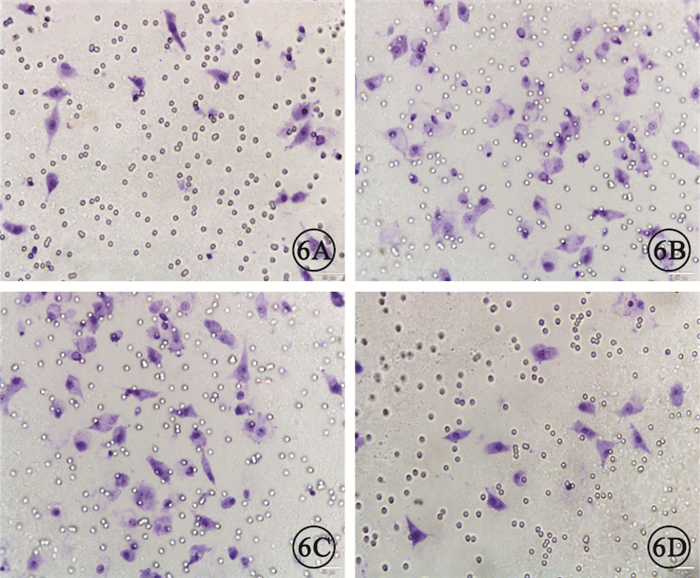 圖6
各組Transwell實驗RF/6A細胞染色像。6A.正常對照組;6B.HG組;6C.HG+rAd-GFP組;6D.HG+rAd-Tum5組。HG組、HG+rAd-GFP組染色細胞數量較正常對照組明顯增加,HG+rAd-Tum5組染色細胞數量較HG組、HG+rAd-GFP組明顯減少結晶紫標尺:50μm
圖6
各組Transwell實驗RF/6A細胞染色像。6A.正常對照組;6B.HG組;6C.HG+rAd-GFP組;6D.HG+rAd-Tum5組。HG組、HG+rAd-GFP組染色細胞數量較正常對照組明顯增加,HG+rAd-Tum5組染色細胞數量較HG組、HG+rAd-GFP組明顯減少結晶紫標尺:50μm
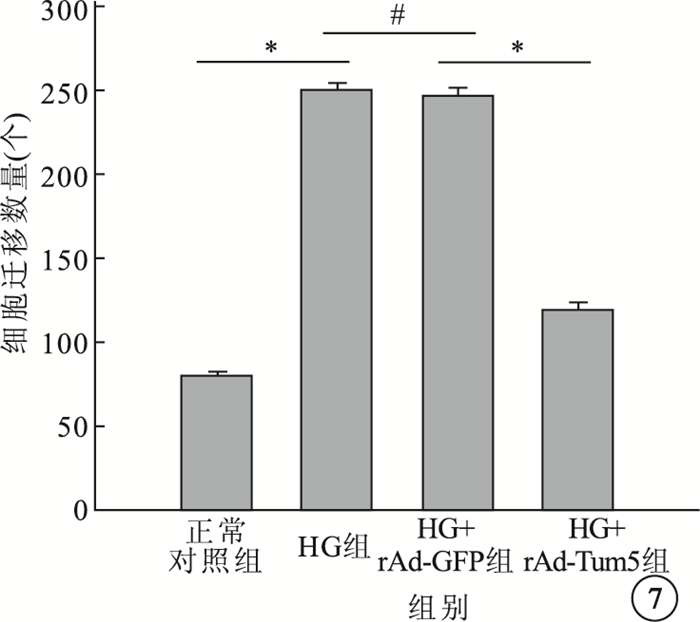 圖7
各組細胞遷移數量比較。*P<0.05,P>0.05
圖7
各組細胞遷移數量比較。*P<0.05,P>0.05
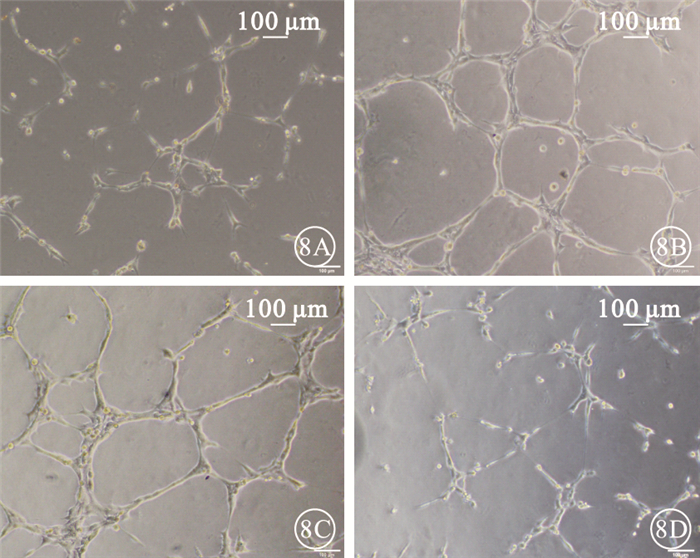
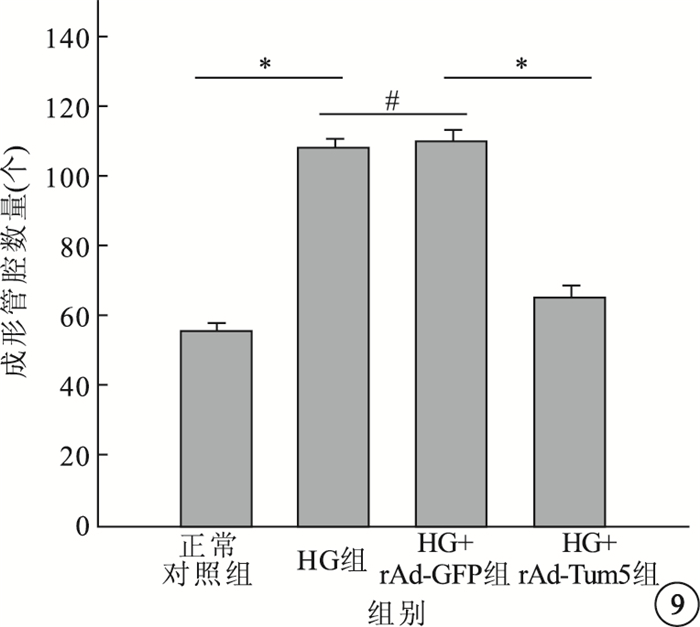
Matrigel實驗結果顯示,4組間成形管腔數量比較,差異有統計學意義(F=137.696,P<0.05)。組間兩兩比較,HG組、HG+rAd-GFP組成形管腔數量明顯高于正常對照組,差異有統計學意義(P<0.05);HG組與HG+rAd-GFP組成形管腔數量比較,差異無統計學意義(P>0.05);HG+rAd-Tum5組成形管腔數量較HG組、HG+rAd-GFP組明顯減少,差異有統計學意義(P<0.05)(圖 8, 9)。
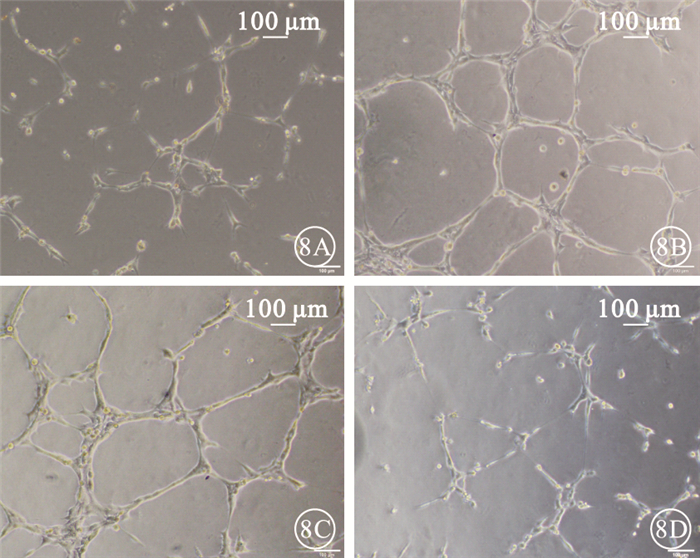 圖8
各組Matrigel實驗像。8A.正常對照組;8B.HG組;8C.HG+rAd-GFP組;8D.HG+rAd-Tum5組。HG組、HG+rAd-GFP組成形管腔數目較正常對照組明顯增加,HG+rAd-Tum5組成形管腔數目較HG組、HG+rAd-GFP組明顯減少標尺:100μm
圖8
各組Matrigel實驗像。8A.正常對照組;8B.HG組;8C.HG+rAd-GFP組;8D.HG+rAd-Tum5組。HG組、HG+rAd-GFP組成形管腔數目較正常對照組明顯增加,HG+rAd-Tum5組成形管腔數目較HG組、HG+rAd-GFP組明顯減少標尺:100μm
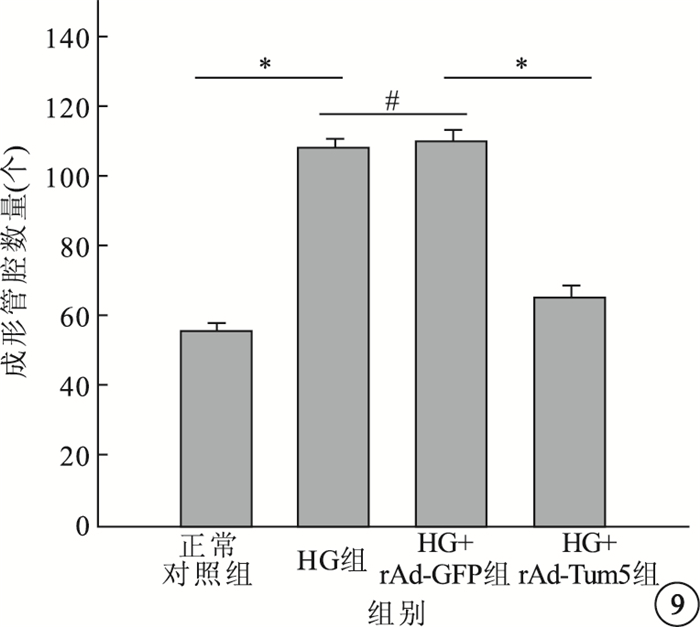 圖9
各組細胞成形管腔數目比較。*P<0.05,#P>0.05
圖9
各組細胞成形管腔數目比較。*P<0.05,#P>0.05
3 討論
腫瘤抑素對新生血管內皮細胞有明顯的抑制增生及促進凋亡的作用,作用強度為內皮抑素的10倍以上[1, 2]。Tum5是全長腫瘤抑素的抗新生血管生成活性片段,同時避免了誘導Goodpasture綜合征的可能。因此,本研究只采用Tum5基因片段,并在Tum5基因序列的前端加入優化的Gluc信號肽片段,以使感染的細胞表達分泌型Tum5肽[11, 12],并以自分泌和旁分泌的形式發揮作用;Tum5基因的后端加上HA-Tag標簽,有利于Tum5基因表達的檢測。本研究以5型腺病毒為載體,將重組的Tum5基因片段導入高糖條件刺激下的RF/6A細胞,通過倒置熒光顯微鏡以及流式細胞儀計數觀察其感染效率。結果顯示,rAd-Tum5與rAd-GFP均具有較高感染效率。說明腺病毒介導rAd-Tum5能夠以較高的效率導入細胞中,有效提高了基因作用的效果。此外,通過Western blot檢測到腺病毒介導的重組Tum5基因可以在高糖刺激下的血管內皮細胞中成功表達。說明重組Tum5基因腺病毒載體構建成功。由此表明Tum5基因能夠被高效的導入高糖刺激下的血管內皮細胞中,并且成功表達。重組Tum5基因載體在宿主細胞內表達,并可以通過Gluc的作用分泌至胞外,作用于自身和其他細胞,增加了導入基因作用的效果,為后續眼內導入基因治療的研究奠定了基礎。
本研究模擬細胞外環境中的高糖狀態,采用高糖培養基刺激RF/6A細胞,并通過腺病毒載體將重組Tum5基因導入RF/6A細胞中。然后分別通過CCK-8、Transwell以及Matrigel實驗觀察到Tum5可以有效抑制高糖刺激下RF/6A細胞的增生、遷移以及管腔成形作用。Maeshima等[1]用提取的Tum5肽觀察其對新生血管的作用,發現Tum5肽呈劑量依賴性的抑制人臍靜脈血管內皮細胞(HUVEC)的管腔形成能力,其作用強度是同劑量內皮抑素的10倍。本研究結果與其相似,但作用效果不如Maeshima等[1]研究結果明顯。可能是因為HUVEC和高糖刺激下的RF/6A細胞存在差異,也可能與感染腺病毒載體的細胞表達Tum5濃度較提純的Tum5濃度低有關,其差異的具體機制還需進一步的研究。許多研究也表明Tum5可以抑制血管內皮細胞管腔形成[13, 14]。此外,Maeshima等[1]通過亞甲藍增生實驗和BrdUrd增生實驗還發現Tum5肽不影響非其增生能力,而對牛肺動脈血管內皮細胞的增生能力有明顯的抑制作用。說明Tum5肽可以抑制血管內皮細胞的增生能力。而本研究結果進一步表明Tum5肽還能夠抑制高糖刺激下視網膜血管內皮細胞的遷移能力。提示Tum5可能能夠抑制糖尿病視網膜新生血管形成。
本研究結果表明,以腺病毒為載體的重組Tum5基因導入高糖刺激的視網膜血管內皮細胞,可以顯著抑制其增生、遷移以及管腔成形。這或許為糖尿病視網膜新生血管的治療提供了新的思路和方向。
腫瘤抑素(Tumstatin)是來源于人基膜的內源性血管抑制因子[1, 2]。全長腫瘤抑素通過抑制血管內皮細胞蛋白合成、促進血管內皮細胞凋亡,發揮抑制新生血管形成的作用[3]。但由于全長腫瘤抑素包含了自身免疫病Goodpasture綜合征的致病抗原Ⅳ型膠原蛋白3鏈NC1結構域,有誘發此病的風險[4]。而位于腫瘤抑素第54~132位序列的Tum5片段是腫瘤抑素抗血管生成的活性片段,與全長腫瘤抑素有著等效的抗血管生成活性,且不包含潛在致病性抗原[5]。基因治療可以將外源性具有較強治療作用的基因片段導入眼內,使其在眼內表達治療基因產物,以達到持久而高效地治療眼內疾病的目的。腺病毒載體擁有裝載外源基因片段容量大、感染能力強、表達效率高、安全性高等優點,作為基因載體已被廣泛的應用于基礎及臨床研究[6-10]。本研究以腺病毒為載體,將重組的Tum5基因感染至高糖狀態下的恒河猴視網膜血管內皮細胞(RF/6A細胞),觀察Tum5肽對高糖狀態下RF/6A細胞增生、移行及管腔形成的影響。現將結果報道如下。
1 材料和方法
RF/6A細胞購自中國科學院典型培養物保藏委員會細胞庫。用含10%胎牛血清(FBS)及1%青霉素、鏈霉素混合液和1‰谷氨酰胺的RPMI 1640培養基,常規培養細胞。FBS(德國PAN公司),RPMI 1640培養液(美國HyClone公司),RNA提取試劑盒(GeneJET RNA Purification Kit,美國Thermo公司)、定量聚合酶鏈反應(Q-PCR)試劑盒、逆轉錄試劑盒(美國Thermo公司),50%葡萄糖注射液(中國大冢制藥有限公司),細胞計數試劑盒(CCK-8,日本Dojindo公司),細胞裂解液、蛋白提取試劑盒、二喹啉甲酸(BCA)試劑盒(中國康為世紀公司),血球凝集素(HA-tag)單克隆抗體(美國Sigma公司),羊抗兔二抗、β-微管蛋白(β-tubulin)抗體(美國Abcom公司),基質膠(Matrigel,美國BD公司),侵襲小室(Transwell)細胞培養板(美國Corning公司)。重組Tum5質粒構建在天津醫科大學第二醫院完成。腺病毒包裝和純化由上海漢恒科技生物公司協助完成。
構建攜帶綠色熒光蛋白的對照空載體病毒(rAd-GFP)和攜帶Tum5基因的重組腺病毒表達載體(rAd-Tum5)。將帶有HA-Tag及分泌型熒光素酶(Gluc)信號肽的原重組Tum5質粒載體(pCMV-Tum5-MCS)進行腺病毒載體構建和包裝(5型腺病毒)。以BamHⅠ、EcoRⅠ為插入位點,從原質粒中酶切含有HA-tag和Gluc信號肽的Tum5基因序列并連接到腺病毒載體中,得到重組Tum5腺病毒過表達載體質粒(pHBAd-MCMV-Tum5-GFP)。將其與腺病毒Admax大骨架(pHBAd-BHG)共同轉染人胚腎細胞(293A細胞)進行病毒擴增,以獲得第3代rAd-GFP和rAd-Tum5。
應用rAd-GFP、rAd-Tum5分別感染RF/6A細胞。常規培養RF/6A細胞,消化離心去上清,用RPMI 1640培養液重懸,調整細胞密度至4×105個/ml。rAd-GFP、rAd-Tum5各設3個復孔,終體積2 ml,接種至6孔板。培養24 h后按1×1010個/ml加入腺病毒20μl,2 h后換液。于感染36 h后在倒置熒光顯微鏡下觀察熒光表達情況,并通過流式細胞儀檢測感染效率。
細胞分成正常對照組、高糖刺激對照組(HG組)、空載體對照組(HG+rAd-GFP組)、Tum5基因組(HG+rAd-Tum5組),接種于6孔板。rAd-GFP、rAd-Tum5分別感染HG+rAd-GFP組、HG +rAd-Tum5組細胞,正常對照組與HG組不處理。24 h后HG組、HG +rAd-GFP組、HG +rAd-Tum5組換用含葡萄糖33 mmol/L、1% FBS的RPMI 1640培養基培養細胞,正常組用含1% FBS的RPMI 1640培養基培養細胞。
采用蛋白免疫印跡法(Western blot)檢測Tum5重組基因體外表達。24 h后提取總蛋白,BCA法測定蛋白濃度。各組取30μg蛋白進行凝膠電泳分離、轉膜、封閉。以β-tubulin為內參抗體,抗HA-Tag一抗4℃孵育過夜,洗膜緩沖液(TBST)洗膜,二抗室溫孵育2 h,TBST洗膜,顯影定影。
采用CCK-8分析Tum5重組基因對高糖刺激下RF/6A細胞增生的抑制作用。細胞轉染24 h后消化細胞并接種于96孔板,8000個/孔,各組按上述條件繼續培養。48 h后每孔加入CCK-8液10μl,分別在37℃孵箱孵育1、2、3 h后,酶標儀檢測450 nm的吸光度[A,舊稱光密度(OD)]值。根據標準曲線計算各組細胞數量。
采用Transwell實驗分析Tum5重組基因對高糖刺激下RF/6A細胞遷移的影響。細胞接種于6孔板培養24 h后分別進行病毒感染,24 h后換用高糖培養液刺激細胞。培養24 h后將刺激細胞以1×105個/孔消化接種于Transwell上層小室中,均用含1% FBS的RPMI 1640培養基培養。HG組、HG+rAd-GFP組、HG+rAd-Tum5組下層放入高糖刺激液,正常對照組下層放入1% FBS培養基,繼續培養24 h后結晶紫染色,計數,拍照。
采用Metrigel實驗分析Tum5對高糖刺激下RF/6A細胞管腔形成的影響。細胞接種,感染病毒,并用高糖培養基刺激。刺激24 h后以5×104個/孔將細胞接種于鋪有Metrigel的24孔板中,6~8 h后觀察管腔形成情況,并拍照。
采用SPSS 17.0統計軟件行統計學分析,計量數據以均數±標準差(
2 結果
將pHBAd-MCMV-GFP、pHBAd-MCMV-Tum5-GFP分別與pHBAd-BHG腺病毒骨架質粒共同轉染293A細胞進行擴增,最終獲得第3代rAd-GFP與rAd-Tum5(圖 1)。
 圖1
重組Tum5腺病毒表達載體。1A. Tum5的氨基酸序列(紅色)及其在全長腫瘤抑素中的位置(黑色);1B. rAd-Tum5的結構示意圖qq
圖1
重組Tum5腺病毒表達載體。1A. Tum5的氨基酸序列(紅色)及其在全長腫瘤抑素中的位置(黑色);1B. rAd-Tum5的結構示意圖qq
倒置熒光顯微鏡觀察發現,大量被rAd-GFP、rAd-Tum5感染的細胞呈綠色熒光(圖 2)。流式細胞儀檢測結果顯示,rAd-GFP、rAd-Tum5感染細胞的效率分別為55.13%、50.31%(圖 3)。
 圖2
倒置熒光顯微鏡像。2A. rAd-GFP;2B. rAd-Tum5。可見大量被感染的細胞呈綠色熒光標尺:100μm
圖2
倒置熒光顯微鏡像。2A. rAd-GFP;2B. rAd-Tum5。可見大量被感染的細胞呈綠色熒光標尺:100μm
 圖3
流式細胞計數結果。3A. rAd-GFP;3B. rAd-Tum5
圖3
流式細胞計數結果。3A. rAd-GFP;3B. rAd-Tum5
Western blot檢測結果顯示,HG+rAd-Tum5組在相對分子質量14×103左右處可見Tum5蛋白表達條帶;正常對照組、HG組、HG+rAd-GFP組均未見Tum5蛋白表達條帶(圖 4)。
 圖4
Western blot檢測像
圖4
Western blot檢測像
CCK-8分析結果顯示,4組間的細胞增生數量比較,差異有統計學意義(F=44.484,P<0.05)。組間兩兩比較,HG組及HG+rAd-GFP組細胞增生數量均高于正常對照組,差異有統計學意義(P<0.05);HG組與HG+rAd-GFP組細胞增生數量比較,差異無統計學意義(P>0.05);HG+rAd-Tum5組細胞增生數量較HG組、HG+rAd-GFP組明顯減少,差異有統計學意義(P<0.05)(圖 5)。
 圖5
各組細胞增生數量比較。*P<0.05,#P>0.05
圖5
各組細胞增生數量比較。*P<0.05,#P>0.05
Transwell實驗結果顯示,4組間細胞遷移數量比較,差異有統計學意義(F=772.666,P<0.05)。組間兩兩比較,HG組、HG+rAd-GFP組細胞遷移數量較正常對照組明顯增加,差異有統計學意義(P<0.05);HG組與HG+rAd-GFP組細胞遷移數量比較,差異無統計學意義(P>0.05);HG+rAd-Tum5組細胞遷移數量較HG組、HG+rAd-GFP組明顯減少,差異有統計學意義(P<0.05)(圖 6,7)。
 圖6
各組Transwell實驗RF/6A細胞染色像。6A.正常對照組;6B.HG組;6C.HG+rAd-GFP組;6D.HG+rAd-Tum5組。HG組、HG+rAd-GFP組染色細胞數量較正常對照組明顯增加,HG+rAd-Tum5組染色細胞數量較HG組、HG+rAd-GFP組明顯減少結晶紫標尺:50μm
圖6
各組Transwell實驗RF/6A細胞染色像。6A.正常對照組;6B.HG組;6C.HG+rAd-GFP組;6D.HG+rAd-Tum5組。HG組、HG+rAd-GFP組染色細胞數量較正常對照組明顯增加,HG+rAd-Tum5組染色細胞數量較HG組、HG+rAd-GFP組明顯減少結晶紫標尺:50μm
 圖7
各組細胞遷移數量比較。*P<0.05,P>0.05
圖7
各組細胞遷移數量比較。*P<0.05,P>0.05
Matrigel實驗結果顯示,4組間成形管腔數量比較,差異有統計學意義(F=137.696,P<0.05)。組間兩兩比較,HG組、HG+rAd-GFP組成形管腔數量明顯高于正常對照組,差異有統計學意義(P<0.05);HG組與HG+rAd-GFP組成形管腔數量比較,差異無統計學意義(P>0.05);HG+rAd-Tum5組成形管腔數量較HG組、HG+rAd-GFP組明顯減少,差異有統計學意義(P<0.05)(圖 8, 9)。
 圖8
各組Matrigel實驗像。8A.正常對照組;8B.HG組;8C.HG+rAd-GFP組;8D.HG+rAd-Tum5組。HG組、HG+rAd-GFP組成形管腔數目較正常對照組明顯增加,HG+rAd-Tum5組成形管腔數目較HG組、HG+rAd-GFP組明顯減少標尺:100μm
圖8
各組Matrigel實驗像。8A.正常對照組;8B.HG組;8C.HG+rAd-GFP組;8D.HG+rAd-Tum5組。HG組、HG+rAd-GFP組成形管腔數目較正常對照組明顯增加,HG+rAd-Tum5組成形管腔數目較HG組、HG+rAd-GFP組明顯減少標尺:100μm
 圖9
各組細胞成形管腔數目比較。*P<0.05,#P>0.05
圖9
各組細胞成形管腔數目比較。*P<0.05,#P>0.05
3 討論
腫瘤抑素對新生血管內皮細胞有明顯的抑制增生及促進凋亡的作用,作用強度為內皮抑素的10倍以上[1, 2]。Tum5是全長腫瘤抑素的抗新生血管生成活性片段,同時避免了誘導Goodpasture綜合征的可能。因此,本研究只采用Tum5基因片段,并在Tum5基因序列的前端加入優化的Gluc信號肽片段,以使感染的細胞表達分泌型Tum5肽[11, 12],并以自分泌和旁分泌的形式發揮作用;Tum5基因的后端加上HA-Tag標簽,有利于Tum5基因表達的檢測。本研究以5型腺病毒為載體,將重組的Tum5基因片段導入高糖條件刺激下的RF/6A細胞,通過倒置熒光顯微鏡以及流式細胞儀計數觀察其感染效率。結果顯示,rAd-Tum5與rAd-GFP均具有較高感染效率。說明腺病毒介導rAd-Tum5能夠以較高的效率導入細胞中,有效提高了基因作用的效果。此外,通過Western blot檢測到腺病毒介導的重組Tum5基因可以在高糖刺激下的血管內皮細胞中成功表達。說明重組Tum5基因腺病毒載體構建成功。由此表明Tum5基因能夠被高效的導入高糖刺激下的血管內皮細胞中,并且成功表達。重組Tum5基因載體在宿主細胞內表達,并可以通過Gluc的作用分泌至胞外,作用于自身和其他細胞,增加了導入基因作用的效果,為后續眼內導入基因治療的研究奠定了基礎。
本研究模擬細胞外環境中的高糖狀態,采用高糖培養基刺激RF/6A細胞,并通過腺病毒載體將重組Tum5基因導入RF/6A細胞中。然后分別通過CCK-8、Transwell以及Matrigel實驗觀察到Tum5可以有效抑制高糖刺激下RF/6A細胞的增生、遷移以及管腔成形作用。Maeshima等[1]用提取的Tum5肽觀察其對新生血管的作用,發現Tum5肽呈劑量依賴性的抑制人臍靜脈血管內皮細胞(HUVEC)的管腔形成能力,其作用強度是同劑量內皮抑素的10倍。本研究結果與其相似,但作用效果不如Maeshima等[1]研究結果明顯。可能是因為HUVEC和高糖刺激下的RF/6A細胞存在差異,也可能與感染腺病毒載體的細胞表達Tum5濃度較提純的Tum5濃度低有關,其差異的具體機制還需進一步的研究。許多研究也表明Tum5可以抑制血管內皮細胞管腔形成[13, 14]。此外,Maeshima等[1]通過亞甲藍增生實驗和BrdUrd增生實驗還發現Tum5肽不影響非其增生能力,而對牛肺動脈血管內皮細胞的增生能力有明顯的抑制作用。說明Tum5肽可以抑制血管內皮細胞的增生能力。而本研究結果進一步表明Tum5肽還能夠抑制高糖刺激下視網膜血管內皮細胞的遷移能力。提示Tum5可能能夠抑制糖尿病視網膜新生血管形成。
本研究結果表明,以腺病毒為載體的重組Tum5基因導入高糖刺激的視網膜血管內皮細胞,可以顯著抑制其增生、遷移以及管腔成形。這或許為糖尿病視網膜新生血管的治療提供了新的思路和方向。