引用本文: 原莉莉, 張東昌, 李筱榮, 盧亞楠. 熱休克蛋白47在增生性玻璃體視網膜病變增生膜組織的表達以及轉化生長子因-β2對視網膜色素上皮細胞中熱休克蛋白47表達的影響. 中華眼底病雜志, 2015, 31(4): 377-381. doi: 10.3760/cma.j.issn.1005-1015.2015.04.016 復制
視網膜色素上皮(RPE)細胞移行、增生,導致細胞外基質(ECM)沉積并形成具有收縮能力的增生膜是增生性玻璃體視網膜病變(PVR)的主要病理特征[1]。研究表明,轉化生長因子(TGF)-β2可誘導RPE細胞增生、遷移及合成ECM,在PVR的發生發展過程中具有重要的調控作用[2],但目前其分子機制尚不明確。熱休克蛋白(HSP)47是一種膠原特異性分子伴侶,是多種膠原成熟和前膠原折疊過程中必需的調控因子。近年研究結果表明,HSP47水平增高,促進ECM沉積可能是多種纖維化疾病的重要病理過程[3-5]。因此,我們推測TGF-β2的促纖維化作用可能與HSP47表達增加,RPE細胞間質-上皮轉化,從而促進ECM蛋白合成相關。本研究首先檢測PVR增生膜病理標本中HSP47的表達,進一步通過體外實驗,觀察TGF-β2對RPE細胞HSP47、間質-上皮細胞轉化標記物Ⅰ型膠原蛋白(Col-Ⅰ)表達的影響,探討TGF-β2及HSP47在PVR發病中的作用。現將結果報道如下。
1 材料和方法
胎牛血清及Dulbecco改良Eagle(DMEM)/F12培養基(美國Hyclone公司),Trizol試劑(美國Invitrogen公司),新生牛血清(美國Gibco公司),QuantiTect 逆轉錄試劑盒(德國QIAGEN公司),TGF-β2(美國Peprotech公司),HSP47單克隆抗體、Col-Ⅰ單克隆抗體(美國Abcam公司),甘油醛-3-磷酸脫氫酶(GAPDH,美國Bioworld公司),人RPE-19 (ARPE-19)細胞株(美國ATCC公司),凝膠成像分析系統(法國Viberlourmat公司),細胞培養箱(美國Thermo公司)。
2012年7~12月在山西省眼科醫院接受玻璃體切割手術治療的PVR D期患者10例10只眼。其中,男性8例8只眼,女性2例2只眼。年齡16~42歲,平均年齡(32.03±9.57)歲。既往因孔源性視網膜脫離接受過鞏膜環扎手術者4只眼;陳舊性視網膜脫離者6只眼。于玻璃體切割手術中取出視網膜前表面增生膜,同時收集5只角膜移植供體眼內界膜作為對照。所取標本立即置于4%甲醛中固定,常規梯度酒精脫水,石蠟包埋,以厚度3 μm切片。分別行蘇木精-伊紅(HE)、Masson及HSP47二氨基聯苯胺(DAB)染色。光學顯微鏡下觀察病理標本的組織病理學特征及HSP47的表達情況。
ARPE-19細胞株常規復蘇,置于含10%胎牛血清、100 U/ml青鏈霉素的DMEM/F12培養基中培養,取3~5代細胞,以細胞密度2×105個/孔,接種于24孔板2板,培養至細胞融合密度70%,第1板換成含終濃度分別為0、1、5、10 ng/ml的 TGF-β2繼續培養24 h,并根據此濃度分為4組;第2板換成含終濃度為5 ng/ml TGF-β2,刺激細胞0、12、24、48 h。
熒光定量聚合酶鏈反應(RT-PCR)檢測細胞內HSP47、Col-Ⅰ mRNA的表達。Trizol法提取各組細胞總RNA,PrimeScrip逆轉錄試劑盒將mRNA逆轉錄成cDNA,稀釋。各組細胞的cDNA 2 μl作為模板,GAPDH為內參,引物序列HSP47:上游引物5′-TCCAGCCTCATCCTCA-3′,下游引物5′-GCCATCT GTGTCCAACTCA-3′; Col-Ⅰ:上游引物5′-GGCGA CAGAGGCATAAAGGG-3′,下游引物5′-GAGGTG GCTGGGGCAGGAAG-3′;GAPDH上游引物: 5′-TC CACCACCCTGTTGCTGTA-3′,下游引物: 5′-TGG CAGGTTTTTCTAGACGGCAG-3′。擴增條件:95 ℃ 30 s,1個循環;95 ℃ 5 s;64 ℃ 34 s,40個循環。數據按照2-ΔΔCt進行計算分析。
蛋白免疫印跡法(Western blot)檢測細胞內HSP47、Col-Ⅰ蛋白表達。收集各組細胞,棄培養基,預冷的磷酸鹽緩沖液洗3次,細胞刮將細胞刮下收集離心,加入適量細胞裂解液,于冰上放置30 min,4 ℃,離心半徑85 mm,13 000 r/min離心15 min,取上清,采用二辛可酸法測定蛋白濃度,取50 μg蛋白進行十二烷基硫酸鈉聚丙烯酰胺凝膠電泳電泳并電轉至聚偏二氟乙烯膜上,5%脫脂奶粉封閉2 h,洗膜緩沖液(TBST)洗膜3次,分別加入HSP47、Col-Ⅰ抗體,4 ℃孵育過夜,TBST洗膜3次,加入二抗,室溫孵育2 h,TBST洗膜3次,加入化學發光試劑后進行成像分析。
應用SPSS 17.0統計軟件進行統計學分析處理。數據采用均數±標準差(
2 結果
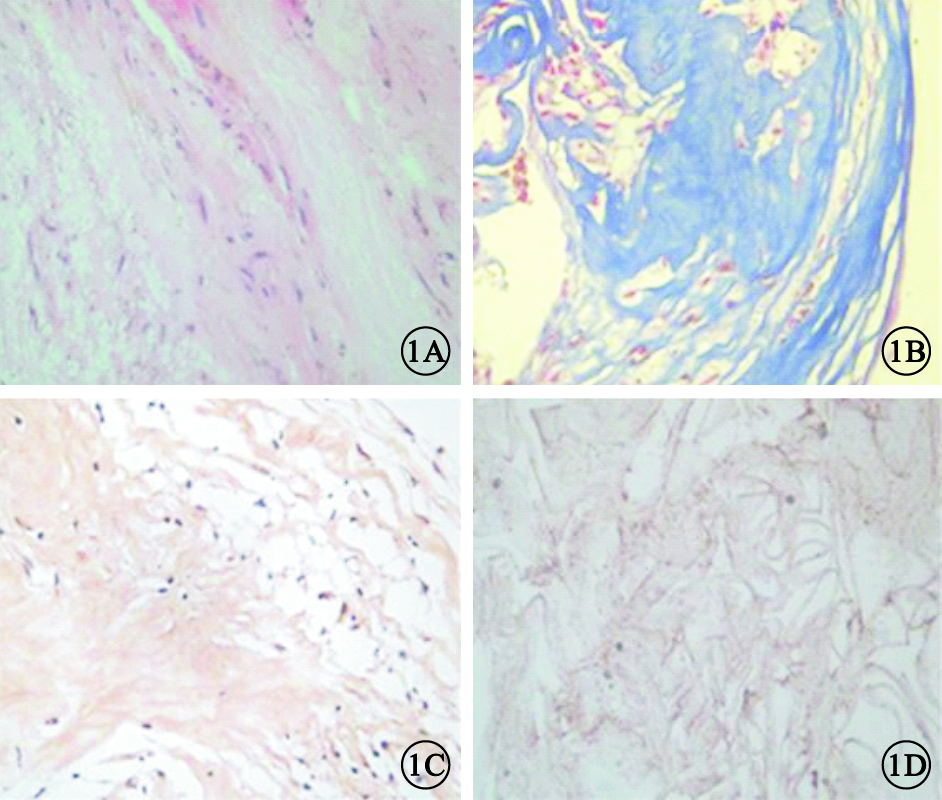
光學顯微鏡觀察發現,PVR增生膜組織中見類圓形或多角形上皮樣細胞及胞體較大的長梭形細胞,散在色素顆粒,膠原致密(圖 1A);增生膜中含有大量膠原纖維(圖 1B);HSP47在多數細胞胞漿及間質內呈陽性表達(圖 1C)。內界膜為較均勻致密的膠原成分,其間散在少量細胞,HSP47呈弱陽性基礎表達(圖 1D)。
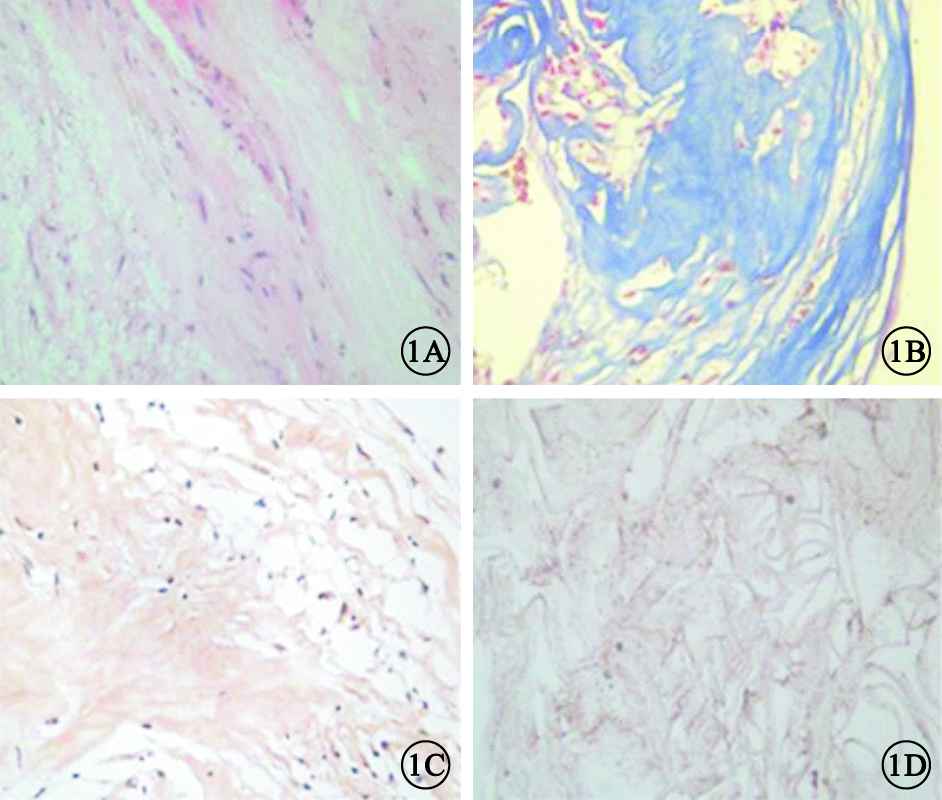 圖1
病理組織光學顯微鏡像。1A.PVR增生膜,可見類圓形或多角形上皮樣細胞及胞體較大的長梭形細胞,散在色素顆粒,膠原致密 HE ×200;1B.PVR增生膜,可見大量膠原纖維呈藍染色 Masson ×200;1C.PVR增生膜,HSP47在多數細胞胞漿及間質內呈陽性表達 DAB ×200;1D.內界膜,可見均勻致密的膠原成分,其間散在少量細胞成分,HSP47染色呈弱陽性表達 DAB ×200
圖1
病理組織光學顯微鏡像。1A.PVR增生膜,可見類圓形或多角形上皮樣細胞及胞體較大的長梭形細胞,散在色素顆粒,膠原致密 HE ×200;1B.PVR增生膜,可見大量膠原纖維呈藍染色 Masson ×200;1C.PVR增生膜,HSP47在多數細胞胞漿及間質內呈陽性表達 DAB ×200;1D.內界膜,可見均勻致密的膠原成分,其間散在少量細胞成分,HSP47染色呈弱陽性表達 DAB ×200
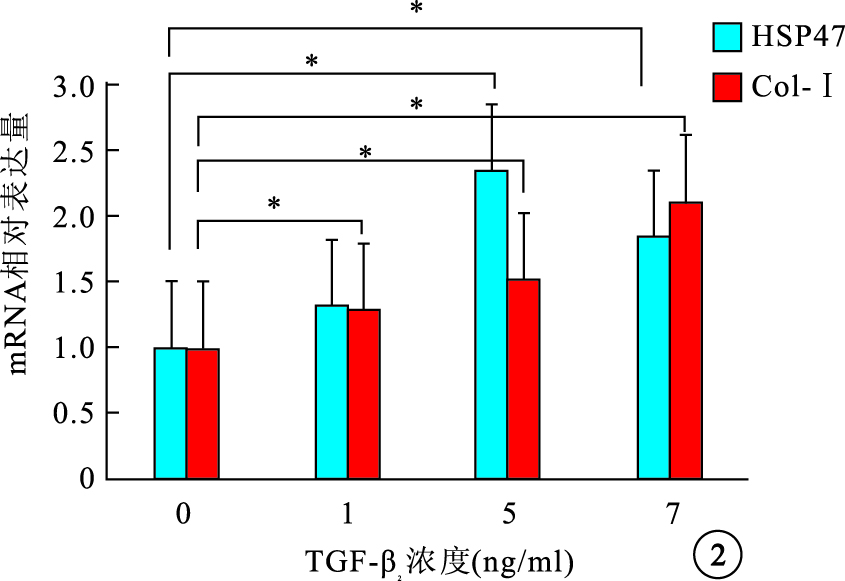
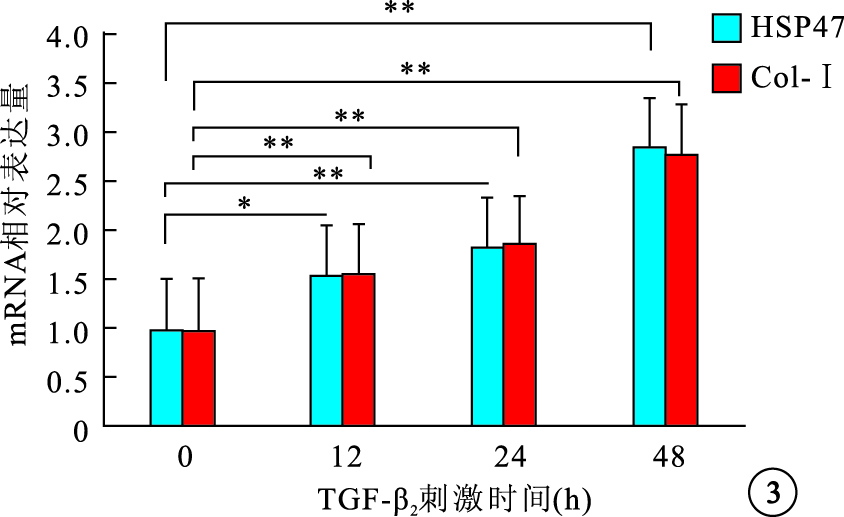
RT-PCR檢測結果顯示,細胞內HSP47 mRNA表達隨TGF-β2濃度增加先增高再下降,1、5、10 ng/ml組細胞內HSP47 mRNA表達較0 ng/ml組分別上調了1.32、2.35、1.85倍,差異有統計學意義(F=27.21,P<0.05);Col-Ⅰ mRNA表達隨TGF-β2濃度增加而逐漸增高,1、5、10 ng/ml組 Col-Ⅰ mRNA表達較0 ng/ml組分別上調了1.29、1.52、2.11倍,差異均有統計學意義(F=23.45,P<0.05)(圖 2)。5 ng/ml組 TGF-β2作用0、12、24、48 h后,細胞內HSP47、Col-Ⅰ mRNA表達均隨其作用時間延長而逐漸增加,12、24、48 h細胞內HSP47、Col-Ⅰ mRNA表達較0 h分別上調了1.56、1.84、2.86倍和1.57、1.86、2.78倍,差異均有統計學意義(HSP47:F=31.56,P<0.05;Col-Ⅰ:F=54.43,P<0.001)(圖 3)。
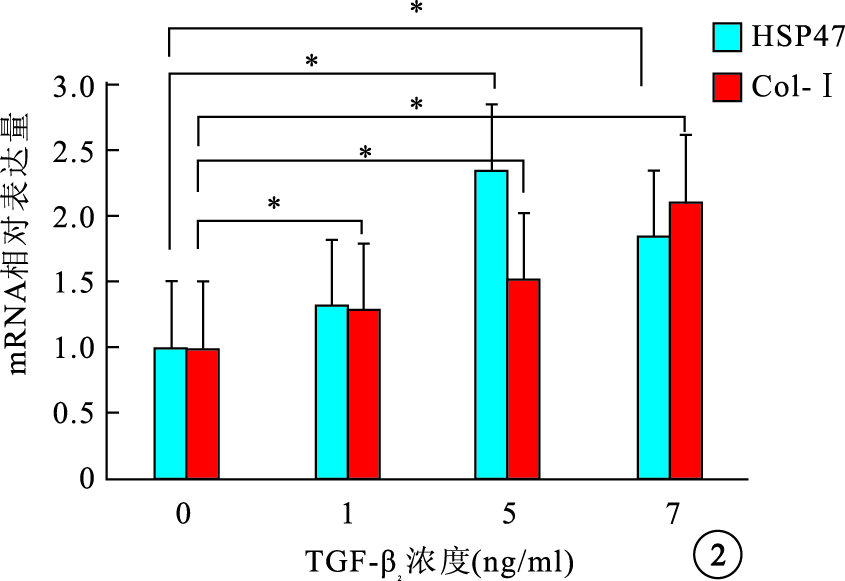 圖2
不同TGF-β2刺激濃度對細胞內HSP47和Col-Ⅰ mRNA表達的影響。*P<0.05
圖2
不同TGF-β2刺激濃度對細胞內HSP47和Col-Ⅰ mRNA表達的影響。*P<0.05
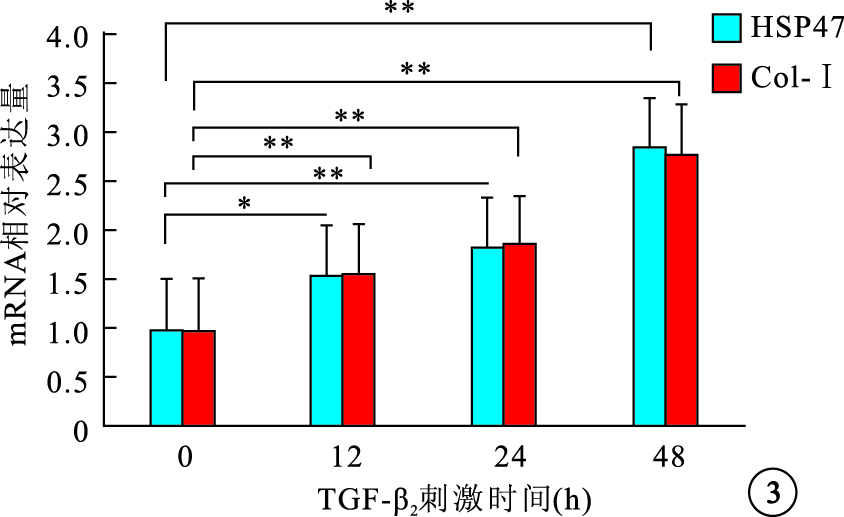 圖3
不同TGF-β2刺激時間對細胞內HSP47和Col-Ⅰ mRNA表達的影響。*P<0.05,**P<0.01
圖3
不同TGF-β2刺激時間對細胞內HSP47和Col-Ⅰ mRNA表達的影響。*P<0.05,**P<0.01
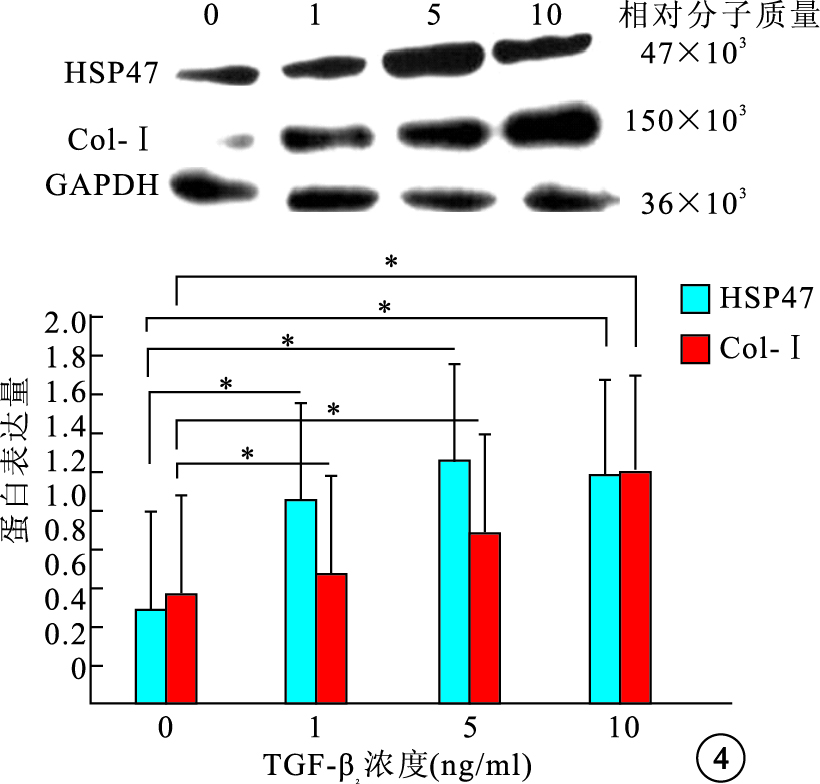
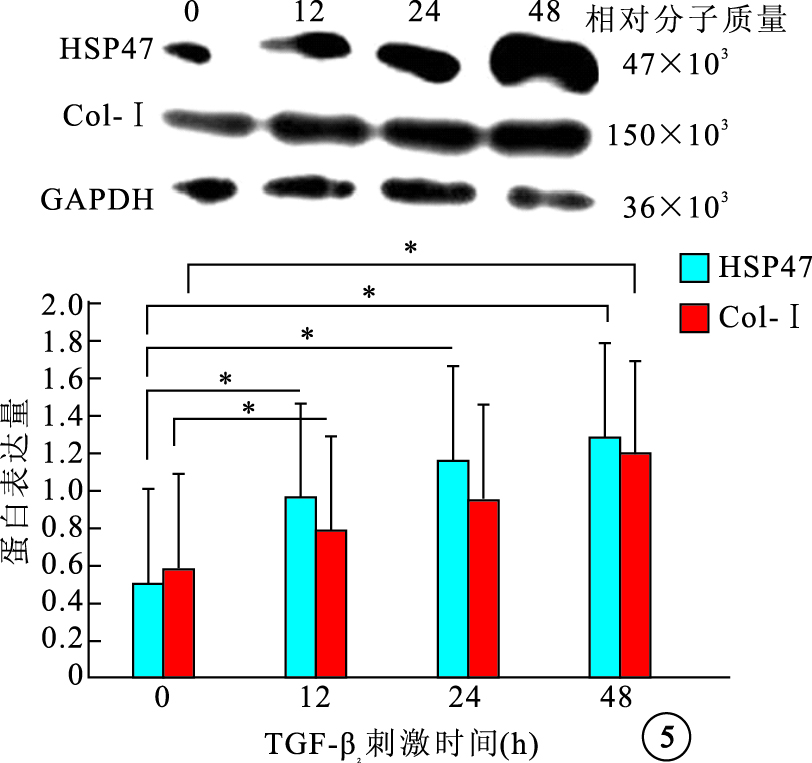
Western blot檢測結果顯示,不同濃度TGF-β2刺激后,細胞內HSP47蛋白表達先增加再降低,1、5、10 ng/ml組細胞內HSP47 蛋白表達較0 ng/ml組分別上調了2.33、2.89、2.60倍,差異有統計學意義(F=39.78,P<0.05);細胞內Col-Ⅰ蛋白表達隨濃度增加逐漸增加,1、5、10 ng/ml組細胞內Col-Ⅰ蛋白表達較0 ng/ml組分別上調了1.18、1.49、2.11倍,差異有統計學意義(F=29.10,P<0.05)(圖 4)。5 ng/ml組 TGF-β2作用0、12、24、48 h后,細胞內HSP47、Col-Ⅰ蛋白表達隨作用時間延長而逐漸增加,12、24、48 h細胞內HSP47、Col-Ⅰ蛋白表達較0 h分別上調了2.08、2.37、2.80倍和1.38、1.59、2.16倍,差異均有統計學意義(HSP47:F=49.18,P<0.05;Col-Ⅰ:F=42.52,P<0.05)(圖 5)。
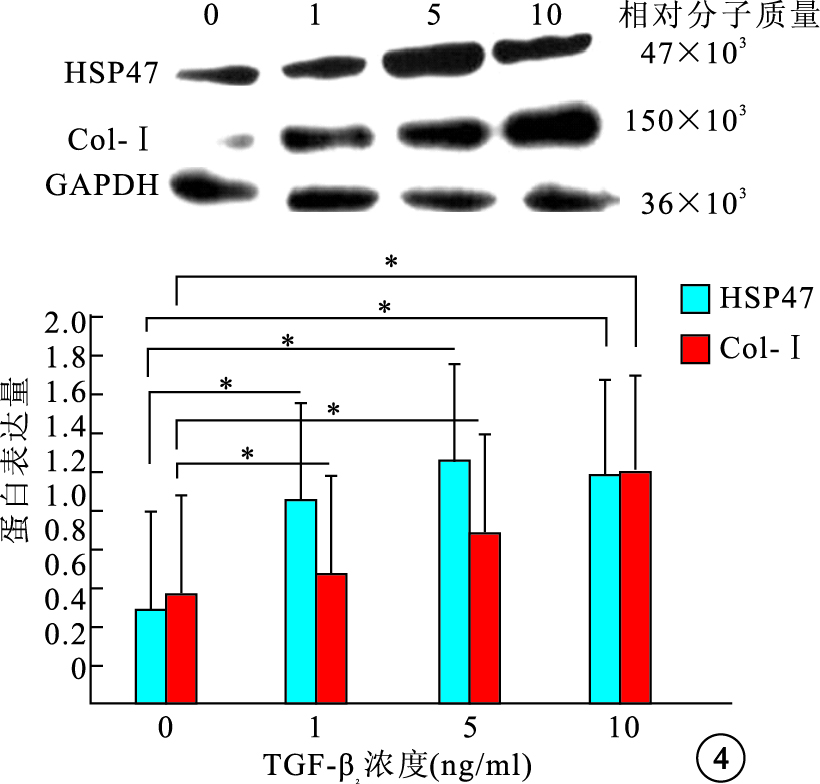 圖4
不同TGF-β2刺激濃度對細胞內HSP47和Col-Ⅰ蛋白表達的影響。*P<0.05
圖4
不同TGF-β2刺激濃度對細胞內HSP47和Col-Ⅰ蛋白表達的影響。*P<0.05
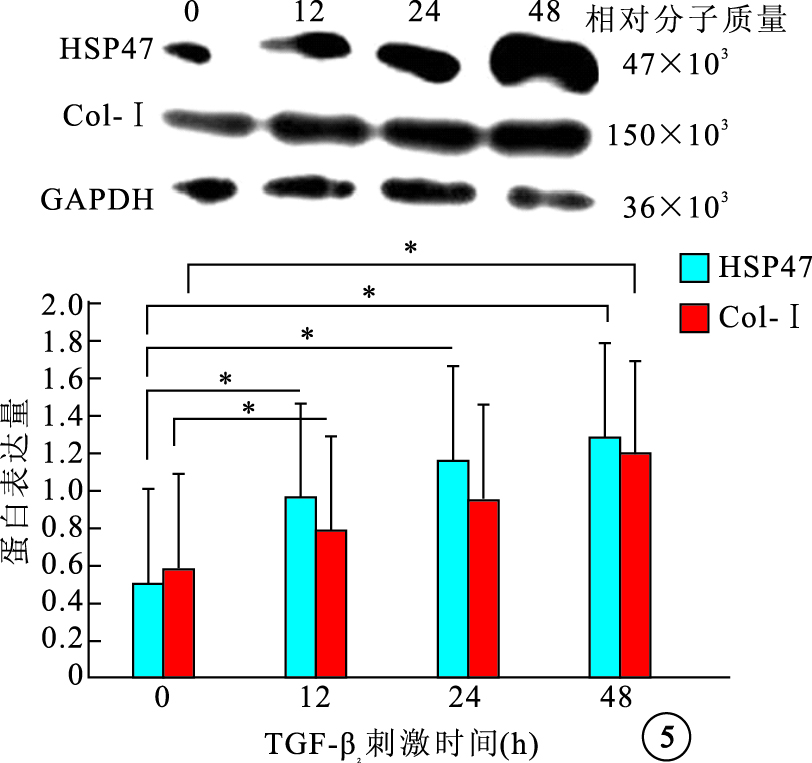 圖5
不同TGF-β2刺激時間對細胞內HSP47和Col-Ⅰ蛋白表達的影響。*P<0.05
圖5
不同TGF-β2刺激時間對細胞內HSP47和Col-Ⅰ蛋白表達的影響。*P<0.05
3 討論
本研究組織病理檢查發現,PVR患者增生膜組織中存在類圓形或多角形上皮樣細胞,以及部分長梭形胞體較大的細胞及一些色素顆粒;增生膜中存在大量膠原蛋白成分,HSP47的表達較內界膜增強。我們推測HSP47表達增加以及膠原蛋白過度合成可能在PVR的發病過程中發揮重要作用。
我們通過體外培養ARPE-19細胞,并依據參考文獻[6, 7],設計了刺激物TGF-β2的濃度和時間梯度,該濃度和時間范圍對細胞無明顯毒性,分別檢測了細胞內HSP47和Col-Ⅰ的mRNA和蛋白表達。結果顯示,TGF-β2刺激細胞后,可以顯著增加細胞內HSP47以及Col-Ⅰ mRNA和蛋白表達,并具有時間及濃度依賴性,濃度為5 ng/ml,刺激時間為48 h時,表達最強。既往研究結果顯示,TGF-β2可使ARPE-19細胞遷移能力增強。結合本研究結果,我們認為TGF-β2可能一方面通過改變細胞骨架結構,另一方面通過促進HSP47的表達增加,繼而促進Col-Ⅰ的合成與沉積,參與PVR的病理過程。 TGF-β及其受體廣泛表達于多種眼部組織,被認為是重要的促纖維化因子,但其具有多種生物學活性,包括免疫抑制、增強組織再生及傷口愈合等[8, 9],作為治療靶點可能對眼組織的生理功能產生廣泛影響,其下游蛋白HSP47最初是從鼠類內胚層細胞中分離出來的蛋白質[10],是CBP2基因產物,屬于絲氨酸蛋白酶抑制劑(serpin)超家族,位于細胞內質網,參與前膠原的折疊、組裝及成熟過程。作為膠原特異性分子伴侶,HSP47可能在纖維化疾病的治療中更有針對性。
目前研究認為TGF-β2是促進上皮細胞間質轉化的重要細胞因子[2],而Col-Ⅰ是主要的間質標記物之一,因此Col-Ⅰ的增加應該是TGF-β2作用的結果。TGF-β2促進Col-Ⅰ合成存在一些中間環節,其確切機制尚未闡明。由于HSP47是膠原合成過程中必需且必要的分子伴侶[11],因而,我們推測HSP47可能是TGF-β2作用的下游分子,是Col-Ⅰ合成的調節因子。即TGF-β2可能通過促進HSP47的表達進而導致Col-Ⅰ的表達增強。
已有研究結果表明,TGF與HSP47在多種組織器官的纖維化疾病如肝纖維化、腎纖維化、肺纖維化及皮膚老化中發揮重要作用[5, 12-14]。同時在一些動物模型的研究中發現,沉默HSP47基因,能夠對多種纖維化疾病起積極的調控作用[4, 5, 15]。因而,我們推測HSP47可能會成為治療PVR的一個生物治療靶點。
我們發現增生膜中存在類圓形上皮樣細胞及色素顆粒,而視網膜組織中存在色素顆粒的上皮細胞只有RPE細胞,因而推測其為RPE細胞。但本研究未能進一步做細胞鑒定加以驗證,實為不足。本研究在發現臨床證據的基礎上進行了體外實驗,但其結論還需要在原代細胞以及進一步的動物實驗中加以驗證。
視網膜色素上皮(RPE)細胞移行、增生,導致細胞外基質(ECM)沉積并形成具有收縮能力的增生膜是增生性玻璃體視網膜病變(PVR)的主要病理特征[1]。研究表明,轉化生長因子(TGF)-β2可誘導RPE細胞增生、遷移及合成ECM,在PVR的發生發展過程中具有重要的調控作用[2],但目前其分子機制尚不明確。熱休克蛋白(HSP)47是一種膠原特異性分子伴侶,是多種膠原成熟和前膠原折疊過程中必需的調控因子。近年研究結果表明,HSP47水平增高,促進ECM沉積可能是多種纖維化疾病的重要病理過程[3-5]。因此,我們推測TGF-β2的促纖維化作用可能與HSP47表達增加,RPE細胞間質-上皮轉化,從而促進ECM蛋白合成相關。本研究首先檢測PVR增生膜病理標本中HSP47的表達,進一步通過體外實驗,觀察TGF-β2對RPE細胞HSP47、間質-上皮細胞轉化標記物Ⅰ型膠原蛋白(Col-Ⅰ)表達的影響,探討TGF-β2及HSP47在PVR發病中的作用。現將結果報道如下。
1 材料和方法
胎牛血清及Dulbecco改良Eagle(DMEM)/F12培養基(美國Hyclone公司),Trizol試劑(美國Invitrogen公司),新生牛血清(美國Gibco公司),QuantiTect 逆轉錄試劑盒(德國QIAGEN公司),TGF-β2(美國Peprotech公司),HSP47單克隆抗體、Col-Ⅰ單克隆抗體(美國Abcam公司),甘油醛-3-磷酸脫氫酶(GAPDH,美國Bioworld公司),人RPE-19 (ARPE-19)細胞株(美國ATCC公司),凝膠成像分析系統(法國Viberlourmat公司),細胞培養箱(美國Thermo公司)。
2012年7~12月在山西省眼科醫院接受玻璃體切割手術治療的PVR D期患者10例10只眼。其中,男性8例8只眼,女性2例2只眼。年齡16~42歲,平均年齡(32.03±9.57)歲。既往因孔源性視網膜脫離接受過鞏膜環扎手術者4只眼;陳舊性視網膜脫離者6只眼。于玻璃體切割手術中取出視網膜前表面增生膜,同時收集5只角膜移植供體眼內界膜作為對照。所取標本立即置于4%甲醛中固定,常規梯度酒精脫水,石蠟包埋,以厚度3 μm切片。分別行蘇木精-伊紅(HE)、Masson及HSP47二氨基聯苯胺(DAB)染色。光學顯微鏡下觀察病理標本的組織病理學特征及HSP47的表達情況。
ARPE-19細胞株常規復蘇,置于含10%胎牛血清、100 U/ml青鏈霉素的DMEM/F12培養基中培養,取3~5代細胞,以細胞密度2×105個/孔,接種于24孔板2板,培養至細胞融合密度70%,第1板換成含終濃度分別為0、1、5、10 ng/ml的 TGF-β2繼續培養24 h,并根據此濃度分為4組;第2板換成含終濃度為5 ng/ml TGF-β2,刺激細胞0、12、24、48 h。
熒光定量聚合酶鏈反應(RT-PCR)檢測細胞內HSP47、Col-Ⅰ mRNA的表達。Trizol法提取各組細胞總RNA,PrimeScrip逆轉錄試劑盒將mRNA逆轉錄成cDNA,稀釋。各組細胞的cDNA 2 μl作為模板,GAPDH為內參,引物序列HSP47:上游引物5′-TCCAGCCTCATCCTCA-3′,下游引物5′-GCCATCT GTGTCCAACTCA-3′; Col-Ⅰ:上游引物5′-GGCGA CAGAGGCATAAAGGG-3′,下游引物5′-GAGGTG GCTGGGGCAGGAAG-3′;GAPDH上游引物: 5′-TC CACCACCCTGTTGCTGTA-3′,下游引物: 5′-TGG CAGGTTTTTCTAGACGGCAG-3′。擴增條件:95 ℃ 30 s,1個循環;95 ℃ 5 s;64 ℃ 34 s,40個循環。數據按照2-ΔΔCt進行計算分析。
蛋白免疫印跡法(Western blot)檢測細胞內HSP47、Col-Ⅰ蛋白表達。收集各組細胞,棄培養基,預冷的磷酸鹽緩沖液洗3次,細胞刮將細胞刮下收集離心,加入適量細胞裂解液,于冰上放置30 min,4 ℃,離心半徑85 mm,13 000 r/min離心15 min,取上清,采用二辛可酸法測定蛋白濃度,取50 μg蛋白進行十二烷基硫酸鈉聚丙烯酰胺凝膠電泳電泳并電轉至聚偏二氟乙烯膜上,5%脫脂奶粉封閉2 h,洗膜緩沖液(TBST)洗膜3次,分別加入HSP47、Col-Ⅰ抗體,4 ℃孵育過夜,TBST洗膜3次,加入二抗,室溫孵育2 h,TBST洗膜3次,加入化學發光試劑后進行成像分析。
應用SPSS 17.0統計軟件進行統計學分析處理。數據采用均數±標準差(
2 結果
光學顯微鏡觀察發現,PVR增生膜組織中見類圓形或多角形上皮樣細胞及胞體較大的長梭形細胞,散在色素顆粒,膠原致密(圖 1A);增生膜中含有大量膠原纖維(圖 1B);HSP47在多數細胞胞漿及間質內呈陽性表達(圖 1C)。內界膜為較均勻致密的膠原成分,其間散在少量細胞,HSP47呈弱陽性基礎表達(圖 1D)。
 圖1
病理組織光學顯微鏡像。1A.PVR增生膜,可見類圓形或多角形上皮樣細胞及胞體較大的長梭形細胞,散在色素顆粒,膠原致密 HE ×200;1B.PVR增生膜,可見大量膠原纖維呈藍染色 Masson ×200;1C.PVR增生膜,HSP47在多數細胞胞漿及間質內呈陽性表達 DAB ×200;1D.內界膜,可見均勻致密的膠原成分,其間散在少量細胞成分,HSP47染色呈弱陽性表達 DAB ×200
圖1
病理組織光學顯微鏡像。1A.PVR增生膜,可見類圓形或多角形上皮樣細胞及胞體較大的長梭形細胞,散在色素顆粒,膠原致密 HE ×200;1B.PVR增生膜,可見大量膠原纖維呈藍染色 Masson ×200;1C.PVR增生膜,HSP47在多數細胞胞漿及間質內呈陽性表達 DAB ×200;1D.內界膜,可見均勻致密的膠原成分,其間散在少量細胞成分,HSP47染色呈弱陽性表達 DAB ×200
RT-PCR檢測結果顯示,細胞內HSP47 mRNA表達隨TGF-β2濃度增加先增高再下降,1、5、10 ng/ml組細胞內HSP47 mRNA表達較0 ng/ml組分別上調了1.32、2.35、1.85倍,差異有統計學意義(F=27.21,P<0.05);Col-Ⅰ mRNA表達隨TGF-β2濃度增加而逐漸增高,1、5、10 ng/ml組 Col-Ⅰ mRNA表達較0 ng/ml組分別上調了1.29、1.52、2.11倍,差異均有統計學意義(F=23.45,P<0.05)(圖 2)。5 ng/ml組 TGF-β2作用0、12、24、48 h后,細胞內HSP47、Col-Ⅰ mRNA表達均隨其作用時間延長而逐漸增加,12、24、48 h細胞內HSP47、Col-Ⅰ mRNA表達較0 h分別上調了1.56、1.84、2.86倍和1.57、1.86、2.78倍,差異均有統計學意義(HSP47:F=31.56,P<0.05;Col-Ⅰ:F=54.43,P<0.001)(圖 3)。
 圖2
不同TGF-β2刺激濃度對細胞內HSP47和Col-Ⅰ mRNA表達的影響。*P<0.05
圖2
不同TGF-β2刺激濃度對細胞內HSP47和Col-Ⅰ mRNA表達的影響。*P<0.05
 圖3
不同TGF-β2刺激時間對細胞內HSP47和Col-Ⅰ mRNA表達的影響。*P<0.05,**P<0.01
圖3
不同TGF-β2刺激時間對細胞內HSP47和Col-Ⅰ mRNA表達的影響。*P<0.05,**P<0.01
Western blot檢測結果顯示,不同濃度TGF-β2刺激后,細胞內HSP47蛋白表達先增加再降低,1、5、10 ng/ml組細胞內HSP47 蛋白表達較0 ng/ml組分別上調了2.33、2.89、2.60倍,差異有統計學意義(F=39.78,P<0.05);細胞內Col-Ⅰ蛋白表達隨濃度增加逐漸增加,1、5、10 ng/ml組細胞內Col-Ⅰ蛋白表達較0 ng/ml組分別上調了1.18、1.49、2.11倍,差異有統計學意義(F=29.10,P<0.05)(圖 4)。5 ng/ml組 TGF-β2作用0、12、24、48 h后,細胞內HSP47、Col-Ⅰ蛋白表達隨作用時間延長而逐漸增加,12、24、48 h細胞內HSP47、Col-Ⅰ蛋白表達較0 h分別上調了2.08、2.37、2.80倍和1.38、1.59、2.16倍,差異均有統計學意義(HSP47:F=49.18,P<0.05;Col-Ⅰ:F=42.52,P<0.05)(圖 5)。
 圖4
不同TGF-β2刺激濃度對細胞內HSP47和Col-Ⅰ蛋白表達的影響。*P<0.05
圖4
不同TGF-β2刺激濃度對細胞內HSP47和Col-Ⅰ蛋白表達的影響。*P<0.05
 圖5
不同TGF-β2刺激時間對細胞內HSP47和Col-Ⅰ蛋白表達的影響。*P<0.05
圖5
不同TGF-β2刺激時間對細胞內HSP47和Col-Ⅰ蛋白表達的影響。*P<0.05
3 討論
本研究組織病理檢查發現,PVR患者增生膜組織中存在類圓形或多角形上皮樣細胞,以及部分長梭形胞體較大的細胞及一些色素顆粒;增生膜中存在大量膠原蛋白成分,HSP47的表達較內界膜增強。我們推測HSP47表達增加以及膠原蛋白過度合成可能在PVR的發病過程中發揮重要作用。
我們通過體外培養ARPE-19細胞,并依據參考文獻[6, 7],設計了刺激物TGF-β2的濃度和時間梯度,該濃度和時間范圍對細胞無明顯毒性,分別檢測了細胞內HSP47和Col-Ⅰ的mRNA和蛋白表達。結果顯示,TGF-β2刺激細胞后,可以顯著增加細胞內HSP47以及Col-Ⅰ mRNA和蛋白表達,并具有時間及濃度依賴性,濃度為5 ng/ml,刺激時間為48 h時,表達最強。既往研究結果顯示,TGF-β2可使ARPE-19細胞遷移能力增強。結合本研究結果,我們認為TGF-β2可能一方面通過改變細胞骨架結構,另一方面通過促進HSP47的表達增加,繼而促進Col-Ⅰ的合成與沉積,參與PVR的病理過程。 TGF-β及其受體廣泛表達于多種眼部組織,被認為是重要的促纖維化因子,但其具有多種生物學活性,包括免疫抑制、增強組織再生及傷口愈合等[8, 9],作為治療靶點可能對眼組織的生理功能產生廣泛影響,其下游蛋白HSP47最初是從鼠類內胚層細胞中分離出來的蛋白質[10],是CBP2基因產物,屬于絲氨酸蛋白酶抑制劑(serpin)超家族,位于細胞內質網,參與前膠原的折疊、組裝及成熟過程。作為膠原特異性分子伴侶,HSP47可能在纖維化疾病的治療中更有針對性。
目前研究認為TGF-β2是促進上皮細胞間質轉化的重要細胞因子[2],而Col-Ⅰ是主要的間質標記物之一,因此Col-Ⅰ的增加應該是TGF-β2作用的結果。TGF-β2促進Col-Ⅰ合成存在一些中間環節,其確切機制尚未闡明。由于HSP47是膠原合成過程中必需且必要的分子伴侶[11],因而,我們推測HSP47可能是TGF-β2作用的下游分子,是Col-Ⅰ合成的調節因子。即TGF-β2可能通過促進HSP47的表達進而導致Col-Ⅰ的表達增強。
已有研究結果表明,TGF與HSP47在多種組織器官的纖維化疾病如肝纖維化、腎纖維化、肺纖維化及皮膚老化中發揮重要作用[5, 12-14]。同時在一些動物模型的研究中發現,沉默HSP47基因,能夠對多種纖維化疾病起積極的調控作用[4, 5, 15]。因而,我們推測HSP47可能會成為治療PVR的一個生物治療靶點。
我們發現增生膜中存在類圓形上皮樣細胞及色素顆粒,而視網膜組織中存在色素顆粒的上皮細胞只有RPE細胞,因而推測其為RPE細胞。但本研究未能進一步做細胞鑒定加以驗證,實為不足。本研究在發現臨床證據的基礎上進行了體外實驗,但其結論還需要在原代細胞以及進一步的動物實驗中加以驗證。