引用本文: 莊淼, 邵珺, 譚澄燁, 姚勇. 轉甲狀腺素蛋白對視網膜微血管內皮細胞生物學行為的影響. 中華眼底病雜志, 2015, 31(4): 368-370. doi: 10.3760/cma.j.issn.1005-1015.2015.04.014 復制
轉甲狀腺素蛋白(TTR)也稱前白蛋白,為相對分子質量55×103的同源四聚體蛋白,主要由肝臟、脈絡膜叢和胰島細胞等合成。在眼內,視網膜色素上皮(RPE)細胞是TTR的唯一來源 [1]。TTR是20種淀粉樣蛋白之一,除了涉及多種形式基因突變的玻璃體淀粉樣變性的研究外[2-4],亦有TTR血清或玻璃體濃度在糖尿病視網膜病變、高度近視等疾病中存在異常表達的報道[5-10]。然而TTR濃度的差異表達是否對疾病有作用,其作用的途徑、機制和靶點等仍有待于進一步基礎研究。視網膜微血管內皮細胞(RMVEC)是研究諸多眼科疾病基礎的重要媒介[11, 12]。本研究通過了解TTR對RMVEC生物學行為的影響,希望從細胞學角度了解TTR是否對RMVEC有作用,為進一步研究其機制提供實驗依據。現將結果報道如下。
1 材料和方法
RMVEC(實驗室自存),澳洲胎牛血清(FBS,美國Gibco公司),Dulbecco改良Eagle(DMEM)/F12培養基(美國Hyclone公司),0.25%胰蛋白酶-乙二胺四乙酸(EDTA)消化液(凱基生物科技發展有限公司),二甲基亞砜(DMSO,美國Amresco公司),人血漿前白蛋白(prealbumin human plasma,美國Millipore公司),24孔Transwell培養板(美國Corning公司)。
RMVEC置于含100 ml/L FBS的DMEM/F12培養基,37℃,5%CO2培養箱中傳代培養,1.25 g/L胰蛋白酶和1 g/L EDTA消化。取第6~8代細胞用于實驗。 用不含FBS的DMEM/F12培養基溶解干粉狀TTR,以TTR濃度不同分為0(初始濃度)、4 μmol/L組。
以細胞密度1×104個/孔將RMVEC接種于96孔板中,共10孔,每5孔歸入一組。每孔加入200 μl相應蛋白濃度的無血清DMEM/F12培養基,培養48 h后加入MTT溶液,繼續培養4 h后棄上清,每孔加入150 μl DMSO,震蕩混勻10 min,490 nm波長酶標儀檢測其吸光度[A,舊稱光密度(OD)]值。按公式計算細胞增生的提升率:提升率(%)=(1-4 μmol/L 組A值/初始濃度組A值)×100%。
在24孔板各孔內分別加入含有0、4 μmol/L TTR的無血清DMEM/F12培養基600 μl,同時置入孔徑為8.0 μm的Transwell小室,小室內加入200 μl 含1×104個RMVEC的無FBS培養基培養。48 h后吸棄上下室培養基,用棉簽擦凈上室內細胞,24孔板內加入0.4 g/L多聚甲醛600 μl室溫固定30 min,吸棄多聚甲醛,磷酸鹽緩沖液(PBS)沖洗小室背面2遍,24孔板內加入結晶紫600 μl,室溫染色20 min,吸出后PBS沖洗小室背面2遍。顯微鏡下觀察照相,隨機取5個視野進行細胞計數。
預先用記號筆在35 mm培養皿底面作井字形標記,接種培養RMVEC,待細胞密度近100%時,使用10 μl槍頭根據井字形標記劃痕,PBS沖洗后更換培養基,分別加入0、4 μmol/L濃度TTR,于0(初始時間)、24、48 h分別拍攝各皿細胞顯微圖像,ImageJ圖像軟件測量邊緣距離變化。
應用SPSS 15.0統計軟件進行統計學分析處理。數據以均數±標準差(
2 結果
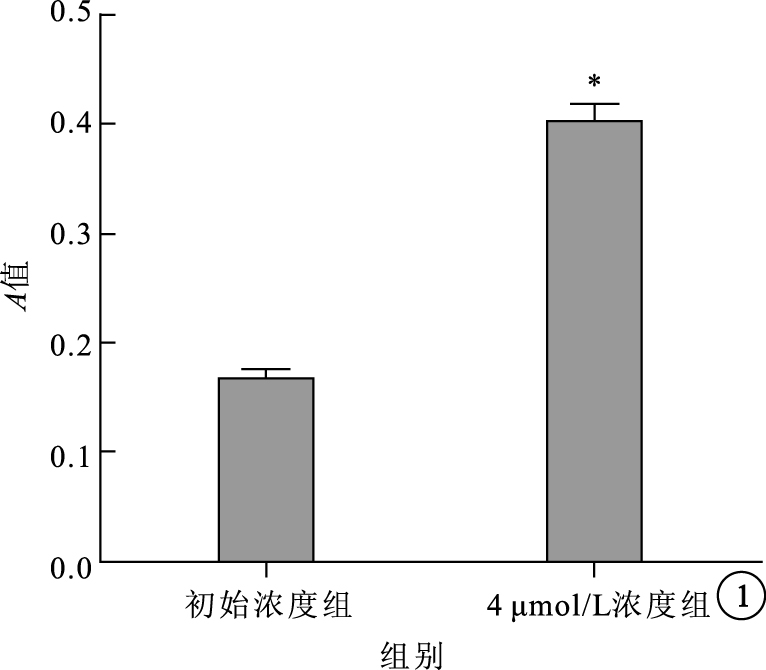
MTT法檢測結果顯示,初始濃度組、4 μmol/L組A值分別為0.17±0.02、0.40±0.03。兩組A值比較,差異有統計學意義(t=15.47,P=0.0001)(圖 1)。4 μmol/L組細胞增生率較初始濃度組提升57.4%。
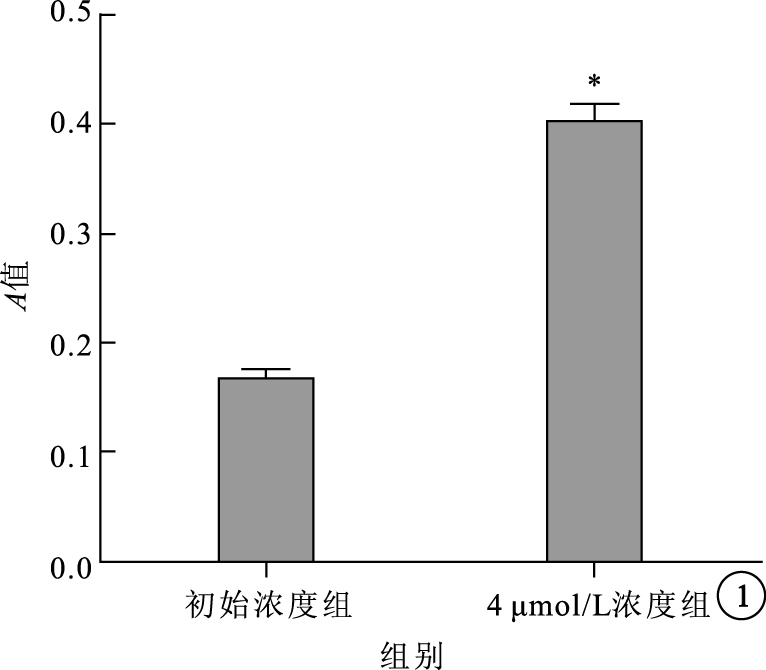 圖1
48 h不同濃度TTR對RMVEC增生的影響。*P<0.01
圖1
48 h不同濃度TTR對RMVEC增生的影響。*P<0.01
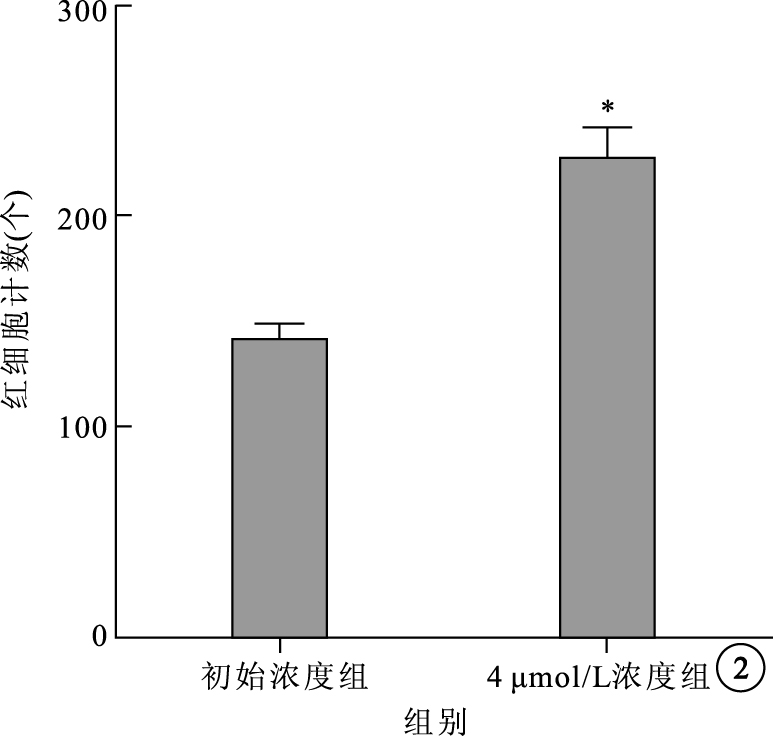
細胞遷移實驗結果顯示,初始濃度組、4 μmol/L組RMVEC向外遷移數分別為(140±7)、(227±14)個。 兩組間RMVEC向外遷移數比較,差異有統計學意義(t=5.44,P=0.000 6)(圖 2)。
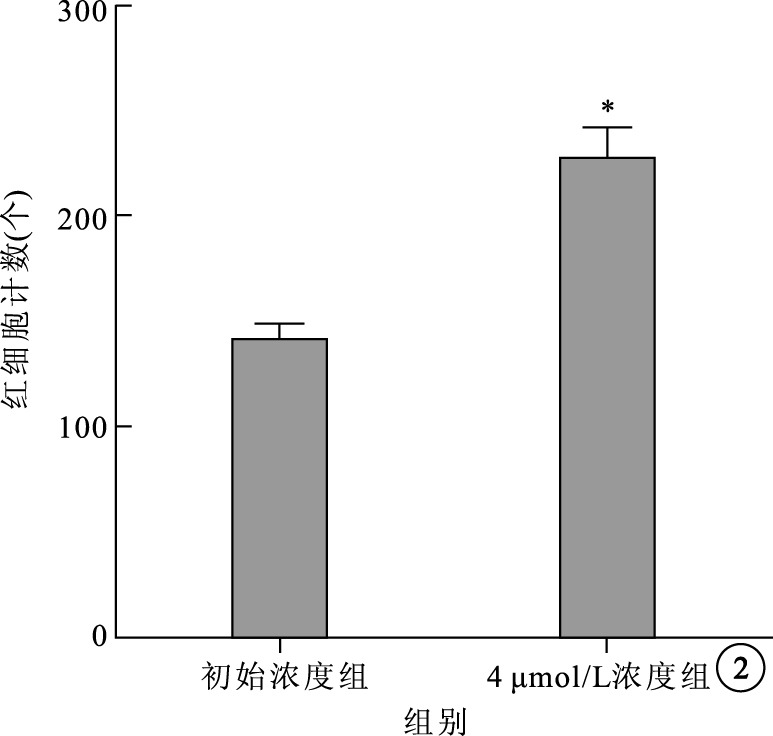 圖2
48 h不同濃度TTR 對RMVEC遷移的影響。*P<0.01
圖2
48 h不同濃度TTR 對RMVEC遷移的影響。*P<0.01
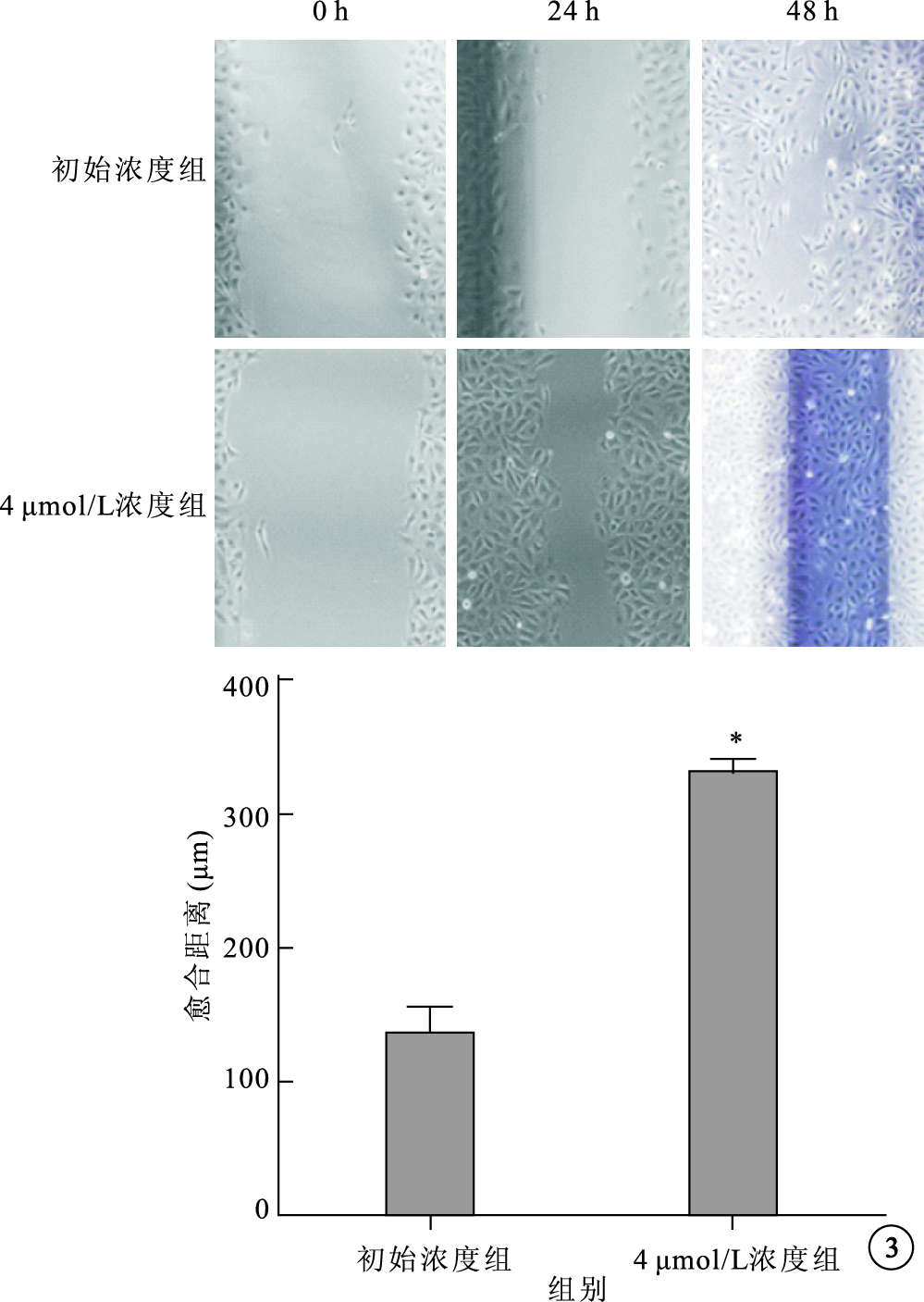
細胞劃痕實驗結果顯示,初始時間各組細胞劃痕間距大致相等;24 h,初始濃度組、4 μmol/L組劃痕愈合距離分別為(134.4±45.4)、(330.0±23.1) μm。兩組細胞劃痕愈合距離比較,差異有統計學意義(t=8.25,P<0.01)。48 h,4 μmol/L組完全愈合,初始濃度組未愈合(圖 3)。
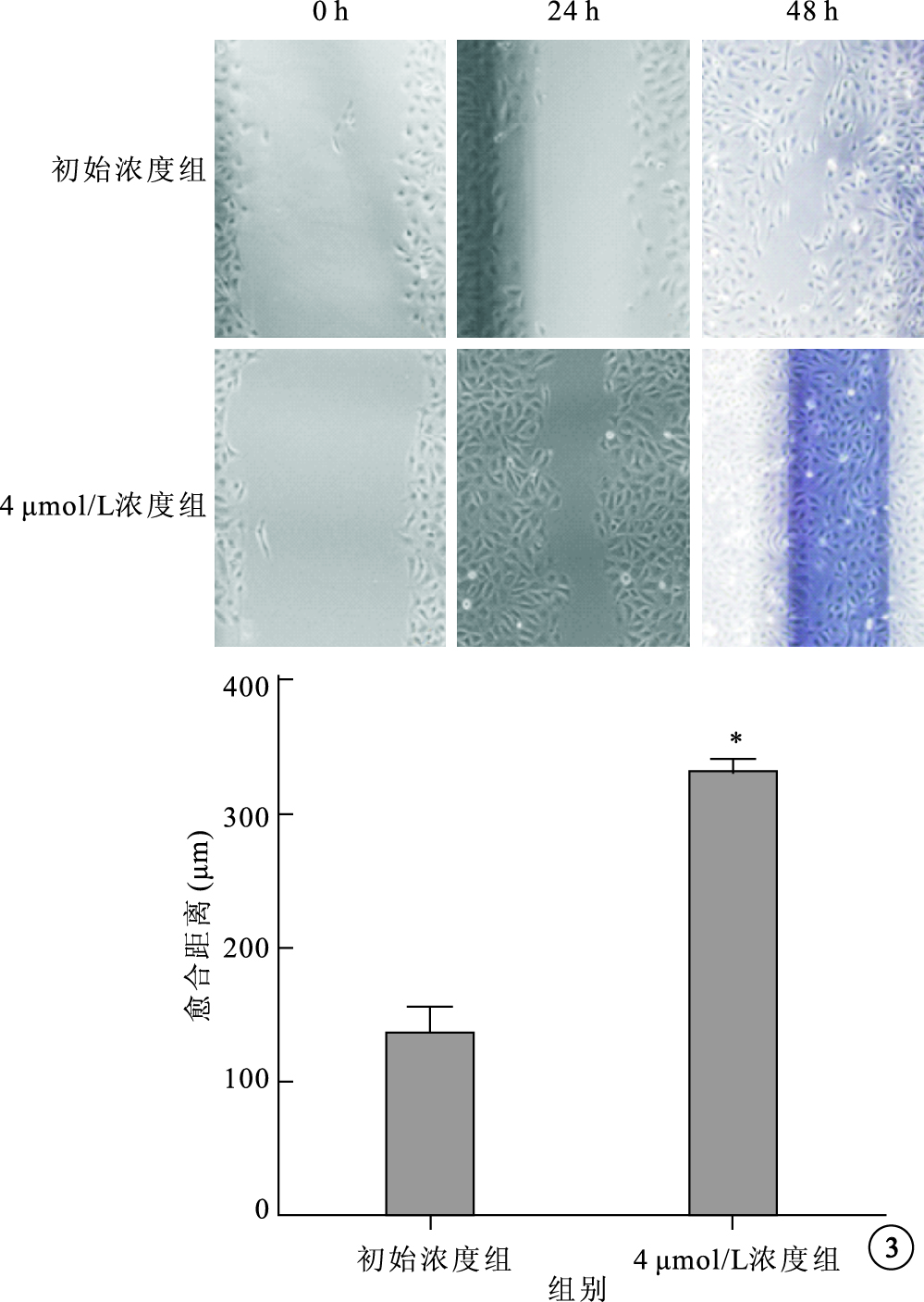 圖3
細胞劃痕實驗結果。3A.細胞顯微鏡像;3B.初始濃度組、4 μmol/L組細胞愈合距離比較。*P<0.01
圖3
細胞劃痕實驗結果。3A.細胞顯微鏡像;3B.初始濃度組、4 μmol/L組細胞愈合距離比較。*P<0.01
3 討論
TTR在體內的主要作用是轉運甲狀腺素或與視黃醇結合蛋白結合,參與視黃醇的轉運[13]。TTR血液或玻璃體濃度在一些系統及眼疾病狀態下與正常狀態之間存在差異[5-10, 14-17]。郭悅江等[18]利用siRNA沉默了前列腺癌PC3細胞表達的TTR,發現TTR對PC3細胞的生長和轉移有明顯的促進作用。本研究同樣從生物學行為的角度,發現TTR對RMVEC的影響。本研究在預實驗中設置了TTR濃度分別0、2、4、6 μmol/L共4組,未發現2、4、6 μmol/L組間存在明顯差異。由于人體內TTR正常濃度為4 μmol/L[19],因此本研究采用0、4 μmol/L兩個濃度進行進一步的觀察。通過采用MMT法、細胞遷移實驗、細胞劃痕實驗等經典實驗方法,經過反復多次實驗,結果一致。說明TTR的確能影響RMVEC的增生、遷移、損傷愈合能力,這對通過RMVEC研究眼科疾病的發生發展提供了一條新思路。
然而,TTR對RMVEC作用的上下游細胞因子尚未在本實驗中明確。在前列腺癌PC3細胞系中,證實了TTR是通過c-myc信號通路對其產生生物學行為方面的影響[20, 21]。在研究家族淀粉樣變性時,檢測到血清和玻璃體中血管內皮生長因子(VEGF)的濃度變化[2, 17]。而TTR是否是通過VEGF實現對RMVEC的作用亦有待進一步研究證實。此外,RPE細胞、Müller細胞等在眼部生理和解剖中都扮演重要的作用,TTR對它們的影響亦有待深入的研究。
轉甲狀腺素蛋白(TTR)也稱前白蛋白,為相對分子質量55×103的同源四聚體蛋白,主要由肝臟、脈絡膜叢和胰島細胞等合成。在眼內,視網膜色素上皮(RPE)細胞是TTR的唯一來源 [1]。TTR是20種淀粉樣蛋白之一,除了涉及多種形式基因突變的玻璃體淀粉樣變性的研究外[2-4],亦有TTR血清或玻璃體濃度在糖尿病視網膜病變、高度近視等疾病中存在異常表達的報道[5-10]。然而TTR濃度的差異表達是否對疾病有作用,其作用的途徑、機制和靶點等仍有待于進一步基礎研究。視網膜微血管內皮細胞(RMVEC)是研究諸多眼科疾病基礎的重要媒介[11, 12]。本研究通過了解TTR對RMVEC生物學行為的影響,希望從細胞學角度了解TTR是否對RMVEC有作用,為進一步研究其機制提供實驗依據。現將結果報道如下。
1 材料和方法
RMVEC(實驗室自存),澳洲胎牛血清(FBS,美國Gibco公司),Dulbecco改良Eagle(DMEM)/F12培養基(美國Hyclone公司),0.25%胰蛋白酶-乙二胺四乙酸(EDTA)消化液(凱基生物科技發展有限公司),二甲基亞砜(DMSO,美國Amresco公司),人血漿前白蛋白(prealbumin human plasma,美國Millipore公司),24孔Transwell培養板(美國Corning公司)。
RMVEC置于含100 ml/L FBS的DMEM/F12培養基,37℃,5%CO2培養箱中傳代培養,1.25 g/L胰蛋白酶和1 g/L EDTA消化。取第6~8代細胞用于實驗。 用不含FBS的DMEM/F12培養基溶解干粉狀TTR,以TTR濃度不同分為0(初始濃度)、4 μmol/L組。
以細胞密度1×104個/孔將RMVEC接種于96孔板中,共10孔,每5孔歸入一組。每孔加入200 μl相應蛋白濃度的無血清DMEM/F12培養基,培養48 h后加入MTT溶液,繼續培養4 h后棄上清,每孔加入150 μl DMSO,震蕩混勻10 min,490 nm波長酶標儀檢測其吸光度[A,舊稱光密度(OD)]值。按公式計算細胞增生的提升率:提升率(%)=(1-4 μmol/L 組A值/初始濃度組A值)×100%。
在24孔板各孔內分別加入含有0、4 μmol/L TTR的無血清DMEM/F12培養基600 μl,同時置入孔徑為8.0 μm的Transwell小室,小室內加入200 μl 含1×104個RMVEC的無FBS培養基培養。48 h后吸棄上下室培養基,用棉簽擦凈上室內細胞,24孔板內加入0.4 g/L多聚甲醛600 μl室溫固定30 min,吸棄多聚甲醛,磷酸鹽緩沖液(PBS)沖洗小室背面2遍,24孔板內加入結晶紫600 μl,室溫染色20 min,吸出后PBS沖洗小室背面2遍。顯微鏡下觀察照相,隨機取5個視野進行細胞計數。
預先用記號筆在35 mm培養皿底面作井字形標記,接種培養RMVEC,待細胞密度近100%時,使用10 μl槍頭根據井字形標記劃痕,PBS沖洗后更換培養基,分別加入0、4 μmol/L濃度TTR,于0(初始時間)、24、48 h分別拍攝各皿細胞顯微圖像,ImageJ圖像軟件測量邊緣距離變化。
應用SPSS 15.0統計軟件進行統計學分析處理。數據以均數±標準差(
2 結果
MTT法檢測結果顯示,初始濃度組、4 μmol/L組A值分別為0.17±0.02、0.40±0.03。兩組A值比較,差異有統計學意義(t=15.47,P=0.0001)(圖 1)。4 μmol/L組細胞增生率較初始濃度組提升57.4%。
 圖1
48 h不同濃度TTR對RMVEC增生的影響。*P<0.01
圖1
48 h不同濃度TTR對RMVEC增生的影響。*P<0.01
細胞遷移實驗結果顯示,初始濃度組、4 μmol/L組RMVEC向外遷移數分別為(140±7)、(227±14)個。 兩組間RMVEC向外遷移數比較,差異有統計學意義(t=5.44,P=0.000 6)(圖 2)。
 圖2
48 h不同濃度TTR 對RMVEC遷移的影響。*P<0.01
圖2
48 h不同濃度TTR 對RMVEC遷移的影響。*P<0.01
細胞劃痕實驗結果顯示,初始時間各組細胞劃痕間距大致相等;24 h,初始濃度組、4 μmol/L組劃痕愈合距離分別為(134.4±45.4)、(330.0±23.1) μm。兩組細胞劃痕愈合距離比較,差異有統計學意義(t=8.25,P<0.01)。48 h,4 μmol/L組完全愈合,初始濃度組未愈合(圖 3)。
 圖3
細胞劃痕實驗結果。3A.細胞顯微鏡像;3B.初始濃度組、4 μmol/L組細胞愈合距離比較。*P<0.01
圖3
細胞劃痕實驗結果。3A.細胞顯微鏡像;3B.初始濃度組、4 μmol/L組細胞愈合距離比較。*P<0.01
3 討論
TTR在體內的主要作用是轉運甲狀腺素或與視黃醇結合蛋白結合,參與視黃醇的轉運[13]。TTR血液或玻璃體濃度在一些系統及眼疾病狀態下與正常狀態之間存在差異[5-10, 14-17]。郭悅江等[18]利用siRNA沉默了前列腺癌PC3細胞表達的TTR,發現TTR對PC3細胞的生長和轉移有明顯的促進作用。本研究同樣從生物學行為的角度,發現TTR對RMVEC的影響。本研究在預實驗中設置了TTR濃度分別0、2、4、6 μmol/L共4組,未發現2、4、6 μmol/L組間存在明顯差異。由于人體內TTR正常濃度為4 μmol/L[19],因此本研究采用0、4 μmol/L兩個濃度進行進一步的觀察。通過采用MMT法、細胞遷移實驗、細胞劃痕實驗等經典實驗方法,經過反復多次實驗,結果一致。說明TTR的確能影響RMVEC的增生、遷移、損傷愈合能力,這對通過RMVEC研究眼科疾病的發生發展提供了一條新思路。
然而,TTR對RMVEC作用的上下游細胞因子尚未在本實驗中明確。在前列腺癌PC3細胞系中,證實了TTR是通過c-myc信號通路對其產生生物學行為方面的影響[20, 21]。在研究家族淀粉樣變性時,檢測到血清和玻璃體中血管內皮生長因子(VEGF)的濃度變化[2, 17]。而TTR是否是通過VEGF實現對RMVEC的作用亦有待進一步研究證實。此外,RPE細胞、Müller細胞等在眼部生理和解剖中都扮演重要的作用,TTR對它們的影響亦有待深入的研究。