引用本文: 田潤, 梅妍, 陳臻, 方林, 李小芹. 血小板反應蛋白1活性片段VR-10合成多肽對恒河猴脈絡膜視網膜內皮細胞增生及遷移的影響. 中華眼底病雜志, 2015, 31(3): 274-278. doi: 10.3760/cma.j.issn.1005-1015.2015.03.015 復制
我們的前期研究發現,缺氧狀態下人視網膜色素上皮細胞中血小板反應蛋白-1(TSP-1)的表達隨時間延長而減少,其可能作為血管生成的負向作用因子參與血管新生性疾病的發生發展[1]。近年來TSP-1在眼部的作用研究越來越多[2-5],但有關TSP-1在眼部新生血管生成中的具體作用還不明確。研究表明,TSP-1是結構復雜的大分子糖蛋白,其中Ⅰ型重復序列(TSRs)被認為是抑制內皮細胞增生、誘導內皮細胞凋亡和抑制血管新生等作用的結構基礎[6, 7]。而內皮細胞是血管生成的關鍵因素,抗血管生成治療也多針對內皮細胞的增生及移行能力進行。為此,我們針對TSRs設計合成了活性片段VR-10合成多肽,觀察其對恒河猴脈絡膜視網膜內皮細胞(RF/6A)增生、遷移及凋亡相關基因的作用,以期為抗新生血管性疾病的防治提供新思路。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料、細胞培養及分組
RF/6A細胞株由陳偉博士惠贈。傳代3~10代細胞用于實驗。VR-10合成多肽由百奧泰生物科技(廣州)公司合成,純化及分析,肽序纈氨酸-蘇氨酸-半胱氨酸-甘氨酸-纈氨酸-異亮氨酸-蘇氨酸-精氨酸-異亮氨酸-精氨酸,分子量1 117.3,純度97.85%。重組人TSP-1蛋白(美國R&D公司),兔抗人凋亡相關因子配體(FAS)多克隆抗體(武漢博士德生物工程有限公司),兔抗人半胱天冬酶(caspase)-3多克隆抗體、羊抗兔IgG/異硫氰酸熒光素(FITC)、兔抗羊IgG/FITC(美國Santa Cruz公司)。
采用含10%牛血清蛋白(BSA)的最低必需培養液(MEM),將RF/6A細胞株置于5% CO2、95%空氣、90%濕度、37℃細胞培養箱中培養,次日更換培養液。
實驗分為對照組、干預組進行。干預組包括0.1、1.0、10.0μg/ml VR-10合成多肽組及1.0μg/ml TSP-1全肽組。各組細胞均采用含10%胎牛血清(FBS)的完全培養基培養,干預組在此基礎上采用與其分組相對應的濃度、藥物干預細胞。
1.2 實驗方法
采用噻唑藍(MTT)法檢測干預組RF/6A細胞存活率。以100μl/孔接種細胞,細胞密度約為1×104個/ml,在5% CO2空氣及100%濕度的細胞培養箱中分別孵育6、12、24、48 h,每孔加入1倍MTT 50μl,在37℃孵育4 h。酶標儀在570 nm波長處檢測每孔的吸光度[A,舊稱光密度(OD)]值。實驗重復3次。細胞存活率=(加藥細胞A值/對照細胞A值)×100%。
細胞培養24 h后,0.01 mol/L磷酸鹽緩沖液(PBS)洗滌2次,換無血清MEM培養基饑餓培養6 h。0.25%胰酶消化后,含0.05%BSA無血清MEM培養基終止消化,調整細胞數為5×104個/ml。在24孔板、濾膜為8μm孔徑的聚碳酸脂微孔濾膜Transwell小室上室中加入細胞懸液200μl,下室加入含10%FBS的MEM培養基500μl。37℃培養24 h。上室經PBS洗滌后,用4%多聚甲醛固定遷移至上室外表面上的細胞,蘇木精-伊紅染色,顯微鏡下計算遷移細胞數。取5個視野計數穿膜細胞數并取均值。遷移抑制率=(對照組遷移細胞數-干預組遷移細胞數)/對照組遷移細胞數×100%。
采用蛋白免疫印跡法(Western blot)檢測10.0μg/ml VR-10合成多肽組RF/6A細胞中caspase-3、FAS的蛋白表達。提取細胞內總蛋白,配膠后蛋白上樣,每個電泳道加樣20μl,電壓調至200 V,電泳。轉膜后加一抗(FAS:1:200;caspase-3:1:400),4℃過夜,加二抗羊抗兔IgG/辣根過氧化物酶(1:40 000),37℃,1 h,磷酸鹽吐溫緩沖液(PBST)洗膜4次。暗室內采用增強化學發光法檢測目的條帶,膠片曝光,定影并顯影,將背景較高的底片放入X線片背景去除液中,觀察到理想的結果時終止反應,用水清洗去除不需要的背景。陽性條帶以Gel Pro4.0版凝膠光密度分析軟件進行分析,測量其A值。以目的條帶與磷酸甘油醛脫氫酶(GAPDH)內參照條帶的比值代表蛋白的表達水平。
采用逆轉錄聚合酶鏈反應(RT-PCR)檢測10.0μg/ml VR-10合成多肽組RF/6A細胞中B細胞淋巴瘤/白血病-2(bcl-2)、FAS配體(FASL)及β-肌動蛋白(β-actin)的mRNA表達。細胞消化后,將細胞密度為5×104個/ml的細胞懸液接種于6孔板,在37℃、5%CO2孵箱中培養24 h。待細胞近融合狀態時,換含0.2%BSA的MEM培養基培養24 h后,加入含10.0μg/ml VR-10合成多肽的MEM完全培養基進行干預,不含合成多肽的MEM完全培養基為對照組,在37℃、5%CO2培養箱中培養24 h后進行RT-PCR檢測。每并列3孔為一組,實驗重復3次。Trizol提取總RNA,經RT-PCR合成cDNA第1鏈,引物由上海生工公司合成。FASL:上游引物5′-ATG CAGCAGCCCTTCAATTA-3′,下游引物5′-ATCCT ACCAAGGCAACCAG-3′,擴增片段引物長度273堿基對(bp);bcl-2:上游引物5′-CTGGGAGAACAGG GTACGA-3′,下游引物5′-ATGACCCCACCGAACT CAA-3′,擴增片段引物長度460 bp。FASL反應條件:95℃預變性5 min,94℃30 s,54℃30 s,72℃30 s,共30個循環,最終72℃延伸5 min;bcl-2反應條件:95℃預變性5 min,94℃30 s,54℃30 s,72℃30 s,共37個循環,最終72℃延伸5 min。擴增產物以1.5%瓊脂糖凝膠電泳,紫外燈下觀察并照相。
1.3 統計學方法
采用SPSS 16.0統計軟件行統計分析,數據以均數±標準差(
2 結果
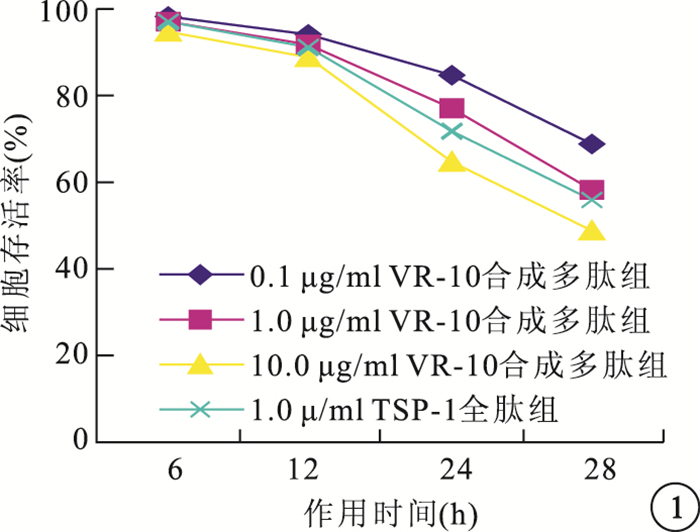
MTT法檢測結果顯示,隨作用時間延長,干預組RF/6A細胞存活率越低;隨VR-10合成多肽濃度增加,RF/6A細胞存活率也越低。以作用48 h時10.0μg/ml VR-10合成多肽組RF/6A細胞存活率最低,為78%(圖 1)。10.0μg/ml VR-10合成多肽組RF/6A細胞存活率與其他干預組比較,差異有統計學意義(P<0.05)。
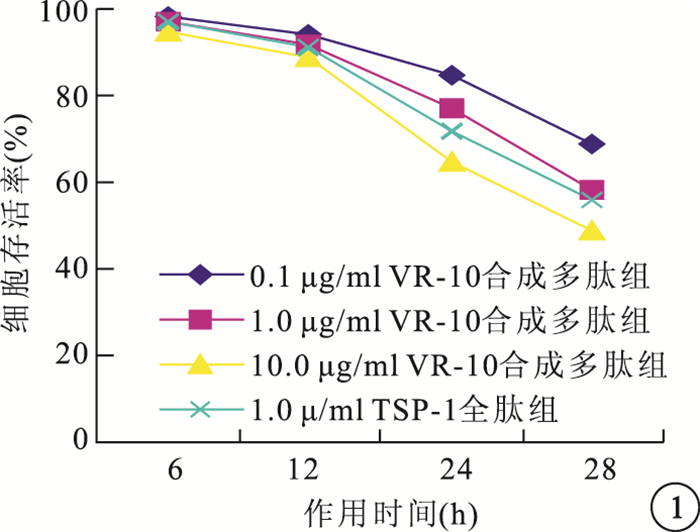 圖1
不同作用時間干預組RF/6A細胞存活率比較
圖1
不同作用時間干預組RF/6A細胞存活率比較
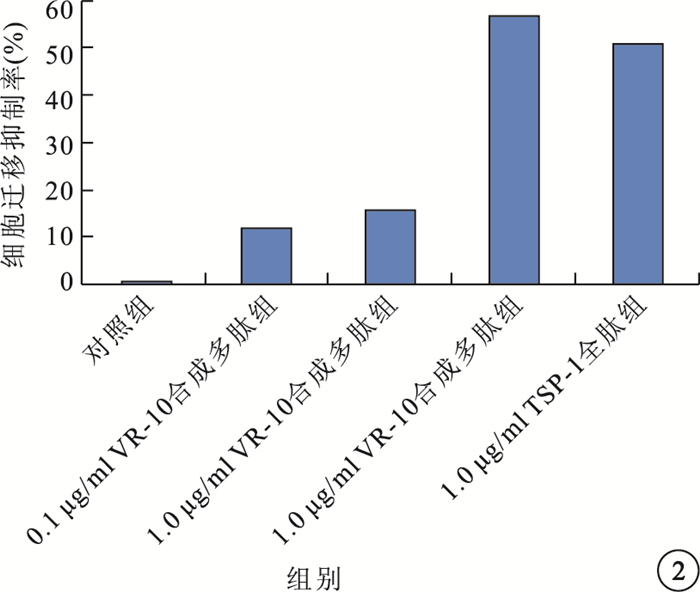
細胞培養24 h后,對照組,0.1、1.0、10.0μg/ml VR-10合成多肽組及1.0μg/ml TSP-1全肽組RF/6A細胞遷移抑制率分別為0.0%、11.8%、15.6%、56.8%、51.0%。以10.0μg/ml VR-10合成多肽組最高,1.0μg/ml TSP-1全肽組次之。與對照組比較,不同濃度VR-10合成多肽組及1.0μg/ml TSP-1全肽組RF/6A細胞遷移抑制率均明顯增加,差異有統計學意義(P<0.05)。0.1μg/ml VR-10合成多肽組與1.0μg/ml VR-10合成多肽組RF/6A細胞遷移抑制率比較,差異無統計學意義(P=0.114)(圖 2)。
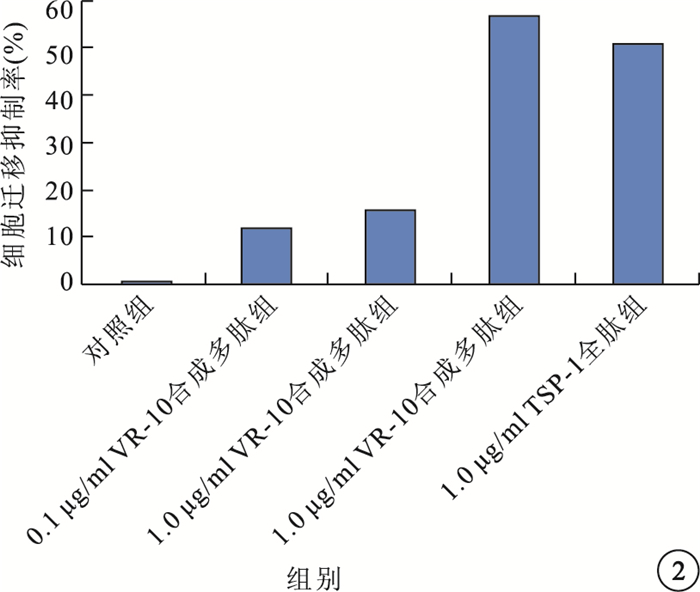 圖2
細胞培養24 h后各組RF/6A細胞遷移抑制率比較
圖2
細胞培養24 h后各組RF/6A細胞遷移抑制率比較
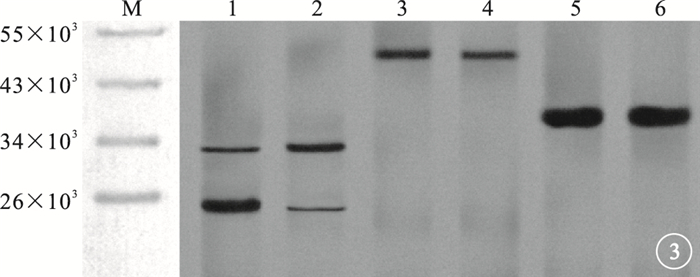
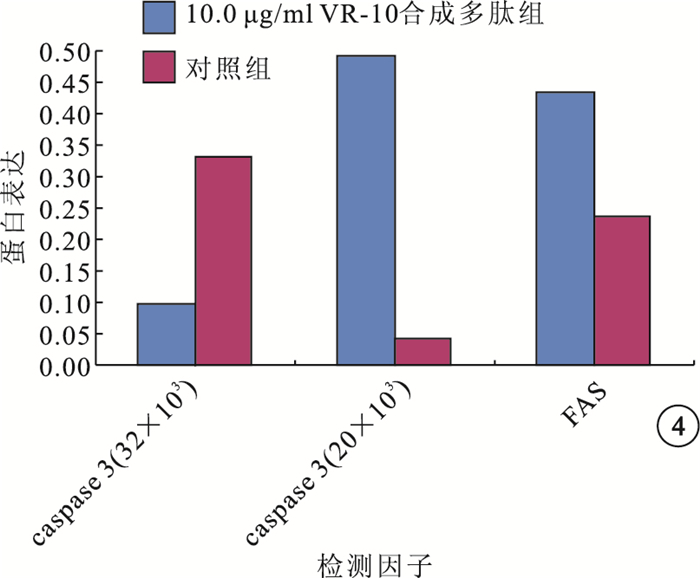
Western blot檢測結果顯示,在相對分子質量32×103、20×103處可見caspase-3蛋白條帶,在相對分子質量48×103處可見FAS蛋白條帶(圖 3)。10.0μg/ml VR-10合成多肽組與對照組RF/6A細胞中caspase-3(t=-66.240、138.813)、FAS(t=163.114)蛋白表達比較,差異均有統計學意義(P<0.05)(圖 4)。
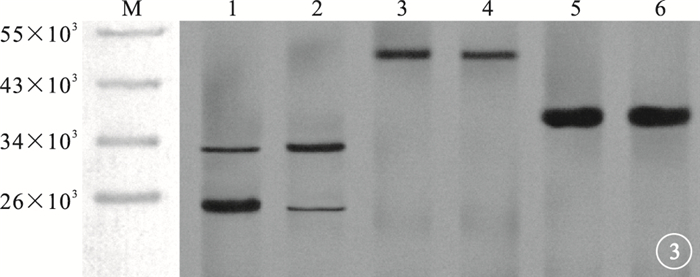 圖3
10.0μg/ml VR-10合成多肽組與對照組Western blot檢測像。M.標記物;1、3、5分別為10.0μg/ml VR-10合成多肽組caspase-3、FAS、GAPDH;2、4、6分別為對照組caspase-3、FAS、GAPDH
圖3
10.0μg/ml VR-10合成多肽組與對照組Western blot檢測像。M.標記物;1、3、5分別為10.0μg/ml VR-10合成多肽組caspase-3、FAS、GAPDH;2、4、6分別為對照組caspase-3、FAS、GAPDH
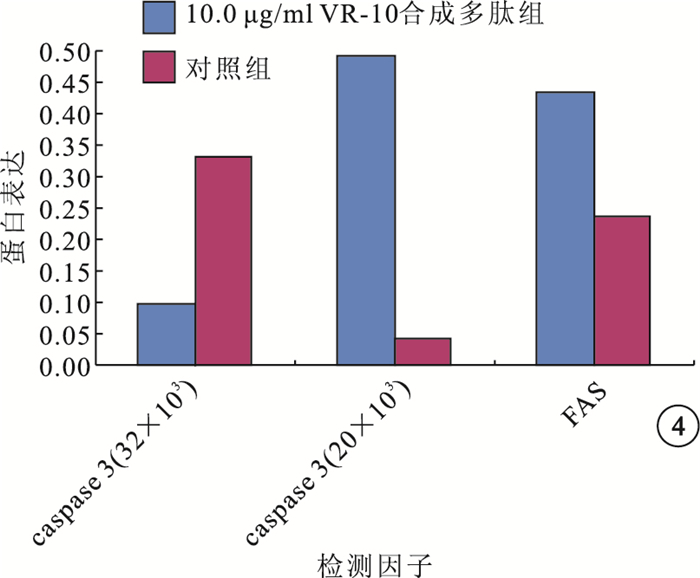 圖4
10.0μg/ml VR-10合成多肽組與對照組caspase-3、FAS蛋白表達比較
圖4
10.0μg/ml VR-10合成多肽組與對照組caspase-3、FAS蛋白表達比較
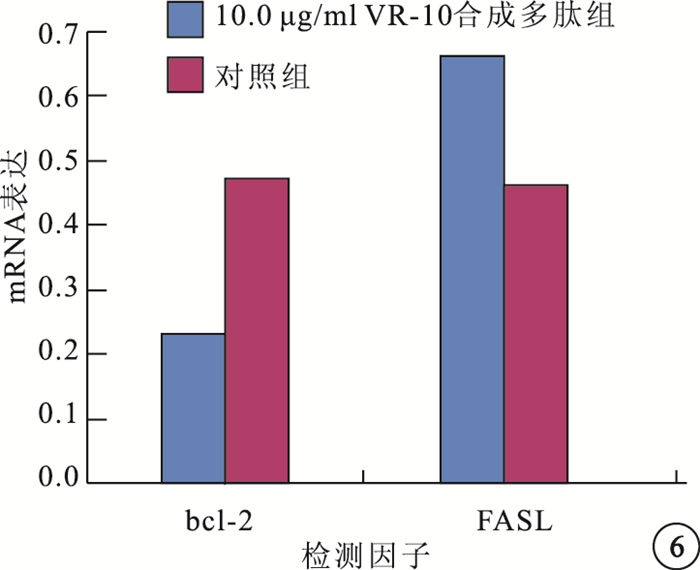
RT-PCR檢測結果顯示,與對照組比較,10.0μg/ml VR-10合成多肽組bcl-2 mRNA表達明顯降低,差異有統計學意義(t=-67.419,P=0.000);FASL mRNA表達明顯增強,差異也有統計學意義(t=39.365,P=0.001)(圖 5,6)。
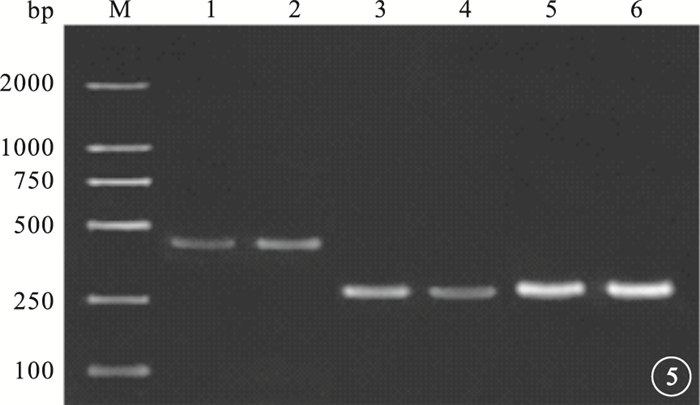
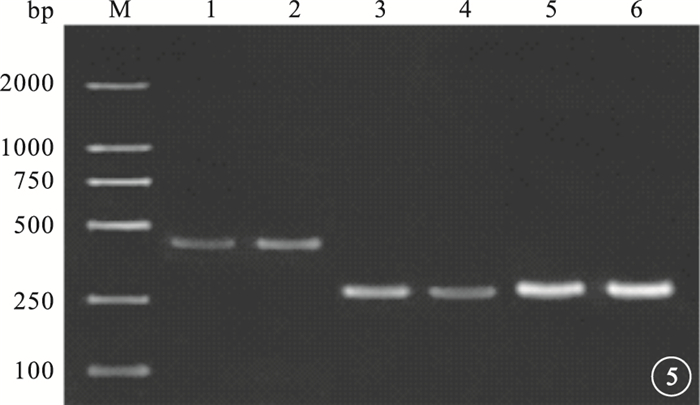 圖5
10.0μg/ml VR-10合成多肽組與對照組RT-PCR檢測像。M.標記物;1、3、5分別為10.0μg/ml VR-10合成多肽組bcl-2、FASL、β-actin;2、4、6分別為對照組bcl-2、FASL、β-actin
圖5
10.0μg/ml VR-10合成多肽組與對照組RT-PCR檢測像。M.標記物;1、3、5分別為10.0μg/ml VR-10合成多肽組bcl-2、FASL、β-actin;2、4、6分別為對照組bcl-2、FASL、β-actin
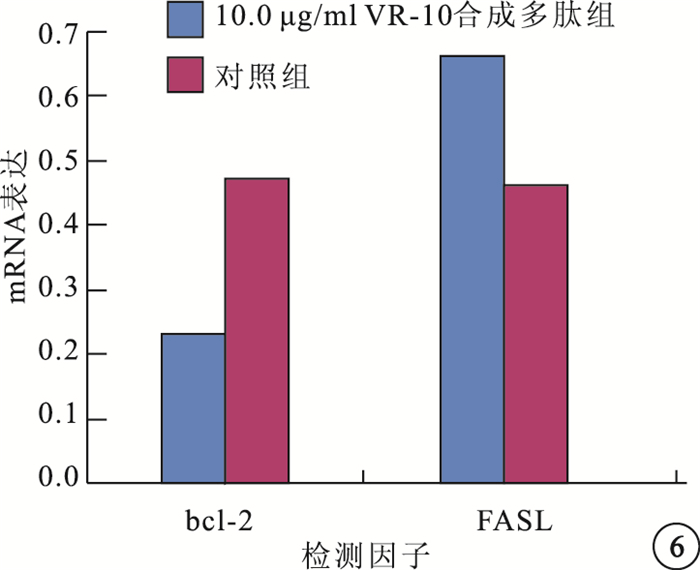 圖6
10.0μg/ml VR-10合成多肽組與對照組bcl-2、FASL mRNA表達比較
圖6
10.0μg/ml VR-10合成多肽組與對照組bcl-2、FASL mRNA表達比較
3 討論
TSRs作為TSP-1抗血管生成的主要活性區域受到廣泛關注。通過化學合成多肽方法可認識其作用并為藥物開發提供理論依據[7]。TSRs主要包括3個活性片段序列:(1)?CSVTCG序列,可抑制成纖維細胞生長因子(FGF)-2和VEGF誘導的雞絨毛膜尿囊膜內毛細血管的形成[8, 9];(2)?WSHWSPW序列,可抑制FGF-2誘導的血管形成,而對VEGF誘導的血管新生無作用[8, 9];(3)?GVITRIR序列,對FGF-2和VEGF誘導的內皮細胞移行有抑制作用,可抗血管新生[10]。本研究設計合成多肽VR-10是包含GVITRIR序列及VTC氨基酸的十肽分子,且處于TSP-1抗血管新生活性區段,既排除了TSP-1 C-端促血管新生區域及與血管新生無關的其他調節區對治療作用的干擾,又有效地解決了臨床上應用大分子多肽在藥代動力學上的困難。
血管生成的一個主要步驟是內皮細胞的增生,TSP-1在體外可直接抑制兔黃體、牛腎上腺皮質、肺動脈、人臍靜脈及牛視網膜內皮細胞的增生,這種抑制作用被抗TSP-1單克隆抗體所中和[11, 12]。本研究應用MTT法檢測TSP-1全肽及VR-10合成多肽對RF/6A細胞亦顯示出抑制作用,且合成多肽具有劑量依賴性。RF/6A細胞屬于微血管內皮細胞,作為血管新生的載體細胞,對其增生的抑制是TSP-1全肽及VR-10合成多肽參與抗血管生成活性的一個主要方面。
內皮細胞在細胞因子的趨化下發生遷移,在異常血管新生中起重要作用。本研究運用Transwell小室遷移實驗證實TSP-1全肽及VR-10合成多肽對RF/6A細胞遷移具有抑制作用,與Yafai等[12]研究結果相似。血管新生與內皮細胞遷移有關,TSP-1全肽及VR-10合成多肽對RF/6A細胞遷移的抑制作用可能是其抗血管新生的機制之一。
Bcl-2基因過度表達可以促進細胞生存,但不能通過刺激細胞分裂、增生、阻斷細胞凋亡而延長細胞壽命,因而又被稱為生存基因[13]。N?r等[14]研究發現,TSP-1誘導人皮膚微血管內皮細胞凋亡呈劑量依賴性,添加TSP-1于人皮膚微血管內皮細胞培養后,bcl-2表達減少2.2倍。本研究結果顯示,10.0μg/ml VR-10合成多肽作用RF/6A細胞表達bcl-2 mRNA較對照組減少。說明VR-10合成多肽亦可通過改變bcl-2的基因表達而參與RF/6A細胞的凋亡。
FAS是細胞膜Ⅰ型糖蛋白,屬于腫瘤壞死因子受體家族,主要以膜受體形式存在,在細胞凋亡中具有信號傳導作用。FAS與FASL結合使細胞表面FAS分子交聯,凋亡信號被傳到細胞內,通過調節蛋白,征集活化caspase-8,啟動級聯反應導致細胞死亡,所以FASL又稱死亡因子[15]。Volpert等[9]研究發現,皮膚微血管內皮細胞持續低量表達FAS及FASL。TSP-1通過上調FASL表達誘導凋亡外部途徑的活化。對于FAS/FASL缺陷小鼠,TSP-1不能抑制堿性FGF誘導的角膜新生血管,提示FAS/FASL凋亡受體途徑在TSP-1誘導凋亡中起重要作用。本研究結果顯示,10.0μg/mlVR-10合成多肽作用RF/6A細胞表達FASL mRNA及FAS蛋白較對照組增加。提示該合成多肽通過FAS/FASL途徑誘導細胞凋亡。
細胞凋亡是caspase-3家族成員介導的蛋白酶級聯反應過程,caspase-3是細胞凋亡蛋白酶級聯反應的必經之路,亦是caspase酶聯反應的終末因子。我們發現,在相對分子質量32×103、20×103處可見caspase-3蛋白條帶。說明對照組RF/6A細胞中caspase-3蛋白多為無活性酶原形式,在10.0μg/ml VR-10合成多肽處理作用下,表達FASL mRNA及FAS蛋白均有增加,從而使得caspase-3蛋白被激活產生活性小分子片段。提示VR-10合成多肽亦存在依賴caspase-3活化介導的內皮細胞凋亡而下調血管生成。
本研究結果表明,TSP-1活性片段VR-10合成多肽對RF/6A細胞增生、遷移具有抑制作用,通過增加凋亡促進基因FAS/FASL而活化caspase-3,同時伴有生存基因bcl-2的減少,共同作用介導內皮細胞凋亡。提示VR-10合成多肽可為抗新生血管性疾病的防治提供新思路。但本研究未能在缺氧條件下深入分析VR-10合成多肽對內皮細胞的影響,是一不足。有關VR-10合成多肽在新生血管性疾病中的確切作用尚有待進一步研究來探討。
我們的前期研究發現,缺氧狀態下人視網膜色素上皮細胞中血小板反應蛋白-1(TSP-1)的表達隨時間延長而減少,其可能作為血管生成的負向作用因子參與血管新生性疾病的發生發展[1]。近年來TSP-1在眼部的作用研究越來越多[2-5],但有關TSP-1在眼部新生血管生成中的具體作用還不明確。研究表明,TSP-1是結構復雜的大分子糖蛋白,其中Ⅰ型重復序列(TSRs)被認為是抑制內皮細胞增生、誘導內皮細胞凋亡和抑制血管新生等作用的結構基礎[6, 7]。而內皮細胞是血管生成的關鍵因素,抗血管生成治療也多針對內皮細胞的增生及移行能力進行。為此,我們針對TSRs設計合成了活性片段VR-10合成多肽,觀察其對恒河猴脈絡膜視網膜內皮細胞(RF/6A)增生、遷移及凋亡相關基因的作用,以期為抗新生血管性疾病的防治提供新思路。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料、細胞培養及分組
RF/6A細胞株由陳偉博士惠贈。傳代3~10代細胞用于實驗。VR-10合成多肽由百奧泰生物科技(廣州)公司合成,純化及分析,肽序纈氨酸-蘇氨酸-半胱氨酸-甘氨酸-纈氨酸-異亮氨酸-蘇氨酸-精氨酸-異亮氨酸-精氨酸,分子量1 117.3,純度97.85%。重組人TSP-1蛋白(美國R&D公司),兔抗人凋亡相關因子配體(FAS)多克隆抗體(武漢博士德生物工程有限公司),兔抗人半胱天冬酶(caspase)-3多克隆抗體、羊抗兔IgG/異硫氰酸熒光素(FITC)、兔抗羊IgG/FITC(美國Santa Cruz公司)。
采用含10%牛血清蛋白(BSA)的最低必需培養液(MEM),將RF/6A細胞株置于5% CO2、95%空氣、90%濕度、37℃細胞培養箱中培養,次日更換培養液。
實驗分為對照組、干預組進行。干預組包括0.1、1.0、10.0μg/ml VR-10合成多肽組及1.0μg/ml TSP-1全肽組。各組細胞均采用含10%胎牛血清(FBS)的完全培養基培養,干預組在此基礎上采用與其分組相對應的濃度、藥物干預細胞。
1.2 實驗方法
采用噻唑藍(MTT)法檢測干預組RF/6A細胞存活率。以100μl/孔接種細胞,細胞密度約為1×104個/ml,在5% CO2空氣及100%濕度的細胞培養箱中分別孵育6、12、24、48 h,每孔加入1倍MTT 50μl,在37℃孵育4 h。酶標儀在570 nm波長處檢測每孔的吸光度[A,舊稱光密度(OD)]值。實驗重復3次。細胞存活率=(加藥細胞A值/對照細胞A值)×100%。
細胞培養24 h后,0.01 mol/L磷酸鹽緩沖液(PBS)洗滌2次,換無血清MEM培養基饑餓培養6 h。0.25%胰酶消化后,含0.05%BSA無血清MEM培養基終止消化,調整細胞數為5×104個/ml。在24孔板、濾膜為8μm孔徑的聚碳酸脂微孔濾膜Transwell小室上室中加入細胞懸液200μl,下室加入含10%FBS的MEM培養基500μl。37℃培養24 h。上室經PBS洗滌后,用4%多聚甲醛固定遷移至上室外表面上的細胞,蘇木精-伊紅染色,顯微鏡下計算遷移細胞數。取5個視野計數穿膜細胞數并取均值。遷移抑制率=(對照組遷移細胞數-干預組遷移細胞數)/對照組遷移細胞數×100%。
采用蛋白免疫印跡法(Western blot)檢測10.0μg/ml VR-10合成多肽組RF/6A細胞中caspase-3、FAS的蛋白表達。提取細胞內總蛋白,配膠后蛋白上樣,每個電泳道加樣20μl,電壓調至200 V,電泳。轉膜后加一抗(FAS:1:200;caspase-3:1:400),4℃過夜,加二抗羊抗兔IgG/辣根過氧化物酶(1:40 000),37℃,1 h,磷酸鹽吐溫緩沖液(PBST)洗膜4次。暗室內采用增強化學發光法檢測目的條帶,膠片曝光,定影并顯影,將背景較高的底片放入X線片背景去除液中,觀察到理想的結果時終止反應,用水清洗去除不需要的背景。陽性條帶以Gel Pro4.0版凝膠光密度分析軟件進行分析,測量其A值。以目的條帶與磷酸甘油醛脫氫酶(GAPDH)內參照條帶的比值代表蛋白的表達水平。
采用逆轉錄聚合酶鏈反應(RT-PCR)檢測10.0μg/ml VR-10合成多肽組RF/6A細胞中B細胞淋巴瘤/白血病-2(bcl-2)、FAS配體(FASL)及β-肌動蛋白(β-actin)的mRNA表達。細胞消化后,將細胞密度為5×104個/ml的細胞懸液接種于6孔板,在37℃、5%CO2孵箱中培養24 h。待細胞近融合狀態時,換含0.2%BSA的MEM培養基培養24 h后,加入含10.0μg/ml VR-10合成多肽的MEM完全培養基進行干預,不含合成多肽的MEM完全培養基為對照組,在37℃、5%CO2培養箱中培養24 h后進行RT-PCR檢測。每并列3孔為一組,實驗重復3次。Trizol提取總RNA,經RT-PCR合成cDNA第1鏈,引物由上海生工公司合成。FASL:上游引物5′-ATG CAGCAGCCCTTCAATTA-3′,下游引物5′-ATCCT ACCAAGGCAACCAG-3′,擴增片段引物長度273堿基對(bp);bcl-2:上游引物5′-CTGGGAGAACAGG GTACGA-3′,下游引物5′-ATGACCCCACCGAACT CAA-3′,擴增片段引物長度460 bp。FASL反應條件:95℃預變性5 min,94℃30 s,54℃30 s,72℃30 s,共30個循環,最終72℃延伸5 min;bcl-2反應條件:95℃預變性5 min,94℃30 s,54℃30 s,72℃30 s,共37個循環,最終72℃延伸5 min。擴增產物以1.5%瓊脂糖凝膠電泳,紫外燈下觀察并照相。
1.3 統計學方法
采用SPSS 16.0統計軟件行統計分析,數據以均數±標準差(
2 結果
MTT法檢測結果顯示,隨作用時間延長,干預組RF/6A細胞存活率越低;隨VR-10合成多肽濃度增加,RF/6A細胞存活率也越低。以作用48 h時10.0μg/ml VR-10合成多肽組RF/6A細胞存活率最低,為78%(圖 1)。10.0μg/ml VR-10合成多肽組RF/6A細胞存活率與其他干預組比較,差異有統計學意義(P<0.05)。
 圖1
不同作用時間干預組RF/6A細胞存活率比較
圖1
不同作用時間干預組RF/6A細胞存活率比較
細胞培養24 h后,對照組,0.1、1.0、10.0μg/ml VR-10合成多肽組及1.0μg/ml TSP-1全肽組RF/6A細胞遷移抑制率分別為0.0%、11.8%、15.6%、56.8%、51.0%。以10.0μg/ml VR-10合成多肽組最高,1.0μg/ml TSP-1全肽組次之。與對照組比較,不同濃度VR-10合成多肽組及1.0μg/ml TSP-1全肽組RF/6A細胞遷移抑制率均明顯增加,差異有統計學意義(P<0.05)。0.1μg/ml VR-10合成多肽組與1.0μg/ml VR-10合成多肽組RF/6A細胞遷移抑制率比較,差異無統計學意義(P=0.114)(圖 2)。
 圖2
細胞培養24 h后各組RF/6A細胞遷移抑制率比較
圖2
細胞培養24 h后各組RF/6A細胞遷移抑制率比較
Western blot檢測結果顯示,在相對分子質量32×103、20×103處可見caspase-3蛋白條帶,在相對分子質量48×103處可見FAS蛋白條帶(圖 3)。10.0μg/ml VR-10合成多肽組與對照組RF/6A細胞中caspase-3(t=-66.240、138.813)、FAS(t=163.114)蛋白表達比較,差異均有統計學意義(P<0.05)(圖 4)。
 圖3
10.0μg/ml VR-10合成多肽組與對照組Western blot檢測像。M.標記物;1、3、5分別為10.0μg/ml VR-10合成多肽組caspase-3、FAS、GAPDH;2、4、6分別為對照組caspase-3、FAS、GAPDH
圖3
10.0μg/ml VR-10合成多肽組與對照組Western blot檢測像。M.標記物;1、3、5分別為10.0μg/ml VR-10合成多肽組caspase-3、FAS、GAPDH;2、4、6分別為對照組caspase-3、FAS、GAPDH
 圖4
10.0μg/ml VR-10合成多肽組與對照組caspase-3、FAS蛋白表達比較
圖4
10.0μg/ml VR-10合成多肽組與對照組caspase-3、FAS蛋白表達比較
RT-PCR檢測結果顯示,與對照組比較,10.0μg/ml VR-10合成多肽組bcl-2 mRNA表達明顯降低,差異有統計學意義(t=-67.419,P=0.000);FASL mRNA表達明顯增強,差異也有統計學意義(t=39.365,P=0.001)(圖 5,6)。
 圖5
10.0μg/ml VR-10合成多肽組與對照組RT-PCR檢測像。M.標記物;1、3、5分別為10.0μg/ml VR-10合成多肽組bcl-2、FASL、β-actin;2、4、6分別為對照組bcl-2、FASL、β-actin
圖5
10.0μg/ml VR-10合成多肽組與對照組RT-PCR檢測像。M.標記物;1、3、5分別為10.0μg/ml VR-10合成多肽組bcl-2、FASL、β-actin;2、4、6分別為對照組bcl-2、FASL、β-actin
 圖6
10.0μg/ml VR-10合成多肽組與對照組bcl-2、FASL mRNA表達比較
圖6
10.0μg/ml VR-10合成多肽組與對照組bcl-2、FASL mRNA表達比較
3 討論
TSRs作為TSP-1抗血管生成的主要活性區域受到廣泛關注。通過化學合成多肽方法可認識其作用并為藥物開發提供理論依據[7]。TSRs主要包括3個活性片段序列:(1)?CSVTCG序列,可抑制成纖維細胞生長因子(FGF)-2和VEGF誘導的雞絨毛膜尿囊膜內毛細血管的形成[8, 9];(2)?WSHWSPW序列,可抑制FGF-2誘導的血管形成,而對VEGF誘導的血管新生無作用[8, 9];(3)?GVITRIR序列,對FGF-2和VEGF誘導的內皮細胞移行有抑制作用,可抗血管新生[10]。本研究設計合成多肽VR-10是包含GVITRIR序列及VTC氨基酸的十肽分子,且處于TSP-1抗血管新生活性區段,既排除了TSP-1 C-端促血管新生區域及與血管新生無關的其他調節區對治療作用的干擾,又有效地解決了臨床上應用大分子多肽在藥代動力學上的困難。
血管生成的一個主要步驟是內皮細胞的增生,TSP-1在體外可直接抑制兔黃體、牛腎上腺皮質、肺動脈、人臍靜脈及牛視網膜內皮細胞的增生,這種抑制作用被抗TSP-1單克隆抗體所中和[11, 12]。本研究應用MTT法檢測TSP-1全肽及VR-10合成多肽對RF/6A細胞亦顯示出抑制作用,且合成多肽具有劑量依賴性。RF/6A細胞屬于微血管內皮細胞,作為血管新生的載體細胞,對其增生的抑制是TSP-1全肽及VR-10合成多肽參與抗血管生成活性的一個主要方面。
內皮細胞在細胞因子的趨化下發生遷移,在異常血管新生中起重要作用。本研究運用Transwell小室遷移實驗證實TSP-1全肽及VR-10合成多肽對RF/6A細胞遷移具有抑制作用,與Yafai等[12]研究結果相似。血管新生與內皮細胞遷移有關,TSP-1全肽及VR-10合成多肽對RF/6A細胞遷移的抑制作用可能是其抗血管新生的機制之一。
Bcl-2基因過度表達可以促進細胞生存,但不能通過刺激細胞分裂、增生、阻斷細胞凋亡而延長細胞壽命,因而又被稱為生存基因[13]。N?r等[14]研究發現,TSP-1誘導人皮膚微血管內皮細胞凋亡呈劑量依賴性,添加TSP-1于人皮膚微血管內皮細胞培養后,bcl-2表達減少2.2倍。本研究結果顯示,10.0μg/ml VR-10合成多肽作用RF/6A細胞表達bcl-2 mRNA較對照組減少。說明VR-10合成多肽亦可通過改變bcl-2的基因表達而參與RF/6A細胞的凋亡。
FAS是細胞膜Ⅰ型糖蛋白,屬于腫瘤壞死因子受體家族,主要以膜受體形式存在,在細胞凋亡中具有信號傳導作用。FAS與FASL結合使細胞表面FAS分子交聯,凋亡信號被傳到細胞內,通過調節蛋白,征集活化caspase-8,啟動級聯反應導致細胞死亡,所以FASL又稱死亡因子[15]。Volpert等[9]研究發現,皮膚微血管內皮細胞持續低量表達FAS及FASL。TSP-1通過上調FASL表達誘導凋亡外部途徑的活化。對于FAS/FASL缺陷小鼠,TSP-1不能抑制堿性FGF誘導的角膜新生血管,提示FAS/FASL凋亡受體途徑在TSP-1誘導凋亡中起重要作用。本研究結果顯示,10.0μg/mlVR-10合成多肽作用RF/6A細胞表達FASL mRNA及FAS蛋白較對照組增加。提示該合成多肽通過FAS/FASL途徑誘導細胞凋亡。
細胞凋亡是caspase-3家族成員介導的蛋白酶級聯反應過程,caspase-3是細胞凋亡蛋白酶級聯反應的必經之路,亦是caspase酶聯反應的終末因子。我們發現,在相對分子質量32×103、20×103處可見caspase-3蛋白條帶。說明對照組RF/6A細胞中caspase-3蛋白多為無活性酶原形式,在10.0μg/ml VR-10合成多肽處理作用下,表達FASL mRNA及FAS蛋白均有增加,從而使得caspase-3蛋白被激活產生活性小分子片段。提示VR-10合成多肽亦存在依賴caspase-3活化介導的內皮細胞凋亡而下調血管生成。
本研究結果表明,TSP-1活性片段VR-10合成多肽對RF/6A細胞增生、遷移具有抑制作用,通過增加凋亡促進基因FAS/FASL而活化caspase-3,同時伴有生存基因bcl-2的減少,共同作用介導內皮細胞凋亡。提示VR-10合成多肽可為抗新生血管性疾病的防治提供新思路。但本研究未能在缺氧條件下深入分析VR-10合成多肽對內皮細胞的影響,是一不足。有關VR-10合成多肽在新生血管性疾病中的確切作用尚有待進一步研究來探討。