引用本文: 蔣劍, 夏曉波, 張櫪心. 脂質體介導的過氧化物酶增殖激活受體-γ共激活子-1α特異性小干擾RNA對小鼠視網膜新生血管的抑制作用. 中華眼底病雜志, 2015, 31(3): 268-273. doi: 10.3760/cma.j.issn.1005-1015.2015.03.014 復制
視網膜新生血管(RNV)生成是以缺血、缺氧為基礎,受多種因素及多通路調控的復雜過程[1-5]。過氧化物酶增殖激活受體-γ共激活子-1α(PGC-1α)可上調包括血管內皮生長因子(VEGF)在內的血管生成因子的表達,從而促進新生血管的形成[6]。已有研究表明,PGC-1α可能與RNV相關性疾病有一定的相關性[7, 8]。但以PGC-1α為靶點的基因治療是否可以抑制RNV形成目前尚不明確。為此,我們通過玻璃體腔注射脂質體介導的PGC-1α特異性干擾性RNA(siRNA)這一基因沉默方法,觀察了PGC-1α對小鼠RNV形成的影響,并對其可能作用機制進行了初步探討。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料
7日齡C57BL/6J小鼠80只,體重約10 g,由中國科學院上海實驗動物中心提供。PGC-1αsiRNA、陰性對照siRNA均由中國廣州Ribobio生物技術公司合成。脂質體LipofectamineTM 2000(LF2000)、Trizol(美國Invitrogen公司),異硫氰酸熒光素標記的葡聚糖(FITC-Dextran,美國Sigma公司)。實時聚合酶鏈反應(PCR)試劑(美國MBI公司),PCR引物由上海捷瑞生物技術服務有限公司合成。兔抗鼠PGC-1α抗體、兔抗鼠VEGF抗體、兔抗鼠β-肌動蛋白(β-actin)抗體(美國Abcam公司)。
1.2 PGC-1αsiRNA設計合成、建模及實驗分組
根據GeneBank中小鼠PGC-1α基因(NM_031347)的mRNA序列,合成3條PGC-1αsiRNA的堿基序列。PGC-1αsiRNA1:正義鏈5′-CCAAGACUCUAG ACAACUA dTdT-3′,反義鏈3′-dTdT GGUUCUG AGAUCUGUUGAU-5′;PGC-1αsiRNA 2:正義鏈5′-GCAACAUGCUCAAGCCAAA dTdT-3′,反義鏈3′-dTdT CGUUGUACGAGUUCGGUUU-5′;PGC-1αsiRNA3:正義鏈5′-CUGCGAACAUUUUGAGAA dTdT-3′,反義鏈3′-dTdT GACGCUUGUAUAAA CUCUU-5′。同時合成陰性對照siRNA序列。由脂質體LF2000介導濃度分別為50、100 nmol/L的PGC-1αsiRNA轉染小鼠血管內皮細胞。細胞轉染后48 h,提取細胞總RNA,采用實時PCR檢測PGC-1αmRNA的表達。從3條PGC-1αsiRNA中篩選出具有最佳抑制效應的PGC-1αsiRNA,進行后續基因轉染實驗。
將80只小鼠分為正常組、模型空白組、模型對照組和PGC-1αsiRNA組,每組20只。正常組小鼠于空氣中飼養,不作任何處理。模型空白組、模型對照組和PGC-1αsiRNA組小鼠參照文獻[9]的方法建立氧誘導視網膜病變模型。小鼠12日齡時,模型對照組、PGC-1αsiRNA組小鼠玻璃體腔分別注射陰性對照siRNA-脂質體復合物、PGC-1αsiRNA-脂質體復合物1μl;模型空白組小鼠不作處理。siRNA與脂質體為等體積混合。
1.3 視網膜鋪片、視網膜切片、實時PCR及蛋白免疫印跡(Western blot)檢測
小鼠17日齡時,每組隨機選取3只小鼠。于心尖部進針,左心室灌注配置好的FITC-Dextran 1 ml。在便攜式顯微鏡下作視網膜鋪片,熒光顯微鏡下觀察視網膜血管形態。
小鼠17日齡時,每組隨機選取3只小鼠處死。摘除眼球,石蠟包埋,通過角膜平行視神經作眼球矢狀位系列切片,厚度為5μm。每只眼球隨機選取10張切片,排除含視神經的切片,常規行蘇木精-伊紅(HE)染色。光學顯微鏡下計數突破視網膜內界膜的血管內皮細胞核數。
小鼠17日齡時,每組隨機選取6只小鼠。采用Trizol一步法提取視網膜總RNA,實時PCR檢測各組小鼠視網膜中PGC-1α、VEGF mRNA的表達。PGC-1α:上游引物5′-AGCAGAAAGCAATTGAA GAG-3′,下游引物5′-AGGTGTAACGGTAGGTG ATG-3′,擴增片段長度為堿基對(171)bp。VEGF:上游引物5′-CATCTTCAAGCCGTCCTGT-3′,下游引物5′-GAGGAAAGGGAAAGGGTCA-3′,擴增片段長度為240 bp。β-actin:上游引物5′-AACTTTGG CATTGTGGAAGG-3′,下游引物5′-GGATGCAG GGATGATGTTCT-3′,擴增片段長度為132 bp。PCR反應條件:95℃預變性5 min,94℃20 s,57~60℃20 s,72℃20 s,共40個循環。計算PGC-1αsiRNA組的PGC-1α、VEGF mRNA表達抑制效率。抑制效率=(模型空白組相對表達量-PGC-1αsiRNA組相對表達量)/模型空白組相對表達量×100%。
小鼠17日齡時,每組隨機選取8只小鼠。提取視網膜總蛋白,行聚丙烯酰胺凝膠電泳。電泳結束后轉聚偏氟乙烯(PVDF)膜,甲醇中浸泡透化20 s。轉膜夾一面依次放置預冷的海綿、濾紙、膠,另一面依次放置海綿、濾紙、PVDF膜,將兩面合攏扣上夾子,確保膠與膜之間完全貼合無氣泡,膠面接陰極,膜面接陽極,恒壓70V轉膜90 min;取出PVDF膜,對比蛋白質標準標記物位置,將所需測定片段和β-actin片段膜剪下。加入封閉液,水平搖床室溫下封閉1 h。加入一抗(PGC-1α一抗稀釋比為1 :500,VEGF一抗稀釋比例為1 :200),水平搖床4℃振搖過夜。加入二抗,洗膜。暗室內增強化學發光法檢測目的條帶,X光膠片曝光。以β-actin作為內參照。BandScan 5.0軟件進行條帶灰度分析。計算PGC-1αsiRNA組的PGC-1α、VEGF蛋白表達的抑制效率。抑制效率=(模型空白組灰度值-PGC-1αsiRNA組灰度值)/模型空白組灰度值×100%。
1.4 統計學方法
采用SPSS 19.0統計軟件行統計分析,計量資料以均數±標準差(
2 結果
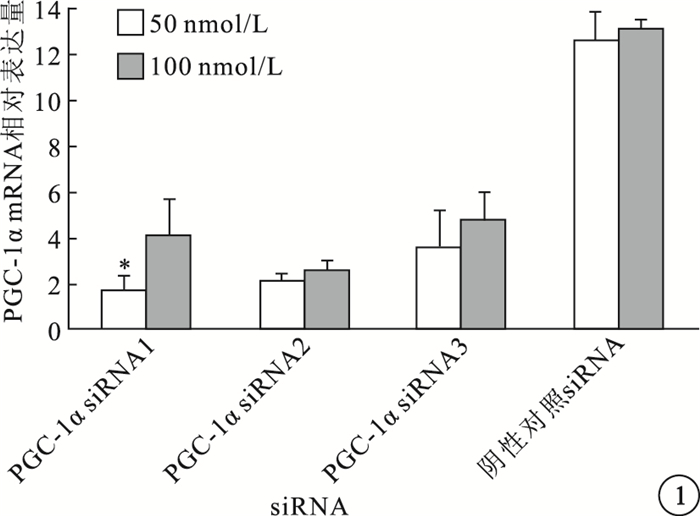
實時PCR檢測結果顯示,50、100 nmol/L濃度條件下,PGC-1αsiRNA1、PGC-1αsiRNA2、PGC-1αsiRNA3對小鼠血管內皮細胞中PGC-1αmRNA表達水平均有不同程度的抑制作用,但以100 nmol/L濃度的PGC-1αsiRNA1抑制效應最佳(P<0.05)(圖 1)。
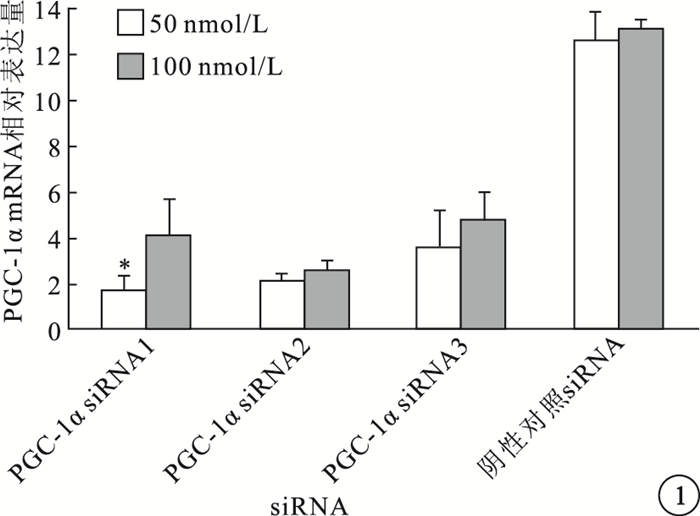 圖1
小鼠血管內皮細胞中PGC-1αmRNA相對表達量比較。*與陰性對照siRNA比較,P<0.05
圖1
小鼠血管內皮細胞中PGC-1αmRNA相對表達量比較。*與陰性對照siRNA比較,P<0.05
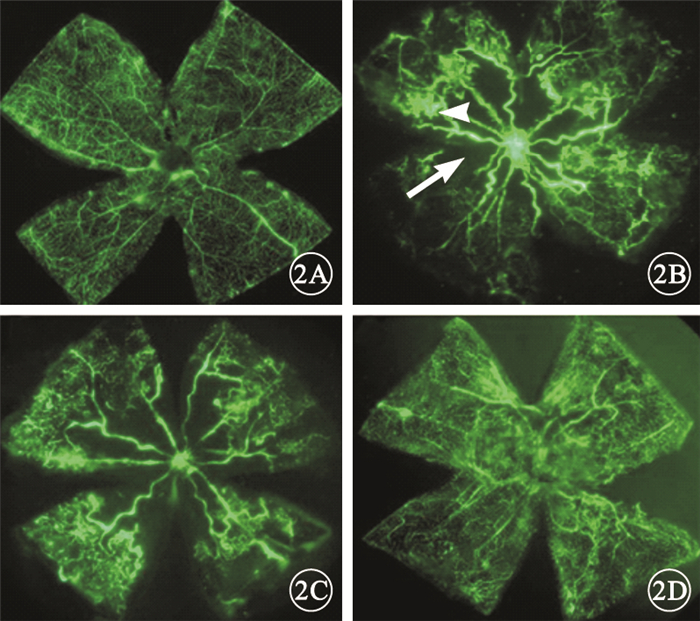
熒光顯微鏡觀察發現,正常組小鼠視網膜血管以視盤為中心呈放射狀走行,直至視網膜周邊部,大血管間的毛細血管交織呈網狀(圖 2A)。模型空白組和模型對照組小鼠視網膜血管不規則、紆曲擴張,視盤周圍血管閉塞,可見大片無血管區,伴有明顯的熒光素滲漏,在無灌注區與灌注區之間可見新生血管叢(圖 2B,2C)。PGC-1αsiRNA組小鼠視網膜新生血管、熒光素滲漏明顯減少,視網膜中央無灌注區面積縮小(圖 2D)。
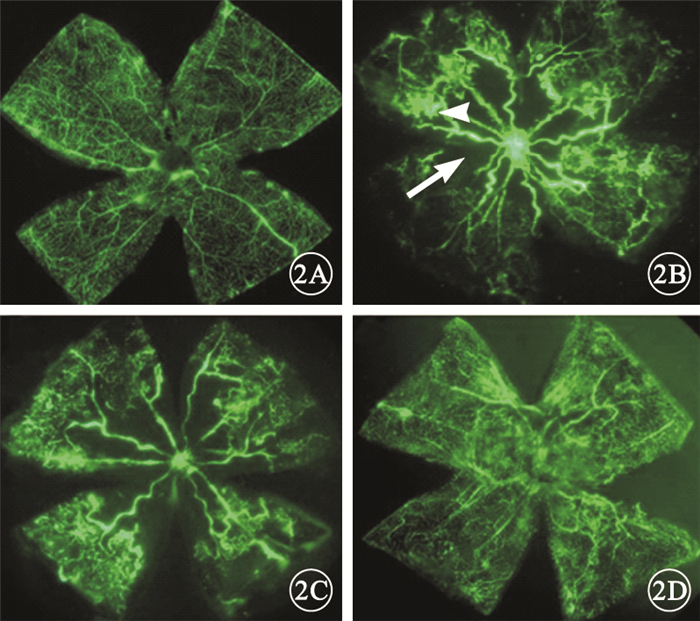 圖2
小鼠視網膜鋪片熒光顯微鏡像。2A.正常組,自視盤發出的血管向四周呈放射狀均勻分布,直至視網膜周邊部,視網膜血管交叉呈網狀;2B、2C分別為模型空白組、模型對照組,視網膜血管紆曲擴張,視盤周邊大片無灌注區(白箭),無灌注區周圍大量新生血管叢(白箭頭),伴有明顯的熒光素滲漏;2D. PGC-1αsiRNA組,視盤周邊無灌注區、新生血管數量以及熒光素滲漏較模型空白組、模型對照組明顯減少?×40
圖2
小鼠視網膜鋪片熒光顯微鏡像。2A.正常組,自視盤發出的血管向四周呈放射狀均勻分布,直至視網膜周邊部,視網膜血管交叉呈網狀;2B、2C分別為模型空白組、模型對照組,視網膜血管紆曲擴張,視盤周邊大片無灌注區(白箭),無灌注區周圍大量新生血管叢(白箭頭),伴有明顯的熒光素滲漏;2D. PGC-1αsiRNA組,視盤周邊無灌注區、新生血管數量以及熒光素滲漏較模型空白組、模型對照組明顯減少?×40
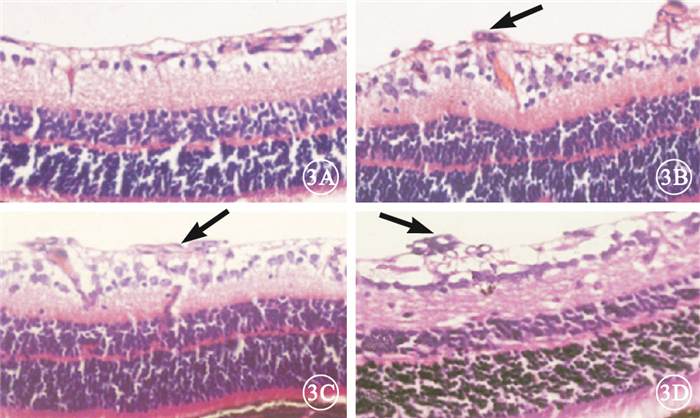
光學顯微鏡觀察發現,正常組小鼠視網膜各層組織排列清晰、整齊,未見新生血管;模型空白組、模型對照組小鼠視網膜表面有大量突破內界膜的血管內皮細胞核,呈叢狀或團狀,甚至形成管腔樣狀;PGC-1αsiRNA組小鼠視網膜表面突破內界膜的內皮細胞核明顯減少(圖 3)。正常組、模型空白組、模型對照組、PGC-1αsiRNA組突破內界膜的血管內皮細胞核計數分別為(0.05±0.01)、(16.70±2.50)、(17.30±3.50)、(6.30±2.50)個,4組間差異有統計學意義(F=2 104.271,P<0.05)。模型空白組、模型對照組突破內界膜的血管內皮細胞核數較正常組明顯增多,差異有統計學意義(P<0.05)。模型空白組、模型對照組突破內界膜的血管內皮細胞核數比較,差異無統計學意義(P>0.05)。PGC-1αsiRNA組突破內界膜的血管內皮細胞核較模型空白組下降了62.3%,差異有統計學意義(P<0.05)。
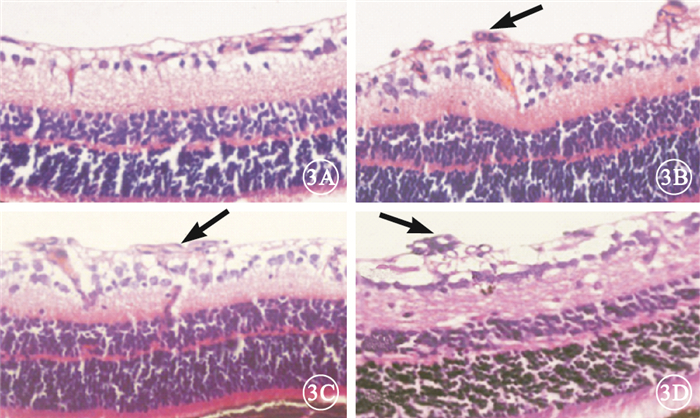 圖3
視網膜切片光學顯微鏡像。3A.正常組,視網膜各層組織排列清晰、整齊,未見新生血管;3B、3C分別為模型空白組、模型對照組,大量突破內界膜的血管內皮細胞核(黑箭);3D. PGC-1αsiRNA組,突破內界膜的血管內皮細胞核(黑箭)較模型空白對照組、模型對照組明顯減少?HE×400
圖3
視網膜切片光學顯微鏡像。3A.正常組,視網膜各層組織排列清晰、整齊,未見新生血管;3B、3C分別為模型空白組、模型對照組,大量突破內界膜的血管內皮細胞核(黑箭);3D. PGC-1αsiRNA組,突破內界膜的血管內皮細胞核(黑箭)較模型空白對照組、模型對照組明顯減少?HE×400
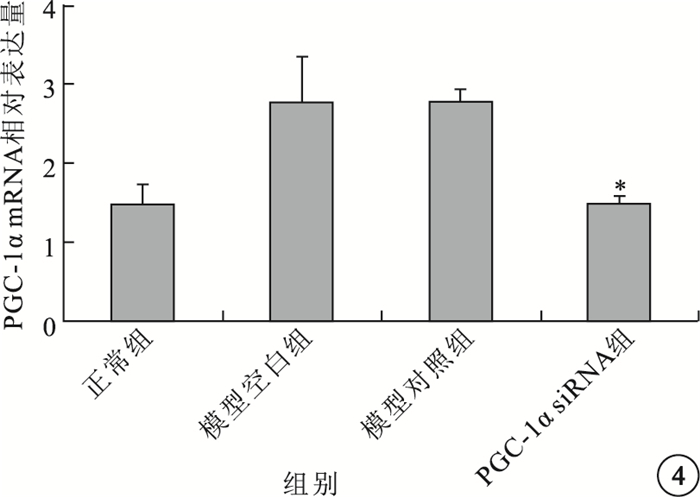
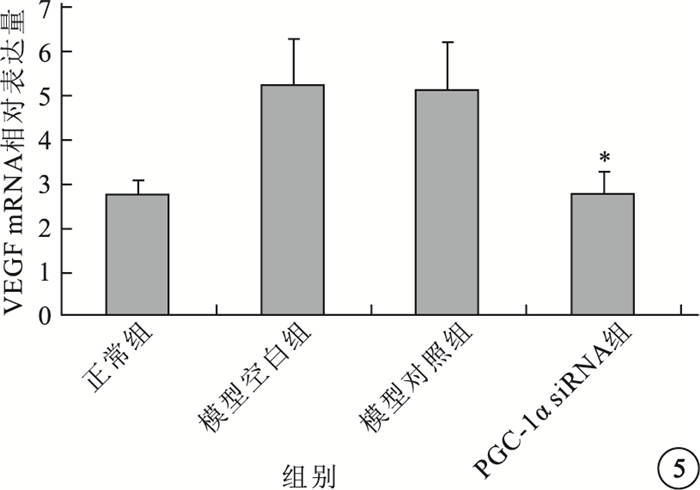
實時PCR檢測結果顯示,模型空白組、模型對照組小鼠視網膜中PGC-1α、VEGF mRNA表達均較正常組明顯上調,差異有統計學意義(P<0.05)。模型空白組、模型對照組小鼠視網膜中PGC-1α、VEGF mRNA表達比較,差異無統計學意義(P>0.05)。PGC-1αsiRNA組小鼠視網膜中PGC-1α、VEGF mRNA表達較模型空白組明顯下調,差異有統計學意義(P<0.05);其PGC-1α、VEGF mRNA表達明顯受抑制,抑制效率分別為54%、48%(圖 4,5)。
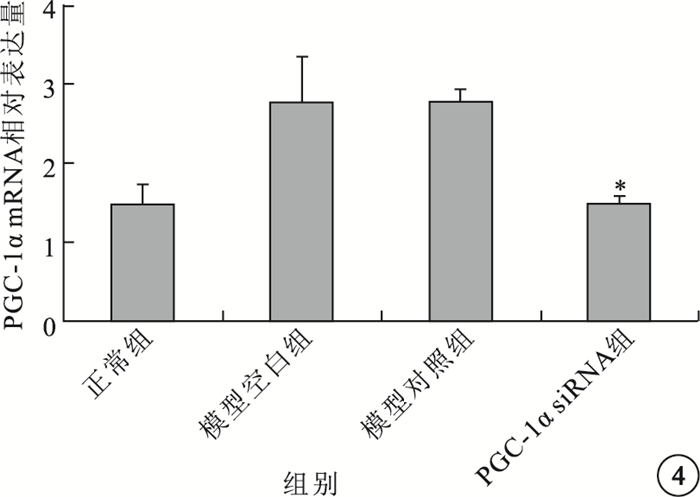 圖4
各組小鼠視網膜中PGC-1αmRNA相對表達量比較。*與模型空白組、模型對照組比較,P<0.05
圖4
各組小鼠視網膜中PGC-1αmRNA相對表達量比較。*與模型空白組、模型對照組比較,P<0.05
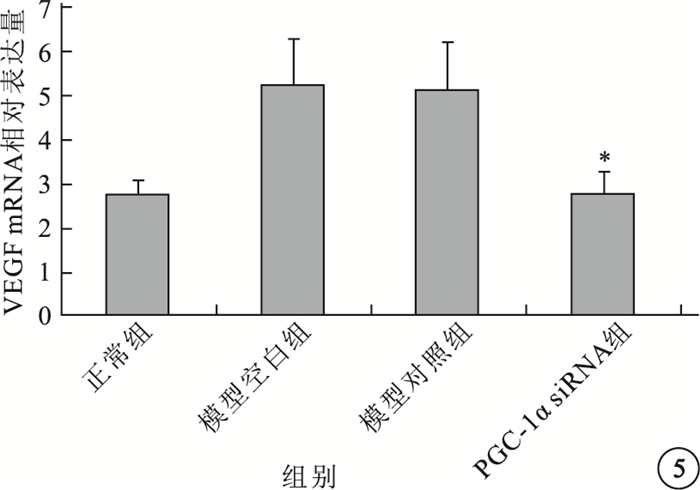 圖5
各組小鼠視網膜中VEGF mRNA相對表達量比較。*與模型空白組、模型對照組比較,P<0.05
圖5
各組小鼠視網膜中VEGF mRNA相對表達量比較。*與模型空白組、模型對照組比較,P<0.05
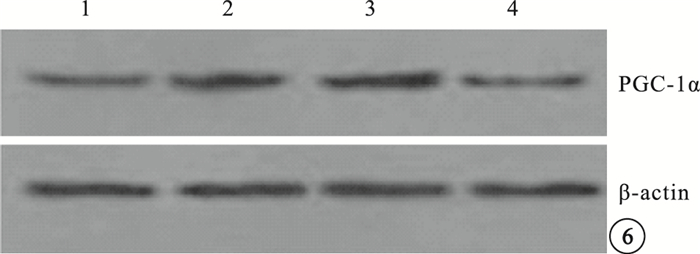
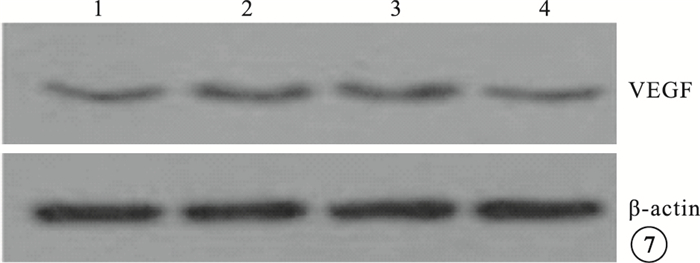
Western blot檢測結果顯示,模型空白組、模型對照組小鼠視網膜中PGC-1α、VEGF蛋白表達較正常組明顯上調,差異有統計學意義(P<0.05)。模型空白組、模型對照組小鼠視網膜中PGC-1α、VEGF蛋白表達比較,差異無統計學意義(P>0.05)。PGC-1αsiRNA組小鼠視網膜中PGC-1α、VEGF蛋白表達較模型空白組明顯下調,差異有統計學意義(P<0.05);其PGC-1α、VEGF蛋白表達明顯受抑制,抑制效率分別為53%、40%(圖 6,7)。
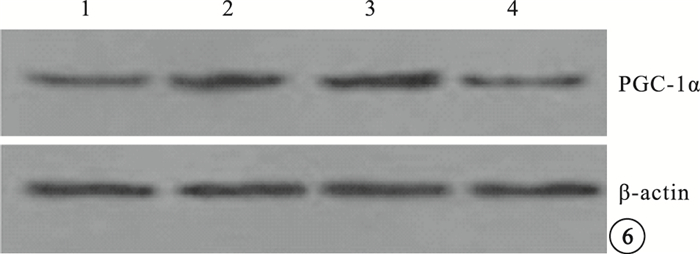 圖6
各組小鼠視網膜中PGC-1α蛋白表達Western blot檢測像。1~4分別為PGC-1αsiRNA組、模型對照組、模型空白組、正常組
圖6
各組小鼠視網膜中PGC-1α蛋白表達Western blot檢測像。1~4分別為PGC-1αsiRNA組、模型對照組、模型空白組、正常組
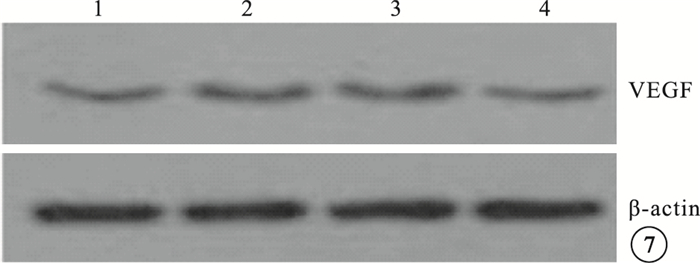 圖7
各組小鼠視網膜中VEGF蛋白表達Western blot檢測像。1~4分別為PGC-1αsiRNA組、模型對照組、模型空白組、正常組
圖7
各組小鼠視網膜中VEGF蛋白表達Western blot檢測像。1~4分別為PGC-1αsiRNA組、模型對照組、模型空白組、正常組
3 討論
缺血、缺氧是誘導RNV形成的重要因素,通過刺激調控血管生成的關鍵基因VEGF的表達升高,從而促進新生血管的形成[3-5]。目前大多研究選擇VEGF作為RNV基因治療的靶基因,但由于VEGF只是調控新生血管形成基因的一種,除此之外還有上游基因對其進行調控,因而并未最大程度的抑制新生血管的形成。近年來,Arany等[6]研究發現PGC-1α可上調包括VEGF在內的血管生成因子的表達,促進新生血管的形成。缺血、缺氧時,鼠心肌細胞、腦、兔腎小管細胞及人類骨骼肌中PGC-1α的表達及轉錄調控功能明顯增強,提示缺血、缺氧對PGC-1α的表達具有調控作用[10-15]。而本研究發現的模型空白組、模型對照組小鼠視網膜PGC-1αmRNA和蛋白表達較正常組明顯上調這一結果,進一步證實了PGC-1α在視網膜中受缺氧調控的特性。
缺氧調控PGC-1α表達升高后,通過PGC-1α協同刺激VEGF啟動子上及第一個內含子區的增強子上的雌激素相關受體-α(ERR-α)來上調VEGF的表達,從而促進新生血管的形成[6, 16]。PGC-1α/VEGF是另一新的RNV形成的信號通路[17, 18]。為了檢測PGC-1α對VEGF的調控能力,將PGC-1α基因敲除鼠和野生鼠的骨骼肌細胞進行低氧培養,3 h后野生鼠細胞VEGF的表達量增加了8倍,而基因敲除鼠只增加了3倍[6]。說明在缺氧環境中PGC-1α對VEGF具有更強的調控能力。本研究結果顯示,模型空白組、模型對照組小鼠視網膜形成大量新生血管,而此時PGC-1α的表達明顯上調。說明PGC-1α可以調控RNV的形成。提示PGC-1α有可能成為缺血缺氧性疾病新的而且更好的治療靶點[19]。
隨著對疾病分子機制的認識加深以及生物技術的飛速發展,基因治療漸漸成為了一個新的研究熱點。脂質體介導的轉染雖然沒有病毒介導的轉染效率高,但因其具有體內存留時間長,無細胞毒性,可攜帶較大DNA分子,保護目的基因不被核酸酶降解,重復性好,制備簡單,能轉染非分裂期細胞并能有效表達的優點,已被廣泛應用于基因治療研究中。本研究所使用的LF2000是一種陽離子脂質體,由帶正電荷的脂類和一種或多種中性輔助脂類共同組成,其中帶正電荷的脂類為整個脂質提供正電荷,磷脂則具有穩定雙層膜和降低陽性成分毒性的作用。其作用機制為脂質體與帶負電荷的DNA結合以后,將DNA分子包埋于脂質體中形成DNA-脂質體復合物。脂質體與細胞接近時就會與細胞表面發生融合而進入細胞質,釋放被包埋于其中的DNA到靶細胞胞核中,從而實現DNA的轉移,進而完成下一步的基因轉染。
為了探索PGC-1α潛在的基因治療特性,本研究采用脂質體介導的PGC-1αsiRNA這一基因沉默方法,驗證PGC-1αsiRNA是否能抑制RNV的形成。結果顯示,PGC-1αsiRNA組小鼠玻璃體腔注射PGC-1αsiRNA后,新生血管較模型空白組、模型對照組明顯減少,抑制效率達到62.3%,視網膜無灌注區面積明顯縮小。表明PGC-1αsiRNA對小鼠RNV有抑制作用。我們還發現,PGC-1αsiRNA組小鼠視網膜中PGC-1α、VEGF mRNA和蛋白表達較模型空白組、模型對照組明顯下調。這一方面證實了PGC-1αsiRNA在活體實驗中的有效性。另一方面說明PGC-1αsiRNA通過抑制PGC-1α的表達,從而下調VEGF的表達,從分子水平證實了PGC-1αsiRNA對RNV的抑制作用;也間接證實了PGC-1α對VEGF的調控。
本研究結果表明PGC-1α在缺氧環境下能上調VEGF的表達,從而刺激RNV的形成;PGC-1αsiRNA對缺血、缺氧誘導的RNV有抑制效果。這為RNV的基因治療研究提供了新的思路。
視網膜新生血管(RNV)生成是以缺血、缺氧為基礎,受多種因素及多通路調控的復雜過程[1-5]。過氧化物酶增殖激活受體-γ共激活子-1α(PGC-1α)可上調包括血管內皮生長因子(VEGF)在內的血管生成因子的表達,從而促進新生血管的形成[6]。已有研究表明,PGC-1α可能與RNV相關性疾病有一定的相關性[7, 8]。但以PGC-1α為靶點的基因治療是否可以抑制RNV形成目前尚不明確。為此,我們通過玻璃體腔注射脂質體介導的PGC-1α特異性干擾性RNA(siRNA)這一基因沉默方法,觀察了PGC-1α對小鼠RNV形成的影響,并對其可能作用機制進行了初步探討。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料
7日齡C57BL/6J小鼠80只,體重約10 g,由中國科學院上海實驗動物中心提供。PGC-1αsiRNA、陰性對照siRNA均由中國廣州Ribobio生物技術公司合成。脂質體LipofectamineTM 2000(LF2000)、Trizol(美國Invitrogen公司),異硫氰酸熒光素標記的葡聚糖(FITC-Dextran,美國Sigma公司)。實時聚合酶鏈反應(PCR)試劑(美國MBI公司),PCR引物由上海捷瑞生物技術服務有限公司合成。兔抗鼠PGC-1α抗體、兔抗鼠VEGF抗體、兔抗鼠β-肌動蛋白(β-actin)抗體(美國Abcam公司)。
1.2 PGC-1αsiRNA設計合成、建模及實驗分組
根據GeneBank中小鼠PGC-1α基因(NM_031347)的mRNA序列,合成3條PGC-1αsiRNA的堿基序列。PGC-1αsiRNA1:正義鏈5′-CCAAGACUCUAG ACAACUA dTdT-3′,反義鏈3′-dTdT GGUUCUG AGAUCUGUUGAU-5′;PGC-1αsiRNA 2:正義鏈5′-GCAACAUGCUCAAGCCAAA dTdT-3′,反義鏈3′-dTdT CGUUGUACGAGUUCGGUUU-5′;PGC-1αsiRNA3:正義鏈5′-CUGCGAACAUUUUGAGAA dTdT-3′,反義鏈3′-dTdT GACGCUUGUAUAAA CUCUU-5′。同時合成陰性對照siRNA序列。由脂質體LF2000介導濃度分別為50、100 nmol/L的PGC-1αsiRNA轉染小鼠血管內皮細胞。細胞轉染后48 h,提取細胞總RNA,采用實時PCR檢測PGC-1αmRNA的表達。從3條PGC-1αsiRNA中篩選出具有最佳抑制效應的PGC-1αsiRNA,進行后續基因轉染實驗。
將80只小鼠分為正常組、模型空白組、模型對照組和PGC-1αsiRNA組,每組20只。正常組小鼠于空氣中飼養,不作任何處理。模型空白組、模型對照組和PGC-1αsiRNA組小鼠參照文獻[9]的方法建立氧誘導視網膜病變模型。小鼠12日齡時,模型對照組、PGC-1αsiRNA組小鼠玻璃體腔分別注射陰性對照siRNA-脂質體復合物、PGC-1αsiRNA-脂質體復合物1μl;模型空白組小鼠不作處理。siRNA與脂質體為等體積混合。
1.3 視網膜鋪片、視網膜切片、實時PCR及蛋白免疫印跡(Western blot)檢測
小鼠17日齡時,每組隨機選取3只小鼠。于心尖部進針,左心室灌注配置好的FITC-Dextran 1 ml。在便攜式顯微鏡下作視網膜鋪片,熒光顯微鏡下觀察視網膜血管形態。
小鼠17日齡時,每組隨機選取3只小鼠處死。摘除眼球,石蠟包埋,通過角膜平行視神經作眼球矢狀位系列切片,厚度為5μm。每只眼球隨機選取10張切片,排除含視神經的切片,常規行蘇木精-伊紅(HE)染色。光學顯微鏡下計數突破視網膜內界膜的血管內皮細胞核數。
小鼠17日齡時,每組隨機選取6只小鼠。采用Trizol一步法提取視網膜總RNA,實時PCR檢測各組小鼠視網膜中PGC-1α、VEGF mRNA的表達。PGC-1α:上游引物5′-AGCAGAAAGCAATTGAA GAG-3′,下游引物5′-AGGTGTAACGGTAGGTG ATG-3′,擴增片段長度為堿基對(171)bp。VEGF:上游引物5′-CATCTTCAAGCCGTCCTGT-3′,下游引物5′-GAGGAAAGGGAAAGGGTCA-3′,擴增片段長度為240 bp。β-actin:上游引物5′-AACTTTGG CATTGTGGAAGG-3′,下游引物5′-GGATGCAG GGATGATGTTCT-3′,擴增片段長度為132 bp。PCR反應條件:95℃預變性5 min,94℃20 s,57~60℃20 s,72℃20 s,共40個循環。計算PGC-1αsiRNA組的PGC-1α、VEGF mRNA表達抑制效率。抑制效率=(模型空白組相對表達量-PGC-1αsiRNA組相對表達量)/模型空白組相對表達量×100%。
小鼠17日齡時,每組隨機選取8只小鼠。提取視網膜總蛋白,行聚丙烯酰胺凝膠電泳。電泳結束后轉聚偏氟乙烯(PVDF)膜,甲醇中浸泡透化20 s。轉膜夾一面依次放置預冷的海綿、濾紙、膠,另一面依次放置海綿、濾紙、PVDF膜,將兩面合攏扣上夾子,確保膠與膜之間完全貼合無氣泡,膠面接陰極,膜面接陽極,恒壓70V轉膜90 min;取出PVDF膜,對比蛋白質標準標記物位置,將所需測定片段和β-actin片段膜剪下。加入封閉液,水平搖床室溫下封閉1 h。加入一抗(PGC-1α一抗稀釋比為1 :500,VEGF一抗稀釋比例為1 :200),水平搖床4℃振搖過夜。加入二抗,洗膜。暗室內增強化學發光法檢測目的條帶,X光膠片曝光。以β-actin作為內參照。BandScan 5.0軟件進行條帶灰度分析。計算PGC-1αsiRNA組的PGC-1α、VEGF蛋白表達的抑制效率。抑制效率=(模型空白組灰度值-PGC-1αsiRNA組灰度值)/模型空白組灰度值×100%。
1.4 統計學方法
采用SPSS 19.0統計軟件行統計分析,計量資料以均數±標準差(
2 結果
實時PCR檢測結果顯示,50、100 nmol/L濃度條件下,PGC-1αsiRNA1、PGC-1αsiRNA2、PGC-1αsiRNA3對小鼠血管內皮細胞中PGC-1αmRNA表達水平均有不同程度的抑制作用,但以100 nmol/L濃度的PGC-1αsiRNA1抑制效應最佳(P<0.05)(圖 1)。
 圖1
小鼠血管內皮細胞中PGC-1αmRNA相對表達量比較。*與陰性對照siRNA比較,P<0.05
圖1
小鼠血管內皮細胞中PGC-1αmRNA相對表達量比較。*與陰性對照siRNA比較,P<0.05
熒光顯微鏡觀察發現,正常組小鼠視網膜血管以視盤為中心呈放射狀走行,直至視網膜周邊部,大血管間的毛細血管交織呈網狀(圖 2A)。模型空白組和模型對照組小鼠視網膜血管不規則、紆曲擴張,視盤周圍血管閉塞,可見大片無血管區,伴有明顯的熒光素滲漏,在無灌注區與灌注區之間可見新生血管叢(圖 2B,2C)。PGC-1αsiRNA組小鼠視網膜新生血管、熒光素滲漏明顯減少,視網膜中央無灌注區面積縮小(圖 2D)。
 圖2
小鼠視網膜鋪片熒光顯微鏡像。2A.正常組,自視盤發出的血管向四周呈放射狀均勻分布,直至視網膜周邊部,視網膜血管交叉呈網狀;2B、2C分別為模型空白組、模型對照組,視網膜血管紆曲擴張,視盤周邊大片無灌注區(白箭),無灌注區周圍大量新生血管叢(白箭頭),伴有明顯的熒光素滲漏;2D. PGC-1αsiRNA組,視盤周邊無灌注區、新生血管數量以及熒光素滲漏較模型空白組、模型對照組明顯減少?×40
圖2
小鼠視網膜鋪片熒光顯微鏡像。2A.正常組,自視盤發出的血管向四周呈放射狀均勻分布,直至視網膜周邊部,視網膜血管交叉呈網狀;2B、2C分別為模型空白組、模型對照組,視網膜血管紆曲擴張,視盤周邊大片無灌注區(白箭),無灌注區周圍大量新生血管叢(白箭頭),伴有明顯的熒光素滲漏;2D. PGC-1αsiRNA組,視盤周邊無灌注區、新生血管數量以及熒光素滲漏較模型空白組、模型對照組明顯減少?×40
光學顯微鏡觀察發現,正常組小鼠視網膜各層組織排列清晰、整齊,未見新生血管;模型空白組、模型對照組小鼠視網膜表面有大量突破內界膜的血管內皮細胞核,呈叢狀或團狀,甚至形成管腔樣狀;PGC-1αsiRNA組小鼠視網膜表面突破內界膜的內皮細胞核明顯減少(圖 3)。正常組、模型空白組、模型對照組、PGC-1αsiRNA組突破內界膜的血管內皮細胞核計數分別為(0.05±0.01)、(16.70±2.50)、(17.30±3.50)、(6.30±2.50)個,4組間差異有統計學意義(F=2 104.271,P<0.05)。模型空白組、模型對照組突破內界膜的血管內皮細胞核數較正常組明顯增多,差異有統計學意義(P<0.05)。模型空白組、模型對照組突破內界膜的血管內皮細胞核數比較,差異無統計學意義(P>0.05)。PGC-1αsiRNA組突破內界膜的血管內皮細胞核較模型空白組下降了62.3%,差異有統計學意義(P<0.05)。
 圖3
視網膜切片光學顯微鏡像。3A.正常組,視網膜各層組織排列清晰、整齊,未見新生血管;3B、3C分別為模型空白組、模型對照組,大量突破內界膜的血管內皮細胞核(黑箭);3D. PGC-1αsiRNA組,突破內界膜的血管內皮細胞核(黑箭)較模型空白對照組、模型對照組明顯減少?HE×400
圖3
視網膜切片光學顯微鏡像。3A.正常組,視網膜各層組織排列清晰、整齊,未見新生血管;3B、3C分別為模型空白組、模型對照組,大量突破內界膜的血管內皮細胞核(黑箭);3D. PGC-1αsiRNA組,突破內界膜的血管內皮細胞核(黑箭)較模型空白對照組、模型對照組明顯減少?HE×400
實時PCR檢測結果顯示,模型空白組、模型對照組小鼠視網膜中PGC-1α、VEGF mRNA表達均較正常組明顯上調,差異有統計學意義(P<0.05)。模型空白組、模型對照組小鼠視網膜中PGC-1α、VEGF mRNA表達比較,差異無統計學意義(P>0.05)。PGC-1αsiRNA組小鼠視網膜中PGC-1α、VEGF mRNA表達較模型空白組明顯下調,差異有統計學意義(P<0.05);其PGC-1α、VEGF mRNA表達明顯受抑制,抑制效率分別為54%、48%(圖 4,5)。
 圖4
各組小鼠視網膜中PGC-1αmRNA相對表達量比較。*與模型空白組、模型對照組比較,P<0.05
圖4
各組小鼠視網膜中PGC-1αmRNA相對表達量比較。*與模型空白組、模型對照組比較,P<0.05
 圖5
各組小鼠視網膜中VEGF mRNA相對表達量比較。*與模型空白組、模型對照組比較,P<0.05
圖5
各組小鼠視網膜中VEGF mRNA相對表達量比較。*與模型空白組、模型對照組比較,P<0.05
Western blot檢測結果顯示,模型空白組、模型對照組小鼠視網膜中PGC-1α、VEGF蛋白表達較正常組明顯上調,差異有統計學意義(P<0.05)。模型空白組、模型對照組小鼠視網膜中PGC-1α、VEGF蛋白表達比較,差異無統計學意義(P>0.05)。PGC-1αsiRNA組小鼠視網膜中PGC-1α、VEGF蛋白表達較模型空白組明顯下調,差異有統計學意義(P<0.05);其PGC-1α、VEGF蛋白表達明顯受抑制,抑制效率分別為53%、40%(圖 6,7)。
 圖6
各組小鼠視網膜中PGC-1α蛋白表達Western blot檢測像。1~4分別為PGC-1αsiRNA組、模型對照組、模型空白組、正常組
圖6
各組小鼠視網膜中PGC-1α蛋白表達Western blot檢測像。1~4分別為PGC-1αsiRNA組、模型對照組、模型空白組、正常組
 圖7
各組小鼠視網膜中VEGF蛋白表達Western blot檢測像。1~4分別為PGC-1αsiRNA組、模型對照組、模型空白組、正常組
圖7
各組小鼠視網膜中VEGF蛋白表達Western blot檢測像。1~4分別為PGC-1αsiRNA組、模型對照組、模型空白組、正常組
3 討論
缺血、缺氧是誘導RNV形成的重要因素,通過刺激調控血管生成的關鍵基因VEGF的表達升高,從而促進新生血管的形成[3-5]。目前大多研究選擇VEGF作為RNV基因治療的靶基因,但由于VEGF只是調控新生血管形成基因的一種,除此之外還有上游基因對其進行調控,因而并未最大程度的抑制新生血管的形成。近年來,Arany等[6]研究發現PGC-1α可上調包括VEGF在內的血管生成因子的表達,促進新生血管的形成。缺血、缺氧時,鼠心肌細胞、腦、兔腎小管細胞及人類骨骼肌中PGC-1α的表達及轉錄調控功能明顯增強,提示缺血、缺氧對PGC-1α的表達具有調控作用[10-15]。而本研究發現的模型空白組、模型對照組小鼠視網膜PGC-1αmRNA和蛋白表達較正常組明顯上調這一結果,進一步證實了PGC-1α在視網膜中受缺氧調控的特性。
缺氧調控PGC-1α表達升高后,通過PGC-1α協同刺激VEGF啟動子上及第一個內含子區的增強子上的雌激素相關受體-α(ERR-α)來上調VEGF的表達,從而促進新生血管的形成[6, 16]。PGC-1α/VEGF是另一新的RNV形成的信號通路[17, 18]。為了檢測PGC-1α對VEGF的調控能力,將PGC-1α基因敲除鼠和野生鼠的骨骼肌細胞進行低氧培養,3 h后野生鼠細胞VEGF的表達量增加了8倍,而基因敲除鼠只增加了3倍[6]。說明在缺氧環境中PGC-1α對VEGF具有更強的調控能力。本研究結果顯示,模型空白組、模型對照組小鼠視網膜形成大量新生血管,而此時PGC-1α的表達明顯上調。說明PGC-1α可以調控RNV的形成。提示PGC-1α有可能成為缺血缺氧性疾病新的而且更好的治療靶點[19]。
隨著對疾病分子機制的認識加深以及生物技術的飛速發展,基因治療漸漸成為了一個新的研究熱點。脂質體介導的轉染雖然沒有病毒介導的轉染效率高,但因其具有體內存留時間長,無細胞毒性,可攜帶較大DNA分子,保護目的基因不被核酸酶降解,重復性好,制備簡單,能轉染非分裂期細胞并能有效表達的優點,已被廣泛應用于基因治療研究中。本研究所使用的LF2000是一種陽離子脂質體,由帶正電荷的脂類和一種或多種中性輔助脂類共同組成,其中帶正電荷的脂類為整個脂質提供正電荷,磷脂則具有穩定雙層膜和降低陽性成分毒性的作用。其作用機制為脂質體與帶負電荷的DNA結合以后,將DNA分子包埋于脂質體中形成DNA-脂質體復合物。脂質體與細胞接近時就會與細胞表面發生融合而進入細胞質,釋放被包埋于其中的DNA到靶細胞胞核中,從而實現DNA的轉移,進而完成下一步的基因轉染。
為了探索PGC-1α潛在的基因治療特性,本研究采用脂質體介導的PGC-1αsiRNA這一基因沉默方法,驗證PGC-1αsiRNA是否能抑制RNV的形成。結果顯示,PGC-1αsiRNA組小鼠玻璃體腔注射PGC-1αsiRNA后,新生血管較模型空白組、模型對照組明顯減少,抑制效率達到62.3%,視網膜無灌注區面積明顯縮小。表明PGC-1αsiRNA對小鼠RNV有抑制作用。我們還發現,PGC-1αsiRNA組小鼠視網膜中PGC-1α、VEGF mRNA和蛋白表達較模型空白組、模型對照組明顯下調。這一方面證實了PGC-1αsiRNA在活體實驗中的有效性。另一方面說明PGC-1αsiRNA通過抑制PGC-1α的表達,從而下調VEGF的表達,從分子水平證實了PGC-1αsiRNA對RNV的抑制作用;也間接證實了PGC-1α對VEGF的調控。
本研究結果表明PGC-1α在缺氧環境下能上調VEGF的表達,從而刺激RNV的形成;PGC-1αsiRNA對缺血、缺氧誘導的RNV有抑制效果。這為RNV的基因治療研究提供了新的思路。