引用本文: 任英華, 鄒剛, 張金金, 盛迅倫. 細胞周期依賴性蛋白激酶5抑制劑Roscovitine對皇家外科學院大鼠視網膜光感受器細胞凋亡的影響. 中華眼底病雜志, 2015, 31(3): 263-267. doi: 10.3760/cma.j.issn.1005-1015.2015.03.013 復制
細胞周期依賴性蛋白激酶5(Cdk5)/p25是激酶活性存在的主要形式,在視網膜色素變性(RP)等神經退行性疾病發病中起重要作用[1-3]。我們的前期研究表明,皇家外科學院(RCS)大鼠視網膜光感受器細胞的凋亡與Cdk5、p25的表達水平升高有關,Cdk5可能參與了RCS大鼠RP的發生發展過程[4, 5]。有研究發現,人工合成的Cdk5抑制劑Roscovitine可以抑制Cdk5/p25的活性,減少細胞凋亡,從而發揮神經保護作用[6]。為了探討Roscovitine對RCS大鼠視網膜光感受器細胞凋亡的影響,我們對不同出生日齡的RCS大鼠進行了玻璃體腔注射Roscovitine,觀察了不同干預時期大鼠視網膜中Cdk5、p25及活化型半胱氨酸天冬氨酸蛋白酶3(cleave-caspase3)的表達。現將結果報道如下。
1 材料和方法
無特定病原體級RCS雄性大鼠30只,由第三軍醫大學大坪醫院野戰外科研究所實驗動物中心提供,符合國家醫用實驗動物標準。依據出生日齡不同,采用隨機數字表法將大鼠隨機分為早期干預組、中期干預組、晚期干預組,每組10只。分別于出生后17、25、35 d,采用5μl的微量注射器給予右眼玻璃體腔注射Cdk5抑制劑Roscovitine 4μl(含Roscovitine 4μg)作為實驗眼;左眼玻璃體腔注射Roscovitine溶劑二甲基亞砜4μl作為對照眼。早期干預組、中期干預組、晚期干預組大鼠分別于出生后25、35、45 d處死,摘除眼球,放入4%多聚甲醛固定液中包制蠟塊作視網膜切片;取下視網膜,充分裂解,離心,取上清液,應用二喹啉甲酸蛋白定量試劑盒進行蛋白質定量。
取組織蠟塊作厚度為4μm的連續切片,將切片置于60℃恒溫烤箱烘烤30 min,蘇木精-伊紅(HE)染色,封片,利用光學顯微鏡觀察各組大鼠視網膜全層結構,采用Image-Pro Plus 6.0圖像分析軟件測量外核層厚度。
取組織蠟塊作厚度為4μm的連續切片,將組織切片置于60℃恒溫烤箱烘烤12 h,嚴格按照北京中杉金橋試劑公司試劑盒說明書操作。將組織切片經含吐溫-20的磷酸鹽緩沖液、3%雙氧水中浸洗,一抗孵育液[抗Cdk5(c-8)多克隆抗體1∶200,抗p25(c-19)多克隆抗體(美國Santa Cruz公司)1∶200,抗活化型半胱氨酸天冬氨酸蛋白酶3(cleave-caspase 3)多克隆抗體(美國Bioworld Technology公司)1∶100]中4℃恒溫箱過夜,山羊抗兔辣根過氧化物酶二抗孵育,3, 3′-二氨基聯苯胺(DAB)顯色,中性樹膠封片。10×40倍的光學顯微鏡下,以適度背景棕色染色且有細胞形態者為陽性顆粒。采用Image-Pro Plus 6.0圖像分析軟件分析,每只眼取3個視野,分別測定每組大鼠視網膜外核層陽性顆粒的平均吸光度[A,舊稱光密度(OD)]值,對比分析3組間Cdk5、p25、cleave-caspase 3的表達差異。
取組織蠟塊作厚度為2μm的連續切片,將切片置于60℃恒溫烤箱烘烤6 h,脫蠟至水,按照原位末端標記法(TUNEL)試劑盒(美國Promega公司)說明書進行操作。將組織切片依次浸入0.85% NaCl、磷酸鹽緩沖液、多聚甲醛溶液中浸洗;蛋白酶K 20μg/ml室溫孵育,重組末端脫氧核苷酸轉移酶緩沖液中孵育60 min,37℃濕盒避光,2倍標準檸檬酸鹽溶液終止反應,避光下4′, 6-二脒基-2-苯基吲哚染核封片。共聚焦熒光顯微鏡下觀察,以細胞核中有熒光素-12-脫氧尿嘧啶核苷三磷酸滲入而定位的綠色熒光為凋亡細胞。采用Image-Pro Plus 6.0圖像分析軟件測定每組大鼠視網膜外核層綠色熒光的平均A值,對比分析3組大鼠視網膜外核層中凋亡細胞的表達差異。
采用蛋白免疫印跡法(Western blot)檢測各組大鼠視網膜中cleave-caspase 3的表達差異。取60μg視網膜組織蛋白上清液,加入上樣緩沖液并充分混勻,100℃水浴中蛋白變性,十二烷基硫酸鈉聚丙烯酰胺凝膠電泳,二氟化樹脂膜濕轉蛋白,5%脫脂奶粉封閉,磷酸鹽吐溫緩沖液浸洗,加入1∶500稀釋濃度的抗cleave-caspase 3抗體,以1∶1000稀釋的β-肌動蛋白(β-actin)作為內參照,4℃溫箱過夜,加入1∶5000稀釋濃度的山羊抗兔辣根過氧化物酶標記二抗,室溫2 h,用增強化學發光試劑盒檢測雜交信號,X線底片曝光,以cleave-caspase 3與β-actin蛋白表達灰度值比值表示cleave-caspase 3相對表達。
采用SPSS 17.0軟件行統計學分析。結果以均數±標準差(
2 結果
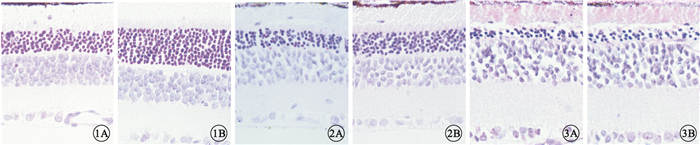
HE染色結果顯示,3組大鼠實驗眼及對照眼視網膜全層結構均清晰可見。早期干預組、中期干預組大鼠實驗眼外核層厚度均較對照眼厚,且早期干預組實驗眼與對照眼外核層厚度的差異更明顯(圖 1,2)。晚期干預組大鼠實驗眼與對照眼的外核層厚度差異不明顯(圖 3)。早期干預組、中期干預組、晚期干預組實驗眼外核層厚度分別為(93.05±3.72)、(59.01±2.70)、(29.22±1.28)μm,對照眼外核層厚度分別為(64.21±2.84)、(43.05±2.04)、(28.42±1.55)μm。早期干預組、中期干預組實驗眼與對照眼外核層厚度比較,差異有統計學意義(P<0.05),而晚期干預組外核層厚度沒有明顯的變化,差異無統計學意義(P>0.05)。
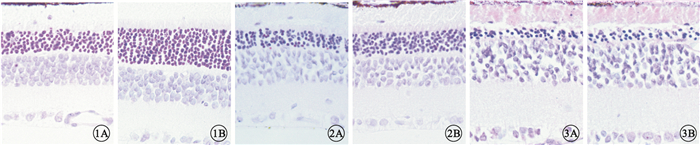 圖1
早期干預組大鼠視網膜光學顯微鏡像。1A.對照眼;1B.實驗眼。實驗眼外核層厚度明顯厚于對照眼HE×400??圖 2?中期干預組大鼠視網膜光學顯微鏡像。2A.對照眼;2B.實驗眼。實驗眼外核層厚度厚于對照眼HE×400??圖 3?晚期干預組大鼠視網膜HE染色光學顯微鏡像。3A.對照眼;3B.實驗眼。實驗眼與對照眼外核層厚度無明顯差異HE×400
圖1
早期干預組大鼠視網膜光學顯微鏡像。1A.對照眼;1B.實驗眼。實驗眼外核層厚度明顯厚于對照眼HE×400??圖 2?中期干預組大鼠視網膜光學顯微鏡像。2A.對照眼;2B.實驗眼。實驗眼外核層厚度厚于對照眼HE×400??圖 3?晚期干預組大鼠視網膜HE染色光學顯微鏡像。3A.對照眼;3B.實驗眼。實驗眼與對照眼外核層厚度無明顯差異HE×400
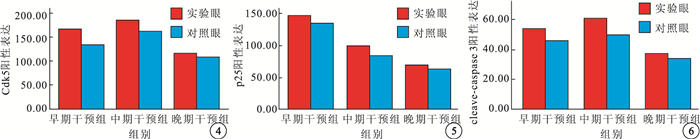
免疫組織化學染色結果顯示,視網膜全層均可見Cdk5陽性表達,外核層p25、cleave-caspase 3陽性表達明顯,內核層及神經節細胞層也有少量p25、cleave-caspase 3陽性表達。早期干預組、中期干預組實驗眼外核層Cdk5、p25、cleave-caspase 3陽性表達均較對照眼降低,差異均有統計學意義(P<0.05)。晚期干預組實驗眼與對照眼外核層Cdk5、p25、cleave-caspase 3陽性表達比較,差異無統計學意義(P>0.05)(圖 4~6)。
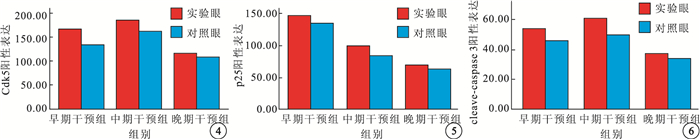 圖4
3組大鼠視網膜外核層Cdk5陽性表達比較??圖 5?3組大鼠視網膜外核層p25陽性表達比較??圖 6?3組大鼠視網膜外核層cleave-caspase 3陽性表達比較
圖4
3組大鼠視網膜外核層Cdk5陽性表達比較??圖 5?3組大鼠視網膜外核層p25陽性表達比較??圖 6?3組大鼠視網膜外核層cleave-caspase 3陽性表達比較
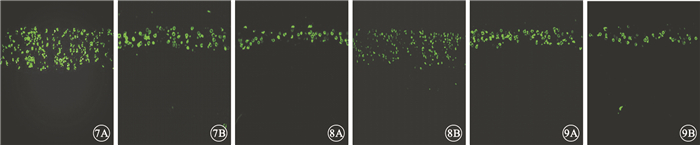
TUNEL檢測結果顯示,3組大鼠實驗眼與對照眼視網膜外核層均可見綠色熒光的凋亡細胞,其余各層未見綠色熒光的凋亡細胞(圖 7~9)。早期干預組、中期干預組大鼠實驗眼外核層凋亡細胞表達較對照眼明顯降低,差異均有統計學意義(P<0.05);晚期干預組大鼠實驗眼與對照眼外核層凋亡細胞表達差異不明顯,差異無統計學意義(P>0.05)。
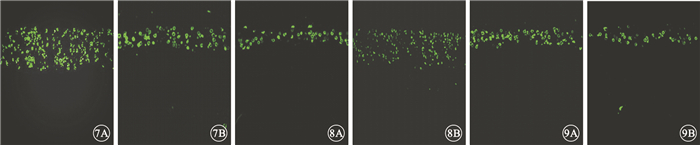 圖7
早期干預組大鼠視網膜共聚焦熒光顯微鏡像。7A.對照眼;7B.實驗眼。實驗眼外核層凋亡細胞的表達明顯高于對照眼??圖 8?中期干預組大鼠視網膜共聚焦熒光顯微鏡像。8A.對照眼;8B.實驗眼。實驗眼外核層凋亡細胞的表達明顯高于對照眼??圖 9?晚期干預組大鼠視網膜共聚焦熒光顯微鏡像。9A.對照眼;9B.實驗眼。實驗眼外核層凋亡細胞的表達與對照組無明顯差異
圖7
早期干預組大鼠視網膜共聚焦熒光顯微鏡像。7A.對照眼;7B.實驗眼。實驗眼外核層凋亡細胞的表達明顯高于對照眼??圖 8?中期干預組大鼠視網膜共聚焦熒光顯微鏡像。8A.對照眼;8B.實驗眼。實驗眼外核層凋亡細胞的表達明顯高于對照眼??圖 9?晚期干預組大鼠視網膜共聚焦熒光顯微鏡像。9A.對照眼;9B.實驗眼。實驗眼外核層凋亡細胞的表達與對照組無明顯差異
多變量偏相關分析結果顯示,Cdk5陽性表達與p25陽性表達、Cdk5陽性表達與cleave-caspase 3陽性表達、Cdk5陽性表達與凋亡細胞表達、p25陽性表達與cleave-caspase 3陽性表達、p25陽性表達與凋亡細胞表達、cleave-caspase 3陽性表達與凋亡細胞表達的兩兩變量之間均呈明顯相關性(相關系數=0.849、0.765、0.928、0.867、0.915、0.846,P<0.05)。
Western blot檢測結果顯示,分別在相對分子質量17×103、42×103處可見cleave-caspase 3、β-actin蛋白表達。早期干預組、中期干預組大鼠實驗眼視網膜中cleave-caspase 3蛋白表達較對照組明顯降低,且早期干預組實驗眼與對照眼視網膜中cleave-caspase 3蛋白表達之間的差異更明顯。晚期干預組實驗眼與對照眼視網膜中cleave-caspase 3蛋白表達的差異不明顯(圖 10)。
 圖10
3組大鼠視網膜中cleave-caspase 3表達Western blot檢測像。1.早期干預組實驗眼;2.早期干預組對照眼;3.中期干預組實驗眼;4.中期干預組對照眼;5.晚期干預組實驗眼;6.晚期干預組對照眼
圖10
3組大鼠視網膜中cleave-caspase 3表達Western blot檢測像。1.早期干預組實驗眼;2.早期干預組對照眼;3.中期干預組實驗眼;4.中期干預組對照眼;5.晚期干預組實驗眼;6.晚期干預組對照眼
3 討論
近年來,Cdk5作為阿爾茨海默癥治療的新靶點而倍受關注,人工合成的Cdk5抑制劑Roscovitine可以抑制Cdk5/p25活性所致的異常磷酸化,可以降低細胞凋亡,使Roscovitine可能成為針對Cdk5過度活化所致的神經退行性疾病的治療手段[7, 8]。Menn等[9]研究表明,Roscovitine通過減少細胞凋亡的途徑從而對神經保護有一定的作用。Zhang等[10]研究證實,Roscovitine在神經元死亡的體內外模型中都發揮一定的神經保護作用。我們的前期研究發現,RCS大鼠視網膜光感受器細胞的凋亡與Cdk5、p25的表達水平升高有關,Cdk5可能參與RCS大鼠RP的發生與發展[4, 5]。RCS大鼠在出生后17 d,視網膜光感受器細胞發育成熟;出生后25 d光感受器細胞發生明顯變性;出生后35 d,大量的光感受器細胞凋亡,外核層厚度減少一半[1]。提示出生后17 d是RCS大鼠RP過程中的重要時間點。因此,本研究選擇在RCS大鼠出生后17 d給予早期干預,并分別選擇出生后25、35 d進行中期和晚期干預,探討不同時期應用Roscovitine干預對RP的作用。同時通過觀察不同干預時間大鼠實驗眼與對照眼視網膜中Cdk5、p25、cleave-caspase 3的表達變化,探討在RCS大鼠RP發展過程中,Roscovitine是否可以阻斷Cdk5對光感受器細胞損害的環節,從而對光感受器細胞發揮保護作用。
本研究HE染色結果顯示,早期干預組、中期干預組大鼠實驗眼較對照眼外核層厚度明顯增厚,而以早期干預組表現更為明顯;晚期干預組大鼠實驗眼與對照眼外核層厚度卻無明顯差異。說明Roscovitine可能對RCS大鼠的光感受器細胞凋亡起到一定程度的延緩作用。
Camins等[11]報道,在神經元細胞死亡過程中,Cdk5/p25起到了一種主要調節器的作用。本研究結果顯示,3組大鼠實驗眼與對照眼視網膜均可發現Cdk5、p25的陽性表達,且早期干預組、中期干預組大鼠實驗眼視網膜Cdk5、p25的陽性表達較對照眼降低,且早期干預組表現更為明顯。而晚期干預組大鼠實驗眼與對照眼視網膜Cdk5、p25的陽性表達無明顯差異。同時應用TUNEL檢測發現,3組大鼠實驗眼與對照眼外核層均可見凋亡細胞,而其余各層未見凋亡細胞。這與HE染色發現的外核層厚度增加的結果相一致。提示RP過程中,主要是外核層光感受器細胞發生了變性死亡。早期干預組及中期干預組大鼠實驗眼視網膜凋亡細胞明顯較對照眼減少,而晚期干預組大鼠實驗眼與對照眼視網膜凋亡細胞無明顯差異。提示早期、中期玻璃體腔注射Roscovitine對延緩視網膜光感受器細胞的凋亡有一定作用,而晚期干預無明顯延緩細胞凋亡的作用。
在細胞凋亡發生過程中,Caspase家族的激活發揮重要作用,而Caspase 3一直作為Caspase家族級聯反應中一種公共的下游效應分子而備受關注[12]。我們通過免疫組織化學染色和Western blot檢測發現,3組大鼠實驗眼與對照眼視網膜均可觀察到cleave-caspase 3陽性細胞,以外核層表達明顯。早期干預組、中期干預組大鼠實驗眼視網膜中cleave-caspase 3陽性表達和蛋白表達均較對照眼降低,而晚期干預組大鼠實驗眼與對照組之間視網膜中cleave-caspase 3陽性表達和蛋白表達無明顯差異。這與TUNEL凋亡細胞表達結果相一致。提示cleave-caspase 3在RCS大鼠視網膜細胞凋亡發生過程中起到重要作用。
本研究采用多變量偏相關分析發現,Cdk5、p25、cleave-caspase 3陽性表達與凋亡細胞表達兩兩變量之間均有明顯相關性。Cdk5、p25蛋白表達的下調與外核層光感受器細胞的凋亡時程相一致。說明Roscovitine可能通過下調Cdk5、p25、cleave-caspase 3陽性表達來發揮抑制光感受器細胞凋亡的作用。
本研究結果表明,Cdk5抑制劑Roscovtine可能對RCS大鼠視網膜光感受器細胞的凋亡過程起到一定延緩作用。但由于本研究樣本量較小,觀察時間點較少,對Cdk5、p25、cleave-caspase 3、凋亡細胞表達主要是定性分析,而缺少定量分析,實驗結果存在一定局限性。今后應更加完善實驗課題的設計,重視預實驗,針對玻璃體腔注射Roscovitine的注射濃度及干預時間進行更深入的實驗研究,從而為RP的可能存在機制及治療方法研究提供更多的實驗依據。
細胞周期依賴性蛋白激酶5(Cdk5)/p25是激酶活性存在的主要形式,在視網膜色素變性(RP)等神經退行性疾病發病中起重要作用[1-3]。我們的前期研究表明,皇家外科學院(RCS)大鼠視網膜光感受器細胞的凋亡與Cdk5、p25的表達水平升高有關,Cdk5可能參與了RCS大鼠RP的發生發展過程[4, 5]。有研究發現,人工合成的Cdk5抑制劑Roscovitine可以抑制Cdk5/p25的活性,減少細胞凋亡,從而發揮神經保護作用[6]。為了探討Roscovitine對RCS大鼠視網膜光感受器細胞凋亡的影響,我們對不同出生日齡的RCS大鼠進行了玻璃體腔注射Roscovitine,觀察了不同干預時期大鼠視網膜中Cdk5、p25及活化型半胱氨酸天冬氨酸蛋白酶3(cleave-caspase3)的表達。現將結果報道如下。
1 材料和方法
無特定病原體級RCS雄性大鼠30只,由第三軍醫大學大坪醫院野戰外科研究所實驗動物中心提供,符合國家醫用實驗動物標準。依據出生日齡不同,采用隨機數字表法將大鼠隨機分為早期干預組、中期干預組、晚期干預組,每組10只。分別于出生后17、25、35 d,采用5μl的微量注射器給予右眼玻璃體腔注射Cdk5抑制劑Roscovitine 4μl(含Roscovitine 4μg)作為實驗眼;左眼玻璃體腔注射Roscovitine溶劑二甲基亞砜4μl作為對照眼。早期干預組、中期干預組、晚期干預組大鼠分別于出生后25、35、45 d處死,摘除眼球,放入4%多聚甲醛固定液中包制蠟塊作視網膜切片;取下視網膜,充分裂解,離心,取上清液,應用二喹啉甲酸蛋白定量試劑盒進行蛋白質定量。
取組織蠟塊作厚度為4μm的連續切片,將切片置于60℃恒溫烤箱烘烤30 min,蘇木精-伊紅(HE)染色,封片,利用光學顯微鏡觀察各組大鼠視網膜全層結構,采用Image-Pro Plus 6.0圖像分析軟件測量外核層厚度。
取組織蠟塊作厚度為4μm的連續切片,將組織切片置于60℃恒溫烤箱烘烤12 h,嚴格按照北京中杉金橋試劑公司試劑盒說明書操作。將組織切片經含吐溫-20的磷酸鹽緩沖液、3%雙氧水中浸洗,一抗孵育液[抗Cdk5(c-8)多克隆抗體1∶200,抗p25(c-19)多克隆抗體(美國Santa Cruz公司)1∶200,抗活化型半胱氨酸天冬氨酸蛋白酶3(cleave-caspase 3)多克隆抗體(美國Bioworld Technology公司)1∶100]中4℃恒溫箱過夜,山羊抗兔辣根過氧化物酶二抗孵育,3, 3′-二氨基聯苯胺(DAB)顯色,中性樹膠封片。10×40倍的光學顯微鏡下,以適度背景棕色染色且有細胞形態者為陽性顆粒。采用Image-Pro Plus 6.0圖像分析軟件分析,每只眼取3個視野,分別測定每組大鼠視網膜外核層陽性顆粒的平均吸光度[A,舊稱光密度(OD)]值,對比分析3組間Cdk5、p25、cleave-caspase 3的表達差異。
取組織蠟塊作厚度為2μm的連續切片,將切片置于60℃恒溫烤箱烘烤6 h,脫蠟至水,按照原位末端標記法(TUNEL)試劑盒(美國Promega公司)說明書進行操作。將組織切片依次浸入0.85% NaCl、磷酸鹽緩沖液、多聚甲醛溶液中浸洗;蛋白酶K 20μg/ml室溫孵育,重組末端脫氧核苷酸轉移酶緩沖液中孵育60 min,37℃濕盒避光,2倍標準檸檬酸鹽溶液終止反應,避光下4′, 6-二脒基-2-苯基吲哚染核封片。共聚焦熒光顯微鏡下觀察,以細胞核中有熒光素-12-脫氧尿嘧啶核苷三磷酸滲入而定位的綠色熒光為凋亡細胞。采用Image-Pro Plus 6.0圖像分析軟件測定每組大鼠視網膜外核層綠色熒光的平均A值,對比分析3組大鼠視網膜外核層中凋亡細胞的表達差異。
采用蛋白免疫印跡法(Western blot)檢測各組大鼠視網膜中cleave-caspase 3的表達差異。取60μg視網膜組織蛋白上清液,加入上樣緩沖液并充分混勻,100℃水浴中蛋白變性,十二烷基硫酸鈉聚丙烯酰胺凝膠電泳,二氟化樹脂膜濕轉蛋白,5%脫脂奶粉封閉,磷酸鹽吐溫緩沖液浸洗,加入1∶500稀釋濃度的抗cleave-caspase 3抗體,以1∶1000稀釋的β-肌動蛋白(β-actin)作為內參照,4℃溫箱過夜,加入1∶5000稀釋濃度的山羊抗兔辣根過氧化物酶標記二抗,室溫2 h,用增強化學發光試劑盒檢測雜交信號,X線底片曝光,以cleave-caspase 3與β-actin蛋白表達灰度值比值表示cleave-caspase 3相對表達。
采用SPSS 17.0軟件行統計學分析。結果以均數±標準差(
2 結果
HE染色結果顯示,3組大鼠實驗眼及對照眼視網膜全層結構均清晰可見。早期干預組、中期干預組大鼠實驗眼外核層厚度均較對照眼厚,且早期干預組實驗眼與對照眼外核層厚度的差異更明顯(圖 1,2)。晚期干預組大鼠實驗眼與對照眼的外核層厚度差異不明顯(圖 3)。早期干預組、中期干預組、晚期干預組實驗眼外核層厚度分別為(93.05±3.72)、(59.01±2.70)、(29.22±1.28)μm,對照眼外核層厚度分別為(64.21±2.84)、(43.05±2.04)、(28.42±1.55)μm。早期干預組、中期干預組實驗眼與對照眼外核層厚度比較,差異有統計學意義(P<0.05),而晚期干預組外核層厚度沒有明顯的變化,差異無統計學意義(P>0.05)。
 圖1
早期干預組大鼠視網膜光學顯微鏡像。1A.對照眼;1B.實驗眼。實驗眼外核層厚度明顯厚于對照眼HE×400??圖 2?中期干預組大鼠視網膜光學顯微鏡像。2A.對照眼;2B.實驗眼。實驗眼外核層厚度厚于對照眼HE×400??圖 3?晚期干預組大鼠視網膜HE染色光學顯微鏡像。3A.對照眼;3B.實驗眼。實驗眼與對照眼外核層厚度無明顯差異HE×400
圖1
早期干預組大鼠視網膜光學顯微鏡像。1A.對照眼;1B.實驗眼。實驗眼外核層厚度明顯厚于對照眼HE×400??圖 2?中期干預組大鼠視網膜光學顯微鏡像。2A.對照眼;2B.實驗眼。實驗眼外核層厚度厚于對照眼HE×400??圖 3?晚期干預組大鼠視網膜HE染色光學顯微鏡像。3A.對照眼;3B.實驗眼。實驗眼與對照眼外核層厚度無明顯差異HE×400
免疫組織化學染色結果顯示,視網膜全層均可見Cdk5陽性表達,外核層p25、cleave-caspase 3陽性表達明顯,內核層及神經節細胞層也有少量p25、cleave-caspase 3陽性表達。早期干預組、中期干預組實驗眼外核層Cdk5、p25、cleave-caspase 3陽性表達均較對照眼降低,差異均有統計學意義(P<0.05)。晚期干預組實驗眼與對照眼外核層Cdk5、p25、cleave-caspase 3陽性表達比較,差異無統計學意義(P>0.05)(圖 4~6)。
 圖4
3組大鼠視網膜外核層Cdk5陽性表達比較??圖 5?3組大鼠視網膜外核層p25陽性表達比較??圖 6?3組大鼠視網膜外核層cleave-caspase 3陽性表達比較
圖4
3組大鼠視網膜外核層Cdk5陽性表達比較??圖 5?3組大鼠視網膜外核層p25陽性表達比較??圖 6?3組大鼠視網膜外核層cleave-caspase 3陽性表達比較
TUNEL檢測結果顯示,3組大鼠實驗眼與對照眼視網膜外核層均可見綠色熒光的凋亡細胞,其余各層未見綠色熒光的凋亡細胞(圖 7~9)。早期干預組、中期干預組大鼠實驗眼外核層凋亡細胞表達較對照眼明顯降低,差異均有統計學意義(P<0.05);晚期干預組大鼠實驗眼與對照眼外核層凋亡細胞表達差異不明顯,差異無統計學意義(P>0.05)。
 圖7
早期干預組大鼠視網膜共聚焦熒光顯微鏡像。7A.對照眼;7B.實驗眼。實驗眼外核層凋亡細胞的表達明顯高于對照眼??圖 8?中期干預組大鼠視網膜共聚焦熒光顯微鏡像。8A.對照眼;8B.實驗眼。實驗眼外核層凋亡細胞的表達明顯高于對照眼??圖 9?晚期干預組大鼠視網膜共聚焦熒光顯微鏡像。9A.對照眼;9B.實驗眼。實驗眼外核層凋亡細胞的表達與對照組無明顯差異
圖7
早期干預組大鼠視網膜共聚焦熒光顯微鏡像。7A.對照眼;7B.實驗眼。實驗眼外核層凋亡細胞的表達明顯高于對照眼??圖 8?中期干預組大鼠視網膜共聚焦熒光顯微鏡像。8A.對照眼;8B.實驗眼。實驗眼外核層凋亡細胞的表達明顯高于對照眼??圖 9?晚期干預組大鼠視網膜共聚焦熒光顯微鏡像。9A.對照眼;9B.實驗眼。實驗眼外核層凋亡細胞的表達與對照組無明顯差異
多變量偏相關分析結果顯示,Cdk5陽性表達與p25陽性表達、Cdk5陽性表達與cleave-caspase 3陽性表達、Cdk5陽性表達與凋亡細胞表達、p25陽性表達與cleave-caspase 3陽性表達、p25陽性表達與凋亡細胞表達、cleave-caspase 3陽性表達與凋亡細胞表達的兩兩變量之間均呈明顯相關性(相關系數=0.849、0.765、0.928、0.867、0.915、0.846,P<0.05)。
Western blot檢測結果顯示,分別在相對分子質量17×103、42×103處可見cleave-caspase 3、β-actin蛋白表達。早期干預組、中期干預組大鼠實驗眼視網膜中cleave-caspase 3蛋白表達較對照組明顯降低,且早期干預組實驗眼與對照眼視網膜中cleave-caspase 3蛋白表達之間的差異更明顯。晚期干預組實驗眼與對照眼視網膜中cleave-caspase 3蛋白表達的差異不明顯(圖 10)。
 圖10
3組大鼠視網膜中cleave-caspase 3表達Western blot檢測像。1.早期干預組實驗眼;2.早期干預組對照眼;3.中期干預組實驗眼;4.中期干預組對照眼;5.晚期干預組實驗眼;6.晚期干預組對照眼
圖10
3組大鼠視網膜中cleave-caspase 3表達Western blot檢測像。1.早期干預組實驗眼;2.早期干預組對照眼;3.中期干預組實驗眼;4.中期干預組對照眼;5.晚期干預組實驗眼;6.晚期干預組對照眼
3 討論
近年來,Cdk5作為阿爾茨海默癥治療的新靶點而倍受關注,人工合成的Cdk5抑制劑Roscovitine可以抑制Cdk5/p25活性所致的異常磷酸化,可以降低細胞凋亡,使Roscovitine可能成為針對Cdk5過度活化所致的神經退行性疾病的治療手段[7, 8]。Menn等[9]研究表明,Roscovitine通過減少細胞凋亡的途徑從而對神經保護有一定的作用。Zhang等[10]研究證實,Roscovitine在神經元死亡的體內外模型中都發揮一定的神經保護作用。我們的前期研究發現,RCS大鼠視網膜光感受器細胞的凋亡與Cdk5、p25的表達水平升高有關,Cdk5可能參與RCS大鼠RP的發生與發展[4, 5]。RCS大鼠在出生后17 d,視網膜光感受器細胞發育成熟;出生后25 d光感受器細胞發生明顯變性;出生后35 d,大量的光感受器細胞凋亡,外核層厚度減少一半[1]。提示出生后17 d是RCS大鼠RP過程中的重要時間點。因此,本研究選擇在RCS大鼠出生后17 d給予早期干預,并分別選擇出生后25、35 d進行中期和晚期干預,探討不同時期應用Roscovitine干預對RP的作用。同時通過觀察不同干預時間大鼠實驗眼與對照眼視網膜中Cdk5、p25、cleave-caspase 3的表達變化,探討在RCS大鼠RP發展過程中,Roscovitine是否可以阻斷Cdk5對光感受器細胞損害的環節,從而對光感受器細胞發揮保護作用。
本研究HE染色結果顯示,早期干預組、中期干預組大鼠實驗眼較對照眼外核層厚度明顯增厚,而以早期干預組表現更為明顯;晚期干預組大鼠實驗眼與對照眼外核層厚度卻無明顯差異。說明Roscovitine可能對RCS大鼠的光感受器細胞凋亡起到一定程度的延緩作用。
Camins等[11]報道,在神經元細胞死亡過程中,Cdk5/p25起到了一種主要調節器的作用。本研究結果顯示,3組大鼠實驗眼與對照眼視網膜均可發現Cdk5、p25的陽性表達,且早期干預組、中期干預組大鼠實驗眼視網膜Cdk5、p25的陽性表達較對照眼降低,且早期干預組表現更為明顯。而晚期干預組大鼠實驗眼與對照眼視網膜Cdk5、p25的陽性表達無明顯差異。同時應用TUNEL檢測發現,3組大鼠實驗眼與對照眼外核層均可見凋亡細胞,而其余各層未見凋亡細胞。這與HE染色發現的外核層厚度增加的結果相一致。提示RP過程中,主要是外核層光感受器細胞發生了變性死亡。早期干預組及中期干預組大鼠實驗眼視網膜凋亡細胞明顯較對照眼減少,而晚期干預組大鼠實驗眼與對照眼視網膜凋亡細胞無明顯差異。提示早期、中期玻璃體腔注射Roscovitine對延緩視網膜光感受器細胞的凋亡有一定作用,而晚期干預無明顯延緩細胞凋亡的作用。
在細胞凋亡發生過程中,Caspase家族的激活發揮重要作用,而Caspase 3一直作為Caspase家族級聯反應中一種公共的下游效應分子而備受關注[12]。我們通過免疫組織化學染色和Western blot檢測發現,3組大鼠實驗眼與對照眼視網膜均可觀察到cleave-caspase 3陽性細胞,以外核層表達明顯。早期干預組、中期干預組大鼠實驗眼視網膜中cleave-caspase 3陽性表達和蛋白表達均較對照眼降低,而晚期干預組大鼠實驗眼與對照組之間視網膜中cleave-caspase 3陽性表達和蛋白表達無明顯差異。這與TUNEL凋亡細胞表達結果相一致。提示cleave-caspase 3在RCS大鼠視網膜細胞凋亡發生過程中起到重要作用。
本研究采用多變量偏相關分析發現,Cdk5、p25、cleave-caspase 3陽性表達與凋亡細胞表達兩兩變量之間均有明顯相關性。Cdk5、p25蛋白表達的下調與外核層光感受器細胞的凋亡時程相一致。說明Roscovitine可能通過下調Cdk5、p25、cleave-caspase 3陽性表達來發揮抑制光感受器細胞凋亡的作用。
本研究結果表明,Cdk5抑制劑Roscovtine可能對RCS大鼠視網膜光感受器細胞的凋亡過程起到一定延緩作用。但由于本研究樣本量較小,觀察時間點較少,對Cdk5、p25、cleave-caspase 3、凋亡細胞表達主要是定性分析,而缺少定量分析,實驗結果存在一定局限性。今后應更加完善實驗課題的設計,重視預實驗,針對玻璃體腔注射Roscovitine的注射濃度及干預時間進行更深入的實驗研究,從而為RP的可能存在機制及治療方法研究提供更多的實驗依據。