引用本文: 秦時月, 殷麗, 姚勇, 鄒健, 孫超. 糖尿病視網膜病變患者血清中微小RNA-195表達結果檢測. 中華眼底病雜志, 2015, 31(2): 134-138. doi: 10.3760/cma.j.issn.1005-1015.2015.02.006 復制
微小RNA(miRNA)能以一種特定的方式誘發信使RNA(mRNA)降解或抑制mRNA翻譯,進而抑制蛋白質合成[1-3]。其參與進化、細胞增生、細胞凋亡、腫瘤和免疫反應等生物學過程,調節著人類三分之一的基因[4-8]。血清miRNA還可以作為多種疾病的生物學標記[9, 10]。研究發現,miRNA在糖尿病視網膜病變(DR)的發生發展中發揮重要作用[11-14]。但血清miRNA是否與DR具有相關性,miRNA是否在DR的發病機制中發揮作用,目前尚不清楚。為此,我們通過基因芯片、逆轉錄聚合酶鏈反應(RT-PCR)檢測了DR患者、糖尿病(DM)患者及正常受檢者血清中最具表達差異的miRNA-195(miR-195)表達,并對其調控的潛在靶基因高遷移率族蛋白B1(HMGB1)的表達變化進行了觀察。現將結果報道如下。
1 對象和方法
2013年10~12月在南京醫科大學附屬無錫人民醫院內分泌科住院治療的DM患者57例(DM組)及在眼科住院治療的DR患者40例(DR組)納入本研究。DM組患者均符合世界衛生組織制定的DM診斷標準[15]。DR組患者經裂隙燈顯微鏡、間接檢眼鏡及熒光素眼底血管造影檢查,結果符合DR臨床診斷標準[16]。DM組患者中,男性30例,女性27例;年齡30~86歲,平均年齡(64.8±12.3)歲;DM病程10~30年,平均DM病程(16.9±12.6)年。DR組患者中,男性21例,女性19例;年齡38~85歲,平均年齡(67.5±11.4)歲;DM病程10~30年,平均DM病程(17.3±10.1)年。選擇同期在眼科門診常規檢查的健康者41名作為正常組。其中,男性26名,女性15名;年齡32~81歲,平均年齡(60.9±12.2)歲。DM組、DR組及正常組受檢者之間性別、年齡比較,差異無統計學意義(P>0.05)。
經本院倫理委員會審批并獲取所有受檢者的知情同意后,抽取受檢者靜脈血5 ml,乙二胺四乙酸抗凝,4℃、3000r/min離心15 min,提取血漿置于-80℃冰箱備用。采用改良異硫氰酸肌法(TriZol)提取血漿總RNA,用NanoDrop 2000紫外分光光度計(美國Thermo Scientific公司)分析RNA純度和濃度。選取純度值為1.8~2.1的樣本。
每組隨機選取10個樣本,采用基因芯片(丹麥Exiqon公司)檢測受檢者血清miRNA表達水平,所有檢測由上海康成生物工程有限公司完成。通過PubMed數據庫進行信息檢索,并結合差異倍數較大的原則選取與新生血管、細胞增生相關的miRNA-195,采用LightCycler 1.5定量PCR儀(瑞士Roche公司)行實時RT-PCR,驗證基因芯片檢測結果。選取差異表達的miRNA,按照RT-PCR定量試劑盒(美國Invetrogen公司)說明書,以U6為內參,將miRNA逆轉錄成cDNA,然后進行實時熒光定量檢測。miR-195的PCR引物及逆轉錄引物購自美國Invetrogen公司。每例樣本均做3個復孔,Ct值取3次平均值,樣品ΔCt=Ct樣品-CtU6,樣品ΔΔCt=ΔCt樣品-ΔCt校正樣品,以2-ΔΔCt樣品表示每個miRNA的相對表達比率[17],即樣品的miRNA表達量表示成校正樣品的2-ΔΔCt樣品倍。2-ΔΔCt樣品>2為表達增強,2-ΔΔCt樣品<0.5為表達減弱[18]。
匯總Mirnada、Mmirbase、Targetscan數據庫中已知miRNA靶點信息,將3種數據庫的結果交集作為最終miRNA的靶基因結果,同時結合已發現的與DR相關的基因,對靶基因進行功能分析,確定HMGB1可能是miR-195調控的潛在靶基因。
參照文獻[19]的方法,采用含10%胎牛血清的RPMI-1640培養液培養人臍靜脈內皮細胞(HUVEC,美國Gibco公司),置于37℃、5%CO2及相對濕度條件下的培養箱中培養。取對數生長期細胞進行細胞轉染,按siRNA-MateTM轉染試劑盒(美國Invetrogen公司)說明書的方法將miR-195模擬物、模擬物對照或miR-195抑制物、抑制物對照分別轉染到HUVEC中。miR-195模擬物:上游引物5′-UAGCAGCACAGAAA UAUUGGC-3′,下游引物5′CAAUAUUUCUGUGC UGCUAUU-3′;模擬物對照:上游引物5′-UUCUCCG AACGUGUCACGUTT-3′,下游引物5′-ACGUGAC ACGUUCGGAGAATT-3′;miR-195抑制物:5′-GCC AAUAUUUCUGUGCUGCUA-3′,抑制物對照:5′-C AGUACUUUUGUGUAGUACAA-3′。轉染前1 d收集對數生長期細胞接種于6孔細胞培養板,待細胞融合率達50%時分別將5 nmol/L miR-195模擬物、模擬物對照、miR-195抑制物、抑制物對照轉染細胞6?h,用熒光倒置顯微鏡檢測轉染效率。轉染效率達80%時以無血清RPMI-1640培養液洗滌2次,加入含10%胎牛血清的RPMI-1640培養液繼續培養24?h用于后續實驗。
建立miR-195高表達和低表達細胞模型。高表達細胞模型分為空白對照組、高表達組及陰性對照組。空白對照組HUVEC不作任何處理;高表達組HUVEC轉染miR-195模擬物;陰性對照組HUVEC轉染模擬物對照。低表達細胞模型分為空白對照組、低表達組及陰性對照組。空白對照組HUVEC不作任何處理;低表達組HUVEC轉染miR-195抑制物;陰性對照組HUVEC轉染抑制物對照。細胞轉染24 h后,Trizol法提取細胞總RNA,分光光度計測定總RNA的純度。采用實時定量RT-PCR檢測轉染后細胞中HMGB1 mRNA的相對表達比率。細胞轉染72 h后,提取細胞總蛋白。采用蛋白免疫印跡法(Western blot)檢測HMGB1蛋白的表達。
采用SPSS 18.0軟件進行統計分析,數據以均數±標準差(
2 結果
基因芯片檢測結果顯示,與DM組和正常組比較,DR組有195個miRNA具有差異表達。其中,155個miRNA上調,40個miRNA下調。DR組miR-195表達較DM組下調8.34倍,較正常組下調11.47倍。
RT-PCR驗證結果與基因芯片檢測結果相符。DM組miR-195表達是正常組的(0.72±0.06)倍,DR組miR-195表達分別是DM組、正常組的(0.28±0.08)、(0.03±0.01)倍。與DM組(F=0.034,t=8.057)和正常組(F=0.370,t=9.522)比較,DR組miR-195表達均明顯減弱,差異均有統計學意義(P<0.05)。與正常組比較,DM組miR-195表達有所減弱,但差異無統計學意義(F=0.283,t=3.242;P>0.05)。
RT-PCR檢測結果顯示,在高表達細胞模型中,高表達組HUVEC的HMGB1 mRNA表達分別是空白對照組、陰性對照組的(0.41±0.20)、(0.38±0.15)倍,空白對照組HUVEC的HMGB1 mRNA表達是陰性對照組的(0.88±0.05)倍。與空白對照組(F=0.023,t=11.287)和陰性對照組(F=0.365,t=7.471)比較,高表達組HUVEC的HMGB1 mRNA表達明顯下調,差異有統計學意義(P<0.05)。與陰性對照組比較,空白對照組HUVEC的HMGB1 mRNA表達無明顯變化,差異無統計學意義(F=0.032,t=4.482;P>0.05)。在低表達細胞模型中,低表達組HUVEC的HMGB1 mRNA表達分別是空白對照組、陰性對照組的(3.76±0.11)、(4.83±0.27)倍,空白對照組HUVEC的HMGB1 mRNA表達是陰性對照組的(1.38±0.04)倍。與空白對照組(F=0.053,t=10.871)和陰性對照組(F=0.492,t=6.883)比較,低表達HUVEC的HMGB1 mRNA表達明顯上調,差異有統計學意義(P<0.05)。與陰性對照組比較,空白對照組HUVEC的HMGB1 mRNA表達無明顯變化,差異無統計學意義(F=0.934,t=3.869;P>0.05)。
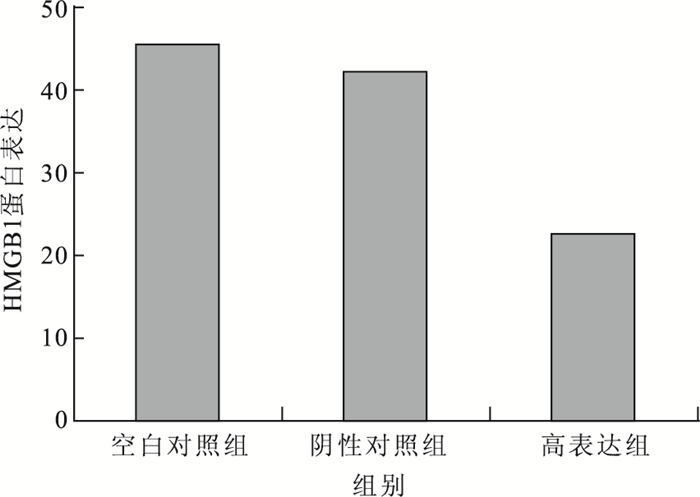
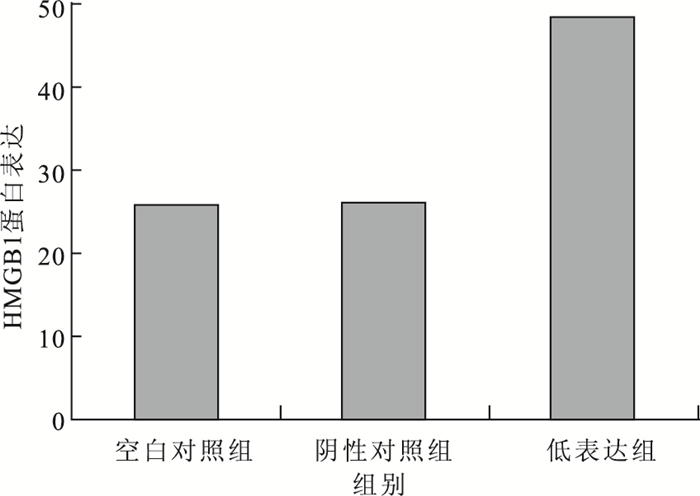
Western blot檢測結果顯示,在高表達細胞模型中,空白對照組、高表達組及陰性對照組HUVEC的HMGB1蛋白表達分別為45.34±0.37、22.51±0.44、42.15±0.21。高表達組HUVEC的HMGB1蛋白表達較空白對照組(F=0.021,t=8.820)、陰性對照組(F=0.039,t=7.401)明顯下降,差異有統計學意義(P<0.05)。與陰性對照組比較,空白對照組HUVEC的HMGB1蛋白表達無明顯變化,差異無統計學意義(F=0.283,t=2.593;P>0.05)(圖 1)。在低表達細胞模型中,空白對照組、低表達組及陰性對照組HUVEC的HMGB1蛋白表達分別為25.77±0.51、48.34±0.32、25.90±0.13。低表達組HUVEC的HMGB1蛋白表達較空白對照組(F=0.186,t=10.092)、陰性對照組(F=0.017,t=12.923)明顯升高,差異有統計學意義(P<0.05)。與陰性對照組比較,空白對照組HUVEC的HMGB1蛋白表達無明顯變化,差異無統計學意義(F=0.283,t=2.593;P>0.05)(圖 2)。
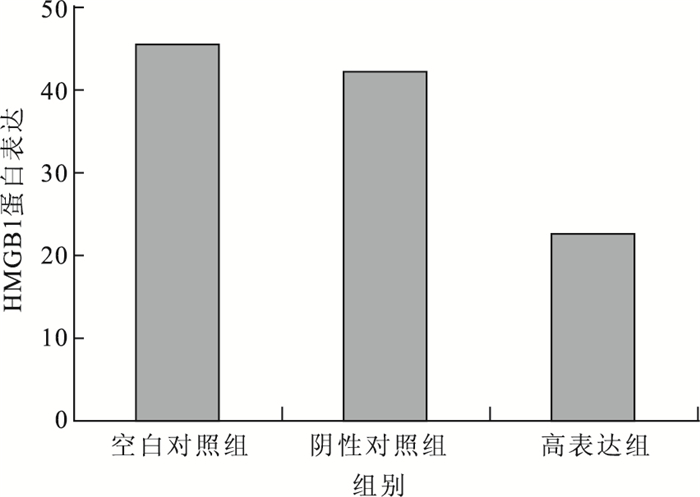 圖1
高表達細胞模型中各組HMGB1蛋白表達比較
圖1
高表達細胞模型中各組HMGB1蛋白表達比較
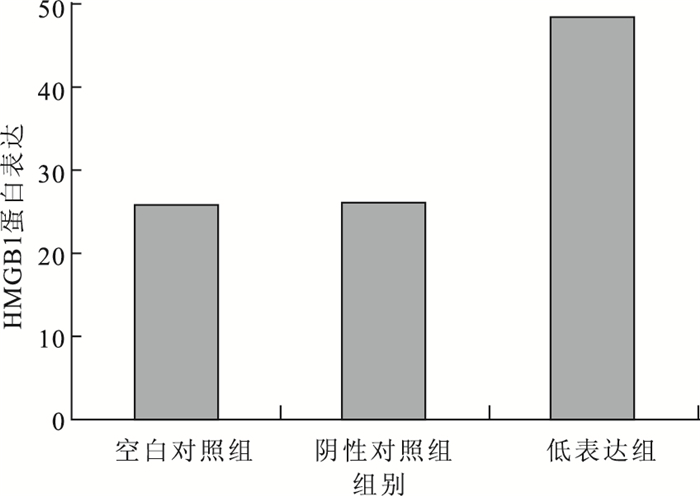 圖2
低表達細胞模型中各組HMGB1蛋白表達比較
圖2
低表達細胞模型中各組HMGB1蛋白表達比較
3 討論
我們將基因芯片技術應用于DR患者血清中miRNA的檢測,發現195個具有差異表達的miRNA,其中miR-195尤為值得關注。MiR-195是miRNA-15/107基因家族成員,位于染色體17p13.1上。其與腫瘤細胞的生長、增生、凋亡、侵襲和遷移等密切相關[20-27]。Wang等[27]通過體外實驗發現,在原發性肝細胞癌中,miR-195的表達可以減少腫瘤組織中微血管的數量,并抑制腫瘤的轉移。更重要的是,miR-195可以通過抑制血管內皮生長因子(VEGF)的表達,從而抑制血管新生。而DR最主要的特征是視網膜微血管功能障礙,視網膜血管新生以及VEGF在其中發揮重要作用。因此,本研究對miR-195進行了后續進一步的深入研究。
通過生物信息學分析,我們發現HMGB1可能是miR-195的調控靶基因。HMGB1是一組高度保守的非組織核蛋白,存在于多種真核細胞的細胞核中,可誘導細胞分化、觸發及調節炎癥反應[28]。DR的發病機制錯綜復雜,近來許多臨床和實驗研究表明了炎癥在DR的微血管損傷機制中發揮重要作用[29]。Lutty等[30]研究發現,白細胞在DR的發生發展中起重要作用,并確定了DR是一種“炎癥疾病”,HMGB1作為晚期炎性因子,可誘導炎性反應和促進新生血管的生成[31, 32]。Biscetti等[33]發現,HMGB1可通過VEGF促進DM患者缺血組織內新生血管的生成。因此,我們認為HMGB1參與了DR的炎性反應和血管新生,并且進一步研究了miR-195與HMGB1的具體調控機制。
HUVEC是目前DR研究中最常用的細胞模型,其體外培養易于生長,培養純度較高[34-37]。我們將HUVEC轉染miR-195模擬物和miR-195抑制物,建立miR-195高表達和低表達細胞模型,采用RT-PCR和Western blot分別檢測細胞轉染后HMGB1 mRNA以及蛋白表達量。結果顯示,通過miR-195模擬物使miR-195過表達,能顯著降低HMGB1 mRNA和蛋白表達水平。相反,通過miR-195抑制物來抑制miR-195的表達,能顯著增加HMGB1 mRNA和蛋白表達水平。表明miR-195可以調控HMGB1的表達。由此我們推測,miR-195可以通過抑制HMGB1的表達,減少炎癥反應以及新生血管的生成,從而延緩或抑制DR的發生發展。
本研究結果表明,DR患者血清中miR-195的表達明顯下調,其可能通過調控HMGB1的表達發揮效應。但由于每個miRNA可以調控多個靶基因,同一個靶基因也可以受到多個miRNA的調控,因此不排除miR-195同時還作用于其他靶基因,協同調控DR發生發展的可能性。因此,今后還需要進一步研究miR-195調控的DR相關基因,并在更多的視網膜內皮細胞系中驗證這一結果,進一步完善miR-195在DR中的功能及機制研究,并尋找可以抑制視網膜炎性反應、保護視網膜、延緩或減少DR發生的方法。
微小RNA(miRNA)能以一種特定的方式誘發信使RNA(mRNA)降解或抑制mRNA翻譯,進而抑制蛋白質合成[1-3]。其參與進化、細胞增生、細胞凋亡、腫瘤和免疫反應等生物學過程,調節著人類三分之一的基因[4-8]。血清miRNA還可以作為多種疾病的生物學標記[9, 10]。研究發現,miRNA在糖尿病視網膜病變(DR)的發生發展中發揮重要作用[11-14]。但血清miRNA是否與DR具有相關性,miRNA是否在DR的發病機制中發揮作用,目前尚不清楚。為此,我們通過基因芯片、逆轉錄聚合酶鏈反應(RT-PCR)檢測了DR患者、糖尿病(DM)患者及正常受檢者血清中最具表達差異的miRNA-195(miR-195)表達,并對其調控的潛在靶基因高遷移率族蛋白B1(HMGB1)的表達變化進行了觀察。現將結果報道如下。
1 對象和方法
2013年10~12月在南京醫科大學附屬無錫人民醫院內分泌科住院治療的DM患者57例(DM組)及在眼科住院治療的DR患者40例(DR組)納入本研究。DM組患者均符合世界衛生組織制定的DM診斷標準[15]。DR組患者經裂隙燈顯微鏡、間接檢眼鏡及熒光素眼底血管造影檢查,結果符合DR臨床診斷標準[16]。DM組患者中,男性30例,女性27例;年齡30~86歲,平均年齡(64.8±12.3)歲;DM病程10~30年,平均DM病程(16.9±12.6)年。DR組患者中,男性21例,女性19例;年齡38~85歲,平均年齡(67.5±11.4)歲;DM病程10~30年,平均DM病程(17.3±10.1)年。選擇同期在眼科門診常規檢查的健康者41名作為正常組。其中,男性26名,女性15名;年齡32~81歲,平均年齡(60.9±12.2)歲。DM組、DR組及正常組受檢者之間性別、年齡比較,差異無統計學意義(P>0.05)。
經本院倫理委員會審批并獲取所有受檢者的知情同意后,抽取受檢者靜脈血5 ml,乙二胺四乙酸抗凝,4℃、3000r/min離心15 min,提取血漿置于-80℃冰箱備用。采用改良異硫氰酸肌法(TriZol)提取血漿總RNA,用NanoDrop 2000紫外分光光度計(美國Thermo Scientific公司)分析RNA純度和濃度。選取純度值為1.8~2.1的樣本。
每組隨機選取10個樣本,采用基因芯片(丹麥Exiqon公司)檢測受檢者血清miRNA表達水平,所有檢測由上海康成生物工程有限公司完成。通過PubMed數據庫進行信息檢索,并結合差異倍數較大的原則選取與新生血管、細胞增生相關的miRNA-195,采用LightCycler 1.5定量PCR儀(瑞士Roche公司)行實時RT-PCR,驗證基因芯片檢測結果。選取差異表達的miRNA,按照RT-PCR定量試劑盒(美國Invetrogen公司)說明書,以U6為內參,將miRNA逆轉錄成cDNA,然后進行實時熒光定量檢測。miR-195的PCR引物及逆轉錄引物購自美國Invetrogen公司。每例樣本均做3個復孔,Ct值取3次平均值,樣品ΔCt=Ct樣品-CtU6,樣品ΔΔCt=ΔCt樣品-ΔCt校正樣品,以2-ΔΔCt樣品表示每個miRNA的相對表達比率[17],即樣品的miRNA表達量表示成校正樣品的2-ΔΔCt樣品倍。2-ΔΔCt樣品>2為表達增強,2-ΔΔCt樣品<0.5為表達減弱[18]。
匯總Mirnada、Mmirbase、Targetscan數據庫中已知miRNA靶點信息,將3種數據庫的結果交集作為最終miRNA的靶基因結果,同時結合已發現的與DR相關的基因,對靶基因進行功能分析,確定HMGB1可能是miR-195調控的潛在靶基因。
參照文獻[19]的方法,采用含10%胎牛血清的RPMI-1640培養液培養人臍靜脈內皮細胞(HUVEC,美國Gibco公司),置于37℃、5%CO2及相對濕度條件下的培養箱中培養。取對數生長期細胞進行細胞轉染,按siRNA-MateTM轉染試劑盒(美國Invetrogen公司)說明書的方法將miR-195模擬物、模擬物對照或miR-195抑制物、抑制物對照分別轉染到HUVEC中。miR-195模擬物:上游引物5′-UAGCAGCACAGAAA UAUUGGC-3′,下游引物5′CAAUAUUUCUGUGC UGCUAUU-3′;模擬物對照:上游引物5′-UUCUCCG AACGUGUCACGUTT-3′,下游引物5′-ACGUGAC ACGUUCGGAGAATT-3′;miR-195抑制物:5′-GCC AAUAUUUCUGUGCUGCUA-3′,抑制物對照:5′-C AGUACUUUUGUGUAGUACAA-3′。轉染前1 d收集對數生長期細胞接種于6孔細胞培養板,待細胞融合率達50%時分別將5 nmol/L miR-195模擬物、模擬物對照、miR-195抑制物、抑制物對照轉染細胞6?h,用熒光倒置顯微鏡檢測轉染效率。轉染效率達80%時以無血清RPMI-1640培養液洗滌2次,加入含10%胎牛血清的RPMI-1640培養液繼續培養24?h用于后續實驗。
建立miR-195高表達和低表達細胞模型。高表達細胞模型分為空白對照組、高表達組及陰性對照組。空白對照組HUVEC不作任何處理;高表達組HUVEC轉染miR-195模擬物;陰性對照組HUVEC轉染模擬物對照。低表達細胞模型分為空白對照組、低表達組及陰性對照組。空白對照組HUVEC不作任何處理;低表達組HUVEC轉染miR-195抑制物;陰性對照組HUVEC轉染抑制物對照。細胞轉染24 h后,Trizol法提取細胞總RNA,分光光度計測定總RNA的純度。采用實時定量RT-PCR檢測轉染后細胞中HMGB1 mRNA的相對表達比率。細胞轉染72 h后,提取細胞總蛋白。采用蛋白免疫印跡法(Western blot)檢測HMGB1蛋白的表達。
采用SPSS 18.0軟件進行統計分析,數據以均數±標準差(
2 結果
基因芯片檢測結果顯示,與DM組和正常組比較,DR組有195個miRNA具有差異表達。其中,155個miRNA上調,40個miRNA下調。DR組miR-195表達較DM組下調8.34倍,較正常組下調11.47倍。
RT-PCR驗證結果與基因芯片檢測結果相符。DM組miR-195表達是正常組的(0.72±0.06)倍,DR組miR-195表達分別是DM組、正常組的(0.28±0.08)、(0.03±0.01)倍。與DM組(F=0.034,t=8.057)和正常組(F=0.370,t=9.522)比較,DR組miR-195表達均明顯減弱,差異均有統計學意義(P<0.05)。與正常組比較,DM組miR-195表達有所減弱,但差異無統計學意義(F=0.283,t=3.242;P>0.05)。
RT-PCR檢測結果顯示,在高表達細胞模型中,高表達組HUVEC的HMGB1 mRNA表達分別是空白對照組、陰性對照組的(0.41±0.20)、(0.38±0.15)倍,空白對照組HUVEC的HMGB1 mRNA表達是陰性對照組的(0.88±0.05)倍。與空白對照組(F=0.023,t=11.287)和陰性對照組(F=0.365,t=7.471)比較,高表達組HUVEC的HMGB1 mRNA表達明顯下調,差異有統計學意義(P<0.05)。與陰性對照組比較,空白對照組HUVEC的HMGB1 mRNA表達無明顯變化,差異無統計學意義(F=0.032,t=4.482;P>0.05)。在低表達細胞模型中,低表達組HUVEC的HMGB1 mRNA表達分別是空白對照組、陰性對照組的(3.76±0.11)、(4.83±0.27)倍,空白對照組HUVEC的HMGB1 mRNA表達是陰性對照組的(1.38±0.04)倍。與空白對照組(F=0.053,t=10.871)和陰性對照組(F=0.492,t=6.883)比較,低表達HUVEC的HMGB1 mRNA表達明顯上調,差異有統計學意義(P<0.05)。與陰性對照組比較,空白對照組HUVEC的HMGB1 mRNA表達無明顯變化,差異無統計學意義(F=0.934,t=3.869;P>0.05)。
Western blot檢測結果顯示,在高表達細胞模型中,空白對照組、高表達組及陰性對照組HUVEC的HMGB1蛋白表達分別為45.34±0.37、22.51±0.44、42.15±0.21。高表達組HUVEC的HMGB1蛋白表達較空白對照組(F=0.021,t=8.820)、陰性對照組(F=0.039,t=7.401)明顯下降,差異有統計學意義(P<0.05)。與陰性對照組比較,空白對照組HUVEC的HMGB1蛋白表達無明顯變化,差異無統計學意義(F=0.283,t=2.593;P>0.05)(圖 1)。在低表達細胞模型中,空白對照組、低表達組及陰性對照組HUVEC的HMGB1蛋白表達分別為25.77±0.51、48.34±0.32、25.90±0.13。低表達組HUVEC的HMGB1蛋白表達較空白對照組(F=0.186,t=10.092)、陰性對照組(F=0.017,t=12.923)明顯升高,差異有統計學意義(P<0.05)。與陰性對照組比較,空白對照組HUVEC的HMGB1蛋白表達無明顯變化,差異無統計學意義(F=0.283,t=2.593;P>0.05)(圖 2)。
 圖1
高表達細胞模型中各組HMGB1蛋白表達比較
圖1
高表達細胞模型中各組HMGB1蛋白表達比較
 圖2
低表達細胞模型中各組HMGB1蛋白表達比較
圖2
低表達細胞模型中各組HMGB1蛋白表達比較
3 討論
我們將基因芯片技術應用于DR患者血清中miRNA的檢測,發現195個具有差異表達的miRNA,其中miR-195尤為值得關注。MiR-195是miRNA-15/107基因家族成員,位于染色體17p13.1上。其與腫瘤細胞的生長、增生、凋亡、侵襲和遷移等密切相關[20-27]。Wang等[27]通過體外實驗發現,在原發性肝細胞癌中,miR-195的表達可以減少腫瘤組織中微血管的數量,并抑制腫瘤的轉移。更重要的是,miR-195可以通過抑制血管內皮生長因子(VEGF)的表達,從而抑制血管新生。而DR最主要的特征是視網膜微血管功能障礙,視網膜血管新生以及VEGF在其中發揮重要作用。因此,本研究對miR-195進行了后續進一步的深入研究。
通過生物信息學分析,我們發現HMGB1可能是miR-195的調控靶基因。HMGB1是一組高度保守的非組織核蛋白,存在于多種真核細胞的細胞核中,可誘導細胞分化、觸發及調節炎癥反應[28]。DR的發病機制錯綜復雜,近來許多臨床和實驗研究表明了炎癥在DR的微血管損傷機制中發揮重要作用[29]。Lutty等[30]研究發現,白細胞在DR的發生發展中起重要作用,并確定了DR是一種“炎癥疾病”,HMGB1作為晚期炎性因子,可誘導炎性反應和促進新生血管的生成[31, 32]。Biscetti等[33]發現,HMGB1可通過VEGF促進DM患者缺血組織內新生血管的生成。因此,我們認為HMGB1參與了DR的炎性反應和血管新生,并且進一步研究了miR-195與HMGB1的具體調控機制。
HUVEC是目前DR研究中最常用的細胞模型,其體外培養易于生長,培養純度較高[34-37]。我們將HUVEC轉染miR-195模擬物和miR-195抑制物,建立miR-195高表達和低表達細胞模型,采用RT-PCR和Western blot分別檢測細胞轉染后HMGB1 mRNA以及蛋白表達量。結果顯示,通過miR-195模擬物使miR-195過表達,能顯著降低HMGB1 mRNA和蛋白表達水平。相反,通過miR-195抑制物來抑制miR-195的表達,能顯著增加HMGB1 mRNA和蛋白表達水平。表明miR-195可以調控HMGB1的表達。由此我們推測,miR-195可以通過抑制HMGB1的表達,減少炎癥反應以及新生血管的生成,從而延緩或抑制DR的發生發展。
本研究結果表明,DR患者血清中miR-195的表達明顯下調,其可能通過調控HMGB1的表達發揮效應。但由于每個miRNA可以調控多個靶基因,同一個靶基因也可以受到多個miRNA的調控,因此不排除miR-195同時還作用于其他靶基因,協同調控DR發生發展的可能性。因此,今后還需要進一步研究miR-195調控的DR相關基因,并在更多的視網膜內皮細胞系中驗證這一結果,進一步完善miR-195在DR中的功能及機制研究,并尋找可以抑制視網膜炎性反應、保護視網膜、延緩或減少DR發生的方法。