引用本文: 徐靜, 劉高勤, 陳志剛, 陸培榮. 白細胞介素17在人視網膜血管內皮細胞增生、遷移及凋亡中的作用. 中華眼底病雜志, 2015, 31(1): 67-71. doi: 10.3760/cma.j.issn.1005-1015.2015.01.017 復制
白細胞介素17(IL-17)是由Th17等細胞亞群分泌的特征性細胞因子,能促進多種細胞釋放炎性因子,在腫瘤的增生、轉移以及血管形成中發揮重要作用[1, 2]。已有研究發現,IL-17能夠促進人脈絡膜血管內皮細胞的遷移及血管形成[3]。但有關IL-17在人視網膜血管內皮細胞(HREC)中是否也能發揮相同作用,目前尚不清楚。為此,我們通過體外培養HREC,并應用人重組IL-17蛋白干預劑對其進行干預,觀察IL-17對HREC細胞增生、遷移、凋亡以及血管生成相關因子分泌等方面的影響。現將結果報道如下。
1 材料和方法
HREC(上海雅吉生物科技有限公司),人重組IL-17蛋白(美國eBioscience公司),Dulbecco改良Eagle培養基(DMEM,美國Hyclone公司),胎牛血清(FBS)、磷酸鹽緩沖溶液(PBS,美國Gibco公司),胰蛋白酶(美國Sigma公司)。微量RNA抽提試劑盒、逆轉錄(RT)試劑盒、Dnase純化劑(德國Qiagen公司),聚合酶鏈反應(PCR)試劑盒及DNA分子量標準(大連TaKaRa生物技術公司),人IL-17受體(IL-17R)、堿性成纖維細胞生長因子(bFGF)、含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-3、凝血酶敏感蛋白-1(TSP-1)引物由南京金思瑞生物科技有限公司設計合成。細胞計數試劑盒-8(CCK-8,碧云天生物技術研究所),細胞凋亡試劑盒(美國Invitrogen公司),兔抗人IL-17R、Caspase-3抗體(美國Santa Cruz公司),辣根過氧化物酶(HRP)標記羊抗兔二抗(上海華美生物技術有限公司),二氨基聯苯胺(DAB)顯色試劑盒(美國DAKO公司)。參照文獻[4]的方法,采用含有10% FBS的DMEM培養基,置于37℃、體積分數為5%的CO2培養箱中培養HREC,3~4 d后細胞長滿瓶底,按照1:4的比例進行傳代。每天觀察細胞生長狀態,并取對數生長期的細胞進行實驗。
采用RT-PCR檢測HREC中IL-17R基因的表達及IL-17干預后HREC中bFGF、Caspase-3、TSP-1的mRNA表達。IL-17R上游引物5′-CCACCCACTGC CAATACAAC-3′,下游引物5′-CGGAACTTGACC CCTACAAA-3′,擴增片段長度241堿基對(bp);磷酸甘油醛脫氫酶上游引物5′-ACCACAGTCCATGCCA TCAC-3′,下游引物5′-TCCACCACCCTGTTGCTGT A-3′,擴增片段長度452 bp;bFGF上游引物5′-GCTG TACTGCACGGGG-3′,下游引物5′-CTTTCT GCCCAGGTCCTGTT-3′,擴增片段長度341 bp;Caspase-3上游引物5′-TGCATACTCCACAGCACC TG-3′, 下游引物5′-TCTGTTGCCACCTTTCGGTT-3′,擴增片段長度153 bp;TSP-1上游引物5′-GGTCG GCCTGCACTGTCACC-3′,下游引物5′-GGGGAAG CTGCTGCACTGGG-3′,擴增片段長度197 bp。以含量1、2 mg/L的IL-17培養液干預細胞6~8 h后,收集處于對數生長期的HREC,并以此分為不同濃度干預組。以不含IL-17的培養液培養細胞作為對照組。參照文獻[5]的方法,利用微量RNA抽提試劑盒提取總RNA,并用Dnase試劑催化清除總RNA中殘留的DNA雜質后,將總RNA逆轉錄成cDNA。以cDNA為模板,樣本置PCR儀上擴增。條件:94℃預變性2 min,94℃變性30 s,58℃退火30 s,72℃延伸30 s。循環相應次數,最后72℃再延伸10 min。擴增產物加入5μl混有核酸染料(Gel Red)的6倍上樣緩沖液,質量分數為2%瓊脂糖凝膠上樣電泳后,于凝膠成像儀上拍照,利用Image J軟件對條帶的灰度值進行檢測。
采用CCK-8增生分析法檢測IL-17對HREC細胞增生的作用。參照文獻[5]的方法,取生長狀態良好的HREC,以每孔5×103個細胞的密度種于96孔板上,37℃恒溫培養箱培養過夜,之后更換無血清的DMEM培養基培養12 h,棄培養液,加入含50、100、200、500μg/L IL-17的10% FBS-DMEM培養液,并以此分為不同濃度干預組。以不含IL-17的培養液培養為對照組。每組設4個復孔,干預20 h后加入CCK-8孵育4 h,共干預24 h。置于酶聯檢測儀上測定波長450 nm下的吸光度[A,舊稱光密度(OD)]值。以A相對值為縱軸,IL-17干預濃度為橫軸,繪制A值變化曲線。
采用細胞劃痕法測定IL-17對HREC遷移的影響。將密度為1×105個/ml的HREC懸液以每孔2 ml接種于6孔板。參照文獻[5]的方法,待細胞長至90%的密度后,用滅菌的黃槍尖垂直于培養板劃直線,PBS漂洗3遍以清除離壁細胞,更換含50、100、200、500μg/L IL-17的10% FBS-DMEM培養液,并以此分為不同濃度干預組。以不含IL-17的培養液培養細胞為對照組。每組設3個平行孔,照相,并將此時設為0 h。將6孔板置于恒溫培養箱中培養,并于12、24 h時在倒置相差顯微鏡下再次拍照。用Photoshop CS4軟件的度量工具分別測量處理前和處理后細胞劃痕邊界的距離。細胞遷移距離=處理前距離-處理后的距離。
采用流式細胞技術檢測IL-17對HREC凋亡的影響。參照文獻[6]的方法將密度為1×105個/ml的HREC懸液以每孔2 ml接種于6孔板,待細胞長至90%的密度后,棄培養液,加入含有200μg/L IL-17的10% FBS-DMEM培養液,干預24 h。以不含IL-17的培養液培養細胞為對照組。收集細胞,并用PBS洗滌3遍,每個樣本加入100μl的1倍膜聯蛋白結合緩沖液,細胞數約為1×106~5×106個/ml,每樣本加入5μl膜聯蛋白和1μl碘化丙啶(PI)工作液,室溫下避光孵育15 min,孵育完成后再加入400μl的1倍膜聯蛋白結合緩沖液,混合均勻。用流式細胞儀進行分析,激發波長為488 nm,用波長530 nm的通道濾器檢測異硫氰酸熒光素(FITC)的熒光反應,575 nm的通道濾器檢測PI熒光反應。
采用Western blot法檢測HREC中IL-17R、Caspase-3的蛋白表達。將密度為1×105個/ml的HREC懸液以每孔2 ml接種于6孔板,待細胞長至90%的密度后,棄培養液,加入含有1、2 mg/L IL-17的10% FBS-DMEM培養液,干預24 h,并以此分為不同濃度干預組。以不含IL-17的培養液培養細胞為對照組。收集細胞,于細胞裂解液中裂解并抽提總蛋白,獲得的蛋白上清離心后與6倍蛋白上樣緩沖液按照5:1比例混勻,經煮沸法變性。變性蛋白加入聚丙烯酰胺膠孔中電泳。電泳結束后,將膠取出,利用硝酸纖維素膜進行轉膜,轉膜成功后將膜放入封閉液封閉,4℃過夜。次日分別加入兔抗人Caspase-3(1 :200)、兔抗人IL-17R(1 :500),室溫下孵育1.5 h,用洗膜緩沖液洗去未結合的抗體,加入HRP標記的羊抗兔IgG多抗(1 :10 000),室溫下孵育1 h,加入底物化學發光顯色液A、B混合液顯色[7]。條帶顯色后拍照并利用Image J軟件對條帶的灰度值進行檢測。
采用SPSS15.0統計軟件進行統計學分析,實驗數據均以均數±標準差(
2 結果
RT-PCR及瓊脂糖電泳結果顯示,利用IL-17R引物能擴增出明顯的特異性條帶,條帶位置與引物設計長度相符。Western blot檢測結果顯示,HREC中也存在IL-17R的蛋白表達。
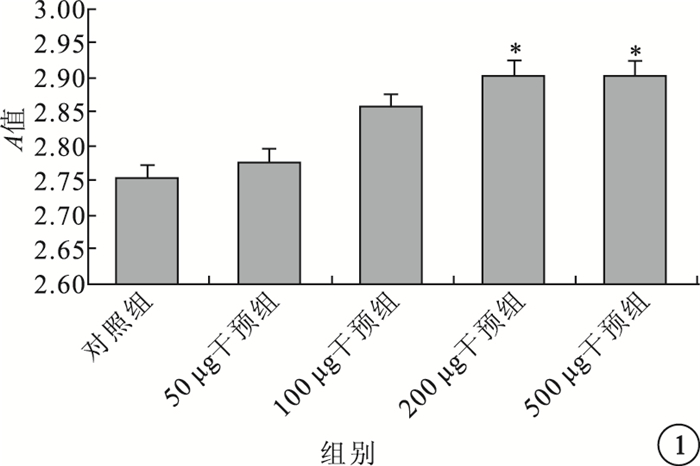
CCK-8增生分析法結果顯示,隨著IL-17培養液的濃度不斷增加,A值也呈上升趨勢。與對照組比較,200、500μg/L干預組A值明顯升高,差異均有統計學意義(t=-3.235、-6.276,P=0.032、0.000);50、100μg/L干預組A值無明顯變化,差異無統計學意義(P>0.05)。不同濃度干預組之間A值比較,差異也無統計學意義(P>0.05)(圖 1)。
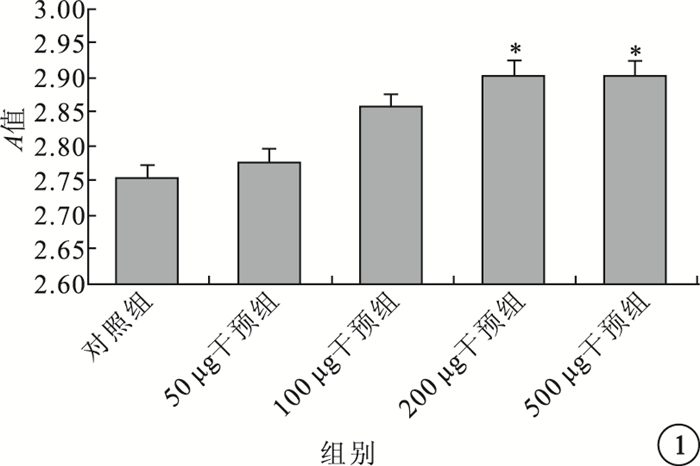 圖1
各組A值比較。*與對照組比較,P<0.05
圖1
各組A值比較。*與對照組比較,P<0.05
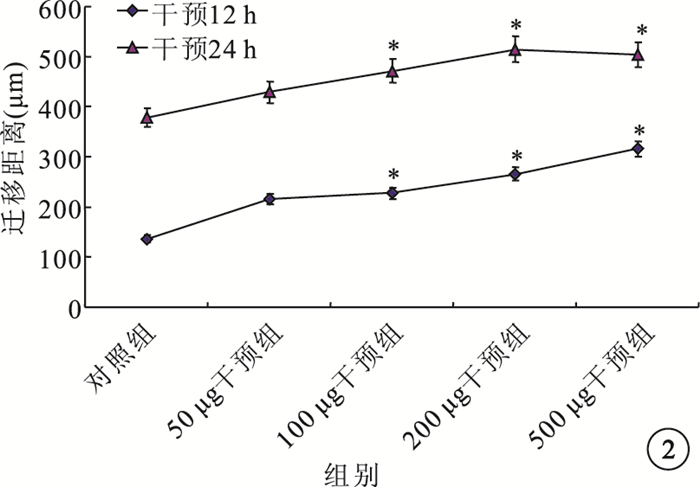
細胞劃痕法檢測結果顯示,干預12、24 h時,與對照組相比,50μg/L干預組HREC遷移距離無明顯變化(t=-1.973、-1.723,P=0.087、0.136);而100μg/L干預組(t=-3.551、-2.849,P=0.006、0.019)、200μg/L干預組(t=-10.347、-4.519,P=0.000、0.001)、500μg/L干預組(t=-3.541、-2.607,P=0.008、0.036)HREC遷移距離均明顯增加,差異有統計學意義。不同濃度干預組之間HREC遷移距離比較,差異無統計學意義(P>0.05)(圖 2)。
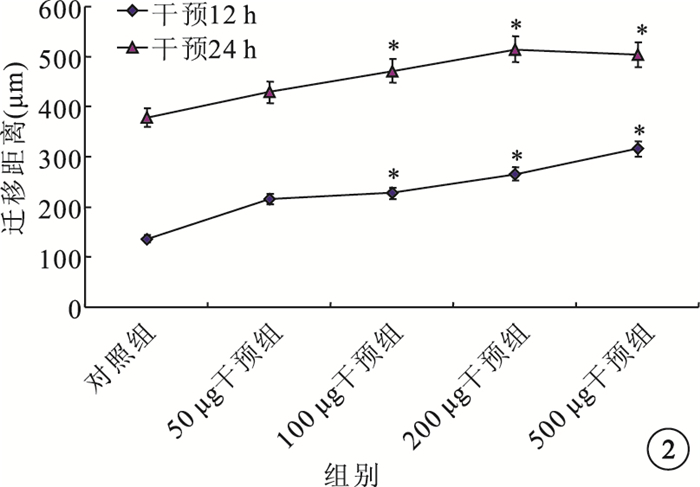 圖2
干預12、24 h時各組細胞遷移距離比較。*與對照組比較,P<0.05
圖2
干預12、24 h時各組細胞遷移距離比較。*與對照組比較,P<0.05
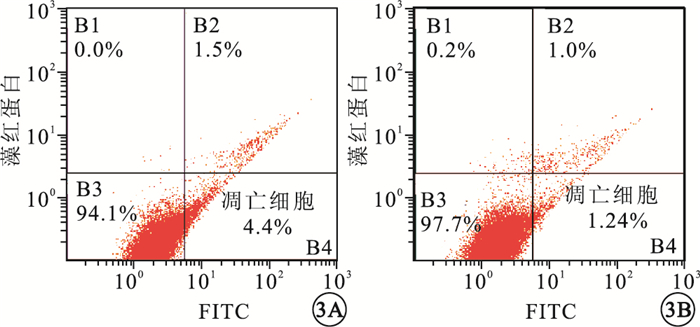
流式細胞技術檢查結果顯示,對照組、200μg/L干預組細胞凋亡比例分別為(5.350±1.574)%、(2.725±1.394)%。與對照組比較,200μg/L干預組細胞凋亡比例下調,差異有統計學意義(t=5.682,P=0.047)(圖 3)。
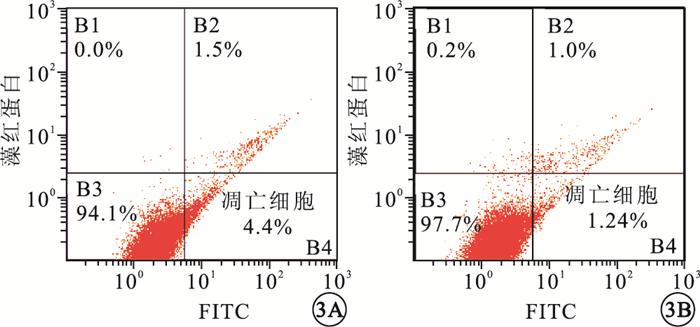 圖3
對照組與200μg/L干預組細胞凋亡流式圖。3A.對照組;3B. 200μg/L干預組
圖3
對照組與200μg/L干預組細胞凋亡流式圖。3A.對照組;3B. 200μg/L干預組
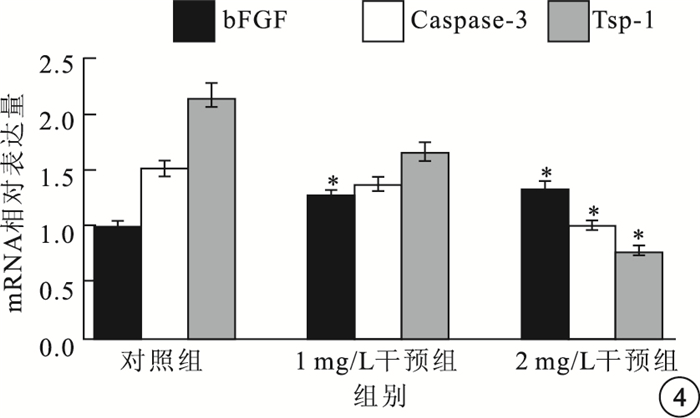
RT-PCR及瓊脂糖電泳結果顯示,以含量1、2 mg/L的IL-17培養液干預HREC 6~8 h后,HREC中bFGF的mRNA表達水平呈升高趨勢,而Caspase-3和TSP-1的mRNA表達水平呈下調趨勢。對照組、1 mg/L干預組及2 mg/L干預組之間bFGF、Caspase-3、TSP-1的mRNA表達比較,差異均有統計學意義(F=12.655、11.547、5.364,P=0.007、0.009、0.046)。組間兩兩比較結果顯示,1 mg/L干預組、2 mg/L干預組與對照組之間bFGF mRNA表達比較,差異有統計學意義(t=-5.990、-4.549,P=0.027、0.045);2 mg/L干預組與對照組之間Caspase-3 mRNA表達比較,差異有統計學意義(t=5.973,P=0.027);2 mg/L干預組與對照組之間TSP-1 mRNA表達比較,差異有統計學意義(t=3.549,P=0.029)。1 mg/L干預組與對照組Caspase-3、TSP-1 mRNA表達比較,差異無統計學意義(P>0.05)。1 mg/L干預組與2 mg/L干預組Caspase-3 mRNA表達比較,差異有統計學意義(t=3.57,P=0.023);bFGF、TSP-1 mRNA表達比較,差異無統計學意義(P>0.05)(圖 4)。
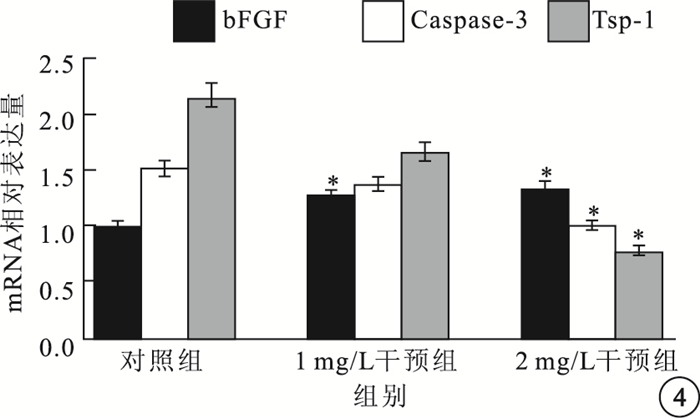 圖4
各組HREC中bFGF、Caspase-3、TSP-1 mRNA表達比較。*與對照組比較,P<0.05
圖4
各組HREC中bFGF、Caspase-3、TSP-1 mRNA表達比較。*與對照組比較,P<0.05
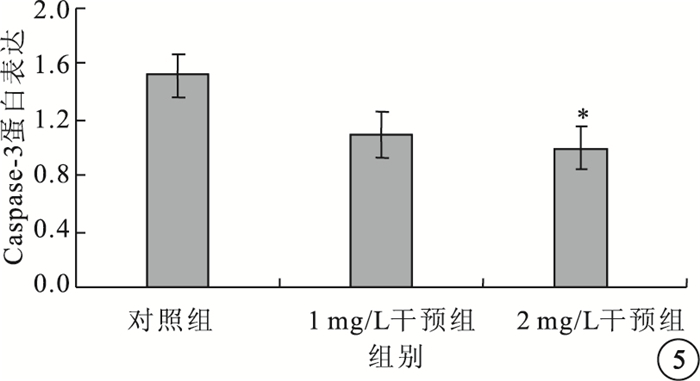
Western blot檢測結果顯示,以含量1、2 mg/L的IL-17培養液干預HREC 24 h后,HREC中Caspase-3蛋白表達呈下調趨勢。對照組、1 mg/L干預組及2 mg/L干預組Caspase-3蛋白表達比較,差異有統計學意義(F=5.892,P=0.023)。組間兩兩比較結果顯示,2 mg/L干預組與對照組Caspase-3蛋白表達比較,差異有統計學意義(t=0.113,P=0.029);1 mg/L干預組與對照組以及1 mg/L干預組與2 mg/L干預組Caspase-3蛋白表達比較,差異均無統計學意義(P>0.05)(圖 5)。
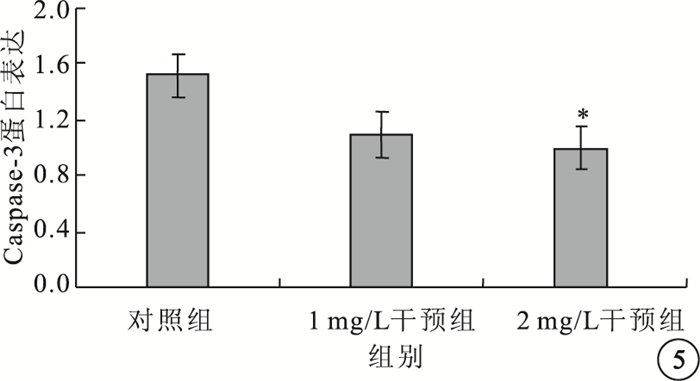 圖5
各組HREC中Caspase-3蛋白表達比較。*與對照組比較,P<0.05
圖5
各組HREC中Caspase-3蛋白表達比較。*與對照組比較,P<0.05
3 討論
本研究通過RT-PCR和Western blot檢測在基因水平和蛋白水平中明確發現了HREC中IL-17R的表達。在確認IL-17R表達后,加入人重組IL-17蛋白對HREC進行干預。CCK-8增生分析法結果顯示,IL-17能促進HREC的增生并呈劑量依賴性。該結果與IL-17在腫瘤[2, 8]、人淋巴微血管內皮細胞[9]中的作用研究結果類似。有研究發現,IL-17能促進人脈絡膜血管內皮細胞和人真皮血管內皮細胞的遷移[3, 10]。與此相似,本研究通過細胞劃痕法檢測發現,IL-17能夠促進HREC的遷移并呈劑量依賴性。同時,我們還利用流式細胞技術檢測發現,IL-17能夠抑制HREC的凋亡。
為了進一步研究IL-17促進HREC增生、遷移及凋亡的分子機制,我們進行了相關的RT-PCR以及Western blot檢測。結果顯示IL-17干預HREC后,能夠促進bFGF mRNA的表達。既往研究發現,IL-17家族成員之一的IL-17E(IL-25)能夠通過與人臍靜脈內皮細胞上IL-17R的作用促進其bFGF基因水平的表達,并認為是通過磷脂酰肌醇3激酶信號通路實現的[11]。IL-17還能促進腫瘤細胞在內的多種細胞血管內皮生長因子(VEGF)的表達[2]。內皮細胞是分泌bFGF的主要細胞之一,現已證明bFGF對于內皮細胞有促增生和促趨化的作用。它能刺激內皮細胞膠原酶和纖維蛋白酶的激活,降解基底膜,促進內皮細胞遷移,毛細血管樣結構的形成[12]。結合本研究結果,我們認為IL-17促進HREC增生和遷移的作用,可能是通過促進內皮細胞bFGF的表達來實現的。
除了促進bFGF的表達,IL-17干預HREC后,Caspase-3 mRNA的表達出現下調。Caspase-3是重要的凋亡相關因子,其表達水平與細胞凋亡密切相關。Caspase-3基因水平表達的檢測結果與其抑制細胞凋亡的流式檢測結果相一致。既往研究發現,IL-17能夠抑制腫瘤細胞的凋亡,并且與信號轉導與轉錄激活因子和NF-κB信號途徑的激活相關[2]。由此推斷,IL-17能夠促進HREC細胞增生,可能是其抗凋亡作用和促進bFGF表達兩者共同作用的結果。
TSP-1是重要的抗血管生成因子,它能通過誘導內皮細胞凋亡、阻止內皮細胞對各種血管因素的刺激反應而抑制血管生長[13]。IL-17干預后HREC的TSP-1基因水平的表達下降,可通過促進內皮細胞凋亡,抑制血管生成。
除此之外,我們還進一步運用Western blot檢測了IL-17干預后Caspase-3的表達變化,從蛋白水平進一步證明了IL-17能抑制Caspase-3的表達,抑制細胞凋亡。
本研究結果表明,IL-17能促進HREC的增生和遷移并抑制細胞凋亡。其機制可能通過促進bFGF等促血管因子、抑制Caspase-3凋亡相關蛋白、TSP-1抑血管因子因子的表達發揮促血管作用。但由于體外實驗環境單一,不能夠完全模擬體內復雜的血管生成和抑制因子之間的相互作用,需進一步進行體內實驗,構建相關動物模型,進一步探索IL-17與視網膜新生血管的相關性及其可能的機制。
白細胞介素17(IL-17)是由Th17等細胞亞群分泌的特征性細胞因子,能促進多種細胞釋放炎性因子,在腫瘤的增生、轉移以及血管形成中發揮重要作用[1, 2]。已有研究發現,IL-17能夠促進人脈絡膜血管內皮細胞的遷移及血管形成[3]。但有關IL-17在人視網膜血管內皮細胞(HREC)中是否也能發揮相同作用,目前尚不清楚。為此,我們通過體外培養HREC,并應用人重組IL-17蛋白干預劑對其進行干預,觀察IL-17對HREC細胞增生、遷移、凋亡以及血管生成相關因子分泌等方面的影響。現將結果報道如下。
1 材料和方法
HREC(上海雅吉生物科技有限公司),人重組IL-17蛋白(美國eBioscience公司),Dulbecco改良Eagle培養基(DMEM,美國Hyclone公司),胎牛血清(FBS)、磷酸鹽緩沖溶液(PBS,美國Gibco公司),胰蛋白酶(美國Sigma公司)。微量RNA抽提試劑盒、逆轉錄(RT)試劑盒、Dnase純化劑(德國Qiagen公司),聚合酶鏈反應(PCR)試劑盒及DNA分子量標準(大連TaKaRa生物技術公司),人IL-17受體(IL-17R)、堿性成纖維細胞生長因子(bFGF)、含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-3、凝血酶敏感蛋白-1(TSP-1)引物由南京金思瑞生物科技有限公司設計合成。細胞計數試劑盒-8(CCK-8,碧云天生物技術研究所),細胞凋亡試劑盒(美國Invitrogen公司),兔抗人IL-17R、Caspase-3抗體(美國Santa Cruz公司),辣根過氧化物酶(HRP)標記羊抗兔二抗(上海華美生物技術有限公司),二氨基聯苯胺(DAB)顯色試劑盒(美國DAKO公司)。參照文獻[4]的方法,采用含有10% FBS的DMEM培養基,置于37℃、體積分數為5%的CO2培養箱中培養HREC,3~4 d后細胞長滿瓶底,按照1:4的比例進行傳代。每天觀察細胞生長狀態,并取對數生長期的細胞進行實驗。
采用RT-PCR檢測HREC中IL-17R基因的表達及IL-17干預后HREC中bFGF、Caspase-3、TSP-1的mRNA表達。IL-17R上游引物5′-CCACCCACTGC CAATACAAC-3′,下游引物5′-CGGAACTTGACC CCTACAAA-3′,擴增片段長度241堿基對(bp);磷酸甘油醛脫氫酶上游引物5′-ACCACAGTCCATGCCA TCAC-3′,下游引物5′-TCCACCACCCTGTTGCTGT A-3′,擴增片段長度452 bp;bFGF上游引物5′-GCTG TACTGCACGGGG-3′,下游引物5′-CTTTCT GCCCAGGTCCTGTT-3′,擴增片段長度341 bp;Caspase-3上游引物5′-TGCATACTCCACAGCACC TG-3′, 下游引物5′-TCTGTTGCCACCTTTCGGTT-3′,擴增片段長度153 bp;TSP-1上游引物5′-GGTCG GCCTGCACTGTCACC-3′,下游引物5′-GGGGAAG CTGCTGCACTGGG-3′,擴增片段長度197 bp。以含量1、2 mg/L的IL-17培養液干預細胞6~8 h后,收集處于對數生長期的HREC,并以此分為不同濃度干預組。以不含IL-17的培養液培養細胞作為對照組。參照文獻[5]的方法,利用微量RNA抽提試劑盒提取總RNA,并用Dnase試劑催化清除總RNA中殘留的DNA雜質后,將總RNA逆轉錄成cDNA。以cDNA為模板,樣本置PCR儀上擴增。條件:94℃預變性2 min,94℃變性30 s,58℃退火30 s,72℃延伸30 s。循環相應次數,最后72℃再延伸10 min。擴增產物加入5μl混有核酸染料(Gel Red)的6倍上樣緩沖液,質量分數為2%瓊脂糖凝膠上樣電泳后,于凝膠成像儀上拍照,利用Image J軟件對條帶的灰度值進行檢測。
采用CCK-8增生分析法檢測IL-17對HREC細胞增生的作用。參照文獻[5]的方法,取生長狀態良好的HREC,以每孔5×103個細胞的密度種于96孔板上,37℃恒溫培養箱培養過夜,之后更換無血清的DMEM培養基培養12 h,棄培養液,加入含50、100、200、500μg/L IL-17的10% FBS-DMEM培養液,并以此分為不同濃度干預組。以不含IL-17的培養液培養為對照組。每組設4個復孔,干預20 h后加入CCK-8孵育4 h,共干預24 h。置于酶聯檢測儀上測定波長450 nm下的吸光度[A,舊稱光密度(OD)]值。以A相對值為縱軸,IL-17干預濃度為橫軸,繪制A值變化曲線。
采用細胞劃痕法測定IL-17對HREC遷移的影響。將密度為1×105個/ml的HREC懸液以每孔2 ml接種于6孔板。參照文獻[5]的方法,待細胞長至90%的密度后,用滅菌的黃槍尖垂直于培養板劃直線,PBS漂洗3遍以清除離壁細胞,更換含50、100、200、500μg/L IL-17的10% FBS-DMEM培養液,并以此分為不同濃度干預組。以不含IL-17的培養液培養細胞為對照組。每組設3個平行孔,照相,并將此時設為0 h。將6孔板置于恒溫培養箱中培養,并于12、24 h時在倒置相差顯微鏡下再次拍照。用Photoshop CS4軟件的度量工具分別測量處理前和處理后細胞劃痕邊界的距離。細胞遷移距離=處理前距離-處理后的距離。
采用流式細胞技術檢測IL-17對HREC凋亡的影響。參照文獻[6]的方法將密度為1×105個/ml的HREC懸液以每孔2 ml接種于6孔板,待細胞長至90%的密度后,棄培養液,加入含有200μg/L IL-17的10% FBS-DMEM培養液,干預24 h。以不含IL-17的培養液培養細胞為對照組。收集細胞,并用PBS洗滌3遍,每個樣本加入100μl的1倍膜聯蛋白結合緩沖液,細胞數約為1×106~5×106個/ml,每樣本加入5μl膜聯蛋白和1μl碘化丙啶(PI)工作液,室溫下避光孵育15 min,孵育完成后再加入400μl的1倍膜聯蛋白結合緩沖液,混合均勻。用流式細胞儀進行分析,激發波長為488 nm,用波長530 nm的通道濾器檢測異硫氰酸熒光素(FITC)的熒光反應,575 nm的通道濾器檢測PI熒光反應。
采用Western blot法檢測HREC中IL-17R、Caspase-3的蛋白表達。將密度為1×105個/ml的HREC懸液以每孔2 ml接種于6孔板,待細胞長至90%的密度后,棄培養液,加入含有1、2 mg/L IL-17的10% FBS-DMEM培養液,干預24 h,并以此分為不同濃度干預組。以不含IL-17的培養液培養細胞為對照組。收集細胞,于細胞裂解液中裂解并抽提總蛋白,獲得的蛋白上清離心后與6倍蛋白上樣緩沖液按照5:1比例混勻,經煮沸法變性。變性蛋白加入聚丙烯酰胺膠孔中電泳。電泳結束后,將膠取出,利用硝酸纖維素膜進行轉膜,轉膜成功后將膜放入封閉液封閉,4℃過夜。次日分別加入兔抗人Caspase-3(1 :200)、兔抗人IL-17R(1 :500),室溫下孵育1.5 h,用洗膜緩沖液洗去未結合的抗體,加入HRP標記的羊抗兔IgG多抗(1 :10 000),室溫下孵育1 h,加入底物化學發光顯色液A、B混合液顯色[7]。條帶顯色后拍照并利用Image J軟件對條帶的灰度值進行檢測。
采用SPSS15.0統計軟件進行統計學分析,實驗數據均以均數±標準差(
2 結果
RT-PCR及瓊脂糖電泳結果顯示,利用IL-17R引物能擴增出明顯的特異性條帶,條帶位置與引物設計長度相符。Western blot檢測結果顯示,HREC中也存在IL-17R的蛋白表達。
CCK-8增生分析法結果顯示,隨著IL-17培養液的濃度不斷增加,A值也呈上升趨勢。與對照組比較,200、500μg/L干預組A值明顯升高,差異均有統計學意義(t=-3.235、-6.276,P=0.032、0.000);50、100μg/L干預組A值無明顯變化,差異無統計學意義(P>0.05)。不同濃度干預組之間A值比較,差異也無統計學意義(P>0.05)(圖 1)。
 圖1
各組A值比較。*與對照組比較,P<0.05
圖1
各組A值比較。*與對照組比較,P<0.05
細胞劃痕法檢測結果顯示,干預12、24 h時,與對照組相比,50μg/L干預組HREC遷移距離無明顯變化(t=-1.973、-1.723,P=0.087、0.136);而100μg/L干預組(t=-3.551、-2.849,P=0.006、0.019)、200μg/L干預組(t=-10.347、-4.519,P=0.000、0.001)、500μg/L干預組(t=-3.541、-2.607,P=0.008、0.036)HREC遷移距離均明顯增加,差異有統計學意義。不同濃度干預組之間HREC遷移距離比較,差異無統計學意義(P>0.05)(圖 2)。
 圖2
干預12、24 h時各組細胞遷移距離比較。*與對照組比較,P<0.05
圖2
干預12、24 h時各組細胞遷移距離比較。*與對照組比較,P<0.05
流式細胞技術檢查結果顯示,對照組、200μg/L干預組細胞凋亡比例分別為(5.350±1.574)%、(2.725±1.394)%。與對照組比較,200μg/L干預組細胞凋亡比例下調,差異有統計學意義(t=5.682,P=0.047)(圖 3)。
 圖3
對照組與200μg/L干預組細胞凋亡流式圖。3A.對照組;3B. 200μg/L干預組
圖3
對照組與200μg/L干預組細胞凋亡流式圖。3A.對照組;3B. 200μg/L干預組
RT-PCR及瓊脂糖電泳結果顯示,以含量1、2 mg/L的IL-17培養液干預HREC 6~8 h后,HREC中bFGF的mRNA表達水平呈升高趨勢,而Caspase-3和TSP-1的mRNA表達水平呈下調趨勢。對照組、1 mg/L干預組及2 mg/L干預組之間bFGF、Caspase-3、TSP-1的mRNA表達比較,差異均有統計學意義(F=12.655、11.547、5.364,P=0.007、0.009、0.046)。組間兩兩比較結果顯示,1 mg/L干預組、2 mg/L干預組與對照組之間bFGF mRNA表達比較,差異有統計學意義(t=-5.990、-4.549,P=0.027、0.045);2 mg/L干預組與對照組之間Caspase-3 mRNA表達比較,差異有統計學意義(t=5.973,P=0.027);2 mg/L干預組與對照組之間TSP-1 mRNA表達比較,差異有統計學意義(t=3.549,P=0.029)。1 mg/L干預組與對照組Caspase-3、TSP-1 mRNA表達比較,差異無統計學意義(P>0.05)。1 mg/L干預組與2 mg/L干預組Caspase-3 mRNA表達比較,差異有統計學意義(t=3.57,P=0.023);bFGF、TSP-1 mRNA表達比較,差異無統計學意義(P>0.05)(圖 4)。
 圖4
各組HREC中bFGF、Caspase-3、TSP-1 mRNA表達比較。*與對照組比較,P<0.05
圖4
各組HREC中bFGF、Caspase-3、TSP-1 mRNA表達比較。*與對照組比較,P<0.05
Western blot檢測結果顯示,以含量1、2 mg/L的IL-17培養液干預HREC 24 h后,HREC中Caspase-3蛋白表達呈下調趨勢。對照組、1 mg/L干預組及2 mg/L干預組Caspase-3蛋白表達比較,差異有統計學意義(F=5.892,P=0.023)。組間兩兩比較結果顯示,2 mg/L干預組與對照組Caspase-3蛋白表達比較,差異有統計學意義(t=0.113,P=0.029);1 mg/L干預組與對照組以及1 mg/L干預組與2 mg/L干預組Caspase-3蛋白表達比較,差異均無統計學意義(P>0.05)(圖 5)。
 圖5
各組HREC中Caspase-3蛋白表達比較。*與對照組比較,P<0.05
圖5
各組HREC中Caspase-3蛋白表達比較。*與對照組比較,P<0.05
3 討論
本研究通過RT-PCR和Western blot檢測在基因水平和蛋白水平中明確發現了HREC中IL-17R的表達。在確認IL-17R表達后,加入人重組IL-17蛋白對HREC進行干預。CCK-8增生分析法結果顯示,IL-17能促進HREC的增生并呈劑量依賴性。該結果與IL-17在腫瘤[2, 8]、人淋巴微血管內皮細胞[9]中的作用研究結果類似。有研究發現,IL-17能促進人脈絡膜血管內皮細胞和人真皮血管內皮細胞的遷移[3, 10]。與此相似,本研究通過細胞劃痕法檢測發現,IL-17能夠促進HREC的遷移并呈劑量依賴性。同時,我們還利用流式細胞技術檢測發現,IL-17能夠抑制HREC的凋亡。
為了進一步研究IL-17促進HREC增生、遷移及凋亡的分子機制,我們進行了相關的RT-PCR以及Western blot檢測。結果顯示IL-17干預HREC后,能夠促進bFGF mRNA的表達。既往研究發現,IL-17家族成員之一的IL-17E(IL-25)能夠通過與人臍靜脈內皮細胞上IL-17R的作用促進其bFGF基因水平的表達,并認為是通過磷脂酰肌醇3激酶信號通路實現的[11]。IL-17還能促進腫瘤細胞在內的多種細胞血管內皮生長因子(VEGF)的表達[2]。內皮細胞是分泌bFGF的主要細胞之一,現已證明bFGF對于內皮細胞有促增生和促趨化的作用。它能刺激內皮細胞膠原酶和纖維蛋白酶的激活,降解基底膜,促進內皮細胞遷移,毛細血管樣結構的形成[12]。結合本研究結果,我們認為IL-17促進HREC增生和遷移的作用,可能是通過促進內皮細胞bFGF的表達來實現的。
除了促進bFGF的表達,IL-17干預HREC后,Caspase-3 mRNA的表達出現下調。Caspase-3是重要的凋亡相關因子,其表達水平與細胞凋亡密切相關。Caspase-3基因水平表達的檢測結果與其抑制細胞凋亡的流式檢測結果相一致。既往研究發現,IL-17能夠抑制腫瘤細胞的凋亡,并且與信號轉導與轉錄激活因子和NF-κB信號途徑的激活相關[2]。由此推斷,IL-17能夠促進HREC細胞增生,可能是其抗凋亡作用和促進bFGF表達兩者共同作用的結果。
TSP-1是重要的抗血管生成因子,它能通過誘導內皮細胞凋亡、阻止內皮細胞對各種血管因素的刺激反應而抑制血管生長[13]。IL-17干預后HREC的TSP-1基因水平的表達下降,可通過促進內皮細胞凋亡,抑制血管生成。
除此之外,我們還進一步運用Western blot檢測了IL-17干預后Caspase-3的表達變化,從蛋白水平進一步證明了IL-17能抑制Caspase-3的表達,抑制細胞凋亡。
本研究結果表明,IL-17能促進HREC的增生和遷移并抑制細胞凋亡。其機制可能通過促進bFGF等促血管因子、抑制Caspase-3凋亡相關蛋白、TSP-1抑血管因子因子的表達發揮促血管作用。但由于體外實驗環境單一,不能夠完全模擬體內復雜的血管生成和抑制因子之間的相互作用,需進一步進行體內實驗,構建相關動物模型,進一步探索IL-17與視網膜新生血管的相關性及其可能的機制。