引用本文: 吳一湘, 楊春波, 于敏, 李筱榮. 苯丙氨酸促進人胚胎干細胞向視網膜色素上皮細胞高效分化的研究. 中華眼底病雜志, 2015, 31(1): 57-61. doi: 10.3760/cma.j.issn.1005-1015.2015.01.015 復制
視網膜色素上皮(RPE)細胞的丟失和功能障礙是導致老年性黃斑變性(AMD)、視網膜色素變性(RP)等視網膜變性性疾病的主要原因。目前尚無有效治療方法,人胚胎干細胞(hESC)來源的RPE(hESC-RPE)移植被認為是可能的治療方案[1]。目前獲得hESC-RPE的主要方法有撤除堿性成纖維細胞因子(bFGF)自主分化、早期應用Wnt和Nodal抑制劑誘導分化、轉化生長因子-β抑制劑誘導分化等[2-4],但均存在分化效率低、成本高、誘導藥物的安全性不確定等問題。苯丙氨酸(phenylalanine)可誘導酪氨酸酶高表達,調控色素細胞增生、分化與色素合成[5]。為此,我們在誘導分化培養中加入苯丙氨酸,通過檢測早期RPE標志人類配對盒基因6(Pax6)、小眼球相關轉錄因子(MITF)和成熟RPE標志RPE65、酪氨酸酶(tyrosinase)[6]的表達情況,觀察其對RPE誘導效率的影響;誘導純化的RPE細胞移植到視網膜變性模型大鼠視網膜下腔,同時對其治療效果進行了觀察;現將結果報道如下。
1 材料和方法
人ESC(hESC)H1[7, 8](美國WiCell研究所)接種于Matrigel基質膠(美國BD公司)包被的6孔板內,人類ESC維持培養液(加拿大Stem Cell公司)培養3~4 d,每天換液,至90%的細胞克隆過度融合,更換為不含bFGF的基礎誘導體系培養2周。將細胞分為對照組和實驗組。對照組繼續以基礎誘導體系培養至第7周;實驗組持續添加0.2 mmol/L左旋苯丙氨酸(北京索萊寶科技有限公司)培養至第7周。基礎誘導體系成分:Knockout-Dulbecco改良的Eagle培養基(DMEM,美國Gibco公司),10% knockout血清替代物(KSR,美國Gibco公司),1%谷氨酰胺(美國Gibco公司),1%青鏈霉素(美國Gibco公司)。人RPE(hRPE)取自眼球摘除的患者視網膜組織。
實時熒光定量聚合酶鏈反應(RT-PCR)檢測MITF、Pax6、RPE65、tyrosinase、Wnt配體(Wnt3a)、淋巴樣增強因子-1(Lef1)、轉錄因子7(Tcf7)mRNA的表達。PCR引物由上海英駿生物技術有限公司合成(表 1)。細胞誘導分化第7周以Trizol(美國Invitrogen公司)分別提取對照組和實驗組細胞總RNA,微量分光光度計(美國Nanodrop公司)測定RNA濃度和純度,按逆轉錄試劑盒(美國Thermo公司)說明合成cDNA,逆轉錄反應體系為65℃,5min;42℃,1 h;70℃,15 min。RT-PCR以甘油醛-3-磷酸脫氫酶(GAPDH)表達量為內參。實驗重復3次,采用2-ΔΔCt法分析。
蛋白免疫印跡法(Western blot)檢測MITF、RPE65蛋白表達。細胞誘導分化第7周使用含有蛋白酶抑制劑(美國Roche公司)的細胞組織快速裂解液(北京索萊寶科技有限公司)分別提取正常組、實驗組細胞和hRPE組織總蛋白,二辛可酸蛋白定量試劑盒(天津寶瑞生物技術有限公司)測定蛋白質濃度,取70μg樣品進行十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳,濕轉法轉膜90 min,5%脫脂奶粉封閉2h,分別加入一抗:小鼠抗人MITF單克隆抗體(英國Abcam公司,1 :1000),小鼠抗hRPE65單克隆抗體(英國Abcam公司,1 :1000),小鼠抗人β-肌動蛋白(actin)單克隆抗體(北京中杉金橋生物技術有限公司,1 :1000)4℃孵育過夜,洗膜后加入辣根過氧化物酶標記的山羊抗小鼠二抗(北京中杉金橋生物技術有限公司,1 :1000)室溫孵育2 h,洗膜后電化學發光法顯影,暗室曝光。以β-actin作為內參。
流式細胞技術(FCM)檢測RPE65陽性細胞比例。細胞誘導分化第7周去除培養基,1倍不含鈣、鎂的磷酸鹽緩沖液(DPBS,美國Gibco公司)沖洗細胞,0.25%胰酶-乙二胺四乙酸(EDTA,美國Gibco公司)37℃孵育20 min, 吹打成單細胞,加入10% KSR基礎誘導培養基中和反應,離心半徑9.5 cm,1500 r/min離心5 min,棄上清液,1倍DPBS,離心半徑9.5 cm,1500 r/min離心5 min,洗滌細胞,棄上清液。4%多聚甲醛,37℃固定10 min,離心洗滌細胞,計數后分別將對照組、實驗組細胞分為0.5-1×106個/管,逐滴加入-20℃90%甲醇(1ml/管),冰上操作,4℃透化10 min,離心洗滌細胞,棄上清液,加入100μl 1%牛血清白蛋白(BSA)稀釋的小鼠抗hRPE65單克隆抗體(英國Abcam公司,1 :100),4℃孵育1 h。離心洗滌3次,加入100μl 1%BSA稀釋的異硫氰酸熒光素標記的山羊抗小鼠二抗(北京中杉金橋生物技術有限公司,1 :100),室溫避光孵育30 min,陰性對照組只加二抗。離心洗滌3次,1 ml 1%BSA重懸。
hESC-RPE細胞純化及體內功能實驗。誘導分化第7周用無菌注射器挑取實驗組色素團塊,1~2 mm/塊,接種于Matrigel包被的12孔板,6~8塊/孔,繼續用0.2 mmol/L左旋苯丙氨酸誘導體系培養,每3天刮除未色素化非六邊形的雜細胞,刮除雜細胞后換液,直至色素化細胞長滿孔板,4周后傳代。去除純化RPE的培養基,1倍DPBS沖洗后,0.25%胰酶-EDTA37℃孵育20 min消化成單細胞,10%KSR分化培養基終止反應,離心洗滌細胞,計數后分為1×106個/管,以12μl DPBS重懸。Sprague Dawley(SD)大鼠12只,雄性,鼠齡28 d[9],隨機分為對照組和治療組。將碘酸鈉溶于生理鹽水配置成10%碘酸鈉溶液,經鼠尾靜脈注射,劑量為20 mg/kg,建模后3 d,行單眼內路法視網膜下腔注射。對照組每只眼注射2μl 1倍DPBS,治療組每只眼注射2μl純化的hESC-RPE。治療后6周行視網膜電圖(ERG)檢查,觀察大鼠暗適應3.0 a-b波振幅。
應用SPSS 21.0統計軟件行統計學分析處理。所有數據以均數±標準差(
2 結果
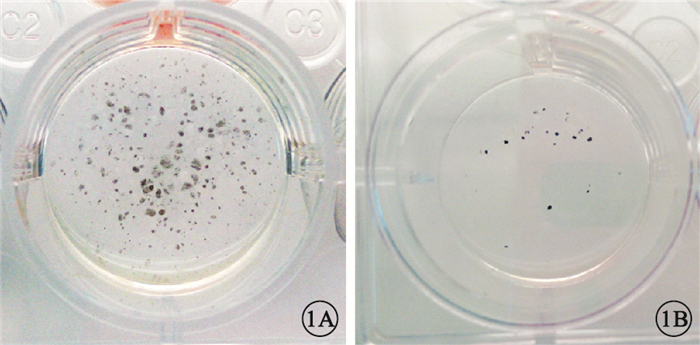
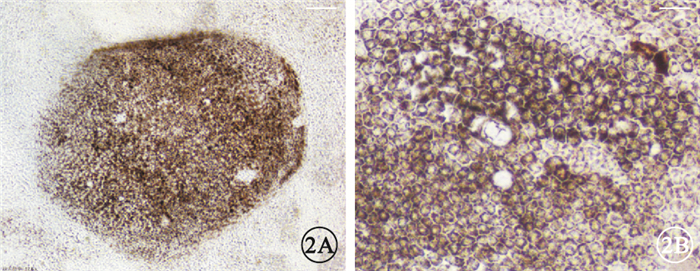
誘導分化第7周,實驗組肉眼可見大量明顯色素團塊(圖 1A),對照組出現少量肉眼可見的色素團塊(圖 1B)。實驗組色素區域內細胞呈多角形蜂窩狀(圖 2A),胞質內有明顯的色素顆粒(圖 2B)。
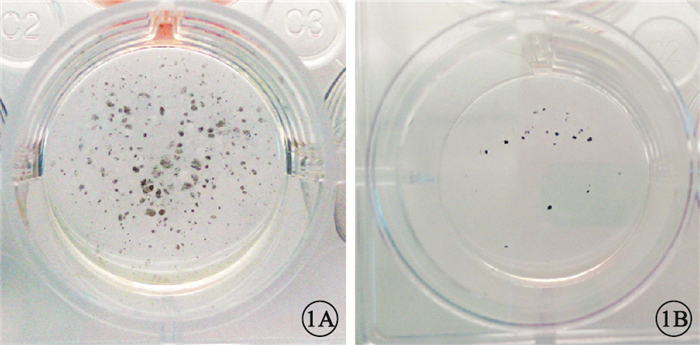 圖1
誘導分化第7周孔板外觀像。1A.實驗組,可見多個色素團塊;1B.對照組,出現少量色素團塊
圖1
誘導分化第7周孔板外觀像。1A.實驗組,可見多個色素團塊;1B.對照組,出現少量色素團塊
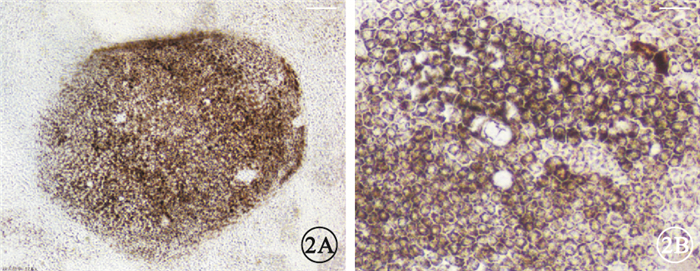 圖2
實驗組hESC-RPE細胞光學顯微鏡像。2A.色素團塊內部多邊形黑素細胞標尺:50μm;2B.多邊形黑素細胞呈蜂窩狀緊密排列,胞質內充滿色素顆粒標尺:20μm
圖2
實驗組hESC-RPE細胞光學顯微鏡像。2A.色素團塊內部多邊形黑素細胞標尺:50μm;2B.多邊形黑素細胞呈蜂窩狀緊密排列,胞質內充滿色素顆粒標尺:20μm
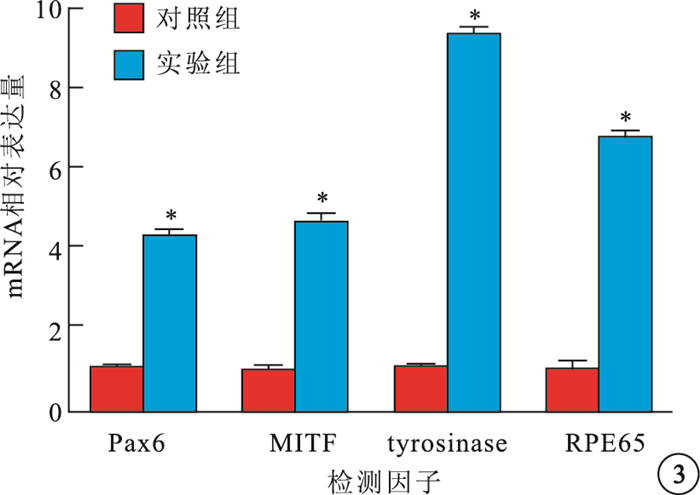
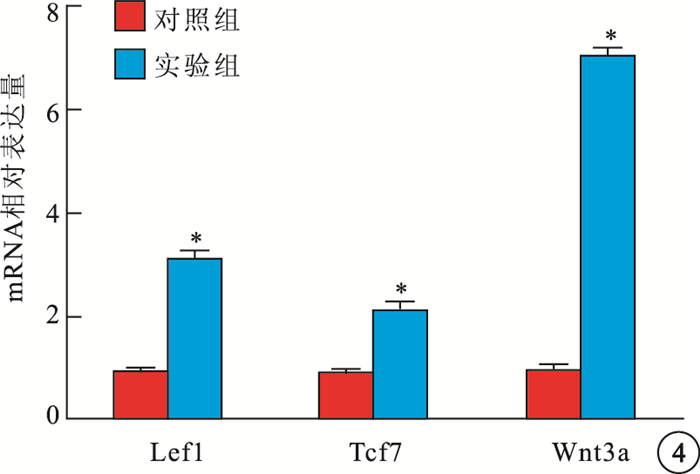
RT-PCR檢測結果顯示,實驗組Pax6、MITF、RPE65、tyrosinase mRNA(圖 3)表達量高于對照組,差異有統計學意義(t=39.442、26.141、31.280、77.239,P=0.000)。實驗組Wnt3a、Lef1、Tcf7 mRNA表達量明顯高于對照組,差異有統計學意義(t=46.113、27.686、17.424,P=0.000)(圖 4)。
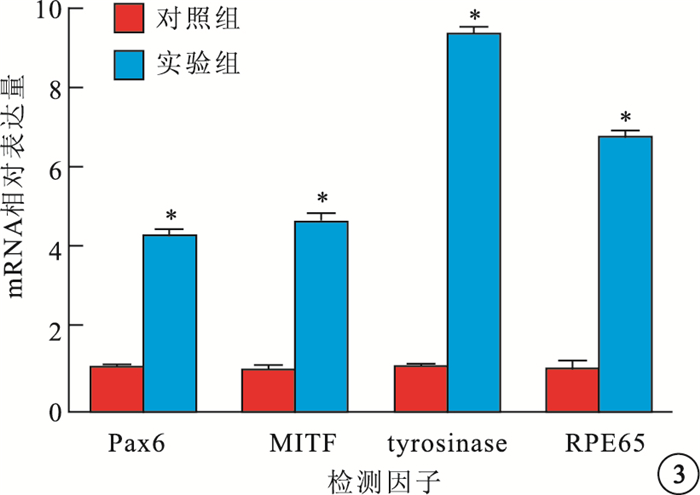 圖3
對照組、實驗組Pax6、MITF、tyrosinase、RPE65 mRNA相對表達量。* P<0.01
圖3
對照組、實驗組Pax6、MITF、tyrosinase、RPE65 mRNA相對表達量。* P<0.01
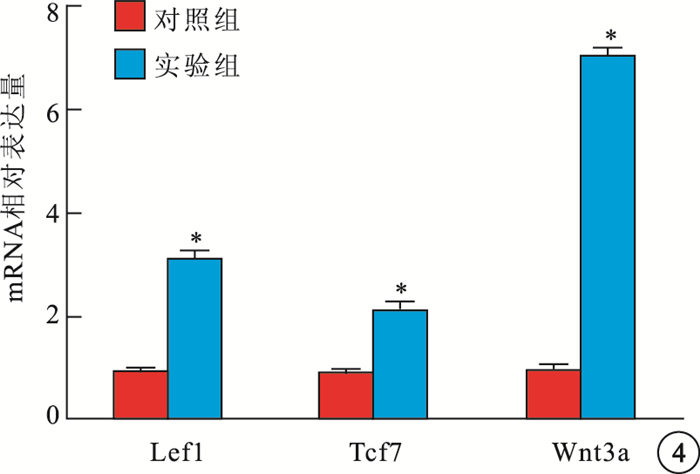 圖4
對照組、實驗組Lef1、Tcf7、Wnt3a mRNA相對表達量統計圖。實驗組Lef1、Tcf7、Wnt3a mRNA表達量明顯高于對照組。* P<0.01
圖4
對照組、實驗組Lef1、Tcf7、Wnt3a mRNA相對表達量統計圖。實驗組Lef1、Tcf7、Wnt3a mRNA表達量明顯高于對照組。* P<0.01
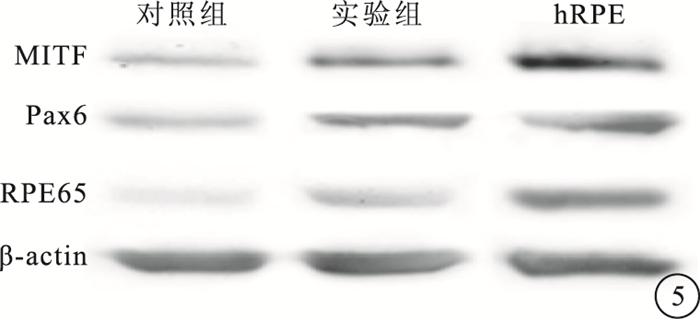
Western blot檢測結果顯示,實驗組細胞MITF、Pax6和RPE65蛋白表達量均高于對照組(圖 5)。
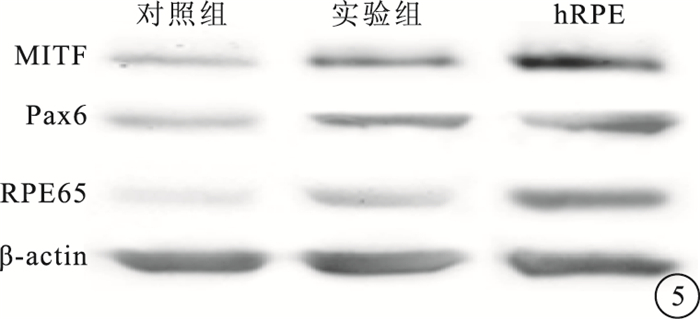 圖5
Western blot檢測圖。對照組、實驗組、hRPE組織中MITF、Pax6和RPE65蛋白表達
圖5
Western blot檢測圖。對照組、實驗組、hRPE組織中MITF、Pax6和RPE65蛋白表達
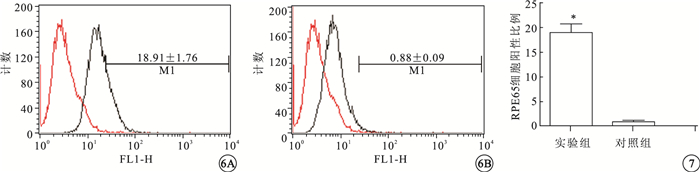
FCM檢測結果顯示,實驗組(圖 6A)、對照組(圖 6B)細胞RPE65陽性細胞比例分別為(18.91±1.76)%、(0.88±0.09)%。實驗組陽性細胞比例明顯高于對照組,差異有統計學意義(t=10.27,P=0.0005)(圖 7)。
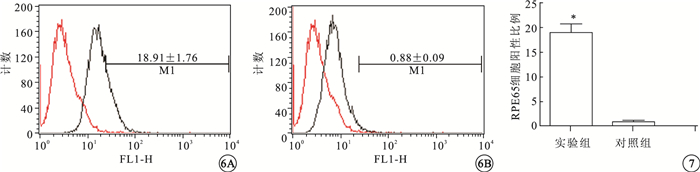 圖6
FCM檢測圖。6A.實驗組細胞RPE65陽性率;6B.對照組細胞RPE65陽性率??圖 7 實驗組、對照組RPE65細胞陽性率比較。*P<0.01
圖6
FCM檢測圖。6A.實驗組細胞RPE65陽性率;6B.對照組細胞RPE65陽性率??圖 7 實驗組、對照組RPE65細胞陽性率比較。*P<0.01
ERG檢查結果顯示,對照組、治療組大鼠暗適應3.0 a-b波振幅分別為(47.3±4.349)、(139.2±11.38)μV。兩組大鼠暗適應3.0 a-b波振幅比較,差異有統計學意義(t=7.543,P=0.000)。
3 討論
RPE細胞功能障礙和細胞丟失是視網膜色素變性等變性疾病致盲的主要原因,RPE移植是目前最具發展前景的治療策略之一[10]。本研究在經典的撤除bFGF自主分化獲得hESC-RPE的基礎上建立無飼養層細胞、無血清成分、以小分子必須氨基酸為誘導劑的高效誘導體系,避免了異種動物成分污染,降低誘導成本,為優化hESC-RPE分化體系提供新的思路。
實驗結果顯示,誘導分化第7周,實驗組出現大量肉眼可見的明顯色素團塊,對照組僅有少量色素團塊出現。隨誘導時間延長,色素團塊逐漸擴大,光學顯微鏡下可見多邊形呈蜂窩狀緊密排列的細胞,胞質充滿色素顆粒;實驗組RPE特異性分子標記Pax6、MITF、RPE65、tyrosinase基因相對表達量明顯高于對照組,Pax6、MITF、RPE65蛋白表達量明顯高于對照組,與基因表達趨勢基本一致[6]。流式細胞檢測結果顯示實驗組RPE65陽性細胞比例明顯高于對照組,與RT-PCR、Western blot及形態學結果一致,RPE65屬于RPE分化晚期特異性蛋白,該結果說明苯丙氨酸處理顯著提高hESC向RPE定向誘導效率[11]。ERG檢查結果表明苯丙氨酸誘導的胚胎干細胞來源RPE可提高碘酸鈉誘導的SD大鼠的視功能,說明苯丙氨酸處理得到的hESC-RPE具備RPE生理功能。
苯丙氨酸是一種必需氨基酸,在肝臟中經苯丙氨酸羥化酶催化形成酪氨酸,誘導酪氨酸酶高表達[12-14],酪氨酸酶含量及活性是調控黑素細胞合成黑色素的關鍵因素[5, 15]。本研究在誘導分化第3周向實驗組誘導體系中添加0.2 mmol/L左旋苯丙氨酸,誘導分化第7周肉眼觀察實驗組細胞色素團塊明顯多于對照組,RT-PCR檢測結果也顯示實驗組tyrosinase mRNA相對表達量亦明顯高于對照組,與S?ominski和Costantino[14]、Schwahn等[15]結論一致。
本研究結果顯示,誘導分化第7周實驗組Wnt3a、Wnt/β-鏈蛋白(β-catenin)下游基因Lef1、Tcf7和RPE標志Pax6、MITF表達量明顯高于對照組。在視網膜發育過程中,視泡與外胚層表面接觸后內陷形成雙層視杯,視杯內層分化為神經視網膜,外層分化為RPE,Wnt/β-catenin信號通路在視杯和RPE形成階段高度活躍,協同BMP和ACTIVIN上調MITF的表達[16, 17],β-catenin通過激活Tcf/Lef轉錄因子直接提高Pax6、MITF基因轉錄促進RPE細胞發育,而β-catenin基因缺失將導致RPE向神經視網膜轉分化[18],異位激活Wnt/β-catenin則抑制RPE形成[19],說明Wnt/β-catenin通路的調節作用在RPE發育中是必不可少的。此外,Wnt/β-catenin可抑制S期細胞,使細胞進入G1期,從而抑制細胞增生、促進細胞分化[20],Wnt3a通過正向調節MITF、tyrosinase、TRP1及其下游基因表達促進細胞合成黑色素[21]。
本研究結果在基因水平上與Wnt/β-catenin通路在RPE分化中的調節作用相符,提示苯丙氨酸促進胚胎干細胞向RPE定向高效分化的機制可能與Wnt3a激活有關,具體分子機制需要進一步研究。
視網膜色素上皮(RPE)細胞的丟失和功能障礙是導致老年性黃斑變性(AMD)、視網膜色素變性(RP)等視網膜變性性疾病的主要原因。目前尚無有效治療方法,人胚胎干細胞(hESC)來源的RPE(hESC-RPE)移植被認為是可能的治療方案[1]。目前獲得hESC-RPE的主要方法有撤除堿性成纖維細胞因子(bFGF)自主分化、早期應用Wnt和Nodal抑制劑誘導分化、轉化生長因子-β抑制劑誘導分化等[2-4],但均存在分化效率低、成本高、誘導藥物的安全性不確定等問題。苯丙氨酸(phenylalanine)可誘導酪氨酸酶高表達,調控色素細胞增生、分化與色素合成[5]。為此,我們在誘導分化培養中加入苯丙氨酸,通過檢測早期RPE標志人類配對盒基因6(Pax6)、小眼球相關轉錄因子(MITF)和成熟RPE標志RPE65、酪氨酸酶(tyrosinase)[6]的表達情況,觀察其對RPE誘導效率的影響;誘導純化的RPE細胞移植到視網膜變性模型大鼠視網膜下腔,同時對其治療效果進行了觀察;現將結果報道如下。
1 材料和方法
人ESC(hESC)H1[7, 8](美國WiCell研究所)接種于Matrigel基質膠(美國BD公司)包被的6孔板內,人類ESC維持培養液(加拿大Stem Cell公司)培養3~4 d,每天換液,至90%的細胞克隆過度融合,更換為不含bFGF的基礎誘導體系培養2周。將細胞分為對照組和實驗組。對照組繼續以基礎誘導體系培養至第7周;實驗組持續添加0.2 mmol/L左旋苯丙氨酸(北京索萊寶科技有限公司)培養至第7周。基礎誘導體系成分:Knockout-Dulbecco改良的Eagle培養基(DMEM,美國Gibco公司),10% knockout血清替代物(KSR,美國Gibco公司),1%谷氨酰胺(美國Gibco公司),1%青鏈霉素(美國Gibco公司)。人RPE(hRPE)取自眼球摘除的患者視網膜組織。
實時熒光定量聚合酶鏈反應(RT-PCR)檢測MITF、Pax6、RPE65、tyrosinase、Wnt配體(Wnt3a)、淋巴樣增強因子-1(Lef1)、轉錄因子7(Tcf7)mRNA的表達。PCR引物由上海英駿生物技術有限公司合成(表 1)。細胞誘導分化第7周以Trizol(美國Invitrogen公司)分別提取對照組和實驗組細胞總RNA,微量分光光度計(美國Nanodrop公司)測定RNA濃度和純度,按逆轉錄試劑盒(美國Thermo公司)說明合成cDNA,逆轉錄反應體系為65℃,5min;42℃,1 h;70℃,15 min。RT-PCR以甘油醛-3-磷酸脫氫酶(GAPDH)表達量為內參。實驗重復3次,采用2-ΔΔCt法分析。
蛋白免疫印跡法(Western blot)檢測MITF、RPE65蛋白表達。細胞誘導分化第7周使用含有蛋白酶抑制劑(美國Roche公司)的細胞組織快速裂解液(北京索萊寶科技有限公司)分別提取正常組、實驗組細胞和hRPE組織總蛋白,二辛可酸蛋白定量試劑盒(天津寶瑞生物技術有限公司)測定蛋白質濃度,取70μg樣品進行十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳,濕轉法轉膜90 min,5%脫脂奶粉封閉2h,分別加入一抗:小鼠抗人MITF單克隆抗體(英國Abcam公司,1 :1000),小鼠抗hRPE65單克隆抗體(英國Abcam公司,1 :1000),小鼠抗人β-肌動蛋白(actin)單克隆抗體(北京中杉金橋生物技術有限公司,1 :1000)4℃孵育過夜,洗膜后加入辣根過氧化物酶標記的山羊抗小鼠二抗(北京中杉金橋生物技術有限公司,1 :1000)室溫孵育2 h,洗膜后電化學發光法顯影,暗室曝光。以β-actin作為內參。
流式細胞技術(FCM)檢測RPE65陽性細胞比例。細胞誘導分化第7周去除培養基,1倍不含鈣、鎂的磷酸鹽緩沖液(DPBS,美國Gibco公司)沖洗細胞,0.25%胰酶-乙二胺四乙酸(EDTA,美國Gibco公司)37℃孵育20 min, 吹打成單細胞,加入10% KSR基礎誘導培養基中和反應,離心半徑9.5 cm,1500 r/min離心5 min,棄上清液,1倍DPBS,離心半徑9.5 cm,1500 r/min離心5 min,洗滌細胞,棄上清液。4%多聚甲醛,37℃固定10 min,離心洗滌細胞,計數后分別將對照組、實驗組細胞分為0.5-1×106個/管,逐滴加入-20℃90%甲醇(1ml/管),冰上操作,4℃透化10 min,離心洗滌細胞,棄上清液,加入100μl 1%牛血清白蛋白(BSA)稀釋的小鼠抗hRPE65單克隆抗體(英國Abcam公司,1 :100),4℃孵育1 h。離心洗滌3次,加入100μl 1%BSA稀釋的異硫氰酸熒光素標記的山羊抗小鼠二抗(北京中杉金橋生物技術有限公司,1 :100),室溫避光孵育30 min,陰性對照組只加二抗。離心洗滌3次,1 ml 1%BSA重懸。
hESC-RPE細胞純化及體內功能實驗。誘導分化第7周用無菌注射器挑取實驗組色素團塊,1~2 mm/塊,接種于Matrigel包被的12孔板,6~8塊/孔,繼續用0.2 mmol/L左旋苯丙氨酸誘導體系培養,每3天刮除未色素化非六邊形的雜細胞,刮除雜細胞后換液,直至色素化細胞長滿孔板,4周后傳代。去除純化RPE的培養基,1倍DPBS沖洗后,0.25%胰酶-EDTA37℃孵育20 min消化成單細胞,10%KSR分化培養基終止反應,離心洗滌細胞,計數后分為1×106個/管,以12μl DPBS重懸。Sprague Dawley(SD)大鼠12只,雄性,鼠齡28 d[9],隨機分為對照組和治療組。將碘酸鈉溶于生理鹽水配置成10%碘酸鈉溶液,經鼠尾靜脈注射,劑量為20 mg/kg,建模后3 d,行單眼內路法視網膜下腔注射。對照組每只眼注射2μl 1倍DPBS,治療組每只眼注射2μl純化的hESC-RPE。治療后6周行視網膜電圖(ERG)檢查,觀察大鼠暗適應3.0 a-b波振幅。
應用SPSS 21.0統計軟件行統計學分析處理。所有數據以均數±標準差(
2 結果
誘導分化第7周,實驗組肉眼可見大量明顯色素團塊(圖 1A),對照組出現少量肉眼可見的色素團塊(圖 1B)。實驗組色素區域內細胞呈多角形蜂窩狀(圖 2A),胞質內有明顯的色素顆粒(圖 2B)。
 圖1
誘導分化第7周孔板外觀像。1A.實驗組,可見多個色素團塊;1B.對照組,出現少量色素團塊
圖1
誘導分化第7周孔板外觀像。1A.實驗組,可見多個色素團塊;1B.對照組,出現少量色素團塊
 圖2
實驗組hESC-RPE細胞光學顯微鏡像。2A.色素團塊內部多邊形黑素細胞標尺:50μm;2B.多邊形黑素細胞呈蜂窩狀緊密排列,胞質內充滿色素顆粒標尺:20μm
圖2
實驗組hESC-RPE細胞光學顯微鏡像。2A.色素團塊內部多邊形黑素細胞標尺:50μm;2B.多邊形黑素細胞呈蜂窩狀緊密排列,胞質內充滿色素顆粒標尺:20μm
RT-PCR檢測結果顯示,實驗組Pax6、MITF、RPE65、tyrosinase mRNA(圖 3)表達量高于對照組,差異有統計學意義(t=39.442、26.141、31.280、77.239,P=0.000)。實驗組Wnt3a、Lef1、Tcf7 mRNA表達量明顯高于對照組,差異有統計學意義(t=46.113、27.686、17.424,P=0.000)(圖 4)。
 圖3
對照組、實驗組Pax6、MITF、tyrosinase、RPE65 mRNA相對表達量。* P<0.01
圖3
對照組、實驗組Pax6、MITF、tyrosinase、RPE65 mRNA相對表達量。* P<0.01
 圖4
對照組、實驗組Lef1、Tcf7、Wnt3a mRNA相對表達量統計圖。實驗組Lef1、Tcf7、Wnt3a mRNA表達量明顯高于對照組。* P<0.01
圖4
對照組、實驗組Lef1、Tcf7、Wnt3a mRNA相對表達量統計圖。實驗組Lef1、Tcf7、Wnt3a mRNA表達量明顯高于對照組。* P<0.01
Western blot檢測結果顯示,實驗組細胞MITF、Pax6和RPE65蛋白表達量均高于對照組(圖 5)。
 圖5
Western blot檢測圖。對照組、實驗組、hRPE組織中MITF、Pax6和RPE65蛋白表達
圖5
Western blot檢測圖。對照組、實驗組、hRPE組織中MITF、Pax6和RPE65蛋白表達
FCM檢測結果顯示,實驗組(圖 6A)、對照組(圖 6B)細胞RPE65陽性細胞比例分別為(18.91±1.76)%、(0.88±0.09)%。實驗組陽性細胞比例明顯高于對照組,差異有統計學意義(t=10.27,P=0.0005)(圖 7)。
 圖6
FCM檢測圖。6A.實驗組細胞RPE65陽性率;6B.對照組細胞RPE65陽性率??圖 7 實驗組、對照組RPE65細胞陽性率比較。*P<0.01
圖6
FCM檢測圖。6A.實驗組細胞RPE65陽性率;6B.對照組細胞RPE65陽性率??圖 7 實驗組、對照組RPE65細胞陽性率比較。*P<0.01
ERG檢查結果顯示,對照組、治療組大鼠暗適應3.0 a-b波振幅分別為(47.3±4.349)、(139.2±11.38)μV。兩組大鼠暗適應3.0 a-b波振幅比較,差異有統計學意義(t=7.543,P=0.000)。
3 討論
RPE細胞功能障礙和細胞丟失是視網膜色素變性等變性疾病致盲的主要原因,RPE移植是目前最具發展前景的治療策略之一[10]。本研究在經典的撤除bFGF自主分化獲得hESC-RPE的基礎上建立無飼養層細胞、無血清成分、以小分子必須氨基酸為誘導劑的高效誘導體系,避免了異種動物成分污染,降低誘導成本,為優化hESC-RPE分化體系提供新的思路。
實驗結果顯示,誘導分化第7周,實驗組出現大量肉眼可見的明顯色素團塊,對照組僅有少量色素團塊出現。隨誘導時間延長,色素團塊逐漸擴大,光學顯微鏡下可見多邊形呈蜂窩狀緊密排列的細胞,胞質充滿色素顆粒;實驗組RPE特異性分子標記Pax6、MITF、RPE65、tyrosinase基因相對表達量明顯高于對照組,Pax6、MITF、RPE65蛋白表達量明顯高于對照組,與基因表達趨勢基本一致[6]。流式細胞檢測結果顯示實驗組RPE65陽性細胞比例明顯高于對照組,與RT-PCR、Western blot及形態學結果一致,RPE65屬于RPE分化晚期特異性蛋白,該結果說明苯丙氨酸處理顯著提高hESC向RPE定向誘導效率[11]。ERG檢查結果表明苯丙氨酸誘導的胚胎干細胞來源RPE可提高碘酸鈉誘導的SD大鼠的視功能,說明苯丙氨酸處理得到的hESC-RPE具備RPE生理功能。
苯丙氨酸是一種必需氨基酸,在肝臟中經苯丙氨酸羥化酶催化形成酪氨酸,誘導酪氨酸酶高表達[12-14],酪氨酸酶含量及活性是調控黑素細胞合成黑色素的關鍵因素[5, 15]。本研究在誘導分化第3周向實驗組誘導體系中添加0.2 mmol/L左旋苯丙氨酸,誘導分化第7周肉眼觀察實驗組細胞色素團塊明顯多于對照組,RT-PCR檢測結果也顯示實驗組tyrosinase mRNA相對表達量亦明顯高于對照組,與S?ominski和Costantino[14]、Schwahn等[15]結論一致。
本研究結果顯示,誘導分化第7周實驗組Wnt3a、Wnt/β-鏈蛋白(β-catenin)下游基因Lef1、Tcf7和RPE標志Pax6、MITF表達量明顯高于對照組。在視網膜發育過程中,視泡與外胚層表面接觸后內陷形成雙層視杯,視杯內層分化為神經視網膜,外層分化為RPE,Wnt/β-catenin信號通路在視杯和RPE形成階段高度活躍,協同BMP和ACTIVIN上調MITF的表達[16, 17],β-catenin通過激活Tcf/Lef轉錄因子直接提高Pax6、MITF基因轉錄促進RPE細胞發育,而β-catenin基因缺失將導致RPE向神經視網膜轉分化[18],異位激活Wnt/β-catenin則抑制RPE形成[19],說明Wnt/β-catenin通路的調節作用在RPE發育中是必不可少的。此外,Wnt/β-catenin可抑制S期細胞,使細胞進入G1期,從而抑制細胞增生、促進細胞分化[20],Wnt3a通過正向調節MITF、tyrosinase、TRP1及其下游基因表達促進細胞合成黑色素[21]。
本研究結果在基因水平上與Wnt/β-catenin通路在RPE分化中的調節作用相符,提示苯丙氨酸促進胚胎干細胞向RPE定向高效分化的機制可能與Wnt3a激活有關,具體分子機制需要進一步研究。