引用本文: 馬海智, 張少沖, 黃雄高, 魏雁濤, 蔣欣桐. 阻斷Rac1對轉化生長因子-β誘導視網膜色素上皮細胞行為改變的作用研究. 中華眼底病雜志, 2015, 31(1): 52-56. doi: 10.3760/cma.j.issn.1005-1015.2015.01.014 復制
上皮細胞間質樣改變是體內眾多纖維化疾病共同的病理過程,在增生性玻璃體視網膜病變(PVR)發生過程中,間質樣轉分化(EMT)也被認為是始動的關鍵環節,而轉化生長因子β(TGF-β)被認為是體內及體外誘導EMT的關鍵細胞因子,由其導致的EMT被稱為tEMT[1]。轉化后的視網膜色素上皮(RPE)細胞具有間質細胞的特性,細胞形態及細胞行為發生變化,從而發生進一步的病理改變,導致視網膜前或下增生形成,從而發生PVR[2]。小G蛋白家族在體內具有調控細胞周期、控制細胞活動力的作用,近年在PVR發生機制的研究中其作用日益受到重視[3]。本研究觀察了TGF-β誘導RPE細胞EMT過程,阻斷小G蛋白家族成員Rac1對于TGF-β所致細胞行為改變的作用。現將結果報道如下。
1 材料和方法
人RPE(ARPE)-19細胞(美國ATCC公司),Dulbecco改良Eagle培養基(DMEM)/F12培養基(美國Hyclone公司),胎牛血清(FBS,杭州四季青生物公司),磷酸鹽緩沖液(PBS,pH7.2;美國Hyclone公司),絲裂霉素C(終濃度10 ng/ml,美國Roche公司),TGF-β1(終濃度10 ng/ml,美國Peprotech公司),NSC23766(終濃度50μmmol/L,美國R&D公司),Matrigel基質膠(美國BD生物技術公司),微量二辛可酸(micro-BCA)蛋白檢測盒(美國Thermo公司),垂直電泳儀(美國Bio-Rad公司),細胞顯微鏡(Axio observer Z1,德國Zeiss公司),Transwell小室、12孔板、24孔板(美國Corning公司)。試劑按照說明書配制。
TGF-β1及NSC23766工作濃度確定。參照文獻行預實驗,TGF-β1取1、10、50、100 ng/ml,觀察細胞形態出現EMT改變而不影響細胞生長。NSC23766取50、100、200μmmol/L,觀察阻斷TGF-β1對細胞形態的改變同時不影響細胞生長。最終確定10 ng/ml及50μmmol/L的工作濃度。
細胞培養及處理。6孔板以含10%FBS的DMEM/F12培養基,37℃,5%CO2培養箱中體外傳代培養,每周換液2~3次,至細胞80%鋪滿后行細胞傳代并行相關實驗。所有實驗于加入TGF-β1前2 h給予NSC23766以封閉Rac1受體。免疫熒光檢測細胞中α-平滑肌肌動蛋白(α-SMA)。ARPE-19細胞分為空白組、TGF-β1組及TGF-β1+NSC23766組。細胞以密度3×103個/ml接種于蓋玻片上,蓋玻片置于6孔板中,37℃,5%CO2培養箱中培養過夜。預冷PBS清洗3次,冰上4%多聚甲醛固定20 min,PBS洗3次,10 min/次,搖床上以含0.2% Triton X-100的PBS處理15 min。室溫下PBS清洗3次,置于含1%牛血清白蛋白/PBS濕盒內室溫封閉1 h,一抗4℃孵育過夜。PBS洗3次,10min/次,室溫下避光加入熒光二抗1 h,PBS清洗10 min,3次,抗熒光淬滅劑封片,熒光顯微鏡下檢測細胞α-SMA表達。
蛋白免疫印跡法(Western blot)檢測α-SMA。細胞分組同上。ARPE-19細胞加入刺激物24 h收集細胞,每孔置冰上加入100μl細胞裂解液(RIPA,含10%苯甲基磺酰氟及10%磷酸酶抑制劑)30 min后刮下細胞,收集并于4℃下14 000×g離心20 min,吸取上清液,抽取15μl行micro-BCA法檢測總蛋白量,其余以1∶4加入5倍上樣緩沖液,混勻后于沸水下煮沸5 min。行十二烷基硫酸鈉-聚丙烯酰胺凝膠,轉膜,按最低濃度加入一抗,4℃過夜。洗膜緩沖液(TBST)清洗3次,最低濃度加入二抗,室溫下1 h, TBST清洗3次后,辣根過氧化物酶催化發光檢測。Image J圖像分析軟件測量條帶灰度并行統計學分析。
細胞劃痕實驗。ARPE-19細胞分為空白組、TGF-β1組、TGF-β1+NSC23766組及NSC23766組,傳代培養于12孔板培養至鋪滿,絲裂霉素C處理細胞2 h,抑制細胞增生。20G針頭行細胞劃痕,PBS輕輕沖洗2~3次使劃痕邊緣粘附的細胞脫落。加入無血清培養基及NSC23766,2 h后加入TGF-β1,置于37℃,5%CO2培養箱中培養。每天更換培養液。在0(初始時間)、24、48 h分別記錄劃痕間距,德國Zeiss細胞顯微鏡測量劃痕間距。
細胞侵襲實驗。按照說明書配制Matrigel基質膠并鋪板于Transwell小室上室。無血清培養基5×104個/孔種板于基質膠表面,Transwell小室下室加入0.5 ml無血清培養基,37℃,5%CO2孵育3 h細胞貼壁后去除下室的無血清培養液,實驗分組及加入NSC23766及TGF-β1時間點同細胞劃痕實驗。孵育20 h后取出Transwell小室,甲醇固定30 min, 去除上室Matrigel基質膠和其下聚碳酯膜上表面的細胞,行蘇木精-伊紅(HE)染色后切下聚碳酯膜,以下表面向上置于載玻片上,中性樹脂封片,光學正置顯微鏡下拍照,并計數9個高倍視野下細胞個數。
凝膠收縮實驗。參照Hirayama等[4]的方法,凝膠終濃度1.8 mg/ml,細胞密度2.5×106個/ml鋪板于24孔板孵育30 min促進其凝固。實驗分組及加入NSC23766及TGF-β1時間點同細胞劃痕實驗。于24 h以鈍性針頭將凝膠分離懸浮于培養液中,每24小時更換培養液并觀察拍照凝膠團塊,Image-pro plus 6.0圖像軟件測量團塊面積。
應用SPSS 17.0統計軟件行統計學分析處理。所有實驗均行3次獨立實驗,每組樣品量3個,數據收集后行單因素方差分析,配對t檢驗檢測差異顯著性。P<0.05為差異有統計學意義。
2 結果
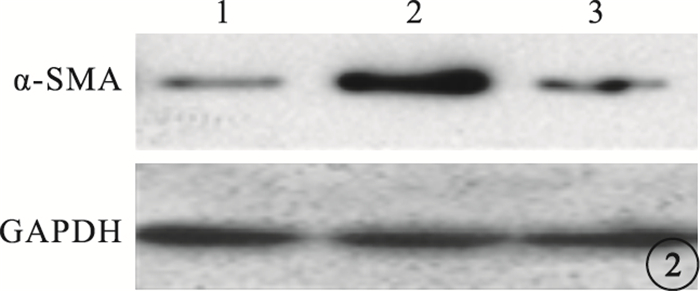
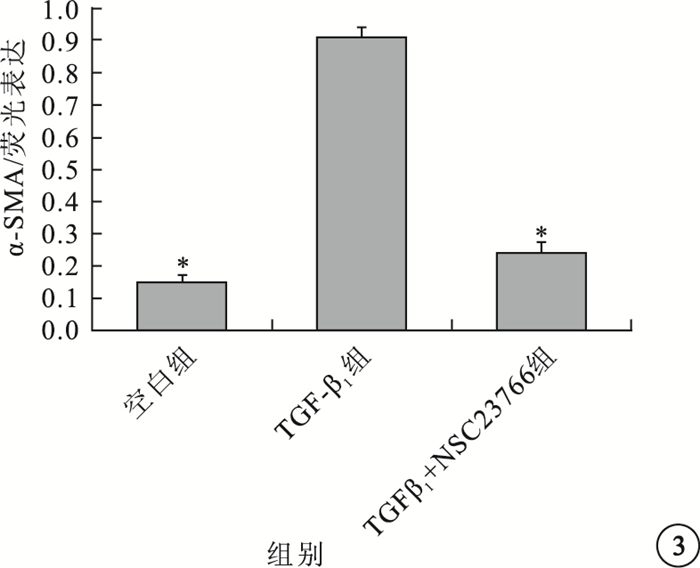
與空白組細胞中α-SMA熒光表達比較,TGF-β1組α-SMA熒光表達明顯增強(圖 1);TGF-β1+NSC23766組熒光表達降低(圖 2)。TGF-β1組細胞中α-SMA熒光表達與空白組、TGF-β1+NSC23766組細胞中α-SMA熒光表達比較,差異有統計學意義(F=825.314,P=0.003)(圖 3)。
 圖1
ARPE-19細胞倒置像差熒光顯微鏡像。1A~1C.分別為空白組、TGF-β1組、TGF-β1+NSC23766組。α-SMA(綠色)在細胞核周圍細胞漿內表達,TGF-β1組較其他兩組綠色熒光表達增強×100
圖1
ARPE-19細胞倒置像差熒光顯微鏡像。1A~1C.分別為空白組、TGF-β1組、TGF-β1+NSC23766組。α-SMA(綠色)在細胞核周圍細胞漿內表達,TGF-β1組較其他兩組綠色熒光表達增強×100
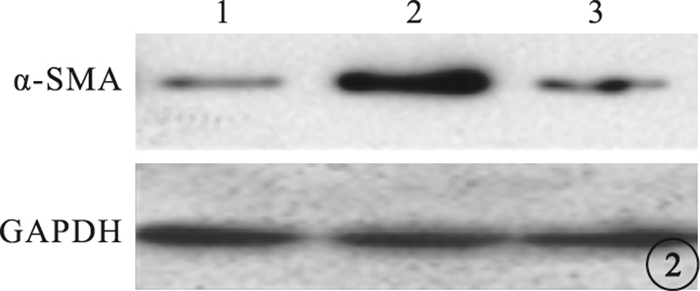 圖2
Western blot檢測圖。1~3.分別為空白組、TGF-β1組、TGF-β1+NSC23766組。TGF-β1+NSC23766組熒光表達降低
圖2
Western blot檢測圖。1~3.分別為空白組、TGF-β1組、TGF-β1+NSC23766組。TGF-β1+NSC23766組熒光表達降低
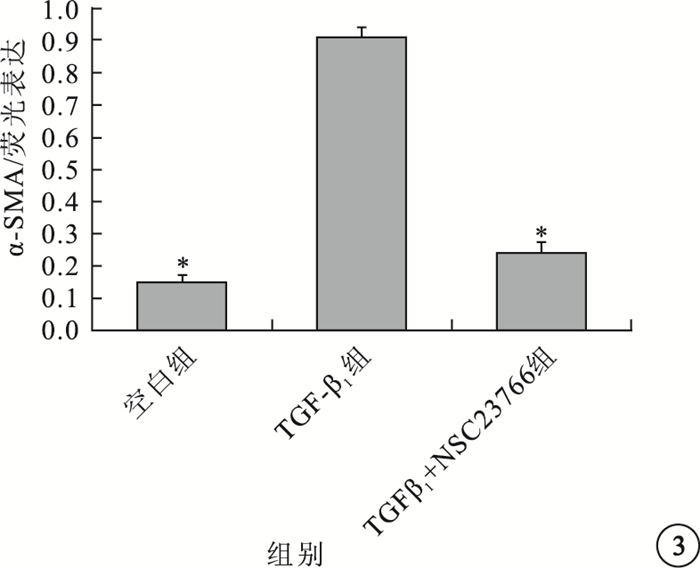 圖3
空白組、TGF-β1組、TGF-β1+NSC23766組細胞中α-SMA表達量比較。*P<0.05
圖3
空白組、TGF-β1組、TGF-β1+NSC23766組細胞中α-SMA表達量比較。*P<0.05
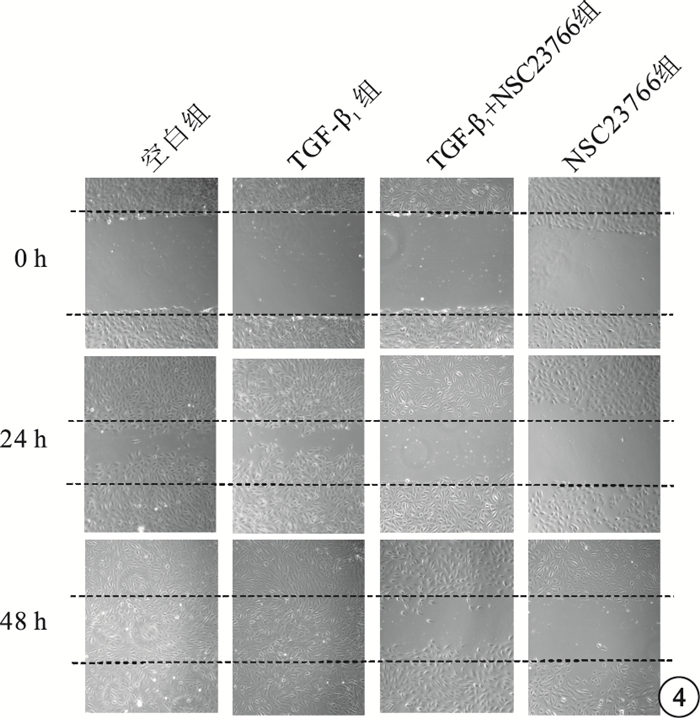
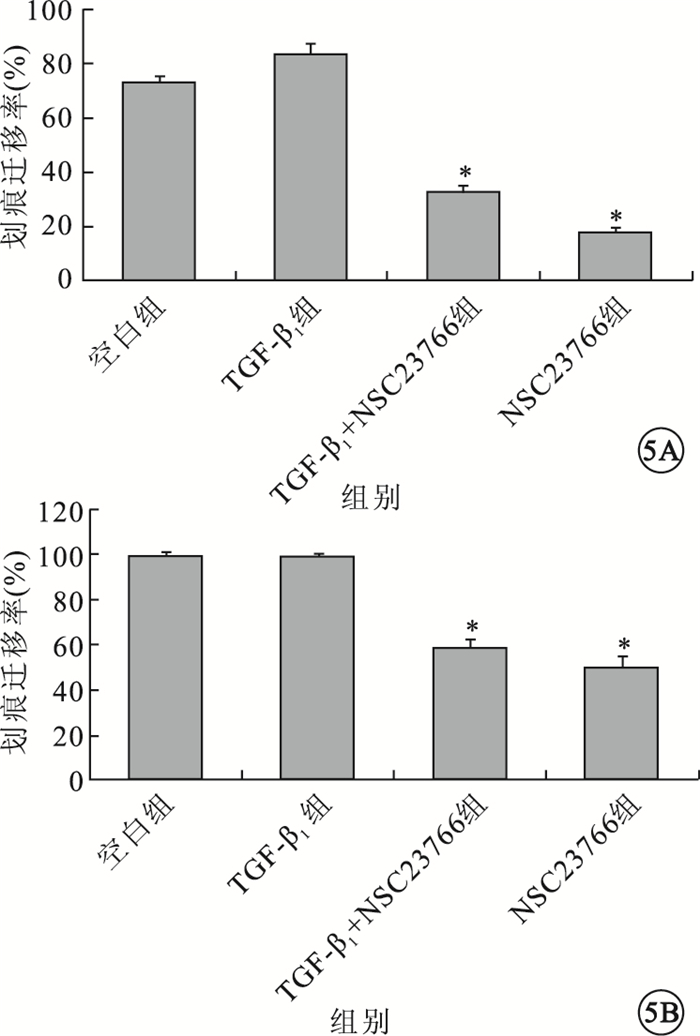
細胞劃痕實驗,初始時間各組細胞劃痕間距大致相等。24 h,TGF-β1組細胞間距稍小于空白組、TGF-β1+NSC23766組、NSC23766組。48 h,TGF-β1組、空白組所有觀測點劃痕均已融合;TGF-β1+NSC23766組、NSC23766組尚未融合(圖 4)。24 h,4組間細胞間距比較,差異有統計學意義(F=177.351,P=0.000);組間兩兩比較,TGF-β1組與空白組差異無統計學意義(P=0.278);與TGF-β1+NSC23766組、NSC23766組差異有統計學意義(P=0.014、0.001)(圖 5A)。48h,4組間細胞間距比較,差異有統計學意義(F=102.167,P=0.000);組間兩兩比較,TGF-β1組與空白組差異無統計學意義(P=1.000);與TGF-β1+NSC23766組、NSC23766組差異有統計學意義(P=0.000、0.000)(圖 5B)。
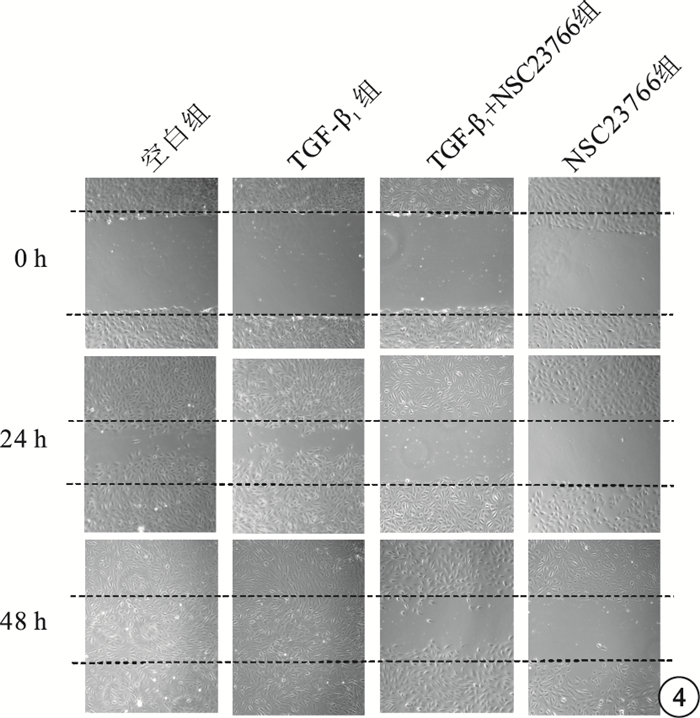 圖4
各組細胞顯微鏡像。不同時間各組細胞劃痕實驗結果。圖中上下黑色虛線代表該時間點間距最遠組劃痕兩個劃痕邊緣
圖4
各組細胞顯微鏡像。不同時間各組細胞劃痕實驗結果。圖中上下黑色虛線代表該時間點間距最遠組劃痕兩個劃痕邊緣
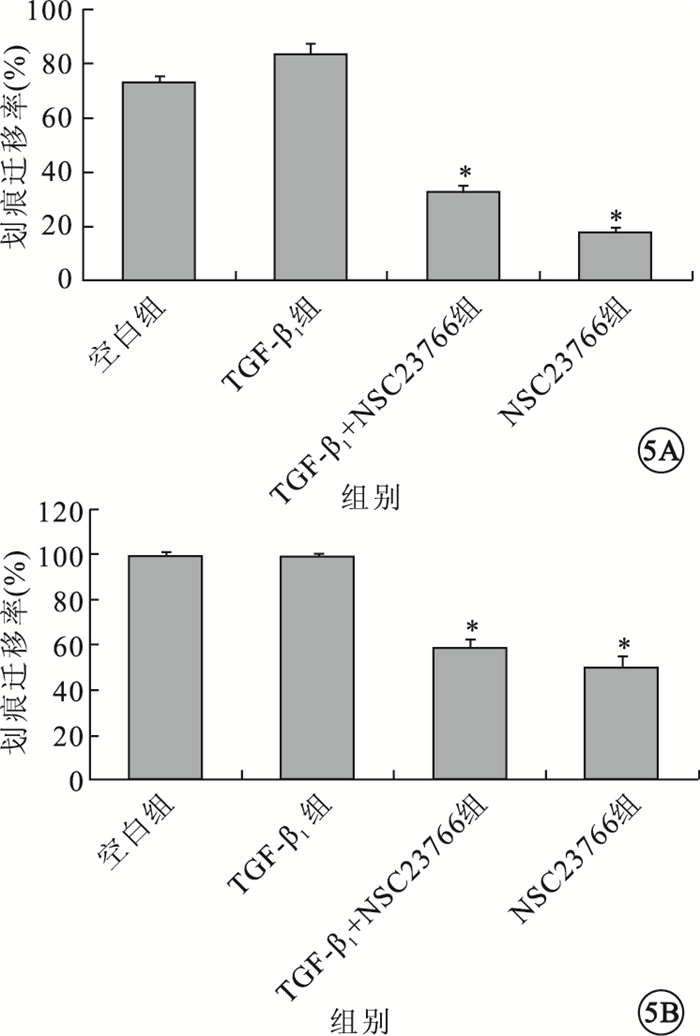 圖5
各組細胞遷移率比較。5A.24 h;5B.48 h。*P<0.05
圖5
各組細胞遷移率比較。5A.24 h;5B.48 h。*P<0.05
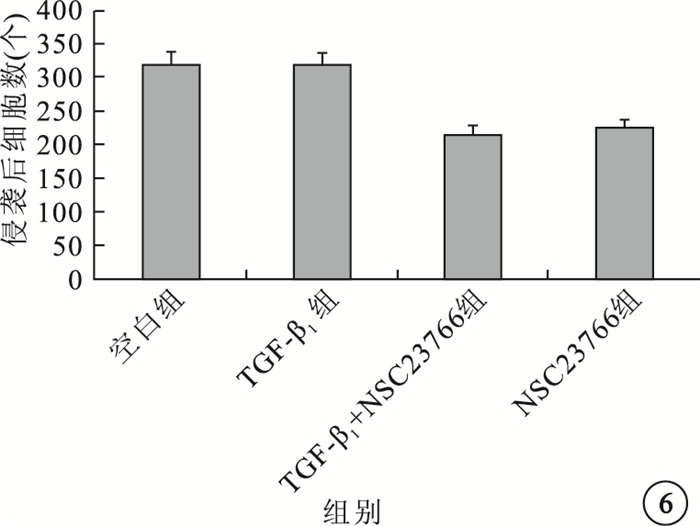
細胞侵襲實驗結果顯示,細胞孵育20h后,TGF-β1組穿過基底膜的細胞數與空白組、TGF-β1+NSC23766組、NSC23766組穿過基底膜的細胞數接近,差異無統計學意義(F=0.371,P=0.055)(圖 6)。
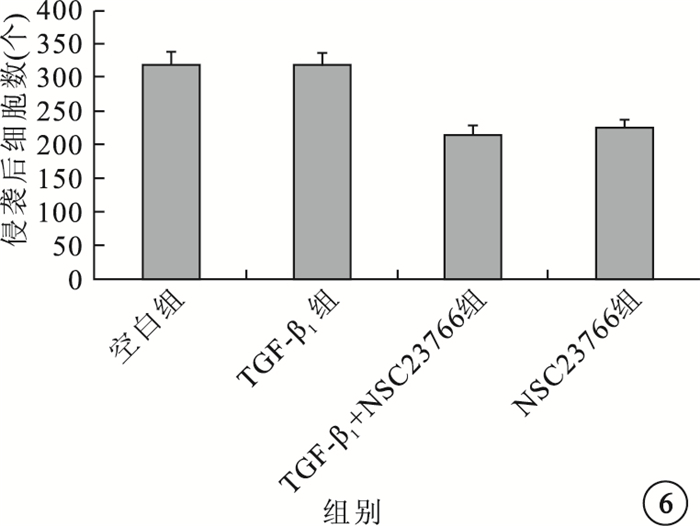 圖6
各組穿過基底膜細胞膜的細胞數比較
圖6
各組穿過基底膜細胞膜的細胞數比較
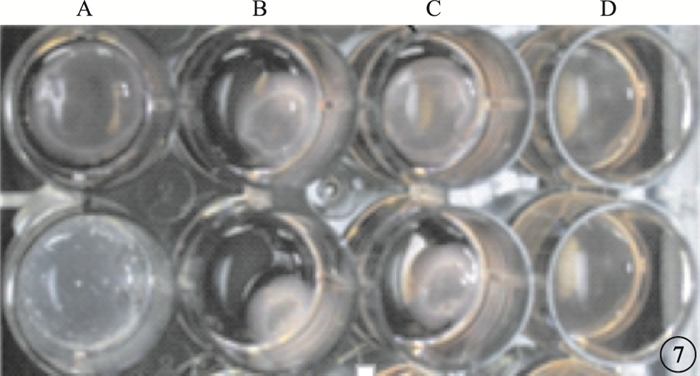
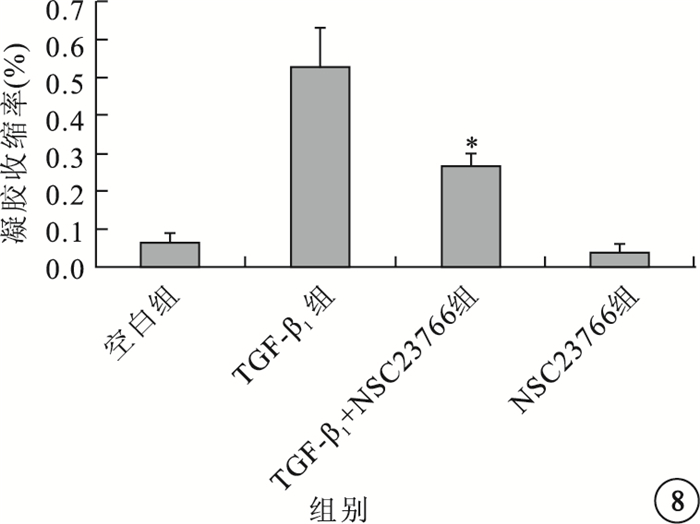
凝膠收縮實驗結果顯示,TGF-β1組能明顯增加ARPE-19細胞的促凝膠收縮能力;TGF-β1+NSC23766組能抑制TGF-β1誘導的ARPE-19細胞的促凝膠收縮;空白組、NSC23766組均未見明顯凝膠收縮(圖 7)。4組間促凝膠收縮能力比較,差異有統計學意義(F=40.473, P=0.000);組間促凝膠收縮能力兩兩比較,TGF-β1組與TGF-β1+NSC23766組差異有統計學意義(P=0.022)(圖 8)。
 圖7
凝膠收縮圖。每孔中白色團塊為收縮后凝膠塊。A~D:分別為空白組、TGF-β1組、TGF-β1+NSC23766組、NSC23766組
圖7
凝膠收縮圖。每孔中白色團塊為收縮后凝膠塊。A~D:分別為空白組、TGF-β1組、TGF-β1+NSC23766組、NSC23766組
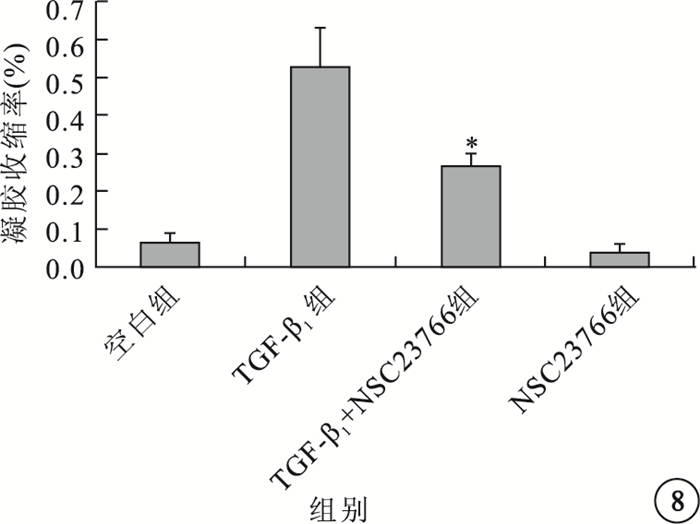 圖8
4組凝膠收縮效率比較。*P<0.05
圖8
4組凝膠收縮效率比較。*P<0.05
3 討論
鑒于TGF-β,EMT與PVR發生之間的相互關系[5-7],本研究選取TGF-β通路作為防治PVR的研究對象。但是TGF-β本身是一個多效應的分子,對其單純拮抗或封閉可能會導致除了抗EMT作用之外其他問題的出現。因此,本研究設計針對其下游可能的細胞通道進行阻斷,達到比較理想的抗PVR效果并同時減少副作用的發生。Rac1做為TGF-β的下游通道之一,在體內主要參與細胞代謝、細胞凋亡及細胞運動的調控[8]。實驗涉及的PVR細胞行為研究最常用的劃痕、侵襲及凝膠收縮實驗,技術較為成熟且可重復性強。本研究應用Rac1特異性抑制劑NSC 23766,作用機制為通過競爭Rac表面的鳥嘌呤核苷酸交換因子位點,靶向抑制Rac,但同時不抑制小G蛋白家族中另外兩個重要成員Cdc42和RhoA。其抑制效率較高,Gao等[9]、Cancelas等[10]研究結果發現,NSC 23766可替代Rac1基因突變體的作用。因此,特異性強,實驗結果可靠。
α-SMA表達是EMT的重要標志,TGF-β能有效刺激上皮細胞表達α-SMA[11],而用單純玻璃體刺激并不能引起α-SMA表達增加[12],提示TGF-β可能是視網膜脫離時RPE發生EMT初始的刺激因素。Connor等[13]研究證實,TGF-β前體的活化需要包括玻璃體在內的眾多刺激因素參與。當視網膜脫離時,眼內存留的無活性的TGF-β前體被激活,隨液化的玻璃體共同到達視網膜下參與構成視網膜下液,并接觸到RPE細胞并促進其發生EMT[2]。
細胞遷徙與細胞侵襲能力是轉分化的上皮細胞是否具有脫離原位并異位至其它部位的基礎。在PVR發生過程中,這種能力是誘導變性后的RPE細胞異位至視網膜內外表面的原因。對于TGF-β是否直接導致細胞的遷徙和侵襲能力增強,有較大爭議。此結果與即往部分實驗結果不同[14],但Parapuram等[15]、黃雄高等[12]、Kirchhof等[16]的研究結果都顯示TGF-β本身并不能直接刺激細胞的遷徙和侵襲能力,而玻璃體卻能提高這兩項細胞行為,但玻璃體的作用卻是TGF-β依賴性,本身不會引起α-SMA表達增加。本研究結果發現,雖然在多個時間位點,TGF-β1組較之空白組細胞遷移及侵襲能力稍微提高,但結果并無統計學差異。因此在PVR發展的進程中,TGF-β啟動RPE細胞發生EMT(α-SMA),協同玻璃體共同促進RPE異位,TGF-β還能促進轉化后細胞在異位增生并產生細胞外基質,促進纖維膜發生收縮(凝膠收縮)。因此,抗TGF-β效應可能對于防治PVR作用顯著。
我們通過實驗中加入Rac1的抑制劑后觀察到,NSC23766能有效下調TGF-β1所致的α-SMA的表達,抑制含有RPE細胞的凝膠收縮,說明Rac1在發生tEMT的過程中發揮重要作用。它能阻止RPE發生間質樣改變,并且減少因增生膜收縮引起的視網膜牽拉。比較有趣的是,無論有無TGF-β1,NSC23766都能有效抑制細胞的遷移能力。同時,玻璃體所致的RPE細胞的遷移及侵襲能力也能被NSC23766抑制[17]。因此,我們推測Rac1對于抑制細胞運動的作用可能是通過其他細胞通道發揮作用,這一點有待今后的研究證實。
Rac1雖然作為tEMT的一個重要通道,但單通道并不能完全揭示EMT這一復雜的病理過程,今后實驗需要進一步研究其與其他tEMT相關通道的關系,從而進一步揭示PVR的發生機制。
上皮細胞間質樣改變是體內眾多纖維化疾病共同的病理過程,在增生性玻璃體視網膜病變(PVR)發生過程中,間質樣轉分化(EMT)也被認為是始動的關鍵環節,而轉化生長因子β(TGF-β)被認為是體內及體外誘導EMT的關鍵細胞因子,由其導致的EMT被稱為tEMT[1]。轉化后的視網膜色素上皮(RPE)細胞具有間質細胞的特性,細胞形態及細胞行為發生變化,從而發生進一步的病理改變,導致視網膜前或下增生形成,從而發生PVR[2]。小G蛋白家族在體內具有調控細胞周期、控制細胞活動力的作用,近年在PVR發生機制的研究中其作用日益受到重視[3]。本研究觀察了TGF-β誘導RPE細胞EMT過程,阻斷小G蛋白家族成員Rac1對于TGF-β所致細胞行為改變的作用。現將結果報道如下。
1 材料和方法
人RPE(ARPE)-19細胞(美國ATCC公司),Dulbecco改良Eagle培養基(DMEM)/F12培養基(美國Hyclone公司),胎牛血清(FBS,杭州四季青生物公司),磷酸鹽緩沖液(PBS,pH7.2;美國Hyclone公司),絲裂霉素C(終濃度10 ng/ml,美國Roche公司),TGF-β1(終濃度10 ng/ml,美國Peprotech公司),NSC23766(終濃度50μmmol/L,美國R&D公司),Matrigel基質膠(美國BD生物技術公司),微量二辛可酸(micro-BCA)蛋白檢測盒(美國Thermo公司),垂直電泳儀(美國Bio-Rad公司),細胞顯微鏡(Axio observer Z1,德國Zeiss公司),Transwell小室、12孔板、24孔板(美國Corning公司)。試劑按照說明書配制。
TGF-β1及NSC23766工作濃度確定。參照文獻行預實驗,TGF-β1取1、10、50、100 ng/ml,觀察細胞形態出現EMT改變而不影響細胞生長。NSC23766取50、100、200μmmol/L,觀察阻斷TGF-β1對細胞形態的改變同時不影響細胞生長。最終確定10 ng/ml及50μmmol/L的工作濃度。
細胞培養及處理。6孔板以含10%FBS的DMEM/F12培養基,37℃,5%CO2培養箱中體外傳代培養,每周換液2~3次,至細胞80%鋪滿后行細胞傳代并行相關實驗。所有實驗于加入TGF-β1前2 h給予NSC23766以封閉Rac1受體。免疫熒光檢測細胞中α-平滑肌肌動蛋白(α-SMA)。ARPE-19細胞分為空白組、TGF-β1組及TGF-β1+NSC23766組。細胞以密度3×103個/ml接種于蓋玻片上,蓋玻片置于6孔板中,37℃,5%CO2培養箱中培養過夜。預冷PBS清洗3次,冰上4%多聚甲醛固定20 min,PBS洗3次,10 min/次,搖床上以含0.2% Triton X-100的PBS處理15 min。室溫下PBS清洗3次,置于含1%牛血清白蛋白/PBS濕盒內室溫封閉1 h,一抗4℃孵育過夜。PBS洗3次,10min/次,室溫下避光加入熒光二抗1 h,PBS清洗10 min,3次,抗熒光淬滅劑封片,熒光顯微鏡下檢測細胞α-SMA表達。
蛋白免疫印跡法(Western blot)檢測α-SMA。細胞分組同上。ARPE-19細胞加入刺激物24 h收集細胞,每孔置冰上加入100μl細胞裂解液(RIPA,含10%苯甲基磺酰氟及10%磷酸酶抑制劑)30 min后刮下細胞,收集并于4℃下14 000×g離心20 min,吸取上清液,抽取15μl行micro-BCA法檢測總蛋白量,其余以1∶4加入5倍上樣緩沖液,混勻后于沸水下煮沸5 min。行十二烷基硫酸鈉-聚丙烯酰胺凝膠,轉膜,按最低濃度加入一抗,4℃過夜。洗膜緩沖液(TBST)清洗3次,最低濃度加入二抗,室溫下1 h, TBST清洗3次后,辣根過氧化物酶催化發光檢測。Image J圖像分析軟件測量條帶灰度并行統計學分析。
細胞劃痕實驗。ARPE-19細胞分為空白組、TGF-β1組、TGF-β1+NSC23766組及NSC23766組,傳代培養于12孔板培養至鋪滿,絲裂霉素C處理細胞2 h,抑制細胞增生。20G針頭行細胞劃痕,PBS輕輕沖洗2~3次使劃痕邊緣粘附的細胞脫落。加入無血清培養基及NSC23766,2 h后加入TGF-β1,置于37℃,5%CO2培養箱中培養。每天更換培養液。在0(初始時間)、24、48 h分別記錄劃痕間距,德國Zeiss細胞顯微鏡測量劃痕間距。
細胞侵襲實驗。按照說明書配制Matrigel基質膠并鋪板于Transwell小室上室。無血清培養基5×104個/孔種板于基質膠表面,Transwell小室下室加入0.5 ml無血清培養基,37℃,5%CO2孵育3 h細胞貼壁后去除下室的無血清培養液,實驗分組及加入NSC23766及TGF-β1時間點同細胞劃痕實驗。孵育20 h后取出Transwell小室,甲醇固定30 min, 去除上室Matrigel基質膠和其下聚碳酯膜上表面的細胞,行蘇木精-伊紅(HE)染色后切下聚碳酯膜,以下表面向上置于載玻片上,中性樹脂封片,光學正置顯微鏡下拍照,并計數9個高倍視野下細胞個數。
凝膠收縮實驗。參照Hirayama等[4]的方法,凝膠終濃度1.8 mg/ml,細胞密度2.5×106個/ml鋪板于24孔板孵育30 min促進其凝固。實驗分組及加入NSC23766及TGF-β1時間點同細胞劃痕實驗。于24 h以鈍性針頭將凝膠分離懸浮于培養液中,每24小時更換培養液并觀察拍照凝膠團塊,Image-pro plus 6.0圖像軟件測量團塊面積。
應用SPSS 17.0統計軟件行統計學分析處理。所有實驗均行3次獨立實驗,每組樣品量3個,數據收集后行單因素方差分析,配對t檢驗檢測差異顯著性。P<0.05為差異有統計學意義。
2 結果
與空白組細胞中α-SMA熒光表達比較,TGF-β1組α-SMA熒光表達明顯增強(圖 1);TGF-β1+NSC23766組熒光表達降低(圖 2)。TGF-β1組細胞中α-SMA熒光表達與空白組、TGF-β1+NSC23766組細胞中α-SMA熒光表達比較,差異有統計學意義(F=825.314,P=0.003)(圖 3)。
 圖1
ARPE-19細胞倒置像差熒光顯微鏡像。1A~1C.分別為空白組、TGF-β1組、TGF-β1+NSC23766組。α-SMA(綠色)在細胞核周圍細胞漿內表達,TGF-β1組較其他兩組綠色熒光表達增強×100
圖1
ARPE-19細胞倒置像差熒光顯微鏡像。1A~1C.分別為空白組、TGF-β1組、TGF-β1+NSC23766組。α-SMA(綠色)在細胞核周圍細胞漿內表達,TGF-β1組較其他兩組綠色熒光表達增強×100
 圖2
Western blot檢測圖。1~3.分別為空白組、TGF-β1組、TGF-β1+NSC23766組。TGF-β1+NSC23766組熒光表達降低
圖2
Western blot檢測圖。1~3.分別為空白組、TGF-β1組、TGF-β1+NSC23766組。TGF-β1+NSC23766組熒光表達降低
 圖3
空白組、TGF-β1組、TGF-β1+NSC23766組細胞中α-SMA表達量比較。*P<0.05
圖3
空白組、TGF-β1組、TGF-β1+NSC23766組細胞中α-SMA表達量比較。*P<0.05
細胞劃痕實驗,初始時間各組細胞劃痕間距大致相等。24 h,TGF-β1組細胞間距稍小于空白組、TGF-β1+NSC23766組、NSC23766組。48 h,TGF-β1組、空白組所有觀測點劃痕均已融合;TGF-β1+NSC23766組、NSC23766組尚未融合(圖 4)。24 h,4組間細胞間距比較,差異有統計學意義(F=177.351,P=0.000);組間兩兩比較,TGF-β1組與空白組差異無統計學意義(P=0.278);與TGF-β1+NSC23766組、NSC23766組差異有統計學意義(P=0.014、0.001)(圖 5A)。48h,4組間細胞間距比較,差異有統計學意義(F=102.167,P=0.000);組間兩兩比較,TGF-β1組與空白組差異無統計學意義(P=1.000);與TGF-β1+NSC23766組、NSC23766組差異有統計學意義(P=0.000、0.000)(圖 5B)。
 圖4
各組細胞顯微鏡像。不同時間各組細胞劃痕實驗結果。圖中上下黑色虛線代表該時間點間距最遠組劃痕兩個劃痕邊緣
圖4
各組細胞顯微鏡像。不同時間各組細胞劃痕實驗結果。圖中上下黑色虛線代表該時間點間距最遠組劃痕兩個劃痕邊緣
 圖5
各組細胞遷移率比較。5A.24 h;5B.48 h。*P<0.05
圖5
各組細胞遷移率比較。5A.24 h;5B.48 h。*P<0.05
細胞侵襲實驗結果顯示,細胞孵育20h后,TGF-β1組穿過基底膜的細胞數與空白組、TGF-β1+NSC23766組、NSC23766組穿過基底膜的細胞數接近,差異無統計學意義(F=0.371,P=0.055)(圖 6)。
 圖6
各組穿過基底膜細胞膜的細胞數比較
圖6
各組穿過基底膜細胞膜的細胞數比較
凝膠收縮實驗結果顯示,TGF-β1組能明顯增加ARPE-19細胞的促凝膠收縮能力;TGF-β1+NSC23766組能抑制TGF-β1誘導的ARPE-19細胞的促凝膠收縮;空白組、NSC23766組均未見明顯凝膠收縮(圖 7)。4組間促凝膠收縮能力比較,差異有統計學意義(F=40.473, P=0.000);組間促凝膠收縮能力兩兩比較,TGF-β1組與TGF-β1+NSC23766組差異有統計學意義(P=0.022)(圖 8)。
 圖7
凝膠收縮圖。每孔中白色團塊為收縮后凝膠塊。A~D:分別為空白組、TGF-β1組、TGF-β1+NSC23766組、NSC23766組
圖7
凝膠收縮圖。每孔中白色團塊為收縮后凝膠塊。A~D:分別為空白組、TGF-β1組、TGF-β1+NSC23766組、NSC23766組
 圖8
4組凝膠收縮效率比較。*P<0.05
圖8
4組凝膠收縮效率比較。*P<0.05
3 討論
鑒于TGF-β,EMT與PVR發生之間的相互關系[5-7],本研究選取TGF-β通路作為防治PVR的研究對象。但是TGF-β本身是一個多效應的分子,對其單純拮抗或封閉可能會導致除了抗EMT作用之外其他問題的出現。因此,本研究設計針對其下游可能的細胞通道進行阻斷,達到比較理想的抗PVR效果并同時減少副作用的發生。Rac1做為TGF-β的下游通道之一,在體內主要參與細胞代謝、細胞凋亡及細胞運動的調控[8]。實驗涉及的PVR細胞行為研究最常用的劃痕、侵襲及凝膠收縮實驗,技術較為成熟且可重復性強。本研究應用Rac1特異性抑制劑NSC 23766,作用機制為通過競爭Rac表面的鳥嘌呤核苷酸交換因子位點,靶向抑制Rac,但同時不抑制小G蛋白家族中另外兩個重要成員Cdc42和RhoA。其抑制效率較高,Gao等[9]、Cancelas等[10]研究結果發現,NSC 23766可替代Rac1基因突變體的作用。因此,特異性強,實驗結果可靠。
α-SMA表達是EMT的重要標志,TGF-β能有效刺激上皮細胞表達α-SMA[11],而用單純玻璃體刺激并不能引起α-SMA表達增加[12],提示TGF-β可能是視網膜脫離時RPE發生EMT初始的刺激因素。Connor等[13]研究證實,TGF-β前體的活化需要包括玻璃體在內的眾多刺激因素參與。當視網膜脫離時,眼內存留的無活性的TGF-β前體被激活,隨液化的玻璃體共同到達視網膜下參與構成視網膜下液,并接觸到RPE細胞并促進其發生EMT[2]。
細胞遷徙與細胞侵襲能力是轉分化的上皮細胞是否具有脫離原位并異位至其它部位的基礎。在PVR發生過程中,這種能力是誘導變性后的RPE細胞異位至視網膜內外表面的原因。對于TGF-β是否直接導致細胞的遷徙和侵襲能力增強,有較大爭議。此結果與即往部分實驗結果不同[14],但Parapuram等[15]、黃雄高等[12]、Kirchhof等[16]的研究結果都顯示TGF-β本身并不能直接刺激細胞的遷徙和侵襲能力,而玻璃體卻能提高這兩項細胞行為,但玻璃體的作用卻是TGF-β依賴性,本身不會引起α-SMA表達增加。本研究結果發現,雖然在多個時間位點,TGF-β1組較之空白組細胞遷移及侵襲能力稍微提高,但結果并無統計學差異。因此在PVR發展的進程中,TGF-β啟動RPE細胞發生EMT(α-SMA),協同玻璃體共同促進RPE異位,TGF-β還能促進轉化后細胞在異位增生并產生細胞外基質,促進纖維膜發生收縮(凝膠收縮)。因此,抗TGF-β效應可能對于防治PVR作用顯著。
我們通過實驗中加入Rac1的抑制劑后觀察到,NSC23766能有效下調TGF-β1所致的α-SMA的表達,抑制含有RPE細胞的凝膠收縮,說明Rac1在發生tEMT的過程中發揮重要作用。它能阻止RPE發生間質樣改變,并且減少因增生膜收縮引起的視網膜牽拉。比較有趣的是,無論有無TGF-β1,NSC23766都能有效抑制細胞的遷移能力。同時,玻璃體所致的RPE細胞的遷移及侵襲能力也能被NSC23766抑制[17]。因此,我們推測Rac1對于抑制細胞運動的作用可能是通過其他細胞通道發揮作用,這一點有待今后的研究證實。
Rac1雖然作為tEMT的一個重要通道,但單通道并不能完全揭示EMT這一復雜的病理過程,今后實驗需要進一步研究其與其他tEMT相關通道的關系,從而進一步揭示PVR的發生機制。