引用本文: 黃海香, 張文芳, 楊義, 獨剛, 顧倬. 紅景天對模擬高海拔缺氧的大鼠視網膜組織形態以及缺氧誘導因子表達的影響. 中華眼底病雜志, 2014, 30(6): 599-603. doi: 10.3760/cma.j.issn.1005-1015.2014.06.015 復制
高海拔缺氧可引起細胞生理功能改變,導致全身組織器官病理損傷;其中,視網膜組織對缺氧極其敏感,尤其是急進高原后的急性缺氧可引起視網膜血管擴張紆曲,視網膜出血、滲出,棉絨斑及視盤水腫等高海拔視網膜病變(HAR)的一系列視網膜病理生理改變[1]。缺氧誘導因子(HIF)-1α是缺氧條件下廣泛存在的核轉錄因子,可調控血管內皮生長因子(VEGF)、p53基因等多種靶基因的表達,其中p53與視網膜新生血管形成和神經細胞凋亡有關[2]。相關研究表明紅景天具有抗缺氧、抗疲勞、抗衰老、抗腫瘤、增強免疫及保護心腦肝腎等作用,臨床中主要用于防治高原反應和心腦血管疾病[3]。而目前有關紅景天對HAR的干預效果還少見報道。為此,我們通過建立模擬高原缺氧的大鼠模型,觀察了紅景天對模擬高海拔缺氧的大鼠視網膜組織結構以及HIF-1α、p53表達的影響。現將結果報道如下。
1 材料和方法
成年雌性Sprague Dawley大鼠48只,體重160~200 g,蘭州大學實驗動物中心提供。將其隨機分為干預組和對照組,每組24只。干預組大鼠按10 ml/kg的劑量腹腔注射大珠紅景天注射液(國藥準字Z20060361,通化玉圣藥業股份有限公司),對照組大鼠按相同劑量注射生理鹽水。注射后1 h,兩組隨機選取6只大鼠分別飼養于氧分壓為17.6、14.7、11.3、7.4 kPa的高原環境模擬實驗艙(山東濰坊華信氧業有限公司)中,模擬的室內海拔高度分別為1500、3000、5000、8000 m。飼養后6 h,摘除大鼠眼球置于固定液(多聚甲醛90 ml、甲醇10 ml)中固定24 h備用。
采用蘇木精伊紅(HE)染色觀察大鼠視網膜病理形態的改變及組織染色分布情況。取出標本,平行視軸剖切眼球。室溫脫水,65℃石蠟包埋,冷卻后切片厚約3 μm,烤干,脫蠟至水。蘇木精染色2 min,分化液、返藍液中浸潤各30 s,沖洗后80%酒精脫水2 min,酒精伊紅染色液染色2 min,脫水透明后封片觀察并采集圖像。
采用免疫組織化學染色觀察大鼠視網膜中HIF-1α、 p53的表達,以細胞漿或細胞核中有特異性分布的棕黃色或棕褐色顆粒為陽性染色。取出標本,平行視軸剖切眼球。室溫脫水,65℃石蠟包埋,冷卻后切片厚約3 μm,烤干,脫蠟至水。磷酸鹽緩沖液(PBS)浸洗,高壓鍋加熱抗原修復,3%H2O2室溫孵育10 min,PBS沖洗,山羊血清封閉,室溫孵育10 min,加兔抗鼠HIF-1α(1:300)、p53(1:200)抗體一抗(北京博奧森生物技術有限公司);以0.1 mol/L的PBS代替一抗作為陰性對照。4℃過夜,PBS沖洗,滴加生物素標記二抗,37℃孵育30 min,PBS沖洗,滴加辣根酶標記鏈霉卵白素,37℃孵育30 min,PBS沖洗,二氨基聯苯胺(DAB)顯色試劑盒(北京博奧森生物技術有限公司)顯色,自來水沖洗,蘇木精復染,脫水透明后封片觀察并采集圖像。采用MetaMorph圖像分析軟件計算陽性細胞的平均吸光度[A,舊稱光密度(OD)]值。
采用SPSS 19.0統計軟件行統計學分析,所有數據以均數±標準差(
2 結果
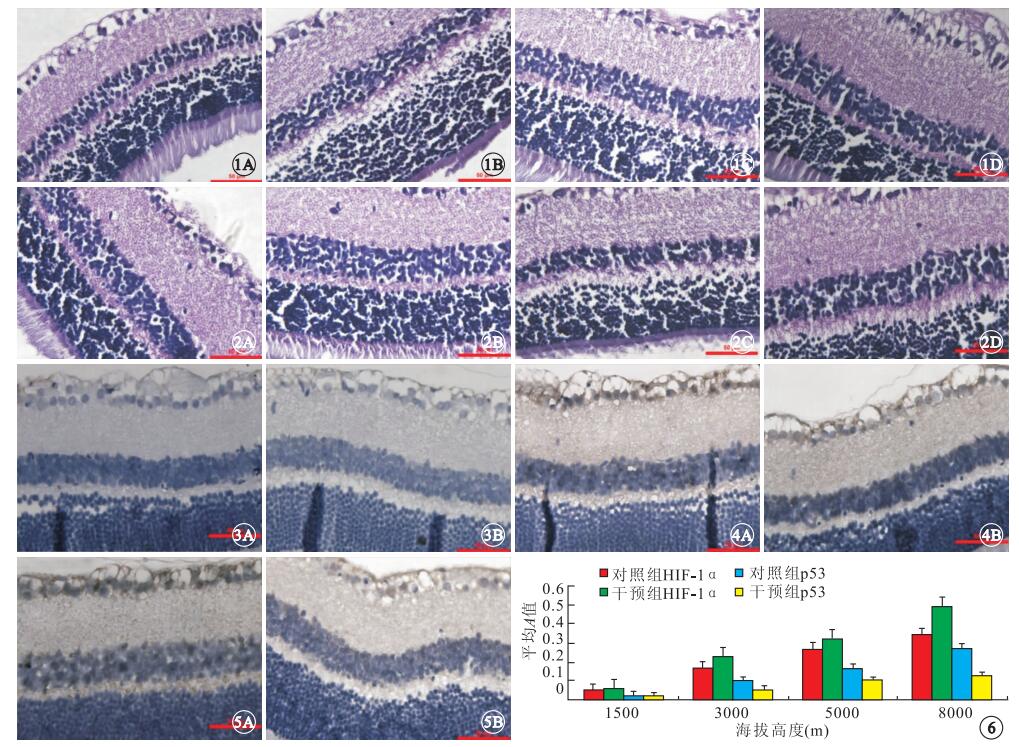
模擬的海拔高度為1500 m時,對照組大鼠視網膜組織結構清楚,視網膜厚度均勻一致,各層組織結構清晰,神經節細胞單層排列,細胞核較大,呈橢圓形(圖 1A);3000 m時,視網膜各層組織出現水腫疏松,視網膜厚度增加,層次排列紊亂(圖 1B);5000 m時,視網膜神經節細胞層及叢狀層水腫加重,神經節細胞腫脹變性(圖 1C);8000 m時,視網膜神經節細胞層及叢狀層疏松水腫更明顯,部分細胞可見核固縮、核溶解及細胞數量減少(圖 1D)。4種模擬的海拔高度下,干預組大鼠視網膜形態改變特點同對照組,但其視網膜組織水腫疏松、層次排列紊亂、神經節細胞腫脹變性的病理損傷程度減輕(圖 2)。
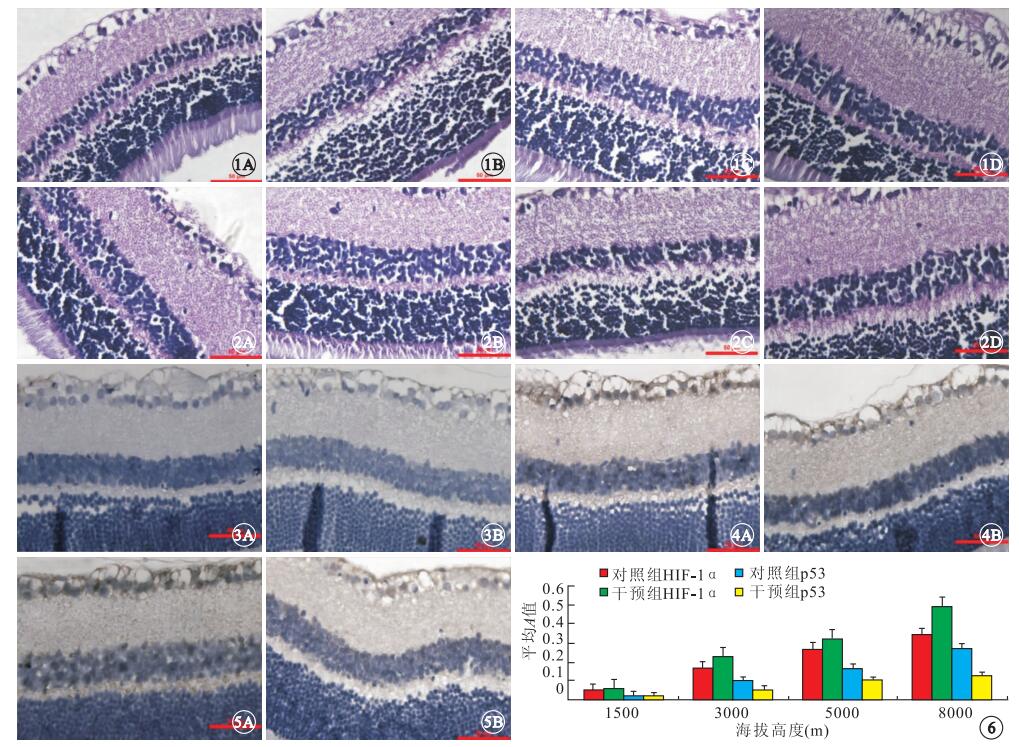 圖1
對照組大鼠視網膜組織病理像。1A.模擬的海拔高度1500 m,視網膜各層組織結構清晰,視網膜厚度均勻一致,神經節細胞單層排列;1B.模擬的海拔高度3000 m,視網膜各層組織水腫疏松,視網膜厚度增加,層次排列紊亂;1C.模擬的海拔高度5000 m,大鼠視網膜神經節細胞層及叢狀層水腫加重,神經節細胞腫脹變性;1D.模擬的海拔高度8000 m,大鼠視網膜膜神經節細胞層及叢狀層疏松水腫更明顯,部分細胞可見核固縮、核溶解及細胞數量減少HE ×400??圖 2??干預組大鼠視網膜組織病理像。2A.模擬的海拔高度1500 m;2B.模擬的海拔高度3000 m;2C.模擬的海拔高度5000 m;2D.模擬的海拔高度8000 m。大鼠視網膜形態改變特點同對照組,但其視網膜組織水腫疏松、層次排列紊亂、神經節細胞腫脹變性的病理損傷程度減輕HE ×400??圖 3??模擬的海拔高度1500 m時對照組大鼠視網膜免疫組織化學染色像。3A. HIF-1α;3B. p53。HIF-1α、p53僅在神經節細胞層有少量微弱表達DAB ×400??圖 4??模擬的海拔高度5000 m時對照組大鼠視網膜免疫組織化學染色像。4A. HIF-1α;4B. p53。HIF-1α、p53在神經節細胞層和內核層表達增強DAB ×400??圖 5??模擬的海拔高度5000 m時干預組大鼠視網膜免疫組織化學染色像。5A. HIF-1α;5B. p53。HIF-1α、p53在神經節細胞層和內核層表達;與對照組比較,HIF-1α表達增強,p53表達減弱DAB ×400??圖 6??模擬的不同海拔高度下兩組大鼠視網膜中HIF-1α、p53表達比較
Figure1.
$[![]!]
圖1
對照組大鼠視網膜組織病理像。1A.模擬的海拔高度1500 m,視網膜各層組織結構清晰,視網膜厚度均勻一致,神經節細胞單層排列;1B.模擬的海拔高度3000 m,視網膜各層組織水腫疏松,視網膜厚度增加,層次排列紊亂;1C.模擬的海拔高度5000 m,大鼠視網膜神經節細胞層及叢狀層水腫加重,神經節細胞腫脹變性;1D.模擬的海拔高度8000 m,大鼠視網膜膜神經節細胞層及叢狀層疏松水腫更明顯,部分細胞可見核固縮、核溶解及細胞數量減少HE ×400??圖 2??干預組大鼠視網膜組織病理像。2A.模擬的海拔高度1500 m;2B.模擬的海拔高度3000 m;2C.模擬的海拔高度5000 m;2D.模擬的海拔高度8000 m。大鼠視網膜形態改變特點同對照組,但其視網膜組織水腫疏松、層次排列紊亂、神經節細胞腫脹變性的病理損傷程度減輕HE ×400??圖 3??模擬的海拔高度1500 m時對照組大鼠視網膜免疫組織化學染色像。3A. HIF-1α;3B. p53。HIF-1α、p53僅在神經節細胞層有少量微弱表達DAB ×400??圖 4??模擬的海拔高度5000 m時對照組大鼠視網膜免疫組織化學染色像。4A. HIF-1α;4B. p53。HIF-1α、p53在神經節細胞層和內核層表達增強DAB ×400??圖 5??模擬的海拔高度5000 m時干預組大鼠視網膜免疫組織化學染色像。5A. HIF-1α;5B. p53。HIF-1α、p53在神經節細胞層和內核層表達;與對照組比較,HIF-1α表達增強,p53表達減弱DAB ×400??圖 6??模擬的不同海拔高度下兩組大鼠視網膜中HIF-1α、p53表達比較
Figure1.
$[![]!]
模擬的海拔高度為1500 m時,對照組大鼠視網膜中HIF-1α、p53僅在神經節細胞層有少量微弱表達(圖 3);3000 m時,HIF-1α、p53在神經節細胞層和內核層均出現表達;5000 m時,HIF-1α和p53在神經節細胞層和內核層表達增強(圖 4);8000 m時,HIF-1α和p53在神經節細胞層和內核層表達增強更明顯。4種模擬的海拔高度下,干預組大鼠視網膜中HIF-1α、 p53表達特點同對照組(圖 5)。與對照組比較,干預組大鼠視網膜中HIF-1α表達升高,p53表達降低。
隨模擬的海拔高度升高,對照組和干預組大鼠視網膜中HIF-1α、p53的表達也升高。模擬的海拔高度為3000、5000、8000 m時,對照組和干預組大鼠視網膜中HIF-1α(t對照組=12.45、31.45、8.16,t干預組=20.13、9.58、11.46)、p53(t對照組=5.34、10.44、28.24,t干預組=15.21、35.61、7.33)的表達較模擬的海拔高度為1500 m時明顯增高,差異均有統計學意義(P<0.05)。模擬的海拔高度為3000、5000、8000 m時,干預組大鼠視網膜中HIF-1α的表達較對照組明顯升高,差異均有統計學意義(F=12.145、21.466、19.233);p53(F=15.658、10.689、11.167)表達明顯降低,差異也有統計學意義(P<0.05)(圖 6)。相關性分析發現,大鼠視網膜中HIF-1α與p53的表達水平呈正相關(r=0.984 6,P<0.05)。
3 討論
目前已知與高海拔缺氧誘導相關的血氧飽和度下降是導致高原腦水腫(HACE)及HAR等高原疾病發生發展的根本原因。早在1967年就有研究表明,HACE動物模型建立的主要依據是腦組織腫脹及腦含水量增加[4]。此后又有研究表明,大鼠HACE建模成功的主要表現為高海拔缺氧后腦組織結構疏松、神經元破壞水腫、部分神經纖維腫脹,膠質細胞變性、血腦屏障破壞和通透性增加,導致腦水腫形成[5]。大腦和視網膜均是對缺氧極其敏感的神經組織,且視網膜神經組織可視為大腦神經組織的延續,如臨床中視盤水腫常成為觀察和評價腦水腫、顱內高壓的有效指標,說明大腦和視網膜對高海拔缺氧有著相似的病理形態改變。有研究在建立高原急性缺氧動物模型時發現,低壓氧艙中缺氧6 h后動物心肌和腦組織細胞形態均會發生明顯變化,出現血管擴張、細胞腫脹及空泡化現象[6]。說明低壓氧艙中急性缺氧6 h便可造成動物組織形態改變,出現HACE類型的腦缺氧損傷。本研究擬通過模擬不同程度高海拔缺氧環境,觀察急性缺氧6 h后大鼠視網膜組織的病理形態改變,以初步探討HAR動物模型的建立方法和依據。結果顯示在模擬的海拔高度為3000、5000、8000 m的缺氧條件下,大鼠視網膜組織均發生不同程度的病理形態改變。提示本研究在高海拔缺氧條件下的大鼠HAR動物模型建立成功。
HIF-1α是缺氧條件下廣泛存在的二聚體核轉錄因子,是缺氧代謝反應中的總開關,可通過缺氧反應元件(HRE)調控多種靶基因表達參與缺氧調節,其中調控的靶基因p53與視網膜的新生血管形成和神經細胞凋亡有關[2]。常氧時HIF-1α通過泛素化和蛋白酶體降解,半衰期小于1 min;p53在正常眼部組織中主要高表達在角膜、結膜、晶狀體上皮細胞中,在視網膜組織中呈低水平表達[7]。本研究結果顯示,模擬的海拔高度為1500 m時是處于輕度缺氧狀態,大鼠視網膜組織中HIF-1α、p53微弱表達。隨著模擬的海拔高度升高,缺氧程度加重,大鼠視網膜中HIF-1α、p53表達增加。分析其機制可能與缺氧時HIF-1α表達上調,調控p53等多種靶轉錄因子共同參與了無氧代謝、血管生成、細胞凋亡等病理生理過程有關[8]。缺氧是p53最強的生理誘導劑,輕度缺氧能降低p53表達以減少細胞凋亡來適應缺氧環境,而中重度或持續缺氧常伴隨DNA損傷和酸中毒,通過誘導HIF-1依賴性轉錄激活、HIF-1α穩定化而增加p53表達促進細胞凋亡[9, 10]。與之相應,本研究也觀察發現當模擬的海拔高度為5000、8000 m時,大鼠視網膜部分神經節細胞腫脹變性,出現核固縮、核溶解及細胞數量減少的細胞凋亡現象。推測這與HIF-1α和p53介導的細胞凋亡機制相關,但其具體作用機制需要進一步探討研究。
紅景天是生長在高海拔地區的景天科植物,其主要成分有紅景天甙、酪醇、沒食子酸、β-谷甾醇等[11]。其通過多種細胞分子機制實現抗缺氧和保護神經細胞的作用,如降低血管通透性、提高氧分壓和線粒體活性、降低細胞色素C釋放、抑制活性氧簇-NO途徑[12-14]。本研究結果顯示,干預組大鼠視網膜病理形態改變較對照組減輕,主要表現在神經節細胞腫脹變性,核固縮、核溶解的細胞凋亡現象減少。提示紅景天對缺氧大鼠視網膜神經細胞可能具有一定保護作用。大株紅景天的主要活性成分為紅景天甙和酪醇,紅景天甙可激活DNA修復酶聚腺苷酸二磷酸核糖轉移酶-1的活性,從而修復氧化損傷的DNA結構,并與自由基競爭結合DNA,降低自由基損傷,減少細胞缺氧性損傷和凋亡[15]。這一特性與本研究干預組大鼠視網膜神經節細胞缺氧性損傷的凋亡現象減少相符合。紅景天的半衰期約為1 h,故本研究選擇入艙前1 h給藥,在達到最佳血藥作用濃度時暴露于急性低壓缺氧環境進行研究。紅景天干預后大鼠視網膜中HIF-1α表達增加,p53表達下降。我們分析其作用機制與紅景天促進HIF-1α合成,HIF-1α與HIF-1β結合形成HIF-1異二聚體后發揮轉錄因子作用,并參與谷氨酸誘導的Ca2+/NO信號通路而降低氧化應激損傷細胞內Ca2+濃度有關;紅景天誘導HIF-1α表達增加主要通過抑制HIF-1α降解途徑,并非增加HIF-1α mRNA翻譯,從而提高機體對缺氧的應答能力;對p53的作用機制主要體現在增加p53泛素化降解途徑降低p53表達,從而減少p53途徑的細胞凋亡,保護視網膜神經細胞[16-18]。
急性高海拔缺氧對機體的各系統器官均有著不同程度的氧化應激損傷,特別是對缺氧極其敏感的大腦、視網膜等神經組織的損傷尤為明顯。本研究通過模擬不同海拔高度缺氧環境建立大鼠模型,發現高海拔缺氧可引起視網膜組織發生明顯的病理形態改變,神經節細胞層及內核層中HIF-1α、p53表達明顯增加;紅景天可減輕模擬高海拔缺氧所致的視網膜組織病理損害,促進神經節細胞層及內核層中HIF-1α表達升高,p53表達降低。提示紅景天可能通過增加HIF-1α表達提高了機體對缺氧的應答能力,從而發揮對高海拔缺氧大鼠視網膜組織的保護作用。但關于紅景天對HIF-1α與p53的具體細胞分子途徑和作用機制目前尚不完全清楚,有待今后研究加以探討。
高海拔缺氧可引起細胞生理功能改變,導致全身組織器官病理損傷;其中,視網膜組織對缺氧極其敏感,尤其是急進高原后的急性缺氧可引起視網膜血管擴張紆曲,視網膜出血、滲出,棉絨斑及視盤水腫等高海拔視網膜病變(HAR)的一系列視網膜病理生理改變[1]。缺氧誘導因子(HIF)-1α是缺氧條件下廣泛存在的核轉錄因子,可調控血管內皮生長因子(VEGF)、p53基因等多種靶基因的表達,其中p53與視網膜新生血管形成和神經細胞凋亡有關[2]。相關研究表明紅景天具有抗缺氧、抗疲勞、抗衰老、抗腫瘤、增強免疫及保護心腦肝腎等作用,臨床中主要用于防治高原反應和心腦血管疾病[3]。而目前有關紅景天對HAR的干預效果還少見報道。為此,我們通過建立模擬高原缺氧的大鼠模型,觀察了紅景天對模擬高海拔缺氧的大鼠視網膜組織結構以及HIF-1α、p53表達的影響。現將結果報道如下。
1 材料和方法
成年雌性Sprague Dawley大鼠48只,體重160~200 g,蘭州大學實驗動物中心提供。將其隨機分為干預組和對照組,每組24只。干預組大鼠按10 ml/kg的劑量腹腔注射大珠紅景天注射液(國藥準字Z20060361,通化玉圣藥業股份有限公司),對照組大鼠按相同劑量注射生理鹽水。注射后1 h,兩組隨機選取6只大鼠分別飼養于氧分壓為17.6、14.7、11.3、7.4 kPa的高原環境模擬實驗艙(山東濰坊華信氧業有限公司)中,模擬的室內海拔高度分別為1500、3000、5000、8000 m。飼養后6 h,摘除大鼠眼球置于固定液(多聚甲醛90 ml、甲醇10 ml)中固定24 h備用。
采用蘇木精伊紅(HE)染色觀察大鼠視網膜病理形態的改變及組織染色分布情況。取出標本,平行視軸剖切眼球。室溫脫水,65℃石蠟包埋,冷卻后切片厚約3 μm,烤干,脫蠟至水。蘇木精染色2 min,分化液、返藍液中浸潤各30 s,沖洗后80%酒精脫水2 min,酒精伊紅染色液染色2 min,脫水透明后封片觀察并采集圖像。
采用免疫組織化學染色觀察大鼠視網膜中HIF-1α、 p53的表達,以細胞漿或細胞核中有特異性分布的棕黃色或棕褐色顆粒為陽性染色。取出標本,平行視軸剖切眼球。室溫脫水,65℃石蠟包埋,冷卻后切片厚約3 μm,烤干,脫蠟至水。磷酸鹽緩沖液(PBS)浸洗,高壓鍋加熱抗原修復,3%H2O2室溫孵育10 min,PBS沖洗,山羊血清封閉,室溫孵育10 min,加兔抗鼠HIF-1α(1:300)、p53(1:200)抗體一抗(北京博奧森生物技術有限公司);以0.1 mol/L的PBS代替一抗作為陰性對照。4℃過夜,PBS沖洗,滴加生物素標記二抗,37℃孵育30 min,PBS沖洗,滴加辣根酶標記鏈霉卵白素,37℃孵育30 min,PBS沖洗,二氨基聯苯胺(DAB)顯色試劑盒(北京博奧森生物技術有限公司)顯色,自來水沖洗,蘇木精復染,脫水透明后封片觀察并采集圖像。采用MetaMorph圖像分析軟件計算陽性細胞的平均吸光度[A,舊稱光密度(OD)]值。
采用SPSS 19.0統計軟件行統計學分析,所有數據以均數±標準差(
2 結果
模擬的海拔高度為1500 m時,對照組大鼠視網膜組織結構清楚,視網膜厚度均勻一致,各層組織結構清晰,神經節細胞單層排列,細胞核較大,呈橢圓形(圖 1A);3000 m時,視網膜各層組織出現水腫疏松,視網膜厚度增加,層次排列紊亂(圖 1B);5000 m時,視網膜神經節細胞層及叢狀層水腫加重,神經節細胞腫脹變性(圖 1C);8000 m時,視網膜神經節細胞層及叢狀層疏松水腫更明顯,部分細胞可見核固縮、核溶解及細胞數量減少(圖 1D)。4種模擬的海拔高度下,干預組大鼠視網膜形態改變特點同對照組,但其視網膜組織水腫疏松、層次排列紊亂、神經節細胞腫脹變性的病理損傷程度減輕(圖 2)。
 圖1
對照組大鼠視網膜組織病理像。1A.模擬的海拔高度1500 m,視網膜各層組織結構清晰,視網膜厚度均勻一致,神經節細胞單層排列;1B.模擬的海拔高度3000 m,視網膜各層組織水腫疏松,視網膜厚度增加,層次排列紊亂;1C.模擬的海拔高度5000 m,大鼠視網膜神經節細胞層及叢狀層水腫加重,神經節細胞腫脹變性;1D.模擬的海拔高度8000 m,大鼠視網膜膜神經節細胞層及叢狀層疏松水腫更明顯,部分細胞可見核固縮、核溶解及細胞數量減少HE ×400??圖 2??干預組大鼠視網膜組織病理像。2A.模擬的海拔高度1500 m;2B.模擬的海拔高度3000 m;2C.模擬的海拔高度5000 m;2D.模擬的海拔高度8000 m。大鼠視網膜形態改變特點同對照組,但其視網膜組織水腫疏松、層次排列紊亂、神經節細胞腫脹變性的病理損傷程度減輕HE ×400??圖 3??模擬的海拔高度1500 m時對照組大鼠視網膜免疫組織化學染色像。3A. HIF-1α;3B. p53。HIF-1α、p53僅在神經節細胞層有少量微弱表達DAB ×400??圖 4??模擬的海拔高度5000 m時對照組大鼠視網膜免疫組織化學染色像。4A. HIF-1α;4B. p53。HIF-1α、p53在神經節細胞層和內核層表達增強DAB ×400??圖 5??模擬的海拔高度5000 m時干預組大鼠視網膜免疫組織化學染色像。5A. HIF-1α;5B. p53。HIF-1α、p53在神經節細胞層和內核層表達;與對照組比較,HIF-1α表達增強,p53表達減弱DAB ×400??圖 6??模擬的不同海拔高度下兩組大鼠視網膜中HIF-1α、p53表達比較
Figure1.
$[![]!]
圖1
對照組大鼠視網膜組織病理像。1A.模擬的海拔高度1500 m,視網膜各層組織結構清晰,視網膜厚度均勻一致,神經節細胞單層排列;1B.模擬的海拔高度3000 m,視網膜各層組織水腫疏松,視網膜厚度增加,層次排列紊亂;1C.模擬的海拔高度5000 m,大鼠視網膜神經節細胞層及叢狀層水腫加重,神經節細胞腫脹變性;1D.模擬的海拔高度8000 m,大鼠視網膜膜神經節細胞層及叢狀層疏松水腫更明顯,部分細胞可見核固縮、核溶解及細胞數量減少HE ×400??圖 2??干預組大鼠視網膜組織病理像。2A.模擬的海拔高度1500 m;2B.模擬的海拔高度3000 m;2C.模擬的海拔高度5000 m;2D.模擬的海拔高度8000 m。大鼠視網膜形態改變特點同對照組,但其視網膜組織水腫疏松、層次排列紊亂、神經節細胞腫脹變性的病理損傷程度減輕HE ×400??圖 3??模擬的海拔高度1500 m時對照組大鼠視網膜免疫組織化學染色像。3A. HIF-1α;3B. p53。HIF-1α、p53僅在神經節細胞層有少量微弱表達DAB ×400??圖 4??模擬的海拔高度5000 m時對照組大鼠視網膜免疫組織化學染色像。4A. HIF-1α;4B. p53。HIF-1α、p53在神經節細胞層和內核層表達增強DAB ×400??圖 5??模擬的海拔高度5000 m時干預組大鼠視網膜免疫組織化學染色像。5A. HIF-1α;5B. p53。HIF-1α、p53在神經節細胞層和內核層表達;與對照組比較,HIF-1α表達增強,p53表達減弱DAB ×400??圖 6??模擬的不同海拔高度下兩組大鼠視網膜中HIF-1α、p53表達比較
Figure1.
$[![]!]
模擬的海拔高度為1500 m時,對照組大鼠視網膜中HIF-1α、p53僅在神經節細胞層有少量微弱表達(圖 3);3000 m時,HIF-1α、p53在神經節細胞層和內核層均出現表達;5000 m時,HIF-1α和p53在神經節細胞層和內核層表達增強(圖 4);8000 m時,HIF-1α和p53在神經節細胞層和內核層表達增強更明顯。4種模擬的海拔高度下,干預組大鼠視網膜中HIF-1α、 p53表達特點同對照組(圖 5)。與對照組比較,干預組大鼠視網膜中HIF-1α表達升高,p53表達降低。
隨模擬的海拔高度升高,對照組和干預組大鼠視網膜中HIF-1α、p53的表達也升高。模擬的海拔高度為3000、5000、8000 m時,對照組和干預組大鼠視網膜中HIF-1α(t對照組=12.45、31.45、8.16,t干預組=20.13、9.58、11.46)、p53(t對照組=5.34、10.44、28.24,t干預組=15.21、35.61、7.33)的表達較模擬的海拔高度為1500 m時明顯增高,差異均有統計學意義(P<0.05)。模擬的海拔高度為3000、5000、8000 m時,干預組大鼠視網膜中HIF-1α的表達較對照組明顯升高,差異均有統計學意義(F=12.145、21.466、19.233);p53(F=15.658、10.689、11.167)表達明顯降低,差異也有統計學意義(P<0.05)(圖 6)。相關性分析發現,大鼠視網膜中HIF-1α與p53的表達水平呈正相關(r=0.984 6,P<0.05)。
3 討論
目前已知與高海拔缺氧誘導相關的血氧飽和度下降是導致高原腦水腫(HACE)及HAR等高原疾病發生發展的根本原因。早在1967年就有研究表明,HACE動物模型建立的主要依據是腦組織腫脹及腦含水量增加[4]。此后又有研究表明,大鼠HACE建模成功的主要表現為高海拔缺氧后腦組織結構疏松、神經元破壞水腫、部分神經纖維腫脹,膠質細胞變性、血腦屏障破壞和通透性增加,導致腦水腫形成[5]。大腦和視網膜均是對缺氧極其敏感的神經組織,且視網膜神經組織可視為大腦神經組織的延續,如臨床中視盤水腫常成為觀察和評價腦水腫、顱內高壓的有效指標,說明大腦和視網膜對高海拔缺氧有著相似的病理形態改變。有研究在建立高原急性缺氧動物模型時發現,低壓氧艙中缺氧6 h后動物心肌和腦組織細胞形態均會發生明顯變化,出現血管擴張、細胞腫脹及空泡化現象[6]。說明低壓氧艙中急性缺氧6 h便可造成動物組織形態改變,出現HACE類型的腦缺氧損傷。本研究擬通過模擬不同程度高海拔缺氧環境,觀察急性缺氧6 h后大鼠視網膜組織的病理形態改變,以初步探討HAR動物模型的建立方法和依據。結果顯示在模擬的海拔高度為3000、5000、8000 m的缺氧條件下,大鼠視網膜組織均發生不同程度的病理形態改變。提示本研究在高海拔缺氧條件下的大鼠HAR動物模型建立成功。
HIF-1α是缺氧條件下廣泛存在的二聚體核轉錄因子,是缺氧代謝反應中的總開關,可通過缺氧反應元件(HRE)調控多種靶基因表達參與缺氧調節,其中調控的靶基因p53與視網膜的新生血管形成和神經細胞凋亡有關[2]。常氧時HIF-1α通過泛素化和蛋白酶體降解,半衰期小于1 min;p53在正常眼部組織中主要高表達在角膜、結膜、晶狀體上皮細胞中,在視網膜組織中呈低水平表達[7]。本研究結果顯示,模擬的海拔高度為1500 m時是處于輕度缺氧狀態,大鼠視網膜組織中HIF-1α、p53微弱表達。隨著模擬的海拔高度升高,缺氧程度加重,大鼠視網膜中HIF-1α、p53表達增加。分析其機制可能與缺氧時HIF-1α表達上調,調控p53等多種靶轉錄因子共同參與了無氧代謝、血管生成、細胞凋亡等病理生理過程有關[8]。缺氧是p53最強的生理誘導劑,輕度缺氧能降低p53表達以減少細胞凋亡來適應缺氧環境,而中重度或持續缺氧常伴隨DNA損傷和酸中毒,通過誘導HIF-1依賴性轉錄激活、HIF-1α穩定化而增加p53表達促進細胞凋亡[9, 10]。與之相應,本研究也觀察發現當模擬的海拔高度為5000、8000 m時,大鼠視網膜部分神經節細胞腫脹變性,出現核固縮、核溶解及細胞數量減少的細胞凋亡現象。推測這與HIF-1α和p53介導的細胞凋亡機制相關,但其具體作用機制需要進一步探討研究。
紅景天是生長在高海拔地區的景天科植物,其主要成分有紅景天甙、酪醇、沒食子酸、β-谷甾醇等[11]。其通過多種細胞分子機制實現抗缺氧和保護神經細胞的作用,如降低血管通透性、提高氧分壓和線粒體活性、降低細胞色素C釋放、抑制活性氧簇-NO途徑[12-14]。本研究結果顯示,干預組大鼠視網膜病理形態改變較對照組減輕,主要表現在神經節細胞腫脹變性,核固縮、核溶解的細胞凋亡現象減少。提示紅景天對缺氧大鼠視網膜神經細胞可能具有一定保護作用。大株紅景天的主要活性成分為紅景天甙和酪醇,紅景天甙可激活DNA修復酶聚腺苷酸二磷酸核糖轉移酶-1的活性,從而修復氧化損傷的DNA結構,并與自由基競爭結合DNA,降低自由基損傷,減少細胞缺氧性損傷和凋亡[15]。這一特性與本研究干預組大鼠視網膜神經節細胞缺氧性損傷的凋亡現象減少相符合。紅景天的半衰期約為1 h,故本研究選擇入艙前1 h給藥,在達到最佳血藥作用濃度時暴露于急性低壓缺氧環境進行研究。紅景天干預后大鼠視網膜中HIF-1α表達增加,p53表達下降。我們分析其作用機制與紅景天促進HIF-1α合成,HIF-1α與HIF-1β結合形成HIF-1異二聚體后發揮轉錄因子作用,并參與谷氨酸誘導的Ca2+/NO信號通路而降低氧化應激損傷細胞內Ca2+濃度有關;紅景天誘導HIF-1α表達增加主要通過抑制HIF-1α降解途徑,并非增加HIF-1α mRNA翻譯,從而提高機體對缺氧的應答能力;對p53的作用機制主要體現在增加p53泛素化降解途徑降低p53表達,從而減少p53途徑的細胞凋亡,保護視網膜神經細胞[16-18]。
急性高海拔缺氧對機體的各系統器官均有著不同程度的氧化應激損傷,特別是對缺氧極其敏感的大腦、視網膜等神經組織的損傷尤為明顯。本研究通過模擬不同海拔高度缺氧環境建立大鼠模型,發現高海拔缺氧可引起視網膜組織發生明顯的病理形態改變,神經節細胞層及內核層中HIF-1α、p53表達明顯增加;紅景天可減輕模擬高海拔缺氧所致的視網膜組織病理損害,促進神經節細胞層及內核層中HIF-1α表達升高,p53表達降低。提示紅景天可能通過增加HIF-1α表達提高了機體對缺氧的應答能力,從而發揮對高海拔缺氧大鼠視網膜組織的保護作用。但關于紅景天對HIF-1α與p53的具體細胞分子途徑和作用機制目前尚不完全清楚,有待今后研究加以探討。