引用本文: 田芳, 東莉潔, 周玉, 王飛, 張曉敏, 李筱榮. 重組腺相關病毒-多聚嘧啶序列結合蛋白相關剪接因子對氧誘導視網膜新生血管形成的抑制作用. 中華眼底病雜志, 2014, 30(5): 504-508. doi: 10.3760/cma.j.issn.1005-1015.2014.05.019 復制
玻璃體腔注射抗血管內皮生長因子(VEGF)藥物是治療視網膜新生血管性疾病的常用治療方法。但通常需反復多次注射以維持藥物的有效性,因而增加了眼內感染的風險。改變藥物劑型以達到并維持眼內有效藥物濃度是目前研究熱點。我們前期研究已證實多聚嘧啶序列結合蛋白相關剪接因子(PSF)可以下調胰島素樣生長因子(IGF)-1刺激后的VEGF表達,并有IGF-1依賴性、即抗VEGF的相對選擇性。重組腺相關病毒(rAAV)作為一種基因治療載體,可整合到人類第19號染色體上并長期表達,使用安全,無致病性和免疫源性[1]。為此,我們采用rAAV載體將PSF轉入小鼠視網膜中,觀察其對氧誘導視網膜新生血管的抑制作用。現將結果報道如下。
1 材料和方法
C57BL/6J小鼠66只,7日齡,雌雄不限,清潔級,中國科學院北京實驗動物中心提供;鼠抗PSF單克隆抗體購自美國Sigma公司,鼠抗VEGF 多克隆抗體、小鼠抗甘油醛-3-磷酸脫氫酶(GAPDH)單克隆抗體購自美國CST公司,BCA蛋白濃度檢測試劑盒購自美國Pierce公司,rAAV-PSF載體的構建及病毒的包裝、收集、擴增及純化方法同文獻[2]。
采用隨機數字表法將18只7日齡小鼠分為正常組、rAAV-PSF注射組、rAAV注射組,每組均為6只。12日齡時,正常組小鼠玻璃體腔注射2 μl生理鹽水;rAAV-PSF注射組小鼠玻璃體腔注射病毒滴度為5×1013 pfu/ml的rAAV-PSF 2 μl;rAAV注射組小鼠玻璃體腔注射相同病毒滴度的單純rAAV載體2 μl。17日齡時處死所有小鼠,摘除眼球提取視網膜組織蛋白,行PSF蛋白表達水平檢測。
參照文獻[3-5]的方法,依照隨機數字表法將48只 7日齡小鼠分為正常組、OIR模型組、OIR rAAV-PSF治療組、OIR rAAV治療組,每組均為12只。除正常組外,其余7日齡小鼠與哺乳母鼠一同置于氧濃度為(75±2)%的氧箱內。飼養5 d后即小鼠12日齡時取出小鼠轉移至正常環境中飼養5 d,建立OIR模型。OIR模型組小鼠出氧箱后不作任何處理;正常組小鼠始終生活在正常氧環境中。12日齡時,OIR rAAV-PSF治療組小鼠玻璃體腔注射病毒滴度為5×1013 pfu/ml的rAAV-PSF重組載體2 μl;OIR rAAV治療組小鼠玻璃體腔注射相同病毒滴度的單純rAAV載體2 μl。17日齡時,各組隨機處死6只小鼠,摘除雙眼眼球提取視網膜組織蛋白,行VEGF蛋白表達水平檢測。
17日齡時正常組、OIR模型組、OIR rAAV-PSF治療組、OIR rAAV治療組隨機處死6只小鼠,摘除雙眼眼球,4%多聚甲醛溶液中固定 24 h,常規酒精梯度脫水,二甲苯透明,石蠟包埋,作6 μm厚度的連續切片,每只眼球取切片10張共計120張行蘇木精-伊紅(HE)染色。40倍光學顯微鏡下觀察,拍照并保存圖像,全視野雙盲法計數突破視網膜內界膜的血管內皮細胞核數。計數血管內皮細胞核時僅計數與內界膜有緊密聯系的細胞核,不含玻璃體腔內與內界膜無聯系的其他血管內皮細胞核。
蛋白免疫印跡法(Western blot)檢測小鼠視網膜PSF、VEGF蛋白表達。將各組每只小鼠的視網膜組織分別置于1.5 ml微離心管內,加入100 μl組織裂解液,冰上研磨裂解視網膜組織30 min后,4℃,離心半徑13.5 cm,16 000 r/min離心15 min收集上清,BCA蛋白檢測試劑盒測定蛋白濃度。取變性的蛋白40 μg/孔,10聚丙烯酰氨凝膠電泳,恒壓下將蛋白轉至聚偏氟乙烯膜后,5% 牛血清白蛋白封閉1 h,分別加入稀釋的抗PSF一抗(1 ∶1000),抗VEGF一抗(1 ∶1000),抗GAPDH一抗(1 ∶1000),4℃過夜。洗膜緩沖液(TBST) 洗膜,10 min,共3次,加入1 ∶5000稀釋的辣根過氧化物酶標記IgG(二抗),孵育1 h。TBST洗膜,10 min,共3次,暗室內ECL發光法檢測目的條帶,Kodak X光膠片曝光,顯影及定影。膠片掃描后,采用Eagle eyeⅡ圖像分析儀進行灰度分析,以GAPDH做內對照進行校正,計算目的蛋白的相對表達量。計算方法:目的蛋白質相對表達量=目的蛋白條帶灰度值/GAPDH條帶灰度值。
采用SPSS 18.0統計軟件包進行統計學分析處理。 實驗數據以均數±標準差(
2 結果
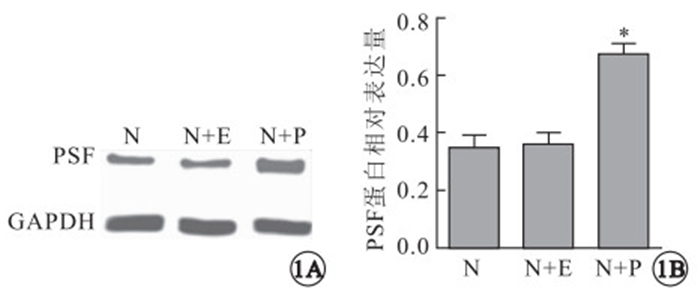
Western blot檢測結果顯示,正常組小鼠視網膜組織中存在PSF蛋白內源性表達,玻璃體腔注射rAAV-PSF后可明顯提高小鼠視網膜組織中PSF蛋白表達,單純注射rAAV不影響小鼠視網膜組織中PSF蛋白的表達(圖 1A)。正常組小鼠視網膜PSF蛋白表達與rAAV-PSF注射組比較,差異有統計學意義(F=16.05,P=0.001),與rAAV注射組比較,差異無統計學意義(F=16.05,P=0.890)(圖 1B)。玻璃體腔注射rAAV-PSF后,rAAV可以成功介導PSF蛋白在視網膜組織中的高表達。
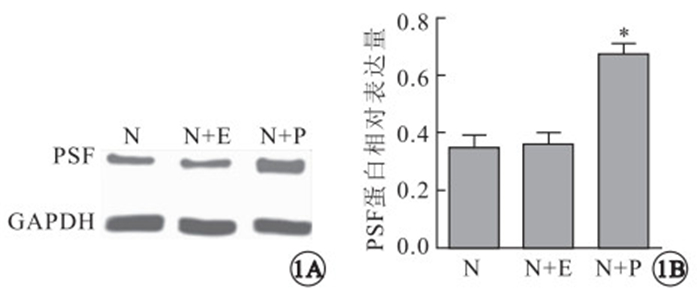 圖1
Western blot檢測各組小鼠視網膜PSF蛋白表達及定量分析。1A.各組小鼠視網膜PSF蛋白表達;1B.各組小鼠視網膜PSF蛋白表達定量分析,*:P<0.05。N:正常組;N+E:rAAV注射組;N+P:rAAV-PSF注射組
圖1
Western blot檢測各組小鼠視網膜PSF蛋白表達及定量分析。1A.各組小鼠視網膜PSF蛋白表達;1B.各組小鼠視網膜PSF蛋白表達定量分析,*:P<0.05。N:正常組;N+E:rAAV注射組;N+P:rAAV-PSF注射組
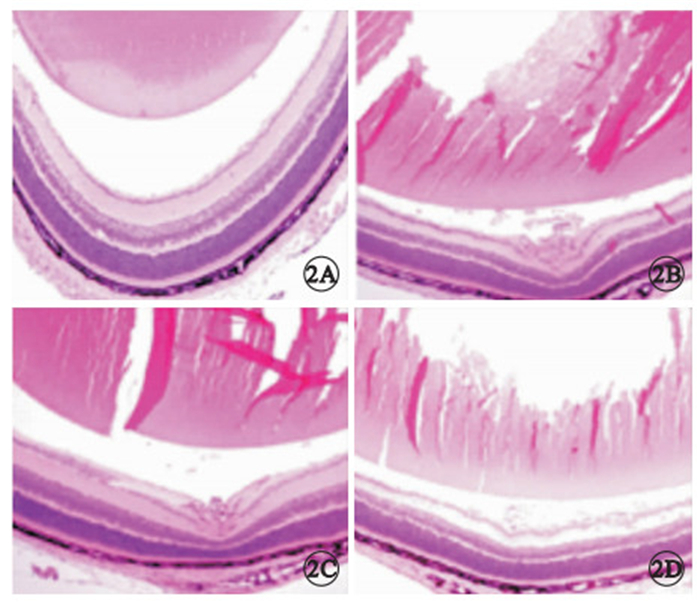
光學顯微鏡觀察,正常組小鼠僅在極少數切片中可見突破視網膜內界膜到達玻璃體腔的血管內皮細胞核;OIR組小鼠可見較多突破視網膜內界膜的血管內皮細胞核,單獨或成簇出現;OIR rAAV治療組小鼠可見較多突破視網膜內界膜的血管內皮細胞核;OIR rAAV-PSF治療組小鼠視網膜新生血管數量顯著減少(圖 2)。各組突破內界膜的視網膜新生血管內皮細胞核數比較,正常組與OIR模型組差異有統計學意義(F=101.00,P=0.007);rAAV-PSF治療組與OIR模型組差異有統計學意義(F=101.00,P=0.002);OIR rAAV治療組與OIR模型組差異無統計學意義(F=101.00,P=0.550)(表 1)。
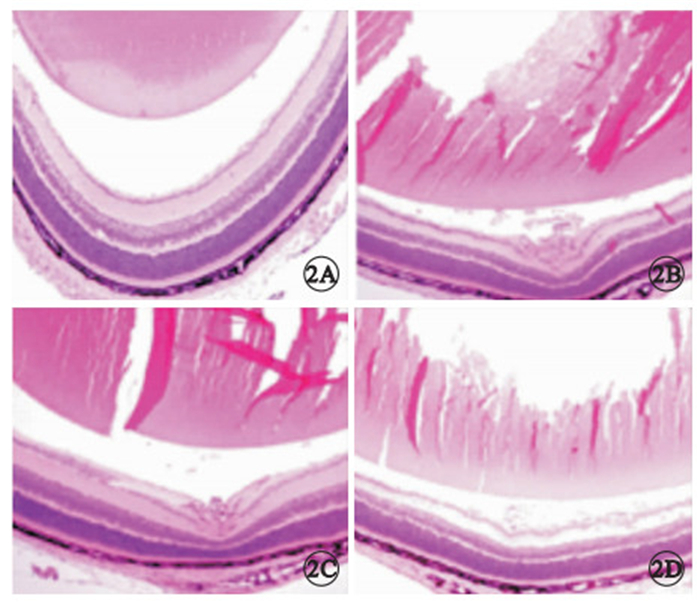 圖2
各組小鼠視網膜組織病理像。2A.正常組,視網膜組織未見新生血管;2B.OIR模型組,血管內皮細胞突破內界膜,形成新生血管;2C.OIR rAAV治療組,可見新生血管形成;2D.OIR rAAV-PSF治療組,視網膜組織新生血管數量顯著減少 HE ×100
圖2
各組小鼠視網膜組織病理像。2A.正常組,視網膜組織未見新生血管;2B.OIR模型組,血管內皮細胞突破內界膜,形成新生血管;2C.OIR rAAV治療組,可見新生血管形成;2D.OIR rAAV-PSF治療組,視網膜組織新生血管數量顯著減少 HE ×100
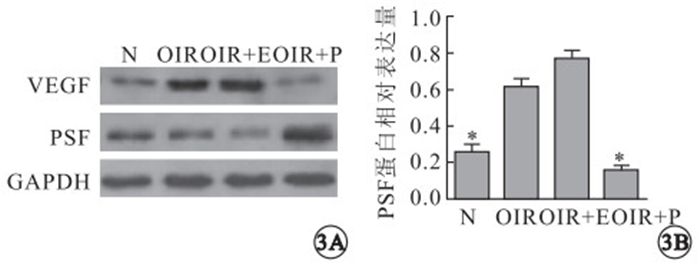
Western blot檢測結果顯示,正常組小鼠視網膜存在生理源性VEGF蛋白表達;OIR模型組、OIR rAAV組小鼠視網膜VEGF蛋白表達顯著升高;OIR rAAV-PSF組小鼠視網膜VEGF蛋白表達顯著降低(圖 3A)。各組視網膜VEGF蛋白表達比較,正常組與OIR模型組差異有統計學意義(F=13.20,P=0.005);OIR模型組與OIR rAAV-PSF治療組差異有統計學意義(F=13.20,P=0.001);OIR模型組與OIR rAAV組差異無統計學意義(F=13.20,P=0.071)(圖 3B)。
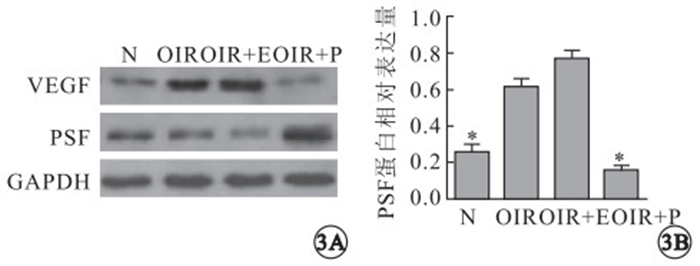 圖3
Western blot檢測各組視網膜VEGF蛋白表達及定量分析。3A.各組小鼠視網膜VEGF蛋白表達;3B.各組小鼠視網膜VEGF蛋白表達定量分析,*:P<0.05。N:正常組;OIR:OIR模型組;OIR+E: OIR rAAV治療組;OIR+P:OIR rAAV-PSF治療組
圖3
Western blot檢測各組視網膜VEGF蛋白表達及定量分析。3A.各組小鼠視網膜VEGF蛋白表達;3B.各組小鼠視網膜VEGF蛋白表達定量分析,*:P<0.05。N:正常組;OIR:OIR模型組;OIR+E: OIR rAAV治療組;OIR+P:OIR rAAV-PSF治療組
3 討論
視網膜新生血管性疾病是一組嚴重致盲性眼病,目前尚無有效藥物療法。大量研究顯示,VEGF是視網膜新生血管生成中必不可少的重要誘導因子,視網膜新生血管的發生和消退與VEGF水平密切相關[6, 7],因此抗VEGF治療成為基因治療研究的重點。
PSF為相對分子質量76×103的多功能蛋白[8],可在多種信號通路中發揮轉錄抑制因子的作用,如白細胞介素4刺激后,PSF可與信號轉導子和轉錄激活子6 (STAT6)結合形成復合物,進而抑制 IL-4/ STAT6信號通路的轉錄激活[9]。Lukong等[10]發現,表皮生長因子刺激后,PSF通過與BReast腫瘤激酶(BRK)相結合,參與細胞周期調控。Urban等[11-13]發現PSF可抑制IGF-1誘導的豬粒膜細胞中細胞色素P-450膽固醇側鏈分解酶的表達,在IGF-1信號轉導的過程中發揮轉錄抑制因子的作用。本研究首次將PSF引入視網膜新生血管性疾病中,并在體外細胞中發現PSF高表達可以抑制IGF-1刺激后的VEGF表達,以及隨之產生的血管內皮細胞增生,而我們前期的體外研究證實PSF可以通過抑制視網膜血管內皮細胞中IGF-1/絲裂原活化蛋白激酶通路來下調VEGF的表達,從而抑制視網膜血管內皮細胞的增生。結果還顯示,高表達的PSF僅能抑制IGF-1刺激后的猴脈絡膜-視網膜內皮細胞增生,并下調VEGF表達,即在IGF-1刺激的前提下,PSF才能發揮上述作用。PSF的IGF-1配體依賴性對于臨床的意義較為重大,目前醫療市場上應用的VEGF抑制劑,大多為VEGF單克隆抗體或者VEGF-trap,它們與VEGF的結合不具有時相選擇性,無法感應病理水平和生理水平VEGF的差異,而生理水平的VEGF可以維持血管的正常結構和功能,一旦過度抑制,必將對正常血管的功能有所影響,引起一系列的遠期并發癥。PSF蛋白則與之不同,它可通過感知眼部微環境中IGF-1水平的改變,準確的識別VEGF病理性升高及其生理水平,從而既能有效抑制病理性升高的VEGF,又不影響其生理水平的維持。 因此,PSF有望成為特異性抑制VEGF表達及視網膜新生血管的基因治療藥物新靶點。
為進一步探討PSF在體內對VEGF的調控,本研究建立OIR模型并進行rAAV-PSF玻璃體腔注射,觀察其治療效果。本研究結果顯示,OIR小鼠經玻璃體腔注射rAAV-PSF后,視網膜新生血管形成減少,并下調視網膜組織中VEGF的表達,從而證明PSF可以通過下調VEGF表達抑制視網膜新生血管形成,可能成為預防和治療視網膜新生血管的一個新靶點。
抗VEGF藥物玻璃體腔注射是視網膜新生血管性疾病的常用治療方法。目前臨床應用的VEGF抑制劑大多為VEGF單克隆抗體或者VEGF-trap[14-17],可與VEGF結合并阻斷其生物活性,從而抑制新生血管的生成。但通常需反復多次注射以維持藥物的有效性,因而增加了眼內感染的風險。緩釋藥物的開發研究顯得迫在眉睫。另外,基因治療的關鍵問題之一是選擇一種安全、有效、適合于產業化的載體。本研究選擇無害病毒rAAV,rAAV在基因治療的應用上有其它病毒載體或基因導入方法所不具備的優點:(1)無致病性。至今尚無報道質疑rAAV為載體感染哺乳動物細胞的安全性,無論從野生型到重組病毒載體,均沒有確定的致病性報道。(2)可以和人的19號染色體整合,從而能夠持續表達。(3)可以高效率地感染人的大多數細胞,沒有組織特異性。(4)既可以感染分裂細胞,也可以感染靜止細胞,不引起明顯的炎癥和免疫反應;可以耐受pH值的變化以及外界環境中濕度、溫度等的變化[2, 18-21]。因此rAAV-PSF將有可能使眼內持續產生PSF,從而長久的發揮抗新生血管作用,以減少臨床注射的次數,本研究的時間尚短,仍需后續研究探討其潛在的緩釋前景。
鑒于離體視網膜鋪片可以幫助我們客觀、完整、形象地觀察小鼠視網膜血管形態和分布情況,我們在實驗初期曾嘗試應用熒光素鈉進行實驗觀察,但由于該化合物分子量低,在行視網膜固定鋪片過程中就已大量滲透過血管壁,使整個視網膜組織呈現彌散的綠色熒光,從而不能清楚顯示出正常和異常血管,且重復性差。其后又嘗試左心室灌注異硫氰酸熒光素葡聚糖(FITC-dextran),但其滲透異常血管壁的速度慢,在完成造影及隨后的視網膜固定鋪片時可清晰地顯示正常和異常視網膜血管完整的走行、形態。但該方法動物死亡率極高,且FITC-dextran 的用量大,實驗成本較高。通過再次查閱文獻,有學者報道球后注射FITC-dextran可較好觀察視網膜新生血管,且FITC-dextran用量極低,耗時短,成功率較高[22]。因此,我們將在后續研究中利用該方法行視網膜血管鋪片,進一步豐富完善實驗數據,明確PSF對于視網膜新生血管的治療作用。
玻璃體腔注射抗血管內皮生長因子(VEGF)藥物是治療視網膜新生血管性疾病的常用治療方法。但通常需反復多次注射以維持藥物的有效性,因而增加了眼內感染的風險。改變藥物劑型以達到并維持眼內有效藥物濃度是目前研究熱點。我們前期研究已證實多聚嘧啶序列結合蛋白相關剪接因子(PSF)可以下調胰島素樣生長因子(IGF)-1刺激后的VEGF表達,并有IGF-1依賴性、即抗VEGF的相對選擇性。重組腺相關病毒(rAAV)作為一種基因治療載體,可整合到人類第19號染色體上并長期表達,使用安全,無致病性和免疫源性[1]。為此,我們采用rAAV載體將PSF轉入小鼠視網膜中,觀察其對氧誘導視網膜新生血管的抑制作用。現將結果報道如下。
1 材料和方法
C57BL/6J小鼠66只,7日齡,雌雄不限,清潔級,中國科學院北京實驗動物中心提供;鼠抗PSF單克隆抗體購自美國Sigma公司,鼠抗VEGF 多克隆抗體、小鼠抗甘油醛-3-磷酸脫氫酶(GAPDH)單克隆抗體購自美國CST公司,BCA蛋白濃度檢測試劑盒購自美國Pierce公司,rAAV-PSF載體的構建及病毒的包裝、收集、擴增及純化方法同文獻[2]。
采用隨機數字表法將18只7日齡小鼠分為正常組、rAAV-PSF注射組、rAAV注射組,每組均為6只。12日齡時,正常組小鼠玻璃體腔注射2 μl生理鹽水;rAAV-PSF注射組小鼠玻璃體腔注射病毒滴度為5×1013 pfu/ml的rAAV-PSF 2 μl;rAAV注射組小鼠玻璃體腔注射相同病毒滴度的單純rAAV載體2 μl。17日齡時處死所有小鼠,摘除眼球提取視網膜組織蛋白,行PSF蛋白表達水平檢測。
參照文獻[3-5]的方法,依照隨機數字表法將48只 7日齡小鼠分為正常組、OIR模型組、OIR rAAV-PSF治療組、OIR rAAV治療組,每組均為12只。除正常組外,其余7日齡小鼠與哺乳母鼠一同置于氧濃度為(75±2)%的氧箱內。飼養5 d后即小鼠12日齡時取出小鼠轉移至正常環境中飼養5 d,建立OIR模型。OIR模型組小鼠出氧箱后不作任何處理;正常組小鼠始終生活在正常氧環境中。12日齡時,OIR rAAV-PSF治療組小鼠玻璃體腔注射病毒滴度為5×1013 pfu/ml的rAAV-PSF重組載體2 μl;OIR rAAV治療組小鼠玻璃體腔注射相同病毒滴度的單純rAAV載體2 μl。17日齡時,各組隨機處死6只小鼠,摘除雙眼眼球提取視網膜組織蛋白,行VEGF蛋白表達水平檢測。
17日齡時正常組、OIR模型組、OIR rAAV-PSF治療組、OIR rAAV治療組隨機處死6只小鼠,摘除雙眼眼球,4%多聚甲醛溶液中固定 24 h,常規酒精梯度脫水,二甲苯透明,石蠟包埋,作6 μm厚度的連續切片,每只眼球取切片10張共計120張行蘇木精-伊紅(HE)染色。40倍光學顯微鏡下觀察,拍照并保存圖像,全視野雙盲法計數突破視網膜內界膜的血管內皮細胞核數。計數血管內皮細胞核時僅計數與內界膜有緊密聯系的細胞核,不含玻璃體腔內與內界膜無聯系的其他血管內皮細胞核。
蛋白免疫印跡法(Western blot)檢測小鼠視網膜PSF、VEGF蛋白表達。將各組每只小鼠的視網膜組織分別置于1.5 ml微離心管內,加入100 μl組織裂解液,冰上研磨裂解視網膜組織30 min后,4℃,離心半徑13.5 cm,16 000 r/min離心15 min收集上清,BCA蛋白檢測試劑盒測定蛋白濃度。取變性的蛋白40 μg/孔,10聚丙烯酰氨凝膠電泳,恒壓下將蛋白轉至聚偏氟乙烯膜后,5% 牛血清白蛋白封閉1 h,分別加入稀釋的抗PSF一抗(1 ∶1000),抗VEGF一抗(1 ∶1000),抗GAPDH一抗(1 ∶1000),4℃過夜。洗膜緩沖液(TBST) 洗膜,10 min,共3次,加入1 ∶5000稀釋的辣根過氧化物酶標記IgG(二抗),孵育1 h。TBST洗膜,10 min,共3次,暗室內ECL發光法檢測目的條帶,Kodak X光膠片曝光,顯影及定影。膠片掃描后,采用Eagle eyeⅡ圖像分析儀進行灰度分析,以GAPDH做內對照進行校正,計算目的蛋白的相對表達量。計算方法:目的蛋白質相對表達量=目的蛋白條帶灰度值/GAPDH條帶灰度值。
采用SPSS 18.0統計軟件包進行統計學分析處理。 實驗數據以均數±標準差(
2 結果
Western blot檢測結果顯示,正常組小鼠視網膜組織中存在PSF蛋白內源性表達,玻璃體腔注射rAAV-PSF后可明顯提高小鼠視網膜組織中PSF蛋白表達,單純注射rAAV不影響小鼠視網膜組織中PSF蛋白的表達(圖 1A)。正常組小鼠視網膜PSF蛋白表達與rAAV-PSF注射組比較,差異有統計學意義(F=16.05,P=0.001),與rAAV注射組比較,差異無統計學意義(F=16.05,P=0.890)(圖 1B)。玻璃體腔注射rAAV-PSF后,rAAV可以成功介導PSF蛋白在視網膜組織中的高表達。
 圖1
Western blot檢測各組小鼠視網膜PSF蛋白表達及定量分析。1A.各組小鼠視網膜PSF蛋白表達;1B.各組小鼠視網膜PSF蛋白表達定量分析,*:P<0.05。N:正常組;N+E:rAAV注射組;N+P:rAAV-PSF注射組
圖1
Western blot檢測各組小鼠視網膜PSF蛋白表達及定量分析。1A.各組小鼠視網膜PSF蛋白表達;1B.各組小鼠視網膜PSF蛋白表達定量分析,*:P<0.05。N:正常組;N+E:rAAV注射組;N+P:rAAV-PSF注射組
光學顯微鏡觀察,正常組小鼠僅在極少數切片中可見突破視網膜內界膜到達玻璃體腔的血管內皮細胞核;OIR組小鼠可見較多突破視網膜內界膜的血管內皮細胞核,單獨或成簇出現;OIR rAAV治療組小鼠可見較多突破視網膜內界膜的血管內皮細胞核;OIR rAAV-PSF治療組小鼠視網膜新生血管數量顯著減少(圖 2)。各組突破內界膜的視網膜新生血管內皮細胞核數比較,正常組與OIR模型組差異有統計學意義(F=101.00,P=0.007);rAAV-PSF治療組與OIR模型組差異有統計學意義(F=101.00,P=0.002);OIR rAAV治療組與OIR模型組差異無統計學意義(F=101.00,P=0.550)(表 1)。
 圖2
各組小鼠視網膜組織病理像。2A.正常組,視網膜組織未見新生血管;2B.OIR模型組,血管內皮細胞突破內界膜,形成新生血管;2C.OIR rAAV治療組,可見新生血管形成;2D.OIR rAAV-PSF治療組,視網膜組織新生血管數量顯著減少 HE ×100
圖2
各組小鼠視網膜組織病理像。2A.正常組,視網膜組織未見新生血管;2B.OIR模型組,血管內皮細胞突破內界膜,形成新生血管;2C.OIR rAAV治療組,可見新生血管形成;2D.OIR rAAV-PSF治療組,視網膜組織新生血管數量顯著減少 HE ×100
Western blot檢測結果顯示,正常組小鼠視網膜存在生理源性VEGF蛋白表達;OIR模型組、OIR rAAV組小鼠視網膜VEGF蛋白表達顯著升高;OIR rAAV-PSF組小鼠視網膜VEGF蛋白表達顯著降低(圖 3A)。各組視網膜VEGF蛋白表達比較,正常組與OIR模型組差異有統計學意義(F=13.20,P=0.005);OIR模型組與OIR rAAV-PSF治療組差異有統計學意義(F=13.20,P=0.001);OIR模型組與OIR rAAV組差異無統計學意義(F=13.20,P=0.071)(圖 3B)。
 圖3
Western blot檢測各組視網膜VEGF蛋白表達及定量分析。3A.各組小鼠視網膜VEGF蛋白表達;3B.各組小鼠視網膜VEGF蛋白表達定量分析,*:P<0.05。N:正常組;OIR:OIR模型組;OIR+E: OIR rAAV治療組;OIR+P:OIR rAAV-PSF治療組
圖3
Western blot檢測各組視網膜VEGF蛋白表達及定量分析。3A.各組小鼠視網膜VEGF蛋白表達;3B.各組小鼠視網膜VEGF蛋白表達定量分析,*:P<0.05。N:正常組;OIR:OIR模型組;OIR+E: OIR rAAV治療組;OIR+P:OIR rAAV-PSF治療組
3 討論
視網膜新生血管性疾病是一組嚴重致盲性眼病,目前尚無有效藥物療法。大量研究顯示,VEGF是視網膜新生血管生成中必不可少的重要誘導因子,視網膜新生血管的發生和消退與VEGF水平密切相關[6, 7],因此抗VEGF治療成為基因治療研究的重點。
PSF為相對分子質量76×103的多功能蛋白[8],可在多種信號通路中發揮轉錄抑制因子的作用,如白細胞介素4刺激后,PSF可與信號轉導子和轉錄激活子6 (STAT6)結合形成復合物,進而抑制 IL-4/ STAT6信號通路的轉錄激活[9]。Lukong等[10]發現,表皮生長因子刺激后,PSF通過與BReast腫瘤激酶(BRK)相結合,參與細胞周期調控。Urban等[11-13]發現PSF可抑制IGF-1誘導的豬粒膜細胞中細胞色素P-450膽固醇側鏈分解酶的表達,在IGF-1信號轉導的過程中發揮轉錄抑制因子的作用。本研究首次將PSF引入視網膜新生血管性疾病中,并在體外細胞中發現PSF高表達可以抑制IGF-1刺激后的VEGF表達,以及隨之產生的血管內皮細胞增生,而我們前期的體外研究證實PSF可以通過抑制視網膜血管內皮細胞中IGF-1/絲裂原活化蛋白激酶通路來下調VEGF的表達,從而抑制視網膜血管內皮細胞的增生。結果還顯示,高表達的PSF僅能抑制IGF-1刺激后的猴脈絡膜-視網膜內皮細胞增生,并下調VEGF表達,即在IGF-1刺激的前提下,PSF才能發揮上述作用。PSF的IGF-1配體依賴性對于臨床的意義較為重大,目前醫療市場上應用的VEGF抑制劑,大多為VEGF單克隆抗體或者VEGF-trap,它們與VEGF的結合不具有時相選擇性,無法感應病理水平和生理水平VEGF的差異,而生理水平的VEGF可以維持血管的正常結構和功能,一旦過度抑制,必將對正常血管的功能有所影響,引起一系列的遠期并發癥。PSF蛋白則與之不同,它可通過感知眼部微環境中IGF-1水平的改變,準確的識別VEGF病理性升高及其生理水平,從而既能有效抑制病理性升高的VEGF,又不影響其生理水平的維持。 因此,PSF有望成為特異性抑制VEGF表達及視網膜新生血管的基因治療藥物新靶點。
為進一步探討PSF在體內對VEGF的調控,本研究建立OIR模型并進行rAAV-PSF玻璃體腔注射,觀察其治療效果。本研究結果顯示,OIR小鼠經玻璃體腔注射rAAV-PSF后,視網膜新生血管形成減少,并下調視網膜組織中VEGF的表達,從而證明PSF可以通過下調VEGF表達抑制視網膜新生血管形成,可能成為預防和治療視網膜新生血管的一個新靶點。
抗VEGF藥物玻璃體腔注射是視網膜新生血管性疾病的常用治療方法。目前臨床應用的VEGF抑制劑大多為VEGF單克隆抗體或者VEGF-trap[14-17],可與VEGF結合并阻斷其生物活性,從而抑制新生血管的生成。但通常需反復多次注射以維持藥物的有效性,因而增加了眼內感染的風險。緩釋藥物的開發研究顯得迫在眉睫。另外,基因治療的關鍵問題之一是選擇一種安全、有效、適合于產業化的載體。本研究選擇無害病毒rAAV,rAAV在基因治療的應用上有其它病毒載體或基因導入方法所不具備的優點:(1)無致病性。至今尚無報道質疑rAAV為載體感染哺乳動物細胞的安全性,無論從野生型到重組病毒載體,均沒有確定的致病性報道。(2)可以和人的19號染色體整合,從而能夠持續表達。(3)可以高效率地感染人的大多數細胞,沒有組織特異性。(4)既可以感染分裂細胞,也可以感染靜止細胞,不引起明顯的炎癥和免疫反應;可以耐受pH值的變化以及外界環境中濕度、溫度等的變化[2, 18-21]。因此rAAV-PSF將有可能使眼內持續產生PSF,從而長久的發揮抗新生血管作用,以減少臨床注射的次數,本研究的時間尚短,仍需后續研究探討其潛在的緩釋前景。
鑒于離體視網膜鋪片可以幫助我們客觀、完整、形象地觀察小鼠視網膜血管形態和分布情況,我們在實驗初期曾嘗試應用熒光素鈉進行實驗觀察,但由于該化合物分子量低,在行視網膜固定鋪片過程中就已大量滲透過血管壁,使整個視網膜組織呈現彌散的綠色熒光,從而不能清楚顯示出正常和異常血管,且重復性差。其后又嘗試左心室灌注異硫氰酸熒光素葡聚糖(FITC-dextran),但其滲透異常血管壁的速度慢,在完成造影及隨后的視網膜固定鋪片時可清晰地顯示正常和異常視網膜血管完整的走行、形態。但該方法動物死亡率極高,且FITC-dextran 的用量大,實驗成本較高。通過再次查閱文獻,有學者報道球后注射FITC-dextran可較好觀察視網膜新生血管,且FITC-dextran用量極低,耗時短,成功率較高[22]。因此,我們將在后續研究中利用該方法行視網膜血管鋪片,進一步豐富完善實驗數據,明確PSF對于視網膜新生血管的治療作用。