引用本文: 于波, 張曉敏, 王梅艷, 蘇暢, 蔣元豐, 劉勛, 李筱榮. 小鼠視網膜激光損傷早期組織功能學變化與單核細胞趨化蛋白動態表達關系的研究. 中華眼底病雜志, 2014, 30(5): 495-499. doi: 10.3760/cma.j.issn.1005-1015.2014.05.017 復制
視網膜激光損傷后早期炎癥細胞聚集,產生視網膜急性炎癥。單核細胞趨化蛋白(MCP-1)為趨化因子家族的一員,是特異性趨化單核細胞的蛋白,可介導炎癥反應并參與多種疾病的發生發展[1]。為探討MCP-1 的表達與視網膜激光損傷早期組織損害進展的關系,我們觀察了視網膜激光損傷早期組織功能改變以及MCP-1基因和蛋白表達的動態變化。現將結果報道如下。
1 材料和方法
健康C57BL/6小鼠116只,鼠齡6~8周,體重15~18 g,雌性,無特定病原體級。飼養方法遵照視覺與眼科學研究協會關于眼科和視覺研究飼養和使用動物標準。
所有小鼠屈光間質清晰,眼底檢查無異常。采用隨機數字表法將小鼠分為正常組、激光損傷組,均為58只。正常組小鼠不做任何處理。激光損傷組小鼠以500 mg/kg劑量腹腔注射5%水合氯醛麻醉,右眼復方托吡卡胺滴眼液散瞳后,采用多波長氪離子激光機NOVUS OMNI(美國Coherent公司)進行激光光凝,激光參數:波長647 nm,輸出功率100 mW,曝光時間100 ms。每只小鼠右眼造成20個激光斑,每個激光斑距視盤兩個視盤直徑以上,相互之間距離至少一個激光斑直徑,且避開眼底大血管。
激光損傷后0、2、6 d隨機選擇對照組及激光損傷組小鼠各10只置于暗室中過夜,第2天行視網膜電圖(ERG)檢測。(1)暗適應ERG:在暗室中微弱暗紅光下,5%水合氯醛腹腔注射麻醉,右眼復方托吡卡胺滴眼液散瞳,0.4%鹽酸奧布卡因滴眼液表面麻醉,1%羧甲基纖維素納滴眼液保護角膜。小鼠俯臥放置于實驗臺上,銀絲環形正電極置于右眼前接觸角膜,針狀負電極置于兩眼之間的枕后皮下,針狀接地電極置于小鼠尾部皮下。光刺激器提供閃光,參數如下:白光,時間2.92 ms,強度3.0 cd·s/m2,間隔10 s,重復測量5次。(2)明適應ERG:在背景光強度30 cd/m2下進行明適應5 min。光刺激器提供閃光,參數與暗適應ERG相同。測量a、b波振幅。
激光損傷后1(T1)、3(T3)、7(T7) d,隨機選取正常組和激光損傷組小鼠各3只,斷頸法處死并摘取右側眼球,10%福爾馬林固定,常規脫水,石蠟包埋。經視盤矢狀徑進行連續切片,切片厚度3 μm,行常規蘇木精-伊紅(HE)染色。光學顯微鏡下觀察視網膜組織結構并拍照。
實時定量聚合酶鏈反應(PCR)檢測MCP-1基因相對表達量。激光損傷后T1、T3、T7分別處死正常組與激光損傷組小鼠各8只,取右側眼球。利用Trizol(美國Invitrogen公司)提取眼球總RNA,Nanodrop2000分光光度計(美國Thermo公司)測定RNA濃度及純度。根據逆轉錄試劑盒(美國Thermo公司)說明書進行逆轉錄。將甘油醛-3-磷酸脫氫酶引物(上游5′-TGTGTCCGTCGTGGATCTGA-3′,下游5′-CCTGCTTCACCACCTTCTTGA-3′)、MCP-1引物(上游 5′-CAGGTCCCTGTCATGCTTCTG-3′,下游 5′-GAGCCAACACGTGGATGCT-3′),Sybgreen(瑞士Roche公司)和cDNA按一定比例以8 μl體系加入384孔板中,每個樣本設3個副孔,7900HT快速實時定量聚合酶鏈反應(PCR)系統(美國Applied Biosystems公司)進行測定,并根據溶解曲線確定測定的特異性。采用△△Ct方法進行數據處理,計算MCP-1 基因相對表達量。
蛋白質免疫印跡法(Western blot)檢測MCP-1蛋白表達。激光損傷后T1、T3、T7分別處死正常組與損傷組小鼠各5只,取右側眼球,加入預冷的組織蛋白裂解液,勻漿并離心以提取眼球總蛋白。測定蛋白量后,將等量蛋白十二烷基酸鈉(SDS)上樣緩沖液,煮沸5 min。 應用濕式電轉移法經SDS凝膠電泳轉到聚偏二氟乙烯膜。室溫封閉,兔抗鼠MCP-1一抗(1 ∶2000,英國Abcam公司)4℃孵育過夜,洗膜緩沖液(TBST)清洗3次,羊抗兔二抗(1 ∶2000,美國Cell Signaling Technology公司)室溫孵育1 h,TBST清洗3次,暗室內顯色曝光掃描,β-肌動蛋白(β-actin)為內參。采用Gene Tools圖像分析軟件測定條帶灰度值,以目的條帶灰度值與β-actin灰度值的比值反映目的蛋白的表達。
采用SPSS 21.0統計學軟件進行統計分析處理。每個時間點組間比較采用獨立樣本t檢驗; 不同時間點間激光損傷組的多重比較采用單因素方差分析輔以Bonferroni事后檢驗。P<0.05為差異有統計學意義。
2 結果
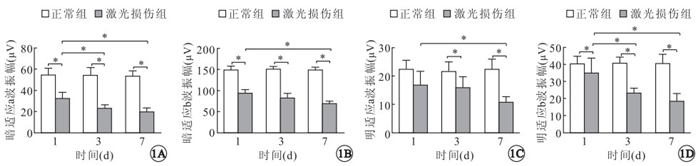
ERG檢測結果顯示,激光后損傷后T1、T3、T7,正常組、激光損傷組小鼠暗適應a(t=6.998、9.594、13.778)、b波(t=12.089、13.310、21.989)振幅比較,差異有統計學意義(P=0.000)(圖 1A,1B)。激光損傷后T1,正常組、激光損傷組明適應a波振幅比較,差異無統計學意義(t=2.659,P=0.200),b波振幅比較,差異有統計學意義(t=8.844,P=0.000);T3、T7,兩組明適應a(t=3.076、7.544)、b波(t=10.418、8.485)振幅比較,差異均有統計學意義(P=0.000)(圖 1C,1D)。
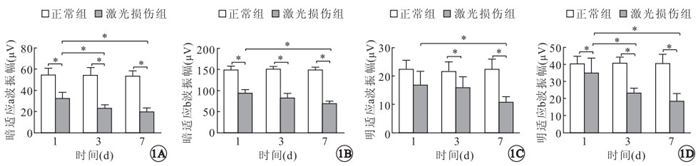 圖1
兩組激光損傷后不同時間ERG明暗適應a、b波振幅比較。*:P<0.05
圖1
兩組激光損傷后不同時間ERG明暗適應a、b波振幅比較。*:P<0.05
激光損傷組暗適應a波振幅,T1與T3(t=3.773)、T1與T7(t=5.070)比較,差異有統計學意義(P<0.01),T3與T7比較,差異無統計學意義(t=1.297,P=0.660);b波振幅,T1與T7比較,差異有統計學意義(t=4.762,P=0.000); T1與T3(t=2.236)、T3與T7(t=2.526)比較,差異無統計學意義(P=0.120、0.060)。明適應a波振幅,T1與T7比較,差異有統計學意義(t=2.991,P=0.020);T1與T3(t=0.516)、T3與T7(t=2.475)比較,差異均無統計學意義(P=1.000、0.710);b波振幅,T1與T3(t=3.570)、 T1與T7(t=4.989)比較,差異均有統計學意義(P<0.01),T3與T7比較,差異無統計學意義(t=1.419,P=0.070)。
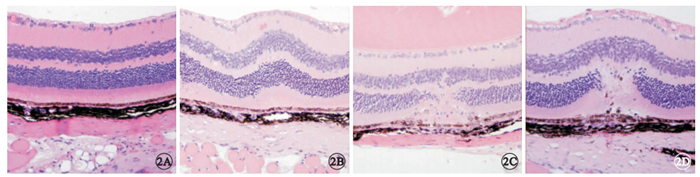
光學顯微鏡觀察,正常組小鼠視網膜各層組織結構完整,未見異常改變。激光損傷組小鼠激光損傷后T1,視網膜色素上皮(RPE)層局限性增厚隆起,神經上皮各層均向玻璃體腔方向隆起,外核層可見細胞核排列紊亂,部分核缺失;T3,外核層局部出現全層缺損,部分內核層細胞核向外核層缺損部位遷移,可見炎癥細胞浸潤;7T,內核層細胞核及RPE層色素細胞向外核層缺損處遷移增多,炎癥反應減輕(圖 2)。
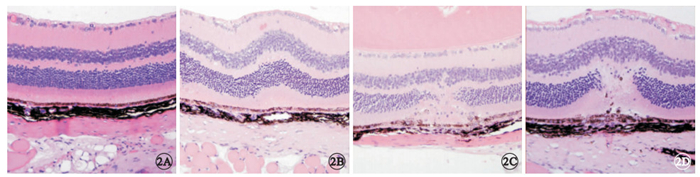 圖2
兩組小鼠視網膜組織病理像。2A.正常組,視網膜各層組織結構完整;2B.激光損傷組,激光損傷后1 d,RPE層局限性增厚隆起,神經上皮各層均向玻璃體腔方向隆起,外核層可見細胞核排列紊亂,部分核缺失;2C.激光損傷組,激光損傷組3 d,外核層局部出現全層缺損,部分內核層細胞核向外核層缺損部位遷移,可見炎癥細胞浸潤;2D.激光損傷組,損傷后7 d,內核層細胞核及RPE層色素細胞向外核層缺損處遷移增多,炎癥反應減輕 HE ×20
圖2
兩組小鼠視網膜組織病理像。2A.正常組,視網膜各層組織結構完整;2B.激光損傷組,激光損傷后1 d,RPE層局限性增厚隆起,神經上皮各層均向玻璃體腔方向隆起,外核層可見細胞核排列紊亂,部分核缺失;2C.激光損傷組,激光損傷組3 d,外核層局部出現全層缺損,部分內核層細胞核向外核層缺損部位遷移,可見炎癥細胞浸潤;2D.激光損傷組,損傷后7 d,內核層細胞核及RPE層色素細胞向外核層缺損處遷移增多,炎癥反應減輕 HE ×20
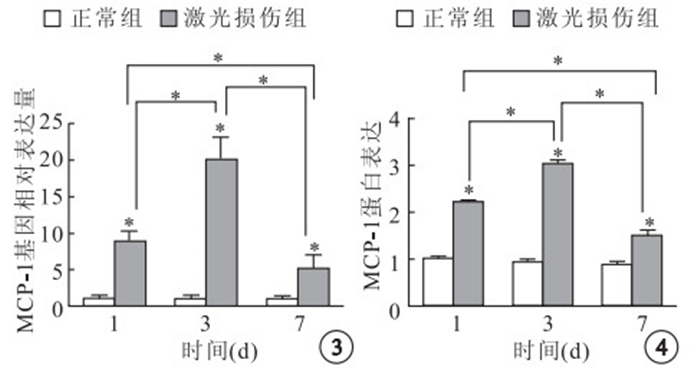
實時定量PCR檢測結果顯示,激光損傷組小鼠激光損傷后T1、T3、T7,MCP-1基因相對表達量分別是正常組小鼠的 8.12、18.35、4.98倍。與正常組小鼠MCP-1 基因相對表達量比較,差異均有統計學意義(t=14.329、16.861、5.743,P<0.05)。激光損傷后不 同時間點,激光損傷組MCP-1基因相對表達量兩兩比較,差異均有統計學意義(F=90.532,P<0.05)(圖 3)。
Western blot檢測結果顯示,激光損傷組小鼠激光損傷后T1、T3、T7 ,MCP-1蛋白表達量分別是正常組小鼠的2.2、3.16、1.72倍。與正常組小鼠MCP-1蛋白表達量比較,差異均有統計學意義(t=75.068、54.145、14.653,P<0.05)。激光損傷后不同時間點,激光損傷組MCP-1蛋白表達量兩兩比較,差異均有統計學意義(F=602.464,P<0.05)(圖 4)。
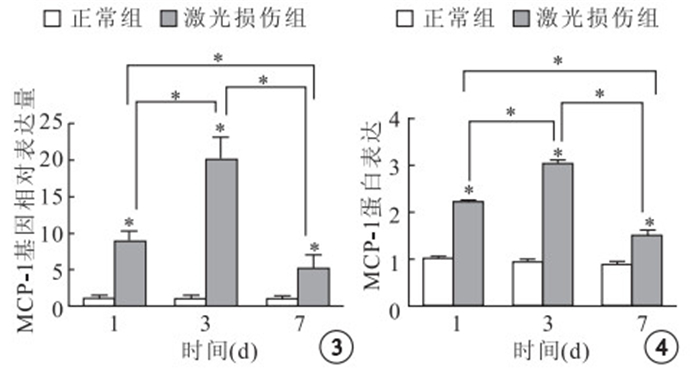 圖3
兩組激光損傷后不同時間MCP-1基因相對表達量比較。*:P<0.05 ? ?圖 4 兩組激光損傷后不同時間視網膜MCP-1蛋白比較,*:P<0.05
圖3
兩組激光損傷后不同時間MCP-1基因相對表達量比較。*:P<0.05 ? ?圖 4 兩組激光損傷后不同時間視網膜MCP-1蛋白比較,*:P<0.05
3 討論
視網膜激光損傷是一個復雜的病理過程,涉及急性炎癥反應、神經細胞凋亡、膠質細胞增生遷移及瘢痕形成等[2];如激光能量較大,損傷較重,還會伴隨脈絡膜新生血管(CNV)的形成[3]。因此常用于研究視網膜炎癥、老年性黃斑變性、視網膜色素變性以及視網膜營養不良的致病機制及可能的治療方法研究[4-6]。目前已有視網膜激光損傷60 d以上的長期報道[7],病理觀察視網膜組織學、功能學變化,并檢測其間MCP-1的表達變化,尋求MCP-1的表達與炎癥反應及組織破壞進行性發展之間的關系。本研究主要觀察激光損傷后1~7 d即損傷后早期視網膜組織學、功能學變化及MCP-1基因和蛋白的動態表達情況,初步探討兩者之間的關系。結果顯示,激光損傷后視網膜組織結構紊亂,炎癥細胞浸潤,光感受器細胞減少以及外核層缺損進行性擴大;視網膜功能逐漸下降,到后期趨于平穩,T7明暗適應各波振幅與T3比較,差異無統計學意義。說明激光損傷范圍隨時間延長逐漸擴展。損傷后1~3 d,組織破壞進展明顯,外核層缺損范圍迅速擴大,功能上各波振幅下降明顯,但3~7 d,外核層全層缺損直徑變化不如之前顯著,各波振幅下降均不明顯,與組織學結果一致。在早期急性炎癥過程中,MCP-1基因與蛋白表達在損傷后T1顯著增高,T3達到高峰,T7表達水平低于T1,接近正常。
到目前為止,與視網膜激光損傷病理改變及治療相關的一些因子,如血管內皮生長因子、肝細胞生長因子及其受體、趨化因子受體已有較深入地研究[8-10],但仍有許多可能的重要靶點還未引起關注。MCP-1也被稱為CCL2,是CC趨化因子家族的一員,屬趨化因子超家族。人MCP-1由76個氨基酸組成,相對分子質量為13×103。單核和(或)巨噬細胞是其主要來源,上皮細胞、成纖維細胞、小膠質細胞等其他細胞均可表達MCP-1[11],但生理狀態下都呈低表達。其受體主要分布于單核和(或)巨噬細胞表面[12]。在炎癥狀態下,炎癥部位細胞高表達MCP-1,會趨化大量單核細胞遷入血管內膜下,活化為巨噬細胞向炎癥部位遷移并發揮作用。在眼內正常情況下,視網膜神經上皮層及RPE層表達少量的MCP-1[13]。隨著年齡增長或是受到損傷,MCP-1表達增多[14]。已有研究表明,激光損傷導致CNV的模型中有MCP-1高表達,并且導致大量單核和(或)巨噬細胞聚集在視網膜中,這也是影響CNV形成與發展的因素[15]。也有研究表明,炎癥反應中各種炎癥因子及相應炎癥細胞的聚集在糖尿病視網膜病變中起到關鍵作用,被證實與糖尿病視網膜病變發展有一定關聯[16, 17]。
本研究結果顯示,激光損傷后1~3 d組織破壞、功能下降均是進展速度最快的時期,而MCP-1的表達也在損傷3 d達到高峰,此后組織功能學變化減慢,趨于穩定狀態,MCP-1表達也下降,損傷后7 d,蛋白表達與正常組接近。有研究表明,MCP-1表達增高會伴隨大量視網膜內單核和(或)巨噬細胞的浸潤,并活化小膠質細胞,使其分泌更多的致炎因子,從而加速炎癥的進展[17]。而在不引起CNV的輕度激光損傷模型中,炎癥因子的分泌與炎癥細胞的浸潤對損傷的進展更是尤為重要。結合本研究結果和相關文獻[15-17],我們推測MCP-1與視網膜激光損傷進行性發展、視功能進行性下降之間存在因果關聯,MCP-1可能通過影響單核和(或)巨噬細胞的浸潤,引起組織損傷程度的加重與神經元的凋亡,使損傷范圍擴大,視功能下降。
本研究未對MCP-1進行干預來驗證其表達水平與損傷進展間的關系,是本研究工作的不足,有待今后進一步研究證實。
視網膜激光損傷后早期炎癥細胞聚集,產生視網膜急性炎癥。單核細胞趨化蛋白(MCP-1)為趨化因子家族的一員,是特異性趨化單核細胞的蛋白,可介導炎癥反應并參與多種疾病的發生發展[1]。為探討MCP-1 的表達與視網膜激光損傷早期組織損害進展的關系,我們觀察了視網膜激光損傷早期組織功能改變以及MCP-1基因和蛋白表達的動態變化。現將結果報道如下。
1 材料和方法
健康C57BL/6小鼠116只,鼠齡6~8周,體重15~18 g,雌性,無特定病原體級。飼養方法遵照視覺與眼科學研究協會關于眼科和視覺研究飼養和使用動物標準。
所有小鼠屈光間質清晰,眼底檢查無異常。采用隨機數字表法將小鼠分為正常組、激光損傷組,均為58只。正常組小鼠不做任何處理。激光損傷組小鼠以500 mg/kg劑量腹腔注射5%水合氯醛麻醉,右眼復方托吡卡胺滴眼液散瞳后,采用多波長氪離子激光機NOVUS OMNI(美國Coherent公司)進行激光光凝,激光參數:波長647 nm,輸出功率100 mW,曝光時間100 ms。每只小鼠右眼造成20個激光斑,每個激光斑距視盤兩個視盤直徑以上,相互之間距離至少一個激光斑直徑,且避開眼底大血管。
激光損傷后0、2、6 d隨機選擇對照組及激光損傷組小鼠各10只置于暗室中過夜,第2天行視網膜電圖(ERG)檢測。(1)暗適應ERG:在暗室中微弱暗紅光下,5%水合氯醛腹腔注射麻醉,右眼復方托吡卡胺滴眼液散瞳,0.4%鹽酸奧布卡因滴眼液表面麻醉,1%羧甲基纖維素納滴眼液保護角膜。小鼠俯臥放置于實驗臺上,銀絲環形正電極置于右眼前接觸角膜,針狀負電極置于兩眼之間的枕后皮下,針狀接地電極置于小鼠尾部皮下。光刺激器提供閃光,參數如下:白光,時間2.92 ms,強度3.0 cd·s/m2,間隔10 s,重復測量5次。(2)明適應ERG:在背景光強度30 cd/m2下進行明適應5 min。光刺激器提供閃光,參數與暗適應ERG相同。測量a、b波振幅。
激光損傷后1(T1)、3(T3)、7(T7) d,隨機選取正常組和激光損傷組小鼠各3只,斷頸法處死并摘取右側眼球,10%福爾馬林固定,常規脫水,石蠟包埋。經視盤矢狀徑進行連續切片,切片厚度3 μm,行常規蘇木精-伊紅(HE)染色。光學顯微鏡下觀察視網膜組織結構并拍照。
實時定量聚合酶鏈反應(PCR)檢測MCP-1基因相對表達量。激光損傷后T1、T3、T7分別處死正常組與激光損傷組小鼠各8只,取右側眼球。利用Trizol(美國Invitrogen公司)提取眼球總RNA,Nanodrop2000分光光度計(美國Thermo公司)測定RNA濃度及純度。根據逆轉錄試劑盒(美國Thermo公司)說明書進行逆轉錄。將甘油醛-3-磷酸脫氫酶引物(上游5′-TGTGTCCGTCGTGGATCTGA-3′,下游5′-CCTGCTTCACCACCTTCTTGA-3′)、MCP-1引物(上游 5′-CAGGTCCCTGTCATGCTTCTG-3′,下游 5′-GAGCCAACACGTGGATGCT-3′),Sybgreen(瑞士Roche公司)和cDNA按一定比例以8 μl體系加入384孔板中,每個樣本設3個副孔,7900HT快速實時定量聚合酶鏈反應(PCR)系統(美國Applied Biosystems公司)進行測定,并根據溶解曲線確定測定的特異性。采用△△Ct方法進行數據處理,計算MCP-1 基因相對表達量。
蛋白質免疫印跡法(Western blot)檢測MCP-1蛋白表達。激光損傷后T1、T3、T7分別處死正常組與損傷組小鼠各5只,取右側眼球,加入預冷的組織蛋白裂解液,勻漿并離心以提取眼球總蛋白。測定蛋白量后,將等量蛋白十二烷基酸鈉(SDS)上樣緩沖液,煮沸5 min。 應用濕式電轉移法經SDS凝膠電泳轉到聚偏二氟乙烯膜。室溫封閉,兔抗鼠MCP-1一抗(1 ∶2000,英國Abcam公司)4℃孵育過夜,洗膜緩沖液(TBST)清洗3次,羊抗兔二抗(1 ∶2000,美國Cell Signaling Technology公司)室溫孵育1 h,TBST清洗3次,暗室內顯色曝光掃描,β-肌動蛋白(β-actin)為內參。采用Gene Tools圖像分析軟件測定條帶灰度值,以目的條帶灰度值與β-actin灰度值的比值反映目的蛋白的表達。
采用SPSS 21.0統計學軟件進行統計分析處理。每個時間點組間比較采用獨立樣本t檢驗; 不同時間點間激光損傷組的多重比較采用單因素方差分析輔以Bonferroni事后檢驗。P<0.05為差異有統計學意義。
2 結果
ERG檢測結果顯示,激光后損傷后T1、T3、T7,正常組、激光損傷組小鼠暗適應a(t=6.998、9.594、13.778)、b波(t=12.089、13.310、21.989)振幅比較,差異有統計學意義(P=0.000)(圖 1A,1B)。激光損傷后T1,正常組、激光損傷組明適應a波振幅比較,差異無統計學意義(t=2.659,P=0.200),b波振幅比較,差異有統計學意義(t=8.844,P=0.000);T3、T7,兩組明適應a(t=3.076、7.544)、b波(t=10.418、8.485)振幅比較,差異均有統計學意義(P=0.000)(圖 1C,1D)。
 圖1
兩組激光損傷后不同時間ERG明暗適應a、b波振幅比較。*:P<0.05
圖1
兩組激光損傷后不同時間ERG明暗適應a、b波振幅比較。*:P<0.05
激光損傷組暗適應a波振幅,T1與T3(t=3.773)、T1與T7(t=5.070)比較,差異有統計學意義(P<0.01),T3與T7比較,差異無統計學意義(t=1.297,P=0.660);b波振幅,T1與T7比較,差異有統計學意義(t=4.762,P=0.000); T1與T3(t=2.236)、T3與T7(t=2.526)比較,差異無統計學意義(P=0.120、0.060)。明適應a波振幅,T1與T7比較,差異有統計學意義(t=2.991,P=0.020);T1與T3(t=0.516)、T3與T7(t=2.475)比較,差異均無統計學意義(P=1.000、0.710);b波振幅,T1與T3(t=3.570)、 T1與T7(t=4.989)比較,差異均有統計學意義(P<0.01),T3與T7比較,差異無統計學意義(t=1.419,P=0.070)。
光學顯微鏡觀察,正常組小鼠視網膜各層組織結構完整,未見異常改變。激光損傷組小鼠激光損傷后T1,視網膜色素上皮(RPE)層局限性增厚隆起,神經上皮各層均向玻璃體腔方向隆起,外核層可見細胞核排列紊亂,部分核缺失;T3,外核層局部出現全層缺損,部分內核層細胞核向外核層缺損部位遷移,可見炎癥細胞浸潤;7T,內核層細胞核及RPE層色素細胞向外核層缺損處遷移增多,炎癥反應減輕(圖 2)。
 圖2
兩組小鼠視網膜組織病理像。2A.正常組,視網膜各層組織結構完整;2B.激光損傷組,激光損傷后1 d,RPE層局限性增厚隆起,神經上皮各層均向玻璃體腔方向隆起,外核層可見細胞核排列紊亂,部分核缺失;2C.激光損傷組,激光損傷組3 d,外核層局部出現全層缺損,部分內核層細胞核向外核層缺損部位遷移,可見炎癥細胞浸潤;2D.激光損傷組,損傷后7 d,內核層細胞核及RPE層色素細胞向外核層缺損處遷移增多,炎癥反應減輕 HE ×20
圖2
兩組小鼠視網膜組織病理像。2A.正常組,視網膜各層組織結構完整;2B.激光損傷組,激光損傷后1 d,RPE層局限性增厚隆起,神經上皮各層均向玻璃體腔方向隆起,外核層可見細胞核排列紊亂,部分核缺失;2C.激光損傷組,激光損傷組3 d,外核層局部出現全層缺損,部分內核層細胞核向外核層缺損部位遷移,可見炎癥細胞浸潤;2D.激光損傷組,損傷后7 d,內核層細胞核及RPE層色素細胞向外核層缺損處遷移增多,炎癥反應減輕 HE ×20
實時定量PCR檢測結果顯示,激光損傷組小鼠激光損傷后T1、T3、T7,MCP-1基因相對表達量分別是正常組小鼠的 8.12、18.35、4.98倍。與正常組小鼠MCP-1 基因相對表達量比較,差異均有統計學意義(t=14.329、16.861、5.743,P<0.05)。激光損傷后不 同時間點,激光損傷組MCP-1基因相對表達量兩兩比較,差異均有統計學意義(F=90.532,P<0.05)(圖 3)。
Western blot檢測結果顯示,激光損傷組小鼠激光損傷后T1、T3、T7 ,MCP-1蛋白表達量分別是正常組小鼠的2.2、3.16、1.72倍。與正常組小鼠MCP-1蛋白表達量比較,差異均有統計學意義(t=75.068、54.145、14.653,P<0.05)。激光損傷后不同時間點,激光損傷組MCP-1蛋白表達量兩兩比較,差異均有統計學意義(F=602.464,P<0.05)(圖 4)。
 圖3
兩組激光損傷后不同時間MCP-1基因相對表達量比較。*:P<0.05 ? ?圖 4 兩組激光損傷后不同時間視網膜MCP-1蛋白比較,*:P<0.05
圖3
兩組激光損傷后不同時間MCP-1基因相對表達量比較。*:P<0.05 ? ?圖 4 兩組激光損傷后不同時間視網膜MCP-1蛋白比較,*:P<0.05
3 討論
視網膜激光損傷是一個復雜的病理過程,涉及急性炎癥反應、神經細胞凋亡、膠質細胞增生遷移及瘢痕形成等[2];如激光能量較大,損傷較重,還會伴隨脈絡膜新生血管(CNV)的形成[3]。因此常用于研究視網膜炎癥、老年性黃斑變性、視網膜色素變性以及視網膜營養不良的致病機制及可能的治療方法研究[4-6]。目前已有視網膜激光損傷60 d以上的長期報道[7],病理觀察視網膜組織學、功能學變化,并檢測其間MCP-1的表達變化,尋求MCP-1的表達與炎癥反應及組織破壞進行性發展之間的關系。本研究主要觀察激光損傷后1~7 d即損傷后早期視網膜組織學、功能學變化及MCP-1基因和蛋白的動態表達情況,初步探討兩者之間的關系。結果顯示,激光損傷后視網膜組織結構紊亂,炎癥細胞浸潤,光感受器細胞減少以及外核層缺損進行性擴大;視網膜功能逐漸下降,到后期趨于平穩,T7明暗適應各波振幅與T3比較,差異無統計學意義。說明激光損傷范圍隨時間延長逐漸擴展。損傷后1~3 d,組織破壞進展明顯,外核層缺損范圍迅速擴大,功能上各波振幅下降明顯,但3~7 d,外核層全層缺損直徑變化不如之前顯著,各波振幅下降均不明顯,與組織學結果一致。在早期急性炎癥過程中,MCP-1基因與蛋白表達在損傷后T1顯著增高,T3達到高峰,T7表達水平低于T1,接近正常。
到目前為止,與視網膜激光損傷病理改變及治療相關的一些因子,如血管內皮生長因子、肝細胞生長因子及其受體、趨化因子受體已有較深入地研究[8-10],但仍有許多可能的重要靶點還未引起關注。MCP-1也被稱為CCL2,是CC趨化因子家族的一員,屬趨化因子超家族。人MCP-1由76個氨基酸組成,相對分子質量為13×103。單核和(或)巨噬細胞是其主要來源,上皮細胞、成纖維細胞、小膠質細胞等其他細胞均可表達MCP-1[11],但生理狀態下都呈低表達。其受體主要分布于單核和(或)巨噬細胞表面[12]。在炎癥狀態下,炎癥部位細胞高表達MCP-1,會趨化大量單核細胞遷入血管內膜下,活化為巨噬細胞向炎癥部位遷移并發揮作用。在眼內正常情況下,視網膜神經上皮層及RPE層表達少量的MCP-1[13]。隨著年齡增長或是受到損傷,MCP-1表達增多[14]。已有研究表明,激光損傷導致CNV的模型中有MCP-1高表達,并且導致大量單核和(或)巨噬細胞聚集在視網膜中,這也是影響CNV形成與發展的因素[15]。也有研究表明,炎癥反應中各種炎癥因子及相應炎癥細胞的聚集在糖尿病視網膜病變中起到關鍵作用,被證實與糖尿病視網膜病變發展有一定關聯[16, 17]。
本研究結果顯示,激光損傷后1~3 d組織破壞、功能下降均是進展速度最快的時期,而MCP-1的表達也在損傷3 d達到高峰,此后組織功能學變化減慢,趨于穩定狀態,MCP-1表達也下降,損傷后7 d,蛋白表達與正常組接近。有研究表明,MCP-1表達增高會伴隨大量視網膜內單核和(或)巨噬細胞的浸潤,并活化小膠質細胞,使其分泌更多的致炎因子,從而加速炎癥的進展[17]。而在不引起CNV的輕度激光損傷模型中,炎癥因子的分泌與炎癥細胞的浸潤對損傷的進展更是尤為重要。結合本研究結果和相關文獻[15-17],我們推測MCP-1與視網膜激光損傷進行性發展、視功能進行性下降之間存在因果關聯,MCP-1可能通過影響單核和(或)巨噬細胞的浸潤,引起組織損傷程度的加重與神經元的凋亡,使損傷范圍擴大,視功能下降。
本研究未對MCP-1進行干預來驗證其表達水平與損傷進展間的關系,是本研究工作的不足,有待今后進一步研究證實。