引用本文: 王菁, 蔡萌, 李靜, 田蓉, 林少芬, 田景毅, 李佳, 俞德超, 羅燕. 補體受體1對補體激活的氧化應激狀態下人視網膜色素上皮單層細胞屏障的保護作用. 中華眼底病雜志, 2014, 30(4): 399-403. doi: 10.3760/cma.j.issn.1005-1015.2014.04.016 復制
視網膜色素上皮(RPE)處于氧化應激狀態時易發生補體激活,介導血管內皮生長因子(VEGF)釋放增加,導致RPE單層細胞屏障破壞[1]。補體受體1(CR1)是一種補體調節蛋白,對補體激活旁路途徑和經典途徑有較大抑制作用,可以抑制心肌缺血、心肌壞死以及外周神經損傷中補體激活,從而保護機體避免過度補體激活導致的炎癥反應[2]。但目前有關CR1對補體激活的氧化應激狀態下人RPE(hRPE)細胞屏障的作用研究較少。為此,我們利用原代培養的hRPE細胞和聚酯膜嵌套(Transwell)培養體系建立體外穩定的hRPE單層細胞屏障模型,從細胞水平角度探討CR1對補體激活的氧化應激狀態下hRPE單層細胞屏障的保護作用。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料與試劑
人CR1(信達生物制藥有限公司),胎牛血清(杭州四季青生物工程材料研究所),Dulbecco改良Eagle培養基(DMEM)/F12培養液、胰蛋白酶(美國Gibco公司),蛋白酶抑制劑(美國Roche公司),FUT-175 (美國BD公司),Transwell(美國Corning公司),叔丁基過氧化氫(t-BHP)、普通人血清(NHS)、二甲基亞礬(DMSO,美國Sigma公司),二喹啉甲酸(BCA)蛋白定量試劑盒(美國Thermo公司),RPE65抗體(美國Novus公司),羊抗鼠熒光二抗Alexa Fluor 555(美國Invitrogen公司),人VEGF酶聯免疫吸附試驗(ELISA)試劑盒、人趨化因子配體2(CCL2)ELISA試劑盒(美國R & D公司),人C3a ELISA試劑盒、人C5a ELISA試劑盒、人膜攻擊復合物(MAC)ELISA試劑盒(美國Quidel公司)。
1.2 hRPE細胞的原代培養及鑒定
本實驗通過中山大學中山眼科中心倫理委員會審查批準,并按相關規定進行。hRPE細胞取自中山大學中山眼科中心眼庫提供的健康尸體眼。用眼科剪從赤道部環形剪除眼前節,去除玻璃體,將神經上皮層從RPE層剝離干凈,并在視神經根部剪斷。滅菌磷酸鹽緩沖液(PBS)清洗眼杯2次,眼杯內加入0.25%胰酶,置于37℃溫箱內孵育消化30 min。用含20%胎牛血清的DMEM/F12培養液終止消化,吸管輕輕吹洗眼杯,收集細胞懸液于離心管中,以離心半徑10 cm,1000 r/min離心5 min,棄上清液。再加入10%胎牛血清的DMEM/F12培養液制成細胞懸液,接種于60 mm的培養皿中,置于37℃、5%CO2培養箱中培養,3 d后第一次換液。以后每2~3天換液1次,采用倒置相差顯微鏡觀察細胞每天的貼壁生長情況。hRPE細胞生長近融合時,胰酶消化細胞,按1 :4傳代。
用特異性表達于RPE細胞內的RPE65蛋白抗體進行鑒定原代培養的hRPE細胞。取融合至70%~80%的第3~5代hRPE細胞爬片進行免疫熒光染色。PBS洗滌2次后冷丙酮固定10 min;PBS洗滌3次,5 min/次;0.1%Triton-X-100聯合1%牛血清蛋白封閉滲透性處理30 min;RPE65抗體(1 :250)濕盒中4℃孵育過夜;PBS洗滌3次,5 min/次;孵育二抗(1 :400),室溫避光1 h;PBS洗滌3次,5 min/次;孵育二脒基苯基吲哚(DAPI,1 :2000),室溫避光5 min;PBS洗滌3次,5 min/次;抗熒光衰減封片劑封片,激光共聚焦顯微鏡下觀察并拍照。
1.3 hRPE單層細胞屏障及補體激活的氧化損傷模型建立
參照文獻[3]的方法建立hRPE單層細胞屏障模型。取第3~5代hRPE細胞,按細胞密度4×105個/ml接種于24孔Transwell上室,其預先用含10%胎牛血清的DMEM/F12培養液包被2 h。上室、下室分別加0.5、1.5 ml含10%胎牛血清的DMEM/F12培養液。接種后第3~4天,細胞貼壁生長至融合形成單層,胎牛血清減至1%繼續培養約4周,倒置相差顯微鏡觀察模型建立情況。接種后6、9、12、15、18、21、24、27、30 d,測量跨表皮細胞膜電阻(TER)值。未接種細胞,僅有培養液的實驗孔為空白對照。空白對照組及處理組均設5個復孔,取平均值后進行比較。測量前調零EVOMX電阻測量儀(美國World Precision Instruments公司),并檢測其內部電阻穩定性。Transwell板在室溫平衡30 min。將STX2筷式電極的短臂與長臂分別置于插入式培養池的內、外室,使電極頂端距離聚脂薄膜約0.5 cm。待讀數穩定后記錄數值,每個培養池測量3次,取平均值。上皮細胞單層凈電阻值=(實際測量值-空白對照值)×上皮細胞單層的有效面積[4]。以hRPE細胞接種3周后的單層細胞屏障,其TER值達55~60 Ω cm2時表明hRPE單層細胞屏障功能形成[5],用于以下各個實驗。
參照文獻[6]的方法建立補體激活的氧化損傷模型。模型建立前,hRPE單層細胞改用無血清DMEM/F12培養液培養5~7 d,換液2~3次,以排除胎牛血清中補體成分對hRPE細胞補體激活的影響。Transwell上室中均加入終濃度為500 μmol/L的t-BHP和10% NHS。NHS為hRPE細胞補體反應提供補體成分。建模后1、2、4、6 h,檢測TER值以觀察補體激活的氧化損傷對hRPE單層細胞屏障的影響,從而確定藥物的作用時間。
1.4 TER值及VEGF、CCL2、C3a、C5a、MAC蛋白量檢測
將補體激活的氧化應激狀態下hRPE單層細胞屏障分為模型組和CR1治療組,未經t-BHP、NHS及藥物處理的正常hRPE單層細胞為正常對照組。模型組和CR1治療組同時加入t-BHP和NHS后,模型組再加入1 μl的PBS,CR1組再加入1 μl的CR1溶液使其終濃度為1 μg/ml。培養4 h后,檢測各組TER值。
收集兩組細胞培養4 h后上室的培養液,加入蛋白酶抑制劑及FUT-175分別抑制蛋白質裂解和體外補體激活。BCA蛋白定量法檢測細胞培養上清液中總蛋白濃度后進行ELISA實驗。提前30 min從冰箱中取出人VEGF和CCL2的ELISA試劑盒,平衡至室溫。用樣本稀釋液按1 :50稀釋標本,除空白孔外,分別將500 μl分析液與200 μl標本或標準樣品加入反應孔中,貼上膠條密封,室溫孵育2 h,洗滌3次;以200 μl/孔加入酶結合的生物素化抗體工作液,室溫孵育2 h,洗滌3次;以200 μl/孔加入底物液,室溫避光孵育20 min;以50 μl/孔加入終止液,混勻后30 min內酶標儀上測量波長450 nm處的吸光度[A,舊稱光密度(OD)]值,波長570 nm處A值用于校正。根據標準曲線和總蛋白濃度,計算每毫克總蛋白中VEGF和CCL2的蛋白量。
采用與VEGF和CCL2蛋白量檢測的相同方法,計算每毫克總蛋白中C3a、C5a、MAC的蛋白量。開始實驗前用洗滌液將反應孔洗滌3次。用樣本稀釋液按1 :20稀釋標本,除空白孔外,分別將100 μl標本或標準樣品加入反應孔中,貼上膠條密封,室溫孵育1 h,洗滌4次;以100 μl/孔加酶結合的生物素化抗體工作液,室溫孵育1 h,洗滌4次;以100 μl/孔加入底物液,室溫避光孵育15 min;以100 μl/孔加入終止液。
1.5 統計學方法
采用SPSS 16.0統計軟件行統計學分析,實驗數據以均數±標準差(
2 結果
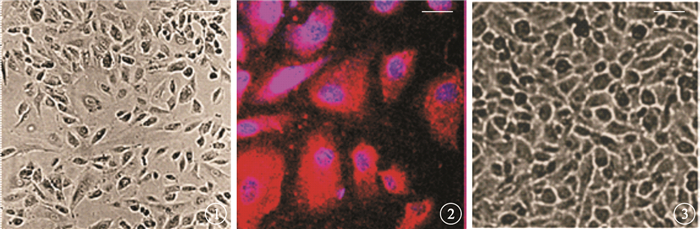
倒置相差顯微鏡觀察發現,第4代hRPE細胞接種于培養皿2 d后,可見細胞貼壁生長,細胞呈多角形,部分細胞可見黑色色素顆粒(圖 1)。激光共聚焦顯微鏡觀察發現,培養的hRPE細胞漿表達特異性的RPE65,呈紅色熒光;細胞核被DAPI標記,呈藍色熒光(圖 2)。倒置相差顯微鏡觀察發現,Transwell中培養第15天,hRPE細胞形成單層細胞屏障,緊密排列生長的細胞呈六角形,部分細胞可見黑色色素顆粒(圖 3)。hRPE單層細胞屏障于接種后3周穩定形成。
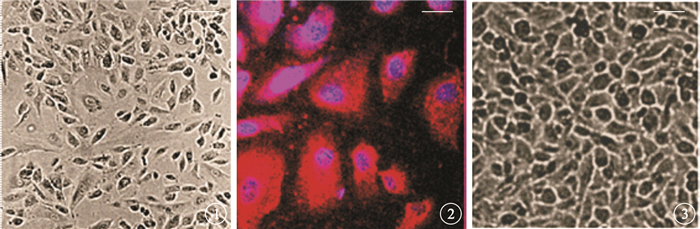 圖1
hRPE細胞倒置相差顯微鏡像。可見細胞貼壁生長,部分細胞可見黑色色素顆粒??標尺:400 μm??圖 2??hRPE細胞激光共聚焦顯微鏡。可見細胞漿中表達特異性RPE65蛋白,呈紅色熒光;細胞核被DAPI標記,呈藍色熒光免疫熒光染色??標尺:200 μm??圖 3??單層hRPE細胞屏障倒置相差顯微鏡像。可見形成單層屏障的hRPE細胞呈六角形,部分細胞可見黑色色素顆粒??標尺:400 μm
圖1
hRPE細胞倒置相差顯微鏡像。可見細胞貼壁生長,部分細胞可見黑色色素顆粒??標尺:400 μm??圖 2??hRPE細胞激光共聚焦顯微鏡。可見細胞漿中表達特異性RPE65蛋白,呈紅色熒光;細胞核被DAPI標記,呈藍色熒光免疫熒光染色??標尺:200 μm??圖 3??單層hRPE細胞屏障倒置相差顯微鏡像。可見形成單層屏障的hRPE細胞呈六角形,部分細胞可見黑色色素顆粒??標尺:400 μm
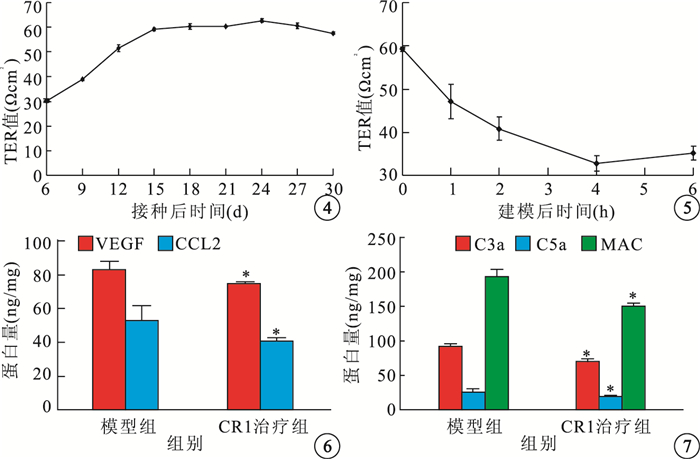
hRPE單層細胞屏障建立過程中,TER值隨培養時間的延長逐漸增大(圖 4)。接種后6 d,TER值為(30.23±0.69) Ωcm2。接種后9、12 d,TER值增加幅度明顯;分別與接種后6 d的TER值比較,差異均有統計學意義(t=8.65、21.31,P<0.05)。接種后15、18、21、24、27、30 d,TER值維持在55~60 Ωcm2,較接種后6 d明顯增高;分別與接種后6 d的TER值比較,差異均有統計學意義(t=28.92、30.09、 30.17、32.38、30.37、27.32,P<0.05)。
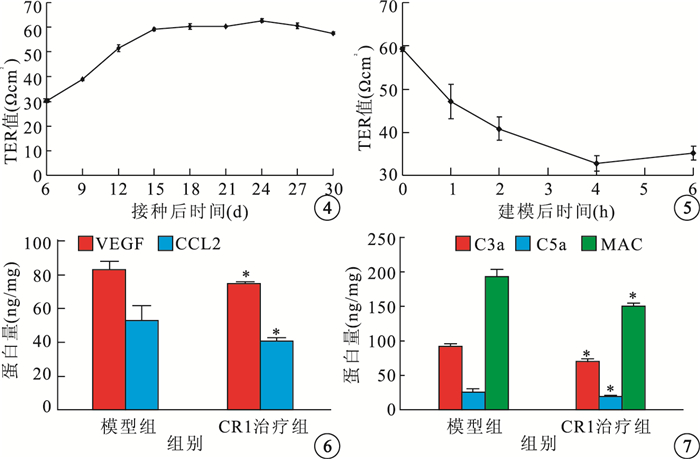 圖4
hRPE細胞接種后不同時間TER值變化曲線??圖 5??補體激活的氧化損傷建模后不同時間TER值變化曲線??圖 6??模型組、CR1治療組VEGF、CCL2蛋白量比較。*:與模型組比較,P<0.05??圖 7??模型組、CR1治療組C3a、C5a、MAC蛋白量比較。*:與模型組比較,P<0.05
圖4
hRPE細胞接種后不同時間TER值變化曲線??圖 5??補體激活的氧化損傷建模后不同時間TER值變化曲線??圖 6??模型組、CR1治療組VEGF、CCL2蛋白量比較。*:與模型組比較,P<0.05??圖 7??模型組、CR1治療組C3a、C5a、MAC蛋白量比較。*:與模型組比較,P<0.05
補體激活的氧化損傷可損傷hRPE單層細胞屏障功能,隨著作用時間的延長,TER值逐漸下降(圖 5)。建模后1、2、4、6 h,TER值分別為(47.16±3.40)、 (40.82±2.70)、(32.79±1.82)、(35.2±1.58) Ωcm2。與建模后4 h的TER值比較,建模后1、2 h的TER值明顯降低,差異有統計學意義(t=14.37、8.02,P<0.05);建模后6 h的TER值有所升高,但差異無統計學意義(t=2.41,P>0.05)。
模型組補體激活的氧化損傷hRPE細胞TER值為(31.95±3.45)Ωcm2,降至正常hRPE細胞的54.01%;與正常hRPE細胞的TER值比較,差異有統計學意義(t=27.20,P<0.05)。CR1治療組補體激活的氧化損傷hRPE細胞的TER值為(34.55±2.08) Ωcm2,達正常hRPE細胞的63.48%;與正常hRPE細胞的TER值比較,差異有統計學意義(t=20.60,P<0.05)。與模型組相比,CR1治療組TER值顯著提高,差異有統計學意義(t=6.60,P<0.05)。
模型組、CR1治療組VEGF蛋白量分別為(83.32±4.51)、(73.40±0.88) pg/mg。CR1治療組VEGF蛋白量較模型組下降了11.48%,差異有統計學意義(t=3.26,P<0.05)。模型組、CR1治療組CCL2蛋白量分別為(53.08±7.10)、(43.63±1.79) pg/mg。CR1治療組CCL2蛋白量較模型組下降了23.47%,差異有統計學意義(t=2.43,P<0.05)(圖 6)。
模型組C3a、C5a、MAC蛋白量分別為(92.38±3.40)、(25.48±4.55)、(193.72±10.07) ng/mg。CR1治療組C3a、C5a、MAC蛋白量分別為(70.24±1.89)、(18.38±1.05)、(150.25±4.06) ng/mg。CR1治療組C3a、C5a、MAC蛋白量較模型組分別下降了24.00%、27.87%、22.44%,差異均有統計學意義(t=9.86、2.63、6.94,P<0.05)(圖 7)。
3 討論
補體激活與氧化損傷在老年性黃斑變性(AMD)的發病機制中關系密切,相互協同[1, 7]。我們通過建立體外穩定的hRPE單層細胞屏障模型,模擬了AMD視網膜RPE外屏障受損的病理環境,以研究補體激活與氧化損傷對視網膜外屏障功能的影響。TER值是hRPE屏障功能的良好反映指標;氧化損傷、補體激活以及多種炎癥反應因子分泌增加均可破壞hRPE屏障功能,從而導致TER值下降[1, 3, 8-10]。TER值降至正常hRPE細胞的60%以下,被認為補體激活的氧化損傷模型建立良好[11]。本研究結果顯示,模型組TER值下降至正常hRPE細胞的54.01%,證明模型建立成功。
VEGF是影響hRPE細胞屏障功能的重要因子,氧化應激狀態的hRPE細胞分泌VEGF的水平明顯增高[8]。本研究結果顯示,CR1治療組VEGF蛋白量較模型組下降了11.48%。說明CR1可明顯抑制補體激活的氧化損傷hRPE細胞分泌VEGF。提示CR1可能通過補體調節的某些機制調控VEGF的表達。
補體C3裂解為C3a和C3b,是補體激活三大途徑中的重要過程;C5a和MAC的水平是補體激活終末階段的重要標志[12, 13]。CR1作為補體調節蛋白,發揮抑制補體激活的作用,與AMD發生發展密切相關。本研究結果顯示,與模型組比較,CR1治療組C3a、C5a、MAC蛋白量明顯下降。提示CR1可抑制氧化損傷hRPE單層細胞的補體激活。
RPE作為血視網膜外屏障的一部分,通過分泌CCL2等促炎性細胞因子而參與眼內炎癥反應[14]。研究表明,氧化損傷導致的CCL2表達升高是慢性光損傷誘導AMD的致病因素,通過拮抗CCL2受體,可有效抑制脈絡膜組織中巨噬細胞的聚集、VEGF的分泌和脈絡膜新生血管(CNV)的形成[15]。Liu等[16]通過建立激光誘導的CNV動物模型,發現MAC在CCL2上游,通過調控RPE分泌CCL2而抑制VEGF的表達。但這一調控機制尚未在細胞實驗中證實,僅在hRPE細胞實驗中發現MAC可誘導單層hRPE細胞分泌VEGF的水平增高[17]。除了MAC,玻璃體腔注射C3a和C5a也可誘導小鼠CNV形成,其機制是C3a和C5a促進脈絡膜組織VEGF生成增多[18]。但C3a、C5a與炎癥因子的關系以及其調控的VEGF的關系尚不明確。本研究結果顯示,CR1治療組CCL2蛋白量較模型組下降了23.47%。說明CR1可明顯抑制補體激活的氧化損傷hRPE細胞分泌CCL2的水平。據此我們推測,CR1可能通過下調補體成分C3a、C5a、MAC以及CCL2、VEGF的表達以保護補體激活的氧化損傷狀態下hRPE單層細胞的屏障功能。
本研究結果表明,CR1對補體激活的氧化應激狀態下hRPE單層細胞屏障具有保護作用,抑制補體激活、下調CCL2和VEGF表達可能是其機制。但有關CR1如何通過抑制補體激活而調控hRPE細胞分泌CCL2、VEGF表達還需要進一步研究來探討。
視網膜色素上皮(RPE)處于氧化應激狀態時易發生補體激活,介導血管內皮生長因子(VEGF)釋放增加,導致RPE單層細胞屏障破壞[1]。補體受體1(CR1)是一種補體調節蛋白,對補體激活旁路途徑和經典途徑有較大抑制作用,可以抑制心肌缺血、心肌壞死以及外周神經損傷中補體激活,從而保護機體避免過度補體激活導致的炎癥反應[2]。但目前有關CR1對補體激活的氧化應激狀態下人RPE(hRPE)細胞屏障的作用研究較少。為此,我們利用原代培養的hRPE細胞和聚酯膜嵌套(Transwell)培養體系建立體外穩定的hRPE單層細胞屏障模型,從細胞水平角度探討CR1對補體激活的氧化應激狀態下hRPE單層細胞屏障的保護作用。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料與試劑
人CR1(信達生物制藥有限公司),胎牛血清(杭州四季青生物工程材料研究所),Dulbecco改良Eagle培養基(DMEM)/F12培養液、胰蛋白酶(美國Gibco公司),蛋白酶抑制劑(美國Roche公司),FUT-175 (美國BD公司),Transwell(美國Corning公司),叔丁基過氧化氫(t-BHP)、普通人血清(NHS)、二甲基亞礬(DMSO,美國Sigma公司),二喹啉甲酸(BCA)蛋白定量試劑盒(美國Thermo公司),RPE65抗體(美國Novus公司),羊抗鼠熒光二抗Alexa Fluor 555(美國Invitrogen公司),人VEGF酶聯免疫吸附試驗(ELISA)試劑盒、人趨化因子配體2(CCL2)ELISA試劑盒(美國R & D公司),人C3a ELISA試劑盒、人C5a ELISA試劑盒、人膜攻擊復合物(MAC)ELISA試劑盒(美國Quidel公司)。
1.2 hRPE細胞的原代培養及鑒定
本實驗通過中山大學中山眼科中心倫理委員會審查批準,并按相關規定進行。hRPE細胞取自中山大學中山眼科中心眼庫提供的健康尸體眼。用眼科剪從赤道部環形剪除眼前節,去除玻璃體,將神經上皮層從RPE層剝離干凈,并在視神經根部剪斷。滅菌磷酸鹽緩沖液(PBS)清洗眼杯2次,眼杯內加入0.25%胰酶,置于37℃溫箱內孵育消化30 min。用含20%胎牛血清的DMEM/F12培養液終止消化,吸管輕輕吹洗眼杯,收集細胞懸液于離心管中,以離心半徑10 cm,1000 r/min離心5 min,棄上清液。再加入10%胎牛血清的DMEM/F12培養液制成細胞懸液,接種于60 mm的培養皿中,置于37℃、5%CO2培養箱中培養,3 d后第一次換液。以后每2~3天換液1次,采用倒置相差顯微鏡觀察細胞每天的貼壁生長情況。hRPE細胞生長近融合時,胰酶消化細胞,按1 :4傳代。
用特異性表達于RPE細胞內的RPE65蛋白抗體進行鑒定原代培養的hRPE細胞。取融合至70%~80%的第3~5代hRPE細胞爬片進行免疫熒光染色。PBS洗滌2次后冷丙酮固定10 min;PBS洗滌3次,5 min/次;0.1%Triton-X-100聯合1%牛血清蛋白封閉滲透性處理30 min;RPE65抗體(1 :250)濕盒中4℃孵育過夜;PBS洗滌3次,5 min/次;孵育二抗(1 :400),室溫避光1 h;PBS洗滌3次,5 min/次;孵育二脒基苯基吲哚(DAPI,1 :2000),室溫避光5 min;PBS洗滌3次,5 min/次;抗熒光衰減封片劑封片,激光共聚焦顯微鏡下觀察并拍照。
1.3 hRPE單層細胞屏障及補體激活的氧化損傷模型建立
參照文獻[3]的方法建立hRPE單層細胞屏障模型。取第3~5代hRPE細胞,按細胞密度4×105個/ml接種于24孔Transwell上室,其預先用含10%胎牛血清的DMEM/F12培養液包被2 h。上室、下室分別加0.5、1.5 ml含10%胎牛血清的DMEM/F12培養液。接種后第3~4天,細胞貼壁生長至融合形成單層,胎牛血清減至1%繼續培養約4周,倒置相差顯微鏡觀察模型建立情況。接種后6、9、12、15、18、21、24、27、30 d,測量跨表皮細胞膜電阻(TER)值。未接種細胞,僅有培養液的實驗孔為空白對照。空白對照組及處理組均設5個復孔,取平均值后進行比較。測量前調零EVOMX電阻測量儀(美國World Precision Instruments公司),并檢測其內部電阻穩定性。Transwell板在室溫平衡30 min。將STX2筷式電極的短臂與長臂分別置于插入式培養池的內、外室,使電極頂端距離聚脂薄膜約0.5 cm。待讀數穩定后記錄數值,每個培養池測量3次,取平均值。上皮細胞單層凈電阻值=(實際測量值-空白對照值)×上皮細胞單層的有效面積[4]。以hRPE細胞接種3周后的單層細胞屏障,其TER值達55~60 Ω cm2時表明hRPE單層細胞屏障功能形成[5],用于以下各個實驗。
參照文獻[6]的方法建立補體激活的氧化損傷模型。模型建立前,hRPE單層細胞改用無血清DMEM/F12培養液培養5~7 d,換液2~3次,以排除胎牛血清中補體成分對hRPE細胞補體激活的影響。Transwell上室中均加入終濃度為500 μmol/L的t-BHP和10% NHS。NHS為hRPE細胞補體反應提供補體成分。建模后1、2、4、6 h,檢測TER值以觀察補體激活的氧化損傷對hRPE單層細胞屏障的影響,從而確定藥物的作用時間。
1.4 TER值及VEGF、CCL2、C3a、C5a、MAC蛋白量檢測
將補體激活的氧化應激狀態下hRPE單層細胞屏障分為模型組和CR1治療組,未經t-BHP、NHS及藥物處理的正常hRPE單層細胞為正常對照組。模型組和CR1治療組同時加入t-BHP和NHS后,模型組再加入1 μl的PBS,CR1組再加入1 μl的CR1溶液使其終濃度為1 μg/ml。培養4 h后,檢測各組TER值。
收集兩組細胞培養4 h后上室的培養液,加入蛋白酶抑制劑及FUT-175分別抑制蛋白質裂解和體外補體激活。BCA蛋白定量法檢測細胞培養上清液中總蛋白濃度后進行ELISA實驗。提前30 min從冰箱中取出人VEGF和CCL2的ELISA試劑盒,平衡至室溫。用樣本稀釋液按1 :50稀釋標本,除空白孔外,分別將500 μl分析液與200 μl標本或標準樣品加入反應孔中,貼上膠條密封,室溫孵育2 h,洗滌3次;以200 μl/孔加入酶結合的生物素化抗體工作液,室溫孵育2 h,洗滌3次;以200 μl/孔加入底物液,室溫避光孵育20 min;以50 μl/孔加入終止液,混勻后30 min內酶標儀上測量波長450 nm處的吸光度[A,舊稱光密度(OD)]值,波長570 nm處A值用于校正。根據標準曲線和總蛋白濃度,計算每毫克總蛋白中VEGF和CCL2的蛋白量。
采用與VEGF和CCL2蛋白量檢測的相同方法,計算每毫克總蛋白中C3a、C5a、MAC的蛋白量。開始實驗前用洗滌液將反應孔洗滌3次。用樣本稀釋液按1 :20稀釋標本,除空白孔外,分別將100 μl標本或標準樣品加入反應孔中,貼上膠條密封,室溫孵育1 h,洗滌4次;以100 μl/孔加酶結合的生物素化抗體工作液,室溫孵育1 h,洗滌4次;以100 μl/孔加入底物液,室溫避光孵育15 min;以100 μl/孔加入終止液。
1.5 統計學方法
采用SPSS 16.0統計軟件行統計學分析,實驗數據以均數±標準差(
2 結果
倒置相差顯微鏡觀察發現,第4代hRPE細胞接種于培養皿2 d后,可見細胞貼壁生長,細胞呈多角形,部分細胞可見黑色色素顆粒(圖 1)。激光共聚焦顯微鏡觀察發現,培養的hRPE細胞漿表達特異性的RPE65,呈紅色熒光;細胞核被DAPI標記,呈藍色熒光(圖 2)。倒置相差顯微鏡觀察發現,Transwell中培養第15天,hRPE細胞形成單層細胞屏障,緊密排列生長的細胞呈六角形,部分細胞可見黑色色素顆粒(圖 3)。hRPE單層細胞屏障于接種后3周穩定形成。
 圖1
hRPE細胞倒置相差顯微鏡像。可見細胞貼壁生長,部分細胞可見黑色色素顆粒??標尺:400 μm??圖 2??hRPE細胞激光共聚焦顯微鏡。可見細胞漿中表達特異性RPE65蛋白,呈紅色熒光;細胞核被DAPI標記,呈藍色熒光免疫熒光染色??標尺:200 μm??圖 3??單層hRPE細胞屏障倒置相差顯微鏡像。可見形成單層屏障的hRPE細胞呈六角形,部分細胞可見黑色色素顆粒??標尺:400 μm
圖1
hRPE細胞倒置相差顯微鏡像。可見細胞貼壁生長,部分細胞可見黑色色素顆粒??標尺:400 μm??圖 2??hRPE細胞激光共聚焦顯微鏡。可見細胞漿中表達特異性RPE65蛋白,呈紅色熒光;細胞核被DAPI標記,呈藍色熒光免疫熒光染色??標尺:200 μm??圖 3??單層hRPE細胞屏障倒置相差顯微鏡像。可見形成單層屏障的hRPE細胞呈六角形,部分細胞可見黑色色素顆粒??標尺:400 μm
hRPE單層細胞屏障建立過程中,TER值隨培養時間的延長逐漸增大(圖 4)。接種后6 d,TER值為(30.23±0.69) Ωcm2。接種后9、12 d,TER值增加幅度明顯;分別與接種后6 d的TER值比較,差異均有統計學意義(t=8.65、21.31,P<0.05)。接種后15、18、21、24、27、30 d,TER值維持在55~60 Ωcm2,較接種后6 d明顯增高;分別與接種后6 d的TER值比較,差異均有統計學意義(t=28.92、30.09、 30.17、32.38、30.37、27.32,P<0.05)。
 圖4
hRPE細胞接種后不同時間TER值變化曲線??圖 5??補體激活的氧化損傷建模后不同時間TER值變化曲線??圖 6??模型組、CR1治療組VEGF、CCL2蛋白量比較。*:與模型組比較,P<0.05??圖 7??模型組、CR1治療組C3a、C5a、MAC蛋白量比較。*:與模型組比較,P<0.05
圖4
hRPE細胞接種后不同時間TER值變化曲線??圖 5??補體激活的氧化損傷建模后不同時間TER值變化曲線??圖 6??模型組、CR1治療組VEGF、CCL2蛋白量比較。*:與模型組比較,P<0.05??圖 7??模型組、CR1治療組C3a、C5a、MAC蛋白量比較。*:與模型組比較,P<0.05
補體激活的氧化損傷可損傷hRPE單層細胞屏障功能,隨著作用時間的延長,TER值逐漸下降(圖 5)。建模后1、2、4、6 h,TER值分別為(47.16±3.40)、 (40.82±2.70)、(32.79±1.82)、(35.2±1.58) Ωcm2。與建模后4 h的TER值比較,建模后1、2 h的TER值明顯降低,差異有統計學意義(t=14.37、8.02,P<0.05);建模后6 h的TER值有所升高,但差異無統計學意義(t=2.41,P>0.05)。
模型組補體激活的氧化損傷hRPE細胞TER值為(31.95±3.45)Ωcm2,降至正常hRPE細胞的54.01%;與正常hRPE細胞的TER值比較,差異有統計學意義(t=27.20,P<0.05)。CR1治療組補體激活的氧化損傷hRPE細胞的TER值為(34.55±2.08) Ωcm2,達正常hRPE細胞的63.48%;與正常hRPE細胞的TER值比較,差異有統計學意義(t=20.60,P<0.05)。與模型組相比,CR1治療組TER值顯著提高,差異有統計學意義(t=6.60,P<0.05)。
模型組、CR1治療組VEGF蛋白量分別為(83.32±4.51)、(73.40±0.88) pg/mg。CR1治療組VEGF蛋白量較模型組下降了11.48%,差異有統計學意義(t=3.26,P<0.05)。模型組、CR1治療組CCL2蛋白量分別為(53.08±7.10)、(43.63±1.79) pg/mg。CR1治療組CCL2蛋白量較模型組下降了23.47%,差異有統計學意義(t=2.43,P<0.05)(圖 6)。
模型組C3a、C5a、MAC蛋白量分別為(92.38±3.40)、(25.48±4.55)、(193.72±10.07) ng/mg。CR1治療組C3a、C5a、MAC蛋白量分別為(70.24±1.89)、(18.38±1.05)、(150.25±4.06) ng/mg。CR1治療組C3a、C5a、MAC蛋白量較模型組分別下降了24.00%、27.87%、22.44%,差異均有統計學意義(t=9.86、2.63、6.94,P<0.05)(圖 7)。
3 討論
補體激活與氧化損傷在老年性黃斑變性(AMD)的發病機制中關系密切,相互協同[1, 7]。我們通過建立體外穩定的hRPE單層細胞屏障模型,模擬了AMD視網膜RPE外屏障受損的病理環境,以研究補體激活與氧化損傷對視網膜外屏障功能的影響。TER值是hRPE屏障功能的良好反映指標;氧化損傷、補體激活以及多種炎癥反應因子分泌增加均可破壞hRPE屏障功能,從而導致TER值下降[1, 3, 8-10]。TER值降至正常hRPE細胞的60%以下,被認為補體激活的氧化損傷模型建立良好[11]。本研究結果顯示,模型組TER值下降至正常hRPE細胞的54.01%,證明模型建立成功。
VEGF是影響hRPE細胞屏障功能的重要因子,氧化應激狀態的hRPE細胞分泌VEGF的水平明顯增高[8]。本研究結果顯示,CR1治療組VEGF蛋白量較模型組下降了11.48%。說明CR1可明顯抑制補體激活的氧化損傷hRPE細胞分泌VEGF。提示CR1可能通過補體調節的某些機制調控VEGF的表達。
補體C3裂解為C3a和C3b,是補體激活三大途徑中的重要過程;C5a和MAC的水平是補體激活終末階段的重要標志[12, 13]。CR1作為補體調節蛋白,發揮抑制補體激活的作用,與AMD發生發展密切相關。本研究結果顯示,與模型組比較,CR1治療組C3a、C5a、MAC蛋白量明顯下降。提示CR1可抑制氧化損傷hRPE單層細胞的補體激活。
RPE作為血視網膜外屏障的一部分,通過分泌CCL2等促炎性細胞因子而參與眼內炎癥反應[14]。研究表明,氧化損傷導致的CCL2表達升高是慢性光損傷誘導AMD的致病因素,通過拮抗CCL2受體,可有效抑制脈絡膜組織中巨噬細胞的聚集、VEGF的分泌和脈絡膜新生血管(CNV)的形成[15]。Liu等[16]通過建立激光誘導的CNV動物模型,發現MAC在CCL2上游,通過調控RPE分泌CCL2而抑制VEGF的表達。但這一調控機制尚未在細胞實驗中證實,僅在hRPE細胞實驗中發現MAC可誘導單層hRPE細胞分泌VEGF的水平增高[17]。除了MAC,玻璃體腔注射C3a和C5a也可誘導小鼠CNV形成,其機制是C3a和C5a促進脈絡膜組織VEGF生成增多[18]。但C3a、C5a與炎癥因子的關系以及其調控的VEGF的關系尚不明確。本研究結果顯示,CR1治療組CCL2蛋白量較模型組下降了23.47%。說明CR1可明顯抑制補體激活的氧化損傷hRPE細胞分泌CCL2的水平。據此我們推測,CR1可能通過下調補體成分C3a、C5a、MAC以及CCL2、VEGF的表達以保護補體激活的氧化損傷狀態下hRPE單層細胞的屏障功能。
本研究結果表明,CR1對補體激活的氧化應激狀態下hRPE單層細胞屏障具有保護作用,抑制補體激活、下調CCL2和VEGF表達可能是其機制。但有關CR1如何通過抑制補體激活而調控hRPE細胞分泌CCL2、VEGF表達還需要進一步研究來探討。