引用本文: 宋偉濤, 張雪詠, 熊思齊, 蔣劍, 文丹, 喻一心, 夏曉波. Notch信號通路抑制劑調控鼠Müller細胞來源的干細胞向神經節細胞分化的研究. 中華眼底病雜志, 2014, 30(4): 395-398. doi: 10.3760/cma.j.issn.1005-1015.2014.04.015 復制
Müller細胞是一種潛在的視網膜干細胞,若能將其定向誘導分化為視網膜神經節細胞,將為青光眼的臨床治療提供新的基因療法[1-4]。視網膜干細胞的定向誘導分化機制十分復雜,主要受細胞外的微環境因素和內在細胞因子的共同調控。研究表明,Notch信號通路的表達上調或下調對小雞和魚類視網膜干細胞的分化有顯著影響;在胚胎視網膜干細胞的發育期,Notch信號通路的激活有助于保持其處于干細胞狀態,而抑制Notch信號通路可誘導干細胞定向分化為神經節細胞[5]。但Notch信號通路對大鼠Müller細胞去分化而來的干細胞是否也具有同樣的調控作用目前報道較少。為此,我們通過培養鼠Müller細胞并去分化為視網膜干細胞,觀察Notch信號通路對視網膜干細胞的調控作用。現將結果報道如下。
1 材料和方法
Sprague Dawley(SD)大鼠20只,鼠齡10~20 d,雌雄不限,無特定病原體級,中南大學湘雅醫學院動物實驗部提供。75%酒精浸泡處死大鼠后,采用改良的不完全胰蛋白酶消化傳代法純化培養Müller細胞[6]。取傳代3次的細胞用于實驗。熒光激活流式細胞分選儀(FACS)和免疫熒光細胞化學染色檢測其純度及特異性表達物谷氨酰胺合成酶(GS)的表達。倒置相差熒光顯微鏡10倍下隨機選取10個非重疊視野,計數細胞并計算表達GS的細胞陽性率。4, 6-聯脒-2-苯基吲哚(DAPI)染色觀察細胞核形態學的改變。逆轉錄-聚合酶鏈反應(RT-PCR)檢測GS和波形蛋白(Vimentin),同時檢測視桿細胞、雙極細胞、神經節細胞、視網膜色素上皮細胞的特異性產物opsin、 mGluR6、 Brn-3b、tyrosinase,明確純化效果。
Müller細胞去分化誘導及神經球傳代培養。取傳代3次的Müller細胞,加入0.25%胰蛋白酶細胞消化液,置于37℃水浴箱中3 min,倒置相差顯微鏡下觀察到貼壁細胞變圓且大部分懸浮時加入去分化培養基終止消化;將細胞懸液移入15 ml離心管中,離心半徑20 cm,800 r/min離心3 min;Dulbecco改良Eagle培養基(DMEM)/F12培養基漂洗1次,重懸后再次離心后加入去分化培養基[DMEM/F12(1 :1),添加劑1倍N2、2倍B27,表皮生長因子(EGF)20 ng/ml,堿性成纖維細胞生長因子(bFGF)10 ng/ml,谷氨酰胺2 mmol/L,青霉素100 U/ml,鏈霉素100 μg/ml],重懸,細胞密度約為1×105個/cm2接種于12孔培養板中,置于37℃, 5%CO2細胞培養箱中培養;之后每3天半量換液1次,觀察細胞增生情況。Müller細胞去分化增生成細胞球后,移入15 ml離心管中,離心半徑20 cm,500 r/min離心5 min,棄上清,加入適量Accutase細胞分離液,重懸細胞球后置于37℃水浴箱中5 min,離心半徑20 cm,500 r/min離心3 min,棄上清,加入去分化培養基重懸,細胞球分散成單個細胞后接種于12孔板,置于37℃細胞培養箱中繼續培養,細胞重新增生形成神經球后再次傳代培養。取傳3代的神經球細胞,以純化后的Müller細胞作對照, 免疫熒光細胞化學染色、RT-PCR、蛋白免疫印跡法(Western blot)檢測視網膜干細胞特異性標記物巢蛋白(Nestin)、Ki-67的表達;5-乙炔基-2′脫氧尿嘧啶核苷(Edu)染色檢測細胞的增生能力。
視網膜干細胞的分化。神經球細胞傳代3次后移入15 ml離心管中,離心半徑20 cm,500 r/min離心5 min,棄上清,加入適量的Accutase細胞分離液,將神經球分離成單個細胞;然后改用含腦源性神經營養因子(BDNF)1 ng/ml 、視磺酸1 μmol/L和1%胎牛血清的DMEM/F12分化培養基重懸視網膜干細胞,調整細胞濃度為1×109個/ml。隨機將視網膜干細胞分為GSI組和對照組,根據實驗手冊分別進行干預后置于37℃細胞培養箱中,培養7 d后分別行采用RT-PCR、Western blot檢測視網膜干細胞特異性表達產物Nestin、Ki-67的表達;Edu檢測細胞增生能力。Western blot和免疫熒光細胞化學雙標染色,檢測分化的視網膜神經節細胞胞體和軸突特異性標記物Thy1.1和Brn-3b的表達;熒光顯微鏡下隨機選取10個視野,計數陽性細胞數,神經節細胞陽性率=Thy1.1+Brn-3b陽性細胞數/DAPI陽性細胞核數×100%。
應用SPSS 13.0統計軟件行統計學分析處理。結果均以均數±標準差(
2 結果
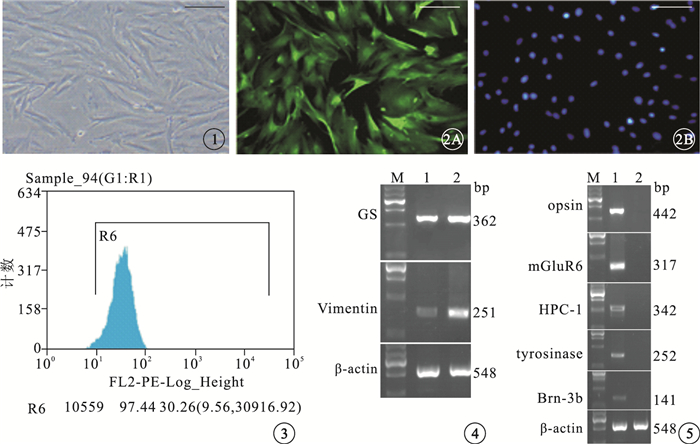
倒置相差顯微鏡觀察結果顯示,傳代3次的Müller細胞胞體呈扁平不規則狀,分布均勻,形態勻稱,細胞漿豐富,折光性強,細胞核呈圓形或卵圓形,相鄰的細胞相互接觸形成網狀(圖 1)。免疫熒光細胞化學檢測結果顯示,細胞漿和細胞核中表達GS的綠色熒光均勻一致;細胞核呈圓形或卵圓形,邊界清晰(圖 2)。Müller細胞的陽性率為(98.5%±1.08)%。FACS檢測結果顯示,細胞純度為97.44%(圖 3)。RT-PCR檢測結果顯示,視網膜組織與純化后的Müller細胞均大量表達GS、Vimentin,其中純化后的Müller細胞表達量更高(圖 4),未見表達其他細胞的特異性產物(圖 5)。
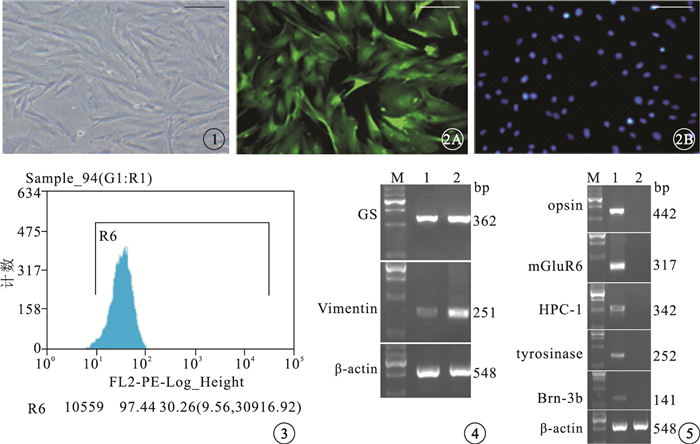 圖1
傳代3次的Müller細胞倒置相差顯微鏡像。細胞分布均勻,形態勻稱,細胞漿豐富,折光性強,相鄰的細胞相互接觸形成網狀??標尺:200 μm??圖 2??培養的Müller細胞免疫熒光細胞化學染色像。2A.細胞分布均勻,細胞漿和細胞核GS呈強陽性,細胞體大,細胞漿豐富,綠色熒光均勻一致??標尺:200 μm;2B.細胞核(藍色)呈圓形或卵圓形,邊界清晰DAPI標尺:200 μm??圖 3??FACS檢測圖。Müller細胞純度為97.44%??圖 4??電泳圖。視網膜組織與純化后的Müller細胞均大量表達GS和Vimentin。M:Marker;1:視網膜組織;2:純化后Müller細胞??圖 5??電泳圖。opsin、mGluR6、Brn-3b、 tyrosinase未見表達。M:Marker;1:視網膜組織;2:純化后Müller細胞
圖1
傳代3次的Müller細胞倒置相差顯微鏡像。細胞分布均勻,形態勻稱,細胞漿豐富,折光性強,相鄰的細胞相互接觸形成網狀??標尺:200 μm??圖 2??培養的Müller細胞免疫熒光細胞化學染色像。2A.細胞分布均勻,細胞漿和細胞核GS呈強陽性,細胞體大,細胞漿豐富,綠色熒光均勻一致??標尺:200 μm;2B.細胞核(藍色)呈圓形或卵圓形,邊界清晰DAPI標尺:200 μm??圖 3??FACS檢測圖。Müller細胞純度為97.44%??圖 4??電泳圖。視網膜組織與純化后的Müller細胞均大量表達GS和Vimentin。M:Marker;1:視網膜組織;2:純化后Müller細胞??圖 5??電泳圖。opsin、mGluR6、Brn-3b、 tyrosinase未見表達。M:Marker;1:視網膜組織;2:純化后Müller細胞
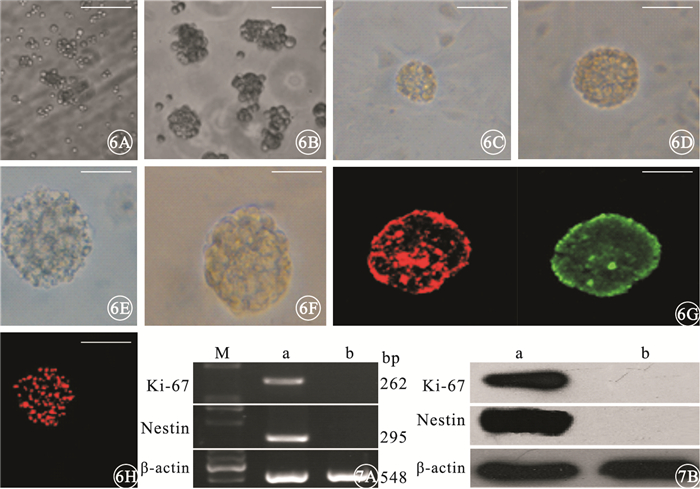
免疫熒光細胞化學染色結果顯示,去分化培養24 h,細胞呈克隆性增生,分裂的細胞聚集成團,形成小細胞球(圖 6A);48~72 h,細胞增生速度顯著加快,細胞體大,細胞漿豐富,細胞球變圓、變大,邊界清晰,折光性強,細胞球立體感明顯,呈懸浮性生長(圖 6B);96 h,細胞球數量增多,體積進一步增大,由于細胞球重量增加,下沉于去分化培養基底部(圖 6C);5 d后,細胞球體積繼續增大,細胞球界限清楚,部分細胞球邊界可見短小毛刺樣突起,折光性強(圖 6D);7 d后,細胞球體積及數量無明顯增加;9~10 d細胞球中央部分折光性降低,可見細胞胞體萎縮、變暗(圖 6E)。神經球傳代培養結果顯示,細胞增生形成新的神經球,細胞球內細胞聚集緊密,密度大,傳至3代增生能力未見減退(圖 6F)。神經細胞球內大部分細胞表達Nestin、Ki-67(圖 6G);細胞核呈紅色熒光(圖 6H)。Nestin、Ki-67、Edu表達率分別為(92.94±6.48)%、(85.96±6.04)%、(82.80±6.65)%。
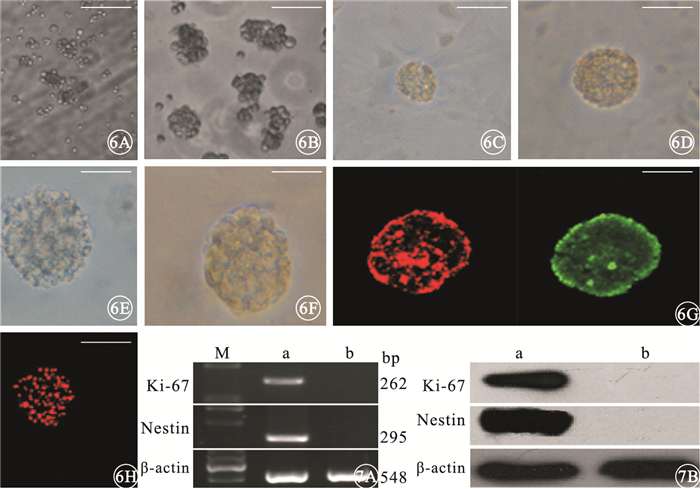 圖6
Müller細胞去分化培養免疫熒光細胞染色像。6A.24h,細胞呈克隆性增生,分裂的細胞聚集成團,形成小細胞球標尺:200 μm;6B.48~72 h,細胞體大,細胞漿豐富,細胞球變大,折光性強,細胞球立體感明顯,呈懸浮性生長標尺:200 μm;6C.96 h后,細胞球體積進一步增大標尺:200 μm;6D.5 d,細胞球體積繼續增大,細胞球界限清楚,部分細胞球邊界可見短小毛刺樣突起,折光性強??標尺:200 μm;6E,9~10 d,細胞球中央部分折光性降低,可見細胞胞體萎縮、變暗標尺:200 μm;6F.傳代3次的細胞球,細胞增生形成新的神經球,細胞球內細胞聚集緊密標尺:200 μm;6G.細胞球均大量表達Nestin(綠色熒光)、Ki-67(紅色熒光)標尺:200 μm;6H.細胞核呈Edu表達陽性的紅色熒光Edu標尺:200 μm??圖 7??電泳圖。7A.神經球細胞中Nestin、Ki-67 mRNA呈高表達,純化后的Müller細胞未見表達;7B.神經球中Nestin、Ki-67蛋白高表達,純化后的Müller細胞表達呈陰性。a:神經球細胞;b:純化后的Müller細胞
圖6
Müller細胞去分化培養免疫熒光細胞染色像。6A.24h,細胞呈克隆性增生,分裂的細胞聚集成團,形成小細胞球標尺:200 μm;6B.48~72 h,細胞體大,細胞漿豐富,細胞球變大,折光性強,細胞球立體感明顯,呈懸浮性生長標尺:200 μm;6C.96 h后,細胞球體積進一步增大標尺:200 μm;6D.5 d,細胞球體積繼續增大,細胞球界限清楚,部分細胞球邊界可見短小毛刺樣突起,折光性強??標尺:200 μm;6E,9~10 d,細胞球中央部分折光性降低,可見細胞胞體萎縮、變暗標尺:200 μm;6F.傳代3次的細胞球,細胞增生形成新的神經球,細胞球內細胞聚集緊密標尺:200 μm;6G.細胞球均大量表達Nestin(綠色熒光)、Ki-67(紅色熒光)標尺:200 μm;6H.細胞核呈Edu表達陽性的紅色熒光Edu標尺:200 μm??圖 7??電泳圖。7A.神經球細胞中Nestin、Ki-67 mRNA呈高表達,純化后的Müller細胞未見表達;7B.神經球中Nestin、Ki-67蛋白高表達,純化后的Müller細胞表達呈陰性。a:神經球細胞;b:純化后的Müller細胞
RT-PCR、Western blot檢測結果顯示,神經球中Nestin、Ki-67 mRNA、蛋白均呈高表達,純化后的Müller細胞中無表達(圖 7)。
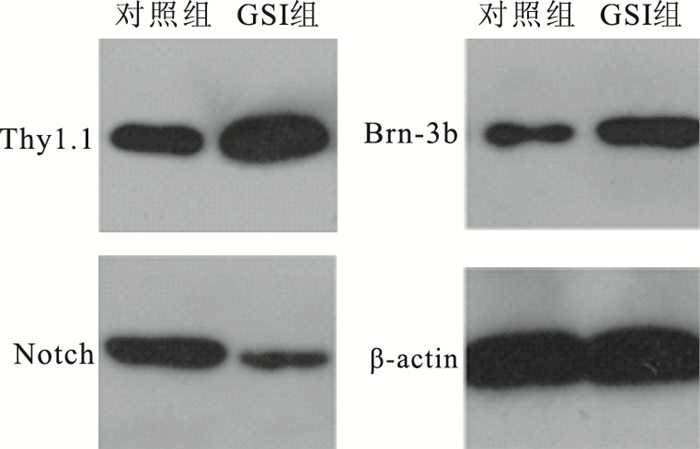
免疫熒光細胞化學雙標染色結果顯示,GSI組、對照組視網膜神經節細胞陽性率分別為(16.98±2.87)%、(11.17±0.71)%。兩組細胞陽性率比較,差異有統計學意義(t=3.210, P=0.002)。Western blot檢測結果顯示,GSI組Thy1.1、Brn-3b表達顯著高于對照組;GSI組Notch表達顯著下降(圖 8)。
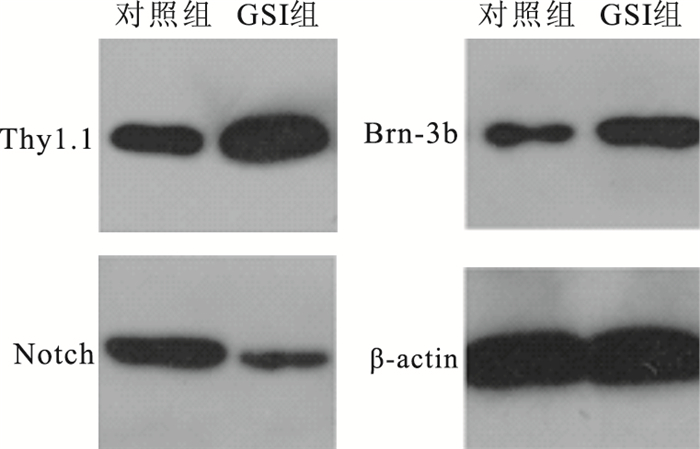 圖8
電泳圖。GSI組Thy1.1、Brn-3b顯著高于對照組,Notch表達在GSI組中顯著下降
圖8
電泳圖。GSI組Thy1.1、Brn-3b顯著高于對照組,Notch表達在GSI組中顯著下降
3 討論
視網膜神經上皮是由神經節細胞、視錐細胞、水平細胞、無長突細胞、視桿細胞、雙極細胞和Müller細胞組成,Müller細胞是一種特殊類型的神經膠質細胞,而其他六種為神經元細胞。盡管Müller細胞是一種膠質細胞,但在維持視網膜神經元細胞正常功能活動中仍發揮重要作用[1, 7-9]:(1)?Müller細胞在胚胎時期可誘導神經元遷移、分化, 維持神經元的生存,促進神經突起的生長,參與視網膜神經網絡的構建;(2)?為視網膜神經元提供營養和能量,并運走和處理代謝產物;(3)?調節視網膜神經元外水、pH值、K+等微環境;(4)?清除突觸間隙內多余的神經遞質-谷氨酸等神經興奮性毒性物質;(5)?合成和分泌神經營養因子等活性物質,維持視網膜神經元的生存和發育;(6)?感受神經元信號, 調節神經元活動。視網膜組織所有類型的細胞中,GS僅表達于Müller細胞[2],故可選擇GS作為唯一特異性標記物來識別Müller細胞。為了進一步鑒定Müller細胞純化的程度,采用RT-PCR對視網膜組織其它類型細胞的特異性表達物如opsin、 mGluR6、Brn-3b、Tyrosinase等進行鑒定,以排除其他細胞污染的可能。本研究結果顯示,純化后的Müller細胞中無其他細胞類型成分表達,說明Müller細胞已從視網膜組織中分離純化出來。
EGF和bFGF是細胞增生過程中重要的有絲分裂原,主要是調節細胞的增生和活性。體外研究發現,條件培養基中加入EGF后BrdU標記的陽性細胞數量明顯增加,表明EGF可調節神經前體細胞的分裂增生[3]。bFGF是嚙齒類動物神經前體細胞的有絲分裂原,這些神經前體細胞可來自胚胎視網膜、皮質、紋狀體、中腦、脊髓以及成年腦的室下區和海馬[4]。bFGF可與EGF等其他因子共同調節神經干細胞的增生[10]。本研究在誘導純化后的Müller細胞去分化時,除了EFG和bFGF兩種必需刺激因子外,還加入N2、B27和谷氨酰胺三種成份。N2和B27屬于EFG和bFGF的輔助刺激因子,可增強EFG和bFGF促有絲分裂活性,而谷氨酰胺則為細胞在增生分裂過程中提供必需的氨基酸。本研究結果表明,在去分化誘導培養基中,Müller細胞可快速去分化增生成神經球,并高表達神經干細胞特異性標志物Nestin和Ki-67;增生能力檢測結果顯示神經球內細胞核內染色呈強陽性。表明原代培養的Müller細胞已成功去分化為視網膜干細胞,并表現出活躍的增生能力,為進一步研究視網膜干細胞的定向分化奠定了基礎。
視網膜干細胞的定向誘導分化機制十分復雜,受大量基因的調控,其中Notch基因是其中重要的調控因子之一[11, 12]。在小雞和魚類等脊椎動物的胚胎視網膜干細胞發育期,Notch信號通路的激活有助于保持其處于干細胞狀態,而抑制Notch信號通路可具有顯著促進胚胎干細胞向神經節細胞定向分化[5]。為了明確Notch信號通路對胚胎干細胞以外的視網膜干細胞是否具有同樣的調控作用,我們選擇Notch信號通路抑制劑GSI干預Müller細胞來源的干細胞。結果表明,Müller細胞去分化而來的干細胞向神經節細胞的分化率提高,說明Notch信號通路是視網膜干細胞在分化過程中重要的負調控通路,而抑制Notch信號通路對視網膜Müller來源的干細胞向神經節細胞的分化具有顯著促進作用。本研究結果將來有可能成為治療青光眼基因治療的新途徑,然而分化后神經節細胞是否能整合入宿主視網膜并具有傳導視覺信號的功能仍有待更進一步深入研究。
Müller細胞是一種潛在的視網膜干細胞,若能將其定向誘導分化為視網膜神經節細胞,將為青光眼的臨床治療提供新的基因療法[1-4]。視網膜干細胞的定向誘導分化機制十分復雜,主要受細胞外的微環境因素和內在細胞因子的共同調控。研究表明,Notch信號通路的表達上調或下調對小雞和魚類視網膜干細胞的分化有顯著影響;在胚胎視網膜干細胞的發育期,Notch信號通路的激活有助于保持其處于干細胞狀態,而抑制Notch信號通路可誘導干細胞定向分化為神經節細胞[5]。但Notch信號通路對大鼠Müller細胞去分化而來的干細胞是否也具有同樣的調控作用目前報道較少。為此,我們通過培養鼠Müller細胞并去分化為視網膜干細胞,觀察Notch信號通路對視網膜干細胞的調控作用。現將結果報道如下。
1 材料和方法
Sprague Dawley(SD)大鼠20只,鼠齡10~20 d,雌雄不限,無特定病原體級,中南大學湘雅醫學院動物實驗部提供。75%酒精浸泡處死大鼠后,采用改良的不完全胰蛋白酶消化傳代法純化培養Müller細胞[6]。取傳代3次的細胞用于實驗。熒光激活流式細胞分選儀(FACS)和免疫熒光細胞化學染色檢測其純度及特異性表達物谷氨酰胺合成酶(GS)的表達。倒置相差熒光顯微鏡10倍下隨機選取10個非重疊視野,計數細胞并計算表達GS的細胞陽性率。4, 6-聯脒-2-苯基吲哚(DAPI)染色觀察細胞核形態學的改變。逆轉錄-聚合酶鏈反應(RT-PCR)檢測GS和波形蛋白(Vimentin),同時檢測視桿細胞、雙極細胞、神經節細胞、視網膜色素上皮細胞的特異性產物opsin、 mGluR6、 Brn-3b、tyrosinase,明確純化效果。
Müller細胞去分化誘導及神經球傳代培養。取傳代3次的Müller細胞,加入0.25%胰蛋白酶細胞消化液,置于37℃水浴箱中3 min,倒置相差顯微鏡下觀察到貼壁細胞變圓且大部分懸浮時加入去分化培養基終止消化;將細胞懸液移入15 ml離心管中,離心半徑20 cm,800 r/min離心3 min;Dulbecco改良Eagle培養基(DMEM)/F12培養基漂洗1次,重懸后再次離心后加入去分化培養基[DMEM/F12(1 :1),添加劑1倍N2、2倍B27,表皮生長因子(EGF)20 ng/ml,堿性成纖維細胞生長因子(bFGF)10 ng/ml,谷氨酰胺2 mmol/L,青霉素100 U/ml,鏈霉素100 μg/ml],重懸,細胞密度約為1×105個/cm2接種于12孔培養板中,置于37℃, 5%CO2細胞培養箱中培養;之后每3天半量換液1次,觀察細胞增生情況。Müller細胞去分化增生成細胞球后,移入15 ml離心管中,離心半徑20 cm,500 r/min離心5 min,棄上清,加入適量Accutase細胞分離液,重懸細胞球后置于37℃水浴箱中5 min,離心半徑20 cm,500 r/min離心3 min,棄上清,加入去分化培養基重懸,細胞球分散成單個細胞后接種于12孔板,置于37℃細胞培養箱中繼續培養,細胞重新增生形成神經球后再次傳代培養。取傳3代的神經球細胞,以純化后的Müller細胞作對照, 免疫熒光細胞化學染色、RT-PCR、蛋白免疫印跡法(Western blot)檢測視網膜干細胞特異性標記物巢蛋白(Nestin)、Ki-67的表達;5-乙炔基-2′脫氧尿嘧啶核苷(Edu)染色檢測細胞的增生能力。
視網膜干細胞的分化。神經球細胞傳代3次后移入15 ml離心管中,離心半徑20 cm,500 r/min離心5 min,棄上清,加入適量的Accutase細胞分離液,將神經球分離成單個細胞;然后改用含腦源性神經營養因子(BDNF)1 ng/ml 、視磺酸1 μmol/L和1%胎牛血清的DMEM/F12分化培養基重懸視網膜干細胞,調整細胞濃度為1×109個/ml。隨機將視網膜干細胞分為GSI組和對照組,根據實驗手冊分別進行干預后置于37℃細胞培養箱中,培養7 d后分別行采用RT-PCR、Western blot檢測視網膜干細胞特異性表達產物Nestin、Ki-67的表達;Edu檢測細胞增生能力。Western blot和免疫熒光細胞化學雙標染色,檢測分化的視網膜神經節細胞胞體和軸突特異性標記物Thy1.1和Brn-3b的表達;熒光顯微鏡下隨機選取10個視野,計數陽性細胞數,神經節細胞陽性率=Thy1.1+Brn-3b陽性細胞數/DAPI陽性細胞核數×100%。
應用SPSS 13.0統計軟件行統計學分析處理。結果均以均數±標準差(
2 結果
倒置相差顯微鏡觀察結果顯示,傳代3次的Müller細胞胞體呈扁平不規則狀,分布均勻,形態勻稱,細胞漿豐富,折光性強,細胞核呈圓形或卵圓形,相鄰的細胞相互接觸形成網狀(圖 1)。免疫熒光細胞化學檢測結果顯示,細胞漿和細胞核中表達GS的綠色熒光均勻一致;細胞核呈圓形或卵圓形,邊界清晰(圖 2)。Müller細胞的陽性率為(98.5%±1.08)%。FACS檢測結果顯示,細胞純度為97.44%(圖 3)。RT-PCR檢測結果顯示,視網膜組織與純化后的Müller細胞均大量表達GS、Vimentin,其中純化后的Müller細胞表達量更高(圖 4),未見表達其他細胞的特異性產物(圖 5)。
 圖1
傳代3次的Müller細胞倒置相差顯微鏡像。細胞分布均勻,形態勻稱,細胞漿豐富,折光性強,相鄰的細胞相互接觸形成網狀??標尺:200 μm??圖 2??培養的Müller細胞免疫熒光細胞化學染色像。2A.細胞分布均勻,細胞漿和細胞核GS呈強陽性,細胞體大,細胞漿豐富,綠色熒光均勻一致??標尺:200 μm;2B.細胞核(藍色)呈圓形或卵圓形,邊界清晰DAPI標尺:200 μm??圖 3??FACS檢測圖。Müller細胞純度為97.44%??圖 4??電泳圖。視網膜組織與純化后的Müller細胞均大量表達GS和Vimentin。M:Marker;1:視網膜組織;2:純化后Müller細胞??圖 5??電泳圖。opsin、mGluR6、Brn-3b、 tyrosinase未見表達。M:Marker;1:視網膜組織;2:純化后Müller細胞
圖1
傳代3次的Müller細胞倒置相差顯微鏡像。細胞分布均勻,形態勻稱,細胞漿豐富,折光性強,相鄰的細胞相互接觸形成網狀??標尺:200 μm??圖 2??培養的Müller細胞免疫熒光細胞化學染色像。2A.細胞分布均勻,細胞漿和細胞核GS呈強陽性,細胞體大,細胞漿豐富,綠色熒光均勻一致??標尺:200 μm;2B.細胞核(藍色)呈圓形或卵圓形,邊界清晰DAPI標尺:200 μm??圖 3??FACS檢測圖。Müller細胞純度為97.44%??圖 4??電泳圖。視網膜組織與純化后的Müller細胞均大量表達GS和Vimentin。M:Marker;1:視網膜組織;2:純化后Müller細胞??圖 5??電泳圖。opsin、mGluR6、Brn-3b、 tyrosinase未見表達。M:Marker;1:視網膜組織;2:純化后Müller細胞
免疫熒光細胞化學染色結果顯示,去分化培養24 h,細胞呈克隆性增生,分裂的細胞聚集成團,形成小細胞球(圖 6A);48~72 h,細胞增生速度顯著加快,細胞體大,細胞漿豐富,細胞球變圓、變大,邊界清晰,折光性強,細胞球立體感明顯,呈懸浮性生長(圖 6B);96 h,細胞球數量增多,體積進一步增大,由于細胞球重量增加,下沉于去分化培養基底部(圖 6C);5 d后,細胞球體積繼續增大,細胞球界限清楚,部分細胞球邊界可見短小毛刺樣突起,折光性強(圖 6D);7 d后,細胞球體積及數量無明顯增加;9~10 d細胞球中央部分折光性降低,可見細胞胞體萎縮、變暗(圖 6E)。神經球傳代培養結果顯示,細胞增生形成新的神經球,細胞球內細胞聚集緊密,密度大,傳至3代增生能力未見減退(圖 6F)。神經細胞球內大部分細胞表達Nestin、Ki-67(圖 6G);細胞核呈紅色熒光(圖 6H)。Nestin、Ki-67、Edu表達率分別為(92.94±6.48)%、(85.96±6.04)%、(82.80±6.65)%。
 圖6
Müller細胞去分化培養免疫熒光細胞染色像。6A.24h,細胞呈克隆性增生,分裂的細胞聚集成團,形成小細胞球標尺:200 μm;6B.48~72 h,細胞體大,細胞漿豐富,細胞球變大,折光性強,細胞球立體感明顯,呈懸浮性生長標尺:200 μm;6C.96 h后,細胞球體積進一步增大標尺:200 μm;6D.5 d,細胞球體積繼續增大,細胞球界限清楚,部分細胞球邊界可見短小毛刺樣突起,折光性強??標尺:200 μm;6E,9~10 d,細胞球中央部分折光性降低,可見細胞胞體萎縮、變暗標尺:200 μm;6F.傳代3次的細胞球,細胞增生形成新的神經球,細胞球內細胞聚集緊密標尺:200 μm;6G.細胞球均大量表達Nestin(綠色熒光)、Ki-67(紅色熒光)標尺:200 μm;6H.細胞核呈Edu表達陽性的紅色熒光Edu標尺:200 μm??圖 7??電泳圖。7A.神經球細胞中Nestin、Ki-67 mRNA呈高表達,純化后的Müller細胞未見表達;7B.神經球中Nestin、Ki-67蛋白高表達,純化后的Müller細胞表達呈陰性。a:神經球細胞;b:純化后的Müller細胞
圖6
Müller細胞去分化培養免疫熒光細胞染色像。6A.24h,細胞呈克隆性增生,分裂的細胞聚集成團,形成小細胞球標尺:200 μm;6B.48~72 h,細胞體大,細胞漿豐富,細胞球變大,折光性強,細胞球立體感明顯,呈懸浮性生長標尺:200 μm;6C.96 h后,細胞球體積進一步增大標尺:200 μm;6D.5 d,細胞球體積繼續增大,細胞球界限清楚,部分細胞球邊界可見短小毛刺樣突起,折光性強??標尺:200 μm;6E,9~10 d,細胞球中央部分折光性降低,可見細胞胞體萎縮、變暗標尺:200 μm;6F.傳代3次的細胞球,細胞增生形成新的神經球,細胞球內細胞聚集緊密標尺:200 μm;6G.細胞球均大量表達Nestin(綠色熒光)、Ki-67(紅色熒光)標尺:200 μm;6H.細胞核呈Edu表達陽性的紅色熒光Edu標尺:200 μm??圖 7??電泳圖。7A.神經球細胞中Nestin、Ki-67 mRNA呈高表達,純化后的Müller細胞未見表達;7B.神經球中Nestin、Ki-67蛋白高表達,純化后的Müller細胞表達呈陰性。a:神經球細胞;b:純化后的Müller細胞
RT-PCR、Western blot檢測結果顯示,神經球中Nestin、Ki-67 mRNA、蛋白均呈高表達,純化后的Müller細胞中無表達(圖 7)。
免疫熒光細胞化學雙標染色結果顯示,GSI組、對照組視網膜神經節細胞陽性率分別為(16.98±2.87)%、(11.17±0.71)%。兩組細胞陽性率比較,差異有統計學意義(t=3.210, P=0.002)。Western blot檢測結果顯示,GSI組Thy1.1、Brn-3b表達顯著高于對照組;GSI組Notch表達顯著下降(圖 8)。
 圖8
電泳圖。GSI組Thy1.1、Brn-3b顯著高于對照組,Notch表達在GSI組中顯著下降
圖8
電泳圖。GSI組Thy1.1、Brn-3b顯著高于對照組,Notch表達在GSI組中顯著下降
3 討論
視網膜神經上皮是由神經節細胞、視錐細胞、水平細胞、無長突細胞、視桿細胞、雙極細胞和Müller細胞組成,Müller細胞是一種特殊類型的神經膠質細胞,而其他六種為神經元細胞。盡管Müller細胞是一種膠質細胞,但在維持視網膜神經元細胞正常功能活動中仍發揮重要作用[1, 7-9]:(1)?Müller細胞在胚胎時期可誘導神經元遷移、分化, 維持神經元的生存,促進神經突起的生長,參與視網膜神經網絡的構建;(2)?為視網膜神經元提供營養和能量,并運走和處理代謝產物;(3)?調節視網膜神經元外水、pH值、K+等微環境;(4)?清除突觸間隙內多余的神經遞質-谷氨酸等神經興奮性毒性物質;(5)?合成和分泌神經營養因子等活性物質,維持視網膜神經元的生存和發育;(6)?感受神經元信號, 調節神經元活動。視網膜組織所有類型的細胞中,GS僅表達于Müller細胞[2],故可選擇GS作為唯一特異性標記物來識別Müller細胞。為了進一步鑒定Müller細胞純化的程度,采用RT-PCR對視網膜組織其它類型細胞的特異性表達物如opsin、 mGluR6、Brn-3b、Tyrosinase等進行鑒定,以排除其他細胞污染的可能。本研究結果顯示,純化后的Müller細胞中無其他細胞類型成分表達,說明Müller細胞已從視網膜組織中分離純化出來。
EGF和bFGF是細胞增生過程中重要的有絲分裂原,主要是調節細胞的增生和活性。體外研究發現,條件培養基中加入EGF后BrdU標記的陽性細胞數量明顯增加,表明EGF可調節神經前體細胞的分裂增生[3]。bFGF是嚙齒類動物神經前體細胞的有絲分裂原,這些神經前體細胞可來自胚胎視網膜、皮質、紋狀體、中腦、脊髓以及成年腦的室下區和海馬[4]。bFGF可與EGF等其他因子共同調節神經干細胞的增生[10]。本研究在誘導純化后的Müller細胞去分化時,除了EFG和bFGF兩種必需刺激因子外,還加入N2、B27和谷氨酰胺三種成份。N2和B27屬于EFG和bFGF的輔助刺激因子,可增強EFG和bFGF促有絲分裂活性,而谷氨酰胺則為細胞在增生分裂過程中提供必需的氨基酸。本研究結果表明,在去分化誘導培養基中,Müller細胞可快速去分化增生成神經球,并高表達神經干細胞特異性標志物Nestin和Ki-67;增生能力檢測結果顯示神經球內細胞核內染色呈強陽性。表明原代培養的Müller細胞已成功去分化為視網膜干細胞,并表現出活躍的增生能力,為進一步研究視網膜干細胞的定向分化奠定了基礎。
視網膜干細胞的定向誘導分化機制十分復雜,受大量基因的調控,其中Notch基因是其中重要的調控因子之一[11, 12]。在小雞和魚類等脊椎動物的胚胎視網膜干細胞發育期,Notch信號通路的激活有助于保持其處于干細胞狀態,而抑制Notch信號通路可具有顯著促進胚胎干細胞向神經節細胞定向分化[5]。為了明確Notch信號通路對胚胎干細胞以外的視網膜干細胞是否具有同樣的調控作用,我們選擇Notch信號通路抑制劑GSI干預Müller細胞來源的干細胞。結果表明,Müller細胞去分化而來的干細胞向神經節細胞的分化率提高,說明Notch信號通路是視網膜干細胞在分化過程中重要的負調控通路,而抑制Notch信號通路對視網膜Müller來源的干細胞向神經節細胞的分化具有顯著促進作用。本研究結果將來有可能成為治療青光眼基因治療的新途徑,然而分化后神經節細胞是否能整合入宿主視網膜并具有傳導視覺信號的功能仍有待更進一步深入研究。