引用本文: 張含, 劉哲麗, 孫鵬, 谷峰. 視網膜下瘢痕形成小鼠視網膜色素上皮-脈絡膜中血管內皮生長因子、促纖維化因子及炎癥因子的表達. 中華眼底病雜志, 2014, 30(4): 381-385. doi: 10.3760/cma.j.issn.1005-1015.2014.04.012 復制
視網膜下瘢痕形成是滲出型老年性黃斑變性(AMD)損傷修復的終末階段,造成光感受器不可逆的損傷[1-3]。瘢痕期或病灶中瘢痕成分較多的滲出型AMD患者,經抗血管內皮生長因子(VEGF)藥物治療后,盡管新生血管消退,但視網膜下瘢痕加速進展,最終造成嚴重視力障礙[1-3]。但目前有關視網膜下瘢痕形成的病理過程及其有效治療手段的研究甚少。為此,我們觀察分析了視網膜下瘢痕形成小鼠視網膜色素上皮(RPE)-脈絡膜組織中VEGF、促纖維化因子及炎癥因子的表達,以探討其分子發病機制,為尋找瘢痕期滲出型AMD患者的最佳治療方法提供理論依據。現將結果報道如下。
1 材料和方法
1.1 主要試劑與實驗儀器及動物模型建立
巰基乙酸、RPMI1640培養液、Masson染色試劑盒(美國Sigma公司),胎牛血清、熒光素標記的抗兔IgG抗體、Trizol試劑(美國Invitrogen公司),膠質纖維酸性蛋白(GFAP)多克隆抗體兔IgG(丹麥Dako公司),逆轉錄聚合酶鏈反應(RT-PCR)試劑盒(德國Roche Diagnostics GmbH公司),SYBR green核酸染料試劑盒(日本TaKaRa Bio公司),蛋白質提取試劑盒(美國Pierce公司),酶聯免疫吸附試驗(ELISA)試劑盒(美國R & D Systems公司)。微量注射針(瑞士Hamilton公司),532 nm二極管激光器(美國Iridex公司)。
7~8周齡雌性C57BL/6(B6)小鼠64只,由日本SLC公司提供。采用激光結合視網膜下注射炎癥巨噬細胞的方法建立視網膜下瘢痕動物模型[4]。小鼠腹腔注射巰基乙酸2.5 ml,3 d后收集腹水,離心收集細胞。重懸細胞于含10%胎牛血清的RPMI1640培養液中,37℃、5%CO2孵箱培養2 h,去除非貼壁細胞,貼壁細胞為腹腔炎癥巨噬細胞。使細胞密度為4×107個/ml,備用。采用532 nm二極管激光,能量200 mW,光斑直徑75 μm,時間0.1 s,擊射后部視網膜,擊破Bruch膜,激光光凝部位產生氣泡。采用微量注射針將0.5 μl的炎癥巨噬細胞注入激光擊射部位的視網膜下,觀察局部視網膜脫離情況。局部出血或無視網膜脫離者不納入實驗。建模后7 d,隨機選取小鼠4只,摘除眼球行Masson染色及脈絡膜鋪片GFAP免疫熒光染色,確認視網膜下瘢痕模型是否建立成功[4]。
1.2 RT-PCR及ELISA檢測
建模前及建模后1、2、3、5、7 d,采用RT-PCR檢測小鼠RPE-脈絡膜組織中VEGF、轉化生長因子(TGF)-β、白細胞介素(IL)-6、IL-10、IL-13的mRNA表達。以β-肌動蛋白(β-actin)作為內參照。各時間點分別處死小鼠6只,取RPE-脈絡膜組織,加入Trizol試劑提取總RNA。以1 μg總RNA為模板,采用RT-PCR試劑盒合成cDNA。VEGF:上游引物5′-GT TCACTGTGAGCCTTGTTCAG-3′,下游引物5′-GT CACATCTGCAAGTACGTTCG-3′,擴增片段長度141堿基對(bp);TGF-β1:上游引物5′-ACGCCTGAG TGGCTGTCTTTTGAC-3′,下游引物5′-GGGCTGATCCCGTTGATTTCCACG-3′,擴增片段長度149 bp;TGF-β2:上游引物5′-GGATGGAAATGGATCCA TGAACCC-3′,下游引物5′-TGTTGTACAGGCTGAGGACTTTGG-3′,擴增片段長度115 bp;TGF-β3:上游引物5′-GATGAGCACATAGCCAAGCA-3′,下游引物5′-ATTGGGCTGAAAGGTGTGAC-3′,擴增片段長度177 bp;IL-6:上游引物5′-TGGAGTCACA GAAGGAGTGGCTAAG-3′,下游引物5′-TCTGAC CACAGTGAGGAATGTCCAC-3′,擴增片段長度155 bp;IL-10:上游引物5′-AACTGCACCCACTTC CCAGTC-3′,下游引物5′-CATTAAGGAGTCGGT TAGCAG-3′,擴增片段長度129 bp;IL-13:上游引物5′-CTCTTGCTTGCCTTGGTGGTCTC-3′,下游引物5′-AGGGAATCCAGGGCTACACAGAA-3′,擴增片段長度192 bp;β-actin:上游引物5′-GATGACCCA GATCATGTTTGA-3′,下游引物5′-GGAGAGCAT AGCCCTCGTAG-3′,擴增片段長度161 bp。PCR反應條件:94℃ 2 min,1個循環;94℃ 30 s,60℃ 30 s,72℃ 40 s,共35個循環。所有樣本重復檢測3次。
分別于建模前及VEGF、TGF-β、IL-6、IL-10、IL-13等因子mRNA表達峰值時處死小鼠8只,取RPE-脈絡膜組織,采用T-PER組織總蛋白抽提試劑提取蛋白質。參照試劑盒說明書行ELISA檢測,測量小鼠RPE-脈絡膜組織中VEGF、總TGF-β1、活性TGF-β1、總TGF-β2、活性TGF-β2、IL-6、IL-10、IL-13的蛋白含量。
1.3 統計學方法
采用SPSS 15.0統計學軟件進行統計分析,實驗數據以均數±標準差(
2 結果
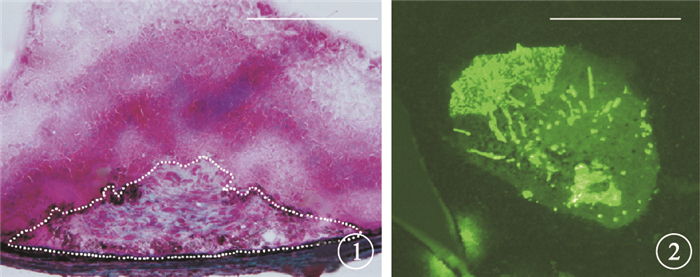
建模后7 d,Masson染色和脈絡膜鋪片GFAP免疫熒光染色檢查證實小鼠視網膜下瘢痕模型建立成功。Masson染色結果顯示,小鼠視網膜下有大量膠原纖維形成,呈淡藍綠色染色(圖 1)。脈絡膜鋪片GFAP免疫熒光染色結果顯示,小鼠視網膜下可見大面積瘢痕組織(圖 2)。
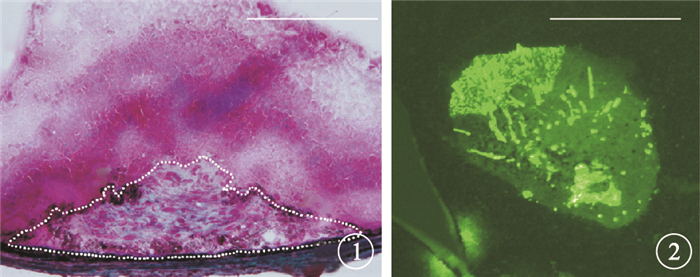 圖1
小鼠眼球Masson染色像。視網膜下有大量膠原纖維形成,呈淡藍綠色染色Masson染色??標尺:50 μm ??圖 2??小鼠視網膜鋪片GFAP免疫熒光染色像。視網膜下可見大面積瘢痕組織GFAP免疫熒光染色??標尺:500 μm
圖1
小鼠眼球Masson染色像。視網膜下有大量膠原纖維形成,呈淡藍綠色染色Masson染色??標尺:50 μm ??圖 2??小鼠視網膜鋪片GFAP免疫熒光染色像。視網膜下可見大面積瘢痕組織GFAP免疫熒光染色??標尺:500 μm
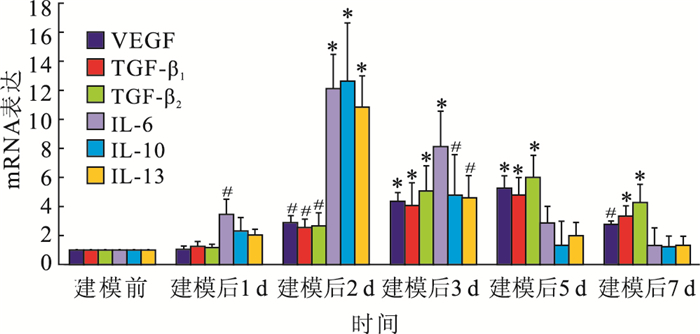
RT-PCR檢查結果顯示,VEGF、TGF-β、IL-6、IL-10、IL-13 mRNA表達在視網膜下瘢痕形成過程中均有不同程度上調。VEGF mRNA表達于建模后2 d表達明顯增加;建模后5 d達到峰值,約為建模前的5~6倍;建模7 d仍高于建模前(圖 3)。TGF-β1、TGF-β2 mRNA表達于建模后2 d表達明顯增加;建模后 5 d達到峰值,約為建模前的5~6倍;之后緩慢下降(圖 3)。IL-6、IL-10、IL-13 mRNA表達于建模后1~2 d表達明顯增加,并于建模后2 d達到峰值,之后迅速下降(圖 3)。建模前后均未檢測到TGF-β3 mRNA表達。建模前與建模后1 d VEGF mRNA表達比較,差異無統計學意義(t=1.62,P>0.05);建模前與建模后2、3、5、7 d VEGF mRNA表達比較,差異有統計學意義(t=2.38、3.65、4.03、2.26,P<0.05)。建模前與建模后1 d TGF-β1、TGF-β2 mRNA表達比較,差異均無統計學意義(t=1.62、1.69,P>0.05);建模前與建模后2、3、5、7 d TGF-β1(t=2.58、3.89、4.37、3.77)、TGF-β2 (t=2.30、4.15、4.20、3.98)mRNA表達比較,差異均有統計學意義(P<0.05)。建模前與建模后1、2、3 d IL-6 mRNA表達比較,差異均有統計學意義(t=2.36、4.54、4.01,P<0.05);建模前與建模5、7 d IL-6 mRNA表達比較,差異均無統計學意義(t=1.63、1.71,P>0.05)。建模前與建模后2、3 d IL-10(t=3.87、2.44)、IL-13 (t=4.20、2.58)mRNA表達比較,差異均有統計學意義(P<0.05);建模前與建模后1、5、7 d IL-10(t=1.97、1.65、1.60)、IL-13 (t=1.84、1.88、1.68)mRNA表達比較,差異均無統計學意義(P>0.05)。
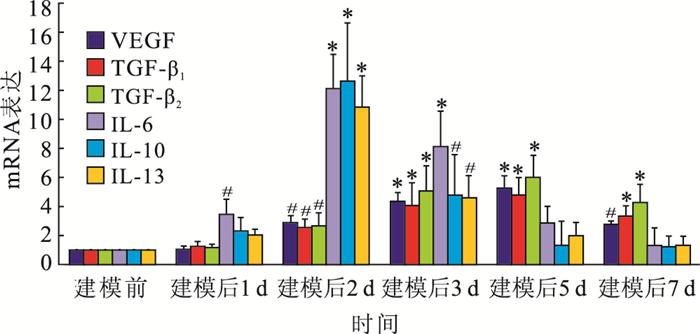 圖3
建模前后VEGF、TGF-β、IL-6、IL-10、IL-13 mRNA表達比較。*:與建模前比較,P<0.05;**:與建模前比較,P<0.01
圖3
建模前后VEGF、TGF-β、IL-6、IL-10、IL-13 mRNA表達比較。*:與建模前比較,P<0.05;**:與建模前比較,P<0.01
建模前,小鼠RPE-脈絡膜組織中VEGF、總TGF-β1、活性TGF-β1、總TGF-β2、活性TGF-β2蛋白含量分別為(18.33±2.51)、(105.04±26.42)、(27.09±4.86)、(113.76±28.11)、(30.40±6.25) pg/mg,未檢測出IL-6、 IL-10及IL-13的蛋白表達。建模后5 d,小鼠RPE-脈絡膜組織中VEGF、總TGF-β1、活性TGF-β1、總TGF-β2、活性TGF-β2蛋白含量分別為(74.90±12.35)、(1384.77±61.34)、(277.83±42.35)、(2191.63±108.34)、(458.06±48.82) pg/mg,較建模前升高約10~20倍。建模前與建模后5 d小鼠RPE-脈絡膜組織中VEGF(t=2.57)、總TGF-β1(t=3.37)、活性TGF-β1(t=2.45)、總TGF-β2(t=3.83)、活性TGF-β2(t=2.74)蛋白含量比較,差異均有統計學意義(P<0.01)。建模后2 d,小鼠RPE-脈絡膜組織中IL-6、IL-10、IL-13蛋白含量分別為(43.59±15.69)、(37.06±10.22)、(23.25±9.35) pg/mg。
3 討論
有研究認為,滲出型AMD的發病機制實質是一種損傷修復過程[5, 6]。在眼內的損傷修復過程中,血管新生與纖維形成存在某種平衡,抗VEGF藥物治療抑制了血管新生過程,打破這種平衡,可以引起過度的纖維增生,瘢痕迅速進展[3]。然而,目前臨床尚無抗視網膜下纖維形成的有效治療方法。為初步明確視網膜下瘢痕形成的病理過程,尋找滲出型AMD新的治療靶點,我們采用激光結合視網膜下注射炎癥巨噬細胞的方法建立視網膜下瘢痕動物模型,觀察了建模前后小鼠RPE-脈絡膜組織中VEGF、TGF-β、IL-6、IL-10、IL-13的mRNA和蛋白表達。組織病理學檢查發現,該模型可以模擬進展期和瘢痕期滲出型AMD的改變,被認為是研究視網膜下瘢痕形成發病機制較理想的動物模型[4]。本研究通過Masson染色和脈絡膜鋪片GFAP免疫熒光染色檢查發現,小鼠視網膜下有大量膠原纖維形成,證實視網膜下瘢痕模型建立成功。
VEGF促進血管新生和血管通透性增加,是脈絡膜新生血管(CNV)發展過程中的關鍵因子。既往研究表明,在經典激光誘導的CNV小鼠RPE-脈絡膜組織中,VEGF mRNA表達于建模后2 d增加,建模后5 d達到峰值,約為建模前表達水平的2倍[7]。與之相似,本研究結果顯示,小鼠RPE-脈絡膜組織中VEGF mRNA表達于建模后2 d明顯增加,建模后5 d達到峰值,其表達量約為建模前表達水平的5~6倍。我們分析這可能是因為該視網膜下瘢痕模型實際上是CNV與瘢痕共存,其CNV面積較經典激光誘導模型更大[4]。提示較高的VEGF mRNA表達可能是導致更大CNV的原因之一。
TGF-β是一類多功能的細胞調控肽,能夠調節成纖維細胞的增生、分化、附著、遷移和凋亡,可以誘導細胞因子的分泌,促進細胞外基質和膠原纖維的沉積,在各種纖維化相關疾病中扮演著至關重要的角色[8]。TGF-β參與多種眼疾的病理過程,與滲出型AMD和增生型糖尿病視網膜病變(PDR)、增生性玻璃體視網膜病變(PVR)等眼內增生性疾病關系密切[9, 10]。研究表明,TGF-β在哺乳動物體內有3種單體,分別為TGF-β1、TGF-β2、TGF-β3,而眼后節主要表達TGF-β1和TGF-β2[11]。本研究結果顯示,TGF-β1和TGF-β2 mRNA表達及總TGF-β1、總TGF-β2蛋白、活性TGF-β1、活性TGF-β2蛋白表達在視網膜下瘢痕形成過程中均明顯增加。提示TGF-β參與了視網膜下瘢痕形成的病理過程。在建模后5 d,TGF-β1和TGF-β2 mRNA表達較建模前升高了約5~6倍,而蛋白水平卻升高了約10~20倍。我們分析認為,更高的蛋白水平可能是通過轉錄后機制實現的。通過相同的機制,脂多糖(LPS)可以在不影響TGF-β mRNA表達變化的情況下,促進單核細胞分泌TGF-β蛋白增加[12]。既往研究表明,TGF-β能夠促進RPE向成纖維細胞轉化,表現為RPE細胞間緊密連接消失、形態由六角形轉化為梭形、遷移能力增加和平滑肌肌動蛋白表達增加等[13]。我們推測,該模型中升高的TGF-β可能通過誘導RPE的表型轉化,促進細胞外基質沉積進而促進視網膜下瘢痕的形成。提示TGF-β有可能成為治療進展期和瘢痕期滲出型AMD新的靶點[14]。
炎癥因素和IL參與多種纖維化的病理過程[15]。研究證實,IL-6參與了PDR、PVR的形成過程[16, 17]。在實驗性CNV發展過程中IL-6表達上調,拮抗IL-6可以抑制CNV的發展[18]。在離體PVR模型中,給予IL-10可以使纖維膜收縮減少63%[19]。IL-13在PVR患者視網膜下液中含量增高[20]。本研究結果顯示,建模后小鼠RPE-脈絡膜組織中IL-6、IL-10、IL-13表達均明顯增加。說明IL-6、IL-10、IL-13均參與了視網膜下瘢痕的形成過程,但具體機制和作用有待進一步研究。
本研究結果表明,VEGF,促纖維化因子TGF-β1和TGF-β2,炎癥因子IL-6、IL-10、IL-13均參與了視網膜下瘢痕形成的發病過程,其中促纖維化因子及炎癥因子有可能成為進展期或瘢痕期滲出型AMD的新治療靶點,與抗VEGF藥物治療相結合,針對損傷修復過程中不同病理過程,促進CNV萎縮、預防瘢痕形成,有望達到最大治療效果。但由于視網膜下瘢痕形成小鼠模型與晚期滲出型AMD瘢痕形成病理過程并不完全相同,有關各因子的具體作用和臨床意義還有待進一步明確和探討。
視網膜下瘢痕形成是滲出型老年性黃斑變性(AMD)損傷修復的終末階段,造成光感受器不可逆的損傷[1-3]。瘢痕期或病灶中瘢痕成分較多的滲出型AMD患者,經抗血管內皮生長因子(VEGF)藥物治療后,盡管新生血管消退,但視網膜下瘢痕加速進展,最終造成嚴重視力障礙[1-3]。但目前有關視網膜下瘢痕形成的病理過程及其有效治療手段的研究甚少。為此,我們觀察分析了視網膜下瘢痕形成小鼠視網膜色素上皮(RPE)-脈絡膜組織中VEGF、促纖維化因子及炎癥因子的表達,以探討其分子發病機制,為尋找瘢痕期滲出型AMD患者的最佳治療方法提供理論依據。現將結果報道如下。
1 材料和方法
1.1 主要試劑與實驗儀器及動物模型建立
巰基乙酸、RPMI1640培養液、Masson染色試劑盒(美國Sigma公司),胎牛血清、熒光素標記的抗兔IgG抗體、Trizol試劑(美國Invitrogen公司),膠質纖維酸性蛋白(GFAP)多克隆抗體兔IgG(丹麥Dako公司),逆轉錄聚合酶鏈反應(RT-PCR)試劑盒(德國Roche Diagnostics GmbH公司),SYBR green核酸染料試劑盒(日本TaKaRa Bio公司),蛋白質提取試劑盒(美國Pierce公司),酶聯免疫吸附試驗(ELISA)試劑盒(美國R & D Systems公司)。微量注射針(瑞士Hamilton公司),532 nm二極管激光器(美國Iridex公司)。
7~8周齡雌性C57BL/6(B6)小鼠64只,由日本SLC公司提供。采用激光結合視網膜下注射炎癥巨噬細胞的方法建立視網膜下瘢痕動物模型[4]。小鼠腹腔注射巰基乙酸2.5 ml,3 d后收集腹水,離心收集細胞。重懸細胞于含10%胎牛血清的RPMI1640培養液中,37℃、5%CO2孵箱培養2 h,去除非貼壁細胞,貼壁細胞為腹腔炎癥巨噬細胞。使細胞密度為4×107個/ml,備用。采用532 nm二極管激光,能量200 mW,光斑直徑75 μm,時間0.1 s,擊射后部視網膜,擊破Bruch膜,激光光凝部位產生氣泡。采用微量注射針將0.5 μl的炎癥巨噬細胞注入激光擊射部位的視網膜下,觀察局部視網膜脫離情況。局部出血或無視網膜脫離者不納入實驗。建模后7 d,隨機選取小鼠4只,摘除眼球行Masson染色及脈絡膜鋪片GFAP免疫熒光染色,確認視網膜下瘢痕模型是否建立成功[4]。
1.2 RT-PCR及ELISA檢測
建模前及建模后1、2、3、5、7 d,采用RT-PCR檢測小鼠RPE-脈絡膜組織中VEGF、轉化生長因子(TGF)-β、白細胞介素(IL)-6、IL-10、IL-13的mRNA表達。以β-肌動蛋白(β-actin)作為內參照。各時間點分別處死小鼠6只,取RPE-脈絡膜組織,加入Trizol試劑提取總RNA。以1 μg總RNA為模板,采用RT-PCR試劑盒合成cDNA。VEGF:上游引物5′-GT TCACTGTGAGCCTTGTTCAG-3′,下游引物5′-GT CACATCTGCAAGTACGTTCG-3′,擴增片段長度141堿基對(bp);TGF-β1:上游引物5′-ACGCCTGAG TGGCTGTCTTTTGAC-3′,下游引物5′-GGGCTGATCCCGTTGATTTCCACG-3′,擴增片段長度149 bp;TGF-β2:上游引物5′-GGATGGAAATGGATCCA TGAACCC-3′,下游引物5′-TGTTGTACAGGCTGAGGACTTTGG-3′,擴增片段長度115 bp;TGF-β3:上游引物5′-GATGAGCACATAGCCAAGCA-3′,下游引物5′-ATTGGGCTGAAAGGTGTGAC-3′,擴增片段長度177 bp;IL-6:上游引物5′-TGGAGTCACA GAAGGAGTGGCTAAG-3′,下游引物5′-TCTGAC CACAGTGAGGAATGTCCAC-3′,擴增片段長度155 bp;IL-10:上游引物5′-AACTGCACCCACTTC CCAGTC-3′,下游引物5′-CATTAAGGAGTCGGT TAGCAG-3′,擴增片段長度129 bp;IL-13:上游引物5′-CTCTTGCTTGCCTTGGTGGTCTC-3′,下游引物5′-AGGGAATCCAGGGCTACACAGAA-3′,擴增片段長度192 bp;β-actin:上游引物5′-GATGACCCA GATCATGTTTGA-3′,下游引物5′-GGAGAGCAT AGCCCTCGTAG-3′,擴增片段長度161 bp。PCR反應條件:94℃ 2 min,1個循環;94℃ 30 s,60℃ 30 s,72℃ 40 s,共35個循環。所有樣本重復檢測3次。
分別于建模前及VEGF、TGF-β、IL-6、IL-10、IL-13等因子mRNA表達峰值時處死小鼠8只,取RPE-脈絡膜組織,采用T-PER組織總蛋白抽提試劑提取蛋白質。參照試劑盒說明書行ELISA檢測,測量小鼠RPE-脈絡膜組織中VEGF、總TGF-β1、活性TGF-β1、總TGF-β2、活性TGF-β2、IL-6、IL-10、IL-13的蛋白含量。
1.3 統計學方法
采用SPSS 15.0統計學軟件進行統計分析,實驗數據以均數±標準差(
2 結果
建模后7 d,Masson染色和脈絡膜鋪片GFAP免疫熒光染色檢查證實小鼠視網膜下瘢痕模型建立成功。Masson染色結果顯示,小鼠視網膜下有大量膠原纖維形成,呈淡藍綠色染色(圖 1)。脈絡膜鋪片GFAP免疫熒光染色結果顯示,小鼠視網膜下可見大面積瘢痕組織(圖 2)。
 圖1
小鼠眼球Masson染色像。視網膜下有大量膠原纖維形成,呈淡藍綠色染色Masson染色??標尺:50 μm ??圖 2??小鼠視網膜鋪片GFAP免疫熒光染色像。視網膜下可見大面積瘢痕組織GFAP免疫熒光染色??標尺:500 μm
圖1
小鼠眼球Masson染色像。視網膜下有大量膠原纖維形成,呈淡藍綠色染色Masson染色??標尺:50 μm ??圖 2??小鼠視網膜鋪片GFAP免疫熒光染色像。視網膜下可見大面積瘢痕組織GFAP免疫熒光染色??標尺:500 μm
RT-PCR檢查結果顯示,VEGF、TGF-β、IL-6、IL-10、IL-13 mRNA表達在視網膜下瘢痕形成過程中均有不同程度上調。VEGF mRNA表達于建模后2 d表達明顯增加;建模后5 d達到峰值,約為建模前的5~6倍;建模7 d仍高于建模前(圖 3)。TGF-β1、TGF-β2 mRNA表達于建模后2 d表達明顯增加;建模后 5 d達到峰值,約為建模前的5~6倍;之后緩慢下降(圖 3)。IL-6、IL-10、IL-13 mRNA表達于建模后1~2 d表達明顯增加,并于建模后2 d達到峰值,之后迅速下降(圖 3)。建模前后均未檢測到TGF-β3 mRNA表達。建模前與建模后1 d VEGF mRNA表達比較,差異無統計學意義(t=1.62,P>0.05);建模前與建模后2、3、5、7 d VEGF mRNA表達比較,差異有統計學意義(t=2.38、3.65、4.03、2.26,P<0.05)。建模前與建模后1 d TGF-β1、TGF-β2 mRNA表達比較,差異均無統計學意義(t=1.62、1.69,P>0.05);建模前與建模后2、3、5、7 d TGF-β1(t=2.58、3.89、4.37、3.77)、TGF-β2 (t=2.30、4.15、4.20、3.98)mRNA表達比較,差異均有統計學意義(P<0.05)。建模前與建模后1、2、3 d IL-6 mRNA表達比較,差異均有統計學意義(t=2.36、4.54、4.01,P<0.05);建模前與建模5、7 d IL-6 mRNA表達比較,差異均無統計學意義(t=1.63、1.71,P>0.05)。建模前與建模后2、3 d IL-10(t=3.87、2.44)、IL-13 (t=4.20、2.58)mRNA表達比較,差異均有統計學意義(P<0.05);建模前與建模后1、5、7 d IL-10(t=1.97、1.65、1.60)、IL-13 (t=1.84、1.88、1.68)mRNA表達比較,差異均無統計學意義(P>0.05)。
 圖3
建模前后VEGF、TGF-β、IL-6、IL-10、IL-13 mRNA表達比較。*:與建模前比較,P<0.05;**:與建模前比較,P<0.01
圖3
建模前后VEGF、TGF-β、IL-6、IL-10、IL-13 mRNA表達比較。*:與建模前比較,P<0.05;**:與建模前比較,P<0.01
建模前,小鼠RPE-脈絡膜組織中VEGF、總TGF-β1、活性TGF-β1、總TGF-β2、活性TGF-β2蛋白含量分別為(18.33±2.51)、(105.04±26.42)、(27.09±4.86)、(113.76±28.11)、(30.40±6.25) pg/mg,未檢測出IL-6、 IL-10及IL-13的蛋白表達。建模后5 d,小鼠RPE-脈絡膜組織中VEGF、總TGF-β1、活性TGF-β1、總TGF-β2、活性TGF-β2蛋白含量分別為(74.90±12.35)、(1384.77±61.34)、(277.83±42.35)、(2191.63±108.34)、(458.06±48.82) pg/mg,較建模前升高約10~20倍。建模前與建模后5 d小鼠RPE-脈絡膜組織中VEGF(t=2.57)、總TGF-β1(t=3.37)、活性TGF-β1(t=2.45)、總TGF-β2(t=3.83)、活性TGF-β2(t=2.74)蛋白含量比較,差異均有統計學意義(P<0.01)。建模后2 d,小鼠RPE-脈絡膜組織中IL-6、IL-10、IL-13蛋白含量分別為(43.59±15.69)、(37.06±10.22)、(23.25±9.35) pg/mg。
3 討論
有研究認為,滲出型AMD的發病機制實質是一種損傷修復過程[5, 6]。在眼內的損傷修復過程中,血管新生與纖維形成存在某種平衡,抗VEGF藥物治療抑制了血管新生過程,打破這種平衡,可以引起過度的纖維增生,瘢痕迅速進展[3]。然而,目前臨床尚無抗視網膜下纖維形成的有效治療方法。為初步明確視網膜下瘢痕形成的病理過程,尋找滲出型AMD新的治療靶點,我們采用激光結合視網膜下注射炎癥巨噬細胞的方法建立視網膜下瘢痕動物模型,觀察了建模前后小鼠RPE-脈絡膜組織中VEGF、TGF-β、IL-6、IL-10、IL-13的mRNA和蛋白表達。組織病理學檢查發現,該模型可以模擬進展期和瘢痕期滲出型AMD的改變,被認為是研究視網膜下瘢痕形成發病機制較理想的動物模型[4]。本研究通過Masson染色和脈絡膜鋪片GFAP免疫熒光染色檢查發現,小鼠視網膜下有大量膠原纖維形成,證實視網膜下瘢痕模型建立成功。
VEGF促進血管新生和血管通透性增加,是脈絡膜新生血管(CNV)發展過程中的關鍵因子。既往研究表明,在經典激光誘導的CNV小鼠RPE-脈絡膜組織中,VEGF mRNA表達于建模后2 d增加,建模后5 d達到峰值,約為建模前表達水平的2倍[7]。與之相似,本研究結果顯示,小鼠RPE-脈絡膜組織中VEGF mRNA表達于建模后2 d明顯增加,建模后5 d達到峰值,其表達量約為建模前表達水平的5~6倍。我們分析這可能是因為該視網膜下瘢痕模型實際上是CNV與瘢痕共存,其CNV面積較經典激光誘導模型更大[4]。提示較高的VEGF mRNA表達可能是導致更大CNV的原因之一。
TGF-β是一類多功能的細胞調控肽,能夠調節成纖維細胞的增生、分化、附著、遷移和凋亡,可以誘導細胞因子的分泌,促進細胞外基質和膠原纖維的沉積,在各種纖維化相關疾病中扮演著至關重要的角色[8]。TGF-β參與多種眼疾的病理過程,與滲出型AMD和增生型糖尿病視網膜病變(PDR)、增生性玻璃體視網膜病變(PVR)等眼內增生性疾病關系密切[9, 10]。研究表明,TGF-β在哺乳動物體內有3種單體,分別為TGF-β1、TGF-β2、TGF-β3,而眼后節主要表達TGF-β1和TGF-β2[11]。本研究結果顯示,TGF-β1和TGF-β2 mRNA表達及總TGF-β1、總TGF-β2蛋白、活性TGF-β1、活性TGF-β2蛋白表達在視網膜下瘢痕形成過程中均明顯增加。提示TGF-β參與了視網膜下瘢痕形成的病理過程。在建模后5 d,TGF-β1和TGF-β2 mRNA表達較建模前升高了約5~6倍,而蛋白水平卻升高了約10~20倍。我們分析認為,更高的蛋白水平可能是通過轉錄后機制實現的。通過相同的機制,脂多糖(LPS)可以在不影響TGF-β mRNA表達變化的情況下,促進單核細胞分泌TGF-β蛋白增加[12]。既往研究表明,TGF-β能夠促進RPE向成纖維細胞轉化,表現為RPE細胞間緊密連接消失、形態由六角形轉化為梭形、遷移能力增加和平滑肌肌動蛋白表達增加等[13]。我們推測,該模型中升高的TGF-β可能通過誘導RPE的表型轉化,促進細胞外基質沉積進而促進視網膜下瘢痕的形成。提示TGF-β有可能成為治療進展期和瘢痕期滲出型AMD新的靶點[14]。
炎癥因素和IL參與多種纖維化的病理過程[15]。研究證實,IL-6參與了PDR、PVR的形成過程[16, 17]。在實驗性CNV發展過程中IL-6表達上調,拮抗IL-6可以抑制CNV的發展[18]。在離體PVR模型中,給予IL-10可以使纖維膜收縮減少63%[19]。IL-13在PVR患者視網膜下液中含量增高[20]。本研究結果顯示,建模后小鼠RPE-脈絡膜組織中IL-6、IL-10、IL-13表達均明顯增加。說明IL-6、IL-10、IL-13均參與了視網膜下瘢痕的形成過程,但具體機制和作用有待進一步研究。
本研究結果表明,VEGF,促纖維化因子TGF-β1和TGF-β2,炎癥因子IL-6、IL-10、IL-13均參與了視網膜下瘢痕形成的發病過程,其中促纖維化因子及炎癥因子有可能成為進展期或瘢痕期滲出型AMD的新治療靶點,與抗VEGF藥物治療相結合,針對損傷修復過程中不同病理過程,促進CNV萎縮、預防瘢痕形成,有望達到最大治療效果。但由于視網膜下瘢痕形成小鼠模型與晚期滲出型AMD瘢痕形成病理過程并不完全相同,有關各因子的具體作用和臨床意義還有待進一步明確和探討。