引用本文: 武志鵬, 蔡善君, 呂建平, 李海輝, 宮鑫, 宿罡, 汪利敏, 王麗麗. 藍光照射對人視網膜色素上皮細胞鈣離子-蛋白激酶C信號通路的影響. 中華眼底病雜志, 2014, 30(3): 284-288. doi: 10.3760/cma.j.issn.1005-1015.2014.03.014 復制
視網膜光損傷是多種玻璃體視網膜病變發生與發展的基礎[1]。近年來研究證實,視網膜色素上皮(RPE)細胞凋亡是視網膜光損傷的最重要機制[2, 3]。藍光誘導的RPE細胞光損傷即是通過細胞凋亡的機制發生的[2]。鈣離子(Ca2+)作為細胞內最重要的第二信使之一,可以激活細胞內的多種酶類,消耗堿性磷酸酶,產生氧自由基從而誘發細胞凋亡[4]。蛋白激酶C(PKC)是細胞信號轉導過程中的重要調節酶,它可以通過對氨基酸的磷酸化作用來介導細胞的增生或凋亡過程。項目組前期研究發現,藍光照射體外培養的人RPE細胞后,出現典型細胞凋亡形態變化,線粒體腫脹,內膜嵴消失,照射早期出現線粒體膜電位降低,細胞色素C釋放[2, 3];藍光照射誘導人RPE細胞凋亡與細胞內游離Ca2+濃度增加有關[5]。但在此過程中PKC活性是否發生變化,這種變化與Ca2+濃度增加之間的關系,目前仍不清楚。因此,我們觀察了藍光照射 后RPE細胞內PKC活性和Ca2+濃度變化,旨在探討Ca2+-PKC信號通路在RPE細胞光損傷過程中的作用。
1 材料和方法
1.1 材料
人RPE細胞來源于意外死亡的2名健康成年男性,年齡分別為25、35歲,死亡12 h內取材。實驗程序符合我院人體試驗委員會制定的倫理道德標準,并通過倫理委員會審查。
藍光光源采用天津英澤科技有限公司生產的20 W醫用藍光燈管,光照度儀采用臺灣泰仕光學儀器股份有限公司TES1330A型,Gel-pro凝膠電泳分析系統購自美國Media Cybernetics公司,激光掃描共焦顯微鏡(LSCM)采用德國Leica公司TCS-SP5型。Dulbecco改良Eagle培養基/F12培養基購自美國Hyclone公司,非放射性PKC活性檢測試劑盒購自美國Promega公司,乙酰氧基甲基酯Ca2+熒光探針(Fluo 3-AM)購自碧云天生物技術公司,佛波酯(PMA)和鈣磷酸結合蛋白(calphostin C)購自德國Sigma公司。
1.2 細胞培養和鑒定
RPE細胞原代培養、傳代參照蔡善君等[2]的方法,第4代細胞用于實驗。每組平行對照實驗均在同一個體同一代細胞中進行,用于實驗的RPE細胞,以錐蟲藍染色進行活力測定,RPE細胞的活力均在90%以上。參照文獻[3]的方法,對培養細胞行角蛋白免疫組織化學染色鑒定。
1.3 實驗方法
參照文獻[6, 7]的方法,采用蛋白免疫印跡法測定培養細胞PKC蛋白表達,檢測PMA和calphostin C對PKC活性的影響;確定PMA與calphostin C影響PKC活性的最適宜濃度。將PMA及calphostin C溶于二甲基亞砜(DMSO)制成不同濃度稀釋液。其中,PMA組終濃度分別為0.1、1.0、10.0、50.0、100.0、200.0 nmol/L;calphostin C組終濃度分別為5.0、25.0、50.0、75.0、100.0、200.0 nmol/L。將人RPE細胞傳至第4代,加入含不同濃度PMA及calphostin C的培養基制作細胞標本,將不同濃度組細胞標本置于37 ℃培養箱中避光孵育12 h。采用0.25%胰蛋白酶消化并收集細胞,加入放射免疫沉淀測定強效裂解液充分裂解,提取各組RPE細胞總蛋白。按雙金雞寧酸法蛋白定量試劑盒說明操作,測定各組RPE細胞蛋白濃度,以20 μg/10 μl進行分裝,依次上樣、電泳、轉膜、封閉、加一抗及二抗孵育后上機檢測。計算PKC條帶與甘油醛-3-磷酸脫氫酶條帶積分吸光度(IA)值的比值并記為細胞膜PKC蛋白相對表達量,以此作為衡量PKC蛋白表達的依據。
采用非放射性核素法測定藍光照射處理對培養細胞PKC活性的影響。將培養細胞隨機分成光照組與對照組。將細胞培養于6孔板中,當細胞近鋪滿時,在37 ℃、5% CO2培養箱中進行藍光照射。參照文獻[2, 8]的方法,采用20 W醫用藍光燈作為光源,波長為450~500 nm,光照強度為(2000±500) Lux,照射6 h。24 h后終止培養,采用非放射性PKC活性檢測試劑盒測定2組細胞PKC活性變化。按試劑盒說明操作,將所得PKC瓊脂糖凝膠條帶放入Gel-pro凝膠光密度分析儀進行分析,以試劑盒自帶的陽性對照(PC)及陰性對照(NC)組作為參考,以磷酸化PKC與非磷酸化PKC的IA值的比值反映PKC活性,即PKC活化度。所有測量均重復3次,取平均值。
參照文獻[5]的方法,采用Fluo 3-AM Ca2+熒光探針檢測不同干預狀態下培養細胞內Ca2+濃度,以熒光強度反映Ca2+濃度。將培養細胞隨機分成無光照、單純光照、光照聯合硝苯地平、光照聯合calphostin C、光照聯合PMA 5個組。其中,無光照組不接受光照,細胞培養瓶用錫箔紙完全包裹;單純光照組僅接受光照;光照聯合硝苯地平組,在光照前1 h加入濃度為0.1 mmol/L的硝苯地平;光照聯合calphostin C組,在光照前12 h加入濃度為100.0 nmol/L的calphostin C; 光照聯合PMA組,在光照前12 h加入濃度為100.0 nmol/L的PMA。采用20 W醫用藍光燈作為光源,波長為450~500 nm,光照強度為(2000±500) Lux,照射6 h,24 h終止培養,檢測各組培養細胞內Ca2+濃度。所有測量均重復3次,取平均值。
1.4 統計學方法
采用SPSS 18.0統計軟件進行統計學處理。計數資料以均數±標準差(
2 結果
體外培養的細胞經角蛋白免疫組織化學染色后,其細胞質呈棕褐色的陽性反應,證明培養細胞為人RPE細胞(圖 1)。
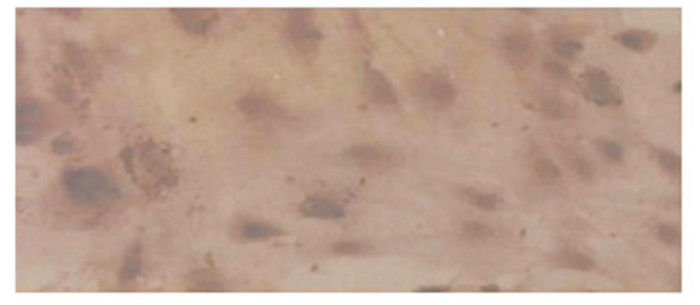 圖1
體外培養細胞光學顯微鏡像。細胞質呈棕褐色的陽性反應 蘇木素 ×200
圖1
體外培養細胞光學顯微鏡像。細胞質呈棕褐色的陽性反應 蘇木素 ×200
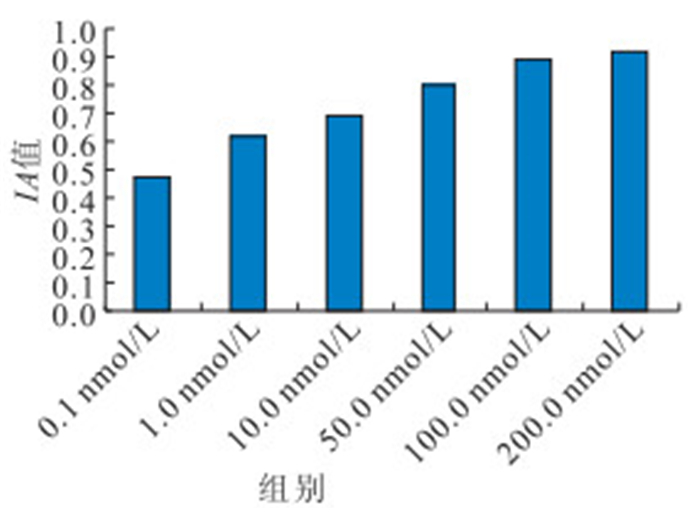
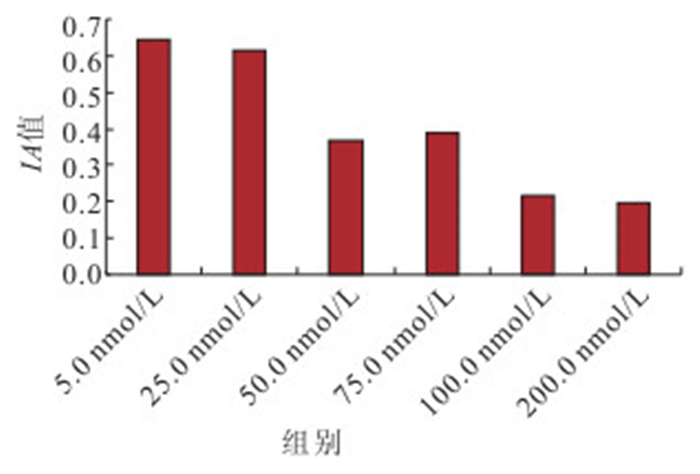
對不同濃度PMA和calphostin C處理后RPE細胞PKC蛋白相對表達量檢測結果顯示,100.0、200.0 nmol/L PMA處理后RPE細胞PKC蛋白相對表達量高于其他濃度,差異有統計學意義(F=217.537,P<0.05),但100.0、200.0 nmol/L PMA處理組間培養細胞PKC蛋白相對表達量比較,差異無統計學意義(P=0.072)(圖 2);100.0、200.0 nmol/L calphostin C處理后培養細胞PKC蛋白相對表達量低于其他濃度,差異有統計學意義(F=164.543,P<0.05),但100.0、200.0 nmol/L calphostin C處理組間培養細胞PKC蛋白相對表達量比較,差異無統計學意義(P=0.385)(圖 3)。
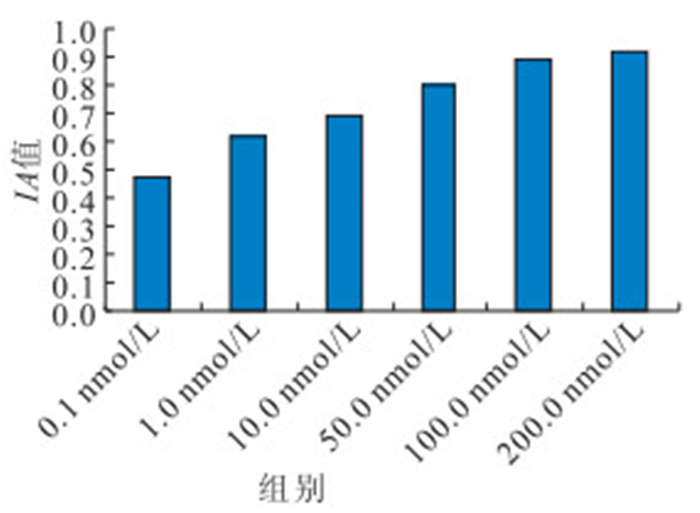 圖2
不同濃度PMA處理組RPE細胞PKC蛋白相對表達量比較
圖2
不同濃度PMA處理組RPE細胞PKC蛋白相對表達量比較
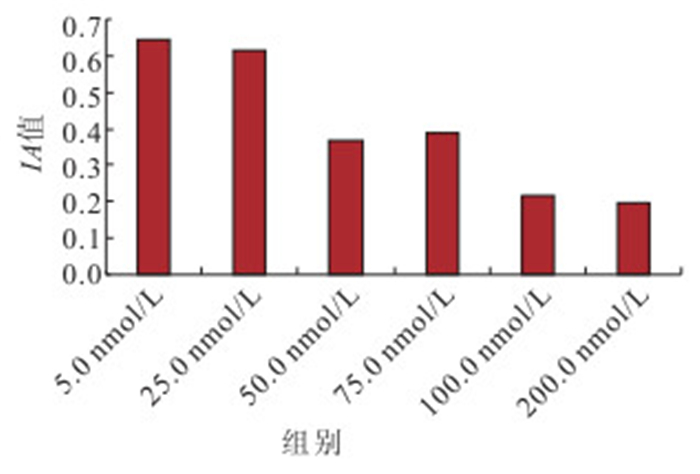 圖3
不同濃度calphostin C處理組RPE細胞PKC蛋白相對表達量比較
圖3
不同濃度calphostin C處理組RPE細胞PKC蛋白相對表達量比較
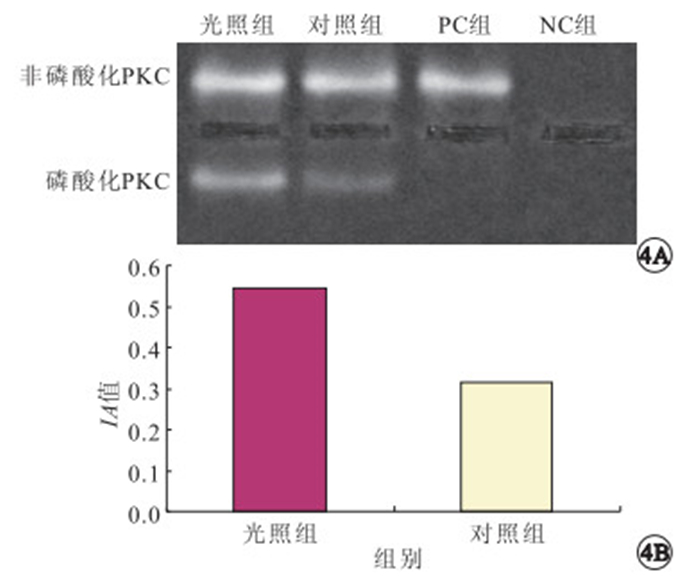
非放射性核素法檢測結果顯示,光照組和對照組培養細胞均可見非磷酸化與磷酸化PKC條帶,但光照組磷酸化PKC與非磷酸化PKC IA值的比值顯著高于對照組,差異有統計學意義(t=-9.869,P<0.05)(圖 4)。
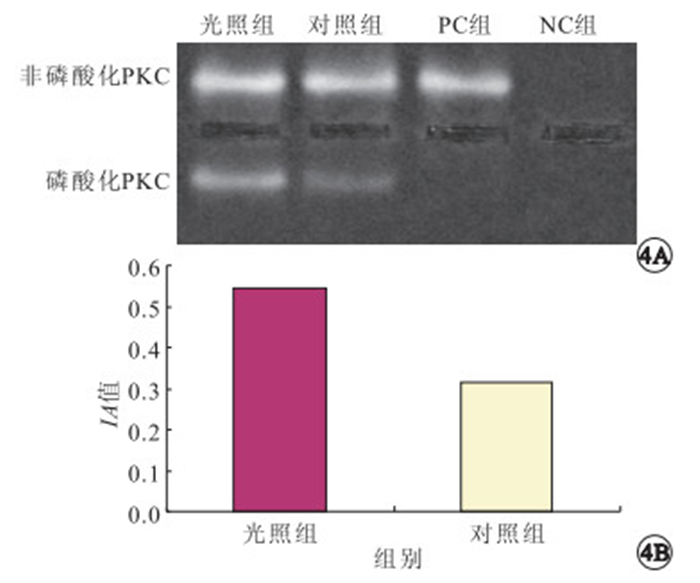 圖4
光照組和對照組培養細胞PKC活性比較。4A.電泳圖;4B.IA值比較
圖4
光照組和對照組培養細胞PKC活性比較。4A.電泳圖;4B.IA值比較
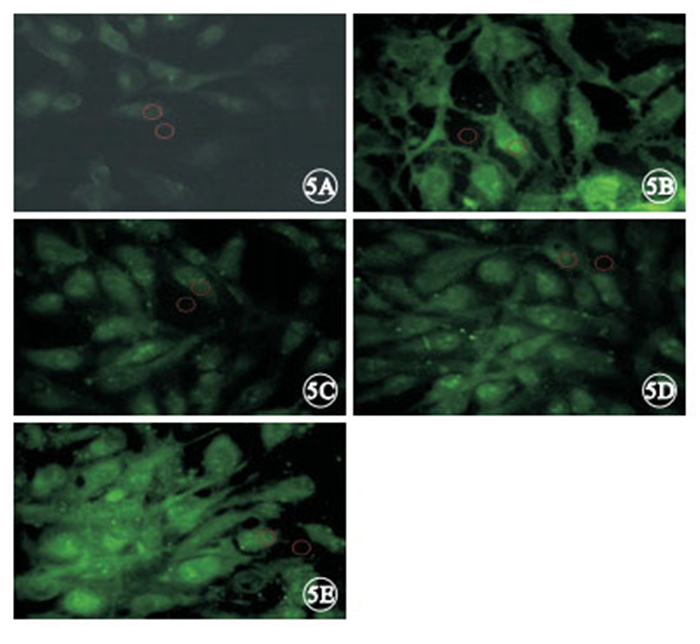
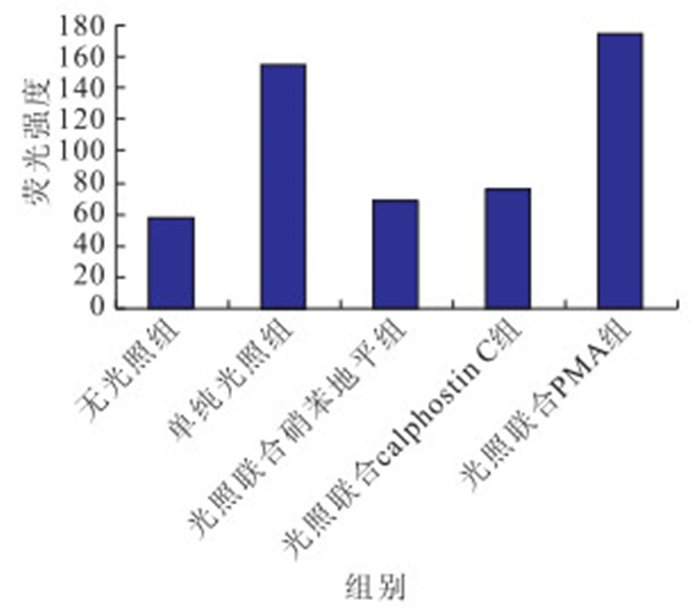
接受光照的培養細胞內Ca2+濃度均高于無光照 組,差異有統計學意義(F=26 764.92,P<0.05)。其中,光照聯合硝苯地平、光照聯合calphostin C組培養細胞內Ca2+濃度低于單純光照組(P<0.05);光照聯合硝苯地平組培養細胞內Ca2+濃度低于光照聯合calphostin C組(P<0.05);光照聯合硝苯地平組培養細胞內Ca2+濃度低于光照聯合PMA組(P<0.05);單純光照組培養細胞內Ca2+濃度低于光照聯合PMA組(P<0.05)(圖 5,6)。
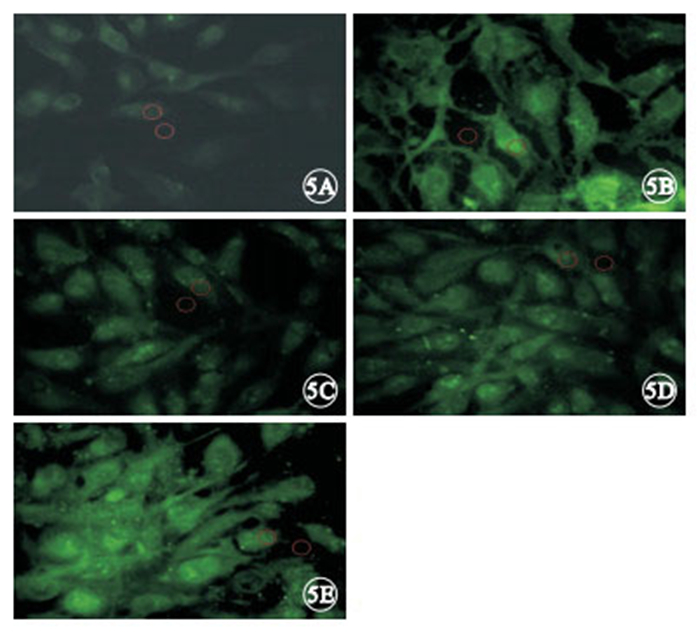 圖5
藍光照射后各組培養細胞內Ca2+檢測LSCM像。5A.無光照組;5B.單純光照組;5C.光照聯合硝苯地平組;5D.光照聯合calphostin C組;5E.光照聯合PMA組。光照聯合PMA組細胞內熒光強度最強,其次為單純光照組,無光照組最弱 ×400
圖5
藍光照射后各組培養細胞內Ca2+檢測LSCM像。5A.無光照組;5B.單純光照組;5C.光照聯合硝苯地平組;5D.光照聯合calphostin C組;5E.光照聯合PMA組。光照聯合PMA組細胞內熒光強度最強,其次為單純光照組,無光照組最弱 ×400
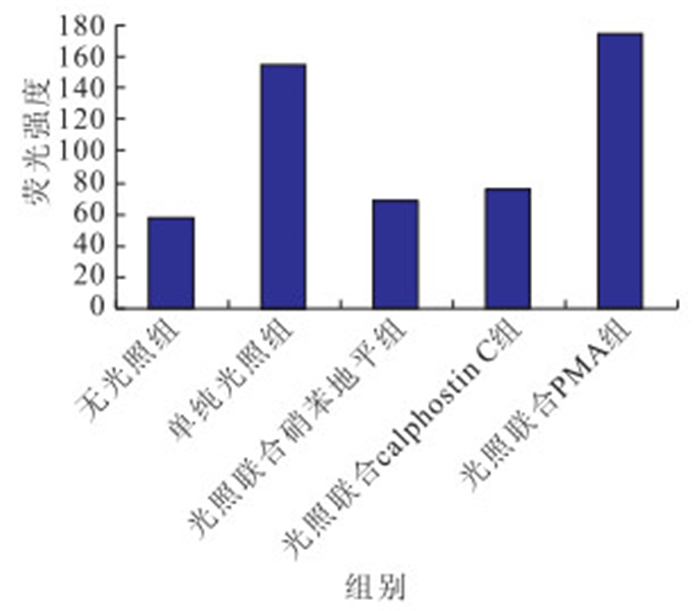 圖6
藍光照射后各組培養細胞內Ca2+濃度比較
圖6
藍光照射后各組培養細胞內Ca2+濃度比較
3 討論
經角蛋白免疫組織化學染色鑒定證實,本實驗的人RPE細胞原代體外培養成功并順利傳代。取第4代培養細胞用于實驗,采用自制的藍光發光裝置,建立體外培養人RPE細胞光損傷模型。為確保結果可比性,減少實驗誤差,本實驗中同一指標比較均選擇同一來源同一代細胞。我們前期的研究確定了藍光致人RPE細胞光損傷模型條件:光照強度為(2000±500) Lux,光照時間為6h,終止培養時間為24 h[2, 3, 5, 8]。該實驗條件可控性好,RPE細胞出現凋亡重復性高,因 此本實驗繼續選擇以上參數作為人RPE細胞光損傷制模條件。根據Lucas和Snchez-Margalet[9]的研究結果,PKC是促進還是抑制凋亡,取決于細胞類型、誘導凋亡的條件、細胞周期和細胞內的信號通道等多種因素。本實驗結果表明,藍光照射誘導人RPE細胞凋亡過程中,磷酸化PKC增加,提示PKC活性增強。因此,在這一過程中,PKC起促凋亡作用。
研究表明,心肌細胞發生凋亡時,細胞質內游離Ca2+濃度迅速出現持續性升高,Ca2+濃度的變化在啟動細胞凋亡過程中有十分重要的作用[10, 11]。為此,我們設計了硝苯地平干預組,在光照前1 h加入硝苯地平,以便充分阻斷細胞膜上的鈣通道,阻斷細胞外的Ca2+內流。在PKC活性干預方面,選擇了PMA和calphostin C。PMA是公認的PKC激活劑,其化學作用與二酰甘油(DAG)相似,能夠直接激活PKC;calphostin C是一種多醌化合物,與PMA競爭PKC調節區的結合位點并發揮其生物學作用,它對PKC的抑制作用具有高效、特異性強的特點[6]。預實驗結果表明,PMA在100.0 nmol/L時達到影響PKC活性的最佳濃度,雖然200.0 nmol/L時PKC活性仍略有變化,但與100.0 nmol/L比較,PKC活性差異并無統計學意義。對calphostin C預實驗結果也表明,calphostin C在100.0 nmol/L時達到影響PKC活性的最佳濃度,與200.0 nmol/L比較,PKC活性差異并無統計學意義。因此,為減少PMA和calphostin C對細胞的毒性作用,我們選擇了較低的濃度作為影響PKC活性的最適宜濃度。而這與毛俊峰等[6]、王中群等[7]的研究結果相吻合。
研究結果表明,接受光照的培養細胞內Ca2+濃度均高于未接受光照的培養細胞。其中,光照聯合PMA組人RPE細胞內Ca2+濃度高于單純光照組;光照聯合硝苯地平和光照聯合calphostin C組人RPE細胞內Ca2+濃度均明顯低于單純光照的培養細胞。表明藍光照射誘導人RPE細胞凋亡過程中細胞內Ca2+濃度升高,與Pang和Hong[12]的結論一致。應用PKC激動劑之后PKC活性增強,細胞內Ca2+濃度進一步升高,應用PKC抑制劑calphostin C之后細胞內Ca2+濃度降低。這提示,Ca2+濃度與PKC活性可能存在相關性,Ca2+-PKC信號傳導通路在藍光照射誘導人RPE細胞凋亡過程中相互協調、相互促進。本實驗結果還表明,與單純光照組比較,在光照聯合鈣通道抑制劑硝苯地平組和光照聯合PKC抑制劑calphostin C組,細胞內Ca2+濃度均明顯降低,但同時又高于未接受光照組。說明在藍光照射誘導人RPE細胞凋亡過程中細胞內Ca2+濃度的升高至少是通過細胞外Ca2+內流和PKC激活誘導的細胞內鈣庫釋放Ca2+這兩條途徑,單純抑制其中一條通路,并不能完全阻斷細胞內Ca2+濃度的升高。因此,我們推測,藍光照射誘導人RPE細胞凋亡過程中,一方面通過藍光刺激激活DAG進而直接激活PKC,此過程又伴隨著內質網鈣庫三磷酸肌醇受體鈣通道的激活而釋放Ca2+進入胞質,另一方面通過調節胞膜L型鈣通道的開放使細胞外Ca2+大量內流,此兩方面共同作用導致細胞內Ca2+濃度急劇升高,打破細胞內Ca2+穩態,誘導RPE細胞凋亡。
但本研究存在一些不足。用DMSO溶解PMA及calphostin C,可能會對細胞產生毒性。此外,沒有同時觀察RPE細胞內Ca2+濃度和PKC活性變化。后續研究將加以完善,同時進一步探討RPE細胞內Ca2+濃度變化對鈣通道及PKC通路是否存在反饋調節機制。
視網膜光損傷是多種玻璃體視網膜病變發生與發展的基礎[1]。近年來研究證實,視網膜色素上皮(RPE)細胞凋亡是視網膜光損傷的最重要機制[2, 3]。藍光誘導的RPE細胞光損傷即是通過細胞凋亡的機制發生的[2]。鈣離子(Ca2+)作為細胞內最重要的第二信使之一,可以激活細胞內的多種酶類,消耗堿性磷酸酶,產生氧自由基從而誘發細胞凋亡[4]。蛋白激酶C(PKC)是細胞信號轉導過程中的重要調節酶,它可以通過對氨基酸的磷酸化作用來介導細胞的增生或凋亡過程。項目組前期研究發現,藍光照射體外培養的人RPE細胞后,出現典型細胞凋亡形態變化,線粒體腫脹,內膜嵴消失,照射早期出現線粒體膜電位降低,細胞色素C釋放[2, 3];藍光照射誘導人RPE細胞凋亡與細胞內游離Ca2+濃度增加有關[5]。但在此過程中PKC活性是否發生變化,這種變化與Ca2+濃度增加之間的關系,目前仍不清楚。因此,我們觀察了藍光照射 后RPE細胞內PKC活性和Ca2+濃度變化,旨在探討Ca2+-PKC信號通路在RPE細胞光損傷過程中的作用。
1 材料和方法
1.1 材料
人RPE細胞來源于意外死亡的2名健康成年男性,年齡分別為25、35歲,死亡12 h內取材。實驗程序符合我院人體試驗委員會制定的倫理道德標準,并通過倫理委員會審查。
藍光光源采用天津英澤科技有限公司生產的20 W醫用藍光燈管,光照度儀采用臺灣泰仕光學儀器股份有限公司TES1330A型,Gel-pro凝膠電泳分析系統購自美國Media Cybernetics公司,激光掃描共焦顯微鏡(LSCM)采用德國Leica公司TCS-SP5型。Dulbecco改良Eagle培養基/F12培養基購自美國Hyclone公司,非放射性PKC活性檢測試劑盒購自美國Promega公司,乙酰氧基甲基酯Ca2+熒光探針(Fluo 3-AM)購自碧云天生物技術公司,佛波酯(PMA)和鈣磷酸結合蛋白(calphostin C)購自德國Sigma公司。
1.2 細胞培養和鑒定
RPE細胞原代培養、傳代參照蔡善君等[2]的方法,第4代細胞用于實驗。每組平行對照實驗均在同一個體同一代細胞中進行,用于實驗的RPE細胞,以錐蟲藍染色進行活力測定,RPE細胞的活力均在90%以上。參照文獻[3]的方法,對培養細胞行角蛋白免疫組織化學染色鑒定。
1.3 實驗方法
參照文獻[6, 7]的方法,采用蛋白免疫印跡法測定培養細胞PKC蛋白表達,檢測PMA和calphostin C對PKC活性的影響;確定PMA與calphostin C影響PKC活性的最適宜濃度。將PMA及calphostin C溶于二甲基亞砜(DMSO)制成不同濃度稀釋液。其中,PMA組終濃度分別為0.1、1.0、10.0、50.0、100.0、200.0 nmol/L;calphostin C組終濃度分別為5.0、25.0、50.0、75.0、100.0、200.0 nmol/L。將人RPE細胞傳至第4代,加入含不同濃度PMA及calphostin C的培養基制作細胞標本,將不同濃度組細胞標本置于37 ℃培養箱中避光孵育12 h。采用0.25%胰蛋白酶消化并收集細胞,加入放射免疫沉淀測定強效裂解液充分裂解,提取各組RPE細胞總蛋白。按雙金雞寧酸法蛋白定量試劑盒說明操作,測定各組RPE細胞蛋白濃度,以20 μg/10 μl進行分裝,依次上樣、電泳、轉膜、封閉、加一抗及二抗孵育后上機檢測。計算PKC條帶與甘油醛-3-磷酸脫氫酶條帶積分吸光度(IA)值的比值并記為細胞膜PKC蛋白相對表達量,以此作為衡量PKC蛋白表達的依據。
采用非放射性核素法測定藍光照射處理對培養細胞PKC活性的影響。將培養細胞隨機分成光照組與對照組。將細胞培養于6孔板中,當細胞近鋪滿時,在37 ℃、5% CO2培養箱中進行藍光照射。參照文獻[2, 8]的方法,采用20 W醫用藍光燈作為光源,波長為450~500 nm,光照強度為(2000±500) Lux,照射6 h。24 h后終止培養,采用非放射性PKC活性檢測試劑盒測定2組細胞PKC活性變化。按試劑盒說明操作,將所得PKC瓊脂糖凝膠條帶放入Gel-pro凝膠光密度分析儀進行分析,以試劑盒自帶的陽性對照(PC)及陰性對照(NC)組作為參考,以磷酸化PKC與非磷酸化PKC的IA值的比值反映PKC活性,即PKC活化度。所有測量均重復3次,取平均值。
參照文獻[5]的方法,采用Fluo 3-AM Ca2+熒光探針檢測不同干預狀態下培養細胞內Ca2+濃度,以熒光強度反映Ca2+濃度。將培養細胞隨機分成無光照、單純光照、光照聯合硝苯地平、光照聯合calphostin C、光照聯合PMA 5個組。其中,無光照組不接受光照,細胞培養瓶用錫箔紙完全包裹;單純光照組僅接受光照;光照聯合硝苯地平組,在光照前1 h加入濃度為0.1 mmol/L的硝苯地平;光照聯合calphostin C組,在光照前12 h加入濃度為100.0 nmol/L的calphostin C; 光照聯合PMA組,在光照前12 h加入濃度為100.0 nmol/L的PMA。采用20 W醫用藍光燈作為光源,波長為450~500 nm,光照強度為(2000±500) Lux,照射6 h,24 h終止培養,檢測各組培養細胞內Ca2+濃度。所有測量均重復3次,取平均值。
1.4 統計學方法
采用SPSS 18.0統計軟件進行統計學處理。計數資料以均數±標準差(
2 結果
體外培養的細胞經角蛋白免疫組織化學染色后,其細胞質呈棕褐色的陽性反應,證明培養細胞為人RPE細胞(圖 1)。
 圖1
體外培養細胞光學顯微鏡像。細胞質呈棕褐色的陽性反應 蘇木素 ×200
圖1
體外培養細胞光學顯微鏡像。細胞質呈棕褐色的陽性反應 蘇木素 ×200
對不同濃度PMA和calphostin C處理后RPE細胞PKC蛋白相對表達量檢測結果顯示,100.0、200.0 nmol/L PMA處理后RPE細胞PKC蛋白相對表達量高于其他濃度,差異有統計學意義(F=217.537,P<0.05),但100.0、200.0 nmol/L PMA處理組間培養細胞PKC蛋白相對表達量比較,差異無統計學意義(P=0.072)(圖 2);100.0、200.0 nmol/L calphostin C處理后培養細胞PKC蛋白相對表達量低于其他濃度,差異有統計學意義(F=164.543,P<0.05),但100.0、200.0 nmol/L calphostin C處理組間培養細胞PKC蛋白相對表達量比較,差異無統計學意義(P=0.385)(圖 3)。
 圖2
不同濃度PMA處理組RPE細胞PKC蛋白相對表達量比較
圖2
不同濃度PMA處理組RPE細胞PKC蛋白相對表達量比較
 圖3
不同濃度calphostin C處理組RPE細胞PKC蛋白相對表達量比較
圖3
不同濃度calphostin C處理組RPE細胞PKC蛋白相對表達量比較
非放射性核素法檢測結果顯示,光照組和對照組培養細胞均可見非磷酸化與磷酸化PKC條帶,但光照組磷酸化PKC與非磷酸化PKC IA值的比值顯著高于對照組,差異有統計學意義(t=-9.869,P<0.05)(圖 4)。
 圖4
光照組和對照組培養細胞PKC活性比較。4A.電泳圖;4B.IA值比較
圖4
光照組和對照組培養細胞PKC活性比較。4A.電泳圖;4B.IA值比較
接受光照的培養細胞內Ca2+濃度均高于無光照 組,差異有統計學意義(F=26 764.92,P<0.05)。其中,光照聯合硝苯地平、光照聯合calphostin C組培養細胞內Ca2+濃度低于單純光照組(P<0.05);光照聯合硝苯地平組培養細胞內Ca2+濃度低于光照聯合calphostin C組(P<0.05);光照聯合硝苯地平組培養細胞內Ca2+濃度低于光照聯合PMA組(P<0.05);單純光照組培養細胞內Ca2+濃度低于光照聯合PMA組(P<0.05)(圖 5,6)。
 圖5
藍光照射后各組培養細胞內Ca2+檢測LSCM像。5A.無光照組;5B.單純光照組;5C.光照聯合硝苯地平組;5D.光照聯合calphostin C組;5E.光照聯合PMA組。光照聯合PMA組細胞內熒光強度最強,其次為單純光照組,無光照組最弱 ×400
圖5
藍光照射后各組培養細胞內Ca2+檢測LSCM像。5A.無光照組;5B.單純光照組;5C.光照聯合硝苯地平組;5D.光照聯合calphostin C組;5E.光照聯合PMA組。光照聯合PMA組細胞內熒光強度最強,其次為單純光照組,無光照組最弱 ×400
 圖6
藍光照射后各組培養細胞內Ca2+濃度比較
圖6
藍光照射后各組培養細胞內Ca2+濃度比較
3 討論
經角蛋白免疫組織化學染色鑒定證實,本實驗的人RPE細胞原代體外培養成功并順利傳代。取第4代培養細胞用于實驗,采用自制的藍光發光裝置,建立體外培養人RPE細胞光損傷模型。為確保結果可比性,減少實驗誤差,本實驗中同一指標比較均選擇同一來源同一代細胞。我們前期的研究確定了藍光致人RPE細胞光損傷模型條件:光照強度為(2000±500) Lux,光照時間為6h,終止培養時間為24 h[2, 3, 5, 8]。該實驗條件可控性好,RPE細胞出現凋亡重復性高,因 此本實驗繼續選擇以上參數作為人RPE細胞光損傷制模條件。根據Lucas和Snchez-Margalet[9]的研究結果,PKC是促進還是抑制凋亡,取決于細胞類型、誘導凋亡的條件、細胞周期和細胞內的信號通道等多種因素。本實驗結果表明,藍光照射誘導人RPE細胞凋亡過程中,磷酸化PKC增加,提示PKC活性增強。因此,在這一過程中,PKC起促凋亡作用。
研究表明,心肌細胞發生凋亡時,細胞質內游離Ca2+濃度迅速出現持續性升高,Ca2+濃度的變化在啟動細胞凋亡過程中有十分重要的作用[10, 11]。為此,我們設計了硝苯地平干預組,在光照前1 h加入硝苯地平,以便充分阻斷細胞膜上的鈣通道,阻斷細胞外的Ca2+內流。在PKC活性干預方面,選擇了PMA和calphostin C。PMA是公認的PKC激活劑,其化學作用與二酰甘油(DAG)相似,能夠直接激活PKC;calphostin C是一種多醌化合物,與PMA競爭PKC調節區的結合位點并發揮其生物學作用,它對PKC的抑制作用具有高效、特異性強的特點[6]。預實驗結果表明,PMA在100.0 nmol/L時達到影響PKC活性的最佳濃度,雖然200.0 nmol/L時PKC活性仍略有變化,但與100.0 nmol/L比較,PKC活性差異并無統計學意義。對calphostin C預實驗結果也表明,calphostin C在100.0 nmol/L時達到影響PKC活性的最佳濃度,與200.0 nmol/L比較,PKC活性差異并無統計學意義。因此,為減少PMA和calphostin C對細胞的毒性作用,我們選擇了較低的濃度作為影響PKC活性的最適宜濃度。而這與毛俊峰等[6]、王中群等[7]的研究結果相吻合。
研究結果表明,接受光照的培養細胞內Ca2+濃度均高于未接受光照的培養細胞。其中,光照聯合PMA組人RPE細胞內Ca2+濃度高于單純光照組;光照聯合硝苯地平和光照聯合calphostin C組人RPE細胞內Ca2+濃度均明顯低于單純光照的培養細胞。表明藍光照射誘導人RPE細胞凋亡過程中細胞內Ca2+濃度升高,與Pang和Hong[12]的結論一致。應用PKC激動劑之后PKC活性增強,細胞內Ca2+濃度進一步升高,應用PKC抑制劑calphostin C之后細胞內Ca2+濃度降低。這提示,Ca2+濃度與PKC活性可能存在相關性,Ca2+-PKC信號傳導通路在藍光照射誘導人RPE細胞凋亡過程中相互協調、相互促進。本實驗結果還表明,與單純光照組比較,在光照聯合鈣通道抑制劑硝苯地平組和光照聯合PKC抑制劑calphostin C組,細胞內Ca2+濃度均明顯降低,但同時又高于未接受光照組。說明在藍光照射誘導人RPE細胞凋亡過程中細胞內Ca2+濃度的升高至少是通過細胞外Ca2+內流和PKC激活誘導的細胞內鈣庫釋放Ca2+這兩條途徑,單純抑制其中一條通路,并不能完全阻斷細胞內Ca2+濃度的升高。因此,我們推測,藍光照射誘導人RPE細胞凋亡過程中,一方面通過藍光刺激激活DAG進而直接激活PKC,此過程又伴隨著內質網鈣庫三磷酸肌醇受體鈣通道的激活而釋放Ca2+進入胞質,另一方面通過調節胞膜L型鈣通道的開放使細胞外Ca2+大量內流,此兩方面共同作用導致細胞內Ca2+濃度急劇升高,打破細胞內Ca2+穩態,誘導RPE細胞凋亡。
但本研究存在一些不足。用DMSO溶解PMA及calphostin C,可能會對細胞產生毒性。此外,沒有同時觀察RPE細胞內Ca2+濃度和PKC活性變化。后續研究將加以完善,同時進一步探討RPE細胞內Ca2+濃度變化對鈣通道及PKC通路是否存在反饋調節機制。