引用本文: 溫臣婷, 賀濤, 邢怡橋, 焦康為, 蔡維. 慢病毒介導環腺苷酸反應成分結合蛋白1特異性小干擾RNA對小鼠視網膜新生血管的抑制作用. 中華眼底病雜志, 2014, 30(3): 278-283. doi: 10.3760/cma.j.issn.1005-1015.2014.03.013 復制
視網膜新生血管(RNV)生成是以缺血、缺氧為基礎,受多種因素及多通路調控,包含血管內皮細胞活化、增生、遷移及細胞外基質重塑等多步驟的復雜過程[1]。環腺苷酸反應成分結合蛋白(CREB)1屬于CREB激活轉錄因子家族,參與血管內膜形成及血管內皮化,在內皮細胞氧化應激損傷中有保護作用[2, 3]。同時也有研究發現,CREB1在腫瘤的低氧環境中對新生血管形成起重要作用[4]。但目前有關CREB1在RNV生成中的作用及其機制探討還少見報道。為此,我們通過玻璃體腔注射慢病毒介導的CREB1特異性小干擾RNA(siRNA)這一基因靜默方法,觀察了CREB1對小鼠RNV形成的影響,并對其可能作用機制進行了初步探討。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料及設備
5日齡C57BL/6J小鼠140只,體重4 g,雌雄不限,由武漢大學實驗動物中心提供。慢病毒表達載體(上海英為信生物科技有限公司),相對分子質量為2×106的異硫氰酸熒光素-葡聚糖(FITC-Dextran,美國Sigma 公司),磷酸化CREB1(P-CREB1)一抗(英國Abcam公司),血管內皮生長因子(VEGF)-A一抗(北京博奧森公司),絲氨酸/蘇氨酸蛋白激酶(Akt)一抗(美國Bioworld公司),磷脂酰肌醇3激酶(PI3K)一抗(美國Cell Signaling Technology公司),辣根過氧化物酶(HRP)標記二抗(武漢博士德生物工程有限公司),RSS-5100型測氧儀(上海雷磁創益儀器儀表有限公司)。引物合成委托南京金斯瑞生物科技有限公司完成。
1.2 靶向CREB1 RNA干擾慢病毒制備及實驗分組
根據美國國家生物技術信息中心小鼠核苷酸CREB1 mRNA序列(NM_133828.2),設計相應的siRNA干擾序列。正義鏈5-GATCCGCCTGAAAGC AACTACAGAATCTTCCTGTCAGAATTCTGTAG TTGCTTTCAGGCTTTTTG-3,反義鏈5-AATTCA GCCTGAAAGCAACTACAGAATTCTGACA GGAAGATTCTGTAGTTGCTTTCAGGCG-3,委托上海英為信生物科技有限公司合成含干擾序列的雙鏈DNA寡核苷酸,其兩端含酶切位點粘端,直接連入酶切后的RNA干擾載體上。將連接好的產物轉入制備好的細菌感受態細胞,對長出的克隆進行酶切鑒定,挑選陽性克隆送測序,進行測序比對后,鑒定陽性的克隆即為構建成功的CREB1基因RNA干擾質粒。用構建的攜帶增強型綠色熒光蛋白(GFP)的慢病毒表達載體(lenti-GFP)和包裝質粒共轉染293T細胞,包裝、收集病毒,超速離心濃縮,調整病毒滴度。同時設立未插入目的基因的lenti-GFP作為對照。將140只C57BL/6J小鼠分為正常對照組、氧誘導視網膜病變(OIR)模型組、空載體組及CREB1干擾組,每組35只。空載體組及CREB1干擾組小鼠于出生后5 d,在解剖顯微鏡下,分別用微量進樣器針尖緊貼角鞏緣后,穿過眼瞼皮膚及鞏膜,向右眼玻璃體腔注射1×109 TU/ml不含目的基因的慢病毒空載體和CREB1-RNA 干擾慢病毒載體1.0 μl。小鼠7日齡時,OIR模型組、空載體組及CREB1干擾組參照文獻[5]的方法建立OIR小鼠模型。正常對照組小鼠自出生即于正常室內空氣中飼養至17日齡,不作其他處理。
1.3 視網膜組織冰凍切片、視網膜切片、視網膜鋪片、逆轉錄聚合酶鏈反應(RT-PCR)及蛋白質免疫印跡法(Western blot)檢測
小鼠12日齡時,每組隨機選取4只小鼠,頸椎脫臼法處死。摘取眼球置于4%多聚甲醛中,4 ℃固定過夜,之后分別用20%和30%蔗糖液脫水,標本最佳切削溫度(OCT)包埋劑包埋,液氮冷凍后作連續切片,片厚12 μm。熒光顯微鏡下觀察GFP的表達。
小鼠17日齡時,取空載體組及CREB1干擾組小鼠各4只,頸椎脫臼法處死。摘取眼球,經4%多聚甲醛固定20 min,梯度蔗糖脫水過夜,OCT包埋劑包埋,液氮冷凍后作連續切片,片厚14 μm,5%牛血清白蛋白封閉20 min,兔抗鼠一抗P-CREB1(1∶200) 4 ℃ 孵育過夜,磷酸鹽緩沖液(PBS)沖洗3次,10 min/次,滴加Cy3標記羊抗兔IgG二抗(1∶200)37 ℃孵育1 h,PBS沖洗3次,10 min/次,4,6-聯脒-2-苯基吲哚避光染核5 min,甩干后用抗熒光衰減封片劑封片。陰性對照采用PBS代替一抗。熒光顯微鏡下觀察并攝片。小鼠17日齡時,每組隨機選取5只小鼠,頸椎脫臼法處死。摘除眼球,經4%多聚甲醛固定,常規梯度乙醇脫水、透明、石蠟包埋、矢狀位連續切片,片厚4 μm,相鄰2張切片間隔30 μm。每只眼球取5張切片行蘇木精-伊紅(HE)染色。用雙盲法統計每張切片中突破視網膜內界膜的血管內皮細胞核數目,統計時排除玻璃體腔與視網膜內界膜無聯系的血管內皮細胞核。
小鼠17日齡時,每組隨機選取4只小鼠。腹腔注射水合氯醛麻醉小鼠,固定后剪開胸腔,暴露心臟,經左心室將充分溶解的50 mg/ml FITC-Dextran快速注入。處死小鼠后摘取眼球于4%中性多聚甲醛室溫固定1 h。分離并放射狀切開視網膜,將視網膜平鋪在載玻片上。封片后熒光顯微鏡下圖像放大40倍拍照。Photoshop CS5軟件打開圖像,利用多邊形套索工具分別選取全視網膜及視網膜中新生血管區和無灌注區域,獲得相應的像素值,分別計算新生血管和無灌注區面積占全視網膜面積的百分比。每張視網膜圖像均由3位不同觀察者盲法計算視網膜新生血管及無灌注區面積[6]。
小鼠17日齡時,每組隨機選取8只小鼠,頸椎脫臼法處死。摘取右眼眼球,取出視網膜組織于液氮中凍存。提取總RNA,紫外分光光度計檢測總RNA,逆轉錄合成cDNA。將梯度稀釋的DNA模板及所有cDNA樣品分別配制成20 μl 聚合酶鏈反應(PCR)反應體系。Akt上游引物5′-ACTCATTCCAGACCCA CGAC-3′,下游引物5′-CCGGTACACCACGTTCTT CT-3′,擴增片段長度為176堿基對(bp)。VEGF-A上游引物5′-GCCTTGTTCAGAGCGGAGAA-3′,下游引物5′-CTTTCCGGTGAGAGGTCTGG-3′,擴增片段長度為205 bp。PI3K上游引物5′-CATGACGA GAAGACGTGGAA-3′,下游引物5′-CCGGTGGCAG TCTTGTTAAT-3′,擴增片段長度為179 bp。CREB1 上游引物5′-AACAATGGTACGGATGGG GT-3′,下游引物5′-GCCATAACAACTCCAGGGGC-3′,擴增片段長度為224 bp。β-肌動蛋白(β-actin)上游引物5′-CACGATGGAGGGGCCGGACTCATC-3′,下游引物5′-TAAAGACCTCTATGCCAACACAGT-3′,擴增片段長度為240 bp。PCR反應條件:50 ℃預變性2 min,95 ℃變性10 min,95 ℃ 30 s,60°C退火30 s,共40個循環。檢測小鼠視網膜組織中CREB1、VEGF-A、Akt、PI3K mRNA的表達。所有標本檢測3次,用標準曲線的2-△△CT相對定量法進行計算。
小鼠17日齡時,每組隨機選取10只小鼠,頸椎脫臼法處死。摘取右眼眼球,取出視網膜組織,提取視網膜總蛋白。根據蛋白分子量配置10%的聚丙烯酰胺凝膠電泳。根據預染分子量標準物顯示,判斷目的蛋白得到充分分離后停止電泳。取出凝膠,根據分子量標準物切下目的條帶,用蒸餾水沖洗后進行轉膜。從負極到正極依次為纖維墊、濾紙、凝膠、聚偏二氟乙烯(PVDF)膜、濾紙和纖維墊。含5%脫脂奶粉的洗膜緩沖液浸泡PVDF膜,室溫搖床封閉2 h。分別孵育經5%脫脂奶粉的磷酸鹽吐溫緩沖液(PBST)稀釋的VEGF-A(1∶300)、Akt(1∶700)、P-CREB1(1∶600)、PI3K(1∶700)一抗,4 ℃過夜。PBST洗膜5次,5 min/次。用封閉液稀釋相應的HRP標記二抗(1∶70 000),孵育二抗。置室溫2 h,PBST洗膜5次,5 min/次。顯影、定影,拍照,分析。
1.4 統計學方法
采用SPSS 20.0統計軟件行統計學分析。計量資料以均數±標準差(
2 結果
RT-PCR擴增獲得的目的基因片段與片段理論值相符。擴增片段與慢病毒載體相連后,經酶切、測序鑒定,測序結果序列比對完全正確。測定病毒滴度達1×109 TU/ml。
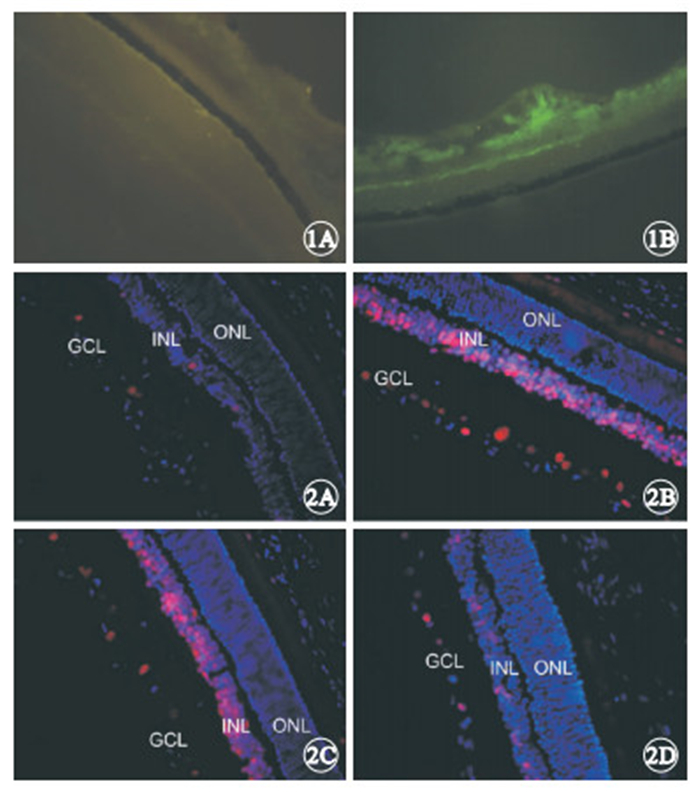
冰凍切片熒光顯微鏡觀察發現,正常對照組小鼠視網膜中未見GFP表達(圖 1A),CREB1干擾組小鼠視網膜中可見大量GFP表達(圖 1B)。
冰凍切片免疫熒光法顯微鏡觀察發現,正常對照組小鼠視網膜中僅見少量P-CREB1蛋白熒光表達(圖 2A);OIR模型組和空載體組小鼠視網膜中可見大量P-CREB1蛋白熒光表達,主要位于內核層(INL)和神經節細胞層(GCL),外核層(ONL)基本無表達(圖 2B,2C);CREB1干擾組小鼠視網膜中P-CREB1蛋白熒光表達明顯減弱(圖 2D)。
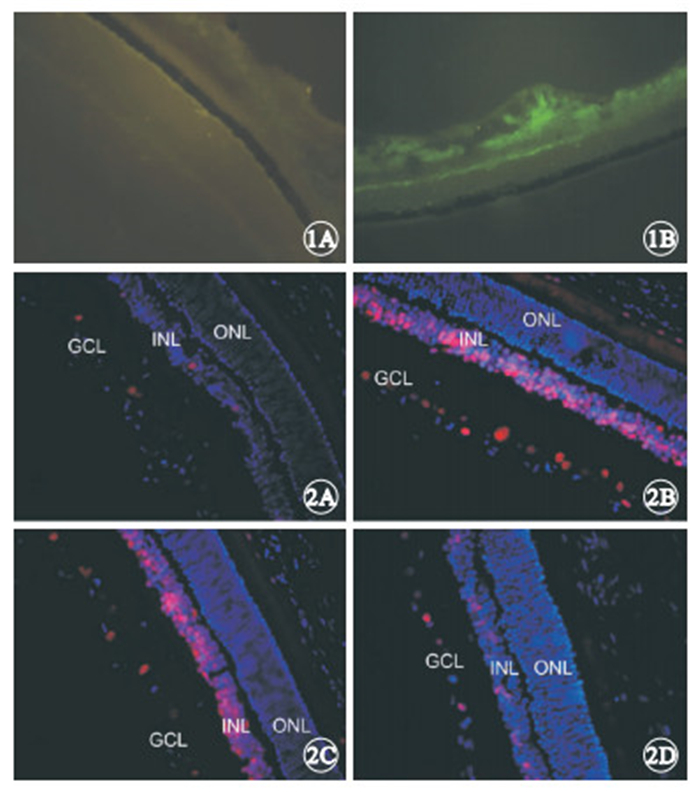 圖1
小鼠視網膜組織冰凍切片熒光顯微鏡像。1A. 正常對照組,未見GFP表達;1B. CREB1干擾組,可見大量GFP表達 ×200 ? ?圖 2 小鼠視網膜組織冰凍切片免疫熒光顯微鏡像。2A.正常對照組,僅見少量P-CREB1蛋白熒光表達;2B. OIR模型組,可見大量P-CREB1蛋白熒光表達,主要位于視網膜INL和GCL;2C.空載體組,可見大量P-CREB1蛋白熒光表達,主要位于視網膜INL和GCL;2D. CREB1干擾組,P-CREB1 蛋白熒光表達明顯減弱 ×400
圖1
小鼠視網膜組織冰凍切片熒光顯微鏡像。1A. 正常對照組,未見GFP表達;1B. CREB1干擾組,可見大量GFP表達 ×200 ? ?圖 2 小鼠視網膜組織冰凍切片免疫熒光顯微鏡像。2A.正常對照組,僅見少量P-CREB1蛋白熒光表達;2B. OIR模型組,可見大量P-CREB1蛋白熒光表達,主要位于視網膜INL和GCL;2C.空載體組,可見大量P-CREB1蛋白熒光表達,主要位于視網膜INL和GCL;2D. CREB1干擾組,P-CREB1 蛋白熒光表達明顯減弱 ×400
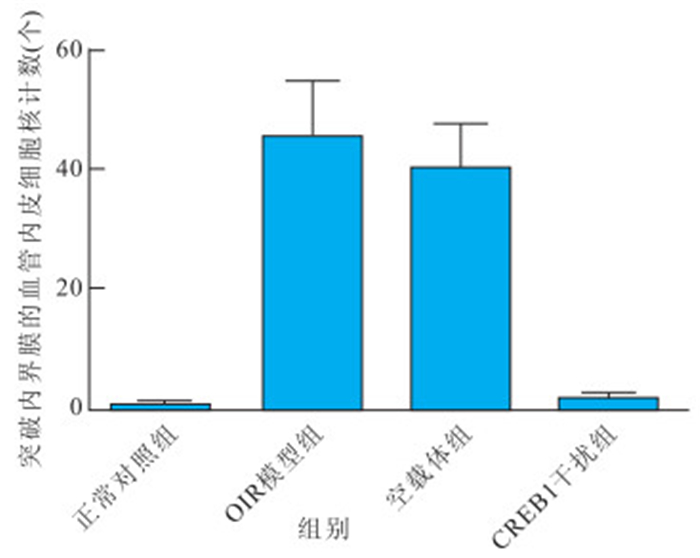
正常對照組、OIR模型組、空載體組及CREB1干 擾組突破內界膜的血管內皮細胞核計數分別為(0.52± 0.44)、(45.64±9.23)、(40.23±7.35)、(1.67±0.67)個。正常對照組分別與模型組和空載體組突破內界膜的血管內皮細胞核數比較,差異均有統計學意義(P<0.05);正常對照組與CREB1干擾組突破內界膜的血管內皮細胞核數比較,差異無統計學意義(P>0.05);CREB1干擾組分別與OIR模型組、空載體組突破內界膜的血管內皮細胞核數比較,差異均有統計學意義(P<0.05);OIR模型組與空載體組突破內界膜的血管內皮細胞核數比較,差異無統計學意義(P>0.05)(圖 3)。
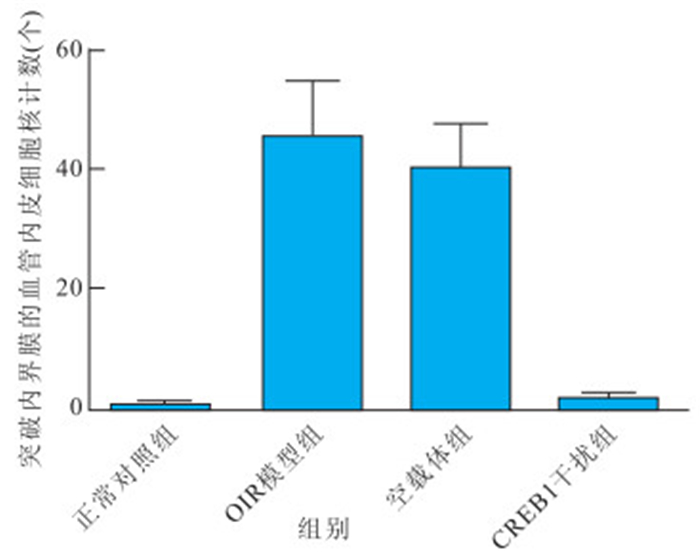 圖3
各組突破內界膜的血管內皮細胞核計數比較
圖3
各組突破內界膜的血管內皮細胞核計數比較
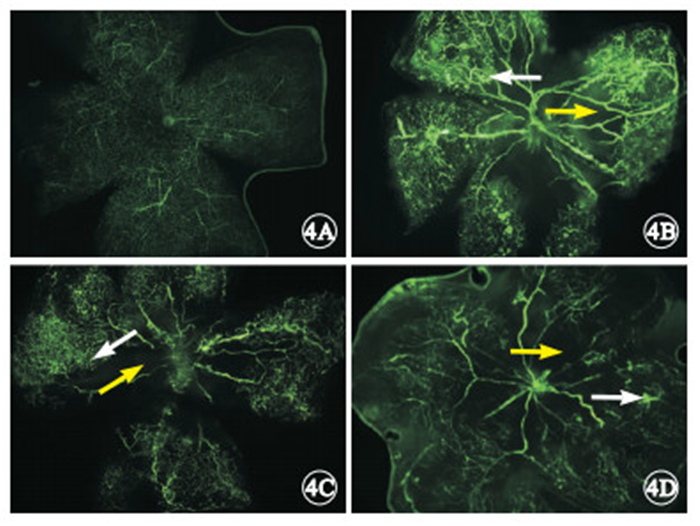
熒光顯微鏡觀察發現,正常對照組小鼠視網膜血管彼此連接形成規則網狀,均勻布滿中央部到周邊部的整個視網膜(圖 4A)。OIR模型組小鼠視網膜血管紆曲、擴張,后極部可見大片無灌注區,并伴中周部新生血管生長;周邊部血管網狀結構消失,熒光滲漏呈團狀(圖 4B)。空載體組小鼠視網膜后極部也可見大面積無血管區與中周部的新生血管形成,新生血管呈不規則的團簇狀(圖 4C)。CREB1干擾組小鼠視網膜血管走行基本均勻,可見少量無灌注區及少許新生血管叢(圖 4D)。
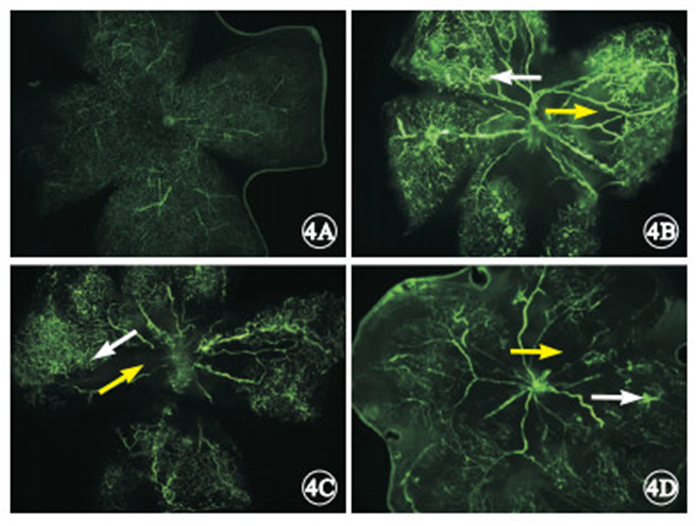 圖4
小鼠視網膜鋪片熒光顯微鏡像。4A.正常對照組,整個視網膜血管分布呈均勻網狀;4B. OIR模型組,視網膜中周部可見新生血管(白箭),后極部可見大片無灌注區(黃箭),伴熒光滲漏;4C. 空載體組,視網膜中周部可見新生血管(白箭),后極部可見大片無灌注區(黃箭),伴熒光滲漏;4D. CREB1干擾組,視網膜血管走行基本均勻,僅有少許新生血管叢(白箭)及少量無灌注區(黃箭) ×40
圖4
小鼠視網膜鋪片熒光顯微鏡像。4A.正常對照組,整個視網膜血管分布呈均勻網狀;4B. OIR模型組,視網膜中周部可見新生血管(白箭),后極部可見大片無灌注區(黃箭),伴熒光滲漏;4C. 空載體組,視網膜中周部可見新生血管(白箭),后極部可見大片無灌注區(黃箭),伴熒光滲漏;4D. CREB1干擾組,視網膜血管走行基本均勻,僅有少許新生血管叢(白箭)及少量無灌注區(黃箭) ×40
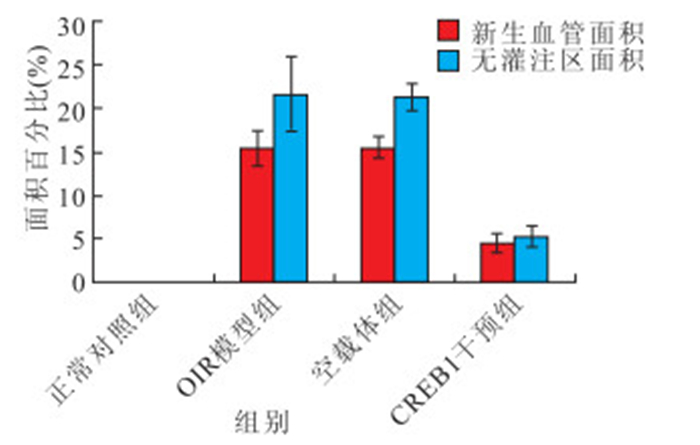
正常對照組、OIR模型組、空載體組及CREB1干擾組小鼠視網膜新生血管面積占全視網膜面積的百分比分別為0、(15.45±2.01)%、(15.56±1.19)%、(4.56±1.13)%;無灌注區面積占全視網膜面積的百分比分別為0、(21.66±4.25)%、(21.35±1.56)%、(5.28±1.22)%。OIR模型組、空載體組小鼠視網膜新生血管面積和無灌注區面積均較正常對照組明顯增大,CREB1干擾組小鼠視網膜新生血管面積和無灌注區面積均較OIR模型和空載體組明顯縮小。4組間小鼠視網膜新生血管面積和無灌注區面積比較,差異均有統計學意義(F=110.090、67.220,P<0.05)。CREB1干擾組小鼠視網膜新生血管面積和無灌注區面積與正常對照組、OIR模型組、空載體組比較,差異均有統計學意義(P<0.05);正常對照組小鼠視網膜新生血管面積和無灌注區面積與OIR模型組、空載體組比較,差異均有統計學意義(P<0.05);OIR模型組小鼠視網膜新生血管面積和無灌注區面積與空載體組比較,差異無統計學意義(P>0.05)(圖 5)。
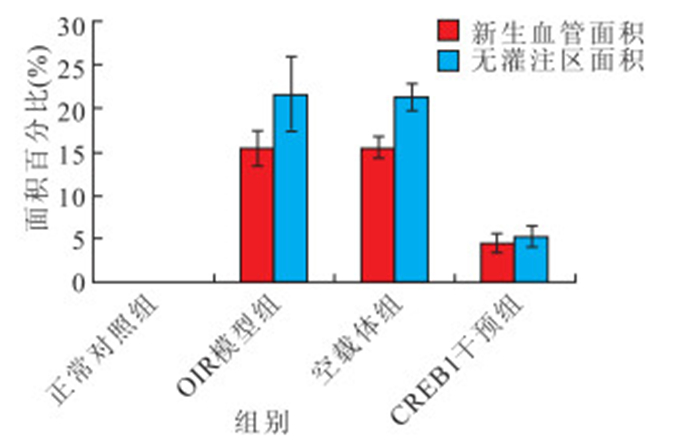 圖5
各組無灌注區面積和新生血管面積比較
圖5
各組無灌注區面積和新生血管面積比較
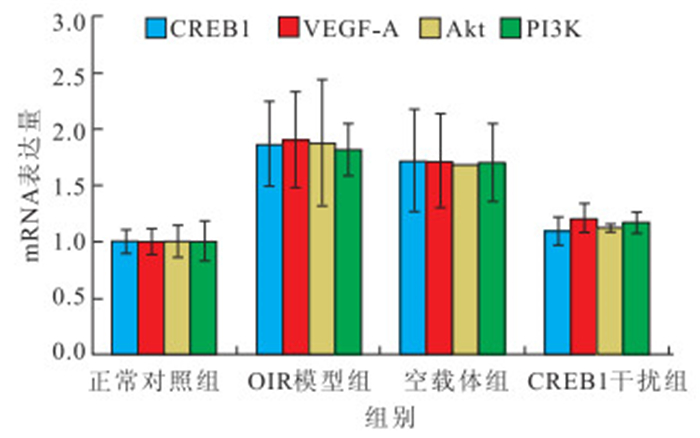
OIR模型組、空載體組小鼠視網膜CREB1、VEGF-A、Akt、PI3K mRNA表達均較正常對照組明 顯增加;CREB1干擾組小鼠視網膜CREB1、VEGF-A、 Akt、PI3K mRNA表達較OIR模型組、空載體組明顯下降。4組小鼠視網膜CREB1、VEGF-A、Akt、PI3K mRNA表達比較,差異均有統計學意義(F=6.087、5.464、6.191、8.627,P<0.05)。OIR模型組、空載體組分別與正常對照組小鼠視網膜CREB1、VEGF-A、Akt、PI3K mRNA表達比較,差異均有統計學意義(P<0.05);CREB1干擾組與OIR模型組、空載體組小鼠視網膜CREB1、VEGF-A、Akt、PI3K mRNA表達比較,差異均有統計學意義(P<0.05);OIR模型組與空載體組小鼠視網膜CREB1、VEGF-A、 Akt、PI3K mRNA表達比較,差異無統計學意義(P>0.05);CREB1干擾組與正常對照組小鼠視網膜CREB1、VEGF-A、Akt、PI3K mRNA表達比較,差異均無統計學意義(P>0.05)(圖 6)。
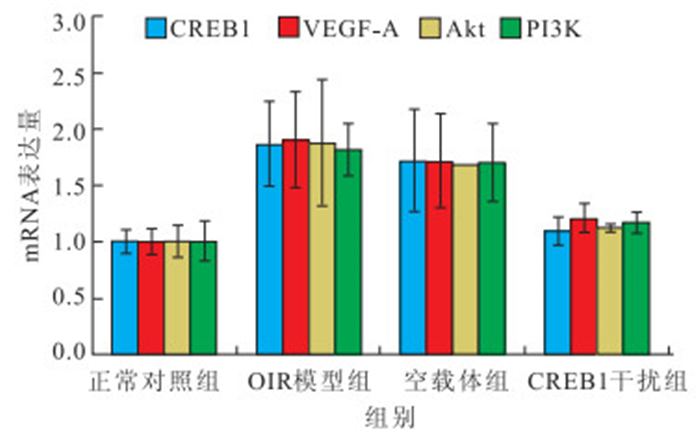 圖6
各組CREB1、VEGF-A、Akt、PI3K mRNA表達比較
圖6
各組CREB1、VEGF-A、Akt、PI3K mRNA表達比較
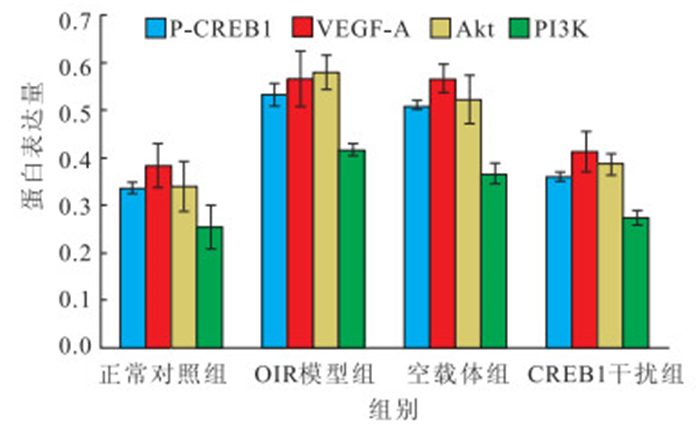
OIR模型組、空載體組小鼠視網膜P-CREB1、VEGF-A、Akt、PI3K蛋白表達均較正常對照組明顯增加;CREB1干擾組小鼠視網膜P-CREB1、VEGF-A、Akt、PI3K 蛋白表達較OIR模型組、空載體組明顯下降。4組小鼠視網膜P-CREB1、VEGF-A、Akt、PI3K 蛋白表達比較,差異均有統計學意義(F=162.944、13.861、19.710、22.827,P<0.05)。OIR模型組、空載體組分別與正常對照組小鼠視網膜P-CREB1、VEGF-A、Akt、PI3K蛋白表達比較,差異均有統計學意義(P<0.05);CREB1干擾組與OIR模型組、空載體組小鼠視網膜P-CREB1、VEGF-A、Akt、PI3K蛋白表達比較,差異均有統計學意義(P<0.05);OIR模型組與空載體組P-CREB1、VEGF-A、Akt、PI3K 蛋白表達比較,差異無統計學意義(P>0.05);CREB1干擾組與正常對照組P-CREB1、VEGF-A、Akt、PI3K 蛋白表達比較,差異均無統計學意義(P>0.05)(圖 7)。
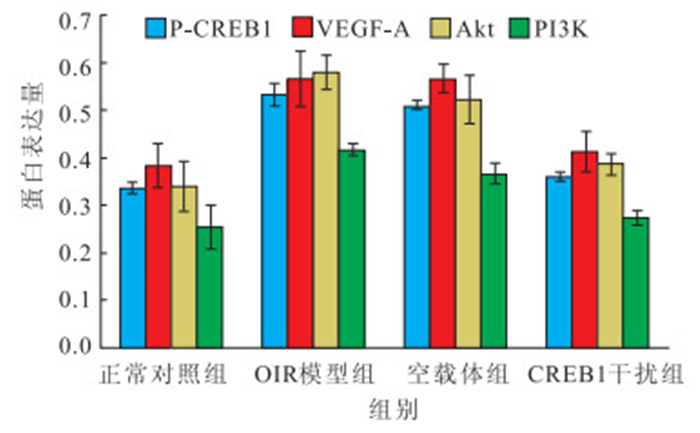 圖7
各組P-CREB1、VEGF-A、Akt、PI3K蛋白表達比較
圖7
各組P-CREB1、VEGF-A、Akt、PI3K蛋白表達比較
3 討論
本研究結果顯示,除正常對照組外其余3組小鼠視網膜均可見大面積無灌注區、新生血管及突破視網膜內界膜的血管內皮細胞核,證實OIR模型制備成功。我們通過RT-PCR檢測發現,其擴增片段與慢病毒載體相連后,經酶切、測序鑒定,測序結果序列比對完全正確。表明靶向CREB1的RNA干擾慢病毒的制備成功。在此基礎上,我們采用玻璃體腔顯微注射法將靶向CREB1 RNA干擾慢病毒轉染至小鼠視網膜組織內,再通過視網膜冰凍切片觀察其是否成功轉染。結果發現,CREB1干擾組小鼠視網膜內可見大量GFP表達。說明帶有目的基因的lenti-GFP成功轉染至小鼠視網膜中。
視網膜無灌注區的形成是誘發后期RNV形成的重要因素,其面積的大小與病理性新生血管形成的嚴重程度以及后續造成的血管滲漏、視網膜水腫、纖維組織增生牽拉造成的視網膜脫離甚至眼球萎縮密切相關。我們還通過比較各組小鼠視網膜新生血管及無灌注區相對面積,觀察CREB1靜默對RNV形成的影響。結果顯示,CREB1干擾組小鼠視網膜新生血管及無灌注區面積較OIR模型組和空載體組明顯減小。說明慢病毒介導的針對CREB1 siRNA的基因靜默對抑制RNV形成是有效的。同時我們還發現,CREB1干擾組突破內界膜的血管內皮細胞核數也較OIR模型組和空載體組明顯降低。這從病理學上進一步證實了缺氧條件下CREB1靜默對RNV的形成具有有效的抑制作用。
本研究結果顯示,OIR模型組和空載體組小鼠視網膜中CREB1表達均較正常對照組明顯升高,CREB1干擾組小鼠CREB1表達較OIR模型組和空載體組明顯降低。表明CREB1參與OIR的病理過程,而慢病毒攜帶的CREB1 siRNA質粒能有效減少OIR小鼠視網膜組織中CREB1 mRNA的表達,從而使CREB1蛋白的表達量也相應下調。
VEGF-A是眼部新生血管形成重要的調控因子[7, 8]。本研究結果顯示,缺氧情況下RNV形成過程中VEGF-A的mRNA和蛋白表達均較正常對照組升高,與Li等[7]和Miller等[9]報道的VEGF參與RNV形成這一結論一致。而CREB1干擾組VEGF-A的表達較OIR模型組和空載體組明顯降低,表明CREB1靜默對VEGF-A的表達起負調節作用。這也證實了CREB1靜默通過減少VEGF-A的生成發揮其抑制RNV形成的作用,與Wu等[10]報道的CREB 信號通路參與VEGF表達調節的結論是一致的。
已有研究證明,PI3K和Akt通路通過調節VEGF的表達參與斑馬魚及大鼠脈絡膜新生血管的形成[11, 12]。但CREB1靜默抑制OIR新生血管形成機制是否與調控PI3K和Akt的表達有關尚不明確。本研究結果顯示,OIR模型組和空載體組PI3K、Akt mRNA和蛋白表達均較正常對照組明顯升高,而CREB1干擾組PI3K、Akt mRNA和蛋白表達較OIR模型組和空載體組明顯降低,其變化趨勢與VEGF-A表達一致。說明與OIR新生血管形成有關的PI3K、Akt表達上調能被CREB1靜默所減弱。由此我們推測CREB1靜默可能通過負調節PI3K、Akt表達使VEGF-A的表達降低,從而減少RNV的形成。
然而我們在實驗中也發現,雖然CREB1干擾組 CREB1 mRNA和P-CREB1蛋白表達,以及VEGF-A、 AKT和PI3K的mRNA和蛋白表達與正常對照組相比無明顯差異,但CREB1干擾組小鼠視網膜仍然有新生血管和無灌注區的出現,這說明RNV的形成是由多種機制所致。由于我們僅僅干擾了其中的CREB1、VEGF-A、Akt、PI3K通路,故并不能完全阻止RNV形成。
本研究結果表明,CREB1靶向靜默可減少OIR 模型中RNV的生成,作用機制可能與其下調VEGF-A、 Akt及PI3K的表達有關。但CREB1靜默是如何下調Akt、PI3K表達以及VEGF-A是否對Akt、PI3K表達有影響,仍需進一步研究。
視網膜新生血管(RNV)生成是以缺血、缺氧為基礎,受多種因素及多通路調控,包含血管內皮細胞活化、增生、遷移及細胞外基質重塑等多步驟的復雜過程[1]。環腺苷酸反應成分結合蛋白(CREB)1屬于CREB激活轉錄因子家族,參與血管內膜形成及血管內皮化,在內皮細胞氧化應激損傷中有保護作用[2, 3]。同時也有研究發現,CREB1在腫瘤的低氧環境中對新生血管形成起重要作用[4]。但目前有關CREB1在RNV生成中的作用及其機制探討還少見報道。為此,我們通過玻璃體腔注射慢病毒介導的CREB1特異性小干擾RNA(siRNA)這一基因靜默方法,觀察了CREB1對小鼠RNV形成的影響,并對其可能作用機制進行了初步探討。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料及設備
5日齡C57BL/6J小鼠140只,體重4 g,雌雄不限,由武漢大學實驗動物中心提供。慢病毒表達載體(上海英為信生物科技有限公司),相對分子質量為2×106的異硫氰酸熒光素-葡聚糖(FITC-Dextran,美國Sigma 公司),磷酸化CREB1(P-CREB1)一抗(英國Abcam公司),血管內皮生長因子(VEGF)-A一抗(北京博奧森公司),絲氨酸/蘇氨酸蛋白激酶(Akt)一抗(美國Bioworld公司),磷脂酰肌醇3激酶(PI3K)一抗(美國Cell Signaling Technology公司),辣根過氧化物酶(HRP)標記二抗(武漢博士德生物工程有限公司),RSS-5100型測氧儀(上海雷磁創益儀器儀表有限公司)。引物合成委托南京金斯瑞生物科技有限公司完成。
1.2 靶向CREB1 RNA干擾慢病毒制備及實驗分組
根據美國國家生物技術信息中心小鼠核苷酸CREB1 mRNA序列(NM_133828.2),設計相應的siRNA干擾序列。正義鏈5-GATCCGCCTGAAAGC AACTACAGAATCTTCCTGTCAGAATTCTGTAG TTGCTTTCAGGCTTTTTG-3,反義鏈5-AATTCA GCCTGAAAGCAACTACAGAATTCTGACA GGAAGATTCTGTAGTTGCTTTCAGGCG-3,委托上海英為信生物科技有限公司合成含干擾序列的雙鏈DNA寡核苷酸,其兩端含酶切位點粘端,直接連入酶切后的RNA干擾載體上。將連接好的產物轉入制備好的細菌感受態細胞,對長出的克隆進行酶切鑒定,挑選陽性克隆送測序,進行測序比對后,鑒定陽性的克隆即為構建成功的CREB1基因RNA干擾質粒。用構建的攜帶增強型綠色熒光蛋白(GFP)的慢病毒表達載體(lenti-GFP)和包裝質粒共轉染293T細胞,包裝、收集病毒,超速離心濃縮,調整病毒滴度。同時設立未插入目的基因的lenti-GFP作為對照。將140只C57BL/6J小鼠分為正常對照組、氧誘導視網膜病變(OIR)模型組、空載體組及CREB1干擾組,每組35只。空載體組及CREB1干擾組小鼠于出生后5 d,在解剖顯微鏡下,分別用微量進樣器針尖緊貼角鞏緣后,穿過眼瞼皮膚及鞏膜,向右眼玻璃體腔注射1×109 TU/ml不含目的基因的慢病毒空載體和CREB1-RNA 干擾慢病毒載體1.0 μl。小鼠7日齡時,OIR模型組、空載體組及CREB1干擾組參照文獻[5]的方法建立OIR小鼠模型。正常對照組小鼠自出生即于正常室內空氣中飼養至17日齡,不作其他處理。
1.3 視網膜組織冰凍切片、視網膜切片、視網膜鋪片、逆轉錄聚合酶鏈反應(RT-PCR)及蛋白質免疫印跡法(Western blot)檢測
小鼠12日齡時,每組隨機選取4只小鼠,頸椎脫臼法處死。摘取眼球置于4%多聚甲醛中,4 ℃固定過夜,之后分別用20%和30%蔗糖液脫水,標本最佳切削溫度(OCT)包埋劑包埋,液氮冷凍后作連續切片,片厚12 μm。熒光顯微鏡下觀察GFP的表達。
小鼠17日齡時,取空載體組及CREB1干擾組小鼠各4只,頸椎脫臼法處死。摘取眼球,經4%多聚甲醛固定20 min,梯度蔗糖脫水過夜,OCT包埋劑包埋,液氮冷凍后作連續切片,片厚14 μm,5%牛血清白蛋白封閉20 min,兔抗鼠一抗P-CREB1(1∶200) 4 ℃ 孵育過夜,磷酸鹽緩沖液(PBS)沖洗3次,10 min/次,滴加Cy3標記羊抗兔IgG二抗(1∶200)37 ℃孵育1 h,PBS沖洗3次,10 min/次,4,6-聯脒-2-苯基吲哚避光染核5 min,甩干后用抗熒光衰減封片劑封片。陰性對照采用PBS代替一抗。熒光顯微鏡下觀察并攝片。小鼠17日齡時,每組隨機選取5只小鼠,頸椎脫臼法處死。摘除眼球,經4%多聚甲醛固定,常規梯度乙醇脫水、透明、石蠟包埋、矢狀位連續切片,片厚4 μm,相鄰2張切片間隔30 μm。每只眼球取5張切片行蘇木精-伊紅(HE)染色。用雙盲法統計每張切片中突破視網膜內界膜的血管內皮細胞核數目,統計時排除玻璃體腔與視網膜內界膜無聯系的血管內皮細胞核。
小鼠17日齡時,每組隨機選取4只小鼠。腹腔注射水合氯醛麻醉小鼠,固定后剪開胸腔,暴露心臟,經左心室將充分溶解的50 mg/ml FITC-Dextran快速注入。處死小鼠后摘取眼球于4%中性多聚甲醛室溫固定1 h。分離并放射狀切開視網膜,將視網膜平鋪在載玻片上。封片后熒光顯微鏡下圖像放大40倍拍照。Photoshop CS5軟件打開圖像,利用多邊形套索工具分別選取全視網膜及視網膜中新生血管區和無灌注區域,獲得相應的像素值,分別計算新生血管和無灌注區面積占全視網膜面積的百分比。每張視網膜圖像均由3位不同觀察者盲法計算視網膜新生血管及無灌注區面積[6]。
小鼠17日齡時,每組隨機選取8只小鼠,頸椎脫臼法處死。摘取右眼眼球,取出視網膜組織于液氮中凍存。提取總RNA,紫外分光光度計檢測總RNA,逆轉錄合成cDNA。將梯度稀釋的DNA模板及所有cDNA樣品分別配制成20 μl 聚合酶鏈反應(PCR)反應體系。Akt上游引物5′-ACTCATTCCAGACCCA CGAC-3′,下游引物5′-CCGGTACACCACGTTCTT CT-3′,擴增片段長度為176堿基對(bp)。VEGF-A上游引物5′-GCCTTGTTCAGAGCGGAGAA-3′,下游引物5′-CTTTCCGGTGAGAGGTCTGG-3′,擴增片段長度為205 bp。PI3K上游引物5′-CATGACGA GAAGACGTGGAA-3′,下游引物5′-CCGGTGGCAG TCTTGTTAAT-3′,擴增片段長度為179 bp。CREB1 上游引物5′-AACAATGGTACGGATGGG GT-3′,下游引物5′-GCCATAACAACTCCAGGGGC-3′,擴增片段長度為224 bp。β-肌動蛋白(β-actin)上游引物5′-CACGATGGAGGGGCCGGACTCATC-3′,下游引物5′-TAAAGACCTCTATGCCAACACAGT-3′,擴增片段長度為240 bp。PCR反應條件:50 ℃預變性2 min,95 ℃變性10 min,95 ℃ 30 s,60°C退火30 s,共40個循環。檢測小鼠視網膜組織中CREB1、VEGF-A、Akt、PI3K mRNA的表達。所有標本檢測3次,用標準曲線的2-△△CT相對定量法進行計算。
小鼠17日齡時,每組隨機選取10只小鼠,頸椎脫臼法處死。摘取右眼眼球,取出視網膜組織,提取視網膜總蛋白。根據蛋白分子量配置10%的聚丙烯酰胺凝膠電泳。根據預染分子量標準物顯示,判斷目的蛋白得到充分分離后停止電泳。取出凝膠,根據分子量標準物切下目的條帶,用蒸餾水沖洗后進行轉膜。從負極到正極依次為纖維墊、濾紙、凝膠、聚偏二氟乙烯(PVDF)膜、濾紙和纖維墊。含5%脫脂奶粉的洗膜緩沖液浸泡PVDF膜,室溫搖床封閉2 h。分別孵育經5%脫脂奶粉的磷酸鹽吐溫緩沖液(PBST)稀釋的VEGF-A(1∶300)、Akt(1∶700)、P-CREB1(1∶600)、PI3K(1∶700)一抗,4 ℃過夜。PBST洗膜5次,5 min/次。用封閉液稀釋相應的HRP標記二抗(1∶70 000),孵育二抗。置室溫2 h,PBST洗膜5次,5 min/次。顯影、定影,拍照,分析。
1.4 統計學方法
采用SPSS 20.0統計軟件行統計學分析。計量資料以均數±標準差(
2 結果
RT-PCR擴增獲得的目的基因片段與片段理論值相符。擴增片段與慢病毒載體相連后,經酶切、測序鑒定,測序結果序列比對完全正確。測定病毒滴度達1×109 TU/ml。
冰凍切片熒光顯微鏡觀察發現,正常對照組小鼠視網膜中未見GFP表達(圖 1A),CREB1干擾組小鼠視網膜中可見大量GFP表達(圖 1B)。
冰凍切片免疫熒光法顯微鏡觀察發現,正常對照組小鼠視網膜中僅見少量P-CREB1蛋白熒光表達(圖 2A);OIR模型組和空載體組小鼠視網膜中可見大量P-CREB1蛋白熒光表達,主要位于內核層(INL)和神經節細胞層(GCL),外核層(ONL)基本無表達(圖 2B,2C);CREB1干擾組小鼠視網膜中P-CREB1蛋白熒光表達明顯減弱(圖 2D)。
 圖1
小鼠視網膜組織冰凍切片熒光顯微鏡像。1A. 正常對照組,未見GFP表達;1B. CREB1干擾組,可見大量GFP表達 ×200 ? ?圖 2 小鼠視網膜組織冰凍切片免疫熒光顯微鏡像。2A.正常對照組,僅見少量P-CREB1蛋白熒光表達;2B. OIR模型組,可見大量P-CREB1蛋白熒光表達,主要位于視網膜INL和GCL;2C.空載體組,可見大量P-CREB1蛋白熒光表達,主要位于視網膜INL和GCL;2D. CREB1干擾組,P-CREB1 蛋白熒光表達明顯減弱 ×400
圖1
小鼠視網膜組織冰凍切片熒光顯微鏡像。1A. 正常對照組,未見GFP表達;1B. CREB1干擾組,可見大量GFP表達 ×200 ? ?圖 2 小鼠視網膜組織冰凍切片免疫熒光顯微鏡像。2A.正常對照組,僅見少量P-CREB1蛋白熒光表達;2B. OIR模型組,可見大量P-CREB1蛋白熒光表達,主要位于視網膜INL和GCL;2C.空載體組,可見大量P-CREB1蛋白熒光表達,主要位于視網膜INL和GCL;2D. CREB1干擾組,P-CREB1 蛋白熒光表達明顯減弱 ×400
正常對照組、OIR模型組、空載體組及CREB1干 擾組突破內界膜的血管內皮細胞核計數分別為(0.52± 0.44)、(45.64±9.23)、(40.23±7.35)、(1.67±0.67)個。正常對照組分別與模型組和空載體組突破內界膜的血管內皮細胞核數比較,差異均有統計學意義(P<0.05);正常對照組與CREB1干擾組突破內界膜的血管內皮細胞核數比較,差異無統計學意義(P>0.05);CREB1干擾組分別與OIR模型組、空載體組突破內界膜的血管內皮細胞核數比較,差異均有統計學意義(P<0.05);OIR模型組與空載體組突破內界膜的血管內皮細胞核數比較,差異無統計學意義(P>0.05)(圖 3)。
 圖3
各組突破內界膜的血管內皮細胞核計數比較
圖3
各組突破內界膜的血管內皮細胞核計數比較
熒光顯微鏡觀察發現,正常對照組小鼠視網膜血管彼此連接形成規則網狀,均勻布滿中央部到周邊部的整個視網膜(圖 4A)。OIR模型組小鼠視網膜血管紆曲、擴張,后極部可見大片無灌注區,并伴中周部新生血管生長;周邊部血管網狀結構消失,熒光滲漏呈團狀(圖 4B)。空載體組小鼠視網膜后極部也可見大面積無血管區與中周部的新生血管形成,新生血管呈不規則的團簇狀(圖 4C)。CREB1干擾組小鼠視網膜血管走行基本均勻,可見少量無灌注區及少許新生血管叢(圖 4D)。
 圖4
小鼠視網膜鋪片熒光顯微鏡像。4A.正常對照組,整個視網膜血管分布呈均勻網狀;4B. OIR模型組,視網膜中周部可見新生血管(白箭),后極部可見大片無灌注區(黃箭),伴熒光滲漏;4C. 空載體組,視網膜中周部可見新生血管(白箭),后極部可見大片無灌注區(黃箭),伴熒光滲漏;4D. CREB1干擾組,視網膜血管走行基本均勻,僅有少許新生血管叢(白箭)及少量無灌注區(黃箭) ×40
圖4
小鼠視網膜鋪片熒光顯微鏡像。4A.正常對照組,整個視網膜血管分布呈均勻網狀;4B. OIR模型組,視網膜中周部可見新生血管(白箭),后極部可見大片無灌注區(黃箭),伴熒光滲漏;4C. 空載體組,視網膜中周部可見新生血管(白箭),后極部可見大片無灌注區(黃箭),伴熒光滲漏;4D. CREB1干擾組,視網膜血管走行基本均勻,僅有少許新生血管叢(白箭)及少量無灌注區(黃箭) ×40
正常對照組、OIR模型組、空載體組及CREB1干擾組小鼠視網膜新生血管面積占全視網膜面積的百分比分別為0、(15.45±2.01)%、(15.56±1.19)%、(4.56±1.13)%;無灌注區面積占全視網膜面積的百分比分別為0、(21.66±4.25)%、(21.35±1.56)%、(5.28±1.22)%。OIR模型組、空載體組小鼠視網膜新生血管面積和無灌注區面積均較正常對照組明顯增大,CREB1干擾組小鼠視網膜新生血管面積和無灌注區面積均較OIR模型和空載體組明顯縮小。4組間小鼠視網膜新生血管面積和無灌注區面積比較,差異均有統計學意義(F=110.090、67.220,P<0.05)。CREB1干擾組小鼠視網膜新生血管面積和無灌注區面積與正常對照組、OIR模型組、空載體組比較,差異均有統計學意義(P<0.05);正常對照組小鼠視網膜新生血管面積和無灌注區面積與OIR模型組、空載體組比較,差異均有統計學意義(P<0.05);OIR模型組小鼠視網膜新生血管面積和無灌注區面積與空載體組比較,差異無統計學意義(P>0.05)(圖 5)。
 圖5
各組無灌注區面積和新生血管面積比較
圖5
各組無灌注區面積和新生血管面積比較
OIR模型組、空載體組小鼠視網膜CREB1、VEGF-A、Akt、PI3K mRNA表達均較正常對照組明 顯增加;CREB1干擾組小鼠視網膜CREB1、VEGF-A、 Akt、PI3K mRNA表達較OIR模型組、空載體組明顯下降。4組小鼠視網膜CREB1、VEGF-A、Akt、PI3K mRNA表達比較,差異均有統計學意義(F=6.087、5.464、6.191、8.627,P<0.05)。OIR模型組、空載體組分別與正常對照組小鼠視網膜CREB1、VEGF-A、Akt、PI3K mRNA表達比較,差異均有統計學意義(P<0.05);CREB1干擾組與OIR模型組、空載體組小鼠視網膜CREB1、VEGF-A、Akt、PI3K mRNA表達比較,差異均有統計學意義(P<0.05);OIR模型組與空載體組小鼠視網膜CREB1、VEGF-A、 Akt、PI3K mRNA表達比較,差異無統計學意義(P>0.05);CREB1干擾組與正常對照組小鼠視網膜CREB1、VEGF-A、Akt、PI3K mRNA表達比較,差異均無統計學意義(P>0.05)(圖 6)。
 圖6
各組CREB1、VEGF-A、Akt、PI3K mRNA表達比較
圖6
各組CREB1、VEGF-A、Akt、PI3K mRNA表達比較
OIR模型組、空載體組小鼠視網膜P-CREB1、VEGF-A、Akt、PI3K蛋白表達均較正常對照組明顯增加;CREB1干擾組小鼠視網膜P-CREB1、VEGF-A、Akt、PI3K 蛋白表達較OIR模型組、空載體組明顯下降。4組小鼠視網膜P-CREB1、VEGF-A、Akt、PI3K 蛋白表達比較,差異均有統計學意義(F=162.944、13.861、19.710、22.827,P<0.05)。OIR模型組、空載體組分別與正常對照組小鼠視網膜P-CREB1、VEGF-A、Akt、PI3K蛋白表達比較,差異均有統計學意義(P<0.05);CREB1干擾組與OIR模型組、空載體組小鼠視網膜P-CREB1、VEGF-A、Akt、PI3K蛋白表達比較,差異均有統計學意義(P<0.05);OIR模型組與空載體組P-CREB1、VEGF-A、Akt、PI3K 蛋白表達比較,差異無統計學意義(P>0.05);CREB1干擾組與正常對照組P-CREB1、VEGF-A、Akt、PI3K 蛋白表達比較,差異均無統計學意義(P>0.05)(圖 7)。
 圖7
各組P-CREB1、VEGF-A、Akt、PI3K蛋白表達比較
圖7
各組P-CREB1、VEGF-A、Akt、PI3K蛋白表達比較
3 討論
本研究結果顯示,除正常對照組外其余3組小鼠視網膜均可見大面積無灌注區、新生血管及突破視網膜內界膜的血管內皮細胞核,證實OIR模型制備成功。我們通過RT-PCR檢測發現,其擴增片段與慢病毒載體相連后,經酶切、測序鑒定,測序結果序列比對完全正確。表明靶向CREB1的RNA干擾慢病毒的制備成功。在此基礎上,我們采用玻璃體腔顯微注射法將靶向CREB1 RNA干擾慢病毒轉染至小鼠視網膜組織內,再通過視網膜冰凍切片觀察其是否成功轉染。結果發現,CREB1干擾組小鼠視網膜內可見大量GFP表達。說明帶有目的基因的lenti-GFP成功轉染至小鼠視網膜中。
視網膜無灌注區的形成是誘發后期RNV形成的重要因素,其面積的大小與病理性新生血管形成的嚴重程度以及后續造成的血管滲漏、視網膜水腫、纖維組織增生牽拉造成的視網膜脫離甚至眼球萎縮密切相關。我們還通過比較各組小鼠視網膜新生血管及無灌注區相對面積,觀察CREB1靜默對RNV形成的影響。結果顯示,CREB1干擾組小鼠視網膜新生血管及無灌注區面積較OIR模型組和空載體組明顯減小。說明慢病毒介導的針對CREB1 siRNA的基因靜默對抑制RNV形成是有效的。同時我們還發現,CREB1干擾組突破內界膜的血管內皮細胞核數也較OIR模型組和空載體組明顯降低。這從病理學上進一步證實了缺氧條件下CREB1靜默對RNV的形成具有有效的抑制作用。
本研究結果顯示,OIR模型組和空載體組小鼠視網膜中CREB1表達均較正常對照組明顯升高,CREB1干擾組小鼠CREB1表達較OIR模型組和空載體組明顯降低。表明CREB1參與OIR的病理過程,而慢病毒攜帶的CREB1 siRNA質粒能有效減少OIR小鼠視網膜組織中CREB1 mRNA的表達,從而使CREB1蛋白的表達量也相應下調。
VEGF-A是眼部新生血管形成重要的調控因子[7, 8]。本研究結果顯示,缺氧情況下RNV形成過程中VEGF-A的mRNA和蛋白表達均較正常對照組升高,與Li等[7]和Miller等[9]報道的VEGF參與RNV形成這一結論一致。而CREB1干擾組VEGF-A的表達較OIR模型組和空載體組明顯降低,表明CREB1靜默對VEGF-A的表達起負調節作用。這也證實了CREB1靜默通過減少VEGF-A的生成發揮其抑制RNV形成的作用,與Wu等[10]報道的CREB 信號通路參與VEGF表達調節的結論是一致的。
已有研究證明,PI3K和Akt通路通過調節VEGF的表達參與斑馬魚及大鼠脈絡膜新生血管的形成[11, 12]。但CREB1靜默抑制OIR新生血管形成機制是否與調控PI3K和Akt的表達有關尚不明確。本研究結果顯示,OIR模型組和空載體組PI3K、Akt mRNA和蛋白表達均較正常對照組明顯升高,而CREB1干擾組PI3K、Akt mRNA和蛋白表達較OIR模型組和空載體組明顯降低,其變化趨勢與VEGF-A表達一致。說明與OIR新生血管形成有關的PI3K、Akt表達上調能被CREB1靜默所減弱。由此我們推測CREB1靜默可能通過負調節PI3K、Akt表達使VEGF-A的表達降低,從而減少RNV的形成。
然而我們在實驗中也發現,雖然CREB1干擾組 CREB1 mRNA和P-CREB1蛋白表達,以及VEGF-A、 AKT和PI3K的mRNA和蛋白表達與正常對照組相比無明顯差異,但CREB1干擾組小鼠視網膜仍然有新生血管和無灌注區的出現,這說明RNV的形成是由多種機制所致。由于我們僅僅干擾了其中的CREB1、VEGF-A、Akt、PI3K通路,故并不能完全阻止RNV形成。
本研究結果表明,CREB1靶向靜默可減少OIR 模型中RNV的生成,作用機制可能與其下調VEGF-A、 Akt及PI3K的表達有關。但CREB1靜默是如何下調Akt、PI3K表達以及VEGF-A是否對Akt、PI3K表達有影響,仍需進一步研究。