引用本文: 田敏, 周琦, 呂紅彬, 李友誼, 何躍, 歐陽科. 5, 6-二氫環戊烯并1, 2-二硫雜環戊烯-3-硫酮對2型糖尿病大鼠視網膜核因子NF-E2相關因子及血紅素氧合酶-1表達的影響. 中華眼底病雜志, 2014, 30(2): 187-192. doi: 10.3760/cma.j.issn.1005-1015.2014.02.016 復制
氧化應激(OS)作為糖尿病視網膜病變(DR)不同發病機制的共同起始途徑已被認可[1]。核因子NF-E2相關因子(Nrf2)通過與抗氧化反應元件(ARE)相互作用調節編碼抗氧化蛋白,是迄今為止發現的最為重要的內源性抗OS信號通路[2]。Nrf2基因敲除小鼠的血視網膜屏障及神經元功能明顯受損,增強Nrf2的表達有可能成為治療DR的新策略[3]。Ⅱ相酶誘導劑5, 6-二氫環戊烯并1, 2-二硫雜環戊烯-3-硫酮(CPDT)是Nrf2/ARE信號通路下游靶基因的強效誘導劑,其可以通過激活Nrf2促進血紅素氧合酶-1(HO-1)的表達[4]。在糖尿病大鼠視網膜中,HO-1的高表達具有抗炎、抗氧化損傷、抗細胞凋亡、抗增生作用[5]。但目前,有關CPDT對DR的作用的研究尚少。因此,為了解CPDT對DR的作用及其相關機制,我們觀察了CPDT對2型糖尿病大鼠視網膜OS損傷的保護作用以及其對Nrf2/ARE/HO-1信號通路的影響。現將結果報道如下。
1 材料和方法
1.1 動物分組及模型制備
參照文獻[6~8]的方法,采用高脂高糖飼料聯合腹腔注射小劑量鏈脲佐菌素(STZ)的方法制備2型糖尿病動物模型。4周齡的清潔級Wistar雄性大鼠35只,180~200 g,購自重慶騰鑫生物科技有限公司。適應性喂養1周后,隨機抽取8只為正常組,其余27只為造模組。正常組大鼠接受標準大鼠飼料喂養,造模組大鼠接受高脂高糖飼料。高脂高糖飼料含豬油18%,蔗糖20%,蛋黃3%,基礎飼料59%。飼養2個月,空腹12 h后,造模組大鼠按體重35 mg/kg腹腔注射STZ(美國Sigma公司),用pH4.5的0.1 mol/L檸檬酸-檸檬酸鈉緩沖液將STZ稀釋至1%的濃度,正常組大鼠注射相同體積的檸檬酸-檸檬酸鈉緩沖液。觀察2 h,恢復飲食。造模7 d后,尾部采血測定空腹血糖濃度大于16.7 mmol/L即為成功的糖尿病大鼠模型。造模組再隨機分為糖尿病組和CPDT干預組。實驗期間大鼠自由進食,飲水,不使用胰島素及其他降糖藥物。參照文獻[9, 10]的方法,CPDT干預組于糖尿病成模后1周開始在高脂高糖飼料中添加質量濃度1%的CPDT(美國Sigma公司)。糖尿病組繼續飼養高脂高糖飲食;正常組繼續飼養普通飼料。繼續飼養8周。
1.2 標本收集
藥物干預飼養8周后,禁食6~8 h,斷尾取血,應用血糖試紙測定血糖值并記錄。按體重50 mg/kg腹腔注射2%戊巴比妥鈉麻醉大鼠。打開胸腔,穿刺心臟收集全血,測定血清丙二醛(MDA)濃度。正常組及糖尿病組大鼠同時檢測血脂含量。立即摘取眼球,一部分眼球使用19G穿刺刀穿刺前房后固定于4%多聚甲醛溶液中24 h以上,用于免疫組織化學法檢測Nrf2、HO-1蛋白在視網膜組織的表達。分離余下部分眼球的視網膜,放入裝有組織保存劑的去RNA酶的1.5 ml離心管中,速存于液氮速凍后-80 ℃保存。部分視網膜組織提取總RNA,檢測Nrf2、HO-1 mRNA表達;部分視網膜組織用于蛋白質免疫印跡(Western blot)法檢測Nrf2、HO-1蛋白表達。
1.3 檢測方法
采用日立7180全自動生化分析儀測定血清總膽固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)含量。采用MDA測定試劑盒(南京建成生物工程公司)檢測血清MDA濃度。各檢測重復3次,取平均值。
采用免疫組織化學檢測法檢測視網膜Nrf2、HO-1表達。正常組取4只眼球,糖尿病組和CPDT干預組各取4只眼球。將固定后的眼球常規石蠟包埋,連續4 μm切片,用于蘇木素-伊紅(HE)及免疫組織化學染色。部分切片常規行HE染色后中性樹膠封片后光學顯微鏡下觀察視網膜結構。部分切片常規免疫組織化學染色,參照文獻[11]的方法,一抗使用1:100的兔抗大鼠Nrf2、HO-1多克隆抗體(美國Bioworld公司),二抗使用加生物素化山羊抗兔IgG(武漢博士德生物工程公司),二氨基聯苯胺(DAB)顯色。使用Lecia DM4000B數字顯微鏡及Image-Pro Plus圖像分析軟件分析Nrf2、HO-1表達。每組切片隨機抽取10張,每張切片于高倍鏡下選擇3處不同視野,測定圖像中有棕黃色或棕褐色陽性反應部位的平均吸光度[A,舊稱光密度(OD)]值,記為Nrf2、HO-1表達值。實驗重復3次,取平均值。
采用逆轉錄-聚合酶鏈反應(RT-PCR)法檢測視網膜Nrf2、HO-1 mRNA表達。由上海生工生物公司設計Nrf2、HO-1的檢測引物。參照文獻[5]的方法設計引物,Nrf2、HO-1的產物分別為219、107堿基對(bp)。正常組取6份視網膜,糖尿病組和CPDT干預組各取6份。使用RNA提取試劑盒(北京天根生化科技公司)分別提取各組視網膜總RNA。用逆轉錄試劑盒(美國Invitrogen公司)進行RNA逆轉錄,用聚合酶鏈反應(PCR)擴增試劑盒(大連寶生物工程公司)進行PCR擴增。擴增程序分別為:Nrf2 mRNA:94 ℃ 3 min,94 ℃ 30 s→57 ℃ 30 s→72 ℃ 30 s,循環45次,72 ℃ 5 min;HO-1 mRNA:94 ℃ 3 min,94 ℃ 30 s→50 ℃ 30 s→72 ℃ 20 s,循環42次,72 ℃ 5 min;內參照甘油醛-3-磷酸脫氫酶(GAPDH),循環30次。反應結束后,RT-PCR產物電泳并攝圖,使用Quantity One4.2軟件分析各組目的基因和GAPDH的條帶灰度值,以兩者的比值作為目的基因的表達量。實驗重復3次,取平均值。
采用Western blot法檢測視網膜Nrf2、HO-1蛋白表達。正常組取6份視網膜,糖尿病組和CPDT干預組各取12份。將視網膜組織制成2%視網膜勻漿,用考馬斯亮蘭蛋白測定試劑盒(南京建成生物工程公司)測定蛋白濃度。每個泳道上樣量為50 μg,一抗為1:500的兔抗大鼠Nrf2、HO-1多克隆抗體(美國Bioworld公司),二抗為1:1000的辣根過氧化物酶標記羊抗兔IgG(武漢博士德生物工程公司),以β-肌動蛋白(β-actin)作為內參照,其余步驟參照文獻[12]的方法。使用Quantity One4.2軟件分析,比較各組Nrf2、HO-1條帶灰度值與β-actin條帶灰度值的比值,表示各組蛋白相對表達水平。實驗重復3次,取平均值。
1.4 統計學方法
用SPSS 17.0軟件進行統計學分析。實驗測試指標的數據資料以均數±標準差(
2 結果
因2只大鼠血糖值不符合標準被剔除出組,造模成功大鼠25只。糖尿病大鼠成模率為92.6%。其中,糖尿病組13只,CPDT干預組12只。糖尿病組死亡2只。這2只大鼠血糖過高(>33 mmol/L),尾部出現膿腫,雙眼球結膜有黃白色分泌物,食欲不振,毛皮污穢無光澤,精神極度萎靡。死亡原因可能是由于血糖過高伴全身感染。CPDT干預組死亡1只。該大鼠行CPDT干預后便食欲不振,活動、體重均逐漸減少,口鼻周圍體毛臟亂,有脫毛癥狀。其死亡可能與CPDT的干預有關。最終用于實驗的正常組大鼠8只,糖尿病組、CPDT干預組大鼠各11只。
藥物干預飼養8周時,正常組、糖尿病組、CPDT干預組大鼠血糖值分別為(5.40±0.85)、 (24.86±3.31)、(11.51±2.45) mmol/L。三組間大鼠血糖值比較,差異有統計學意義(χ2=25.812,P=0.000),糖尿病組大鼠血糖值顯著高于正常組和CPDT干預組。正常組與糖尿病組大鼠血脂水平比較,差異有統計學意義,糖尿病組大鼠血脂水平顯著高于正常組(FTC=65.866,FTG=25.441,FLDL-C=38.889,P=0.000)(表 1)。
正常組、糖尿病組、CPDT干預組大鼠血清MDA分別為(3.75±0.72)、(7.85±1.16)、(4.82±0.64) μmol/L。三組間大鼠血清MDA比較,差異有統計學意義(F=59.545,P=0.000)。其中,糖尿病組大鼠血清MDA明顯高于正常組(t=10.523,P=0.000);CPDT干預組大鼠血清MDA明顯低于糖尿病組(t=7.766,P=0.000)。
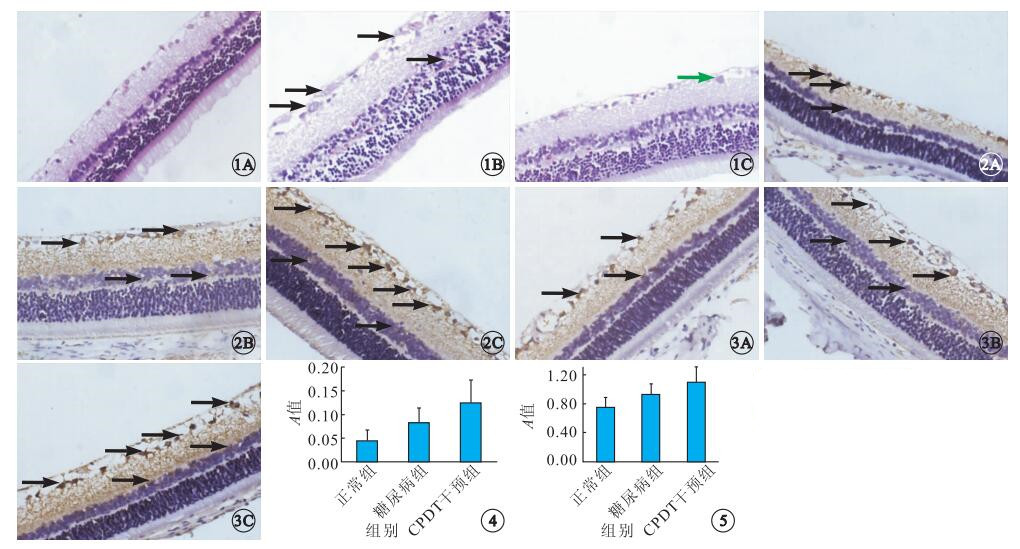
光學顯微鏡下,正常組視網膜各層組織排列整齊,無細胞腫脹,內界膜、外界膜清楚,視網膜神經節細胞層單層排列(圖 1A)。糖尿病組視網膜各層組織排列紊亂,視網膜增厚,細胞間質水腫,神經纖維層增厚,神經節細胞空泡變性,細胞染色質邊緣聚集,內叢狀層水腫,內核層細胞空泡變性,內、外核層部分融合,內、外界膜排列不清楚(圖 1B)。CPDT干預組大鼠視網膜神經纖維層、神經節細胞層、光感受器細胞層排列基本整齊,內、外界膜基本清楚,各層組織水腫現象較糖尿病組輕,部分神經節細胞出現輕度腫脹(圖 1C)。
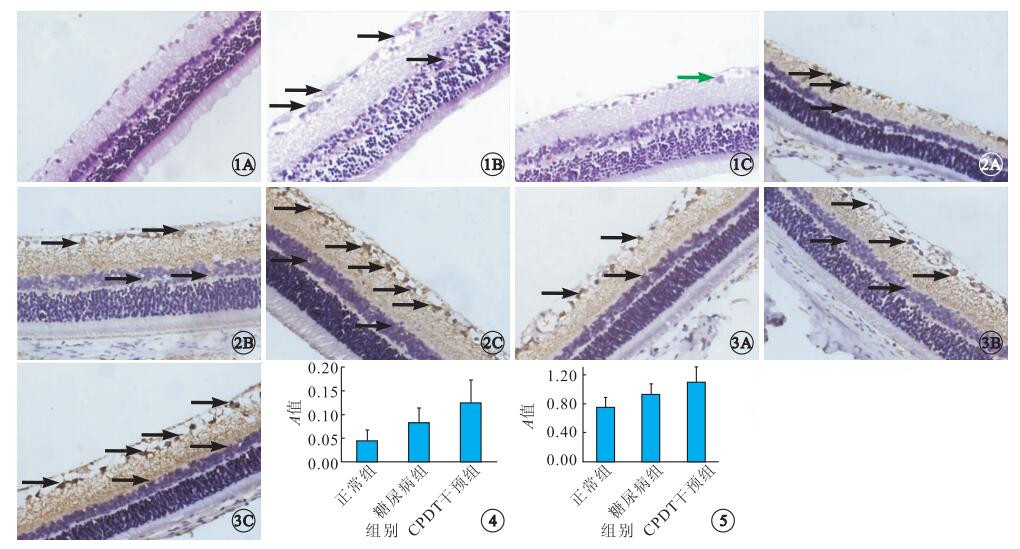 圖1
各組大鼠視網膜光學顯微鏡像。1A.正常組;1B.糖尿病組;1C.CPDT干預組。正常組視網膜各層組織排列整齊、清晰,無細胞腫脹;糖尿病組視網膜各層組織排列紊亂,神經纖維層增厚,神經節細胞空泡變性,細胞染色質邊緣聚集,內核層細胞空泡變性(黑箭);CPDT干預組視網膜各層排列基本整齊,內、外界膜基本清楚,部分神經節細胞出現輕度腫脹(綠箭) HE ×400??圖 2??各組大鼠視網膜組織Nrf2表達光學顯微鏡像。2A.正常組;2B.糖尿病組;2C.CPDT干預組。視網膜神經節細胞層、內核層、內叢狀層均可見Nrf2表達,主要為細胞漿染色(黑箭) DAB ×400??圖 3??各組大鼠視網膜組織HO-1表達光學顯微鏡像。3A.正常組;3B.糖尿病組;3C.CPDT干預組。視網膜神經節細胞層、內核層、內叢狀層均可見HO-1表達,主要為細胞漿染色(黑箭) DAB ×400??圖 4??各組大鼠視網膜組織Nrf2蛋白表達平均A值比較??圖 5??各組大鼠視網膜組織HO-1蛋白表達平均A值比較
圖1
各組大鼠視網膜光學顯微鏡像。1A.正常組;1B.糖尿病組;1C.CPDT干預組。正常組視網膜各層組織排列整齊、清晰,無細胞腫脹;糖尿病組視網膜各層組織排列紊亂,神經纖維層增厚,神經節細胞空泡變性,細胞染色質邊緣聚集,內核層細胞空泡變性(黑箭);CPDT干預組視網膜各層排列基本整齊,內、外界膜基本清楚,部分神經節細胞出現輕度腫脹(綠箭) HE ×400??圖 2??各組大鼠視網膜組織Nrf2表達光學顯微鏡像。2A.正常組;2B.糖尿病組;2C.CPDT干預組。視網膜神經節細胞層、內核層、內叢狀層均可見Nrf2表達,主要為細胞漿染色(黑箭) DAB ×400??圖 3??各組大鼠視網膜組織HO-1表達光學顯微鏡像。3A.正常組;3B.糖尿病組;3C.CPDT干預組。視網膜神經節細胞層、內核層、內叢狀層均可見HO-1表達,主要為細胞漿染色(黑箭) DAB ×400??圖 4??各組大鼠視網膜組織Nrf2蛋白表達平均A值比較??圖 5??各組大鼠視網膜組織HO-1蛋白表達平均A值比較
免疫組織化學法檢測結果顯示,Nrf2、HO-1蛋白陽性表達定位于視網膜神經節細胞層、內核層、內叢狀層(圖 2,3)。各組大鼠視網膜Nrf2、HO-1蛋白表達量比較,差異有統計學意義(FNrf2=16.206,FHO-1=46.790,P=0.000)(圖 4,5)。其中,CPDT干預組大鼠視網膜Nrf2、HO-1蛋白表達量高于糖尿病組(tNrf2=3.172,PNrf2=0.003;tHO-1=6.321,PHO-1=0.000);糖尿病組大鼠視網膜Nrf2、HO-1蛋白表達量高于正常組(tNrf2=2.679,PNrf2=0.011;tHO-1=3.482,PHO-1=0.001)。
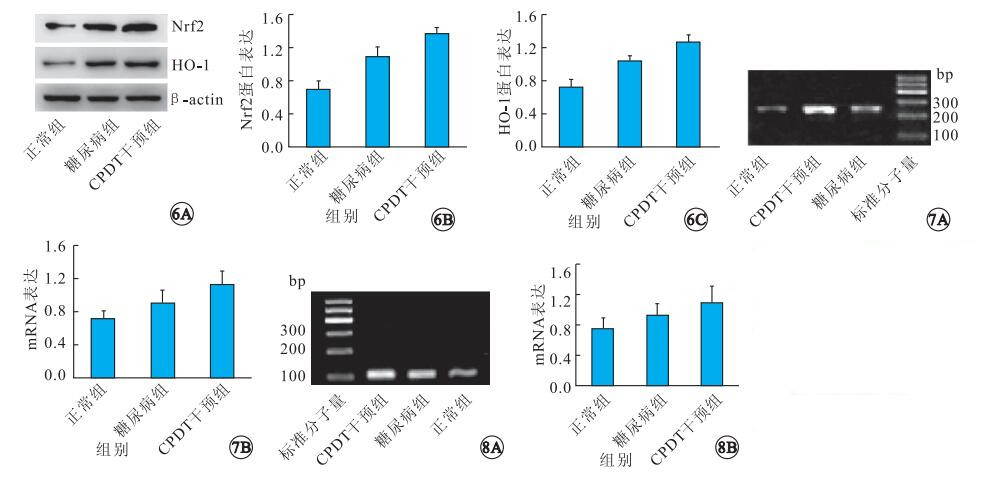
Western blot檢測結果顯示,各組大鼠視網膜Nrf2、HO-1蛋白表達比較,差異有統計學意義(FNrf2=112.823,FHO-1=119.361,P=0.000)(圖 6)。其中,糖尿病組大鼠視網膜Nrf2、HO-1蛋白表達明顯高于正常組(tNrf2=8.746,tHO-1=8.988,P=0.000);CPDT干預組大鼠視網膜Nrf2、HO-1蛋白表達明顯高于糖尿病組(tNrf2=6.203,tHO-1=6.388,P=0.000)。
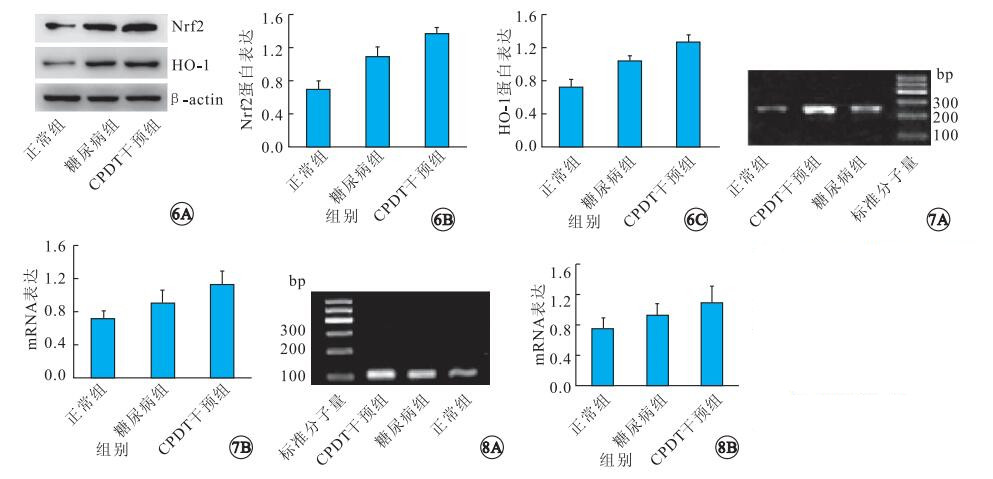 圖6
各組大鼠視網膜Nrf2、HO-1蛋白表達比較。6A.Western blot檢測像;6B.Nrf2蛋白表達比較;6C.HO-1蛋白表達比較??圖 7??各組大鼠視網膜Nrf2 mRNA表達比較。7A.RT-PCR產物電泳像;7B.表達量比較??圖 8??各組大鼠視網膜HO-1 mRNA表達比較。8A.RT-PCR產物電泳像;8B.表達量比較
圖6
各組大鼠視網膜Nrf2、HO-1蛋白表達比較。6A.Western blot檢測像;6B.Nrf2蛋白表達比較;6C.HO-1蛋白表達比較??圖 7??各組大鼠視網膜Nrf2 mRNA表達比較。7A.RT-PCR產物電泳像;7B.表達量比較??圖 8??各組大鼠視網膜HO-1 mRNA表達比較。8A.RT-PCR產物電泳像;8B.表達量比較
RT-PCR檢測結果顯示,各組大鼠視網膜Nrf2 mRNA表達比較,差異有統計學意義(F=19.503,P=0.000)(圖 7)。其中,糖尿病組大鼠視網膜Nrf2RNA表達明顯高于正常組(t=2.838,P=0.009);CPDT干預組大鼠視網膜Nrf2 mRNA表達明顯高于糖尿病組(t=3.399,P=0.002)。各組大鼠視網膜HO-1 mRNA表達比較,差異有統計學意義(F=9.737,P=0.001)(圖 8)。其中,糖尿病組大鼠視網膜HO-1 mRNA表達明顯高于正常組(t=2.245,P=0.033);CPDT干預組大鼠視網膜HO-1 mRNA表達明顯高于糖尿病組(t=2.167,P=0.039)。
3 討論
2型糖尿病動物模型建立的機制是首先通過高脂高糖飼料誘發出胰島素抵抗,再通過注射小劑量STZ,導致胰腺代償性分泌胰島素障礙,最后誘發出高血糖癥。大多數研究采用這種方法成功建立2型糖尿病模型[6~8]。本研究也采用這種方法,模型成功率為92.6%,大鼠血糖、血脂升高,且在STZ注射2個月后血糖仍大于16.7 mmol/L。說明建模過程中大鼠的胰島功能未出現自發性恢復。在糖尿病組大鼠視網膜的HE染色切片中,可觀察到糖尿病視網膜病理改變。因此,本實驗制成的2型糖尿病大鼠模型基本可靠。參照文獻[9, 10]的方法,我們選擇在大鼠高脂高糖飼料中添加質量濃度1%的CPDT進行干預。CPDT能選擇性作用于Nrf2/ARE信號通路,誘導抗氧化酶HO-1的表達,提高細胞的抗氧化能力[4]。Nrf2在體內參與抗氧化損傷,并在糖尿病小鼠視網膜Müller細胞中高表達[3, 13, 14]。HO-1的誘導表達與轉錄因子Nrf2的激活相關,并且糖尿病大鼠視網膜中HO-1的高表達具有抗炎、抗氧化損傷、抗細胞凋亡、抗增生的保護作用[5]。而MDA是評價機體OS最常用的指標,MDA含量可反映機體內脂質過氧化程度,間接地反映組織細胞氧化損傷的程度[15]。因此,本實驗采用檢測MDA、Nrf2及HO-1了解CPDT對抗糖尿病大鼠視網膜氧化損傷的作用。
Ⅱ相酶誘導劑還包括叔丁基對苯二酚(tBHQ),用質量濃度1% tBHQ添加飼料喂養1型糖尿病小鼠,可以通過激活Nrf2/HO-1通路來減輕糖尿病小鼠腎臟的OS損傷[9, 10]。本實驗使用質量濃度1% CPDT喂養糖尿病大鼠,8周后,CPDT干預組大鼠血糖較糖尿病組低,提示CPDT有抗高血糖癥的作用。同時,經CPDT干預后,大鼠血清MDA降低,表明CPDT具有對抗機體脂質過氧化水平升高的作用,說明CPDT具有抗OS作用。糖尿病組大鼠視網膜Nrf2、HO-1蛋白及mRNA較正常組上調,這說明在8周后糖尿病組大鼠視網膜組織出現了缺氧并造成了OS損傷,抗OS通路被激活,抗氧化蛋白增加。當使用CPDT后,大鼠視網膜Nrf2、HO-1蛋白及mRNA較糖尿病組進一步上調,這說明CPDT可以通過上調Nrf2及HO-1蛋白水平從而減少視網膜組織細胞氧化損傷的程度,保護糖尿病引起的視網膜OS損傷。本組研究結果與Kim等[16]和Wang等[17]的研究結果相似。我們注意到,Nrf2及HO-1表達在糖尿病視網膜中變化規律一致,且均為CPDT干預組較糖尿病組明顯上調,糖尿病組較正常組明顯上調,提示這一保護過程可能與Nrf2/ARE信號通路激活并進一步上調HO-1的表達相關。同時,免疫組織化學法檢測結果顯示,Nrf2及HO-1的表達主要分布于視網膜神經節細胞層、內核層、內叢狀層,且CPDT干預后Nrf2及HO-1蛋白陽性表達增加,再次說明CPDT可以改善糖尿病引起的視網膜神經OS損傷。
鑒于CPDT可以降低2型糖尿病大鼠血糖、血清MDA水平,同時有效地誘導視網膜Nrf2、HO-1高表達,從而達到抗氧化治療的作用。這提示,CPDT可能有益于防治DR。其相關機制可能與Nrf2/ARE信號通路激活并進一步上調HO-1的表達有關。但本研究樣本量總體較少,干預藥物濃度單一,干預時間短,檢測指標較少。今后有必要采用不同劑量CPDT干預,收集不同時間點的視網膜Müller細胞,增加更多的反映氧化應激損傷的觀測指標,多方印證CPDT對視網膜的影響,了解CPDT長期作用能否延緩及減輕DR的發生發展,以及其長期應用的毒副作用。
氧化應激(OS)作為糖尿病視網膜病變(DR)不同發病機制的共同起始途徑已被認可[1]。核因子NF-E2相關因子(Nrf2)通過與抗氧化反應元件(ARE)相互作用調節編碼抗氧化蛋白,是迄今為止發現的最為重要的內源性抗OS信號通路[2]。Nrf2基因敲除小鼠的血視網膜屏障及神經元功能明顯受損,增強Nrf2的表達有可能成為治療DR的新策略[3]。Ⅱ相酶誘導劑5, 6-二氫環戊烯并1, 2-二硫雜環戊烯-3-硫酮(CPDT)是Nrf2/ARE信號通路下游靶基因的強效誘導劑,其可以通過激活Nrf2促進血紅素氧合酶-1(HO-1)的表達[4]。在糖尿病大鼠視網膜中,HO-1的高表達具有抗炎、抗氧化損傷、抗細胞凋亡、抗增生作用[5]。但目前,有關CPDT對DR的作用的研究尚少。因此,為了解CPDT對DR的作用及其相關機制,我們觀察了CPDT對2型糖尿病大鼠視網膜OS損傷的保護作用以及其對Nrf2/ARE/HO-1信號通路的影響。現將結果報道如下。
1 材料和方法
1.1 動物分組及模型制備
參照文獻[6~8]的方法,采用高脂高糖飼料聯合腹腔注射小劑量鏈脲佐菌素(STZ)的方法制備2型糖尿病動物模型。4周齡的清潔級Wistar雄性大鼠35只,180~200 g,購自重慶騰鑫生物科技有限公司。適應性喂養1周后,隨機抽取8只為正常組,其余27只為造模組。正常組大鼠接受標準大鼠飼料喂養,造模組大鼠接受高脂高糖飼料。高脂高糖飼料含豬油18%,蔗糖20%,蛋黃3%,基礎飼料59%。飼養2個月,空腹12 h后,造模組大鼠按體重35 mg/kg腹腔注射STZ(美國Sigma公司),用pH4.5的0.1 mol/L檸檬酸-檸檬酸鈉緩沖液將STZ稀釋至1%的濃度,正常組大鼠注射相同體積的檸檬酸-檸檬酸鈉緩沖液。觀察2 h,恢復飲食。造模7 d后,尾部采血測定空腹血糖濃度大于16.7 mmol/L即為成功的糖尿病大鼠模型。造模組再隨機分為糖尿病組和CPDT干預組。實驗期間大鼠自由進食,飲水,不使用胰島素及其他降糖藥物。參照文獻[9, 10]的方法,CPDT干預組于糖尿病成模后1周開始在高脂高糖飼料中添加質量濃度1%的CPDT(美國Sigma公司)。糖尿病組繼續飼養高脂高糖飲食;正常組繼續飼養普通飼料。繼續飼養8周。
1.2 標本收集
藥物干預飼養8周后,禁食6~8 h,斷尾取血,應用血糖試紙測定血糖值并記錄。按體重50 mg/kg腹腔注射2%戊巴比妥鈉麻醉大鼠。打開胸腔,穿刺心臟收集全血,測定血清丙二醛(MDA)濃度。正常組及糖尿病組大鼠同時檢測血脂含量。立即摘取眼球,一部分眼球使用19G穿刺刀穿刺前房后固定于4%多聚甲醛溶液中24 h以上,用于免疫組織化學法檢測Nrf2、HO-1蛋白在視網膜組織的表達。分離余下部分眼球的視網膜,放入裝有組織保存劑的去RNA酶的1.5 ml離心管中,速存于液氮速凍后-80 ℃保存。部分視網膜組織提取總RNA,檢測Nrf2、HO-1 mRNA表達;部分視網膜組織用于蛋白質免疫印跡(Western blot)法檢測Nrf2、HO-1蛋白表達。
1.3 檢測方法
采用日立7180全自動生化分析儀測定血清總膽固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)含量。采用MDA測定試劑盒(南京建成生物工程公司)檢測血清MDA濃度。各檢測重復3次,取平均值。
采用免疫組織化學檢測法檢測視網膜Nrf2、HO-1表達。正常組取4只眼球,糖尿病組和CPDT干預組各取4只眼球。將固定后的眼球常規石蠟包埋,連續4 μm切片,用于蘇木素-伊紅(HE)及免疫組織化學染色。部分切片常規行HE染色后中性樹膠封片后光學顯微鏡下觀察視網膜結構。部分切片常規免疫組織化學染色,參照文獻[11]的方法,一抗使用1:100的兔抗大鼠Nrf2、HO-1多克隆抗體(美國Bioworld公司),二抗使用加生物素化山羊抗兔IgG(武漢博士德生物工程公司),二氨基聯苯胺(DAB)顯色。使用Lecia DM4000B數字顯微鏡及Image-Pro Plus圖像分析軟件分析Nrf2、HO-1表達。每組切片隨機抽取10張,每張切片于高倍鏡下選擇3處不同視野,測定圖像中有棕黃色或棕褐色陽性反應部位的平均吸光度[A,舊稱光密度(OD)]值,記為Nrf2、HO-1表達值。實驗重復3次,取平均值。
采用逆轉錄-聚合酶鏈反應(RT-PCR)法檢測視網膜Nrf2、HO-1 mRNA表達。由上海生工生物公司設計Nrf2、HO-1的檢測引物。參照文獻[5]的方法設計引物,Nrf2、HO-1的產物分別為219、107堿基對(bp)。正常組取6份視網膜,糖尿病組和CPDT干預組各取6份。使用RNA提取試劑盒(北京天根生化科技公司)分別提取各組視網膜總RNA。用逆轉錄試劑盒(美國Invitrogen公司)進行RNA逆轉錄,用聚合酶鏈反應(PCR)擴增試劑盒(大連寶生物工程公司)進行PCR擴增。擴增程序分別為:Nrf2 mRNA:94 ℃ 3 min,94 ℃ 30 s→57 ℃ 30 s→72 ℃ 30 s,循環45次,72 ℃ 5 min;HO-1 mRNA:94 ℃ 3 min,94 ℃ 30 s→50 ℃ 30 s→72 ℃ 20 s,循環42次,72 ℃ 5 min;內參照甘油醛-3-磷酸脫氫酶(GAPDH),循環30次。反應結束后,RT-PCR產物電泳并攝圖,使用Quantity One4.2軟件分析各組目的基因和GAPDH的條帶灰度值,以兩者的比值作為目的基因的表達量。實驗重復3次,取平均值。
采用Western blot法檢測視網膜Nrf2、HO-1蛋白表達。正常組取6份視網膜,糖尿病組和CPDT干預組各取12份。將視網膜組織制成2%視網膜勻漿,用考馬斯亮蘭蛋白測定試劑盒(南京建成生物工程公司)測定蛋白濃度。每個泳道上樣量為50 μg,一抗為1:500的兔抗大鼠Nrf2、HO-1多克隆抗體(美國Bioworld公司),二抗為1:1000的辣根過氧化物酶標記羊抗兔IgG(武漢博士德生物工程公司),以β-肌動蛋白(β-actin)作為內參照,其余步驟參照文獻[12]的方法。使用Quantity One4.2軟件分析,比較各組Nrf2、HO-1條帶灰度值與β-actin條帶灰度值的比值,表示各組蛋白相對表達水平。實驗重復3次,取平均值。
1.4 統計學方法
用SPSS 17.0軟件進行統計學分析。實驗測試指標的數據資料以均數±標準差(
2 結果
因2只大鼠血糖值不符合標準被剔除出組,造模成功大鼠25只。糖尿病大鼠成模率為92.6%。其中,糖尿病組13只,CPDT干預組12只。糖尿病組死亡2只。這2只大鼠血糖過高(>33 mmol/L),尾部出現膿腫,雙眼球結膜有黃白色分泌物,食欲不振,毛皮污穢無光澤,精神極度萎靡。死亡原因可能是由于血糖過高伴全身感染。CPDT干預組死亡1只。該大鼠行CPDT干預后便食欲不振,活動、體重均逐漸減少,口鼻周圍體毛臟亂,有脫毛癥狀。其死亡可能與CPDT的干預有關。最終用于實驗的正常組大鼠8只,糖尿病組、CPDT干預組大鼠各11只。
藥物干預飼養8周時,正常組、糖尿病組、CPDT干預組大鼠血糖值分別為(5.40±0.85)、 (24.86±3.31)、(11.51±2.45) mmol/L。三組間大鼠血糖值比較,差異有統計學意義(χ2=25.812,P=0.000),糖尿病組大鼠血糖值顯著高于正常組和CPDT干預組。正常組與糖尿病組大鼠血脂水平比較,差異有統計學意義,糖尿病組大鼠血脂水平顯著高于正常組(FTC=65.866,FTG=25.441,FLDL-C=38.889,P=0.000)(表 1)。
正常組、糖尿病組、CPDT干預組大鼠血清MDA分別為(3.75±0.72)、(7.85±1.16)、(4.82±0.64) μmol/L。三組間大鼠血清MDA比較,差異有統計學意義(F=59.545,P=0.000)。其中,糖尿病組大鼠血清MDA明顯高于正常組(t=10.523,P=0.000);CPDT干預組大鼠血清MDA明顯低于糖尿病組(t=7.766,P=0.000)。
光學顯微鏡下,正常組視網膜各層組織排列整齊,無細胞腫脹,內界膜、外界膜清楚,視網膜神經節細胞層單層排列(圖 1A)。糖尿病組視網膜各層組織排列紊亂,視網膜增厚,細胞間質水腫,神經纖維層增厚,神經節細胞空泡變性,細胞染色質邊緣聚集,內叢狀層水腫,內核層細胞空泡變性,內、外核層部分融合,內、外界膜排列不清楚(圖 1B)。CPDT干預組大鼠視網膜神經纖維層、神經節細胞層、光感受器細胞層排列基本整齊,內、外界膜基本清楚,各層組織水腫現象較糖尿病組輕,部分神經節細胞出現輕度腫脹(圖 1C)。
 圖1
各組大鼠視網膜光學顯微鏡像。1A.正常組;1B.糖尿病組;1C.CPDT干預組。正常組視網膜各層組織排列整齊、清晰,無細胞腫脹;糖尿病組視網膜各層組織排列紊亂,神經纖維層增厚,神經節細胞空泡變性,細胞染色質邊緣聚集,內核層細胞空泡變性(黑箭);CPDT干預組視網膜各層排列基本整齊,內、外界膜基本清楚,部分神經節細胞出現輕度腫脹(綠箭) HE ×400??圖 2??各組大鼠視網膜組織Nrf2表達光學顯微鏡像。2A.正常組;2B.糖尿病組;2C.CPDT干預組。視網膜神經節細胞層、內核層、內叢狀層均可見Nrf2表達,主要為細胞漿染色(黑箭) DAB ×400??圖 3??各組大鼠視網膜組織HO-1表達光學顯微鏡像。3A.正常組;3B.糖尿病組;3C.CPDT干預組。視網膜神經節細胞層、內核層、內叢狀層均可見HO-1表達,主要為細胞漿染色(黑箭) DAB ×400??圖 4??各組大鼠視網膜組織Nrf2蛋白表達平均A值比較??圖 5??各組大鼠視網膜組織HO-1蛋白表達平均A值比較
圖1
各組大鼠視網膜光學顯微鏡像。1A.正常組;1B.糖尿病組;1C.CPDT干預組。正常組視網膜各層組織排列整齊、清晰,無細胞腫脹;糖尿病組視網膜各層組織排列紊亂,神經纖維層增厚,神經節細胞空泡變性,細胞染色質邊緣聚集,內核層細胞空泡變性(黑箭);CPDT干預組視網膜各層排列基本整齊,內、外界膜基本清楚,部分神經節細胞出現輕度腫脹(綠箭) HE ×400??圖 2??各組大鼠視網膜組織Nrf2表達光學顯微鏡像。2A.正常組;2B.糖尿病組;2C.CPDT干預組。視網膜神經節細胞層、內核層、內叢狀層均可見Nrf2表達,主要為細胞漿染色(黑箭) DAB ×400??圖 3??各組大鼠視網膜組織HO-1表達光學顯微鏡像。3A.正常組;3B.糖尿病組;3C.CPDT干預組。視網膜神經節細胞層、內核層、內叢狀層均可見HO-1表達,主要為細胞漿染色(黑箭) DAB ×400??圖 4??各組大鼠視網膜組織Nrf2蛋白表達平均A值比較??圖 5??各組大鼠視網膜組織HO-1蛋白表達平均A值比較
免疫組織化學法檢測結果顯示,Nrf2、HO-1蛋白陽性表達定位于視網膜神經節細胞層、內核層、內叢狀層(圖 2,3)。各組大鼠視網膜Nrf2、HO-1蛋白表達量比較,差異有統計學意義(FNrf2=16.206,FHO-1=46.790,P=0.000)(圖 4,5)。其中,CPDT干預組大鼠視網膜Nrf2、HO-1蛋白表達量高于糖尿病組(tNrf2=3.172,PNrf2=0.003;tHO-1=6.321,PHO-1=0.000);糖尿病組大鼠視網膜Nrf2、HO-1蛋白表達量高于正常組(tNrf2=2.679,PNrf2=0.011;tHO-1=3.482,PHO-1=0.001)。
Western blot檢測結果顯示,各組大鼠視網膜Nrf2、HO-1蛋白表達比較,差異有統計學意義(FNrf2=112.823,FHO-1=119.361,P=0.000)(圖 6)。其中,糖尿病組大鼠視網膜Nrf2、HO-1蛋白表達明顯高于正常組(tNrf2=8.746,tHO-1=8.988,P=0.000);CPDT干預組大鼠視網膜Nrf2、HO-1蛋白表達明顯高于糖尿病組(tNrf2=6.203,tHO-1=6.388,P=0.000)。
 圖6
各組大鼠視網膜Nrf2、HO-1蛋白表達比較。6A.Western blot檢測像;6B.Nrf2蛋白表達比較;6C.HO-1蛋白表達比較??圖 7??各組大鼠視網膜Nrf2 mRNA表達比較。7A.RT-PCR產物電泳像;7B.表達量比較??圖 8??各組大鼠視網膜HO-1 mRNA表達比較。8A.RT-PCR產物電泳像;8B.表達量比較
圖6
各組大鼠視網膜Nrf2、HO-1蛋白表達比較。6A.Western blot檢測像;6B.Nrf2蛋白表達比較;6C.HO-1蛋白表達比較??圖 7??各組大鼠視網膜Nrf2 mRNA表達比較。7A.RT-PCR產物電泳像;7B.表達量比較??圖 8??各組大鼠視網膜HO-1 mRNA表達比較。8A.RT-PCR產物電泳像;8B.表達量比較
RT-PCR檢測結果顯示,各組大鼠視網膜Nrf2 mRNA表達比較,差異有統計學意義(F=19.503,P=0.000)(圖 7)。其中,糖尿病組大鼠視網膜Nrf2RNA表達明顯高于正常組(t=2.838,P=0.009);CPDT干預組大鼠視網膜Nrf2 mRNA表達明顯高于糖尿病組(t=3.399,P=0.002)。各組大鼠視網膜HO-1 mRNA表達比較,差異有統計學意義(F=9.737,P=0.001)(圖 8)。其中,糖尿病組大鼠視網膜HO-1 mRNA表達明顯高于正常組(t=2.245,P=0.033);CPDT干預組大鼠視網膜HO-1 mRNA表達明顯高于糖尿病組(t=2.167,P=0.039)。
3 討論
2型糖尿病動物模型建立的機制是首先通過高脂高糖飼料誘發出胰島素抵抗,再通過注射小劑量STZ,導致胰腺代償性分泌胰島素障礙,最后誘發出高血糖癥。大多數研究采用這種方法成功建立2型糖尿病模型[6~8]。本研究也采用這種方法,模型成功率為92.6%,大鼠血糖、血脂升高,且在STZ注射2個月后血糖仍大于16.7 mmol/L。說明建模過程中大鼠的胰島功能未出現自發性恢復。在糖尿病組大鼠視網膜的HE染色切片中,可觀察到糖尿病視網膜病理改變。因此,本實驗制成的2型糖尿病大鼠模型基本可靠。參照文獻[9, 10]的方法,我們選擇在大鼠高脂高糖飼料中添加質量濃度1%的CPDT進行干預。CPDT能選擇性作用于Nrf2/ARE信號通路,誘導抗氧化酶HO-1的表達,提高細胞的抗氧化能力[4]。Nrf2在體內參與抗氧化損傷,并在糖尿病小鼠視網膜Müller細胞中高表達[3, 13, 14]。HO-1的誘導表達與轉錄因子Nrf2的激活相關,并且糖尿病大鼠視網膜中HO-1的高表達具有抗炎、抗氧化損傷、抗細胞凋亡、抗增生的保護作用[5]。而MDA是評價機體OS最常用的指標,MDA含量可反映機體內脂質過氧化程度,間接地反映組織細胞氧化損傷的程度[15]。因此,本實驗采用檢測MDA、Nrf2及HO-1了解CPDT對抗糖尿病大鼠視網膜氧化損傷的作用。
Ⅱ相酶誘導劑還包括叔丁基對苯二酚(tBHQ),用質量濃度1% tBHQ添加飼料喂養1型糖尿病小鼠,可以通過激活Nrf2/HO-1通路來減輕糖尿病小鼠腎臟的OS損傷[9, 10]。本實驗使用質量濃度1% CPDT喂養糖尿病大鼠,8周后,CPDT干預組大鼠血糖較糖尿病組低,提示CPDT有抗高血糖癥的作用。同時,經CPDT干預后,大鼠血清MDA降低,表明CPDT具有對抗機體脂質過氧化水平升高的作用,說明CPDT具有抗OS作用。糖尿病組大鼠視網膜Nrf2、HO-1蛋白及mRNA較正常組上調,這說明在8周后糖尿病組大鼠視網膜組織出現了缺氧并造成了OS損傷,抗OS通路被激活,抗氧化蛋白增加。當使用CPDT后,大鼠視網膜Nrf2、HO-1蛋白及mRNA較糖尿病組進一步上調,這說明CPDT可以通過上調Nrf2及HO-1蛋白水平從而減少視網膜組織細胞氧化損傷的程度,保護糖尿病引起的視網膜OS損傷。本組研究結果與Kim等[16]和Wang等[17]的研究結果相似。我們注意到,Nrf2及HO-1表達在糖尿病視網膜中變化規律一致,且均為CPDT干預組較糖尿病組明顯上調,糖尿病組較正常組明顯上調,提示這一保護過程可能與Nrf2/ARE信號通路激活并進一步上調HO-1的表達相關。同時,免疫組織化學法檢測結果顯示,Nrf2及HO-1的表達主要分布于視網膜神經節細胞層、內核層、內叢狀層,且CPDT干預后Nrf2及HO-1蛋白陽性表達增加,再次說明CPDT可以改善糖尿病引起的視網膜神經OS損傷。
鑒于CPDT可以降低2型糖尿病大鼠血糖、血清MDA水平,同時有效地誘導視網膜Nrf2、HO-1高表達,從而達到抗氧化治療的作用。這提示,CPDT可能有益于防治DR。其相關機制可能與Nrf2/ARE信號通路激活并進一步上調HO-1的表達有關。但本研究樣本量總體較少,干預藥物濃度單一,干預時間短,檢測指標較少。今后有必要采用不同劑量CPDT干預,收集不同時間點的視網膜Müller細胞,增加更多的反映氧化應激損傷的觀測指標,多方印證CPDT對視網膜的影響,了解CPDT長期作用能否延緩及減輕DR的發生發展,以及其長期應用的毒副作用。