引用本文: 羅云楓, 倪焰, 欒潔. 瘦素對胰島素抵抗狀態下人視網膜色素上皮細胞氧化損傷的影響. 中華眼底病雜志, 2014, 30(2): 161-165. doi: 10.3760/cma.j.issn.1005-1015.2014.02.011 復制
胰島素抵抗是代謝綜合征(MS)發病的中心環節和基本致病基礎[1],其引起的氧化應激可導致血管炎癥反應以及內皮細胞功能紊亂而導致各種全身性病變。MS對于視網膜血管的功能和代謝的影響主要是能引起視網膜的糖尿病視網膜病變(DR)[2, 3]。腹型肥胖是MS的臨床表現和診斷標準之一[4]。脂肪細胞因子可直接或者間接地負性調節胰島素信號轉導,導致機體出現胰島素抵抗及其相關疾病,瘦素是脂肪細胞因子之一。有臨床研究發現,胰島素抵抗患者的DR發生高于無胰島素抵抗患者。但是否與脂肪因子的分泌有關目前尚不清楚。本研究通過觀察不同濃度瘦素(leptin)對人視網膜色素上皮(RPE)細胞氧化損傷和修復的影響,探討瘦素在DR發生發展中的作用,現將結果報道如下。
1 材料和方法
Leptin human L4146(美國Sigma公司);人RPE細胞株(ARPE-19, 美國ATCC公司);葡萄糖(南京凱基生物科技發展有限公司);胰島素(生物合成人胰島素注射液;諾和諾德制藥有限公司);Dulbecco改良的Eagle培養基(DMEM)/F12培養基,胎牛血清,胰蛋白酶(美國Gibco公司);鼠抗人8-羥基脫氧鳥嘌呤(8-OHdG)單克隆抗體(美國Trevigen公司);鼠抗人8-羥基鳥嘌呤DNA糖苷酶1(hOGG1)單克隆抗體(美國Assay Designs公司);細胞內氧化應激活性氧(ROS)初級熒光測定試劑盒(上海杰美基因醫藥有限公司);二喹啉甲酸(BCA)蛋白定量試劑盒(碧云天生物技術研究所);3-(4, 5-二甲基噻唑2)-2, 5-二苯基四氮唑嗅鹽(MTT)(美國Sigma公司);醫用凈化工作臺(吳江市凈化設備總廠);流式細胞儀(美國FACS Calibur Becton-Dickinson公司);酶標儀(model 860,BIO-RAD,美國MDC公司);電泳儀(DYY-5型,北京市六一儀器廠),正置熒光顯微鏡(Scope A1,德國Zeiss公司)。
人RPE細胞培養。ARPE-19細胞復蘇,細胞融合密度達80%后,棄去培養液,磷酸鹽緩沖液(PBS)沖洗3次,加入胰酶消化液(0.05%胰蛋白酶-0.02%乙二胺四乙酸)2 ml,倒置相差顯微鏡下觀察細胞形態,待細胞變圓、細胞間隙變大或少量細胞脫壁漂移時,加入含血清的培養液終止消化,收集細胞懸液,離心半徑7.5 cm,1000 r/min離心10 min,將細胞吹打均勻,計數,接種于25 cm2培養瓶中,按1:4至1:6傳代,置于37 ℃、5%CO2培養箱中培養,每周換液2~3次,直至細胞融合。取4~6代80%融合細胞用于實驗。
實驗分組。將體外培養ARPE-19細胞隨機分為成正常對照組、胰島素抵抗組[4]。正常對照組加入DMEM/F12培養液,胰島素抵抗組加含30 mmol/L葡萄糖+10-7 mol/L胰島素的DMEM/F12培養液。
2′,7′-二氯熒光素二乙酸酯(DCFH-DA)法檢測細胞內ROS水平。正常對照組、胰島素抵抗組分別加入0、10、100 ng/ml瘦素,干預后24、48、72 h,應用ROS檢測試劑盒,按照說明書流程操作。波長488 nm的流式細胞儀計數50 000個細胞,檢測平均熒光強度以反映細胞內ROS水平。
免疫細胞化學(ICG)法檢測細胞內8-OHdG的表達[5]。以細胞漿呈棕黃色或細胞核、細胞漿同時呈棕黃色為陽性,以細胞核、細胞漿均無著色為陰性。根據陽性細胞著色面積和著色強度積分,應用Image-pro plus圖像分析軟件進行分析。
蛋白質免疫印跡法(Western blot)檢測hOGG1表達。將各組RPE細胞提取蛋白,BCA法對上清蛋白進行定量。各取出20 μg總蛋白,10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳,轉印(53 V,60 mA)。封閉過夜。一抗(1:2000鼠抗人hOGG1單克隆抗體)4 ℃過夜。二抗(1:10 000HRP標記的羊抗鼠IgG)室溫搖床孵育1 h。電化學發光法顯色,凝膠圖像分析儀掃描圖像。應用Band Scan 5.0圖像分析軟件讀取膠片上各蛋白條帶的灰度值,以β-肌動蛋白(β-actin)作為內參,以目的蛋白和β-actin條帶密度的比值表示目的蛋白的相對含量。
SPSS17.0統計軟件包進行統計學分析處理。上述每組實驗均重復4次;采用描述性統計分析。計量資料用均數±標準差(
2 結果
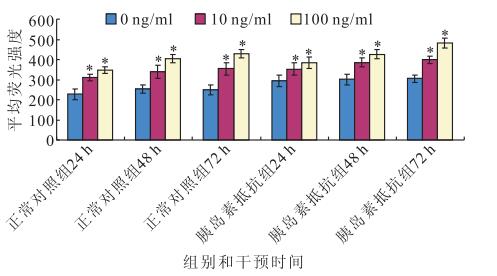
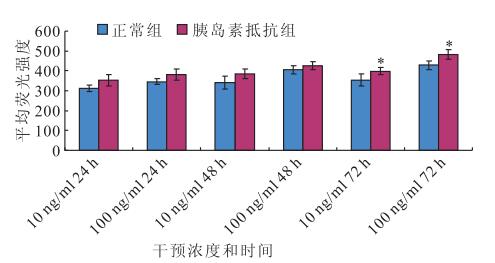
DCFH-DA法檢測結果顯示,干預后24、48、72 h,正常對照組(F=37.136、37.178、49.634)和胰島素抵抗組(F=9.822、28.881、71.150)RPE細胞ROS表達均隨瘦素濃度增加而增加,差異均有統計學意義(P<0.05)。其中,胰島素抵抗組在干預后24 h,RPE細胞ROS的表達量隨著瘦素濃度的增加遞增,0 ng/ml濃度瘦素干預與10、100 ng/ml濃度瘦素干預之間RPE細胞ROS表達量比較,差異均有統計學意義(F=46.077,P<0.05);10 ng/ml濃度瘦素干預與100 ng/ml濃度瘦素干預之間RPE細胞ROS表達量比較,差異無統計學意義(F=6.077,P>0.05)(圖 1)。隨干預時間延長,100 ng/ml濃度瘦素干預RPE細胞ROS表達量均升高,差異有統計學意義(F=14.998,P<0.05)(圖 1)。干預后24、48 h,10(F=8.035、7.983)、100 ng/ml濃度瘦素(F=8.063、7.932)正常對照組和胰島素抵抗組之間RPE細胞ROS表達量比較,差異無統計學意義(P>0.05);干預后72 h,胰島素抵抗組RPE細胞ROS表達量高于正常對照組RPE細胞ROS表達量,差異有統計學意義(F=39.213,P<0.05)(圖 2)。
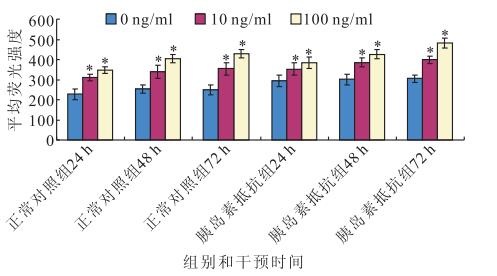 圖1
不同濃度瘦素對人RPE細胞ROS表達的影響。*:與0 ng/ml濃度瘦素比較,P<0.05
圖1
不同濃度瘦素對人RPE細胞ROS表達的影響。*:與0 ng/ml濃度瘦素比較,P<0.05
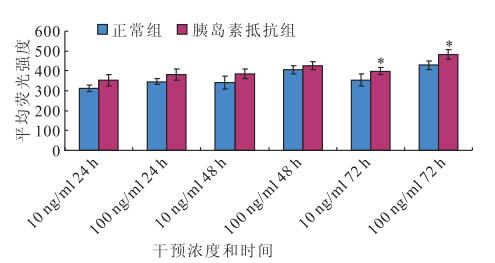 圖2
相同濃度瘦素干預下正常組、胰島素抵抗組RPE細胞ROS表達量。*:與對照組比較,P<0.05
圖2
相同濃度瘦素干預下正常組、胰島素抵抗組RPE細胞ROS表達量。*:與對照組比較,P<0.05
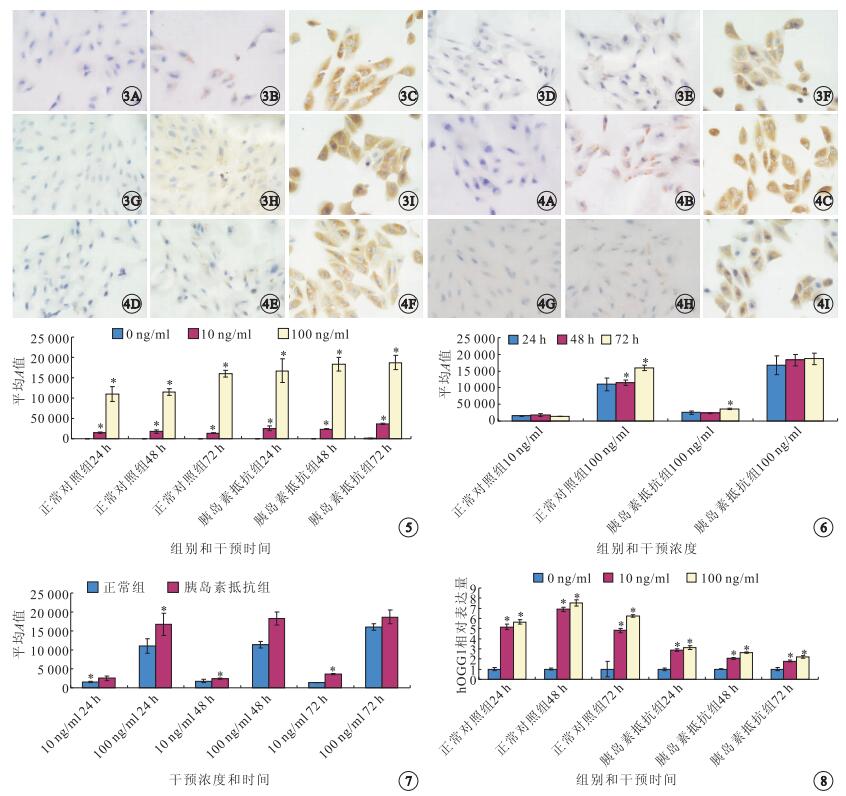
ICG法檢測結果顯示,8-OHdG陽性定位于細胞漿和(或)細胞核,呈棕黃色。干預后24、48、72 h,10、100 ng/ml濃度瘦素干預后,正常對照組和胰島素抵抗組RPE細胞內均有8-OHdG的表達(圖 3,4)。
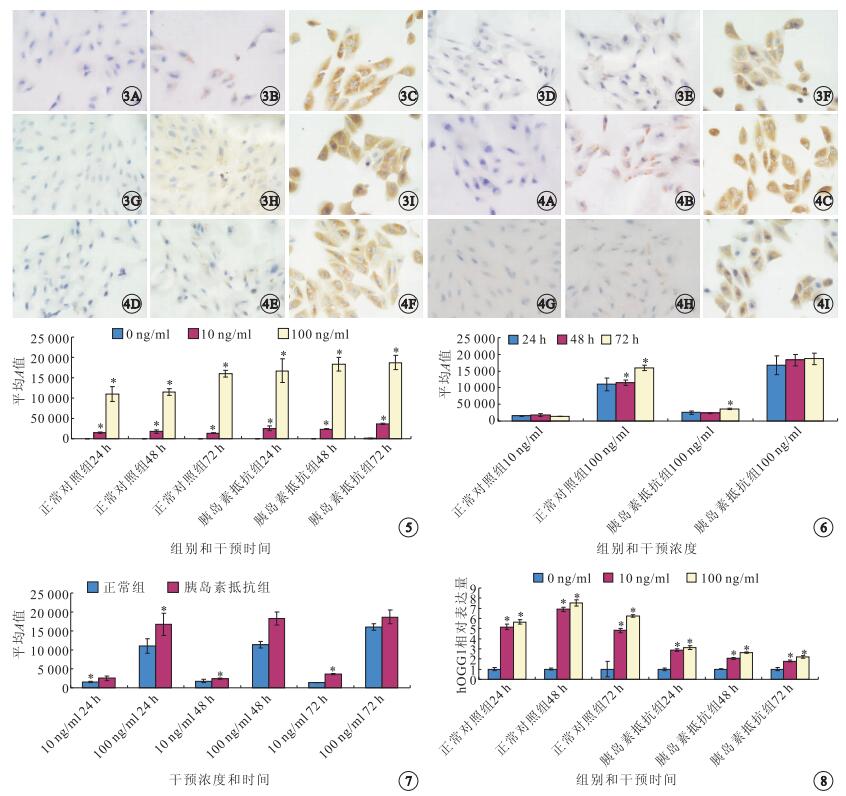 圖3
正常對照組RPE細胞ICG染色像。3A~3C.0、10、100 ng/ml濃度瘦素干預后24 h;3D~3F.0、10、100 ng/ml濃度瘦素干預后48 h;3G~3I.0、10、100 ng/ml濃度瘦素干預后72 h。RPE細胞內均有8-OHdG的表達。0、10 ng/ml濃度瘦素ICG ×400,100 ng/ml濃度瘦素ICG ×800??圖 4??胰島素抵抗組RPE細胞ICG染色像。4A~4C.0、10、100 ng/ml濃度瘦素干預后24 h;4D~4F.0、10、100 ng/ml濃度瘦素干預后48 h;4G~4I.0、10、100 ng/ml濃度瘦素干預后72 h。RPE細胞內均有8-OHdG的表達。0、10 ng/ml濃度瘦素ICG ×400,100 ng/ml濃度瘦素ICG ×800??圖 5??不同濃度瘦素對人RPE細胞8-OHdG表達的影響。*:與0 ng/ml濃度比較,P<0.05??圖 6??相同濃度瘦素干預下不同時間點人RPE細胞8-OHdG表達量。*:與干預后24 h比較,P<0.05??圖 7??相同濃度瘦素干預下兩組人RPE細胞8-OHdG表達量。*:與對照組比較,P<0.05??圖 8??不同濃度瘦素對人RPE細胞hOGG1表達的影響。*:與0 ng/ml濃度比較,P<0.05
圖3
正常對照組RPE細胞ICG染色像。3A~3C.0、10、100 ng/ml濃度瘦素干預后24 h;3D~3F.0、10、100 ng/ml濃度瘦素干預后48 h;3G~3I.0、10、100 ng/ml濃度瘦素干預后72 h。RPE細胞內均有8-OHdG的表達。0、10 ng/ml濃度瘦素ICG ×400,100 ng/ml濃度瘦素ICG ×800??圖 4??胰島素抵抗組RPE細胞ICG染色像。4A~4C.0、10、100 ng/ml濃度瘦素干預后24 h;4D~4F.0、10、100 ng/ml濃度瘦素干預后48 h;4G~4I.0、10、100 ng/ml濃度瘦素干預后72 h。RPE細胞內均有8-OHdG的表達。0、10 ng/ml濃度瘦素ICG ×400,100 ng/ml濃度瘦素ICG ×800??圖 5??不同濃度瘦素對人RPE細胞8-OHdG表達的影響。*:與0 ng/ml濃度比較,P<0.05??圖 6??相同濃度瘦素干預下不同時間點人RPE細胞8-OHdG表達量。*:與干預后24 h比較,P<0.05??圖 7??相同濃度瘦素干預下兩組人RPE細胞8-OHdG表達量。*:與對照組比較,P<0.05??圖 8??不同濃度瘦素對人RPE細胞hOGG1表達的影響。*:與0 ng/ml濃度比較,P<0.05
干預后24、48、72 h,正常對照組(F=88.643、390.920、1039.276)和胰島素抵抗組(F=273.311、299.155、82.237)RPE細胞8-OHdG的表達隨瘦素濃度增加而增加,差異均有統計學意義(P<0.05)。其中,正常對照組100 ng/ml濃度瘦素干預后,RPE細胞8-OHdG表達量隨干預時間延長而增高,差異均有統計學意義(F=79.823, P<0.05)(圖 5)。胰島素抵抗組10 ng/ml濃度瘦素干預后72 h的RPE細胞8-OHdG表達量高于干預后24、48 h,差異有統計學意義(F=309.623,P<0.05);100 ng/ml濃度瘦素干預后,RPE細胞8-OHdG表達量隨干預時間延長有升高趨勢,但差異無統計學意義(F=15.389,P>0.05)(圖 6)。10 ng/ml濃度瘦素干預后24、72 h,胰島素抵抗組RPE細胞8-OHdG表達量高于正常對照組,差異有統計學意義(F=157.199、1183.004,P<0.05);干預后48 h,正常對照組、胰島素抵抗組PRE細胞8-OHdG表達量比較,差異無統計學意義(F=9.089,P>0.05)。100 ng/ml濃度瘦素干預后24、48 h,胰島素抵抗組RPE細胞8-OHdG表達量高于正常對照組,差異有統計學意義(F=52.408、167.983,P<0.05)(圖 7);干預后72 h,正常對照組、胰島素抵抗組RPE細胞8-OHdG表達量比較,差異無統計學意義(F=34.527,P>0.05)。
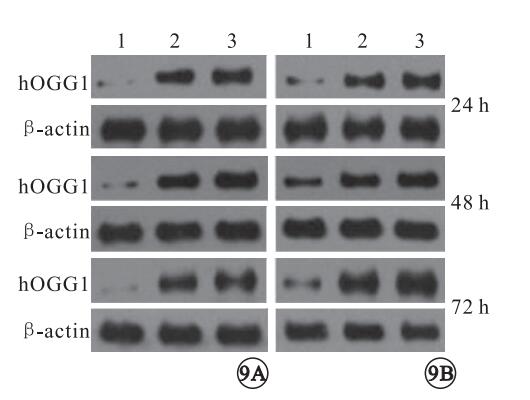
Western blot檢測結果顯示,干預后24、48、72 h,正常對照組(F=470.062、1073.113、295.456)、胰島素抵抗組(F=240.032、592.389、527.760)RPE細胞hOGGl表達量均隨瘦素濃度增加遞增,差異均有統計學意義(P<0.05)(圖 8, 9);在相同濃度瘦素干預下,隨著時間延長,RPE細胞hOGG1表達量呈現先升高后降低的趨勢。干預后48 h,正常對照組(F=83.673、268.000、373.492)、胰島素抵抗組(F=49.021、304.293、294.293)RPE細胞hOGGl表達量均高于干預后24、72hRPE細胞hOGGl表達量,差異有統計學意義(P<0.05)。
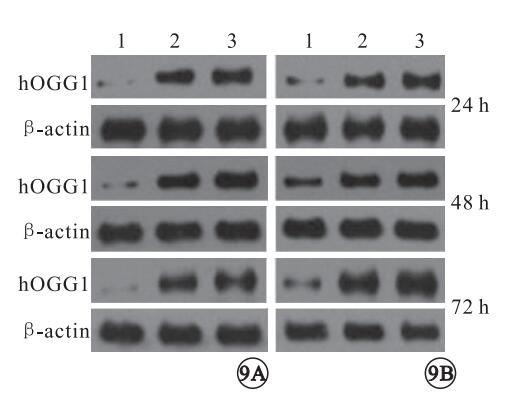 圖9
Western blot圖。9A.正常對照組。9B.胰島素抵抗組。1~3:0、10、100 ng/ml。不同濃度瘦素干預下RPE細胞內hOGGl的表達量
圖9
Western blot圖。9A.正常對照組。9B.胰島素抵抗組。1~3:0、10、100 ng/ml。不同濃度瘦素干預下RPE細胞內hOGGl的表達量
10 ng/ml濃度瘦素干預后24 h,胰島素抵抗組、正常對照組RPE細胞hOGGl表達量比較,差異無統計學意義(F=23.392,P>0.05);干預后48、72 h,胰島素抵抗組RPE細胞hOGGl表達量低于正常對照組,差異有統計學意義(F=293.392、129.394,P<0.05)。100 ng/ml濃度瘦素干預24 h,胰島素抵抗組、正常對照組RPE細胞hOGGl表達量比較,差異無統計學意義(F=9.023,P>0.05);干預后48 h,正常對照組RPE細胞hOGGl表達量低于胰島素抵抗組,差異有統計學意義(F=593.02,P<0.05);干預后72 h,胰島素抵抗組RPE細胞hOGGl表達量低于正常對照組,差異有統計學意義(F=329.89,P<0.05)。
3 討論
有臨床研究發現,胰島素抵抗患者的DR發生高于無胰島素抵抗患者,但是否與脂肪因子的分泌有關目前尚不清楚[6]。瘦素是一種脂肪因子,免疫組織化學研究發現,在糖尿病患者的視網膜外纖維血管組織的視網膜前膜組織中檢測出了瘦素效應受體長型受體中存在著瘦素和瘦素受體,在增生型DR(PDR)患者的表達[7],而對正常人的視網膜組織進行相同的檢測卻并未檢測到它的表達。同時還有研究發現,在PDR患者的玻璃體液中瘦素濃度顯著高于正常人,既使把體重指數對瘦素水平的影響去除后結果也如此。體外實驗已證明,瘦素在PDR患者玻璃體液中的平均濃度已能夠有效地促進新生血管的形成[8]。這些均提示瘦素是促進PDR的發生發展的直接因素之一。瘦素在DR的發生發展過程中究竟如何發揮作用?這是本研究想要探討的問題。統一機制學說認為氧化應激是DR發生發展過程中的重要因素[6],RPE細胞因分泌內源性抗新生血管因子色素上皮衍生因子而在抗新生血管生成中發揮著重要作用,因此我們選擇了RPE細胞做為研究對象,模擬胰島素抵抗環境,觀察瘦素對RPE細胞氧化損傷的影響。
ROS被認為是引起DNA氧化損傷的主要因素之一,而ROS可使鳥嘌呤(G)氧化為8-OHdG,在體內形成后較為穩定、易于檢測,被視為DNA氧化損傷的生物標志物。本研究結果顯示,無論在正常狀態還是胰島素抵抗狀態下,RPE細胞內ROS、8-OHdG的表達量均隨著瘦素濃度增加而增加,差異具有統計學意義;而在相同瘦素濃度的干預下,兩組RPE細胞內ROS、8-OHdG的表達量呈現胰島素抵抗組高于正常對照組的趨勢,雖然在干預后24、48 h時兩組RPE細胞內ROS的表達的差異不具有統計學意義,仍提示無論是正常狀態還是胰島素抵抗狀態下,瘦素均能誘發人RPE細胞的氧化損傷,而在胰島素抵抗狀態下,瘦素誘發的人RPE細胞的氧化損傷程度更重。
正常細胞具有多種應對氧化損傷的機制,哺乳動物中負責DNA鏈8-OHdG突變修復的主要DNA糖基化酶之一是8-羥基鳥嘌呤糖基化酶(OGG),人類的稱為hOGG[9]。本研究結果顯示,兩組RPE細胞內hOGGl的表達量均隨瘦素濃度的增加遞增,差異有統計學意義;在相同濃度瘦素干預下,兩組RPE細胞內hOGGl的表達均顯示干預后48 h時高于干預后24、72 h時。因此我們推測,瘦素在誘發RPE細胞氧化損傷的同時,啟動了氧化損傷的代償性修復,但隨著時間的延長及氧化損傷程度的加重,氧化損傷的修復能力下降。另外,我們還發現以10 ng/ml濃度瘦素干預的兩組RPE細胞內hOGG1表達量呈現胰島素抵抗組低于正常對照組的趨勢;而以100 ng/ml濃度瘦素干預的兩組RPE細胞內hOGG1表達量干預后48 h時正常對照組低于胰島素抵抗組,差異有統計學意義;干預后72 h時胰島素抵抗組低于正常對照組,差異有統計學意義;提示針對瘦素引起的氧化損傷,胰島素抵抗狀態下的RPE細胞更易發揮代償性氧化損傷修復的作用,但隨著氧化損傷的加重,胰島素抵抗狀態下的RPE細胞更易發生氧化損傷修復失代償。
由于并未觀察瘦素是否對與DR發生直接相關的視網膜血管內皮細胞或周細胞產生氧化損傷,本研究結果對探討瘦素在DR發生發展中的作用尚有局限性。
胰島素抵抗是代謝綜合征(MS)發病的中心環節和基本致病基礎[1],其引起的氧化應激可導致血管炎癥反應以及內皮細胞功能紊亂而導致各種全身性病變。MS對于視網膜血管的功能和代謝的影響主要是能引起視網膜的糖尿病視網膜病變(DR)[2, 3]。腹型肥胖是MS的臨床表現和診斷標準之一[4]。脂肪細胞因子可直接或者間接地負性調節胰島素信號轉導,導致機體出現胰島素抵抗及其相關疾病,瘦素是脂肪細胞因子之一。有臨床研究發現,胰島素抵抗患者的DR發生高于無胰島素抵抗患者。但是否與脂肪因子的分泌有關目前尚不清楚。本研究通過觀察不同濃度瘦素(leptin)對人視網膜色素上皮(RPE)細胞氧化損傷和修復的影響,探討瘦素在DR發生發展中的作用,現將結果報道如下。
1 材料和方法
Leptin human L4146(美國Sigma公司);人RPE細胞株(ARPE-19, 美國ATCC公司);葡萄糖(南京凱基生物科技發展有限公司);胰島素(生物合成人胰島素注射液;諾和諾德制藥有限公司);Dulbecco改良的Eagle培養基(DMEM)/F12培養基,胎牛血清,胰蛋白酶(美國Gibco公司);鼠抗人8-羥基脫氧鳥嘌呤(8-OHdG)單克隆抗體(美國Trevigen公司);鼠抗人8-羥基鳥嘌呤DNA糖苷酶1(hOGG1)單克隆抗體(美國Assay Designs公司);細胞內氧化應激活性氧(ROS)初級熒光測定試劑盒(上海杰美基因醫藥有限公司);二喹啉甲酸(BCA)蛋白定量試劑盒(碧云天生物技術研究所);3-(4, 5-二甲基噻唑2)-2, 5-二苯基四氮唑嗅鹽(MTT)(美國Sigma公司);醫用凈化工作臺(吳江市凈化設備總廠);流式細胞儀(美國FACS Calibur Becton-Dickinson公司);酶標儀(model 860,BIO-RAD,美國MDC公司);電泳儀(DYY-5型,北京市六一儀器廠),正置熒光顯微鏡(Scope A1,德國Zeiss公司)。
人RPE細胞培養。ARPE-19細胞復蘇,細胞融合密度達80%后,棄去培養液,磷酸鹽緩沖液(PBS)沖洗3次,加入胰酶消化液(0.05%胰蛋白酶-0.02%乙二胺四乙酸)2 ml,倒置相差顯微鏡下觀察細胞形態,待細胞變圓、細胞間隙變大或少量細胞脫壁漂移時,加入含血清的培養液終止消化,收集細胞懸液,離心半徑7.5 cm,1000 r/min離心10 min,將細胞吹打均勻,計數,接種于25 cm2培養瓶中,按1:4至1:6傳代,置于37 ℃、5%CO2培養箱中培養,每周換液2~3次,直至細胞融合。取4~6代80%融合細胞用于實驗。
實驗分組。將體外培養ARPE-19細胞隨機分為成正常對照組、胰島素抵抗組[4]。正常對照組加入DMEM/F12培養液,胰島素抵抗組加含30 mmol/L葡萄糖+10-7 mol/L胰島素的DMEM/F12培養液。
2′,7′-二氯熒光素二乙酸酯(DCFH-DA)法檢測細胞內ROS水平。正常對照組、胰島素抵抗組分別加入0、10、100 ng/ml瘦素,干預后24、48、72 h,應用ROS檢測試劑盒,按照說明書流程操作。波長488 nm的流式細胞儀計數50 000個細胞,檢測平均熒光強度以反映細胞內ROS水平。
免疫細胞化學(ICG)法檢測細胞內8-OHdG的表達[5]。以細胞漿呈棕黃色或細胞核、細胞漿同時呈棕黃色為陽性,以細胞核、細胞漿均無著色為陰性。根據陽性細胞著色面積和著色強度積分,應用Image-pro plus圖像分析軟件進行分析。
蛋白質免疫印跡法(Western blot)檢測hOGG1表達。將各組RPE細胞提取蛋白,BCA法對上清蛋白進行定量。各取出20 μg總蛋白,10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳,轉印(53 V,60 mA)。封閉過夜。一抗(1:2000鼠抗人hOGG1單克隆抗體)4 ℃過夜。二抗(1:10 000HRP標記的羊抗鼠IgG)室溫搖床孵育1 h。電化學發光法顯色,凝膠圖像分析儀掃描圖像。應用Band Scan 5.0圖像分析軟件讀取膠片上各蛋白條帶的灰度值,以β-肌動蛋白(β-actin)作為內參,以目的蛋白和β-actin條帶密度的比值表示目的蛋白的相對含量。
SPSS17.0統計軟件包進行統計學分析處理。上述每組實驗均重復4次;采用描述性統計分析。計量資料用均數±標準差(
2 結果
DCFH-DA法檢測結果顯示,干預后24、48、72 h,正常對照組(F=37.136、37.178、49.634)和胰島素抵抗組(F=9.822、28.881、71.150)RPE細胞ROS表達均隨瘦素濃度增加而增加,差異均有統計學意義(P<0.05)。其中,胰島素抵抗組在干預后24 h,RPE細胞ROS的表達量隨著瘦素濃度的增加遞增,0 ng/ml濃度瘦素干預與10、100 ng/ml濃度瘦素干預之間RPE細胞ROS表達量比較,差異均有統計學意義(F=46.077,P<0.05);10 ng/ml濃度瘦素干預與100 ng/ml濃度瘦素干預之間RPE細胞ROS表達量比較,差異無統計學意義(F=6.077,P>0.05)(圖 1)。隨干預時間延長,100 ng/ml濃度瘦素干預RPE細胞ROS表達量均升高,差異有統計學意義(F=14.998,P<0.05)(圖 1)。干預后24、48 h,10(F=8.035、7.983)、100 ng/ml濃度瘦素(F=8.063、7.932)正常對照組和胰島素抵抗組之間RPE細胞ROS表達量比較,差異無統計學意義(P>0.05);干預后72 h,胰島素抵抗組RPE細胞ROS表達量高于正常對照組RPE細胞ROS表達量,差異有統計學意義(F=39.213,P<0.05)(圖 2)。
 圖1
不同濃度瘦素對人RPE細胞ROS表達的影響。*:與0 ng/ml濃度瘦素比較,P<0.05
圖1
不同濃度瘦素對人RPE細胞ROS表達的影響。*:與0 ng/ml濃度瘦素比較,P<0.05
 圖2
相同濃度瘦素干預下正常組、胰島素抵抗組RPE細胞ROS表達量。*:與對照組比較,P<0.05
圖2
相同濃度瘦素干預下正常組、胰島素抵抗組RPE細胞ROS表達量。*:與對照組比較,P<0.05
ICG法檢測結果顯示,8-OHdG陽性定位于細胞漿和(或)細胞核,呈棕黃色。干預后24、48、72 h,10、100 ng/ml濃度瘦素干預后,正常對照組和胰島素抵抗組RPE細胞內均有8-OHdG的表達(圖 3,4)。
 圖3
正常對照組RPE細胞ICG染色像。3A~3C.0、10、100 ng/ml濃度瘦素干預后24 h;3D~3F.0、10、100 ng/ml濃度瘦素干預后48 h;3G~3I.0、10、100 ng/ml濃度瘦素干預后72 h。RPE細胞內均有8-OHdG的表達。0、10 ng/ml濃度瘦素ICG ×400,100 ng/ml濃度瘦素ICG ×800??圖 4??胰島素抵抗組RPE細胞ICG染色像。4A~4C.0、10、100 ng/ml濃度瘦素干預后24 h;4D~4F.0、10、100 ng/ml濃度瘦素干預后48 h;4G~4I.0、10、100 ng/ml濃度瘦素干預后72 h。RPE細胞內均有8-OHdG的表達。0、10 ng/ml濃度瘦素ICG ×400,100 ng/ml濃度瘦素ICG ×800??圖 5??不同濃度瘦素對人RPE細胞8-OHdG表達的影響。*:與0 ng/ml濃度比較,P<0.05??圖 6??相同濃度瘦素干預下不同時間點人RPE細胞8-OHdG表達量。*:與干預后24 h比較,P<0.05??圖 7??相同濃度瘦素干預下兩組人RPE細胞8-OHdG表達量。*:與對照組比較,P<0.05??圖 8??不同濃度瘦素對人RPE細胞hOGG1表達的影響。*:與0 ng/ml濃度比較,P<0.05
圖3
正常對照組RPE細胞ICG染色像。3A~3C.0、10、100 ng/ml濃度瘦素干預后24 h;3D~3F.0、10、100 ng/ml濃度瘦素干預后48 h;3G~3I.0、10、100 ng/ml濃度瘦素干預后72 h。RPE細胞內均有8-OHdG的表達。0、10 ng/ml濃度瘦素ICG ×400,100 ng/ml濃度瘦素ICG ×800??圖 4??胰島素抵抗組RPE細胞ICG染色像。4A~4C.0、10、100 ng/ml濃度瘦素干預后24 h;4D~4F.0、10、100 ng/ml濃度瘦素干預后48 h;4G~4I.0、10、100 ng/ml濃度瘦素干預后72 h。RPE細胞內均有8-OHdG的表達。0、10 ng/ml濃度瘦素ICG ×400,100 ng/ml濃度瘦素ICG ×800??圖 5??不同濃度瘦素對人RPE細胞8-OHdG表達的影響。*:與0 ng/ml濃度比較,P<0.05??圖 6??相同濃度瘦素干預下不同時間點人RPE細胞8-OHdG表達量。*:與干預后24 h比較,P<0.05??圖 7??相同濃度瘦素干預下兩組人RPE細胞8-OHdG表達量。*:與對照組比較,P<0.05??圖 8??不同濃度瘦素對人RPE細胞hOGG1表達的影響。*:與0 ng/ml濃度比較,P<0.05
干預后24、48、72 h,正常對照組(F=88.643、390.920、1039.276)和胰島素抵抗組(F=273.311、299.155、82.237)RPE細胞8-OHdG的表達隨瘦素濃度增加而增加,差異均有統計學意義(P<0.05)。其中,正常對照組100 ng/ml濃度瘦素干預后,RPE細胞8-OHdG表達量隨干預時間延長而增高,差異均有統計學意義(F=79.823, P<0.05)(圖 5)。胰島素抵抗組10 ng/ml濃度瘦素干預后72 h的RPE細胞8-OHdG表達量高于干預后24、48 h,差異有統計學意義(F=309.623,P<0.05);100 ng/ml濃度瘦素干預后,RPE細胞8-OHdG表達量隨干預時間延長有升高趨勢,但差異無統計學意義(F=15.389,P>0.05)(圖 6)。10 ng/ml濃度瘦素干預后24、72 h,胰島素抵抗組RPE細胞8-OHdG表達量高于正常對照組,差異有統計學意義(F=157.199、1183.004,P<0.05);干預后48 h,正常對照組、胰島素抵抗組PRE細胞8-OHdG表達量比較,差異無統計學意義(F=9.089,P>0.05)。100 ng/ml濃度瘦素干預后24、48 h,胰島素抵抗組RPE細胞8-OHdG表達量高于正常對照組,差異有統計學意義(F=52.408、167.983,P<0.05)(圖 7);干預后72 h,正常對照組、胰島素抵抗組RPE細胞8-OHdG表達量比較,差異無統計學意義(F=34.527,P>0.05)。
Western blot檢測結果顯示,干預后24、48、72 h,正常對照組(F=470.062、1073.113、295.456)、胰島素抵抗組(F=240.032、592.389、527.760)RPE細胞hOGGl表達量均隨瘦素濃度增加遞增,差異均有統計學意義(P<0.05)(圖 8, 9);在相同濃度瘦素干預下,隨著時間延長,RPE細胞hOGG1表達量呈現先升高后降低的趨勢。干預后48 h,正常對照組(F=83.673、268.000、373.492)、胰島素抵抗組(F=49.021、304.293、294.293)RPE細胞hOGGl表達量均高于干預后24、72hRPE細胞hOGGl表達量,差異有統計學意義(P<0.05)。
 圖9
Western blot圖。9A.正常對照組。9B.胰島素抵抗組。1~3:0、10、100 ng/ml。不同濃度瘦素干預下RPE細胞內hOGGl的表達量
圖9
Western blot圖。9A.正常對照組。9B.胰島素抵抗組。1~3:0、10、100 ng/ml。不同濃度瘦素干預下RPE細胞內hOGGl的表達量
10 ng/ml濃度瘦素干預后24 h,胰島素抵抗組、正常對照組RPE細胞hOGGl表達量比較,差異無統計學意義(F=23.392,P>0.05);干預后48、72 h,胰島素抵抗組RPE細胞hOGGl表達量低于正常對照組,差異有統計學意義(F=293.392、129.394,P<0.05)。100 ng/ml濃度瘦素干預24 h,胰島素抵抗組、正常對照組RPE細胞hOGGl表達量比較,差異無統計學意義(F=9.023,P>0.05);干預后48 h,正常對照組RPE細胞hOGGl表達量低于胰島素抵抗組,差異有統計學意義(F=593.02,P<0.05);干預后72 h,胰島素抵抗組RPE細胞hOGGl表達量低于正常對照組,差異有統計學意義(F=329.89,P<0.05)。
3 討論
有臨床研究發現,胰島素抵抗患者的DR發生高于無胰島素抵抗患者,但是否與脂肪因子的分泌有關目前尚不清楚[6]。瘦素是一種脂肪因子,免疫組織化學研究發現,在糖尿病患者的視網膜外纖維血管組織的視網膜前膜組織中檢測出了瘦素效應受體長型受體中存在著瘦素和瘦素受體,在增生型DR(PDR)患者的表達[7],而對正常人的視網膜組織進行相同的檢測卻并未檢測到它的表達。同時還有研究發現,在PDR患者的玻璃體液中瘦素濃度顯著高于正常人,既使把體重指數對瘦素水平的影響去除后結果也如此。體外實驗已證明,瘦素在PDR患者玻璃體液中的平均濃度已能夠有效地促進新生血管的形成[8]。這些均提示瘦素是促進PDR的發生發展的直接因素之一。瘦素在DR的發生發展過程中究竟如何發揮作用?這是本研究想要探討的問題。統一機制學說認為氧化應激是DR發生發展過程中的重要因素[6],RPE細胞因分泌內源性抗新生血管因子色素上皮衍生因子而在抗新生血管生成中發揮著重要作用,因此我們選擇了RPE細胞做為研究對象,模擬胰島素抵抗環境,觀察瘦素對RPE細胞氧化損傷的影響。
ROS被認為是引起DNA氧化損傷的主要因素之一,而ROS可使鳥嘌呤(G)氧化為8-OHdG,在體內形成后較為穩定、易于檢測,被視為DNA氧化損傷的生物標志物。本研究結果顯示,無論在正常狀態還是胰島素抵抗狀態下,RPE細胞內ROS、8-OHdG的表達量均隨著瘦素濃度增加而增加,差異具有統計學意義;而在相同瘦素濃度的干預下,兩組RPE細胞內ROS、8-OHdG的表達量呈現胰島素抵抗組高于正常對照組的趨勢,雖然在干預后24、48 h時兩組RPE細胞內ROS的表達的差異不具有統計學意義,仍提示無論是正常狀態還是胰島素抵抗狀態下,瘦素均能誘發人RPE細胞的氧化損傷,而在胰島素抵抗狀態下,瘦素誘發的人RPE細胞的氧化損傷程度更重。
正常細胞具有多種應對氧化損傷的機制,哺乳動物中負責DNA鏈8-OHdG突變修復的主要DNA糖基化酶之一是8-羥基鳥嘌呤糖基化酶(OGG),人類的稱為hOGG[9]。本研究結果顯示,兩組RPE細胞內hOGGl的表達量均隨瘦素濃度的增加遞增,差異有統計學意義;在相同濃度瘦素干預下,兩組RPE細胞內hOGGl的表達均顯示干預后48 h時高于干預后24、72 h時。因此我們推測,瘦素在誘發RPE細胞氧化損傷的同時,啟動了氧化損傷的代償性修復,但隨著時間的延長及氧化損傷程度的加重,氧化損傷的修復能力下降。另外,我們還發現以10 ng/ml濃度瘦素干預的兩組RPE細胞內hOGG1表達量呈現胰島素抵抗組低于正常對照組的趨勢;而以100 ng/ml濃度瘦素干預的兩組RPE細胞內hOGG1表達量干預后48 h時正常對照組低于胰島素抵抗組,差異有統計學意義;干預后72 h時胰島素抵抗組低于正常對照組,差異有統計學意義;提示針對瘦素引起的氧化損傷,胰島素抵抗狀態下的RPE細胞更易發揮代償性氧化損傷修復的作用,但隨著氧化損傷的加重,胰島素抵抗狀態下的RPE細胞更易發生氧化損傷修復失代償。
由于并未觀察瘦素是否對與DR發生直接相關的視網膜血管內皮細胞或周細胞產生氧化損傷,本研究結果對探討瘦素在DR發生發展中的作用尚有局限性。