引用本文: 宋虎平, 朱琦, 吳瓊, 艾華, 雷嘵琴, 朱昭亮, 楊陽. 缺氧誘導因子1α特異性小干擾RNA對髓樣細胞表面黏附分子CD18及神經損傷誘導蛋白-1表達的影響. 中華眼底病雜志, 2014, 30(2): 156-160. doi: 10.3760/cma.j.issn.1005-1015.2014.02.010 復制
白細胞與視網膜血管內皮細胞黏附是糖尿病視網膜病變(DR)早期重要事件,其過程與白細胞表面黏附分子CD18表達有關[1, 2]。在早期DR的發展過程中,起關鍵作用的是髓樣細胞的黏附[3, 4]。神經損傷誘導蛋白-1(Ninj-1)是一種新的黏附分子,在中樞神經系統炎癥病灶中可特異性表達在髓樣細胞表面,有可能成為中樞神經系統炎癥疾病治療的特異性靶點[5, 6]。研究表明,缺氧誘導因子1α(HIF1α)對糖尿病狀態下中性粒細胞表面黏附分子CD18的表達及白細胞與血管內皮細胞黏附有調節作用[7, 8]。但目前有關HIF1α對髓樣細胞的黏附及其表面黏附分子表達的作用還少有研究。為此,我們通過小干擾(si)RNA技術,觀察在早期DR條件下,HIF1α對髓樣細胞表面CD18及Ninj-1表達的影響,以期為治療早期DR尋找合適靶點。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料
2012年3~9月在西安市第四醫院眼科就診的10例1期DR患者及年齡、性別與之匹配的8例健康志愿者的血清樣本納入本研究。本研究經醫院倫理委員會同意,并獲得每一位受試者的知情同意。DR患者納入標準:(1)確診為1期DR者[9];(2)經熒光素眼底血管造影檢查證實其眼底只有少量可數的滲漏點,且沒有無灌注區存在者。排除DR患者和健康志愿者中合并有全身及局部炎癥病灶者。DR患者中,男性6例,女性4例;平均年齡(54.90±6.67)歲,平均空腹血糖(6.38±0.92) mmol/L。健康志愿者中,男女性各4名,平均年齡(55.10±5.33)歲,平均空腹血糖(4.88±0.75) mmol/L。DR患者和健康志愿者年齡間差異無統計學意義(F=0.01,P=0.97),平均空腹血糖間差異有統計學意義(F=15.85,P=0.01)。
人髓樣細胞系白血病細胞系(K562)及恒河猴視網膜脈絡膜血管內皮細胞系(RF/6A)(中國科學院上海細胞生物所),pSUPER.retro空載體(美國Oligoengine公司),LipofectamineTM2000 (美國Invitrogen公司),鼠HIF1α抗體、藻紅蛋白(PE)-標記鼠抗人IgG及CD18(美國Chemicon公司),β-肌動蛋白(β-actin)抗體(北京中杉金橋生物技術公司),電化學發光(ECL)試劑盒(美國Pierce公司),人Ninj-1抗體(美國Abcam公司),酶標儀(美國BIO-RAD公司),FACScan流式細胞儀(美國Becton Dickinson公司)。
1.2 實驗分組及轉染
取對數生長期K562細胞,以無血清無抗菌素Dulbecco改良Eagle培養基(DMEM)培養24 h后分為健康人血清培養組(A組)、糖尿病血清培養組(B組)、糖尿病血清培養聯合pSUPERH1-siHIF1α轉染組(C組)及糖尿病血清培養聯合pSUPER空載體組(D組)。A組加入10%健康志愿者血清繼續培養,B、C、D組加入10%DR患者血清繼續培養。C組在加入DR患者血清之前24 h先轉染pSUPERH1-siHIF1α,D組在加入DR患者血清之前24 h先轉染pSUPER空載體。A、B、C、D組細胞均在37 ℃、5%CO2孵箱中繼續培養24 h,然后收集細胞進行下一步實驗。
參照文獻[10]的方法構建pSUPERH1-siHIF1α真核表達載體。HIF1α siRNA的靶序列為AAGAGG TGGATATGTCTGG(1214-1232)。化學合成64 nt的HIF 1α小發夾(shHIF1α)RNA寡核苷酸序列:正義鏈5′-GATCCCCAAGAGGTGGATATGTCTGGT TCAAGAGACCAGACATATCCACCTCTTTTTTT GG-3′,反義鏈5′-AGCTTTTCCAAAG AGGTGGATATGTCTGGTCTCTTGAACCAGACA TATCCACCTCTTGGG-3′。將shHIF1α正義鏈和反義鏈退火形成雙鏈模板。采用Hind Ⅲ和BgⅢ雙酶切pSUPER.retro質粒,將線性化pSUPER. retro質粒與退火形成的雙鏈模板體外連接,經轉化、篩選,測序并鑒定,均由北京鼎國生物技術公司完成。基因轉染方法按照LipofectamineTM2000試劑盒說明書進行。
1.3 HIF1α、CD18、Ninj-1表達檢測及細胞黏附實驗
采用蛋白質免疫印跡法(Western blot)檢測各組K562細胞HIF1α蛋白表達水平。以pH 7.5的20 mmol/L羥乙基哌嗪乙硫磺酸、1% Triton X-100、1 mmol/L乙二胺四乙酸、0.1 mol/L NaCl配置細胞裂解緩沖液。取25×106個細胞,加入細胞裂解緩沖液,冰上裂解,離心,取上清液,蛋白定量。上樣,凝膠電泳后,轉印至聚偏二氟乙烯膜,10%脫脂奶粉4 ℃封閉過夜,加鼠HIF1α單克隆抗體(1:500)和β-actin抗體(1 ∶500),37 ℃孵育1 h,洗3次,加辣根過氧化物酶標記的羊抗鼠IgG (1 ∶5000),37 ℃孵育1 h,洗3次,ECL發光并照相。以β-actin為內參照。實驗重復3次。采用軟件Bandscan 5.0對感光膠片蛋白條帶進行灰度值分析,以目的條帶與內參照條帶的比值代表HIF1α蛋白的表達水平。
參照文獻[7]的方法,采用FACScan流式細胞儀檢測各組K562細胞表面的CD18表達。取1×105個細胞,以含有0.5 μl的0.5 mg/ml鼠抗人IgG抗體的RPMI-5%胎牛血清,冰上孵育5 min,加400 μl的20 mg/ml PE標記的鼠抗人CD18抗體,冰上孵育30 min。以FACScan流式細胞儀統計1×104個細胞的熒光強度。以細胞表面CD18陽性細胞的比例為CD18表達。
參照文獻[6]的方法,采用FACScan流式細胞儀檢測各組K562細胞表面的Ninj-1表達。取1×105個細胞,以含有0.5 μl的20 μg/ml鼠抗人IgG抗體的RPMI-10%胎牛血清,冰上孵育15 min,加400 μl的20 μg/ml鼠抗人Ninj-1抗體,冰上孵育30 min。以FACScan流式細胞儀統計1×104個細胞的熒光強度。以細胞表面Ninj-1陽性細胞的比例為Ninj-1表達。
參照文獻[7]的方法進行細胞黏附實驗,檢測各組K562細胞與RF/6A細胞黏附率。RF/6A細胞培養在96孔板中至融合,以1×105個/孔的細胞密度分別加入A、B、C、D組K562細胞,孵育1 h,用磷酸鹽緩沖液洗去未黏附細胞,加入0.25%虎紅,100 μl/孔,室溫作用10 min,洗去游離虎紅,加磷酸鹽緩沖液洗乙醇(1 ∶1),200 μl/孔,室溫作用1 h,酶標儀檢測波長570 nm處的吸光度[A,舊稱光密度(OD)]值。
1.4 統計學方法
采用SPSS 11.0軟件對數據進行統計分析處理。組間比較采用單因素方差分析;組間平均HIF1α兩兩比較采用最小顯著差法(LSD-t),以95%可信區間(CI)表示。P<0.05為差異有統計學意義。
2 結果
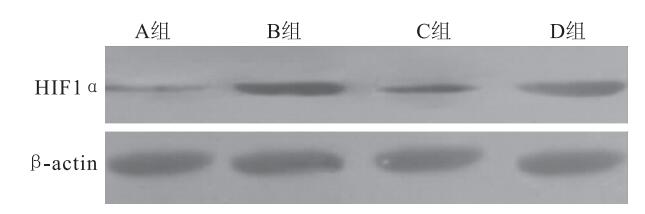
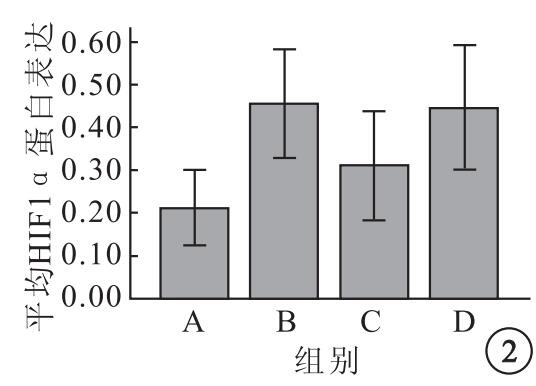
各組K562細胞均在相對分子質量120×103處見到HIF1α蛋白表達陽性條帶(圖 1)。A、B、C、D組平均HIF1α蛋白表達分別為0.21±0.05、0.45±0.07、0.31±0.08、0.44±0.09,4組平均HIF1α蛋白表達比較,差異有統計學意義(F=8.90,P=0.02)。組間平均HIF1α蛋白表達兩兩比較,B組較A組明顯升高(95%CI=-0.3~0.12,P=0.001);C組較B組明顯下降(95%CI=0.02~0.26,P=0.02);B組與D組之間無明顯差異(95%CI=-0.10~0.12,P=0.85);C組較D組明顯下降(95%CI=-0.25~0.01,P=0.03)(圖 2)。
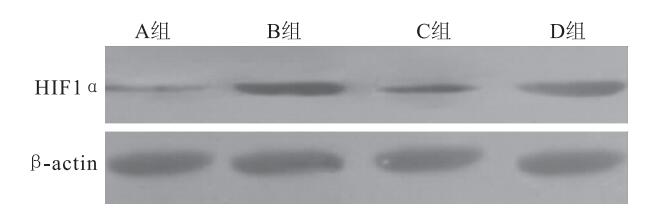 圖1
各組K562細胞HIF1α蛋白表達Western blot檢測像
圖1
各組K562細胞HIF1α蛋白表達Western blot檢測像
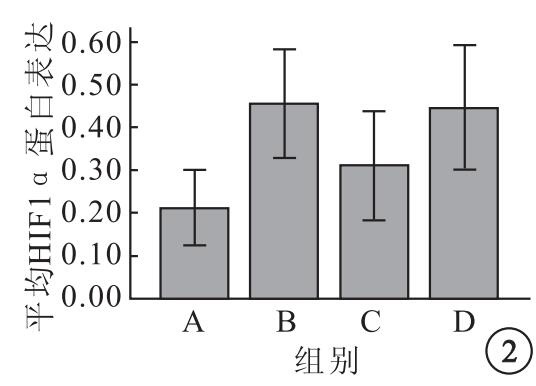 圖2
各組K562細胞中平均HIF1α蛋白表達比較
圖2
各組K562細胞中平均HIF1α蛋白表達比較
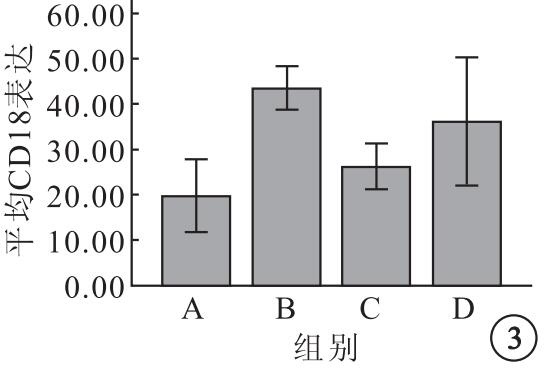
A、B、C、D組K562細胞表面平均CD18表達分別為19.81±5.02、43.42±2.96、26.19±3.16、36.16±8.84,4組平均CD18表達比較,差異有統計學意義(F=14.33,P=0.01)。組間平均CD18表達兩兩比較,B組明顯高于A組(95%CI=-32.12~-15.09,P=0.001);C組明顯低于B組(95%CI=8.71~25.74,P=0.001)和D組(95%CI=-18.48~-1.45,P=0.02);C組與A組之間無明顯差異(95%CI=-14.89~2.13,P=0.12)(圖 3)。
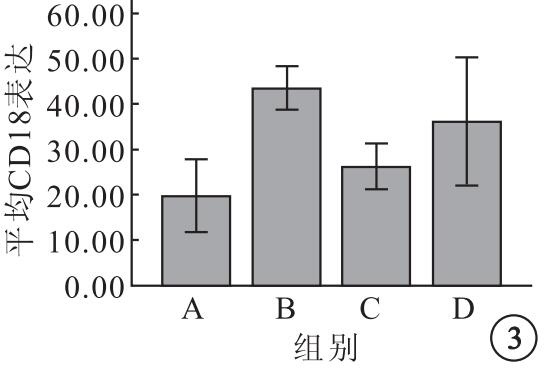 圖3
各組K562細胞表面平均CD18表達比較
圖3
各組K562細胞表面平均CD18表達比較
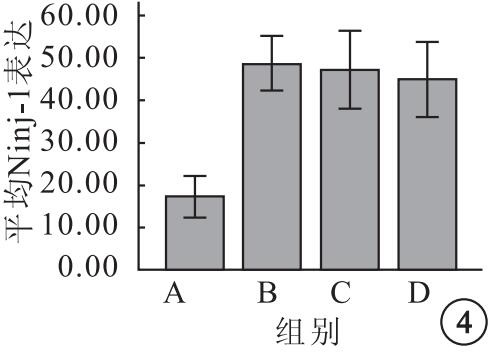
A、B、C、D組K562細胞表面平均Ninj-1表達分別為17.32±3.06、48.68±4.05、47.25±5.77、44.91±5.56,4組平均Ninj-1表達比較,差異有統計學意義(F=39.38,P=0.001)。組間平均Ninj-1表達兩兩比較,B組明顯高于A組(95%CI=-38.67~-24.04,P=0.00);C組與B組之間無明顯差異(95%CI=-5.87~8.75,P=0.06);C組與D組之間也無明顯差異(95%CI=-4.97~-9.65,P=0.49)(圖 4)。
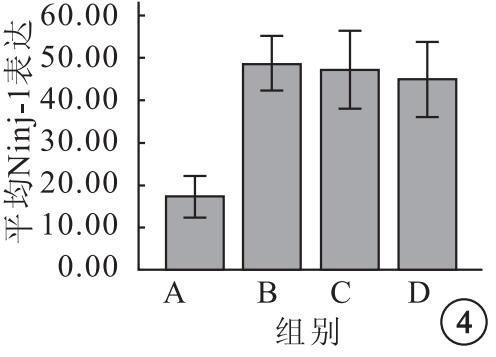 圖4
各組K562細胞表面平均Ninj-1表達比較
圖4
各組K562細胞表面平均Ninj-1表達比較
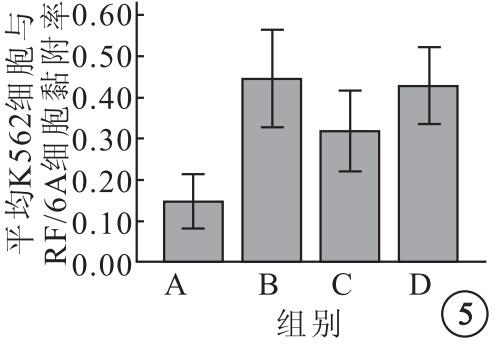
A、B、C、D組平均K562細胞與RF/6A細胞黏附率分別為0.14±0.04、0.44±0.07、0.31±0.06、0.42±0.06,4組平均K562細胞與RF16A細胞黏附率比較,差異有統計學意義(F=20.62,P=0.00)。組間平均K526細胞與RF16A細胞黏附率兩兩比較,B組明顯高于A組(95%CI=-0.39~-0.20,P=0.000);C組較B組明顯下降(95%CI=0.03~0.22,P=0.01),較A組明顯提高(95%CI=-0.26~-0.07,P=0.002);B組與D組之間無明顯差異(95%CI=-0.075~0.11,P=0.68)(圖 5)。
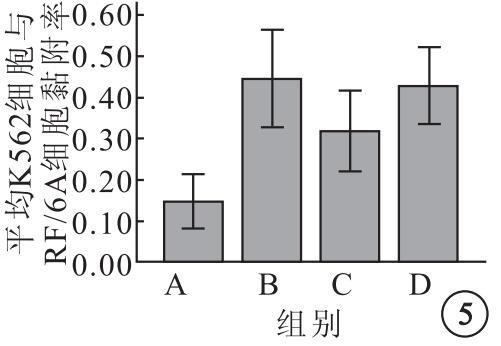 圖5
各組平均K562細胞與RF/6A細胞黏附率比較
圖5
各組平均K562細胞與RF/6A細胞黏附率比較
3 討論
研究表明,白細胞中的髓樣細胞與視網膜血管內皮細胞黏附是早期DR發病中的關鍵因素[3, 4]。特異性抑制髓樣細胞的黏附有可能成為早期DR治療。人血液中髓樣細胞包括中性粒細胞和單核細胞,但中性粒細胞是終末分化細胞,不適于體外培養研究。K562細胞是人髓系白血病細胞系,具有向髓樣細胞分化潛能,因此我們選擇了K562細胞作為人類循環中髓樣細胞模型研究其在糖尿病狀態下的黏附分子表達及其與血管內皮細胞黏附的功能。
HIF1α是重要的炎癥調節因子,對炎癥狀態下髓樣細胞黏附具有調節作用[11, 12]。但對于糖尿病狀態下HIF1α對髓樣細胞黏附的調節作用的研究不多。本研究結果顯示,在糖尿病狀態下,K562細胞中HIF1α水平升高。而HIF1α的表達水平被抑制后,K562細胞與血管內皮細胞黏附水平下降,說明HIF1α也可能參與糖尿病狀態下K562細胞與血管內皮細胞的黏附。這種調節作用可能與K562細胞表面CD18表達有關。因為通過siRNA技術抑制K562細胞中的HIF1α表達后,細胞表面黏附分子CD18顯著降低,與以往研究結果一致[7]。
CD18在各類白細胞表面均有表達,抗CD18治療對一些炎癥性疾病的治療有效[13]。但其明顯的副作用就是限制了抗原呈遞細胞對淋巴細胞的激活[14]。以CD18為靶點抑制白細胞黏附治療早期DR,雖然從機制上講很吸引人,但是其廣泛的白細胞抑制特點給機體自身免疫系統的抗病毒、抗細菌及抗腫瘤免疫監督功能留下很少的空間,因為大部分的免疫細胞都表達高水平的CD18 [15, 16]。本研究結果顯示,當用來自DR患者的血清培養后,K562細胞表面CD18蛋白水平顯著升高,K562細胞與血管內皮細胞黏附率顯著升高;而抑制CD18表達水平后,K562細胞與血管內皮細胞的黏附也顯著下降,說明CD18參與DR狀態下髓樣細胞的黏附,有可能成為治療早期DR的靶點。
Ninj-1是一種新型黏附分子,在炎癥過程中起著重要作用[17]。由于HIF1α是一種重要的轉錄調節因子,參與調節機體內多種炎癥介質及黏附分子的合成,因此我們擬研究其對Ninj-1的調節作用。本研究結果顯示,DR患者的血清可以刺激K562細胞表面Ninj-1表達水平升高。說明其有可能參與了DR狀態下髓樣細胞的黏附,與以往研究結果一致[18]。但HIF1α基因被干擾后,Ninj-1蛋白的表達水平并沒有受到影響。說明HIF1α有可能并不參與調節K562細胞表面Ninj-1蛋白的表達。Ninj-1在正常成年大鼠腦組織中表達水平較低,但是過敏性室管膜炎情況下其表達水平顯著升高,主要在單核-巨噬細胞、中性粒細胞及血管內皮細胞表面表達升高,而淋巴細胞表面幾乎無表達[6]。在進一步的研究中發現,Ninj-1可特異性調節髓樣細胞與血管內皮細胞的黏附,調節這些細胞通過血腦屏障進入多發性硬化及實驗性過敏性室管膜炎炎癥病灶周圍,而對CD8+T淋巴細胞功能無顯著影響。Ninj-1有可能成為治療中樞神經系統炎癥的特異性靶點[19]。
本研究結果表明,早期DR狀態下,以pSUPER為載體的siHIF1α RNA可降低K562細胞表面CD18的表達,但對Ninj-1表達無明顯影響。說明HIF1α及CD18有可能成為抑制早期DR髓樣細胞黏附的一個非特異性靶點;Ninj-1可能參與早期DR狀態下髓樣細胞黏附,但其能否成為DR的特異性靶點仍需做深入研究。但由于本研究沒有采用人髓樣細胞作為研究對象,這可能會影響對實驗結果的解釋。今后研究應選擇更適合的細胞模型進行DR狀態下髓樣細胞表面特異性黏附分子的研究。
白細胞與視網膜血管內皮細胞黏附是糖尿病視網膜病變(DR)早期重要事件,其過程與白細胞表面黏附分子CD18表達有關[1, 2]。在早期DR的發展過程中,起關鍵作用的是髓樣細胞的黏附[3, 4]。神經損傷誘導蛋白-1(Ninj-1)是一種新的黏附分子,在中樞神經系統炎癥病灶中可特異性表達在髓樣細胞表面,有可能成為中樞神經系統炎癥疾病治療的特異性靶點[5, 6]。研究表明,缺氧誘導因子1α(HIF1α)對糖尿病狀態下中性粒細胞表面黏附分子CD18的表達及白細胞與血管內皮細胞黏附有調節作用[7, 8]。但目前有關HIF1α對髓樣細胞的黏附及其表面黏附分子表達的作用還少有研究。為此,我們通過小干擾(si)RNA技術,觀察在早期DR條件下,HIF1α對髓樣細胞表面CD18及Ninj-1表達的影響,以期為治療早期DR尋找合適靶點。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料
2012年3~9月在西安市第四醫院眼科就診的10例1期DR患者及年齡、性別與之匹配的8例健康志愿者的血清樣本納入本研究。本研究經醫院倫理委員會同意,并獲得每一位受試者的知情同意。DR患者納入標準:(1)確診為1期DR者[9];(2)經熒光素眼底血管造影檢查證實其眼底只有少量可數的滲漏點,且沒有無灌注區存在者。排除DR患者和健康志愿者中合并有全身及局部炎癥病灶者。DR患者中,男性6例,女性4例;平均年齡(54.90±6.67)歲,平均空腹血糖(6.38±0.92) mmol/L。健康志愿者中,男女性各4名,平均年齡(55.10±5.33)歲,平均空腹血糖(4.88±0.75) mmol/L。DR患者和健康志愿者年齡間差異無統計學意義(F=0.01,P=0.97),平均空腹血糖間差異有統計學意義(F=15.85,P=0.01)。
人髓樣細胞系白血病細胞系(K562)及恒河猴視網膜脈絡膜血管內皮細胞系(RF/6A)(中國科學院上海細胞生物所),pSUPER.retro空載體(美國Oligoengine公司),LipofectamineTM2000 (美國Invitrogen公司),鼠HIF1α抗體、藻紅蛋白(PE)-標記鼠抗人IgG及CD18(美國Chemicon公司),β-肌動蛋白(β-actin)抗體(北京中杉金橋生物技術公司),電化學發光(ECL)試劑盒(美國Pierce公司),人Ninj-1抗體(美國Abcam公司),酶標儀(美國BIO-RAD公司),FACScan流式細胞儀(美國Becton Dickinson公司)。
1.2 實驗分組及轉染
取對數生長期K562細胞,以無血清無抗菌素Dulbecco改良Eagle培養基(DMEM)培養24 h后分為健康人血清培養組(A組)、糖尿病血清培養組(B組)、糖尿病血清培養聯合pSUPERH1-siHIF1α轉染組(C組)及糖尿病血清培養聯合pSUPER空載體組(D組)。A組加入10%健康志愿者血清繼續培養,B、C、D組加入10%DR患者血清繼續培養。C組在加入DR患者血清之前24 h先轉染pSUPERH1-siHIF1α,D組在加入DR患者血清之前24 h先轉染pSUPER空載體。A、B、C、D組細胞均在37 ℃、5%CO2孵箱中繼續培養24 h,然后收集細胞進行下一步實驗。
參照文獻[10]的方法構建pSUPERH1-siHIF1α真核表達載體。HIF1α siRNA的靶序列為AAGAGG TGGATATGTCTGG(1214-1232)。化學合成64 nt的HIF 1α小發夾(shHIF1α)RNA寡核苷酸序列:正義鏈5′-GATCCCCAAGAGGTGGATATGTCTGGT TCAAGAGACCAGACATATCCACCTCTTTTTTT GG-3′,反義鏈5′-AGCTTTTCCAAAG AGGTGGATATGTCTGGTCTCTTGAACCAGACA TATCCACCTCTTGGG-3′。將shHIF1α正義鏈和反義鏈退火形成雙鏈模板。采用Hind Ⅲ和BgⅢ雙酶切pSUPER.retro質粒,將線性化pSUPER. retro質粒與退火形成的雙鏈模板體外連接,經轉化、篩選,測序并鑒定,均由北京鼎國生物技術公司完成。基因轉染方法按照LipofectamineTM2000試劑盒說明書進行。
1.3 HIF1α、CD18、Ninj-1表達檢測及細胞黏附實驗
采用蛋白質免疫印跡法(Western blot)檢測各組K562細胞HIF1α蛋白表達水平。以pH 7.5的20 mmol/L羥乙基哌嗪乙硫磺酸、1% Triton X-100、1 mmol/L乙二胺四乙酸、0.1 mol/L NaCl配置細胞裂解緩沖液。取25×106個細胞,加入細胞裂解緩沖液,冰上裂解,離心,取上清液,蛋白定量。上樣,凝膠電泳后,轉印至聚偏二氟乙烯膜,10%脫脂奶粉4 ℃封閉過夜,加鼠HIF1α單克隆抗體(1:500)和β-actin抗體(1 ∶500),37 ℃孵育1 h,洗3次,加辣根過氧化物酶標記的羊抗鼠IgG (1 ∶5000),37 ℃孵育1 h,洗3次,ECL發光并照相。以β-actin為內參照。實驗重復3次。采用軟件Bandscan 5.0對感光膠片蛋白條帶進行灰度值分析,以目的條帶與內參照條帶的比值代表HIF1α蛋白的表達水平。
參照文獻[7]的方法,采用FACScan流式細胞儀檢測各組K562細胞表面的CD18表達。取1×105個細胞,以含有0.5 μl的0.5 mg/ml鼠抗人IgG抗體的RPMI-5%胎牛血清,冰上孵育5 min,加400 μl的20 mg/ml PE標記的鼠抗人CD18抗體,冰上孵育30 min。以FACScan流式細胞儀統計1×104個細胞的熒光強度。以細胞表面CD18陽性細胞的比例為CD18表達。
參照文獻[6]的方法,采用FACScan流式細胞儀檢測各組K562細胞表面的Ninj-1表達。取1×105個細胞,以含有0.5 μl的20 μg/ml鼠抗人IgG抗體的RPMI-10%胎牛血清,冰上孵育15 min,加400 μl的20 μg/ml鼠抗人Ninj-1抗體,冰上孵育30 min。以FACScan流式細胞儀統計1×104個細胞的熒光強度。以細胞表面Ninj-1陽性細胞的比例為Ninj-1表達。
參照文獻[7]的方法進行細胞黏附實驗,檢測各組K562細胞與RF/6A細胞黏附率。RF/6A細胞培養在96孔板中至融合,以1×105個/孔的細胞密度分別加入A、B、C、D組K562細胞,孵育1 h,用磷酸鹽緩沖液洗去未黏附細胞,加入0.25%虎紅,100 μl/孔,室溫作用10 min,洗去游離虎紅,加磷酸鹽緩沖液洗乙醇(1 ∶1),200 μl/孔,室溫作用1 h,酶標儀檢測波長570 nm處的吸光度[A,舊稱光密度(OD)]值。
1.4 統計學方法
采用SPSS 11.0軟件對數據進行統計分析處理。組間比較采用單因素方差分析;組間平均HIF1α兩兩比較采用最小顯著差法(LSD-t),以95%可信區間(CI)表示。P<0.05為差異有統計學意義。
2 結果
各組K562細胞均在相對分子質量120×103處見到HIF1α蛋白表達陽性條帶(圖 1)。A、B、C、D組平均HIF1α蛋白表達分別為0.21±0.05、0.45±0.07、0.31±0.08、0.44±0.09,4組平均HIF1α蛋白表達比較,差異有統計學意義(F=8.90,P=0.02)。組間平均HIF1α蛋白表達兩兩比較,B組較A組明顯升高(95%CI=-0.3~0.12,P=0.001);C組較B組明顯下降(95%CI=0.02~0.26,P=0.02);B組與D組之間無明顯差異(95%CI=-0.10~0.12,P=0.85);C組較D組明顯下降(95%CI=-0.25~0.01,P=0.03)(圖 2)。
 圖1
各組K562細胞HIF1α蛋白表達Western blot檢測像
圖1
各組K562細胞HIF1α蛋白表達Western blot檢測像
 圖2
各組K562細胞中平均HIF1α蛋白表達比較
圖2
各組K562細胞中平均HIF1α蛋白表達比較
A、B、C、D組K562細胞表面平均CD18表達分別為19.81±5.02、43.42±2.96、26.19±3.16、36.16±8.84,4組平均CD18表達比較,差異有統計學意義(F=14.33,P=0.01)。組間平均CD18表達兩兩比較,B組明顯高于A組(95%CI=-32.12~-15.09,P=0.001);C組明顯低于B組(95%CI=8.71~25.74,P=0.001)和D組(95%CI=-18.48~-1.45,P=0.02);C組與A組之間無明顯差異(95%CI=-14.89~2.13,P=0.12)(圖 3)。
 圖3
各組K562細胞表面平均CD18表達比較
圖3
各組K562細胞表面平均CD18表達比較
A、B、C、D組K562細胞表面平均Ninj-1表達分別為17.32±3.06、48.68±4.05、47.25±5.77、44.91±5.56,4組平均Ninj-1表達比較,差異有統計學意義(F=39.38,P=0.001)。組間平均Ninj-1表達兩兩比較,B組明顯高于A組(95%CI=-38.67~-24.04,P=0.00);C組與B組之間無明顯差異(95%CI=-5.87~8.75,P=0.06);C組與D組之間也無明顯差異(95%CI=-4.97~-9.65,P=0.49)(圖 4)。
 圖4
各組K562細胞表面平均Ninj-1表達比較
圖4
各組K562細胞表面平均Ninj-1表達比較
A、B、C、D組平均K562細胞與RF/6A細胞黏附率分別為0.14±0.04、0.44±0.07、0.31±0.06、0.42±0.06,4組平均K562細胞與RF16A細胞黏附率比較,差異有統計學意義(F=20.62,P=0.00)。組間平均K526細胞與RF16A細胞黏附率兩兩比較,B組明顯高于A組(95%CI=-0.39~-0.20,P=0.000);C組較B組明顯下降(95%CI=0.03~0.22,P=0.01),較A組明顯提高(95%CI=-0.26~-0.07,P=0.002);B組與D組之間無明顯差異(95%CI=-0.075~0.11,P=0.68)(圖 5)。
 圖5
各組平均K562細胞與RF/6A細胞黏附率比較
圖5
各組平均K562細胞與RF/6A細胞黏附率比較
3 討論
研究表明,白細胞中的髓樣細胞與視網膜血管內皮細胞黏附是早期DR發病中的關鍵因素[3, 4]。特異性抑制髓樣細胞的黏附有可能成為早期DR治療。人血液中髓樣細胞包括中性粒細胞和單核細胞,但中性粒細胞是終末分化細胞,不適于體外培養研究。K562細胞是人髓系白血病細胞系,具有向髓樣細胞分化潛能,因此我們選擇了K562細胞作為人類循環中髓樣細胞模型研究其在糖尿病狀態下的黏附分子表達及其與血管內皮細胞黏附的功能。
HIF1α是重要的炎癥調節因子,對炎癥狀態下髓樣細胞黏附具有調節作用[11, 12]。但對于糖尿病狀態下HIF1α對髓樣細胞黏附的調節作用的研究不多。本研究結果顯示,在糖尿病狀態下,K562細胞中HIF1α水平升高。而HIF1α的表達水平被抑制后,K562細胞與血管內皮細胞黏附水平下降,說明HIF1α也可能參與糖尿病狀態下K562細胞與血管內皮細胞的黏附。這種調節作用可能與K562細胞表面CD18表達有關。因為通過siRNA技術抑制K562細胞中的HIF1α表達后,細胞表面黏附分子CD18顯著降低,與以往研究結果一致[7]。
CD18在各類白細胞表面均有表達,抗CD18治療對一些炎癥性疾病的治療有效[13]。但其明顯的副作用就是限制了抗原呈遞細胞對淋巴細胞的激活[14]。以CD18為靶點抑制白細胞黏附治療早期DR,雖然從機制上講很吸引人,但是其廣泛的白細胞抑制特點給機體自身免疫系統的抗病毒、抗細菌及抗腫瘤免疫監督功能留下很少的空間,因為大部分的免疫細胞都表達高水平的CD18 [15, 16]。本研究結果顯示,當用來自DR患者的血清培養后,K562細胞表面CD18蛋白水平顯著升高,K562細胞與血管內皮細胞黏附率顯著升高;而抑制CD18表達水平后,K562細胞與血管內皮細胞的黏附也顯著下降,說明CD18參與DR狀態下髓樣細胞的黏附,有可能成為治療早期DR的靶點。
Ninj-1是一種新型黏附分子,在炎癥過程中起著重要作用[17]。由于HIF1α是一種重要的轉錄調節因子,參與調節機體內多種炎癥介質及黏附分子的合成,因此我們擬研究其對Ninj-1的調節作用。本研究結果顯示,DR患者的血清可以刺激K562細胞表面Ninj-1表達水平升高。說明其有可能參與了DR狀態下髓樣細胞的黏附,與以往研究結果一致[18]。但HIF1α基因被干擾后,Ninj-1蛋白的表達水平并沒有受到影響。說明HIF1α有可能并不參與調節K562細胞表面Ninj-1蛋白的表達。Ninj-1在正常成年大鼠腦組織中表達水平較低,但是過敏性室管膜炎情況下其表達水平顯著升高,主要在單核-巨噬細胞、中性粒細胞及血管內皮細胞表面表達升高,而淋巴細胞表面幾乎無表達[6]。在進一步的研究中發現,Ninj-1可特異性調節髓樣細胞與血管內皮細胞的黏附,調節這些細胞通過血腦屏障進入多發性硬化及實驗性過敏性室管膜炎炎癥病灶周圍,而對CD8+T淋巴細胞功能無顯著影響。Ninj-1有可能成為治療中樞神經系統炎癥的特異性靶點[19]。
本研究結果表明,早期DR狀態下,以pSUPER為載體的siHIF1α RNA可降低K562細胞表面CD18的表達,但對Ninj-1表達無明顯影響。說明HIF1α及CD18有可能成為抑制早期DR髓樣細胞黏附的一個非特異性靶點;Ninj-1可能參與早期DR狀態下髓樣細胞黏附,但其能否成為DR的特異性靶點仍需做深入研究。但由于本研究沒有采用人髓樣細胞作為研究對象,這可能會影響對實驗結果的解釋。今后研究應選擇更適合的細胞模型進行DR狀態下髓樣細胞表面特異性黏附分子的研究。