引用本文: 楊博宇, 楊春波, 于敏, 李筱榮. 轉化生長因子-β受體抑制劑復合物C促進人胚胎干細胞向視網膜色素上皮細胞定向誘導. 中華眼底病雜志, 2014, 30(1): 75-79. doi: 10.3760/cma.j.issn.1005-1015.2014.01.019 復制
視網膜色素上皮(RPE)的變性和缺失是引起老年性黃斑變性(AMD)、視網膜色素變性(RP)等視網膜變性疾病的主要原因[1, 2]。應用人胚胎干細胞(hESC)來源的RPE(hESC-RPE)細胞進行體內細胞移植治療,為AMD和RP患者重見光明帶來了希望[3-5]。然而,hESC向RPE細胞誘導分化效率低、成熟周期長、造價高等問題仍然是目前研究的瓶頸,如何在短時間內更有效的擴增出RPE細胞,是當前需要解決的重要問題。RPE由神經外胚層發育而來,促進hESC向神經外胚層分化,可以提高RPE定向誘導效率。而轉化生長因子-β(TGF-β)超家族受體抑制劑復合物 C能提高hESC向神經方向誘導分化效率,抑制hESC向內胚層、中胚層及滋養外胚層分化[6]。為此,我們在誘導分化培養體系中加入復合物 C,觀察其對RPE細胞誘導效率的影響,并對hESC-RPE細胞特性進行了驗證。現將結果報道如下。
1 材料和方法
H1 hESC(美國WiCell研究所)用mTeSR(加拿大StemCell公司)培養于基質膠(Matrigel,美國BD公司)包被的孔板里,每天換液。將H1 hESC分為對照組和實驗組。對照組在細胞過度融合后,以去除堿性成纖維細胞生長因子(bFGF)的血清替代物(KOSR)培養體系誘導RPE細胞定向分化。實驗組于誘導分化前6 d在培養體系中加入1 μmol/L 復合物C(美國R&D System公司)。誘導分化培養體系成分:Knockout-Dulbecco改良的Eagle培養基(DMEM),10% KOSR,1%谷氨酰胺,1%非必需氨基酸和1%青鏈霉素(美國Gibco公司)。誘導分化第1、3、5周用Trizol(美國Invitrogen公司)提取兩組細胞總RNA,紫外分光光度法測定RNA濃度和純度,要求波長260、280 nm的吸光度[A,舊稱光密度(OD)]比值>1.8。逆轉錄試劑盒(美國Thermo公司)合成cDNA,逆轉錄反應體系:65 ℃,5 min;42 ℃,1 h;70 ℃,5 min。實時熒光定量逆轉錄聚合酶鏈反應(RT-PCR)檢測兩組人類配對盒基因(PAX6)、小眼球相關轉錄因子(MITF)、細胞視黃醛結合蛋白(CRALBP)、RPE65 mRNA的表達,以磷酸甘油醛脫氫酶(GAPDH)為內參照。PAX6上游引物:5′-TCAC CATGGCAAATAACCTG-3′,下游引物:5′-CAGCA TGCAGGAGTATGAGG-3′,擴增片段長度為70堿基對(bp);MITF上游引物:5′-AGAGTCTGAAGC AAGAGCACTG-3′,下游引物:5′-TGCGGTCATTT ATGTTAAATCTTC-3′,擴增片段長度為94 bp;CRALBP 上游引物:5′-AGATCTCAGGAAGATG GTGGAC-3′,下游引物:5′-GAAGTGGATGGCTTT GAACC-3′,擴增片段長度為66 bp;RPE65上游引物:5′-CAATGGGTTTCTGATTGTGGA-3′,下游引物:5′-CCAGTTCTCACGTAAATTGGCTA-3′,擴增片段長度為90 bp;GAPDH上游引物:5′-ATTGCCCT CAACGACCACT-3′,下游引物:5′-ATGAGGTCCAC CACCCTGT-3′,擴增片段長度為82 bp。RT-PCR反應條件: 50 ℃,2 min;95 ℃,10 min;接下來40個循環,循環條件為95 ℃,15 s;60 ℃,1 min。反應結束后,儀器自動生成循環閾值(CT)。實驗重復3次。數據采用2-△△CT分析。
當光學顯微鏡下看到較多細胞呈多角形形態及細胞質內色素化明顯時,挑取色素細胞團塊接種于基質膠包被的孔板里,用機械法和速率沉降法分離雜細胞、提純hESC-RPE細胞。同時培養ARPE-19細胞系(美國ATCC公司)用于對hESC-RPE細胞進行鑒定。ARPE-19細胞系培養基成分:DMEM/F12,5%胎牛血清,1%谷氨酰胺,1%非必需氨基酸和1%青鏈霉素(美國Gibco公司)。分別用3種方法鑒定hESC-RPE細胞:(1)提取hESC、ARPE-19、hESC-RPE細胞總RNA,RT-PCR檢測3種細胞PAX6、MITF、CRALBP、RPE65 mRNA表達。(2)采用蛋白免疫印跡法(Western blot)檢測hESC、ARPE-19、hESC-RPE細胞中PAX6、RPE65的蛋白表達,以β-肌動蛋白(β-actin)為內參照。細胞蛋白裂解液(RIPA,北京索 萊寶科技有限公司)分別提取hESC、ARPE-19、hESC-RPE細胞總蛋白,以離心半徑8 cm,12 000 r/min 離心20 min,取上清液,二喹啉甲酸(BCA)蛋白定量試劑盒(天津寶瑞生物技術有限公司)測蛋白濃度,配制10%分離膠和5%濃縮膠,100 ℃ 10 min蛋白變性,25 μg等量蛋白上樣,十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳,半干法轉膜30 min,37 ℃封閉2 h,加入PAX6兔單克隆抗體(1 ∶1000,PRB-278P,美國COVANCE公司)、RPE65鼠單克隆抗體(1 ∶1000,ab78036,英國Abcam公司)、β-actin鼠單克隆抗體(1 ∶1000,北京中杉金橋生物技術有限公司),4 ℃過夜孵育,洗膜緩沖液(TBST)洗膜3次,分別加辣根過氧化物酶(HRP)標記的羊抗兔和羊抗小鼠二抗,37 ℃孵育2 h,洗膜后電化學發光曝光顯影。(3)采用細胞免疫熒光法檢測hESC-RPE細胞中PAX6、緊密連接蛋白(ZO)-1的表達。將分離提純的hESC-RPE細胞接種在0.1%Gelatin包被的蓋玻片上,待細胞近融合時將玻片取出,4%多聚甲醛室溫下固定15 min,磷酸鹽緩沖液(PBS)洗3次,每次5 min,0.25%Triton X-100通透10 min,PBS洗3次,每次5 min,1%牛血清白蛋白室溫封閉30 min,加入PAX6兔單克隆抗體和ZO-1兔單克隆抗體(1 ∶500,美國Invitrogen公司),4 ℃濕盒孵育過夜,PBS洗3次,每次5 min,二抗室溫孵育2 h,PBS洗3次,每次5 min,1 μg/ml 二脒基苯基吲哚(DAPI)染色10 min,抗熒光淬滅封片劑封片,熒光顯微鏡下觀察hESC-RPE細胞中PAX6、ZO-1的表達情況。
采用SPSS 19.0統計軟件進行統計學分析。所有數據以均數±標準差(
2 結果
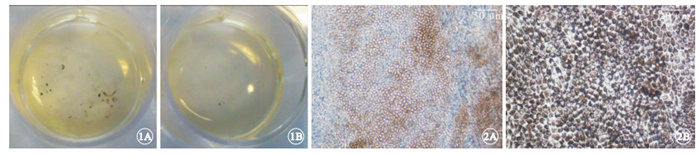
誘導分化第4周,實驗組肉眼可見色素團塊;對照組無色素團塊出現,顯微鏡下觀察色素細胞團尚未出現明顯的RPE細胞形態。誘導分化第5周,實驗組可見多個色素細胞團塊(圖 1A),對照組剛開始出現色素團塊(圖 1B)。實驗組色素細胞為典型的RPE細胞多角形細胞形態,細胞質內色素化明顯(圖 2A);分離提純后發現,其100%為多角形細胞形態,細胞質充滿色素顆粒(圖 2B)。
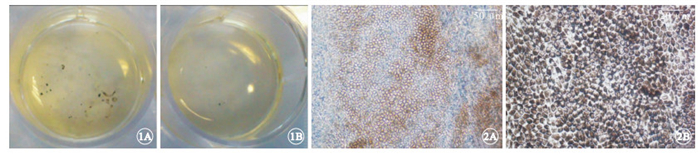 圖1
誘導分化第5周孔板外觀像。1A. 實驗組,肉眼可見多個色素團塊;1B. 對照組,剛開始出現色素團塊 ? ?圖 2 實驗組hESC-RPE細胞光學顯微鏡像。2A. 出現多角形色素化細胞 標尺: 50 μm;2B. 純化后的細胞100%為多角形細胞形態,細胞質充滿色素顆粒 標尺:20 μm
圖1
誘導分化第5周孔板外觀像。1A. 實驗組,肉眼可見多個色素團塊;1B. 對照組,剛開始出現色素團塊 ? ?圖 2 實驗組hESC-RPE細胞光學顯微鏡像。2A. 出現多角形色素化細胞 標尺: 50 μm;2B. 純化后的細胞100%為多角形細胞形態,細胞質充滿色素顆粒 標尺:20 μm
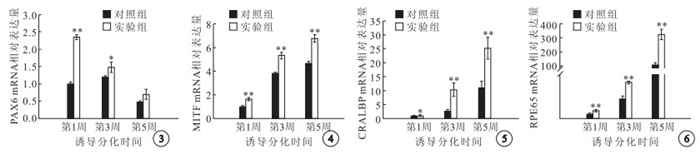
RT-PCR檢測結果顯示,實驗組PAX6 mRNA表達在誘導分化第1、3周顯著高于對照組,差異有統計學意義(t=28.498、3.141,P<0.05);誘導分化第5周,兩組PAX6 mRNA表達間差異無統計學意義(t=2.54,P>0.05)(圖 3)。誘導分化第3、5周,實驗組MITF(t=8.866、10.111)、CRALBP(t=5.293、5.394)和RPE65(t=9.263、9.504)的表達均明顯高于對照組,差異有統計學意義(P<0.05)(圖 4~6)。
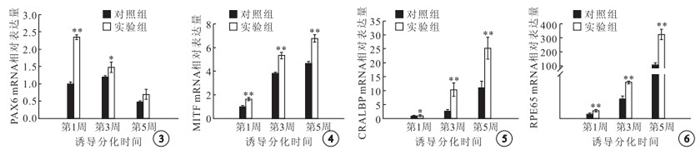 圖3
兩組PAX6 mRNA相對表達量比較。*: P<0.05,**: P<0.01 ? ?圖 4 兩組MITF mRNA相對表達量比較。**:P<0.01 ? ?圖 5 兩組CRALBP mRNA相對表達量比較。*:P<0.05,**:P<0.01 ? ?圖 6 兩組RPE65 mRNA相對表達量比較。**:P<0.01
圖3
兩組PAX6 mRNA相對表達量比較。*: P<0.05,**: P<0.01 ? ?圖 4 兩組MITF mRNA相對表達量比較。**:P<0.01 ? ?圖 5 兩組CRALBP mRNA相對表達量比較。*:P<0.05,**:P<0.01 ? ?圖 6 兩組RPE65 mRNA相對表達量比較。**:P<0.01
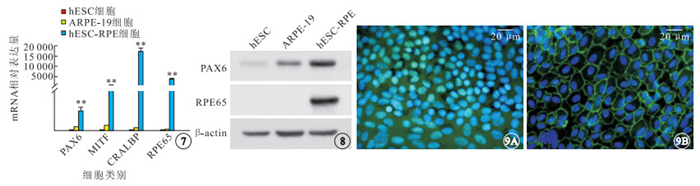
RT-PCR檢測結果顯示,hESC-RPE細胞PAX6、MITF、CRALBP、RPE65 mRNA表達均顯著高于hESC(t=9.154、17.284、18.204、44.194)和ARPE-19(t=7.605、16.770、18.190、44.190)細胞,差異有統計學意義(P<0.05)(圖 7)。Western blot檢測結果顯示,hESC-RPE細胞PAX6蛋白表達高于hESC、ARPE-19細胞;hESC-RPE細胞高表達RPE65,hESC、ARPE-19細胞均不表達RPE65(圖 8)。熒光顯微鏡觀察發現,hESC-RPE細胞表達RPE細胞特異性標志蛋白PAX6、ZO-1。PAX6表達于細胞核;ZO-1表達于細胞膜,顯示出hESC-RPE細胞緊密連接和多角形外觀(圖 9)。
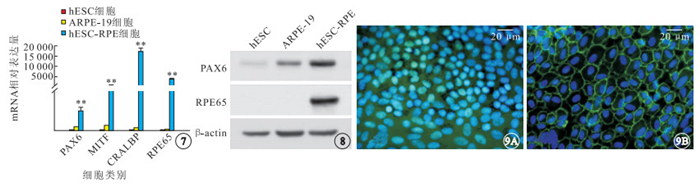 圖7
hESC、ARPE-19、hESC-RPE細胞中PAX6、MITF、CRALBP、RPE65 mRNA相對表達量比較。**:分別與hESC、ARPE-19細胞比較,P<0.01 ? ?圖 8 hESC、ARPE-19、hESC-RPE細胞中PAX6、RPE65蛋白表達Western blot檢測像 ? ?圖 9 hESC-RPE細胞熒光顯微鏡。9A. PAX6,可見PAX6表達于細胞核;9B. ZO-1,可見ZO-1表達于細胞膜,hESC-RPE細胞呈緊密連接和多角形外觀 標尺: 20 μm
圖7
hESC、ARPE-19、hESC-RPE細胞中PAX6、MITF、CRALBP、RPE65 mRNA相對表達量比較。**:分別與hESC、ARPE-19細胞比較,P<0.01 ? ?圖 8 hESC、ARPE-19、hESC-RPE細胞中PAX6、RPE65蛋白表達Western blot檢測像 ? ?圖 9 hESC-RPE細胞熒光顯微鏡。9A. PAX6,可見PAX6表達于細胞核;9B. ZO-1,可見ZO-1表達于細胞膜,hESC-RPE細胞呈緊密連接和多角形外觀 標尺: 20 μm
3 討論
胚胎干細胞(ESC)具有體外培養無限增生、自我更新和多向分化的特性,作為無限的種子細胞資源庫,應用ESC來源的RPE細胞進行體內細胞移植治療,補充損傷的RPE細胞,恢復視網膜功能,為視網膜變性疾病的患者重見光明帶來了希望[7, 8]。Schwartz等[9]將hESC-RPE細胞運用于臨床研究,發現接受移植治療的兩名罹患AMD和斯特格氏癥的失明患者均沒有對移植產生排斥反應,雖然他們的視力沒有得到很大恢復,但在移植手術后4個月能辨識出更多字母。這對hESC-RPE細胞臨床移植治療視網膜變性疾病起到了極大的鼓舞作用。
RPE發育經歷了神經誘導、眼區形成、視杯形成,與中樞神經系統的發育密切相關,促進hESC向神經外胚層分化進而向RPE細胞定向誘導,是提高RPE細胞誘導效率的方法之一[10]。復合物 C是TGF-β超家族受體抑制劑,能作用至少7種Ⅰ類和Ⅱ類TGF-β超家族受體。作為蛋白激酶抑制劑,復合物 C通過阻斷活化素和骨形成蛋白信號通路,抑制hESC向中胚層、內胚層和滋養外胚層分化,提高PAX6表達,促進hESC快速高效的向神經方向分化[6]。此外,復合物 C具有生產容易、純度高、使用方便、價格低廉等優點,這為提高hESC向RPE細胞定向誘導效率提供了理論依據。PAX6是神經祖細胞的標志,也是早期眼部細胞分化和RPE細胞前體細胞的標志[11]。本研究結果顯示,實驗組PAX6表達在誘導早期顯著高于對照組,提示復合物 C能促進hESC向神經外胚層分化。MITF、CRALBP和RPE65是RPE細胞的標志[12]。我們通過比較實驗組和對照組MITF、CRALBP、RPE65的表達,發現隨著誘導時間延長,兩組均出現RPE細胞標志基因MITF、CRALBP和RPE65的表達,且實驗組明顯高于對照組,尤其是在誘導分化第5周時差異顯著。提示復合物 C能提高早期眼部細胞和RPE細胞相關基因的表達,促進hESC向RPE細胞誘導。
本研究結果顯示,實驗組較對照組更早出現色素細胞團,誘導效率明顯提高,并且hESC-RPE細胞表現出典型的多角形色素化外觀。根據RPE細胞色素化和多角形外觀易于機械分離和擴增的特性,我們采用機械法聯合速率沉降法分離雜細胞、提純hESC-RPE細胞,純化后的細胞100%為多角形細胞形態,細胞質充滿色素顆粒,聯合使用這兩種方法能明顯減低污染細胞的比例。我們還對純化的hESC-RPE細胞進行鑒定,其基因水平檢測結果顯示,hESC-RPE細胞高表達PAX6、MITF、CRALBP、RPE65,較ARPE-19細胞更能顯示出RPE細胞特性,這與Klimanskaya等[13]研究結果一致。我們還發現,hESC-RPE細胞高表達PAX6和RPE65蛋白水平,hESC-RPE細胞表達RPE特異性標志蛋白PAX6、ZO-1,與Osakada等[14]報道結果一致。ARPE-19細胞用于細胞移植研究,也取得一定效果[15, 16]。但本研究結果顯示,ARPE-19細胞表達PAX6量很低,未檢出RPE65。說明轉化后的細胞系性質發生明顯改變,用于視網膜變性疾病的治療及機制研究存在明顯缺陷。hESC-RPE細胞表達RPE標志基因和標志蛋白顯著好于ARPE-19細胞系,接近于正常的RPE細胞,更加適合細胞移植治療視網膜變性疾病,為視網膜變性疾病的研究提供了更好的細胞平臺。
本研究結果表明,TGF-β受體抑制劑復合物 C能顯著提高hESC向RPE細胞的定向誘導效率,hESC-RPE細胞具備RPE細胞的多角形、色素化外觀,表達RPE細胞標志基因和蛋白,為提高RPE細胞誘導效率及hESC-RPE細胞移植療法的臨床轉化開辟了新的途徑。但是移植體內的hESC-RPE細胞存活率及其與視網膜整合性如何,能否發揮RPE細胞特有的功能,是否會產生移植排斥反應以及是否具有成瘤性等問題,還需要更深入的研究。
視網膜色素上皮(RPE)的變性和缺失是引起老年性黃斑變性(AMD)、視網膜色素變性(RP)等視網膜變性疾病的主要原因[1, 2]。應用人胚胎干細胞(hESC)來源的RPE(hESC-RPE)細胞進行體內細胞移植治療,為AMD和RP患者重見光明帶來了希望[3-5]。然而,hESC向RPE細胞誘導分化效率低、成熟周期長、造價高等問題仍然是目前研究的瓶頸,如何在短時間內更有效的擴增出RPE細胞,是當前需要解決的重要問題。RPE由神經外胚層發育而來,促進hESC向神經外胚層分化,可以提高RPE定向誘導效率。而轉化生長因子-β(TGF-β)超家族受體抑制劑復合物 C能提高hESC向神經方向誘導分化效率,抑制hESC向內胚層、中胚層及滋養外胚層分化[6]。為此,我們在誘導分化培養體系中加入復合物 C,觀察其對RPE細胞誘導效率的影響,并對hESC-RPE細胞特性進行了驗證。現將結果報道如下。
1 材料和方法
H1 hESC(美國WiCell研究所)用mTeSR(加拿大StemCell公司)培養于基質膠(Matrigel,美國BD公司)包被的孔板里,每天換液。將H1 hESC分為對照組和實驗組。對照組在細胞過度融合后,以去除堿性成纖維細胞生長因子(bFGF)的血清替代物(KOSR)培養體系誘導RPE細胞定向分化。實驗組于誘導分化前6 d在培養體系中加入1 μmol/L 復合物C(美國R&D System公司)。誘導分化培養體系成分:Knockout-Dulbecco改良的Eagle培養基(DMEM),10% KOSR,1%谷氨酰胺,1%非必需氨基酸和1%青鏈霉素(美國Gibco公司)。誘導分化第1、3、5周用Trizol(美國Invitrogen公司)提取兩組細胞總RNA,紫外分光光度法測定RNA濃度和純度,要求波長260、280 nm的吸光度[A,舊稱光密度(OD)]比值>1.8。逆轉錄試劑盒(美國Thermo公司)合成cDNA,逆轉錄反應體系:65 ℃,5 min;42 ℃,1 h;70 ℃,5 min。實時熒光定量逆轉錄聚合酶鏈反應(RT-PCR)檢測兩組人類配對盒基因(PAX6)、小眼球相關轉錄因子(MITF)、細胞視黃醛結合蛋白(CRALBP)、RPE65 mRNA的表達,以磷酸甘油醛脫氫酶(GAPDH)為內參照。PAX6上游引物:5′-TCAC CATGGCAAATAACCTG-3′,下游引物:5′-CAGCA TGCAGGAGTATGAGG-3′,擴增片段長度為70堿基對(bp);MITF上游引物:5′-AGAGTCTGAAGC AAGAGCACTG-3′,下游引物:5′-TGCGGTCATTT ATGTTAAATCTTC-3′,擴增片段長度為94 bp;CRALBP 上游引物:5′-AGATCTCAGGAAGATG GTGGAC-3′,下游引物:5′-GAAGTGGATGGCTTT GAACC-3′,擴增片段長度為66 bp;RPE65上游引物:5′-CAATGGGTTTCTGATTGTGGA-3′,下游引物:5′-CCAGTTCTCACGTAAATTGGCTA-3′,擴增片段長度為90 bp;GAPDH上游引物:5′-ATTGCCCT CAACGACCACT-3′,下游引物:5′-ATGAGGTCCAC CACCCTGT-3′,擴增片段長度為82 bp。RT-PCR反應條件: 50 ℃,2 min;95 ℃,10 min;接下來40個循環,循環條件為95 ℃,15 s;60 ℃,1 min。反應結束后,儀器自動生成循環閾值(CT)。實驗重復3次。數據采用2-△△CT分析。
當光學顯微鏡下看到較多細胞呈多角形形態及細胞質內色素化明顯時,挑取色素細胞團塊接種于基質膠包被的孔板里,用機械法和速率沉降法分離雜細胞、提純hESC-RPE細胞。同時培養ARPE-19細胞系(美國ATCC公司)用于對hESC-RPE細胞進行鑒定。ARPE-19細胞系培養基成分:DMEM/F12,5%胎牛血清,1%谷氨酰胺,1%非必需氨基酸和1%青鏈霉素(美國Gibco公司)。分別用3種方法鑒定hESC-RPE細胞:(1)提取hESC、ARPE-19、hESC-RPE細胞總RNA,RT-PCR檢測3種細胞PAX6、MITF、CRALBP、RPE65 mRNA表達。(2)采用蛋白免疫印跡法(Western blot)檢測hESC、ARPE-19、hESC-RPE細胞中PAX6、RPE65的蛋白表達,以β-肌動蛋白(β-actin)為內參照。細胞蛋白裂解液(RIPA,北京索 萊寶科技有限公司)分別提取hESC、ARPE-19、hESC-RPE細胞總蛋白,以離心半徑8 cm,12 000 r/min 離心20 min,取上清液,二喹啉甲酸(BCA)蛋白定量試劑盒(天津寶瑞生物技術有限公司)測蛋白濃度,配制10%分離膠和5%濃縮膠,100 ℃ 10 min蛋白變性,25 μg等量蛋白上樣,十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳,半干法轉膜30 min,37 ℃封閉2 h,加入PAX6兔單克隆抗體(1 ∶1000,PRB-278P,美國COVANCE公司)、RPE65鼠單克隆抗體(1 ∶1000,ab78036,英國Abcam公司)、β-actin鼠單克隆抗體(1 ∶1000,北京中杉金橋生物技術有限公司),4 ℃過夜孵育,洗膜緩沖液(TBST)洗膜3次,分別加辣根過氧化物酶(HRP)標記的羊抗兔和羊抗小鼠二抗,37 ℃孵育2 h,洗膜后電化學發光曝光顯影。(3)采用細胞免疫熒光法檢測hESC-RPE細胞中PAX6、緊密連接蛋白(ZO)-1的表達。將分離提純的hESC-RPE細胞接種在0.1%Gelatin包被的蓋玻片上,待細胞近融合時將玻片取出,4%多聚甲醛室溫下固定15 min,磷酸鹽緩沖液(PBS)洗3次,每次5 min,0.25%Triton X-100通透10 min,PBS洗3次,每次5 min,1%牛血清白蛋白室溫封閉30 min,加入PAX6兔單克隆抗體和ZO-1兔單克隆抗體(1 ∶500,美國Invitrogen公司),4 ℃濕盒孵育過夜,PBS洗3次,每次5 min,二抗室溫孵育2 h,PBS洗3次,每次5 min,1 μg/ml 二脒基苯基吲哚(DAPI)染色10 min,抗熒光淬滅封片劑封片,熒光顯微鏡下觀察hESC-RPE細胞中PAX6、ZO-1的表達情況。
采用SPSS 19.0統計軟件進行統計學分析。所有數據以均數±標準差(
2 結果
誘導分化第4周,實驗組肉眼可見色素團塊;對照組無色素團塊出現,顯微鏡下觀察色素細胞團尚未出現明顯的RPE細胞形態。誘導分化第5周,實驗組可見多個色素細胞團塊(圖 1A),對照組剛開始出現色素團塊(圖 1B)。實驗組色素細胞為典型的RPE細胞多角形細胞形態,細胞質內色素化明顯(圖 2A);分離提純后發現,其100%為多角形細胞形態,細胞質充滿色素顆粒(圖 2B)。
 圖1
誘導分化第5周孔板外觀像。1A. 實驗組,肉眼可見多個色素團塊;1B. 對照組,剛開始出現色素團塊 ? ?圖 2 實驗組hESC-RPE細胞光學顯微鏡像。2A. 出現多角形色素化細胞 標尺: 50 μm;2B. 純化后的細胞100%為多角形細胞形態,細胞質充滿色素顆粒 標尺:20 μm
圖1
誘導分化第5周孔板外觀像。1A. 實驗組,肉眼可見多個色素團塊;1B. 對照組,剛開始出現色素團塊 ? ?圖 2 實驗組hESC-RPE細胞光學顯微鏡像。2A. 出現多角形色素化細胞 標尺: 50 μm;2B. 純化后的細胞100%為多角形細胞形態,細胞質充滿色素顆粒 標尺:20 μm
RT-PCR檢測結果顯示,實驗組PAX6 mRNA表達在誘導分化第1、3周顯著高于對照組,差異有統計學意義(t=28.498、3.141,P<0.05);誘導分化第5周,兩組PAX6 mRNA表達間差異無統計學意義(t=2.54,P>0.05)(圖 3)。誘導分化第3、5周,實驗組MITF(t=8.866、10.111)、CRALBP(t=5.293、5.394)和RPE65(t=9.263、9.504)的表達均明顯高于對照組,差異有統計學意義(P<0.05)(圖 4~6)。
 圖3
兩組PAX6 mRNA相對表達量比較。*: P<0.05,**: P<0.01 ? ?圖 4 兩組MITF mRNA相對表達量比較。**:P<0.01 ? ?圖 5 兩組CRALBP mRNA相對表達量比較。*:P<0.05,**:P<0.01 ? ?圖 6 兩組RPE65 mRNA相對表達量比較。**:P<0.01
圖3
兩組PAX6 mRNA相對表達量比較。*: P<0.05,**: P<0.01 ? ?圖 4 兩組MITF mRNA相對表達量比較。**:P<0.01 ? ?圖 5 兩組CRALBP mRNA相對表達量比較。*:P<0.05,**:P<0.01 ? ?圖 6 兩組RPE65 mRNA相對表達量比較。**:P<0.01
RT-PCR檢測結果顯示,hESC-RPE細胞PAX6、MITF、CRALBP、RPE65 mRNA表達均顯著高于hESC(t=9.154、17.284、18.204、44.194)和ARPE-19(t=7.605、16.770、18.190、44.190)細胞,差異有統計學意義(P<0.05)(圖 7)。Western blot檢測結果顯示,hESC-RPE細胞PAX6蛋白表達高于hESC、ARPE-19細胞;hESC-RPE細胞高表達RPE65,hESC、ARPE-19細胞均不表達RPE65(圖 8)。熒光顯微鏡觀察發現,hESC-RPE細胞表達RPE細胞特異性標志蛋白PAX6、ZO-1。PAX6表達于細胞核;ZO-1表達于細胞膜,顯示出hESC-RPE細胞緊密連接和多角形外觀(圖 9)。
 圖7
hESC、ARPE-19、hESC-RPE細胞中PAX6、MITF、CRALBP、RPE65 mRNA相對表達量比較。**:分別與hESC、ARPE-19細胞比較,P<0.01 ? ?圖 8 hESC、ARPE-19、hESC-RPE細胞中PAX6、RPE65蛋白表達Western blot檢測像 ? ?圖 9 hESC-RPE細胞熒光顯微鏡。9A. PAX6,可見PAX6表達于細胞核;9B. ZO-1,可見ZO-1表達于細胞膜,hESC-RPE細胞呈緊密連接和多角形外觀 標尺: 20 μm
圖7
hESC、ARPE-19、hESC-RPE細胞中PAX6、MITF、CRALBP、RPE65 mRNA相對表達量比較。**:分別與hESC、ARPE-19細胞比較,P<0.01 ? ?圖 8 hESC、ARPE-19、hESC-RPE細胞中PAX6、RPE65蛋白表達Western blot檢測像 ? ?圖 9 hESC-RPE細胞熒光顯微鏡。9A. PAX6,可見PAX6表達于細胞核;9B. ZO-1,可見ZO-1表達于細胞膜,hESC-RPE細胞呈緊密連接和多角形外觀 標尺: 20 μm
3 討論
胚胎干細胞(ESC)具有體外培養無限增生、自我更新和多向分化的特性,作為無限的種子細胞資源庫,應用ESC來源的RPE細胞進行體內細胞移植治療,補充損傷的RPE細胞,恢復視網膜功能,為視網膜變性疾病的患者重見光明帶來了希望[7, 8]。Schwartz等[9]將hESC-RPE細胞運用于臨床研究,發現接受移植治療的兩名罹患AMD和斯特格氏癥的失明患者均沒有對移植產生排斥反應,雖然他們的視力沒有得到很大恢復,但在移植手術后4個月能辨識出更多字母。這對hESC-RPE細胞臨床移植治療視網膜變性疾病起到了極大的鼓舞作用。
RPE發育經歷了神經誘導、眼區形成、視杯形成,與中樞神經系統的發育密切相關,促進hESC向神經外胚層分化進而向RPE細胞定向誘導,是提高RPE細胞誘導效率的方法之一[10]。復合物 C是TGF-β超家族受體抑制劑,能作用至少7種Ⅰ類和Ⅱ類TGF-β超家族受體。作為蛋白激酶抑制劑,復合物 C通過阻斷活化素和骨形成蛋白信號通路,抑制hESC向中胚層、內胚層和滋養外胚層分化,提高PAX6表達,促進hESC快速高效的向神經方向分化[6]。此外,復合物 C具有生產容易、純度高、使用方便、價格低廉等優點,這為提高hESC向RPE細胞定向誘導效率提供了理論依據。PAX6是神經祖細胞的標志,也是早期眼部細胞分化和RPE細胞前體細胞的標志[11]。本研究結果顯示,實驗組PAX6表達在誘導早期顯著高于對照組,提示復合物 C能促進hESC向神經外胚層分化。MITF、CRALBP和RPE65是RPE細胞的標志[12]。我們通過比較實驗組和對照組MITF、CRALBP、RPE65的表達,發現隨著誘導時間延長,兩組均出現RPE細胞標志基因MITF、CRALBP和RPE65的表達,且實驗組明顯高于對照組,尤其是在誘導分化第5周時差異顯著。提示復合物 C能提高早期眼部細胞和RPE細胞相關基因的表達,促進hESC向RPE細胞誘導。
本研究結果顯示,實驗組較對照組更早出現色素細胞團,誘導效率明顯提高,并且hESC-RPE細胞表現出典型的多角形色素化外觀。根據RPE細胞色素化和多角形外觀易于機械分離和擴增的特性,我們采用機械法聯合速率沉降法分離雜細胞、提純hESC-RPE細胞,純化后的細胞100%為多角形細胞形態,細胞質充滿色素顆粒,聯合使用這兩種方法能明顯減低污染細胞的比例。我們還對純化的hESC-RPE細胞進行鑒定,其基因水平檢測結果顯示,hESC-RPE細胞高表達PAX6、MITF、CRALBP、RPE65,較ARPE-19細胞更能顯示出RPE細胞特性,這與Klimanskaya等[13]研究結果一致。我們還發現,hESC-RPE細胞高表達PAX6和RPE65蛋白水平,hESC-RPE細胞表達RPE特異性標志蛋白PAX6、ZO-1,與Osakada等[14]報道結果一致。ARPE-19細胞用于細胞移植研究,也取得一定效果[15, 16]。但本研究結果顯示,ARPE-19細胞表達PAX6量很低,未檢出RPE65。說明轉化后的細胞系性質發生明顯改變,用于視網膜變性疾病的治療及機制研究存在明顯缺陷。hESC-RPE細胞表達RPE標志基因和標志蛋白顯著好于ARPE-19細胞系,接近于正常的RPE細胞,更加適合細胞移植治療視網膜變性疾病,為視網膜變性疾病的研究提供了更好的細胞平臺。
本研究結果表明,TGF-β受體抑制劑復合物 C能顯著提高hESC向RPE細胞的定向誘導效率,hESC-RPE細胞具備RPE細胞的多角形、色素化外觀,表達RPE細胞標志基因和蛋白,為提高RPE細胞誘導效率及hESC-RPE細胞移植療法的臨床轉化開辟了新的途徑。但是移植體內的hESC-RPE細胞存活率及其與視網膜整合性如何,能否發揮RPE細胞特有的功能,是否會產生移植排斥反應以及是否具有成瘤性等問題,還需要更深入的研究。