引用本文: 王亞娜, 高莎, 沈璽. 色素上皮衍生因子對氧誘導視網膜新生血管的抑制作用. 中華眼底病雜志, 2014, 30(6): 588-593. doi: 10.3760/cma.j.issn.1005-1015.2014-06.013 復制
視網膜新生血管(RNV)生成是缺血、缺氧性視網膜病變發生的病理基礎。其發生是新生血管生成因子和抑制因子之間失衡導致的[1]。已有研究表明,炎癥因子白細胞介素(IL)-1β參與了缺血、缺氧性視網膜病變的發病進程[2, 3]。色素上皮衍生因子(PEDF)是絲氨酸蛋白酶抑制劑超家族的一員[4],是天然存在于眼內的血管抑制因子,具有抗血管生成、血管通透性和抗氧化作用以及抑制炎癥作用等[5-7]。但在缺血、缺氧性視網膜病變中抑制RNV形成的作用機制尚未完全闡明。為此,本研究通過建立氧誘導視網膜病變(OIR)小鼠模型,觀察PEDF對RNV抑制和IL-1β表達的影響。現將結果報道如下。
1 材料和方法
C57BL/6J新生小鼠140只, 7日齡,雌雄不限,清潔級,由上海市瑞金醫院動物房提供,動物飼養條件符合國家科學技術委員會頒布的《實驗動物管理條例》。重組PEDF蛋白(美國Peprotech公司),熒光標記的GS-Isolectin B4(Vector Laboratories),IL-1β山羊單克隆抗體一抗、甘油醛-3-磷酸脫氫酶(GAPDH)兔單克隆抗體一抗(美國R & D公司),辣根過氧化物酶(HRP)標記的山羊抗兔二抗(碧云天生物技術公司),HRP標記的大鼠抗山羊二抗(碧云天生物技術公司)。
采用隨機數字表法將140只7日齡小鼠分為正常對照組、OIR模型組、磷酸鹽緩沖液(PBS)干預對照組、PEDF治療組,每組均為20只。參照Smith等[8]方法制作OIR模型。7日齡C57BL/6J小鼠與哺乳母鼠一同置于氧濃度為(75±2)%的氧箱內,箱內溫度控制在(23±2)℃,每天日光照射12 h。飼養5 d后即小鼠12日齡時取出小鼠轉移至正常環境中飼養5 d,建立OIR模型。OIR模型組小鼠出氧箱后不作任何處理;正常對照組小鼠始終生活在正常氧環境中。
所有小鼠均取右眼為實驗眼。12、14日齡時,PEDF治療組小鼠玻璃體注射分別注射2 μg/μl的PEDF 1 μl[9];PBS干預對照組小鼠玻璃體腔注射等量PBS(10 mmol/L, pH7.4);正常對照組小鼠不作任何干預。17日齡時,所有小鼠過量麻醉處死。各組隨機抽取16只小鼠摘除右眼球,立即浸泡于40 g/L多聚甲醛溶液中固定,制作視網膜鋪片及冰凍切片。其余小鼠處死后手術顯微鏡下分離取出視網膜,液氮迅速冷凍后轉移至-80℃冰箱保存,以備提取蛋白質和總RNA。
每組各取8只小鼠眼球行全視網膜鋪片。4%多聚甲醛固定液固定2 h,手術顯微鏡下剝取完整視網膜組織,漂洗后以1:50稀釋的GS-Isolectin B4染色液對游離視網膜進行染色,室溫避光45 min~1 h;以視盤為中心做5~6個放射狀切口,清除鞏膜、脈絡膜、視網膜色素上皮層和玻璃體,封片劑封片。全部視網膜分為5~6瓣,熒光顯微鏡下照相,觀察無血管灌注區是否出現血管紆曲擴張、微血管瘤以及新生血管的形態。Image Pro Plus 6.0計算各組全RNV面積,SPSS software version 16.0統計軟件進行統計。
每組各取8只小鼠眼球行視網膜冰凍切片。4%多聚甲醛固定液固定24 h,手術顯微鏡下去除角膜、晶狀體,4℃冰箱,30%蔗糖溶液脫水24 h;OCT包埋,冰凍切片機切片,厚度8~10 μm。切片以1:50稀釋的GS-Isolectin B4染色液染色,室溫避光孵育45 min~1h;4′, 6-二脒基-2-苯基吲哚(DAPI)核染,室溫15 min;再次漂洗,封片劑封片,熒光顯微鏡下觀察視網膜全層新生血管生長情況,實驗結果重復3次。
蛋白免疫印跡法(Western blot)檢測視網膜組織中IL-1β蛋白的表達情況。每組各取6個視網膜樣本,提取蛋白后酶標儀測蛋白濃度,計算含40 μg蛋白的溶液體積為上樣量,與蛋白上樣緩沖液混合后100℃加熱5 min使其變性,加入配置好的聚丙烯酰胺凝膠中進行電泳。電泳結束后進行濕轉膜,將蛋白轉移至聚偏氟乙烯膜(美國Millipore公司),50 g/L脫脂奶粉37℃封閉1~2 h,洗膜后分別加入按1 :100稀釋的IL-1β一抗以及1 :10000稀釋的GAPDH一抗;4℃過夜后洗膜,分別加入HRP標記的二抗:1 :500稀釋的大鼠抗山羊以及山羊抗兔抗體。室溫下孵育2 h,洗膜緩沖液(TBST)洗膜10 min,3次。ECL化學發光顯色,GAPDH作為內參照。采用GIS-2020凝膠圖像分析系統掃描蛋白條帶的吸光度[A,舊稱光密度(OD)]值,以目的蛋白與內參蛋白GAPDH A值的比值作為目的蛋白的表達強度。實驗結果重復3次。
實時逆轉錄(RT)-聚合酶鏈反應(PCR)檢測視網膜組織中IL-1β mRNA的表達情況。每組隨機取8個視網膜樣本,Trizol試劑(美國Invitrogen公司)提取總RNA,分光光度計測定A260、A280及其濃度,根據A260/A280和A280/A260的比值鑒定總RNA純度,后每組每個視網膜樣品根據測得的總RNA濃度取2 μg總RNA,20 μl體系逆轉錄合成cDNA第一鏈。引物設計合成:IL-1β上游引物:5′-CTCCATGAGCTTTGTACAAGG-3′,下游引物:5′-TGCTGATGTACCAGTTGGGG-3′;β-肌動蛋白上游引物:5′-CTTCTTTGCAGCTCCTTCGT-3′,下游引物:5′-GTGCCAGATCTTCTCCATGT-3′。采用SYBR green PCR試劑盒(日本Takara公司)使目的基因和管家基因的擴增效率保持一致,接近于1。ABI Prism 7500-HT定量PCR儀擴增,反應完成后,得到所有標本的擴增曲線,軟件進行自動數據分析,2-△△Ct表示目的基因相對表達量。每組8個樣品,實驗重復3次。
應用SPSS 13.0統計軟件進行統計學分析處理。數據結果以均數土標準差(
2 結果
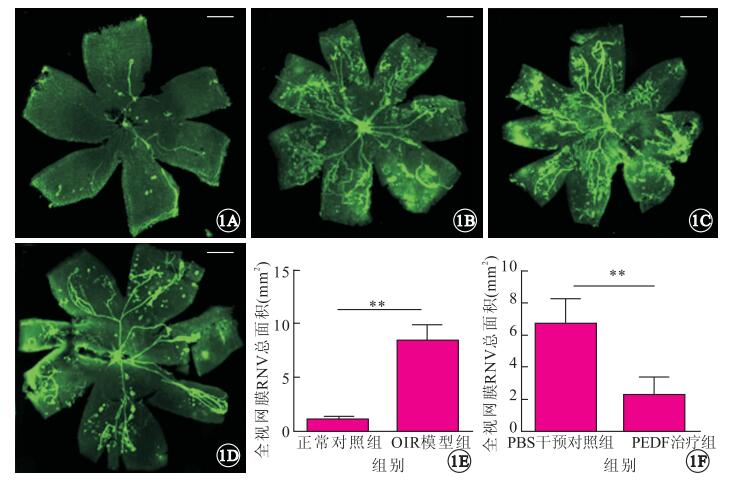
視網膜鋪片檢查結果顯示,正常對照組小鼠視網膜表面血管叢呈放射狀自視盤發出,走形平滑自然,分布于中央部與外周部視網膜(圖 1A);OIR模型組小鼠紆曲擴張的放射狀新生血管叢,新生血管成簇或成團分布于視網膜表面,中央區部分無灌注區(圖 1B);PEDF治療組小鼠視網膜表面新生血管團較PBS治療干預組明顯減少(圖 1C, 1D)。OIR模型組組、正常組對照組RNV面積分別為(8.358 5±0.481 3)、(1.073 4±0.059 0) mm2,兩組RNV面積比較,差異有統計學意義(t=15.02, P<0.01)(圖 1E);PEDF治療組、PBS干預對照組RNV面積分別為(2.262 9±0.422 8) 、(6.608 3±0.594 4) mm2,兩組RNV面積比較,差異有統計學意義(t=5.96, P<0.01)(圖 1F)。
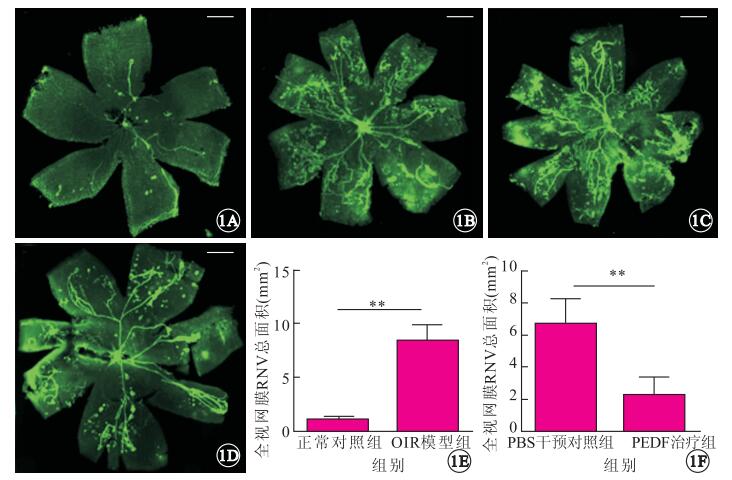 圖1
視網膜鋪片熒光顯微鏡像。1A.正常對照組,血管叢呈放射狀自視盤發出,走形平滑自然;1B.OIR模型組,視網膜血管擴張、紆曲,無灌注區形成,并在無灌注區與灌注區的交界處產生新生血管,可見新生血管芽和微血管瘤形成;1C. PBS干預對照組,可見成簇的新生血管;1D. PEDF治療組,PEDF治療組視網膜表面新生血管團較PBS治療干預組明顯減少。標尺:100 μm。1E.OIR模型組、正常對照組新生血管面積比較。**P<0.01。1F.PBS干預對照組、PEDF治療組RNV面積比較。**P<0.01
圖1
視網膜鋪片熒光顯微鏡像。1A.正常對照組,血管叢呈放射狀自視盤發出,走形平滑自然;1B.OIR模型組,視網膜血管擴張、紆曲,無灌注區形成,并在無灌注區與灌注區的交界處產生新生血管,可見新生血管芽和微血管瘤形成;1C. PBS干預對照組,可見成簇的新生血管;1D. PEDF治療組,PEDF治療組視網膜表面新生血管團較PBS治療干預組明顯減少。標尺:100 μm。1E.OIR模型組、正常對照組新生血管面積比較。**P<0.01。1F.PBS干預對照組、PEDF治療組RNV面積比較。**P<0.01
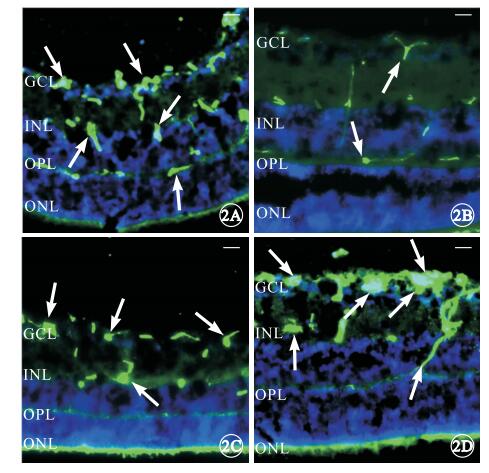
熒光顯微鏡觀察結果顯示,OIR模型組小鼠視網膜可見外叢狀層(OPL)與神經節細胞層(GCL)之間的新生血管簇較正常對照組明顯增多(圖 2A, 2B);PEDF治療組小鼠視網膜OPL與GCL之間的新生血管簇較PBS干預對照組明顯減少(圖 2C, 2D)。
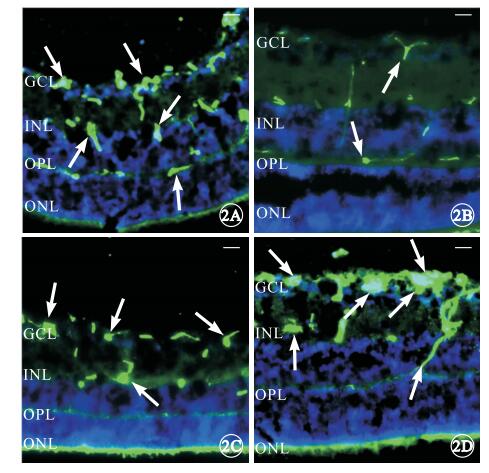 圖2
視網膜各層熒光顯微鏡像。2A, 2B.分別為OIR模型組、正常對照組,OIR模型組小鼠視網膜OPL與GCL之間的新生血管簇(白箭)較正常對照組明顯增多;2C, 2D.分別為PEDF治療組、PBS干預對照組,PEDF治療組RNV簇(白箭)較PBS干預對照組明顯減少。ONL:外核層;OPL:外叢狀層;INL:內核層;GCL:神經節細胞層標尺:200 μm
圖2
視網膜各層熒光顯微鏡像。2A, 2B.分別為OIR模型組、正常對照組,OIR模型組小鼠視網膜OPL與GCL之間的新生血管簇(白箭)較正常對照組明顯增多;2C, 2D.分別為PEDF治療組、PBS干預對照組,PEDF治療組RNV簇(白箭)較PBS干預對照組明顯減少。ONL:外核層;OPL:外叢狀層;INL:內核層;GCL:神經節細胞層標尺:200 μm
Western blot檢測結果顯示,正常對照組、OIR模型組、PBS干預對照組、PEDF治療組小鼠視網膜IL-1β蛋白表達量分別0.29±0.12、0.68±0.01、1.05±0.13、0.37±0.11。與正常對照組小鼠視網膜IL-1β蛋白表達量比較,OIR模型組小鼠視網膜IL-1β蛋白表達量增高,差異均有統計學意義(t=3.35, P<0.05)。正常對照組、PEDF治療組、PBS干預對照組間視網膜IL-1β蛋白表達量比較,差異有統計學意義(F=11.764, P<0.05)。PBS干預對照組小鼠視網膜IL-1β蛋白表達量較正常對照組增高,差異有統計學意義(P<0.05);PEDF治療組小鼠視網膜IL-1β蛋白表達量較PBS干預對照組降低,差異有統計學意義(P<0.01)。正常對照組小鼠視網膜IL-1β蛋白表達量與PEDF治療組比較,差異無統計學意義(P>0.05)(圖 3)。
 圖3
Western blot檢測圖。各組視網膜IL-1β蛋白表達量
圖3
Western blot檢測圖。各組視網膜IL-1β蛋白表達量
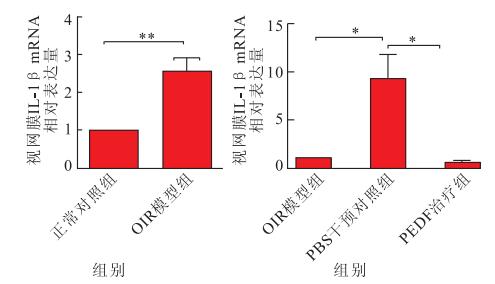
實時RT-PCR檢測結果顯示,正常對照組、OIR模型組、PBS干預對照組、PEDF治療組小鼠視網膜IL-1β mRNA的相對表達量分別為1、2.56±0.35、9.26±2.53、0.59±0.13。與正常對照組小鼠視網膜IL-1β mRNA的相對表達量比較,OIR模型組小鼠視網膜IL-1β mRNA相對表達增加,差異有統計學意義(t=4.43, P<0.01)。正常對照組、PEDF治療組、PBS干預對照組間視網膜IL-1β mRNA相對表達量比較,差異有統計學意義(F=11.151, P<0.05)。PBS干預對照組小鼠視網膜IL-1β mRNA相對表達量較正常對照組增高,差異有統計學意義(P<0.01);PEDF治療組小鼠視網膜IL-1β mRNA相對表達較PBS干預對照組減少,差異有統計學意義(P<0.01);正常對照組小鼠視網膜IL-1β mRNA相對表達量與PEDF治療組比較,差異無統計學意義(P>0.05)(圖 4)。
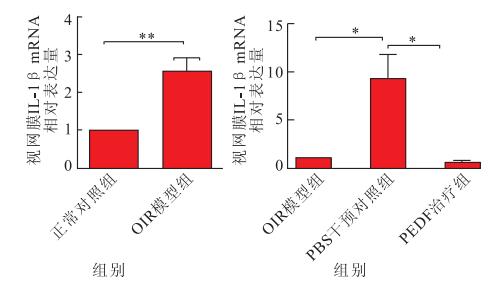 圖4
各組視網膜IL-1β mRNA相對表達量檢測結果。**P<0.01,*P<0.05
圖4
各組視網膜IL-1β mRNA相對表達量檢測結果。**P<0.01,*P<0.05
3 討論
RNV的形成是老年性黃斑變性、糖尿病視網膜病變、視網膜中央和分支靜脈阻塞以及早產兒視網膜病變等缺血、缺氧性視網膜病變常見的病理改變[10, 11]。大量研究結果表明PEDF具有抗新生血管作用[5, 6]。但其具體機制尚未完全揭示。本研究通過建立OIR小鼠模型來模擬缺血、缺氧視網膜病變,重組PEDF玻璃體腔注射進行干預。在觀察不同處理組RNV的生成情況的同時測定不同處理組視網膜炎癥因子IL-1β的表達變化,探討PEDF抑制新生血管形成的可能機制。
研究結果表明IL-1β具有促血管生成的特性[12, 13]。IL-1β通過與IL-1RI結合而發揮作用,Olson等[14]、Lavalette等[15]的研究結果證明激光誘導視網膜IL-1β的表達增多,而IL-1β抑制劑可以抑制激光誘導的大鼠視網膜下新生血管的形成。RNV形成受多種因子調控,其中血管內皮生長因子(VEGF)是最重要的細胞因子。過量表達IL-1β的轉基因鼠,出生后5~7 d炎性細胞開始浸潤,視網膜有散在VEGF強陽性表達并呈不斷增多趨勢,9~15 d開始減弱。從出生后15 d開始,VEGF強陽性達到第2個高峰,并且貫穿整個成年期。生后9~12 d,GS-isolectin-B4強陽性染色在視網膜表面聚集,12~15 d陽性染色在視網膜表面逐漸融合并形成RNV。表明VEGF升高與RNV的形成與炎癥因子IL-1β密切相關[16]。增生型糖尿病視網膜病變以細胞異常增生和新生血管形成為特征,患者玻璃體與血清內IL-1β和腫瘤壞死因子α均高于正常對照組[17]。但OIR的形成是否與IL-1β相關至今未見相關報道。本研究結果顯示,OIR模型組小鼠視網膜IL-1β蛋白、mRNA相對表達量均較正常對照組明顯升高,差異有統計學意義;同時OIR模型組以及PBS干預對照組小鼠RNV面積較正常對照組明顯增加,差異顯著;提示炎癥因子IL-1β可能在氧誘導RNV形成過程中發揮重要作用。
PEDF屬于絲氨酸蛋白酶抑制劑超家族,但無抑制蛋白水解酶的功能[4]。其在眼內組織中分布廣泛,角膜、睫狀體上皮細胞、晶狀體上皮細胞、脈絡膜、視網膜色素上皮細胞、光感受器細胞、神經節細胞均可以檢測到PEDF mRNA和蛋白的表達[18, 19]。PEDF能夠抑制諸如血小板源性生長因子、VEGF、IL-8以及酸性成纖維細胞生長因子等引起的血管內皮細胞的遷移[6]。PEDF抑制新生血管的生長,而不破壞現存的正常血管。其具體機制尚不清楚,既往研究認為可能是病理性新生血管內皮細胞不完整,通透性增加,從而滲漏出這些促血管生長因子,而這些很可能是PEDF受體的識別標志[20]。本研究中PEDF治療組RNV面積較PBS干預對照組明顯減少,差異有統計學意義,進一步證實了PEDF抑制OIR新生血管的作用。
越來越多的研究認為PEDF是眼內最強的抑炎因子之一[7]。多種視網膜病變的病理過程往往有免疫炎癥因素參與。我們早期研究發現高糖環境下PEDF可能通過下調視網膜Müller細胞中IL-β的表達,阻斷c-Jun通路的激活,上調Müller細胞GS的表達,從而改善谷氨酸循環而發揮神經保護作用[20]。那么PEDF是否能夠通過抑制炎癥因子IL-1β的作用而抑制新生血管的形成?Drechsler等[21]通過激光誘導建立的大鼠視網膜中央靜脈阻塞模型中,VEGF-A、IL-1β和IL-6的表達較對照組顯著增加,然而玻璃體腔注射貝伐單抗和抗VEGF抗體可以抑制VEGF-A、IL-1β水平的升高,但抗VEGF的治療對升高的IL-6不起作用。在關于肝臟胰島素信號轉導的研究中,Gattu等[22]研究結果顯示PEDF基因敲除的小鼠除了有顯著肥胖、葡糖糖耐受不良等的表型外,肝臟基因表達分析結果顯示IL-1β表達增加。本研究中,玻璃體腔注射PEDF在減少新生血管形成的同時也顯著減少了視網膜IL-1β的表達水平。綜合炎癥因子IL-1β在氧誘導RNV形成的相關性,提示PEDF能夠通過抑制炎癥因子IL-1β的表達水平而發揮抗新生血管的作用。
本研究通過建立OIR小鼠模型觀察PEDF對缺血缺氧環境下RNV的抑制作用及其對IL-1β表達的影響,提出在缺血缺氧情況下,PEDF可以通過抑制炎癥因子IL-1β的表達水平而發揮抗新生血管的作用。但是本研究尚缺乏IL-1β誘發RNV的直接證據,將在后續研究中進一步完善實驗數據,明確PEDF抑制新生血管形成的這一可能機制。
視網膜新生血管(RNV)生成是缺血、缺氧性視網膜病變發生的病理基礎。其發生是新生血管生成因子和抑制因子之間失衡導致的[1]。已有研究表明,炎癥因子白細胞介素(IL)-1β參與了缺血、缺氧性視網膜病變的發病進程[2, 3]。色素上皮衍生因子(PEDF)是絲氨酸蛋白酶抑制劑超家族的一員[4],是天然存在于眼內的血管抑制因子,具有抗血管生成、血管通透性和抗氧化作用以及抑制炎癥作用等[5-7]。但在缺血、缺氧性視網膜病變中抑制RNV形成的作用機制尚未完全闡明。為此,本研究通過建立氧誘導視網膜病變(OIR)小鼠模型,觀察PEDF對RNV抑制和IL-1β表達的影響。現將結果報道如下。
1 材料和方法
C57BL/6J新生小鼠140只, 7日齡,雌雄不限,清潔級,由上海市瑞金醫院動物房提供,動物飼養條件符合國家科學技術委員會頒布的《實驗動物管理條例》。重組PEDF蛋白(美國Peprotech公司),熒光標記的GS-Isolectin B4(Vector Laboratories),IL-1β山羊單克隆抗體一抗、甘油醛-3-磷酸脫氫酶(GAPDH)兔單克隆抗體一抗(美國R & D公司),辣根過氧化物酶(HRP)標記的山羊抗兔二抗(碧云天生物技術公司),HRP標記的大鼠抗山羊二抗(碧云天生物技術公司)。
采用隨機數字表法將140只7日齡小鼠分為正常對照組、OIR模型組、磷酸鹽緩沖液(PBS)干預對照組、PEDF治療組,每組均為20只。參照Smith等[8]方法制作OIR模型。7日齡C57BL/6J小鼠與哺乳母鼠一同置于氧濃度為(75±2)%的氧箱內,箱內溫度控制在(23±2)℃,每天日光照射12 h。飼養5 d后即小鼠12日齡時取出小鼠轉移至正常環境中飼養5 d,建立OIR模型。OIR模型組小鼠出氧箱后不作任何處理;正常對照組小鼠始終生活在正常氧環境中。
所有小鼠均取右眼為實驗眼。12、14日齡時,PEDF治療組小鼠玻璃體注射分別注射2 μg/μl的PEDF 1 μl[9];PBS干預對照組小鼠玻璃體腔注射等量PBS(10 mmol/L, pH7.4);正常對照組小鼠不作任何干預。17日齡時,所有小鼠過量麻醉處死。各組隨機抽取16只小鼠摘除右眼球,立即浸泡于40 g/L多聚甲醛溶液中固定,制作視網膜鋪片及冰凍切片。其余小鼠處死后手術顯微鏡下分離取出視網膜,液氮迅速冷凍后轉移至-80℃冰箱保存,以備提取蛋白質和總RNA。
每組各取8只小鼠眼球行全視網膜鋪片。4%多聚甲醛固定液固定2 h,手術顯微鏡下剝取完整視網膜組織,漂洗后以1:50稀釋的GS-Isolectin B4染色液對游離視網膜進行染色,室溫避光45 min~1 h;以視盤為中心做5~6個放射狀切口,清除鞏膜、脈絡膜、視網膜色素上皮層和玻璃體,封片劑封片。全部視網膜分為5~6瓣,熒光顯微鏡下照相,觀察無血管灌注區是否出現血管紆曲擴張、微血管瘤以及新生血管的形態。Image Pro Plus 6.0計算各組全RNV面積,SPSS software version 16.0統計軟件進行統計。
每組各取8只小鼠眼球行視網膜冰凍切片。4%多聚甲醛固定液固定24 h,手術顯微鏡下去除角膜、晶狀體,4℃冰箱,30%蔗糖溶液脫水24 h;OCT包埋,冰凍切片機切片,厚度8~10 μm。切片以1:50稀釋的GS-Isolectin B4染色液染色,室溫避光孵育45 min~1h;4′, 6-二脒基-2-苯基吲哚(DAPI)核染,室溫15 min;再次漂洗,封片劑封片,熒光顯微鏡下觀察視網膜全層新生血管生長情況,實驗結果重復3次。
蛋白免疫印跡法(Western blot)檢測視網膜組織中IL-1β蛋白的表達情況。每組各取6個視網膜樣本,提取蛋白后酶標儀測蛋白濃度,計算含40 μg蛋白的溶液體積為上樣量,與蛋白上樣緩沖液混合后100℃加熱5 min使其變性,加入配置好的聚丙烯酰胺凝膠中進行電泳。電泳結束后進行濕轉膜,將蛋白轉移至聚偏氟乙烯膜(美國Millipore公司),50 g/L脫脂奶粉37℃封閉1~2 h,洗膜后分別加入按1 :100稀釋的IL-1β一抗以及1 :10000稀釋的GAPDH一抗;4℃過夜后洗膜,分別加入HRP標記的二抗:1 :500稀釋的大鼠抗山羊以及山羊抗兔抗體。室溫下孵育2 h,洗膜緩沖液(TBST)洗膜10 min,3次。ECL化學發光顯色,GAPDH作為內參照。采用GIS-2020凝膠圖像分析系統掃描蛋白條帶的吸光度[A,舊稱光密度(OD)]值,以目的蛋白與內參蛋白GAPDH A值的比值作為目的蛋白的表達強度。實驗結果重復3次。
實時逆轉錄(RT)-聚合酶鏈反應(PCR)檢測視網膜組織中IL-1β mRNA的表達情況。每組隨機取8個視網膜樣本,Trizol試劑(美國Invitrogen公司)提取總RNA,分光光度計測定A260、A280及其濃度,根據A260/A280和A280/A260的比值鑒定總RNA純度,后每組每個視網膜樣品根據測得的總RNA濃度取2 μg總RNA,20 μl體系逆轉錄合成cDNA第一鏈。引物設計合成:IL-1β上游引物:5′-CTCCATGAGCTTTGTACAAGG-3′,下游引物:5′-TGCTGATGTACCAGTTGGGG-3′;β-肌動蛋白上游引物:5′-CTTCTTTGCAGCTCCTTCGT-3′,下游引物:5′-GTGCCAGATCTTCTCCATGT-3′。采用SYBR green PCR試劑盒(日本Takara公司)使目的基因和管家基因的擴增效率保持一致,接近于1。ABI Prism 7500-HT定量PCR儀擴增,反應完成后,得到所有標本的擴增曲線,軟件進行自動數據分析,2-△△Ct表示目的基因相對表達量。每組8個樣品,實驗重復3次。
應用SPSS 13.0統計軟件進行統計學分析處理。數據結果以均數土標準差(
2 結果
視網膜鋪片檢查結果顯示,正常對照組小鼠視網膜表面血管叢呈放射狀自視盤發出,走形平滑自然,分布于中央部與外周部視網膜(圖 1A);OIR模型組小鼠紆曲擴張的放射狀新生血管叢,新生血管成簇或成團分布于視網膜表面,中央區部分無灌注區(圖 1B);PEDF治療組小鼠視網膜表面新生血管團較PBS治療干預組明顯減少(圖 1C, 1D)。OIR模型組組、正常組對照組RNV面積分別為(8.358 5±0.481 3)、(1.073 4±0.059 0) mm2,兩組RNV面積比較,差異有統計學意義(t=15.02, P<0.01)(圖 1E);PEDF治療組、PBS干預對照組RNV面積分別為(2.262 9±0.422 8) 、(6.608 3±0.594 4) mm2,兩組RNV面積比較,差異有統計學意義(t=5.96, P<0.01)(圖 1F)。
 圖1
視網膜鋪片熒光顯微鏡像。1A.正常對照組,血管叢呈放射狀自視盤發出,走形平滑自然;1B.OIR模型組,視網膜血管擴張、紆曲,無灌注區形成,并在無灌注區與灌注區的交界處產生新生血管,可見新生血管芽和微血管瘤形成;1C. PBS干預對照組,可見成簇的新生血管;1D. PEDF治療組,PEDF治療組視網膜表面新生血管團較PBS治療干預組明顯減少。標尺:100 μm。1E.OIR模型組、正常對照組新生血管面積比較。**P<0.01。1F.PBS干預對照組、PEDF治療組RNV面積比較。**P<0.01
圖1
視網膜鋪片熒光顯微鏡像。1A.正常對照組,血管叢呈放射狀自視盤發出,走形平滑自然;1B.OIR模型組,視網膜血管擴張、紆曲,無灌注區形成,并在無灌注區與灌注區的交界處產生新生血管,可見新生血管芽和微血管瘤形成;1C. PBS干預對照組,可見成簇的新生血管;1D. PEDF治療組,PEDF治療組視網膜表面新生血管團較PBS治療干預組明顯減少。標尺:100 μm。1E.OIR模型組、正常對照組新生血管面積比較。**P<0.01。1F.PBS干預對照組、PEDF治療組RNV面積比較。**P<0.01
熒光顯微鏡觀察結果顯示,OIR模型組小鼠視網膜可見外叢狀層(OPL)與神經節細胞層(GCL)之間的新生血管簇較正常對照組明顯增多(圖 2A, 2B);PEDF治療組小鼠視網膜OPL與GCL之間的新生血管簇較PBS干預對照組明顯減少(圖 2C, 2D)。
 圖2
視網膜各層熒光顯微鏡像。2A, 2B.分別為OIR模型組、正常對照組,OIR模型組小鼠視網膜OPL與GCL之間的新生血管簇(白箭)較正常對照組明顯增多;2C, 2D.分別為PEDF治療組、PBS干預對照組,PEDF治療組RNV簇(白箭)較PBS干預對照組明顯減少。ONL:外核層;OPL:外叢狀層;INL:內核層;GCL:神經節細胞層標尺:200 μm
圖2
視網膜各層熒光顯微鏡像。2A, 2B.分別為OIR模型組、正常對照組,OIR模型組小鼠視網膜OPL與GCL之間的新生血管簇(白箭)較正常對照組明顯增多;2C, 2D.分別為PEDF治療組、PBS干預對照組,PEDF治療組RNV簇(白箭)較PBS干預對照組明顯減少。ONL:外核層;OPL:外叢狀層;INL:內核層;GCL:神經節細胞層標尺:200 μm
Western blot檢測結果顯示,正常對照組、OIR模型組、PBS干預對照組、PEDF治療組小鼠視網膜IL-1β蛋白表達量分別0.29±0.12、0.68±0.01、1.05±0.13、0.37±0.11。與正常對照組小鼠視網膜IL-1β蛋白表達量比較,OIR模型組小鼠視網膜IL-1β蛋白表達量增高,差異均有統計學意義(t=3.35, P<0.05)。正常對照組、PEDF治療組、PBS干預對照組間視網膜IL-1β蛋白表達量比較,差異有統計學意義(F=11.764, P<0.05)。PBS干預對照組小鼠視網膜IL-1β蛋白表達量較正常對照組增高,差異有統計學意義(P<0.05);PEDF治療組小鼠視網膜IL-1β蛋白表達量較PBS干預對照組降低,差異有統計學意義(P<0.01)。正常對照組小鼠視網膜IL-1β蛋白表達量與PEDF治療組比較,差異無統計學意義(P>0.05)(圖 3)。
 圖3
Western blot檢測圖。各組視網膜IL-1β蛋白表達量
圖3
Western blot檢測圖。各組視網膜IL-1β蛋白表達量
實時RT-PCR檢測結果顯示,正常對照組、OIR模型組、PBS干預對照組、PEDF治療組小鼠視網膜IL-1β mRNA的相對表達量分別為1、2.56±0.35、9.26±2.53、0.59±0.13。與正常對照組小鼠視網膜IL-1β mRNA的相對表達量比較,OIR模型組小鼠視網膜IL-1β mRNA相對表達增加,差異有統計學意義(t=4.43, P<0.01)。正常對照組、PEDF治療組、PBS干預對照組間視網膜IL-1β mRNA相對表達量比較,差異有統計學意義(F=11.151, P<0.05)。PBS干預對照組小鼠視網膜IL-1β mRNA相對表達量較正常對照組增高,差異有統計學意義(P<0.01);PEDF治療組小鼠視網膜IL-1β mRNA相對表達較PBS干預對照組減少,差異有統計學意義(P<0.01);正常對照組小鼠視網膜IL-1β mRNA相對表達量與PEDF治療組比較,差異無統計學意義(P>0.05)(圖 4)。
 圖4
各組視網膜IL-1β mRNA相對表達量檢測結果。**P<0.01,*P<0.05
圖4
各組視網膜IL-1β mRNA相對表達量檢測結果。**P<0.01,*P<0.05
3 討論
RNV的形成是老年性黃斑變性、糖尿病視網膜病變、視網膜中央和分支靜脈阻塞以及早產兒視網膜病變等缺血、缺氧性視網膜病變常見的病理改變[10, 11]。大量研究結果表明PEDF具有抗新生血管作用[5, 6]。但其具體機制尚未完全揭示。本研究通過建立OIR小鼠模型來模擬缺血、缺氧視網膜病變,重組PEDF玻璃體腔注射進行干預。在觀察不同處理組RNV的生成情況的同時測定不同處理組視網膜炎癥因子IL-1β的表達變化,探討PEDF抑制新生血管形成的可能機制。
研究結果表明IL-1β具有促血管生成的特性[12, 13]。IL-1β通過與IL-1RI結合而發揮作用,Olson等[14]、Lavalette等[15]的研究結果證明激光誘導視網膜IL-1β的表達增多,而IL-1β抑制劑可以抑制激光誘導的大鼠視網膜下新生血管的形成。RNV形成受多種因子調控,其中血管內皮生長因子(VEGF)是最重要的細胞因子。過量表達IL-1β的轉基因鼠,出生后5~7 d炎性細胞開始浸潤,視網膜有散在VEGF強陽性表達并呈不斷增多趨勢,9~15 d開始減弱。從出生后15 d開始,VEGF強陽性達到第2個高峰,并且貫穿整個成年期。生后9~12 d,GS-isolectin-B4強陽性染色在視網膜表面聚集,12~15 d陽性染色在視網膜表面逐漸融合并形成RNV。表明VEGF升高與RNV的形成與炎癥因子IL-1β密切相關[16]。增生型糖尿病視網膜病變以細胞異常增生和新生血管形成為特征,患者玻璃體與血清內IL-1β和腫瘤壞死因子α均高于正常對照組[17]。但OIR的形成是否與IL-1β相關至今未見相關報道。本研究結果顯示,OIR模型組小鼠視網膜IL-1β蛋白、mRNA相對表達量均較正常對照組明顯升高,差異有統計學意義;同時OIR模型組以及PBS干預對照組小鼠RNV面積較正常對照組明顯增加,差異顯著;提示炎癥因子IL-1β可能在氧誘導RNV形成過程中發揮重要作用。
PEDF屬于絲氨酸蛋白酶抑制劑超家族,但無抑制蛋白水解酶的功能[4]。其在眼內組織中分布廣泛,角膜、睫狀體上皮細胞、晶狀體上皮細胞、脈絡膜、視網膜色素上皮細胞、光感受器細胞、神經節細胞均可以檢測到PEDF mRNA和蛋白的表達[18, 19]。PEDF能夠抑制諸如血小板源性生長因子、VEGF、IL-8以及酸性成纖維細胞生長因子等引起的血管內皮細胞的遷移[6]。PEDF抑制新生血管的生長,而不破壞現存的正常血管。其具體機制尚不清楚,既往研究認為可能是病理性新生血管內皮細胞不完整,通透性增加,從而滲漏出這些促血管生長因子,而這些很可能是PEDF受體的識別標志[20]。本研究中PEDF治療組RNV面積較PBS干預對照組明顯減少,差異有統計學意義,進一步證實了PEDF抑制OIR新生血管的作用。
越來越多的研究認為PEDF是眼內最強的抑炎因子之一[7]。多種視網膜病變的病理過程往往有免疫炎癥因素參與。我們早期研究發現高糖環境下PEDF可能通過下調視網膜Müller細胞中IL-β的表達,阻斷c-Jun通路的激活,上調Müller細胞GS的表達,從而改善谷氨酸循環而發揮神經保護作用[20]。那么PEDF是否能夠通過抑制炎癥因子IL-1β的作用而抑制新生血管的形成?Drechsler等[21]通過激光誘導建立的大鼠視網膜中央靜脈阻塞模型中,VEGF-A、IL-1β和IL-6的表達較對照組顯著增加,然而玻璃體腔注射貝伐單抗和抗VEGF抗體可以抑制VEGF-A、IL-1β水平的升高,但抗VEGF的治療對升高的IL-6不起作用。在關于肝臟胰島素信號轉導的研究中,Gattu等[22]研究結果顯示PEDF基因敲除的小鼠除了有顯著肥胖、葡糖糖耐受不良等的表型外,肝臟基因表達分析結果顯示IL-1β表達增加。本研究中,玻璃體腔注射PEDF在減少新生血管形成的同時也顯著減少了視網膜IL-1β的表達水平。綜合炎癥因子IL-1β在氧誘導RNV形成的相關性,提示PEDF能夠通過抑制炎癥因子IL-1β的表達水平而發揮抗新生血管的作用。
本研究通過建立OIR小鼠模型觀察PEDF對缺血缺氧環境下RNV的抑制作用及其對IL-1β表達的影響,提出在缺血缺氧情況下,PEDF可以通過抑制炎癥因子IL-1β的表達水平而發揮抗新生血管的作用。但是本研究尚缺乏IL-1β誘發RNV的直接證據,將在后續研究中進一步完善實驗數據,明確PEDF抑制新生血管形成的這一可能機制。