引用本文: 施曉倩, 臧遠勝. 以腫塊伴空洞為表現的隱源性機化性肺炎一例并文獻復習. 中國呼吸與危重監護雜志, 2015, 14(2): 168-172. doi: 10.7507/1671-6205.2015043 復制
機化性肺炎(organizing pneumonia,OP)指肺泡管和肺泡腔中存在肉芽組織栓的一組疾病[1],隱源性機化性肺炎(cryptogenic organizing pneumonia,COP)指無明確的致病原因(如感染)或伴隨其他臨床疾病(如結締組織疾病)而出現的OP,有其獨特的臨床、病理、影像學特點。臨床上屬于少見病,有報道[2]OP的平均發病率估計為(6~7)/10萬,其中超過半數為COP,但COP確切的發病率目前尚不清楚[3]。現總結我院收治的1例初步診斷為肺癌,后經病理確診為COP患者的診斷、治療及轉歸,并結合有關文獻進行討論。
臨床資料
患者男性,63歲,否認吸煙史,因“咳嗽、咳痰1個月,發熱、畏寒1周”于2014年2月19日收入我院呼吸科。2014年1月中旬無明顯誘因出現咳嗽、咳痰,痰為白色泡沫痰,偶有陳舊性血性分泌物及黃膿痰,無咯鮮紅色痰,痰液黏稠不易咳出,咳嗽時伴右胸針刺樣疼痛,活動后略胸悶,無氣促。1周前出現發熱,體溫最高38.6 ℃,伴畏寒、全身酸痛不適,感乏力、納差、盜汗,無寒戰,無咽痛、流涕,無頭暈、頭痛。2014年2月14日就診當地醫院,血常規示白細胞、中性粒細胞百分比升高,胸部CT平掃+增強+三維重建示“右肺尖占位(大小約6.2 cm×6 cm)伴厚壁偏心空洞形成,縱隔淋巴結腫大(最大約1.7 cm)(圖 1、圖 2),予頭孢曲松鈉聯合左氧氟沙星抗感染5 d,體溫波動于37.5~38 ℃,咳嗽、咳痰略有好轉,為進一步診治,來我院就診,門診以“右上肺占位”收入院。患者自患病以來,精神狀態尚可,飲食欠佳,大、小便正常,睡眠無異常,體質量減輕約5 kg。
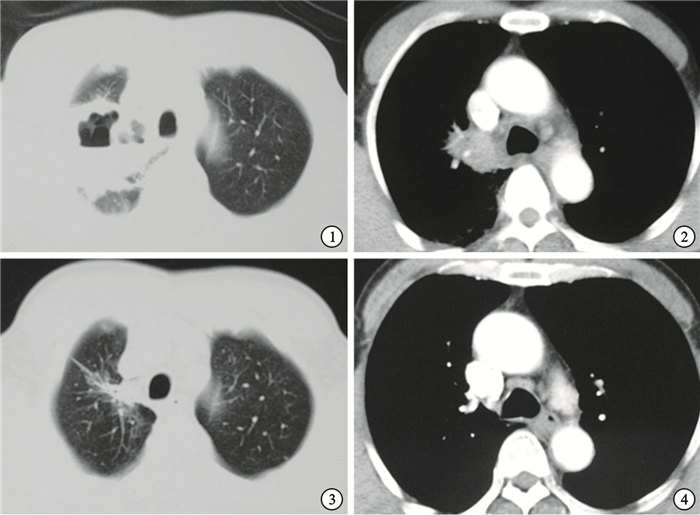 圖1
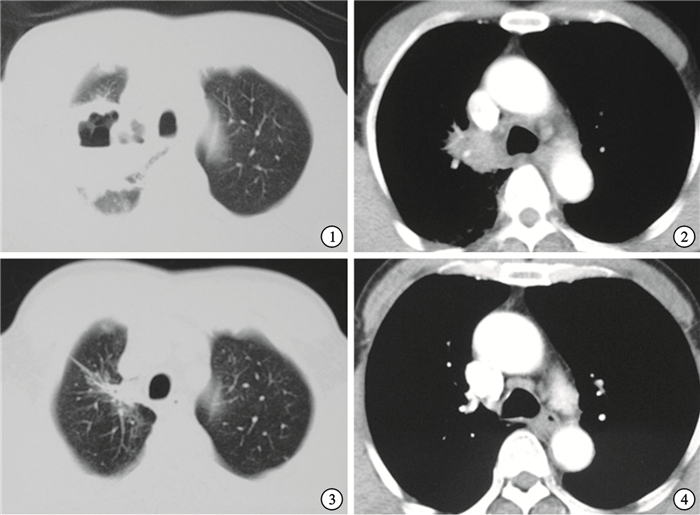
胸部CT(2014-02-14肺窗) 右肺尖腫塊伴厚壁偏心空洞形成 ? ?圖 2 胸部CT(2014-02-14縱隔窗) 縱隔淋巴結腫大 ? ?圖 3 激素治療后復查胸部CT(2014-04-15肺窗) 右肺尖腫塊較前明顯縮小,空洞消失 ? ?圖 4 激素治療后復查胸部CT(2014-04-15縱隔窗) 縱隔淋巴結較前縮小
圖1
胸部CT(2014-02-14肺窗) 右肺尖腫塊伴厚壁偏心空洞形成 ? ?圖 2 胸部CT(2014-02-14縱隔窗) 縱隔淋巴結腫大 ? ?圖 3 激素治療后復查胸部CT(2014-04-15肺窗) 右肺尖腫塊較前明顯縮小,空洞消失 ? ?圖 4 激素治療后復查胸部CT(2014-04-15縱隔窗) 縱隔淋巴結較前縮小
查體:神志清楚,體溫36.5 ℃,呼吸20次/min,血壓 120/80 mm Hg(1 mm Hg=0.133 kPa),未見杵狀指,口唇無發紺,淺表淋巴結無腫大,無頸靜脈怒張,雙肺呼吸音減低,未聞及干濕性啰音,心濁音界無擴大,心率80次/min,律齊,未聞及病理性雜音,雙下肢無浮腫。
入院后輔助檢查:血常規:白細胞 10.8×109/L,中性粒細胞百分比 83.3%,嗜酸性粒細胞百分比0.7%;C反應蛋白 55.91 mg/L;血沉 116 mm/1h;白蛋白25 g/L;血管緊張素轉化酶16.5 U/L;血腫瘤指標(CA125、NSE、CYFRA211、CEA、CA199、SCC)、尿常規、肝腎功能正常;血氣分析正常;肺功能提示輕度阻塞性通氣功能障礙,支氣管舒張試驗陰性;PET-CT:右肺上葉占位(長徑約5.8 cm,SUV max 8.8),考慮肺癌,縱隔淋巴結轉移可能(最大者長徑約2 cm,SUVmax 3.8)。
診治經過與結果:入院后根據胸部CT平掃+增強及PET-CT結果,擬診為“右上肺癌”,行纖維支氣管鏡檢查未見明顯異常,于右上肺尖段刷檢細菌、真菌、抗酸染色、細胞學陰性,行右上肺尖段TBLB示“肺泡及少量支氣管黏膜組織,局灶纖維組織增生伴鈣化”;2014 年2月21日行CT引導下右上肺腫塊穿刺術,病理示:肺泡腔內纖維組織增生,淋巴細胞、漿細胞浸潤,符合肺肉質變;因肺穿刺及TBLB病理均提示良性病變,與影像學表現不完全符合,故2014年2月26日再行CT引導下右上肺腫塊穿刺術,術中見右上肺病灶較前縮小,病理示:肺泡腔內成纖維細胞增生,間質慢性炎細胞浸潤,肺泡Ⅱ型上皮細胞增生,符合OP改變。診斷:COP,2014年3月3日開始潑尼松抗炎治療30 mg,qd,2014年4月15日復查胸部CT(圖 3、圖 4)提示右上肺病灶較前縮小,空洞消失,縱隔淋巴結較前縮小,潑尼松以每月減量5 mg治療。2014年8月底電話隨訪患者情況,自訴無發熱,無明顯咳嗽、咳痰,無胸悶、胸痛等不適,右上肺病灶已基本吸收,目前潑尼松5 mg,qd,繼續治療隨訪中。
文獻復習
COP是由Davison等[4]于1983年首先提出的一種臨床病理綜合征,1985年Epler等[5]將同樣的病變定義為“閉塞性細支氣管炎伴機化性肺炎(bronchiolitis obliterans organizing pneumonia,BOOP)”,2002年美國胸科協會/歐洲呼吸學會(ATS/ERS)發布的特發性間質性肺炎分類共識中[6],將其正式命名為COP,其發病率排在特發性間質性肺炎分類中的第3位,診斷遵循“臨床-影像-病理診斷”。
一 臨床特點
COP發病年齡可見于20~80歲,中位數55歲,與吸煙無關,男女發病概率相當[7]。一般亞急性或緩慢發病,偶有急性起病者表現為急性呼吸窘迫綜合征[8]。曲寶戈等[9]分析了115例國內COP臨床資料,主要臨床表現為不同程度的咳嗽和氣促,咳少量痰,偶痰中帶血絲,常伴有多汗、發熱、乏力,胸痛、盜汗不明顯;75%肺部體征可聞及濕啰音或爆裂音,多位于雙肺中下部,杵狀指罕見,抗感染無效。實驗室檢查多有血白細胞、中性粒細胞、血沉及C反應蛋白升高[10]。本例患者63歲,既往無吸煙史,有發熱、咳嗽、胸悶、乏力等不適,實驗室相關炎性指標升高,與文獻報道基本符合。
二 影像學特征
李惠萍等[11]總結了25例COP的影像學表現,提出“五多一少”特點,即:多形態、雙肺多發、多變、多復發、雙肺多受累及少見蜂窩肺。Johkoh等[12]在薄層CT對間質性肺病的診斷準確性的研究中,發現CT對COP的診斷準確性最高,為79%,表明COP的CT表現具有特征性的改變。COP的主要胸部CT征象包括:①伴有支氣管充氣征的實變影:Lynch等[13]指出:約90%的COP患者可表現為實變影,其中超過50%的實變分布于胸膜下或血管支氣管束周圍,下肺多發;約50%的斑片狀影具有明顯游走性[14]。②磨玻璃影:Polverosi等[15]總結約60%的COP患者有磨玻璃樣改變,隨機分布,多出現在實變病灶周圍;③結節影:包括粟粒結節(直徑≤0.5 cm)、小結節(直徑≤1 cm)和大結節(直徑>1 cm) 3種。文獻報道[6],約30%的COP患者出現小結節影沿支氣管血管束走形分布;約15%的COP患者可見多發大結節影及塊狀影,邊緣不規則,可出現胸膜牽拉征、毛刺征,部分結節內可見支氣管充氣征,極少為孤立性結節影改變;④各類線帶狀影:包括由Murphy等[16]提出的線帶狀陰影,表現為起于支氣管沿支氣管放射狀與胸膜相連的線帶狀影,或位于胸膜下與支氣管無關的線帶狀影和Ujita等[17]提出的小葉周圍型線狀影,表現為類似小葉間隔增厚的曲線形的線狀影。COP的少見CT征象包括:胸膜反應少見;極少數病例可類似于中央型肺癌表現的肺門腫塊,但一般無縱隔淋巴結增大[18]。此外,Greenberg-Wolff等[19]研究發現,COP患者可有縱隔淋巴結輕度腫大,大小一般1.0~1.5 cm,同時不伴有胸膜反應,故認為縱隔淋巴結輕度腫大對COP的診斷有一定價值。18F-FDG PET/CT檢查中,COP可出現糖代謝增高,其原因尚不明確。病灶炎癥細胞可以引起18F-FDG糖代謝增高[20],急性炎癥主要表現為中性粒細胞浸潤,而慢性炎癥則主要表現為淋巴細胞及單核細胞浸潤。研究顯示[21],PET-CT對肺部>1 cm的惡性腫瘤診斷敏感性為93.6%,特異性為80%,準確率為90%,但對一些慢性炎癥性病變如結核、肉芽腫、炎癥、曲霉病等可出現假陽性。慢性炎癥、肉芽腫性炎18F-FDG顯像表現為放射性濃聚。韓佩等[22]總結了11例COP患者的PET-CT表現,發現11例病灶18F-FDG呈不同程度增高,認為COP患者的18F-FDG PET/CT糖代謝增高水平反映了病灶的活動及嚴重性,但單從糖代謝增高水平對疾病的診斷價值有限。本例患者胸部CT以右上肺腫塊伴空洞形成為主要表現,有縱隔淋巴結腫大,與既往文獻所報道的影像學特征不完全符合,而PET-CT提示右上肺病灶攝取值明顯增高,與韓佩等[22]報道的文獻相符。
三 病理學
OP的確診依據依靠病理學,主要病理特點[23]包括:①遠端氣腔(包括細支氣管、肺泡管、肺泡腔)內的機化性炎癥。小氣道和肺泡管內過多的肉芽組織增殖。肺泡腔內肉芽組織呈芽生狀,以小氣道為中心向遠端延伸,可通過肺泡孔從一個肺泡擴展到鄰近的肺泡,形成典型的“蝴蝶影”。②病灶呈片狀分布,鏡下病變均勻一致。③肺部結構通常保持完整。④受累區域伴輕度間質慢性炎癥、Ⅱ型上皮細胞化生和肺泡腔內巨噬細胞(有些為泡沫細胞)增加。本例患者病理學描述與文獻符合。
四 鑒別診斷
本例患者表現為腫塊、空洞形成、縱隔淋巴結腫大,影像學方面臨床需要與以下疾病鑒別:
肺癌:有相似的上述影像征象,但有3點影像學特征可鑒別以單發腫塊表現的OP與肺癌[24]:①前者腫塊累及胸膜或沿支氣管血管束并見血管的收縮會聚。②前者腫塊形狀為平的、橢圓形、梯形或斜方形,并非圓形。③前者可存在衛星灶。
肺結核:本例患者病灶位于上肺,為結核好發部位,伴有空洞、縱隔淋巴結腫大,影像學與結核鑒別有一定難度,但右上肺病灶不伴鈣化,影像學無胸腔積液,結合痰抗酸陰性及結核中毒癥狀不典型,可基本不考慮,同時病理進一步排除。
肺膿腫:多有典型的高熱、咳嗽、咳膿臭痰表現,伴有血象明顯升高,抗感染治療有效,而COP臨床癥狀不典型,同時抗感染治療無效,臨床上易于鑒別。
此外,需進一步排除激素治療有效的其他肉芽腫性病變:①結節病:病理為非干酪樣壞死性類上皮肉芽腫,圍繞血管、淋巴管及支氣管黏膜下分布,而機化性肺炎肉芽腫病變局限在小氣道及肺泡管,病理表現不符,同時血管緊張素轉化酶正常,可予排除。②慢性嗜酸性粒細胞肺炎:可出現咳嗽、咳黏液痰及痰中帶血、呼吸困難,血中嗜酸性粒細胞比例>25%,胸部影像學可有腫塊伴空洞表現,病理以肺泡壁和肺泡腔內見大量嗜酸細胞、巨噬細胞、漿細胞和少量淋巴細胞浸潤。本患者病理以淋巴細胞、漿細胞浸潤為主,未見嗜酸細胞,同時血中嗜酸細胞比例<1%,可鑒別。③Churg-Struss綜合征:以哮喘、外周血嗜酸性粒細胞增多(可達80%)和系統性壞死性血管炎為三聯征表現,部分患者病理學伴有肉芽腫病變,表現為壞死性嗜酸性粒細胞為中心的壞死性肉芽腫,而COP以淋巴細胞、巨噬細胞為主。④韋格納肉芽腫:病理以肺實質壞死、血管炎癥和肉芽腫形成為特征,其他組織學改變會合并OP表現,但本例患者一般情況良好,無血尿及腎功能損害,該病以單發腫塊伴空洞為單一表現少見,更多的為雙肺多發結節伴空洞,同時病理學未提示肺實質壞死及血管炎表現,故OP表現無法以韋格納肉芽腫繼發改變解釋。⑤肺壞死性結節病樣肉芽腫:以非干酪樣壞死性肉芽腫形成和壞死性血管炎為病理表現。肉芽腫由上皮細胞、淋巴細胞、多核巨細胞等構成,融合聚集,直接侵入小血管肌層和內腔,導致管腔堵塞或血管腔閉塞,形成以血管為中心的缺血壞死性改變,而COP病理無血管受累表現。
五 治療
雖有報道部分COP可自愈,但多數患者需藥物來緩解和控制癥狀。糖皮質激素仍是治療COP最有效的藥物,通過抑制細胞因子釋放,減輕炎性細胞或細胞因子浸潤,從而減少機化性、炎性滲出物以及肉芽組織的形成,能迅速緩解癥狀,清除肺部病灶。但糖皮質激素的療程和劑量目前并不統一。推薦潑尼松起始劑量0.75~1.5 mg·kg-1·d-1,維持4~6周后逐漸減量至20~40 mg/d,治療3個月;后期改為5~10 mg/d,隔日1次維持治療,療程1年,停藥過早可能復發。當糖皮質激素治療后癥狀無明顯改善,甚至長時間治療后病情仍無改善時,可聯合使用環磷酰胺和硫唑嘌呤等細胞毒藥物[1],但難以評估其療效。亦有文獻報道應用大環內酯類抗生素治療COP有效[25]。本例患者對激素治療有效。
六 預后
COP的預后遠較其他間質性肺疾病為佳[6],約10%的患者可自行緩解,經治療完全緩解者占60%~75%。部分患者雖經糖皮質激素積極治療但病情仍持續進展,死亡的主要原因為呼吸衰竭。早期診斷、早期治療是影響預后的重要因素。
討論
本例COP患者有發熱、咳嗽、胸悶癥狀,胸部CT表現為右上肺腫塊伴空洞形成,縱隔淋巴結腫大,PET-CT提示右上肺病灶及縱隔淋巴結18F-FDG糖代謝增高,結合臨床表現及影像學,均高度懷疑肺癌,最后經病理診斷為COP,進一步證實了COP的診斷是臨床-影像-病理的綜合分析過程。COP目前仍屬于臨床少見病,通過本病例的診治,我們得到如下經驗:①COP多緩慢起病,臨床癥狀輕微且缺乏特異性。②COP影像學表現的五多一少征象,我們臨床上有一定的認識,而對于胸部影像學表現為腫塊伴空洞影時,除考慮腫瘤、結核及肉芽腫等病變外,亦需要考慮COP的可能,避免漏診、誤診。③影像學表現為肺炎改變時,如經過積極有效抗感染治療后影像學無吸收,同時排除結核、真菌和非典型病原體等感染后,要警惕COP可能。④對于影像學同時出現腫塊影、空洞性改變及縱隔淋巴結腫大,高度提示肺癌的同時,監測血腫瘤指標有一定指導意義,但肺組織活檢是明確診斷的唯一金標準。⑤COP是一種良性疾病,糖皮質激素治療效果好,早期停藥易復發,同時影像學變化需要較長時間,故需定期隨訪。
機化性肺炎(organizing pneumonia,OP)指肺泡管和肺泡腔中存在肉芽組織栓的一組疾病[1],隱源性機化性肺炎(cryptogenic organizing pneumonia,COP)指無明確的致病原因(如感染)或伴隨其他臨床疾病(如結締組織疾病)而出現的OP,有其獨特的臨床、病理、影像學特點。臨床上屬于少見病,有報道[2]OP的平均發病率估計為(6~7)/10萬,其中超過半數為COP,但COP確切的發病率目前尚不清楚[3]。現總結我院收治的1例初步診斷為肺癌,后經病理確診為COP患者的診斷、治療及轉歸,并結合有關文獻進行討論。
臨床資料
患者男性,63歲,否認吸煙史,因“咳嗽、咳痰1個月,發熱、畏寒1周”于2014年2月19日收入我院呼吸科。2014年1月中旬無明顯誘因出現咳嗽、咳痰,痰為白色泡沫痰,偶有陳舊性血性分泌物及黃膿痰,無咯鮮紅色痰,痰液黏稠不易咳出,咳嗽時伴右胸針刺樣疼痛,活動后略胸悶,無氣促。1周前出現發熱,體溫最高38.6 ℃,伴畏寒、全身酸痛不適,感乏力、納差、盜汗,無寒戰,無咽痛、流涕,無頭暈、頭痛。2014年2月14日就診當地醫院,血常規示白細胞、中性粒細胞百分比升高,胸部CT平掃+增強+三維重建示“右肺尖占位(大小約6.2 cm×6 cm)伴厚壁偏心空洞形成,縱隔淋巴結腫大(最大約1.7 cm)(圖 1、圖 2),予頭孢曲松鈉聯合左氧氟沙星抗感染5 d,體溫波動于37.5~38 ℃,咳嗽、咳痰略有好轉,為進一步診治,來我院就診,門診以“右上肺占位”收入院。患者自患病以來,精神狀態尚可,飲食欠佳,大、小便正常,睡眠無異常,體質量減輕約5 kg。
 圖1
胸部CT(2014-02-14肺窗) 右肺尖腫塊伴厚壁偏心空洞形成 ? ?圖 2 胸部CT(2014-02-14縱隔窗) 縱隔淋巴結腫大 ? ?圖 3 激素治療后復查胸部CT(2014-04-15肺窗) 右肺尖腫塊較前明顯縮小,空洞消失 ? ?圖 4 激素治療后復查胸部CT(2014-04-15縱隔窗) 縱隔淋巴結較前縮小
圖1
胸部CT(2014-02-14肺窗) 右肺尖腫塊伴厚壁偏心空洞形成 ? ?圖 2 胸部CT(2014-02-14縱隔窗) 縱隔淋巴結腫大 ? ?圖 3 激素治療后復查胸部CT(2014-04-15肺窗) 右肺尖腫塊較前明顯縮小,空洞消失 ? ?圖 4 激素治療后復查胸部CT(2014-04-15縱隔窗) 縱隔淋巴結較前縮小
查體:神志清楚,體溫36.5 ℃,呼吸20次/min,血壓 120/80 mm Hg(1 mm Hg=0.133 kPa),未見杵狀指,口唇無發紺,淺表淋巴結無腫大,無頸靜脈怒張,雙肺呼吸音減低,未聞及干濕性啰音,心濁音界無擴大,心率80次/min,律齊,未聞及病理性雜音,雙下肢無浮腫。
入院后輔助檢查:血常規:白細胞 10.8×109/L,中性粒細胞百分比 83.3%,嗜酸性粒細胞百分比0.7%;C反應蛋白 55.91 mg/L;血沉 116 mm/1h;白蛋白25 g/L;血管緊張素轉化酶16.5 U/L;血腫瘤指標(CA125、NSE、CYFRA211、CEA、CA199、SCC)、尿常規、肝腎功能正常;血氣分析正常;肺功能提示輕度阻塞性通氣功能障礙,支氣管舒張試驗陰性;PET-CT:右肺上葉占位(長徑約5.8 cm,SUV max 8.8),考慮肺癌,縱隔淋巴結轉移可能(最大者長徑約2 cm,SUVmax 3.8)。
診治經過與結果:入院后根據胸部CT平掃+增強及PET-CT結果,擬診為“右上肺癌”,行纖維支氣管鏡檢查未見明顯異常,于右上肺尖段刷檢細菌、真菌、抗酸染色、細胞學陰性,行右上肺尖段TBLB示“肺泡及少量支氣管黏膜組織,局灶纖維組織增生伴鈣化”;2014 年2月21日行CT引導下右上肺腫塊穿刺術,病理示:肺泡腔內纖維組織增生,淋巴細胞、漿細胞浸潤,符合肺肉質變;因肺穿刺及TBLB病理均提示良性病變,與影像學表現不完全符合,故2014年2月26日再行CT引導下右上肺腫塊穿刺術,術中見右上肺病灶較前縮小,病理示:肺泡腔內成纖維細胞增生,間質慢性炎細胞浸潤,肺泡Ⅱ型上皮細胞增生,符合OP改變。診斷:COP,2014年3月3日開始潑尼松抗炎治療30 mg,qd,2014年4月15日復查胸部CT(圖 3、圖 4)提示右上肺病灶較前縮小,空洞消失,縱隔淋巴結較前縮小,潑尼松以每月減量5 mg治療。2014年8月底電話隨訪患者情況,自訴無發熱,無明顯咳嗽、咳痰,無胸悶、胸痛等不適,右上肺病灶已基本吸收,目前潑尼松5 mg,qd,繼續治療隨訪中。
文獻復習
COP是由Davison等[4]于1983年首先提出的一種臨床病理綜合征,1985年Epler等[5]將同樣的病變定義為“閉塞性細支氣管炎伴機化性肺炎(bronchiolitis obliterans organizing pneumonia,BOOP)”,2002年美國胸科協會/歐洲呼吸學會(ATS/ERS)發布的特發性間質性肺炎分類共識中[6],將其正式命名為COP,其發病率排在特發性間質性肺炎分類中的第3位,診斷遵循“臨床-影像-病理診斷”。
一 臨床特點
COP發病年齡可見于20~80歲,中位數55歲,與吸煙無關,男女發病概率相當[7]。一般亞急性或緩慢發病,偶有急性起病者表現為急性呼吸窘迫綜合征[8]。曲寶戈等[9]分析了115例國內COP臨床資料,主要臨床表現為不同程度的咳嗽和氣促,咳少量痰,偶痰中帶血絲,常伴有多汗、發熱、乏力,胸痛、盜汗不明顯;75%肺部體征可聞及濕啰音或爆裂音,多位于雙肺中下部,杵狀指罕見,抗感染無效。實驗室檢查多有血白細胞、中性粒細胞、血沉及C反應蛋白升高[10]。本例患者63歲,既往無吸煙史,有發熱、咳嗽、胸悶、乏力等不適,實驗室相關炎性指標升高,與文獻報道基本符合。
二 影像學特征
李惠萍等[11]總結了25例COP的影像學表現,提出“五多一少”特點,即:多形態、雙肺多發、多變、多復發、雙肺多受累及少見蜂窩肺。Johkoh等[12]在薄層CT對間質性肺病的診斷準確性的研究中,發現CT對COP的診斷準確性最高,為79%,表明COP的CT表現具有特征性的改變。COP的主要胸部CT征象包括:①伴有支氣管充氣征的實變影:Lynch等[13]指出:約90%的COP患者可表現為實變影,其中超過50%的實變分布于胸膜下或血管支氣管束周圍,下肺多發;約50%的斑片狀影具有明顯游走性[14]。②磨玻璃影:Polverosi等[15]總結約60%的COP患者有磨玻璃樣改變,隨機分布,多出現在實變病灶周圍;③結節影:包括粟粒結節(直徑≤0.5 cm)、小結節(直徑≤1 cm)和大結節(直徑>1 cm) 3種。文獻報道[6],約30%的COP患者出現小結節影沿支氣管血管束走形分布;約15%的COP患者可見多發大結節影及塊狀影,邊緣不規則,可出現胸膜牽拉征、毛刺征,部分結節內可見支氣管充氣征,極少為孤立性結節影改變;④各類線帶狀影:包括由Murphy等[16]提出的線帶狀陰影,表現為起于支氣管沿支氣管放射狀與胸膜相連的線帶狀影,或位于胸膜下與支氣管無關的線帶狀影和Ujita等[17]提出的小葉周圍型線狀影,表現為類似小葉間隔增厚的曲線形的線狀影。COP的少見CT征象包括:胸膜反應少見;極少數病例可類似于中央型肺癌表現的肺門腫塊,但一般無縱隔淋巴結增大[18]。此外,Greenberg-Wolff等[19]研究發現,COP患者可有縱隔淋巴結輕度腫大,大小一般1.0~1.5 cm,同時不伴有胸膜反應,故認為縱隔淋巴結輕度腫大對COP的診斷有一定價值。18F-FDG PET/CT檢查中,COP可出現糖代謝增高,其原因尚不明確。病灶炎癥細胞可以引起18F-FDG糖代謝增高[20],急性炎癥主要表現為中性粒細胞浸潤,而慢性炎癥則主要表現為淋巴細胞及單核細胞浸潤。研究顯示[21],PET-CT對肺部>1 cm的惡性腫瘤診斷敏感性為93.6%,特異性為80%,準確率為90%,但對一些慢性炎癥性病變如結核、肉芽腫、炎癥、曲霉病等可出現假陽性。慢性炎癥、肉芽腫性炎18F-FDG顯像表現為放射性濃聚。韓佩等[22]總結了11例COP患者的PET-CT表現,發現11例病灶18F-FDG呈不同程度增高,認為COP患者的18F-FDG PET/CT糖代謝增高水平反映了病灶的活動及嚴重性,但單從糖代謝增高水平對疾病的診斷價值有限。本例患者胸部CT以右上肺腫塊伴空洞形成為主要表現,有縱隔淋巴結腫大,與既往文獻所報道的影像學特征不完全符合,而PET-CT提示右上肺病灶攝取值明顯增高,與韓佩等[22]報道的文獻相符。
三 病理學
OP的確診依據依靠病理學,主要病理特點[23]包括:①遠端氣腔(包括細支氣管、肺泡管、肺泡腔)內的機化性炎癥。小氣道和肺泡管內過多的肉芽組織增殖。肺泡腔內肉芽組織呈芽生狀,以小氣道為中心向遠端延伸,可通過肺泡孔從一個肺泡擴展到鄰近的肺泡,形成典型的“蝴蝶影”。②病灶呈片狀分布,鏡下病變均勻一致。③肺部結構通常保持完整。④受累區域伴輕度間質慢性炎癥、Ⅱ型上皮細胞化生和肺泡腔內巨噬細胞(有些為泡沫細胞)增加。本例患者病理學描述與文獻符合。
四 鑒別診斷
本例患者表現為腫塊、空洞形成、縱隔淋巴結腫大,影像學方面臨床需要與以下疾病鑒別:
肺癌:有相似的上述影像征象,但有3點影像學特征可鑒別以單發腫塊表現的OP與肺癌[24]:①前者腫塊累及胸膜或沿支氣管血管束并見血管的收縮會聚。②前者腫塊形狀為平的、橢圓形、梯形或斜方形,并非圓形。③前者可存在衛星灶。
肺結核:本例患者病灶位于上肺,為結核好發部位,伴有空洞、縱隔淋巴結腫大,影像學與結核鑒別有一定難度,但右上肺病灶不伴鈣化,影像學無胸腔積液,結合痰抗酸陰性及結核中毒癥狀不典型,可基本不考慮,同時病理進一步排除。
肺膿腫:多有典型的高熱、咳嗽、咳膿臭痰表現,伴有血象明顯升高,抗感染治療有效,而COP臨床癥狀不典型,同時抗感染治療無效,臨床上易于鑒別。
此外,需進一步排除激素治療有效的其他肉芽腫性病變:①結節病:病理為非干酪樣壞死性類上皮肉芽腫,圍繞血管、淋巴管及支氣管黏膜下分布,而機化性肺炎肉芽腫病變局限在小氣道及肺泡管,病理表現不符,同時血管緊張素轉化酶正常,可予排除。②慢性嗜酸性粒細胞肺炎:可出現咳嗽、咳黏液痰及痰中帶血、呼吸困難,血中嗜酸性粒細胞比例>25%,胸部影像學可有腫塊伴空洞表現,病理以肺泡壁和肺泡腔內見大量嗜酸細胞、巨噬細胞、漿細胞和少量淋巴細胞浸潤。本患者病理以淋巴細胞、漿細胞浸潤為主,未見嗜酸細胞,同時血中嗜酸細胞比例<1%,可鑒別。③Churg-Struss綜合征:以哮喘、外周血嗜酸性粒細胞增多(可達80%)和系統性壞死性血管炎為三聯征表現,部分患者病理學伴有肉芽腫病變,表現為壞死性嗜酸性粒細胞為中心的壞死性肉芽腫,而COP以淋巴細胞、巨噬細胞為主。④韋格納肉芽腫:病理以肺實質壞死、血管炎癥和肉芽腫形成為特征,其他組織學改變會合并OP表現,但本例患者一般情況良好,無血尿及腎功能損害,該病以單發腫塊伴空洞為單一表現少見,更多的為雙肺多發結節伴空洞,同時病理學未提示肺實質壞死及血管炎表現,故OP表現無法以韋格納肉芽腫繼發改變解釋。⑤肺壞死性結節病樣肉芽腫:以非干酪樣壞死性肉芽腫形成和壞死性血管炎為病理表現。肉芽腫由上皮細胞、淋巴細胞、多核巨細胞等構成,融合聚集,直接侵入小血管肌層和內腔,導致管腔堵塞或血管腔閉塞,形成以血管為中心的缺血壞死性改變,而COP病理無血管受累表現。
五 治療
雖有報道部分COP可自愈,但多數患者需藥物來緩解和控制癥狀。糖皮質激素仍是治療COP最有效的藥物,通過抑制細胞因子釋放,減輕炎性細胞或細胞因子浸潤,從而減少機化性、炎性滲出物以及肉芽組織的形成,能迅速緩解癥狀,清除肺部病灶。但糖皮質激素的療程和劑量目前并不統一。推薦潑尼松起始劑量0.75~1.5 mg·kg-1·d-1,維持4~6周后逐漸減量至20~40 mg/d,治療3個月;后期改為5~10 mg/d,隔日1次維持治療,療程1年,停藥過早可能復發。當糖皮質激素治療后癥狀無明顯改善,甚至長時間治療后病情仍無改善時,可聯合使用環磷酰胺和硫唑嘌呤等細胞毒藥物[1],但難以評估其療效。亦有文獻報道應用大環內酯類抗生素治療COP有效[25]。本例患者對激素治療有效。
六 預后
COP的預后遠較其他間質性肺疾病為佳[6],約10%的患者可自行緩解,經治療完全緩解者占60%~75%。部分患者雖經糖皮質激素積極治療但病情仍持續進展,死亡的主要原因為呼吸衰竭。早期診斷、早期治療是影響預后的重要因素。
討論
本例COP患者有發熱、咳嗽、胸悶癥狀,胸部CT表現為右上肺腫塊伴空洞形成,縱隔淋巴結腫大,PET-CT提示右上肺病灶及縱隔淋巴結18F-FDG糖代謝增高,結合臨床表現及影像學,均高度懷疑肺癌,最后經病理診斷為COP,進一步證實了COP的診斷是臨床-影像-病理的綜合分析過程。COP目前仍屬于臨床少見病,通過本病例的診治,我們得到如下經驗:①COP多緩慢起病,臨床癥狀輕微且缺乏特異性。②COP影像學表現的五多一少征象,我們臨床上有一定的認識,而對于胸部影像學表現為腫塊伴空洞影時,除考慮腫瘤、結核及肉芽腫等病變外,亦需要考慮COP的可能,避免漏診、誤診。③影像學表現為肺炎改變時,如經過積極有效抗感染治療后影像學無吸收,同時排除結核、真菌和非典型病原體等感染后,要警惕COP可能。④對于影像學同時出現腫塊影、空洞性改變及縱隔淋巴結腫大,高度提示肺癌的同時,監測血腫瘤指標有一定指導意義,但肺組織活檢是明確診斷的唯一金標準。⑤COP是一種良性疾病,糖皮質激素治療效果好,早期停藥易復發,同時影像學變化需要較長時間,故需定期隨訪。