肝中葉腫瘤因其解剖位置特殊、手術難度高,過去常采用擴大半肝切除術進行治療,但肝實質切除較多,對于肝硬化、肝功能較差的患者術后肝衰竭發生率和病死率相應升高,因此有研究者提出采用肝中葉切除術來治療肝中葉腫瘤,但由于該手術技術要求高、風險較大,因此開展之后的數十年并未常規開展。后來隨著腹腔鏡技術在肝臟外科領域的迅猛發展及其具有的創傷小、術后恢復快、手術療效與開放手術后的療效相當的優點,近年來國內外關于腹腔鏡肝中葉切除術的研究報道逐年增多,并且隨著腹腔鏡肝中葉切除術標準化術式的完善,將全面推動腹腔鏡肝中葉切除術的發展,這可能成為未來肝中葉腫瘤外科治療的主流趨勢。
引用本文: 馮清波, 李嘉鑫, 曾勇, 吳泓. 腹腔鏡肝中葉切除術的現狀與未來展望. 中國普外基礎與臨床雜志, 2022, 29(4): 421-425. doi: 10.7507/1007-9424.202112023 復制
肝中葉為右前葉和左內葉的總稱,位于肝臟中葉,臟面為第一肝門所在部位,膈頂部為第二肝門,背面緊貼下腔靜脈。根據Couinaud分段包含Ⅳ、Ⅴ、Ⅷ段,將位于此處的腫瘤稱為肝中葉腫瘤。因肝中葉腫瘤解剖位置特殊、手術難度高,過去常采用擴大右半肝或擴大左半肝切除術進行治療,需要切除60%~85%的肝實質[1];并且按照既往手術方式,通常實施肝三葉切除術,如此肝實質切除較多,對于肝硬化、肝功能較差的患者術后肝衰竭發生率和病死率相應升高。1965年吳孟超等[2]率先提出了肝中葉切除術(central hepatectomy,CH)治療肝中葉腫瘤,此術式僅切除左內葉和右前葉。CH與擴大半肝切除術相比,其可以保留更多的肝實質,降低肝衰竭發生率[3-5]。但由于肝中葉鄰近第一、第二肝門,手術技術要求高、風險較大,因此最開始僅僅是一些個案或小樣本報道,并未得以常規開展。后來隨著肝臟外科技術的發展,越來越多的肝臟外科中心開始采用CH治療肝中葉腫瘤[6-10];并且近年來由于腔鏡手術具有創傷小、術后恢復快、手術療效與開放手術療效相當的優點,其已被開始廣泛應用于各外科領域中[11-15],其在肝臟外科領域也迅猛發展,腹腔鏡肝切除術已從初期僅應用于肝臟良性疾病拓展到肝臟惡性腫瘤的治療。隨著技術的改進、經驗的積累、技巧的嫻熟,越來越多復雜疑難的腹腔鏡肝臟手術得以開展,從開始僅做肝臟邊緣及表淺病灶的局部切除過渡到肝段、半肝切除甚至多個肝段的聯合切除。因肝中葉切除技術難度大、手術風險高,曾一度作為腹腔鏡肝切除術的禁忌證之一,因此腹腔鏡CH(laparoscopic CH,LCH)鮮有報道[4, 16]。近年來,隨著腹腔鏡肝切除術的發展,國內外關于LCH的研究報道逐年增多,LCH或將有取代開放肝中葉切除術成為主流術式的趨勢。筆者現結合國內外文獻對LCH的發展、現狀和研究進展進行歸納總結并作一展望。
1 LCH的發展歷程及現狀
雖然1991年就開始了第1例腹腔鏡肝切除術[17],但因為肝中葉解剖位置的特殊性,LCH曾被視為腹腔鏡手術的禁忌證。2008年法國學者Gumbs等[18]對1例結腸癌肝轉移患者成功實施了首例完全LCH,標志著肝臟外科醫師開始對LCH進行嘗試。2009年Yoon等[19]首次報道了LCH成功治療肝細胞癌的案例;之后國內外陸續有LCH的研究報道[20-27]。筆者團隊也于2018 年報道了由吳泓教授帶領團隊[21]完成的41例LCH與307例開放CH的傾向性評分研究,其結果顯示,LCH在縮短住院時間、降低術后并發癥發生率方面具有明顯優勢,再次印證了LCH的安全性與可行性。截止到目前為止,對于LCH的報道仍多以個案報道、小樣本回顧性研究為主,缺乏大樣本的研究和相關的對照研究。檢索近年來國內外的相關文獻后發現,關于LCH的研究報道主要集中在國內,國外多是個案報道和案例回顧,本次共檢索到國內外共17篇文獻[10, 18, 20-34]共128例LCH(表1),涉及到的腫瘤主要有肝細胞癌、膽管細胞癌、混合細胞癌、乳腺癌肝轉移、結直腸癌肝轉移、膽管囊腺瘤、海綿狀血管瘤、肝臟局灶性結節增生等。
隨著達芬奇機器人手術系統的發展,機器人手術系統也開始逐漸應用于肝臟外科,目前已有機器人輔助下的CH治療肝臟腫瘤的報道。2020年法國Camerlo等[35]首次應用機器人手術系統開展CH治療1例肝臟孤立性纖維瘤患者;次年Camerlo等[36]成功完成世界第1例機器人CH治療1例腫瘤位于Ⅳ、Ⅴ、Ⅷ段的肝癌患者并以視頻形式展示機器人輔助下CH的要點和可行性。2021年美國Sucandy等[37]對15例膽囊癌患者進行機器人CH治療,15例患者中僅有2例患者術后出現并發癥(1例膽汁漏,1例呼吸衰竭),無30 d內死亡病例。
2 LCH的適應證選擇
對于LCH的適應證,過去鄭樹國[4]主張的適應證:① 全身情況及重要器官功能良好,能耐受肝切除手術;② ≤10 cm的孤立病灶;③ 無肝門侵犯,未累及下腔靜脈,門靜脈、肝靜脈、下腔靜脈及膽管無癌栓,無肝內及遠處轉移,腫瘤未浸潤膈肌或周圍組織;④ 肝功能Child-Pugh分級A級或B級,無嚴重肝硬變、門靜脈高壓癥及活動性肝炎,肝膽管結石患者無嚴重萎縮-增生復合征,無肝門部膽管狹窄;⑤ 吲哚菁綠15 min滯留率<15%,剩余肝臟體積/標準肝臟體積之比>40%;⑥ 術中探查無血性腹水,腫瘤無破裂出血;⑦ 上腹部手術史不視為絕對禁忌證。隨著腔鏡肝膽外科技術的發展,2018年李敬東等[3]提出,>10 cm的病灶雖然會增加LCH的手術難度,但還是有一定的機會獲得R0切除,可以行LCH。既往對于侵犯門靜脈右前支的肝臟惡性腫瘤被認為是LCH手術的絕對禁忌證之一,然而隨著外科技術的提高,對于侵犯血管的肝中葉腫瘤實施R0切除也成為了可能。筆者團隊認為,對于初期開展LCH的醫療中心仍建議優先選擇無大血管侵犯、腫瘤直徑較小、良性腫瘤或惡性程度較低的病例,而對于開展LCH較多的大型臨床肝臟外科中心團隊可以對侵犯重要血管的肝中葉腫瘤實施LCH。總之,LCH適用于腫瘤位于肝臟中葉的各類良惡性腫瘤如肝血管瘤、肝腺瘤、肝細胞癌、結直腸癌肝轉移、膽囊癌(Ⅳ期)、肝門膽管癌(Bismuth Ⅳ型)等。
3 LCH的分型與改良分型
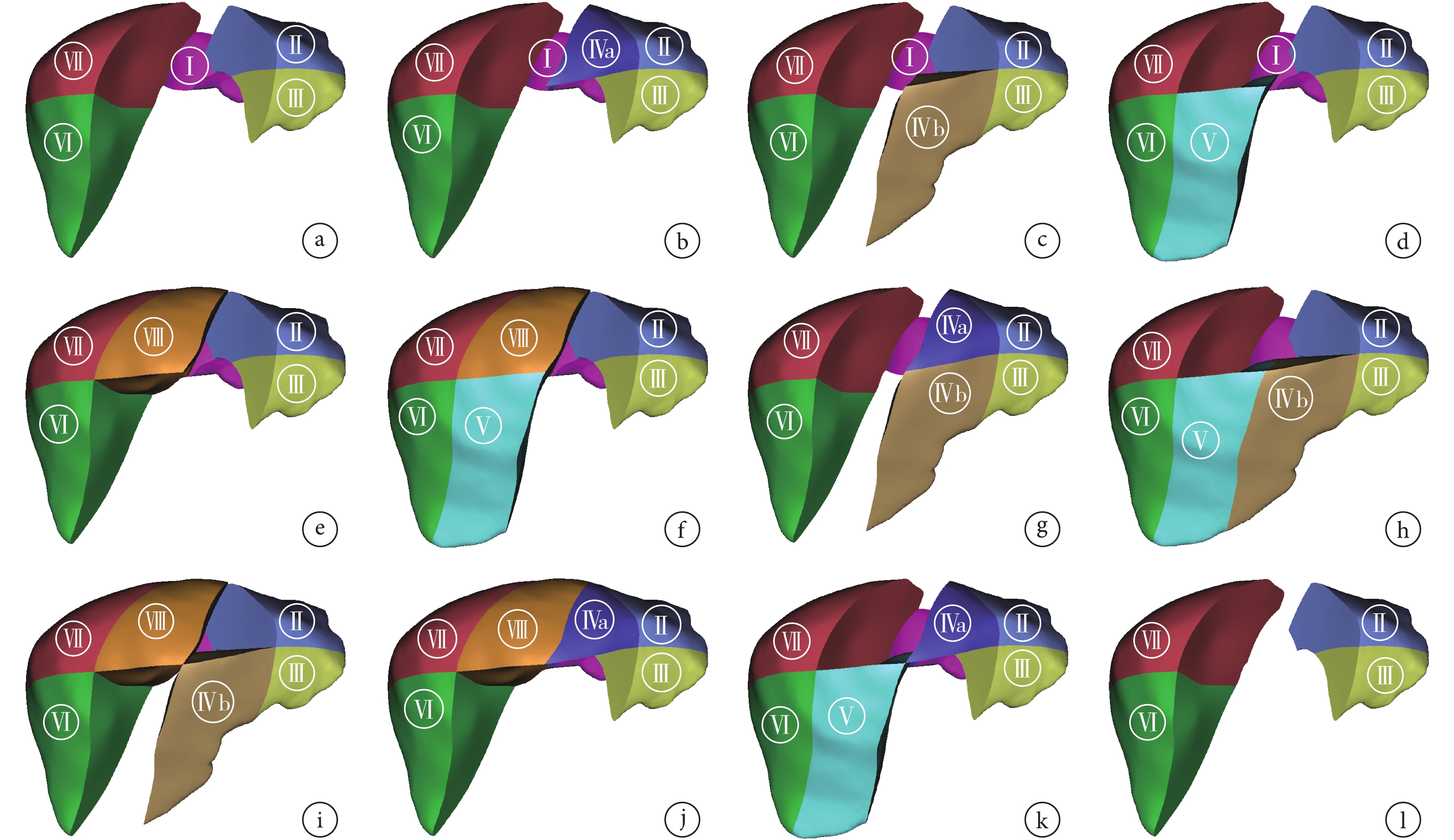
鄭樹國[4]將LCH分為兩大類,即解剖性LCH和非解剖性LCH。解剖性LCH要求完整地切除Ⅳ、Ⅴ、Ⅷ段肝臟,但其難度和風險較大;而非解剖性LCH是指肝臟中葉的局部切除或不規則切除,其難度和風險相對較小。隨著精準肝切除概念的引入,對于局部單一肝段的切除,筆者團隊不建議將其歸為中肝切除。結合實際臨床工作經驗,筆者團隊根據臨床工作中LCH切除肝臟的實際范圍將LCH分為3大類。① 標準LCH,即完整切除肝臟Couinaud分段的Ⅳ、Ⅴ、Ⅷ段(圖1a)。② 部分LCH,又分為a類和b類2種亞型。a類:切除范圍包括完整的肝右前葉或者肝左內葉全段加另一葉的部分肝段,即切除Ⅳb+Ⅴ+Ⅷ段,或Ⅳa+Ⅴ+Ⅷ段,或Ⅳ+Ⅷ段,或Ⅳ+Ⅴ段(圖1b~1e);b類切除范圍僅包括右肝前葉全段或肝左內葉全段,或右肝前葉部分肝段+肝左內葉部分肝段,即Ⅳ段,或Ⅴ+Ⅷ段,或Ⅳa+Ⅴ/Ⅷ段,或Ⅳb+Ⅴ/Ⅷ段(圖1f~1k)。③ 擴大LCH,即除完整切除肝臟中葉外且一并切除肝尾葉,切除范圍包括Ⅰ、Ⅳ、Ⅴ、Ⅷ段(圖1l)。
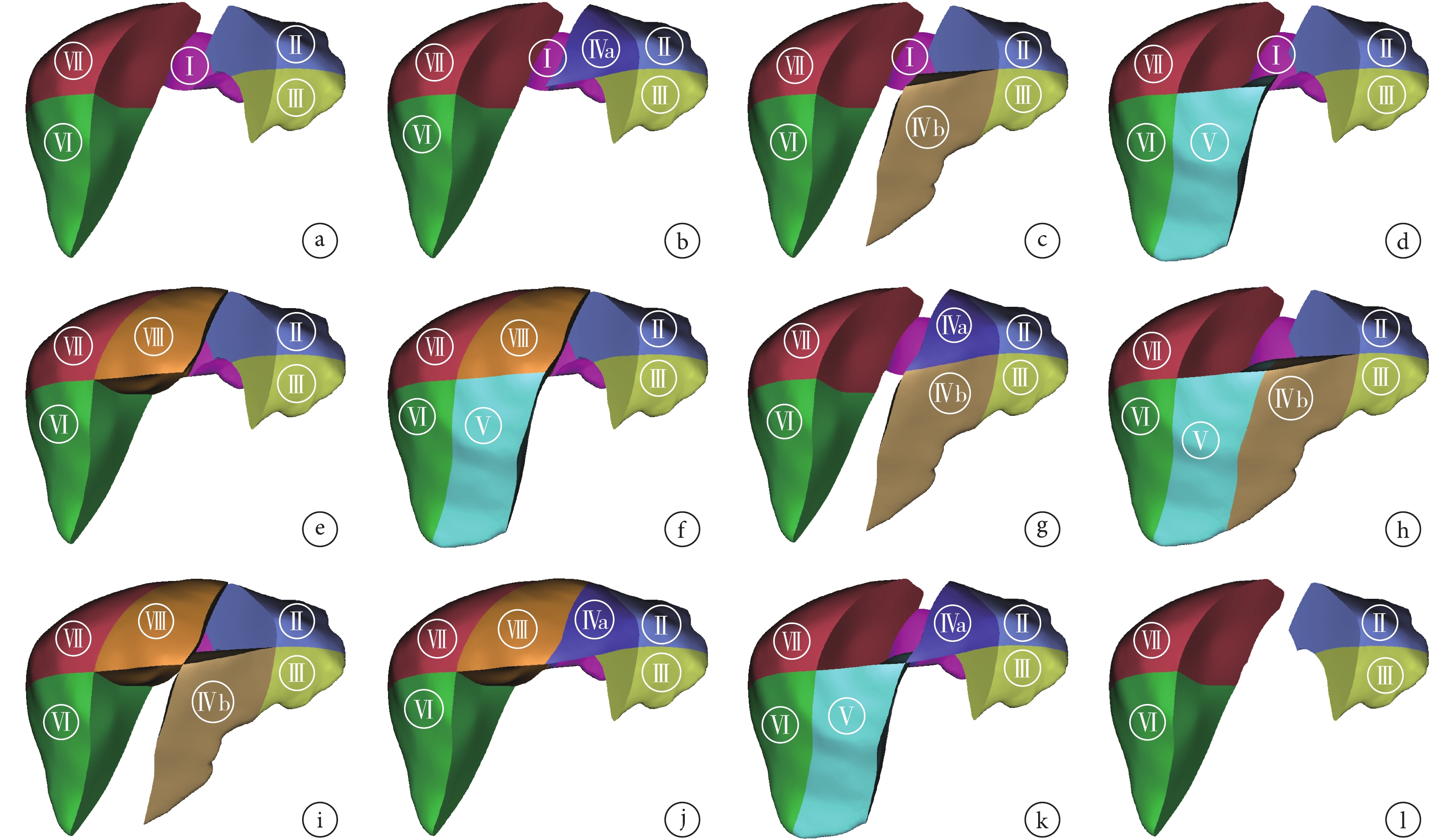 圖1
示LCH的分型
圖1
示LCH的分型
a:標準LCH(切除Ⅳ+Ⅴ+Ⅷ段);b~e:部分LCH a類(b:切除Ⅳb+Ⅴ+Ⅷ段;c:切除Ⅳa+Ⅴ+Ⅷ段;d:切除Ⅳ+Ⅷ段;e:切除Ⅳ+Ⅴ段);f~k:部分LCH b類(f:切除Ⅳ段;g:切除Ⅴ+Ⅷ段;h:切除Ⅳa+Ⅷ段;i:切除Ⅳa+Ⅴ段;j:切除Ⅳb+Ⅴ段;k:切除Ⅳb+Ⅷ段);l:擴大LCH(切除Ⅳ+Ⅴ+Ⅷ+Ⅰ段)
4 LCH的手術入路方式
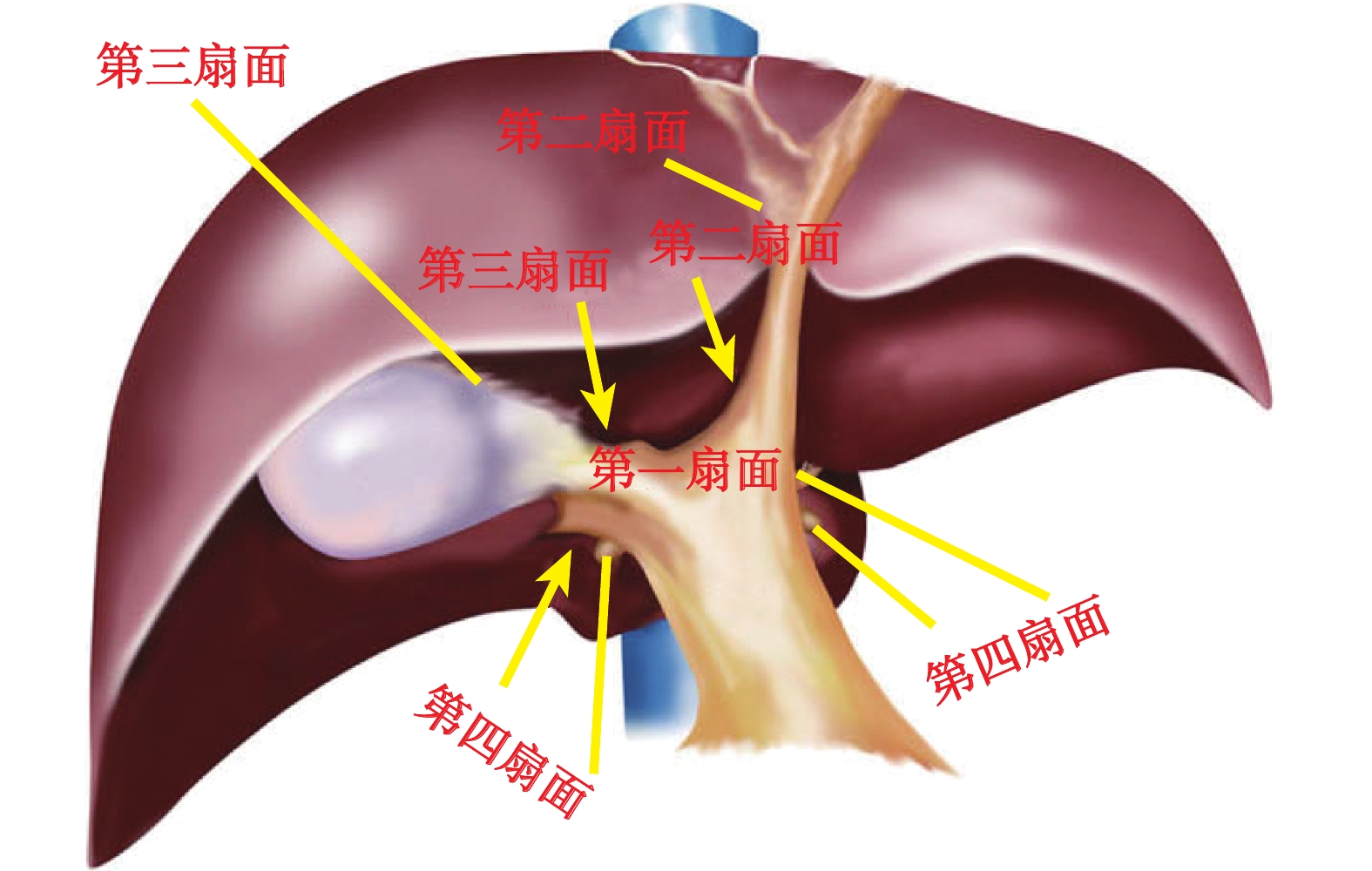
LCH不僅要求手術醫生具有豐富的開放切除經驗,同時也需要主刀醫生對腹腔鏡器械使用熟練。因為手術區域鄰近第一、二、三肝門,解剖結構復雜,且需保證腫瘤切除后剩余肝臟出入管道的完整性,避免術后出現肝衰竭、膽汁漏等并發癥。目前LCH的手術入路方式主要有以下幾種。① 經肝實質CH[30, 38-39]。此入路方式不需要解剖第一肝門,可使用彩色多普勒超聲定位肝右靜脈和肝左靜脈,直接在肝臟表面標記切線,左側切線大致為鐮狀韌帶右緣內側0.5 cm,右側切線為右肝切跡至肝右靜脈入口內側連線,此法雖然不夠精準,但優勢在于技術要求和手術難度較小。② 肝臟“四扇門”入路法[40](圖2)。筆者團隊曾提出通過肝臟“四扇門”入路應用于腹腔鏡肝切除手術中,手術安全、效果可靠,其中第一扇門為主門靜脈裂區域;第二扇門為臍裂區,即肝臟左外葉與左內葉間的臍裂靜脈走行處;第三扇門位于肝實質內,需切開部分肝實質后才能良好顯露,其具體解剖位置為右門靜脈裂與主門靜脈裂之間的縱門靜脈裂,縱門靜脈裂區域的前裂區域打開后即第三扇門;第四扇門即肝短靜脈匯入肝尾葉處。肝臟“四扇門”入路行LCH的主要步驟是:解剖主門靜脈裂區域打開肝臟第一扇門,控制肝臟左、右葉 Glisson蒂,為行LCH奠定基礎;然后打開第二扇門的前門顯現肝臟Ⅳ段入口,進而控制肝臟Ⅳa、Ⅳb段的Glisson蒂,缺血線出現后行Ⅳ段切除;打開第三扇門前門顯現肝臟Ⅴ、Ⅷ段入口后控制肝臟Ⅴ、Ⅷ段的Glisson蒂,缺血線出現后行Ⅴ、Ⅷ段切除術,如需行擴大LCH,則可打開第四扇門,顯露至肝尾葉入口,控制肝尾葉的Glisson蒂,行肝尾葉切除。以上手術入路方式,均有其優點和不足,但無論何種入路方式都無法適用于所有情況。因此,術者應根據患者情況結合腫瘤位置、是否侵犯重要血管等實際情況來選擇最佳的手術入路方式完成手術。
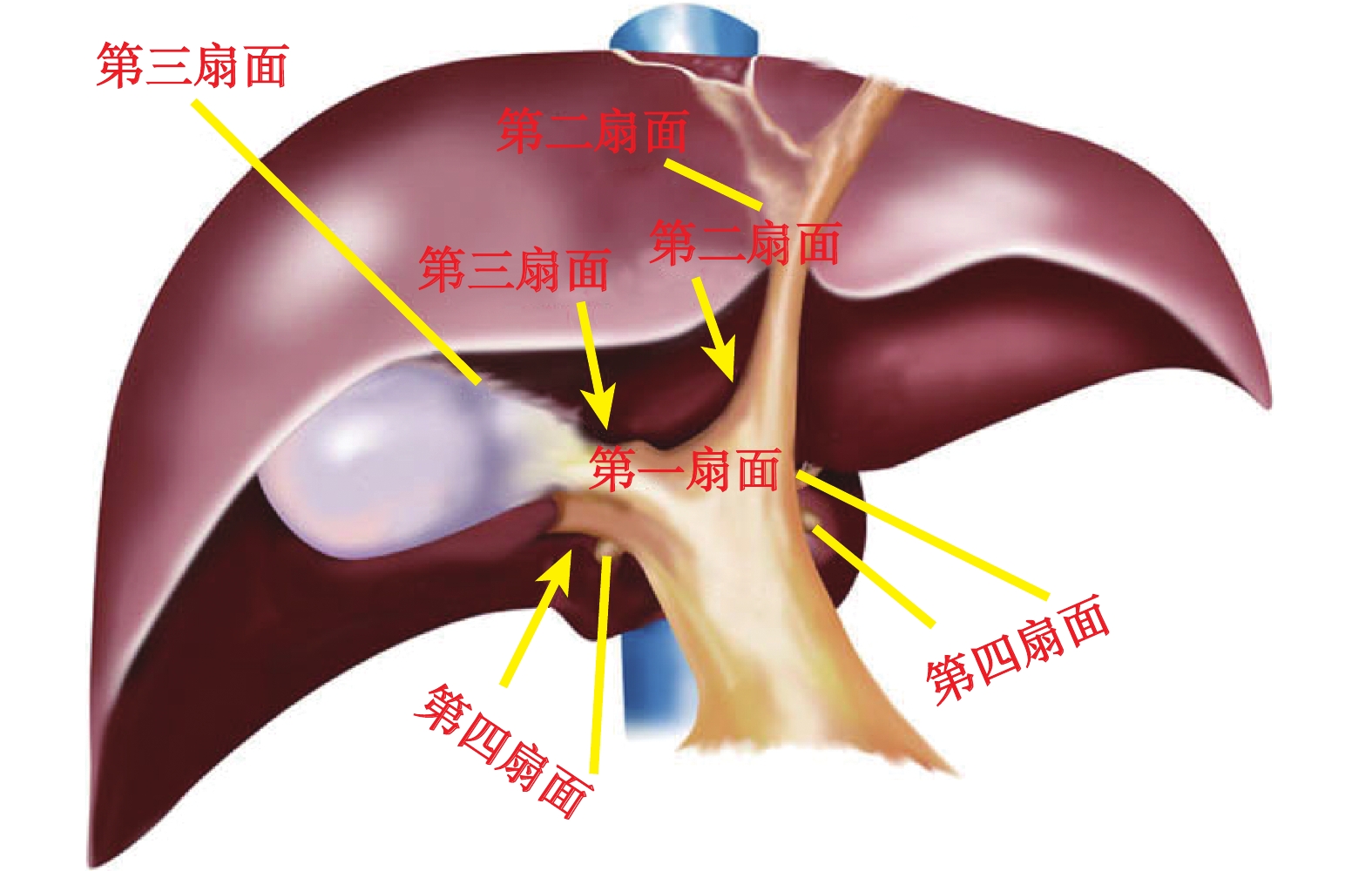 圖2
示肝臟“四扇門”劃分圖
圖2
示肝臟“四扇門”劃分圖
5 LCH的優缺點
近年來,隨著腹腔鏡技術快速發展,術中超聲、吲哚菁綠熒光染色等技術的應用,LCH治療肝中葉腫瘤得到進一步應用和發展,使得LCH技術更完善和成熟。現有證據[21, 24]表明,LCH治療肝中葉腫瘤的療效與開放手術相當且創傷小、出血少、術后恢復快,但手術時間相應延長。國內張忠林團隊[24]和成劍等[29]分別使用吲哚菁綠熒光導航開展LCH 11例和2例,研究顯示,LCH術中使用吲哚菁綠熒光實時導航技術及反染法可清晰顯露腫瘤邊界,不僅可避免損傷重要血管減少出血,還能避免切除肝實質過多,降低肝衰竭發生率,使LCH手術更加安全,但張忠林團隊[24]研究顯示吲哚菁綠熒光實時導航有一缺陷,即肝段顯影成功率不高,實施正、負顯影的7例患者中僅4例獲得成功。
6 小結與展望
盡管 LCH是肝臟外科最具挑戰性手術之一,經歷10余年的探索后目前已逐漸成熟。對于有豐富開腹肝臟手術經驗的外科醫師,經過嚴格的腹腔鏡手術技術操作訓練,LCH可以作為常規術式開展。基于目前研究結果來看,LCH具有一定優勢,期待高質量的大樣本、多中心的隨機對照試驗和高質量的循證醫學證據能填補空缺。自1991年開展腹腔鏡手術以來,經過30年的快速發展,微創的觀念已經深入人心,我國微創外科水平已達到世界先進水平。隨著腹腔鏡技術的迅速發展和積極推廣,我國肝中葉腫瘤的外科治療現已步入精準化和個體化時代,合理推廣普及LCH,提高肝中葉腫瘤患者的生活質量是未來的發展方向。與傳統半肝切除和擴大半肝切除相比,雖然LCH技術要求較高,但可以保留更多的肝實質,能降低肝衰竭發生率,且療效與開腹手術相當。目前,LCH術式尚未標準化,盡管LCH的理論與技術已經趨于成熟,但手術流程還需進一步優化,增加手術安全性,縮短學習曲線。隨著外科器械和技術的不斷發展,在不久的將來,隨著LCH標準化術式的完善和大量臨床研究數據的發布和更多循證醫學證據的支持,LCH必將蓬勃發展。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,聲明彼此間無利益沖突。
作者貢獻聲明:馮清波檢索文獻、起草文章;吳泓和曾勇核實論文格式、文章結構、手稿重要論點;曾勇和李嘉鑫對文章知識性內容作批判性審閱并給予指導性意見。
肝中葉為右前葉和左內葉的總稱,位于肝臟中葉,臟面為第一肝門所在部位,膈頂部為第二肝門,背面緊貼下腔靜脈。根據Couinaud分段包含Ⅳ、Ⅴ、Ⅷ段,將位于此處的腫瘤稱為肝中葉腫瘤。因肝中葉腫瘤解剖位置特殊、手術難度高,過去常采用擴大右半肝或擴大左半肝切除術進行治療,需要切除60%~85%的肝實質[1];并且按照既往手術方式,通常實施肝三葉切除術,如此肝實質切除較多,對于肝硬化、肝功能較差的患者術后肝衰竭發生率和病死率相應升高。1965年吳孟超等[2]率先提出了肝中葉切除術(central hepatectomy,CH)治療肝中葉腫瘤,此術式僅切除左內葉和右前葉。CH與擴大半肝切除術相比,其可以保留更多的肝實質,降低肝衰竭發生率[3-5]。但由于肝中葉鄰近第一、第二肝門,手術技術要求高、風險較大,因此最開始僅僅是一些個案或小樣本報道,并未得以常規開展。后來隨著肝臟外科技術的發展,越來越多的肝臟外科中心開始采用CH治療肝中葉腫瘤[6-10];并且近年來由于腔鏡手術具有創傷小、術后恢復快、手術療效與開放手術療效相當的優點,其已被開始廣泛應用于各外科領域中[11-15],其在肝臟外科領域也迅猛發展,腹腔鏡肝切除術已從初期僅應用于肝臟良性疾病拓展到肝臟惡性腫瘤的治療。隨著技術的改進、經驗的積累、技巧的嫻熟,越來越多復雜疑難的腹腔鏡肝臟手術得以開展,從開始僅做肝臟邊緣及表淺病灶的局部切除過渡到肝段、半肝切除甚至多個肝段的聯合切除。因肝中葉切除技術難度大、手術風險高,曾一度作為腹腔鏡肝切除術的禁忌證之一,因此腹腔鏡CH(laparoscopic CH,LCH)鮮有報道[4, 16]。近年來,隨著腹腔鏡肝切除術的發展,國內外關于LCH的研究報道逐年增多,LCH或將有取代開放肝中葉切除術成為主流術式的趨勢。筆者現結合國內外文獻對LCH的發展、現狀和研究進展進行歸納總結并作一展望。
1 LCH的發展歷程及現狀
雖然1991年就開始了第1例腹腔鏡肝切除術[17],但因為肝中葉解剖位置的特殊性,LCH曾被視為腹腔鏡手術的禁忌證。2008年法國學者Gumbs等[18]對1例結腸癌肝轉移患者成功實施了首例完全LCH,標志著肝臟外科醫師開始對LCH進行嘗試。2009年Yoon等[19]首次報道了LCH成功治療肝細胞癌的案例;之后國內外陸續有LCH的研究報道[20-27]。筆者團隊也于2018 年報道了由吳泓教授帶領團隊[21]完成的41例LCH與307例開放CH的傾向性評分研究,其結果顯示,LCH在縮短住院時間、降低術后并發癥發生率方面具有明顯優勢,再次印證了LCH的安全性與可行性。截止到目前為止,對于LCH的報道仍多以個案報道、小樣本回顧性研究為主,缺乏大樣本的研究和相關的對照研究。檢索近年來國內外的相關文獻后發現,關于LCH的研究報道主要集中在國內,國外多是個案報道和案例回顧,本次共檢索到國內外共17篇文獻[10, 18, 20-34]共128例LCH(表1),涉及到的腫瘤主要有肝細胞癌、膽管細胞癌、混合細胞癌、乳腺癌肝轉移、結直腸癌肝轉移、膽管囊腺瘤、海綿狀血管瘤、肝臟局灶性結節增生等。
隨著達芬奇機器人手術系統的發展,機器人手術系統也開始逐漸應用于肝臟外科,目前已有機器人輔助下的CH治療肝臟腫瘤的報道。2020年法國Camerlo等[35]首次應用機器人手術系統開展CH治療1例肝臟孤立性纖維瘤患者;次年Camerlo等[36]成功完成世界第1例機器人CH治療1例腫瘤位于Ⅳ、Ⅴ、Ⅷ段的肝癌患者并以視頻形式展示機器人輔助下CH的要點和可行性。2021年美國Sucandy等[37]對15例膽囊癌患者進行機器人CH治療,15例患者中僅有2例患者術后出現并發癥(1例膽汁漏,1例呼吸衰竭),無30 d內死亡病例。
2 LCH的適應證選擇
對于LCH的適應證,過去鄭樹國[4]主張的適應證:① 全身情況及重要器官功能良好,能耐受肝切除手術;② ≤10 cm的孤立病灶;③ 無肝門侵犯,未累及下腔靜脈,門靜脈、肝靜脈、下腔靜脈及膽管無癌栓,無肝內及遠處轉移,腫瘤未浸潤膈肌或周圍組織;④ 肝功能Child-Pugh分級A級或B級,無嚴重肝硬變、門靜脈高壓癥及活動性肝炎,肝膽管結石患者無嚴重萎縮-增生復合征,無肝門部膽管狹窄;⑤ 吲哚菁綠15 min滯留率<15%,剩余肝臟體積/標準肝臟體積之比>40%;⑥ 術中探查無血性腹水,腫瘤無破裂出血;⑦ 上腹部手術史不視為絕對禁忌證。隨著腔鏡肝膽外科技術的發展,2018年李敬東等[3]提出,>10 cm的病灶雖然會增加LCH的手術難度,但還是有一定的機會獲得R0切除,可以行LCH。既往對于侵犯門靜脈右前支的肝臟惡性腫瘤被認為是LCH手術的絕對禁忌證之一,然而隨著外科技術的提高,對于侵犯血管的肝中葉腫瘤實施R0切除也成為了可能。筆者團隊認為,對于初期開展LCH的醫療中心仍建議優先選擇無大血管侵犯、腫瘤直徑較小、良性腫瘤或惡性程度較低的病例,而對于開展LCH較多的大型臨床肝臟外科中心團隊可以對侵犯重要血管的肝中葉腫瘤實施LCH。總之,LCH適用于腫瘤位于肝臟中葉的各類良惡性腫瘤如肝血管瘤、肝腺瘤、肝細胞癌、結直腸癌肝轉移、膽囊癌(Ⅳ期)、肝門膽管癌(Bismuth Ⅳ型)等。
3 LCH的分型與改良分型
鄭樹國[4]將LCH分為兩大類,即解剖性LCH和非解剖性LCH。解剖性LCH要求完整地切除Ⅳ、Ⅴ、Ⅷ段肝臟,但其難度和風險較大;而非解剖性LCH是指肝臟中葉的局部切除或不規則切除,其難度和風險相對較小。隨著精準肝切除概念的引入,對于局部單一肝段的切除,筆者團隊不建議將其歸為中肝切除。結合實際臨床工作經驗,筆者團隊根據臨床工作中LCH切除肝臟的實際范圍將LCH分為3大類。① 標準LCH,即完整切除肝臟Couinaud分段的Ⅳ、Ⅴ、Ⅷ段(圖1a)。② 部分LCH,又分為a類和b類2種亞型。a類:切除范圍包括完整的肝右前葉或者肝左內葉全段加另一葉的部分肝段,即切除Ⅳb+Ⅴ+Ⅷ段,或Ⅳa+Ⅴ+Ⅷ段,或Ⅳ+Ⅷ段,或Ⅳ+Ⅴ段(圖1b~1e);b類切除范圍僅包括右肝前葉全段或肝左內葉全段,或右肝前葉部分肝段+肝左內葉部分肝段,即Ⅳ段,或Ⅴ+Ⅷ段,或Ⅳa+Ⅴ/Ⅷ段,或Ⅳb+Ⅴ/Ⅷ段(圖1f~1k)。③ 擴大LCH,即除完整切除肝臟中葉外且一并切除肝尾葉,切除范圍包括Ⅰ、Ⅳ、Ⅴ、Ⅷ段(圖1l)。
 圖1
示LCH的分型
圖1
示LCH的分型
a:標準LCH(切除Ⅳ+Ⅴ+Ⅷ段);b~e:部分LCH a類(b:切除Ⅳb+Ⅴ+Ⅷ段;c:切除Ⅳa+Ⅴ+Ⅷ段;d:切除Ⅳ+Ⅷ段;e:切除Ⅳ+Ⅴ段);f~k:部分LCH b類(f:切除Ⅳ段;g:切除Ⅴ+Ⅷ段;h:切除Ⅳa+Ⅷ段;i:切除Ⅳa+Ⅴ段;j:切除Ⅳb+Ⅴ段;k:切除Ⅳb+Ⅷ段);l:擴大LCH(切除Ⅳ+Ⅴ+Ⅷ+Ⅰ段)
4 LCH的手術入路方式
LCH不僅要求手術醫生具有豐富的開放切除經驗,同時也需要主刀醫生對腹腔鏡器械使用熟練。因為手術區域鄰近第一、二、三肝門,解剖結構復雜,且需保證腫瘤切除后剩余肝臟出入管道的完整性,避免術后出現肝衰竭、膽汁漏等并發癥。目前LCH的手術入路方式主要有以下幾種。① 經肝實質CH[30, 38-39]。此入路方式不需要解剖第一肝門,可使用彩色多普勒超聲定位肝右靜脈和肝左靜脈,直接在肝臟表面標記切線,左側切線大致為鐮狀韌帶右緣內側0.5 cm,右側切線為右肝切跡至肝右靜脈入口內側連線,此法雖然不夠精準,但優勢在于技術要求和手術難度較小。② 肝臟“四扇門”入路法[40](圖2)。筆者團隊曾提出通過肝臟“四扇門”入路應用于腹腔鏡肝切除手術中,手術安全、效果可靠,其中第一扇門為主門靜脈裂區域;第二扇門為臍裂區,即肝臟左外葉與左內葉間的臍裂靜脈走行處;第三扇門位于肝實質內,需切開部分肝實質后才能良好顯露,其具體解剖位置為右門靜脈裂與主門靜脈裂之間的縱門靜脈裂,縱門靜脈裂區域的前裂區域打開后即第三扇門;第四扇門即肝短靜脈匯入肝尾葉處。肝臟“四扇門”入路行LCH的主要步驟是:解剖主門靜脈裂區域打開肝臟第一扇門,控制肝臟左、右葉 Glisson蒂,為行LCH奠定基礎;然后打開第二扇門的前門顯現肝臟Ⅳ段入口,進而控制肝臟Ⅳa、Ⅳb段的Glisson蒂,缺血線出現后行Ⅳ段切除;打開第三扇門前門顯現肝臟Ⅴ、Ⅷ段入口后控制肝臟Ⅴ、Ⅷ段的Glisson蒂,缺血線出現后行Ⅴ、Ⅷ段切除術,如需行擴大LCH,則可打開第四扇門,顯露至肝尾葉入口,控制肝尾葉的Glisson蒂,行肝尾葉切除。以上手術入路方式,均有其優點和不足,但無論何種入路方式都無法適用于所有情況。因此,術者應根據患者情況結合腫瘤位置、是否侵犯重要血管等實際情況來選擇最佳的手術入路方式完成手術。
 圖2
示肝臟“四扇門”劃分圖
圖2
示肝臟“四扇門”劃分圖
5 LCH的優缺點
近年來,隨著腹腔鏡技術快速發展,術中超聲、吲哚菁綠熒光染色等技術的應用,LCH治療肝中葉腫瘤得到進一步應用和發展,使得LCH技術更完善和成熟。現有證據[21, 24]表明,LCH治療肝中葉腫瘤的療效與開放手術相當且創傷小、出血少、術后恢復快,但手術時間相應延長。國內張忠林團隊[24]和成劍等[29]分別使用吲哚菁綠熒光導航開展LCH 11例和2例,研究顯示,LCH術中使用吲哚菁綠熒光實時導航技術及反染法可清晰顯露腫瘤邊界,不僅可避免損傷重要血管減少出血,還能避免切除肝實質過多,降低肝衰竭發生率,使LCH手術更加安全,但張忠林團隊[24]研究顯示吲哚菁綠熒光實時導航有一缺陷,即肝段顯影成功率不高,實施正、負顯影的7例患者中僅4例獲得成功。
6 小結與展望
盡管 LCH是肝臟外科最具挑戰性手術之一,經歷10余年的探索后目前已逐漸成熟。對于有豐富開腹肝臟手術經驗的外科醫師,經過嚴格的腹腔鏡手術技術操作訓練,LCH可以作為常規術式開展。基于目前研究結果來看,LCH具有一定優勢,期待高質量的大樣本、多中心的隨機對照試驗和高質量的循證醫學證據能填補空缺。自1991年開展腹腔鏡手術以來,經過30年的快速發展,微創的觀念已經深入人心,我國微創外科水平已達到世界先進水平。隨著腹腔鏡技術的迅速發展和積極推廣,我國肝中葉腫瘤的外科治療現已步入精準化和個體化時代,合理推廣普及LCH,提高肝中葉腫瘤患者的生活質量是未來的發展方向。與傳統半肝切除和擴大半肝切除相比,雖然LCH技術要求較高,但可以保留更多的肝實質,能降低肝衰竭發生率,且療效與開腹手術相當。目前,LCH術式尚未標準化,盡管LCH的理論與技術已經趨于成熟,但手術流程還需進一步優化,增加手術安全性,縮短學習曲線。隨著外科器械和技術的不斷發展,在不久的將來,隨著LCH標準化術式的完善和大量臨床研究數據的發布和更多循證醫學證據的支持,LCH必將蓬勃發展。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,聲明彼此間無利益沖突。
作者貢獻聲明:馮清波檢索文獻、起草文章;吳泓和曾勇核實論文格式、文章結構、手稿重要論點;曾勇和李嘉鑫對文章知識性內容作批判性審閱并給予指導性意見。