引用本文: 丁冬陽, 孫大鵬, 袁聲賢, 周偉平. 維生素 D 在肝細胞癌發生發展中作用的研究進展及臨床轉化. 中國普外基礎與臨床雜志, 2021, 28(5): 688-694. doi: 10.7507/1007-9424.202008032 復制
肝細胞癌(HCC)是目前導致癌癥相關性死亡的第五大原因,其發病率呈迅速上升態勢,女性每年上升約 3%,男性每年上升約 4%[1],而我國更是一個肝癌高發地區,形勢仍十分嚴峻[2]。在過去的十幾年中,肝癌的診斷、外科治療和綜合治療都有了很大的進步,然而在臨床實踐中,篩查和監測項目的利用率仍然很低,普通人群中被診斷為肝癌的患者的 1 年生存率仍低于 50%[3],隨著巴塞羅那分期(BCLC 分期)的進展,患者的中位生存率顯著降低,其總中位生存期為 9 個月,主要死因為腫瘤進展[3]。靶向藥物索拉非尼只能使肝癌患者的總生存期延長約 3 個月[4],效果并不理想。因此迫切需要新的治療方案來改善原發性肝癌的預后。近年來有研究表明,維生素 D 可能與慢性肝病進展的病理生理有關[5-7],其在肝癌防治中的潛在作用越來越受到重視。筆者系統地梳理和總結了維生素 D 的代謝、生理作用,以及其在肝癌及慢性肝病中的潛在作用和臨床應用轉化問題。
1 維生素 D 的合成與代謝
維生素 D 是調節機體礦物質和骨代謝的重要細胞因子,具有維持血鈣穩態和促進骨骼礦化的經典作用[8],然而其抗增殖、促分化、促凋亡、抗炎、免疫調節等非經典作用在近十年來受到了廣泛的關注[9]。
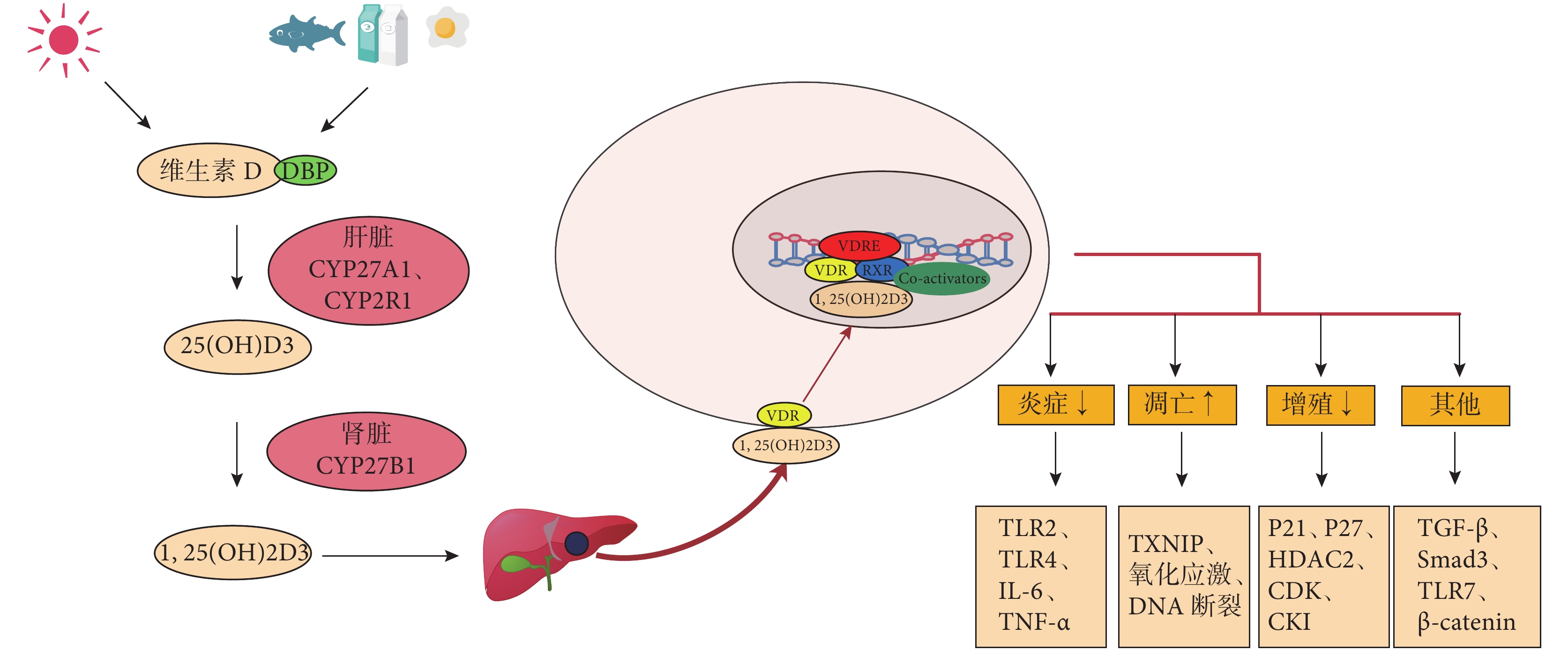
體內的維生素主要以維生素 D2(麥角鈣化醇)和維生素 D3(膽鈣化醇)兩種形式存在。維生素 D3 主要由皮膚中的 7-脫氫膽固醇受到紫外線照射轉化而來,一些油性魚、魚肝油、牛奶、蛋黃等食物也含有少量的維生素 D3[10]。這些維生素 D3 的活性形式是 1, 25-二羥維生素 D3 [1, 25(OH)2D3],是維生素 D3 經過兩步羥化反應轉化形成的。首先,皮膚或飲食來源的維生素 D3 與血液中的維生素 D 結合蛋白(DBP)結合,并被運輸到肝臟,在肝臟中其 25 位碳原子被羥基化轉化為 25-羥維生素 D3 [25(OH)D3]。這一步反應是由細胞色素 P450 酶(CYP27A1 和 CYP2R1)催化的[11]。第二步的羥化發生在腎近端小管細胞內,25(OH)D3 的 1 位碳原子被羥基化形成 1, 25(OH)2D3,這一步反應是由另一種細胞色素 P450 酶(CYP27B1)催化。其中腎組織中還存在另一種發揮關鍵作用的酶,即25(OH)D3-24-羥化酶(24-OHase 或 CYP24A1)。24-OHase 負責 1, 25(OH)2D3 的降解,形成1, 24, 25-三羥維生素 D3 [1, 24, 25(OH)3D3]。此外,當 25(OH)D 過量的時候,腎臟中的 24-OHase 可將其轉化為24, 25(OH)2D3,以防 1, 25(OH)2D3的過量產生[12]。維生素 D2 與維生素 D3 相似,經兩個羥基化反應,分別轉化為 25(OH)D2 和1, 25(OH)2D2[13]。甲狀旁腺激素(PTH)已被證實對第二步的羥化反應有促進作用,而生成的1, 25(OH)2D3 又可抑制其本身以及 PTH 的合成,這形成一個負反饋調節通路,對體內的 1, 25(OH)2D3含量進行精確調控[14]。
2 維生素 D 的生理作用
維生素 D 在體內發揮作用是通過結合維生素 D 受體(VDR),從而對特定的組織和器官的基因表達進行調控。VDR 是核受體家族中的一員,與其他核受體家族成員類似,結合配體狀態的 VDR 需要與維甲酸 X 受體(RXR)結合,形成二聚體,進而與維生素 D 反應基因啟動子區的維生素 D 反應元件(VDRE)結合,發揮其基因轉錄調控功能[15]。目前為止,利用高通量測序法已經鑒定出了 2 776 個 VDR 結合位點以及 229 個受維生素 D 調控的基因,其中在自身免疫和癌癥相關基因附近,VDR 結合位點顯著豐富[16-17],這說明維生素 D 可能參與調節某些免疫性和腫瘤疾病的發生發展。Stumpf 等[18]首次發現,在調節體內鈣平衡和骨代謝以外的組織中可以檢測到 VDR,這為維生素 D 非傳統作用的研究拉開了帷幕。人們陸續發現,1, 25(OH)2D3 具有抗腫瘤增殖、抗炎癥反應、促進細胞分化、促進細胞凋亡、免疫調節等非經典作用,并且這些作用的發揮是具有組織和細胞特異性的[19]。VDR 可廣泛表達于不同類型的組織或細胞,包括甲狀腺、肝臟、腎臟、肺、皮膚、胃、淋巴細胞、心臟、肌肉、卵巢、前列腺、睪丸、大腦和脊髓[20-21]。
VDR 在單核細胞和 T 細胞中也表達上調,提示維生素 D 可能參與免疫應答過程。維生素 D 在先天免疫應答中發揮著重要作用,包括誘導抗菌肽、刺激細胞因子的產生和誘導自噬作用[22]。1, 25(OH)2D3 還能通過降低單核細胞中 Toll 樣受體(TLR)2 和 TLR4 的表達來發揮免疫抑制作用[23]。因此,維生素 D 似乎在維持激活先天免疫反應以有效消滅病原體和預防過度炎癥反應之間的平衡方面發揮著關鍵作用。在后天性免疫中,維生素 D 抑制了 T 細胞中 IL-2、γ 干擾素(IFN-γ,來源于 Th1 細胞)和 IL-17(來源于 Th17 細胞)的生成,同時增加了 IL-3、4、5 和 10(來源于 Th2 細胞)的生成,以及來源于調節性 T 細胞(Tregs)的 IL-10 的生成,說明維生素 D 可能通過增強 T 細胞的抑制作用來下調過敏,調控自身免疫[24-25]。在體液免疫過程中,1, 25(OH)2D3 可抑制 B 細胞分泌 IgA、IgG、IgM 和 IgE[26]。
眾所周知,細胞程序性死亡-配體 1(PD-L1)可通過作用于程序性死亡受體 1(PD-1)來下調免疫系統對人體細胞的反應,從而抑制 T 細胞的免疫作用,這種機制可預防自身免疫性疾病,但也可以介導腫瘤逃逸[27]。有研究發現,1, 25(OH)2D3 可以通過作用于 VDR 直接誘導編碼 PD-L1 和 PD-L2的基因表達,用 1, 25(OH)2D3 處理原代 T 細胞可抑制 CD4+ 和 CD8+ 細胞的活化,從而抑制炎癥細胞因子的產生,而抗 PD-L1 阻斷抗體則消除了這種抑制作用[28]。這說明,1, 25(OH)2D3 可能通過促進 PD-L1 的表達來控制炎癥免疫反應,但這可能是一把雙刃劍,因為人體中 PD-L1 的表達上調可能會抑制抗腫瘤免疫反應,降低腫瘤的免疫治療效果。
除通過基因組途徑發揮作用外,1, 25(OH)2D3還具有快速改變某些跨膜信號的作用,從而在細胞膜、細胞器膜以及基質中產生即時的生物學效應[29]。盡管這種作用不會直接影響基因的表達,但是它可以通過與其他信號通路相互作用來調節基因轉錄[30]。有研究[31]表明,這種快速反應與質膜上的 VDR 發揮非經典作用有關,VDR 激活后可促進下游的蛋白激酶 C 和蛋白磷酸脂酶 1C(PP1C)的激活,從而調控相關的離子通道。這種非轉錄快速效應可能在控制癌細胞增殖中發揮重要作用。目前這種快速非基因組作用的確切機制尚不清楚,有待于進一步研究。
3 維生素 D:HCC 進展及預后指標
越來越多的證據表明,維生素 D 水平與慢性肝臟疾病死亡的風險以及 HCC 的發生發展顯著相關,維生素 D 在 HCC 的病情進展和預后的監測中具有越來越大的潛力。Skaaby 等[32]首次進行了維生素 D 與慢性肝病關系的前瞻性調查,共納入 2 649 位研究對象,平均隨訪時間為 15.6 年,研究表明,維生素 D 水平與致死性肝病的發生呈顯著的負相關。Finkelmeier 等[33]認為,維生素 D3 水平與肝癌分期呈負相關,其中嚴重缺乏維生素 D3 的肝癌患者的死亡率最高,極低的維生素 D3 水平可作為 HCC 預后不良的指標。Fedirko 等[34]和 Buonomo 等[35]學者進行的前瞻性巢式病例對照研究,探討了 HCC 和慢性肝硬化患者血清中1, 25(OH)2D3 水平與疾病死亡、危險因素及預后之間的關系,結果發現,維生素 D 與這些指標呈顯著負相關。Hammad 等[36]將慢性 HCV 患者按肝損害程度分為肝周纖維化、肝硬化和 HCC 3 組,采血檢測 1, 25(OH)2D3 水平,發現其水平在 3 組間顯著地進行性下降。這說明,血清中 1, 25(OH)2D3 水平的進行性下降可能與慢性肝病的進展相關聯,提示其可作為一種潛在的腫瘤進展及預后指標。最近的一項大型隊列研究[37]證明,血清中生物可利用的 25(OH)D3 水平與 HCC 患者的生存率獨立相關,表明 25(OH)D3對 HCC 預后有潛在的提示作用。25(OH)D3 還可作為 HCC 經導管動脈化療栓塞術(TACE)治療后腫瘤反應不良的預測指標[38],以指導臨床肝癌化療。此外,25(OH)D3 是目前臨床上普遍接受的維生素 D 的評價指標,它具有半衰期長和性質穩定的特點,有望成為一種新型的腫瘤監測指標。然而由于研究的局限性(樣本量不足),HCC 影響因素的復雜性,血清中維生素 D 水平可能受光照和飲食影響,維生素 D 能否轉化為 HCC 的臨床監測和預后指標需要進一步研究。
4 維生素 D 調控 HCC 的發生和發展
維生素 D 作為一種重要的免疫調節因子,在 HCC 的發生和發展過程中發揮著重要作用。然而 1, 25(OH)2D3 抗 HCC 的機制尚未完全闡明,國內對其與 HCC 相關性的報道尚十分匱乏,亟需在此方面進行研究,填補領域空白。
4.1 抗炎和抗纖維化作用
單核細胞和巨噬細胞發出的炎癥信號可以調控局部的維生素 D 的代謝,其主要通過誘導 CYP27B1 的表達以及 1, 25(OH)2D3 的合成,從而控制過度的免疫反應[39]。而肝內的巨噬細胞數目約占體內巨噬細胞總數的 90%[40],因此當發生肝臟疾病時,活性維生素 D3 的生成將會受到極大地影響,這也解釋了為什么慢性肝病患者體內維生素 D 的水平始終處于降低狀態。
維生素 D 可作為一種免疫調節劑抑制肝內成纖維細胞增殖和膠原蛋白的產生,從而抑制肝纖維化。肝星狀細胞在肝纖維化過程中起主要作用,而維生素 D 可作用于肝星狀細胞的 VDR,從而抑制其膠原蛋白的產生,發揮抗纖維化作用[41]。Ding等[42]發現,VDR 基因敲除小鼠會自發發生肝纖維化,相反,結合維生素 D3 的 VDR 可以通過結合共調基因如 Tgfb1、Mmp7、Ctgf 等,減少 Smad3 在這些位點的占用,從而抑制轉化生長因子-β(TGF-β)介導的肝纖維化過程。此外,維生素 D 還可以通過調節體內促纖維蛋白的水平來抑制 TGF-β 介導的肝纖維化過程,如下調Ⅰ型和Ⅲ型膠原蛋白的表達,上調降解膠原蛋白的金屬蛋白酶(MMP)8 的表達[43]。
4.2 抗增殖和促凋亡作用
1, 25(OH)2D3 對 HCC 的抗增殖作用主要體現在使其細胞周期停滯于 G0/G1 期,而 S 期的細胞數量下降[44]。細胞周期由細胞周期蛋白和細胞周期蛋白依賴性激酶(CDKs)共同調控,而 CDKs 又受到 CDKs 抑制劑(CKI)的調控。CKI 又稱為抑癌基因,如 P21、P27 等[45]。1, 25(OH)2D3 可誘導多種腫瘤細胞中 P21 和 P27 的表達,進而抑制細胞周期蛋白(D、E 和 A)及 CDK(2 和 4)的表達,抑制細胞增殖[46-47]。癌基因組蛋白去乙酰化酶 2(HDAC2)通常在 HCC 組織中呈高水平表達,其下調可促使 P21 表達水平升高。Huang 等[48]發現,1, 25(OH)2D3可以下調 HCC 中 HDAC2 的表達,進而上調 P21 水平,使 HCC 生長減慢。
硫氧還蛋白互作蛋白(TXNIP)屬于硫氧還蛋白(TRX)結合蛋白的一種,可通過抑制 TRX 系統的功能而發揮介導氧化應激、抑制細胞增殖、誘導細胞凋亡等作用。TXNIP 在多數癌癥患者體內處于降低的水平,維生素 D 可能對其表達有誘導作用[49]。TXNIP 在人肝癌標本和肝癌衍生細胞系中表達低或缺失,而維生素 D3 可刺激 TXNIP 表達,導致 HCC 細胞增殖減少,凋亡增強[50]。這表明,維生素 D3 可通過刺激 TXNIP 的表達來抑制 HCC 的發生發展。
Rizvi 等[51]在二乙基亞硝胺(DEN)誘導的大鼠 HCC 模型中,發現 HCC 細胞中銅的含量顯著增加,維生素 D3 與銅相互作用導致活性氧介導的 HCC 細胞的 DNA 斷裂。這種非酶促、銅依賴、氧化還原介導的途徑可能是 1, 25(OH)2D3 發揮抗癌作用的幾種機制之一,同時也為維生素 D 的臨床應用提供了新思路。
Chen 等[52]對 Smad3 基因敲除小鼠給予低維生素 D3 飲食,證實維生素 D3 可能通過調節 TLR7 的表達和 β-連環蛋白(β-catenin)的激活來抑制 HCC 增殖。盡管 1, 25(OH)2D3 被報道可以抑制β-catenin 信號傳導,以及癌細胞的增殖、遷移和分化,但是無論是飲食中補充維生素 D 還是維生素 D 類似物治療都不能改善 β-catenin 激活所介導的 HCC 的形成或生長[53]。這說明維生素 D 在肝癌中的作用需要更多的研究來佐證。圖 1 為維生素 D 的合成、代謝及其調控 HCC 細胞的機制示意圖。
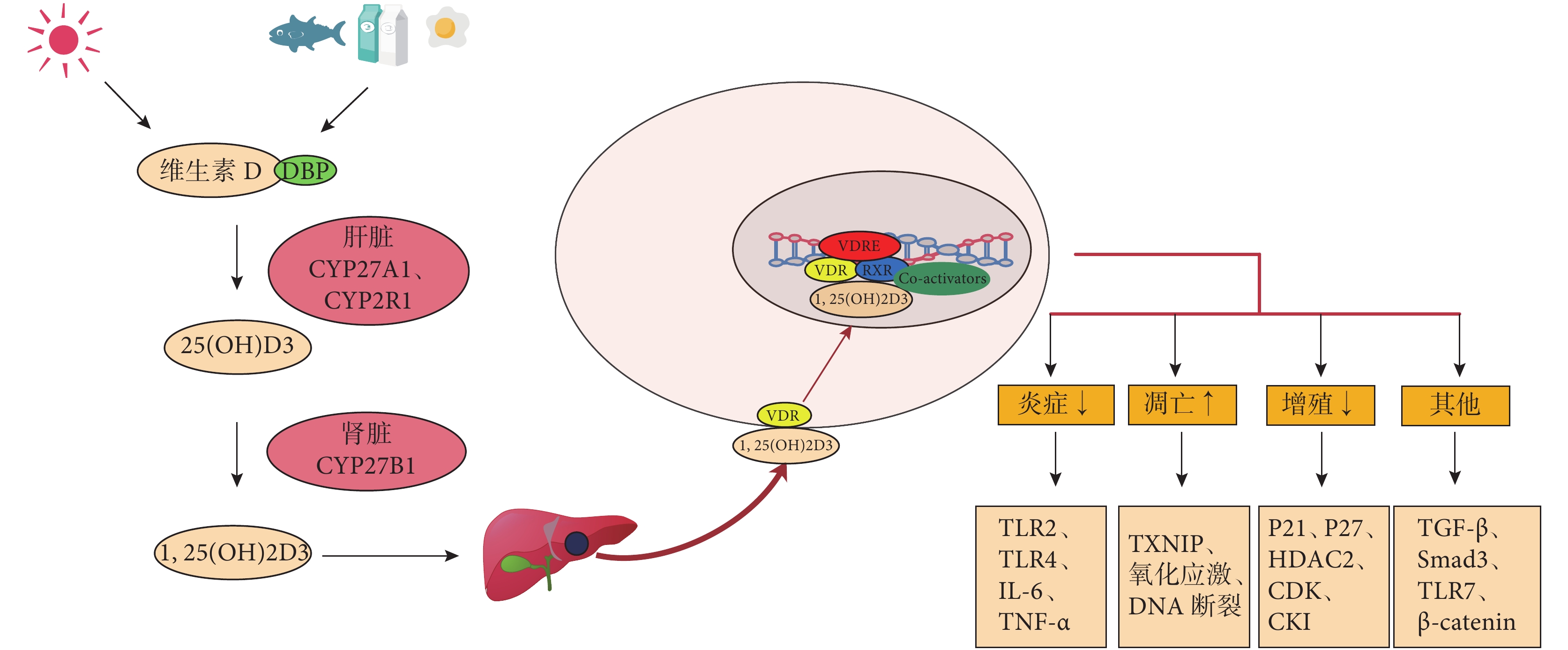 圖1
示維生素 D 的合成、代謝及其調控 HCC 的機制示意圖,其中 Co-activators 為共刺激因子
圖1
示維生素 D 的合成、代謝及其調控 HCC 的機制示意圖,其中 Co-activators 為共刺激因子
5 VDR、DBP 基因多態性與肝癌
VDR 是維生素 D 發揮作用的重要中介,DBP 是 25(OH)D3 在循環中的主要轉運蛋白,約 88% 的 25(OH)D3 與 DBP 結合。近年來,VDR 和 DBP 的基因多態性與肝癌的關系被廣泛討論和研究。Falleti 等[54]發現,VDR 的 Bsml 基因的 b/b 型和 Taql 基因的 TT 型與酒精性肝硬化患者進展為 HCC的風險顯著相關;Hung 等[55]證實,在感染丙型肝炎病毒的 HCC 患者中,VDR 的 Apal 基因的 CC 型出現的頻率更高。在中國人群中,VDR rs2228570 和 DBP rs7041 多態性可能增加了 HBV 相關的 HCC 的易感性[56-57]。這不僅間接提示維生素 D 在肝癌發生中的作用,也進一步提示,可以通過檢測患者的 VDR 和 DBP 基因的多態性來預測肝癌發生的風險。
6 維生素 D 及其類似物的臨床應用
維生素 D 對多種癌癥有抗腫瘤作用,使其成為治療多種癌癥的潛在藥物。然而 1, 25(OH)2D3 本身可導致高鈣血癥,限制了其在抗腫瘤治療中的應用。為了解決這一問題,Chiang 等[58]開展了研究,他們發現,深海魚油能夠增強 1, 25(OH)2D3 的抗肝癌細胞增殖的能力,使其能夠在較低濃度下對癌細胞表現出明顯的抑制效應,同時不會引起高鈣血癥;此外,他們首次證明肝癌細胞表達 CYP27B1,并能夠在體外將 25(OH)D3 轉化為 1, 25(OH)2D3,從而抑制 HepG2 細胞的生長,因此 25(OH)D3治療可將高鈣血癥的風險降到最低[59]。Finlay 等[60]猜想,由于肝的首過效應,肝動脈局部給藥可允許大劑量 1, 25(OH)2D3 用于治療肝癌,而不會產生高鈣血癥,并對肝癌患者進行了臨床試驗,結果顯示,肝動脈灌注高劑量 1, 25(OH)2D3 不會引起高鈣血癥,在整個治療期間,所有患者的肝功能、血清尿素和電解質水平都在正常水平范圍內。Morris 等[61]對 8 例晚期肝癌患者通過肝動脈給予溶于 5 mL碘油的 1, 25(OH)2D3 治療(50、 75 和 100 μg,3 個梯度),4 周后監測血清鈣、1, 25(OH)2D3、甲胎蛋白和一系列生化指標,發現未有患者出現高鈣血癥,并且這些患者的血清甲胎蛋白維持了短暫穩定,說明局部聯合應用碘化油和 1, 25(OH)2D3 可預防高鈣血癥的發生。這些給藥途徑使 1, 25(OH)2D3在肝癌治療中的應用成為可能,但是由于試驗的樣本量過少,對患者的遠期預后未進行觀測,還需要進一步臨床隨機對照研究來全面、準確地了解維生素 D 在肝癌治療中的抗腫瘤作用。
鑒于高鈣血癥的副作用,具有較低的鈣毒副作用和較強的抗腫瘤作用的 1,25(OH)2D3 類似物 MART-10、EB1089 等逐漸被開發出來[62]。Chiang 等[63]發現,MART-10 對 DBP 的結合親和力較低,對 CYP24A1 降解的敏感性較低,因此,MART-10 可能具有更高的生物利用度和更長的體內半衰期,并且 MART-10 在抑制 HepG2 細胞增殖方面的效果比 1,25(OH)2D3 高 100 倍。這表明,MART-10 是一個很有前景的肝癌治療候選方案,需要進一步的動物模型實驗和人體臨床試驗來驗證。Ghous 等[64]進行了一項 EB1089 的體內外實驗,其中體外實驗證實多種濃度下的 EB1089 均可顯著抑制 hep3b、PLC/PRF/5 和 SKHEP-1 肝癌細胞的增殖;體內實驗證實,EB1089 能有效抑制 SKHEP-1 腫瘤生長,且不引起高鈣血癥。這說明 EB1089 是一種有效的肝癌生長抑制劑。Sahpazidou 等[65]證實,EB1089 的化學預防性給藥對 C3H/Sy 小鼠的 HCC 發生率有顯著的抑制作用(P<0.000 1)。這種效應可能在 HCC 的化學預防控制方面有潛在的應用前景。在 Dalhoff 等[66]開展的一項晚期肝癌的Ⅱ期臨床試驗中,對 33 例晚期肝癌患者使用 EB1089 治療,結果 2 例完全緩解,12 例病情穩定,19 例病情進展,說明 EB1089 對晚期肝癌有一定的緩解作用,但是需要實施進一步的隨機對照研究來探索其對 HCC 遠期預后的影響。
近年來越來越多的學者探索維生素 D 與其他藥物聯合應用治療肝癌的效果。Provvisiero 等[67]發現,維生素 D 可以使對 mTOR 抑制劑依維莫司治療耐藥的肝癌細胞再致敏,并且上調 miR-375 的表達,從而抑制與耐藥和上皮間質轉化(EMT)有關的癌基因,如 MTDH、YAP-1 和 c-MYC 。Ebrahim等[68]發現,5-FU 聯合維生素 D 治療可顯著降低紅系衍生的核轉錄相關因子 2(NrF2)和 TGF-β1 的基因表達水平以及血清 AFP 濃度,上調 caspase-3 基因表達,促進肝癌細胞凋亡。Xu 等[69]發現,抗組胺藥阿司咪唑與維生素 D 聯合可使體外肝癌細胞增殖能力降低,凋亡增加,細胞遷移、侵襲行為減少,體內癌腫的數量、質量和發病率降低。Wu 等[70]發現,維生素 D2 類似物與索拉非尼聯合應用可以增強肝癌細胞自噬和凋亡。至于維生素 D 對其他肝癌治療藥物是否有影響以及其具體的分子機制,即維生素 D 是否起到“調節者”的作用,還需要進一步的研究,這可能是大大提升 HCC 藥物治療效果的潛在契機,也是維生素 D 臨床轉化應用于肝癌治療的重要佐證。表 1 為從 ClinicalTrials.gov 獲取的目前關于維生素 D 在肝癌方面的臨床試驗。
7 小結與展望
盡管近些年來肝癌治療取得了一些新進展,但是由于傳統的藥物治療和放療效果不佳,其預后仍相當差,迫切需要尋找一種新的治療策略或者聯合治療方案。維生素 D 是一個陳舊藥物,但是它在肝癌中的研究卻是一個十分新的概念,國內幾乎沒有相關的研究,國外也僅是一些分子機制和流行病學上的研究。近幾年相關的基礎研究和臨床研究都在一定程度上揭示了維生素 D 及其類似物的抗肝癌作用。這些結果表明,在臨床轉化應用方面,維生素 D 及其類似物有可能被開發成為治療肝癌的新方案,并在肝癌的患病風險、治療效果評估、進展監測等方面發揮重要作用。然而,維生素 D 及其類似物調控 HCC 的機制尚未完全闡明,有關的臨床試驗相對較少,試驗設計需要進一步完善,這些問題是未來幾年需要重點解決的。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:丁冬陽,思路構想、文獻檢索和文章撰寫;孫大鵬,思路構想;袁聲賢和周偉平:文章指導。
肝細胞癌(HCC)是目前導致癌癥相關性死亡的第五大原因,其發病率呈迅速上升態勢,女性每年上升約 3%,男性每年上升約 4%[1],而我國更是一個肝癌高發地區,形勢仍十分嚴峻[2]。在過去的十幾年中,肝癌的診斷、外科治療和綜合治療都有了很大的進步,然而在臨床實踐中,篩查和監測項目的利用率仍然很低,普通人群中被診斷為肝癌的患者的 1 年生存率仍低于 50%[3],隨著巴塞羅那分期(BCLC 分期)的進展,患者的中位生存率顯著降低,其總中位生存期為 9 個月,主要死因為腫瘤進展[3]。靶向藥物索拉非尼只能使肝癌患者的總生存期延長約 3 個月[4],效果并不理想。因此迫切需要新的治療方案來改善原發性肝癌的預后。近年來有研究表明,維生素 D 可能與慢性肝病進展的病理生理有關[5-7],其在肝癌防治中的潛在作用越來越受到重視。筆者系統地梳理和總結了維生素 D 的代謝、生理作用,以及其在肝癌及慢性肝病中的潛在作用和臨床應用轉化問題。
1 維生素 D 的合成與代謝
維生素 D 是調節機體礦物質和骨代謝的重要細胞因子,具有維持血鈣穩態和促進骨骼礦化的經典作用[8],然而其抗增殖、促分化、促凋亡、抗炎、免疫調節等非經典作用在近十年來受到了廣泛的關注[9]。
體內的維生素主要以維生素 D2(麥角鈣化醇)和維生素 D3(膽鈣化醇)兩種形式存在。維生素 D3 主要由皮膚中的 7-脫氫膽固醇受到紫外線照射轉化而來,一些油性魚、魚肝油、牛奶、蛋黃等食物也含有少量的維生素 D3[10]。這些維生素 D3 的活性形式是 1, 25-二羥維生素 D3 [1, 25(OH)2D3],是維生素 D3 經過兩步羥化反應轉化形成的。首先,皮膚或飲食來源的維生素 D3 與血液中的維生素 D 結合蛋白(DBP)結合,并被運輸到肝臟,在肝臟中其 25 位碳原子被羥基化轉化為 25-羥維生素 D3 [25(OH)D3]。這一步反應是由細胞色素 P450 酶(CYP27A1 和 CYP2R1)催化的[11]。第二步的羥化發生在腎近端小管細胞內,25(OH)D3 的 1 位碳原子被羥基化形成 1, 25(OH)2D3,這一步反應是由另一種細胞色素 P450 酶(CYP27B1)催化。其中腎組織中還存在另一種發揮關鍵作用的酶,即25(OH)D3-24-羥化酶(24-OHase 或 CYP24A1)。24-OHase 負責 1, 25(OH)2D3 的降解,形成1, 24, 25-三羥維生素 D3 [1, 24, 25(OH)3D3]。此外,當 25(OH)D 過量的時候,腎臟中的 24-OHase 可將其轉化為24, 25(OH)2D3,以防 1, 25(OH)2D3的過量產生[12]。維生素 D2 與維生素 D3 相似,經兩個羥基化反應,分別轉化為 25(OH)D2 和1, 25(OH)2D2[13]。甲狀旁腺激素(PTH)已被證實對第二步的羥化反應有促進作用,而生成的1, 25(OH)2D3 又可抑制其本身以及 PTH 的合成,這形成一個負反饋調節通路,對體內的 1, 25(OH)2D3含量進行精確調控[14]。
2 維生素 D 的生理作用
維生素 D 在體內發揮作用是通過結合維生素 D 受體(VDR),從而對特定的組織和器官的基因表達進行調控。VDR 是核受體家族中的一員,與其他核受體家族成員類似,結合配體狀態的 VDR 需要與維甲酸 X 受體(RXR)結合,形成二聚體,進而與維生素 D 反應基因啟動子區的維生素 D 反應元件(VDRE)結合,發揮其基因轉錄調控功能[15]。目前為止,利用高通量測序法已經鑒定出了 2 776 個 VDR 結合位點以及 229 個受維生素 D 調控的基因,其中在自身免疫和癌癥相關基因附近,VDR 結合位點顯著豐富[16-17],這說明維生素 D 可能參與調節某些免疫性和腫瘤疾病的發生發展。Stumpf 等[18]首次發現,在調節體內鈣平衡和骨代謝以外的組織中可以檢測到 VDR,這為維生素 D 非傳統作用的研究拉開了帷幕。人們陸續發現,1, 25(OH)2D3 具有抗腫瘤增殖、抗炎癥反應、促進細胞分化、促進細胞凋亡、免疫調節等非經典作用,并且這些作用的發揮是具有組織和細胞特異性的[19]。VDR 可廣泛表達于不同類型的組織或細胞,包括甲狀腺、肝臟、腎臟、肺、皮膚、胃、淋巴細胞、心臟、肌肉、卵巢、前列腺、睪丸、大腦和脊髓[20-21]。
VDR 在單核細胞和 T 細胞中也表達上調,提示維生素 D 可能參與免疫應答過程。維生素 D 在先天免疫應答中發揮著重要作用,包括誘導抗菌肽、刺激細胞因子的產生和誘導自噬作用[22]。1, 25(OH)2D3 還能通過降低單核細胞中 Toll 樣受體(TLR)2 和 TLR4 的表達來發揮免疫抑制作用[23]。因此,維生素 D 似乎在維持激活先天免疫反應以有效消滅病原體和預防過度炎癥反應之間的平衡方面發揮著關鍵作用。在后天性免疫中,維生素 D 抑制了 T 細胞中 IL-2、γ 干擾素(IFN-γ,來源于 Th1 細胞)和 IL-17(來源于 Th17 細胞)的生成,同時增加了 IL-3、4、5 和 10(來源于 Th2 細胞)的生成,以及來源于調節性 T 細胞(Tregs)的 IL-10 的生成,說明維生素 D 可能通過增強 T 細胞的抑制作用來下調過敏,調控自身免疫[24-25]。在體液免疫過程中,1, 25(OH)2D3 可抑制 B 細胞分泌 IgA、IgG、IgM 和 IgE[26]。
眾所周知,細胞程序性死亡-配體 1(PD-L1)可通過作用于程序性死亡受體 1(PD-1)來下調免疫系統對人體細胞的反應,從而抑制 T 細胞的免疫作用,這種機制可預防自身免疫性疾病,但也可以介導腫瘤逃逸[27]。有研究發現,1, 25(OH)2D3 可以通過作用于 VDR 直接誘導編碼 PD-L1 和 PD-L2的基因表達,用 1, 25(OH)2D3 處理原代 T 細胞可抑制 CD4+ 和 CD8+ 細胞的活化,從而抑制炎癥細胞因子的產生,而抗 PD-L1 阻斷抗體則消除了這種抑制作用[28]。這說明,1, 25(OH)2D3 可能通過促進 PD-L1 的表達來控制炎癥免疫反應,但這可能是一把雙刃劍,因為人體中 PD-L1 的表達上調可能會抑制抗腫瘤免疫反應,降低腫瘤的免疫治療效果。
除通過基因組途徑發揮作用外,1, 25(OH)2D3還具有快速改變某些跨膜信號的作用,從而在細胞膜、細胞器膜以及基質中產生即時的生物學效應[29]。盡管這種作用不會直接影響基因的表達,但是它可以通過與其他信號通路相互作用來調節基因轉錄[30]。有研究[31]表明,這種快速反應與質膜上的 VDR 發揮非經典作用有關,VDR 激活后可促進下游的蛋白激酶 C 和蛋白磷酸脂酶 1C(PP1C)的激活,從而調控相關的離子通道。這種非轉錄快速效應可能在控制癌細胞增殖中發揮重要作用。目前這種快速非基因組作用的確切機制尚不清楚,有待于進一步研究。
3 維生素 D:HCC 進展及預后指標
越來越多的證據表明,維生素 D 水平與慢性肝臟疾病死亡的風險以及 HCC 的發生發展顯著相關,維生素 D 在 HCC 的病情進展和預后的監測中具有越來越大的潛力。Skaaby 等[32]首次進行了維生素 D 與慢性肝病關系的前瞻性調查,共納入 2 649 位研究對象,平均隨訪時間為 15.6 年,研究表明,維生素 D 水平與致死性肝病的發生呈顯著的負相關。Finkelmeier 等[33]認為,維生素 D3 水平與肝癌分期呈負相關,其中嚴重缺乏維生素 D3 的肝癌患者的死亡率最高,極低的維生素 D3 水平可作為 HCC 預后不良的指標。Fedirko 等[34]和 Buonomo 等[35]學者進行的前瞻性巢式病例對照研究,探討了 HCC 和慢性肝硬化患者血清中1, 25(OH)2D3 水平與疾病死亡、危險因素及預后之間的關系,結果發現,維生素 D 與這些指標呈顯著負相關。Hammad 等[36]將慢性 HCV 患者按肝損害程度分為肝周纖維化、肝硬化和 HCC 3 組,采血檢測 1, 25(OH)2D3 水平,發現其水平在 3 組間顯著地進行性下降。這說明,血清中 1, 25(OH)2D3 水平的進行性下降可能與慢性肝病的進展相關聯,提示其可作為一種潛在的腫瘤進展及預后指標。最近的一項大型隊列研究[37]證明,血清中生物可利用的 25(OH)D3 水平與 HCC 患者的生存率獨立相關,表明 25(OH)D3對 HCC 預后有潛在的提示作用。25(OH)D3 還可作為 HCC 經導管動脈化療栓塞術(TACE)治療后腫瘤反應不良的預測指標[38],以指導臨床肝癌化療。此外,25(OH)D3 是目前臨床上普遍接受的維生素 D 的評價指標,它具有半衰期長和性質穩定的特點,有望成為一種新型的腫瘤監測指標。然而由于研究的局限性(樣本量不足),HCC 影響因素的復雜性,血清中維生素 D 水平可能受光照和飲食影響,維生素 D 能否轉化為 HCC 的臨床監測和預后指標需要進一步研究。
4 維生素 D 調控 HCC 的發生和發展
維生素 D 作為一種重要的免疫調節因子,在 HCC 的發生和發展過程中發揮著重要作用。然而 1, 25(OH)2D3 抗 HCC 的機制尚未完全闡明,國內對其與 HCC 相關性的報道尚十分匱乏,亟需在此方面進行研究,填補領域空白。
4.1 抗炎和抗纖維化作用
單核細胞和巨噬細胞發出的炎癥信號可以調控局部的維生素 D 的代謝,其主要通過誘導 CYP27B1 的表達以及 1, 25(OH)2D3 的合成,從而控制過度的免疫反應[39]。而肝內的巨噬細胞數目約占體內巨噬細胞總數的 90%[40],因此當發生肝臟疾病時,活性維生素 D3 的生成將會受到極大地影響,這也解釋了為什么慢性肝病患者體內維生素 D 的水平始終處于降低狀態。
維生素 D 可作為一種免疫調節劑抑制肝內成纖維細胞增殖和膠原蛋白的產生,從而抑制肝纖維化。肝星狀細胞在肝纖維化過程中起主要作用,而維生素 D 可作用于肝星狀細胞的 VDR,從而抑制其膠原蛋白的產生,發揮抗纖維化作用[41]。Ding等[42]發現,VDR 基因敲除小鼠會自發發生肝纖維化,相反,結合維生素 D3 的 VDR 可以通過結合共調基因如 Tgfb1、Mmp7、Ctgf 等,減少 Smad3 在這些位點的占用,從而抑制轉化生長因子-β(TGF-β)介導的肝纖維化過程。此外,維生素 D 還可以通過調節體內促纖維蛋白的水平來抑制 TGF-β 介導的肝纖維化過程,如下調Ⅰ型和Ⅲ型膠原蛋白的表達,上調降解膠原蛋白的金屬蛋白酶(MMP)8 的表達[43]。
4.2 抗增殖和促凋亡作用
1, 25(OH)2D3 對 HCC 的抗增殖作用主要體現在使其細胞周期停滯于 G0/G1 期,而 S 期的細胞數量下降[44]。細胞周期由細胞周期蛋白和細胞周期蛋白依賴性激酶(CDKs)共同調控,而 CDKs 又受到 CDKs 抑制劑(CKI)的調控。CKI 又稱為抑癌基因,如 P21、P27 等[45]。1, 25(OH)2D3 可誘導多種腫瘤細胞中 P21 和 P27 的表達,進而抑制細胞周期蛋白(D、E 和 A)及 CDK(2 和 4)的表達,抑制細胞增殖[46-47]。癌基因組蛋白去乙酰化酶 2(HDAC2)通常在 HCC 組織中呈高水平表達,其下調可促使 P21 表達水平升高。Huang 等[48]發現,1, 25(OH)2D3可以下調 HCC 中 HDAC2 的表達,進而上調 P21 水平,使 HCC 生長減慢。
硫氧還蛋白互作蛋白(TXNIP)屬于硫氧還蛋白(TRX)結合蛋白的一種,可通過抑制 TRX 系統的功能而發揮介導氧化應激、抑制細胞增殖、誘導細胞凋亡等作用。TXNIP 在多數癌癥患者體內處于降低的水平,維生素 D 可能對其表達有誘導作用[49]。TXNIP 在人肝癌標本和肝癌衍生細胞系中表達低或缺失,而維生素 D3 可刺激 TXNIP 表達,導致 HCC 細胞增殖減少,凋亡增強[50]。這表明,維生素 D3 可通過刺激 TXNIP 的表達來抑制 HCC 的發生發展。
Rizvi 等[51]在二乙基亞硝胺(DEN)誘導的大鼠 HCC 模型中,發現 HCC 細胞中銅的含量顯著增加,維生素 D3 與銅相互作用導致活性氧介導的 HCC 細胞的 DNA 斷裂。這種非酶促、銅依賴、氧化還原介導的途徑可能是 1, 25(OH)2D3 發揮抗癌作用的幾種機制之一,同時也為維生素 D 的臨床應用提供了新思路。
Chen 等[52]對 Smad3 基因敲除小鼠給予低維生素 D3 飲食,證實維生素 D3 可能通過調節 TLR7 的表達和 β-連環蛋白(β-catenin)的激活來抑制 HCC 增殖。盡管 1, 25(OH)2D3 被報道可以抑制β-catenin 信號傳導,以及癌細胞的增殖、遷移和分化,但是無論是飲食中補充維生素 D 還是維生素 D 類似物治療都不能改善 β-catenin 激活所介導的 HCC 的形成或生長[53]。這說明維生素 D 在肝癌中的作用需要更多的研究來佐證。圖 1 為維生素 D 的合成、代謝及其調控 HCC 細胞的機制示意圖。
 圖1
示維生素 D 的合成、代謝及其調控 HCC 的機制示意圖,其中 Co-activators 為共刺激因子
圖1
示維生素 D 的合成、代謝及其調控 HCC 的機制示意圖,其中 Co-activators 為共刺激因子
5 VDR、DBP 基因多態性與肝癌
VDR 是維生素 D 發揮作用的重要中介,DBP 是 25(OH)D3 在循環中的主要轉運蛋白,約 88% 的 25(OH)D3 與 DBP 結合。近年來,VDR 和 DBP 的基因多態性與肝癌的關系被廣泛討論和研究。Falleti 等[54]發現,VDR 的 Bsml 基因的 b/b 型和 Taql 基因的 TT 型與酒精性肝硬化患者進展為 HCC的風險顯著相關;Hung 等[55]證實,在感染丙型肝炎病毒的 HCC 患者中,VDR 的 Apal 基因的 CC 型出現的頻率更高。在中國人群中,VDR rs2228570 和 DBP rs7041 多態性可能增加了 HBV 相關的 HCC 的易感性[56-57]。這不僅間接提示維生素 D 在肝癌發生中的作用,也進一步提示,可以通過檢測患者的 VDR 和 DBP 基因的多態性來預測肝癌發生的風險。
6 維生素 D 及其類似物的臨床應用
維生素 D 對多種癌癥有抗腫瘤作用,使其成為治療多種癌癥的潛在藥物。然而 1, 25(OH)2D3 本身可導致高鈣血癥,限制了其在抗腫瘤治療中的應用。為了解決這一問題,Chiang 等[58]開展了研究,他們發現,深海魚油能夠增強 1, 25(OH)2D3 的抗肝癌細胞增殖的能力,使其能夠在較低濃度下對癌細胞表現出明顯的抑制效應,同時不會引起高鈣血癥;此外,他們首次證明肝癌細胞表達 CYP27B1,并能夠在體外將 25(OH)D3 轉化為 1, 25(OH)2D3,從而抑制 HepG2 細胞的生長,因此 25(OH)D3治療可將高鈣血癥的風險降到最低[59]。Finlay 等[60]猜想,由于肝的首過效應,肝動脈局部給藥可允許大劑量 1, 25(OH)2D3 用于治療肝癌,而不會產生高鈣血癥,并對肝癌患者進行了臨床試驗,結果顯示,肝動脈灌注高劑量 1, 25(OH)2D3 不會引起高鈣血癥,在整個治療期間,所有患者的肝功能、血清尿素和電解質水平都在正常水平范圍內。Morris 等[61]對 8 例晚期肝癌患者通過肝動脈給予溶于 5 mL碘油的 1, 25(OH)2D3 治療(50、 75 和 100 μg,3 個梯度),4 周后監測血清鈣、1, 25(OH)2D3、甲胎蛋白和一系列生化指標,發現未有患者出現高鈣血癥,并且這些患者的血清甲胎蛋白維持了短暫穩定,說明局部聯合應用碘化油和 1, 25(OH)2D3 可預防高鈣血癥的發生。這些給藥途徑使 1, 25(OH)2D3在肝癌治療中的應用成為可能,但是由于試驗的樣本量過少,對患者的遠期預后未進行觀測,還需要進一步臨床隨機對照研究來全面、準確地了解維生素 D 在肝癌治療中的抗腫瘤作用。
鑒于高鈣血癥的副作用,具有較低的鈣毒副作用和較強的抗腫瘤作用的 1,25(OH)2D3 類似物 MART-10、EB1089 等逐漸被開發出來[62]。Chiang 等[63]發現,MART-10 對 DBP 的結合親和力較低,對 CYP24A1 降解的敏感性較低,因此,MART-10 可能具有更高的生物利用度和更長的體內半衰期,并且 MART-10 在抑制 HepG2 細胞增殖方面的效果比 1,25(OH)2D3 高 100 倍。這表明,MART-10 是一個很有前景的肝癌治療候選方案,需要進一步的動物模型實驗和人體臨床試驗來驗證。Ghous 等[64]進行了一項 EB1089 的體內外實驗,其中體外實驗證實多種濃度下的 EB1089 均可顯著抑制 hep3b、PLC/PRF/5 和 SKHEP-1 肝癌細胞的增殖;體內實驗證實,EB1089 能有效抑制 SKHEP-1 腫瘤生長,且不引起高鈣血癥。這說明 EB1089 是一種有效的肝癌生長抑制劑。Sahpazidou 等[65]證實,EB1089 的化學預防性給藥對 C3H/Sy 小鼠的 HCC 發生率有顯著的抑制作用(P<0.000 1)。這種效應可能在 HCC 的化學預防控制方面有潛在的應用前景。在 Dalhoff 等[66]開展的一項晚期肝癌的Ⅱ期臨床試驗中,對 33 例晚期肝癌患者使用 EB1089 治療,結果 2 例完全緩解,12 例病情穩定,19 例病情進展,說明 EB1089 對晚期肝癌有一定的緩解作用,但是需要實施進一步的隨機對照研究來探索其對 HCC 遠期預后的影響。
近年來越來越多的學者探索維生素 D 與其他藥物聯合應用治療肝癌的效果。Provvisiero 等[67]發現,維生素 D 可以使對 mTOR 抑制劑依維莫司治療耐藥的肝癌細胞再致敏,并且上調 miR-375 的表達,從而抑制與耐藥和上皮間質轉化(EMT)有關的癌基因,如 MTDH、YAP-1 和 c-MYC 。Ebrahim等[68]發現,5-FU 聯合維生素 D 治療可顯著降低紅系衍生的核轉錄相關因子 2(NrF2)和 TGF-β1 的基因表達水平以及血清 AFP 濃度,上調 caspase-3 基因表達,促進肝癌細胞凋亡。Xu 等[69]發現,抗組胺藥阿司咪唑與維生素 D 聯合可使體外肝癌細胞增殖能力降低,凋亡增加,細胞遷移、侵襲行為減少,體內癌腫的數量、質量和發病率降低。Wu 等[70]發現,維生素 D2 類似物與索拉非尼聯合應用可以增強肝癌細胞自噬和凋亡。至于維生素 D 對其他肝癌治療藥物是否有影響以及其具體的分子機制,即維生素 D 是否起到“調節者”的作用,還需要進一步的研究,這可能是大大提升 HCC 藥物治療效果的潛在契機,也是維生素 D 臨床轉化應用于肝癌治療的重要佐證。表 1 為從 ClinicalTrials.gov 獲取的目前關于維生素 D 在肝癌方面的臨床試驗。
7 小結與展望
盡管近些年來肝癌治療取得了一些新進展,但是由于傳統的藥物治療和放療效果不佳,其預后仍相當差,迫切需要尋找一種新的治療策略或者聯合治療方案。維生素 D 是一個陳舊藥物,但是它在肝癌中的研究卻是一個十分新的概念,國內幾乎沒有相關的研究,國外也僅是一些分子機制和流行病學上的研究。近幾年相關的基礎研究和臨床研究都在一定程度上揭示了維生素 D 及其類似物的抗肝癌作用。這些結果表明,在臨床轉化應用方面,維生素 D 及其類似物有可能被開發成為治療肝癌的新方案,并在肝癌的患病風險、治療效果評估、進展監測等方面發揮重要作用。然而,維生素 D 及其類似物調控 HCC 的機制尚未完全闡明,有關的臨床試驗相對較少,試驗設計需要進一步完善,這些問題是未來幾年需要重點解決的。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:丁冬陽,思路構想、文獻檢索和文章撰寫;孫大鵬,思路構想;袁聲賢和周偉平:文章指導。