引用本文: 鄒海波, 羅蘭云, 王顯魁, 路濤, 謝坪, 陳吉東, 王冠, 駱樂, 姚豫桐, 向光明, 薛華, 黃孝倫. 經MDT治療后獲得長期生存的晚期肝癌病例臨床分析. 中國普外基礎與臨床雜志, 2017, 24(1): 96-100. doi: 10.7507/1007-9424.201605059 復制
肝細胞肝癌(HCC)病死率高居惡性腫瘤死因的第2位,全球每年近80萬人死于HCC[1],我國每年HCC發病率及病死率均占全球50%以上。因其起病隱匿,初期癥狀不明顯,又缺乏針對HCC高危人群的篩查制度,患者就診時多屬晚期,僅20%~30%有機會接受手術切除或肝移植治療[2-3]。肝切除治療HCC已有70多年的歷史,單一的治療手段效果差,生存期短。筆者所在醫院2010年建立了多學科診療(MDT)HCC的臨床路徑,擬提高HCC患者術后的生存期,已實施多例,現將一例晚期HCC患者無瘤生存5年的初步結果報道如下。
1 臨床資料
1.1 一般資料
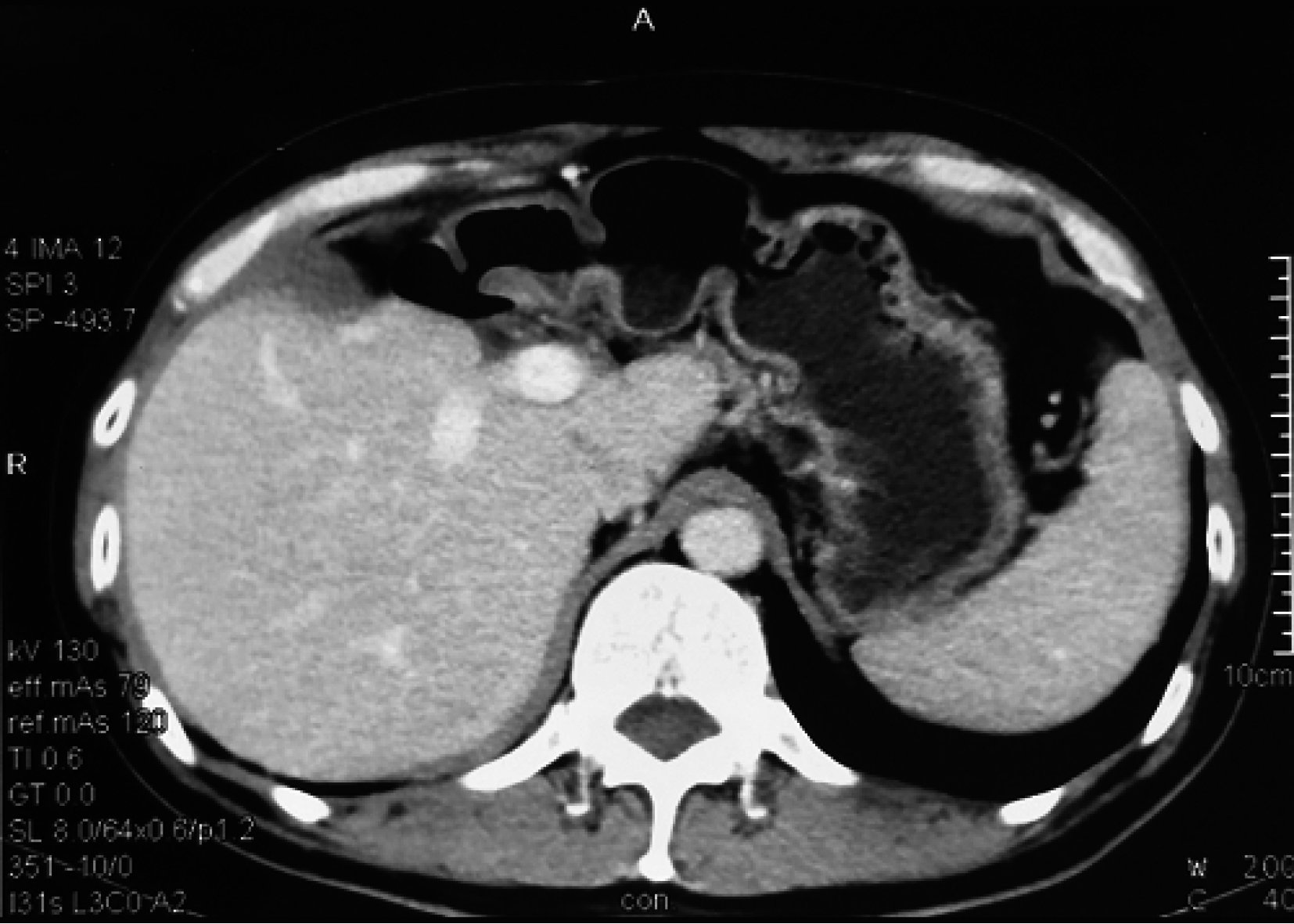
患者,男,37歲,初次就診時間2010-09-28;主訴劍突下脹痛 1+月由外院轉入筆者所在醫院。患者既往有慢性乙肝病史10+年,未規范治療及隨訪復查。否認丙肝、黑便、嘔血史。入院評估體質量指數(body mass index,BMI)為21.9 kg /m2,營養風險評分[4]為 1 分,日常生活能力(activities of daily living,ADL) 評級[5]為Ⅰ級,體力狀態評分參照美國東部腫瘤協作組(Eastern Cooperative Oncology Group score standard,ECOG)評分標準[6]評分為 0 分。查體示生命體征平穩,皮膚鞏膜無黃染,全身淺表淋巴結未觸及明顯腫大,心肺無特殊;右肋下及劍突下3 cm可觸及質硬腫物,不可推動。腹壁靜脈無怒張,脾臟未觸及。實驗室檢查:HBsAg(+),HBeAg(+),HBcAb(+),Pre-S1Ag(+);HBV-DNA 5.1E3 IU/mL;ALT 108 U/L,AST 112 U/L,PT、ALB及TBIL正常,肝功能分級為Child A級;吲哚菁綠試驗15 min滯留率(indocyanine green retention rate test for 15 minutes,ICGR15)為22.4%(日本光電DDG-3300K); 血清AFP>2 000 μg/L(化學發光分析法)。肝臟超聲造影檢查顯示:肝臟多發腫瘤性占位伴多發衛星灶。胸腹部增強CT(圖 1)顯示:雙肺正常;左肝及右肝前葉見多發占位,最大直徑約16 cm,呈典型快進快出表現,考慮HCC伴肝內轉移,門靜脈左支受侵犯。腫瘤體積/全肝體積為1 270 mL/2 209 mL=57.4%。
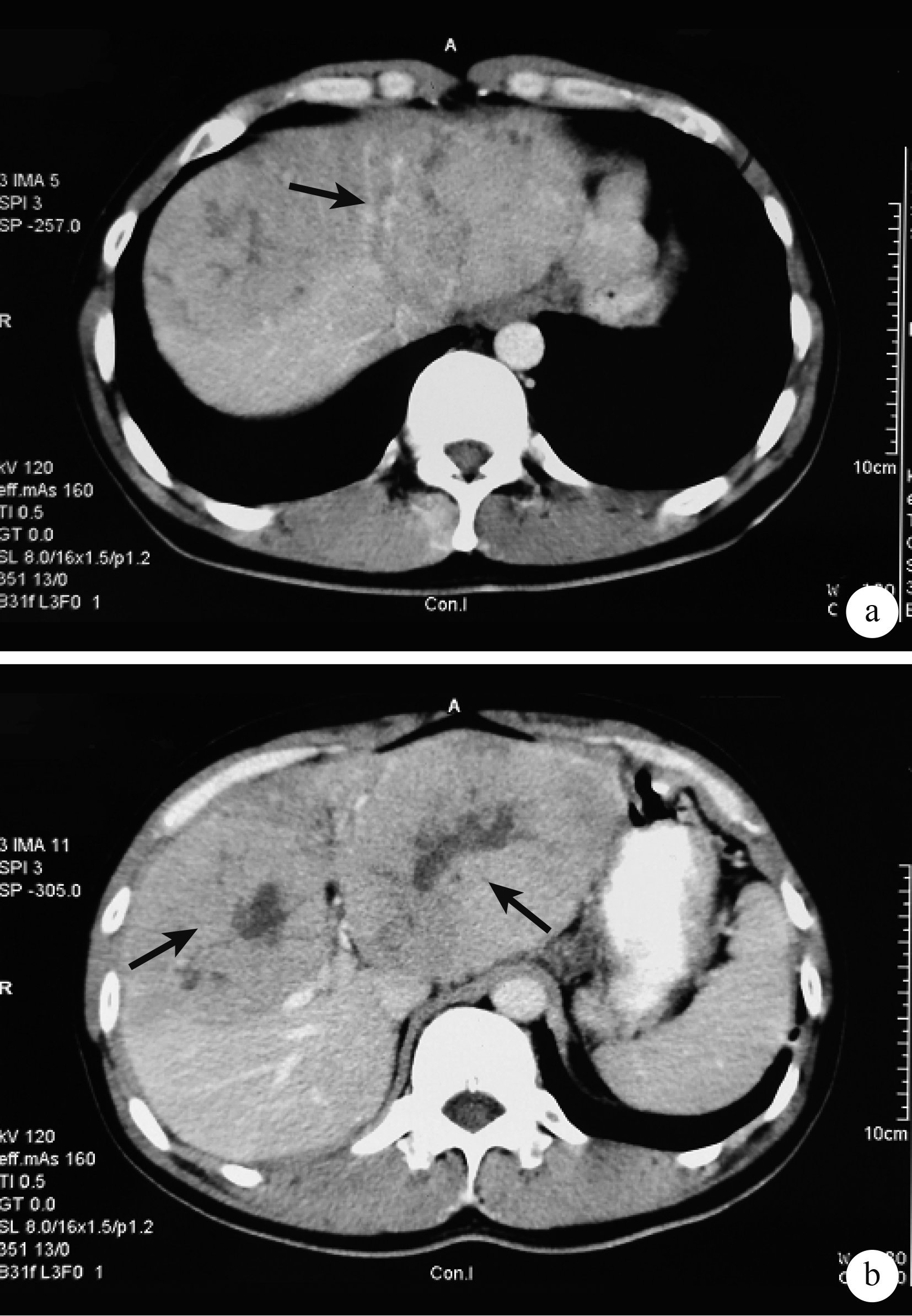
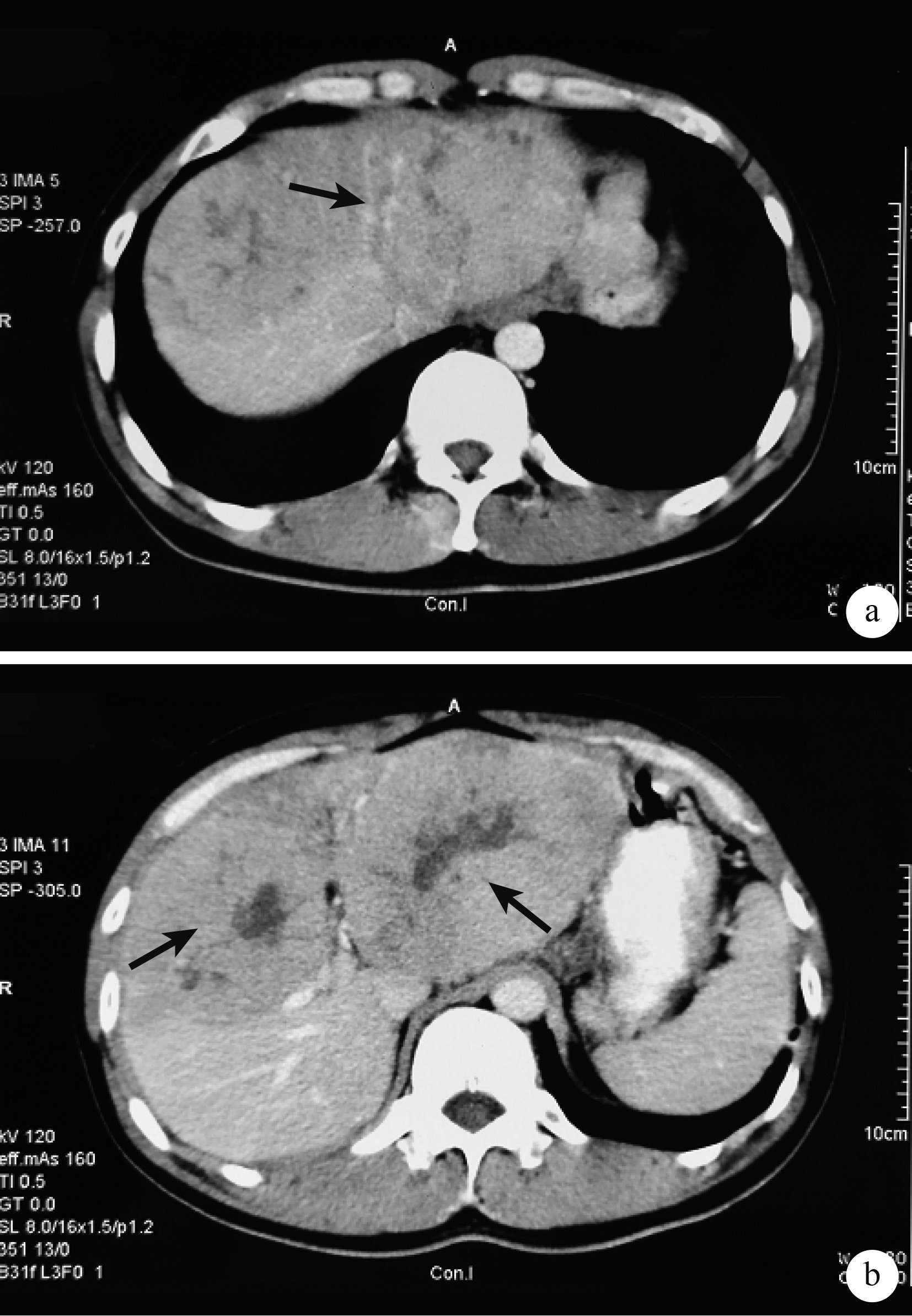 圖1
示初次就診時CT掃描結果 a:第 2 肝門幾乎為腫瘤占據(黑箭); b:腫瘤最大截面約16 cm2(黑箭)
圖1
示初次就診時CT掃描結果 a:第 2 肝門幾乎為腫瘤占據(黑箭); b:腫瘤最大截面約16 cm2(黑箭)
1.2 臨床路徑
1.2.1 第 1 次MDT 召集肝膽外科、感染科、腫瘤科、放射科、放射介入科、超聲介入科及核醫學科進行第 1 次MDT,討論后診斷:①原發性HCC(T3NXMX);②慢性乙型肝炎活動期。治療方案:①基礎治療。立即開始抗病毒治療,藥物選用恩替卡韋(0.5 mg,1 次/d,中美施貴寶),聯合抗乙肝免疫球蛋白(200 U,肌肉注射),治療 1 周后復查HBV-DNA<1.0E3 IU/mL,AST 62 U/L,ALT 53 U/L; 胸腺五肽(10 mg,皮下注射,1 次/d,武漢華龍生物) 調節免疫,三氧化二砷注射液系統化療及護肝治療(10 mg,靜脈滴注,1 次/d,北京雙鷺)。②分次、分部位行經皮肝動脈化療栓塞術(percutaneous hepatic arterial chemoem-bolization,TACE)。復查時根據碘油沉積情況及腫瘤反應決定TACE治療次數及是否手術切除腫瘤。TACE方案:奧沙利鉑+5-FU+絲裂霉素+三氧化二砷+超液化碘油+明膠海綿微粒(杭州艾力康醫藥)。復查CT結果顯示,分次TACE后碘油沉積良好,腫瘤體積縮小(圖 2–圖 4)。
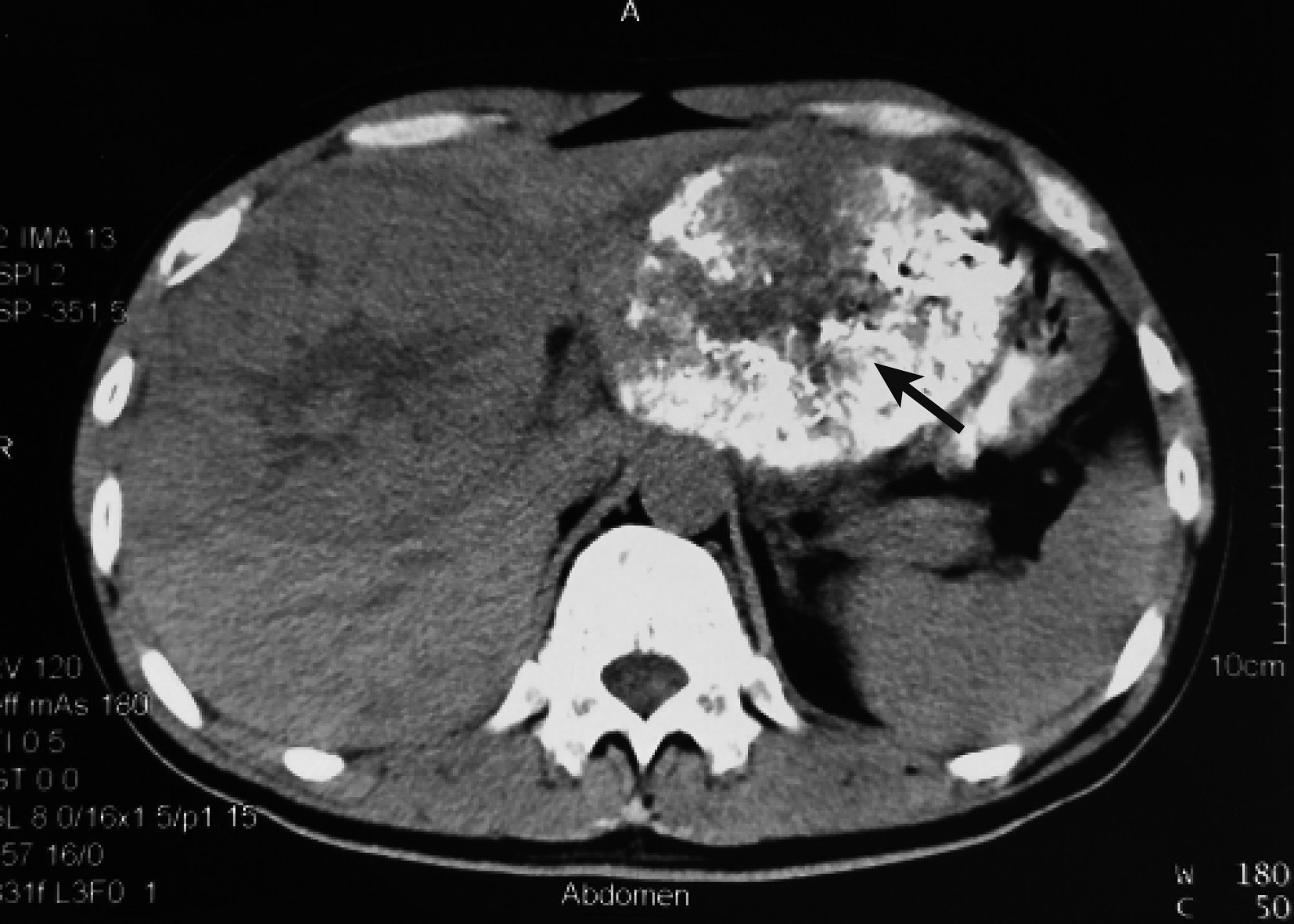
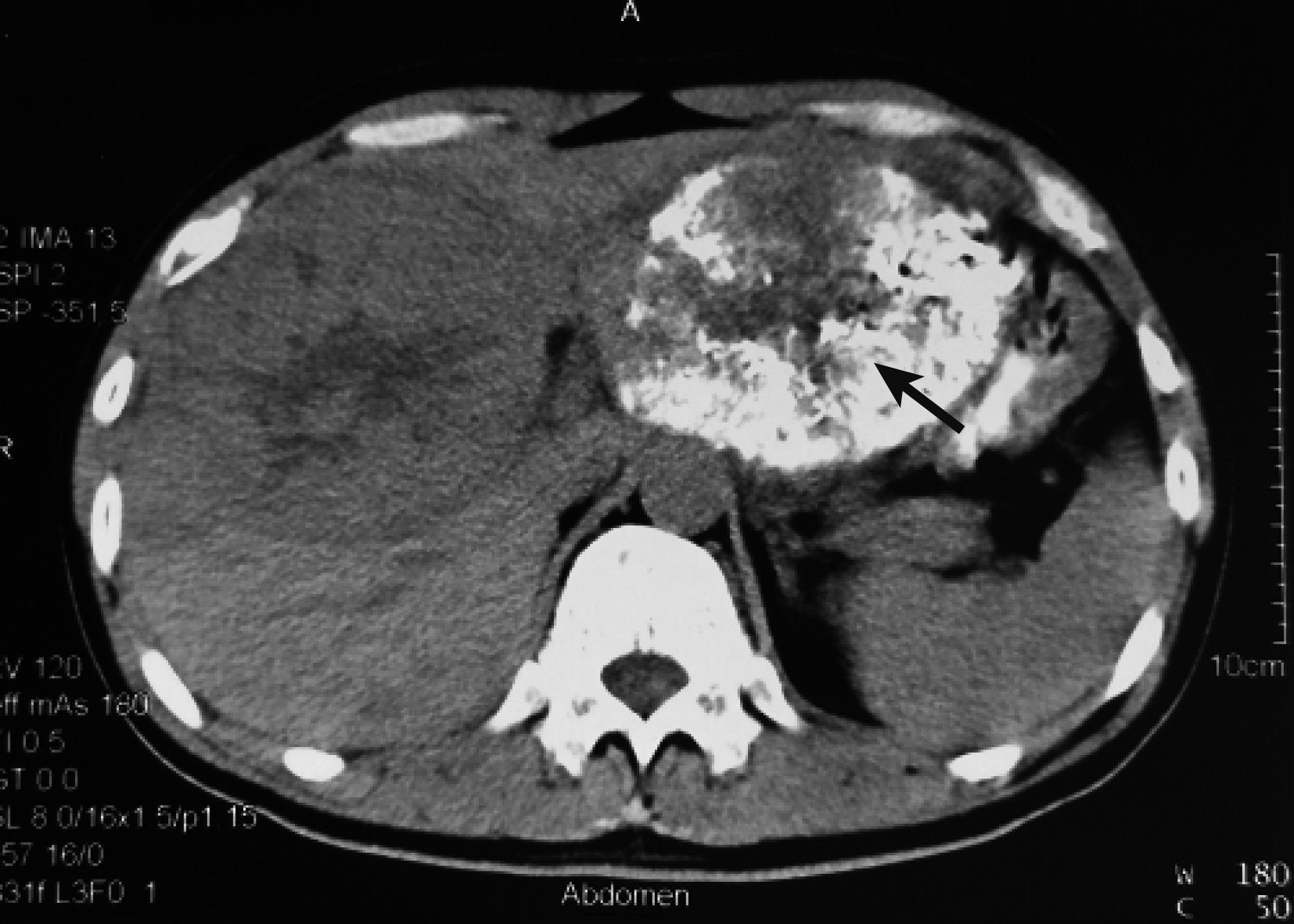 圖2
示第 1 次TACE超選栓塞左肝腫瘤后 1 個月CT掃描結果 見左肝腫瘤為栓塞劑填塞,體積較初次就診時縮小(黑箭)
圖2
示第 1 次TACE超選栓塞左肝腫瘤后 1 個月CT掃描結果 見左肝腫瘤為栓塞劑填塞,體積較初次就診時縮小(黑箭)
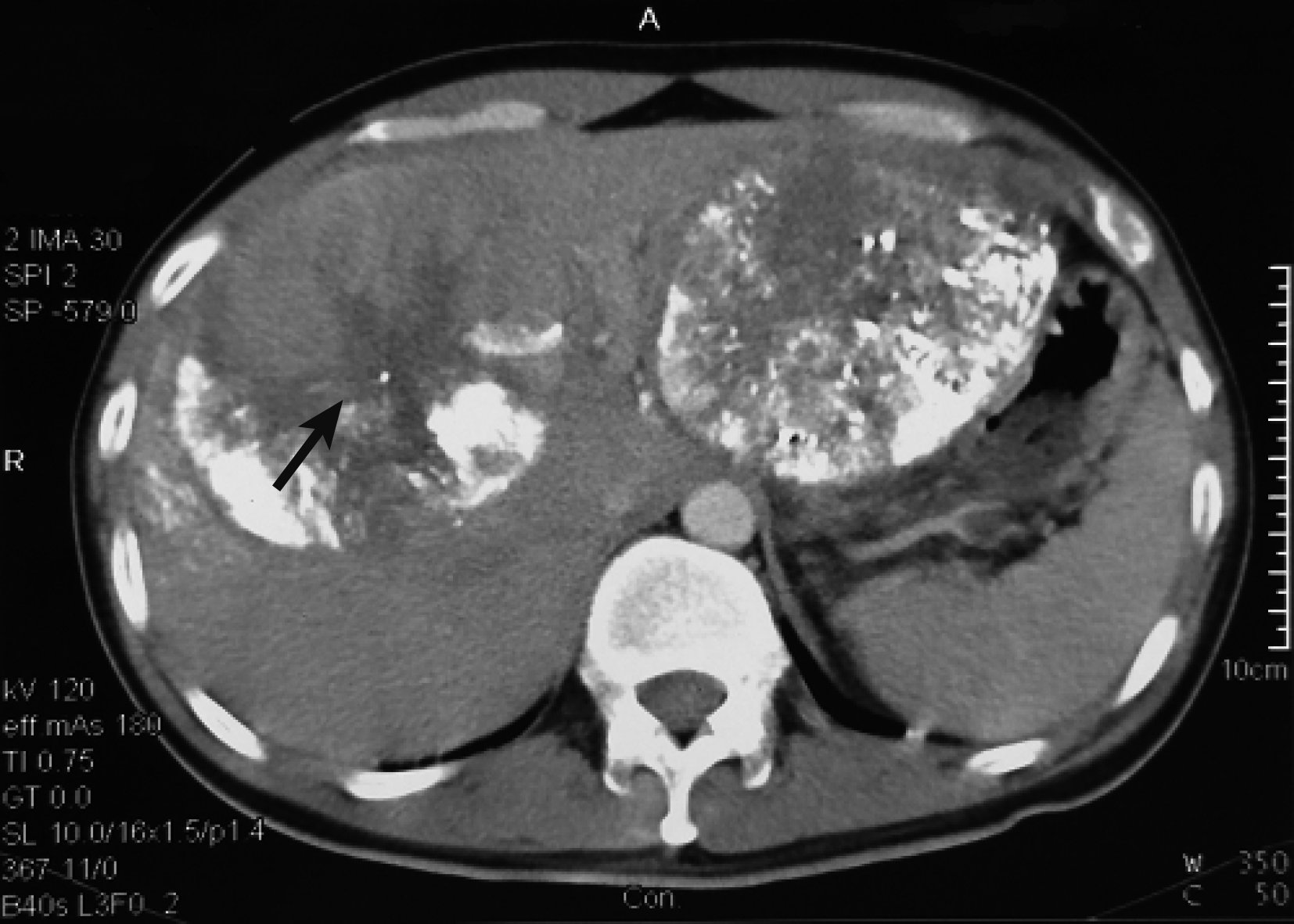
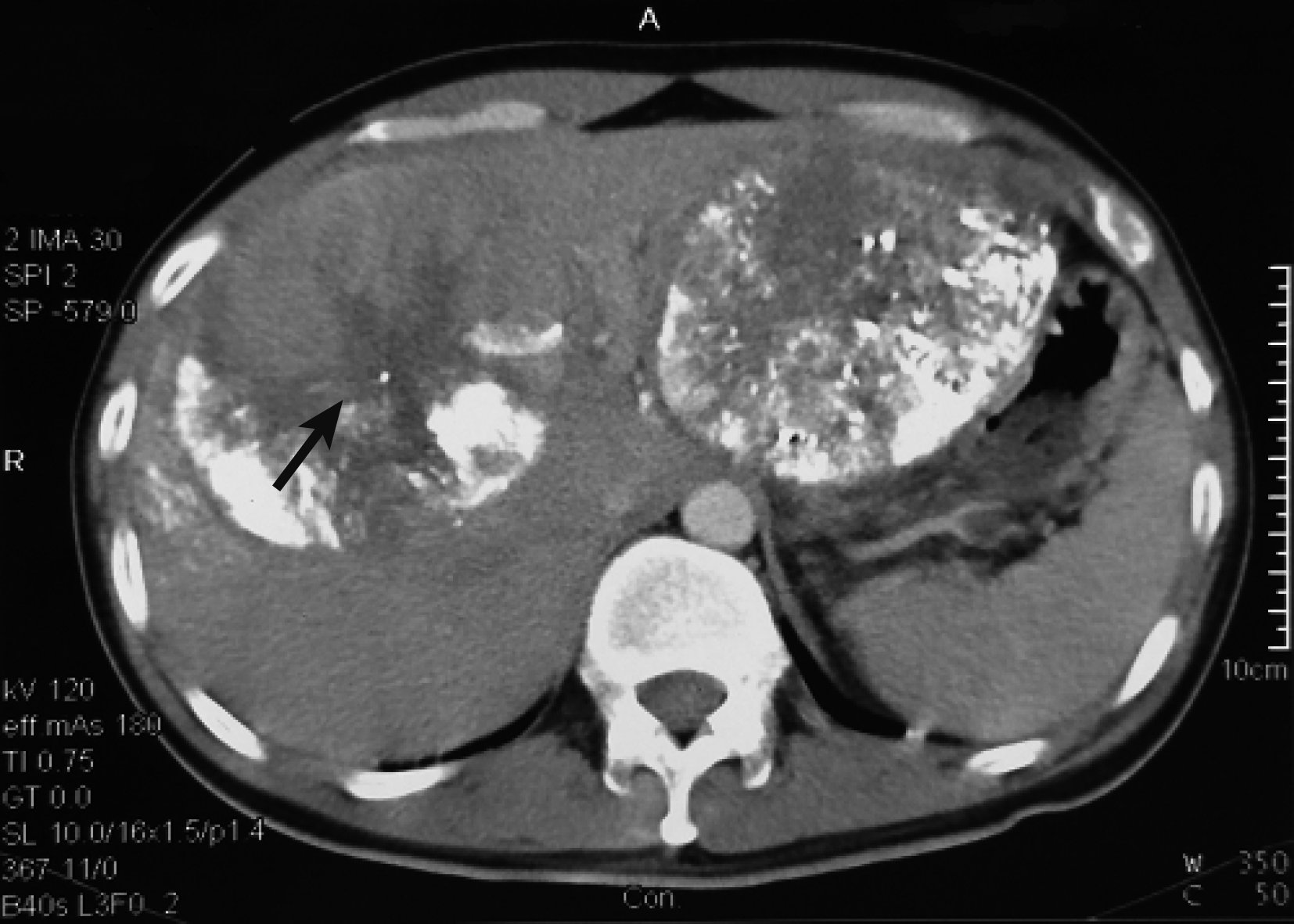 圖3
示第 2 次TACE栓塞右肝腫瘤后 1 個月CT掃描結果見右肝腫瘤縮小(黑箭),健肝體積增大
圖3
示第 2 次TACE栓塞右肝腫瘤后 1 個月CT掃描結果見右肝腫瘤縮小(黑箭),健肝體積增大
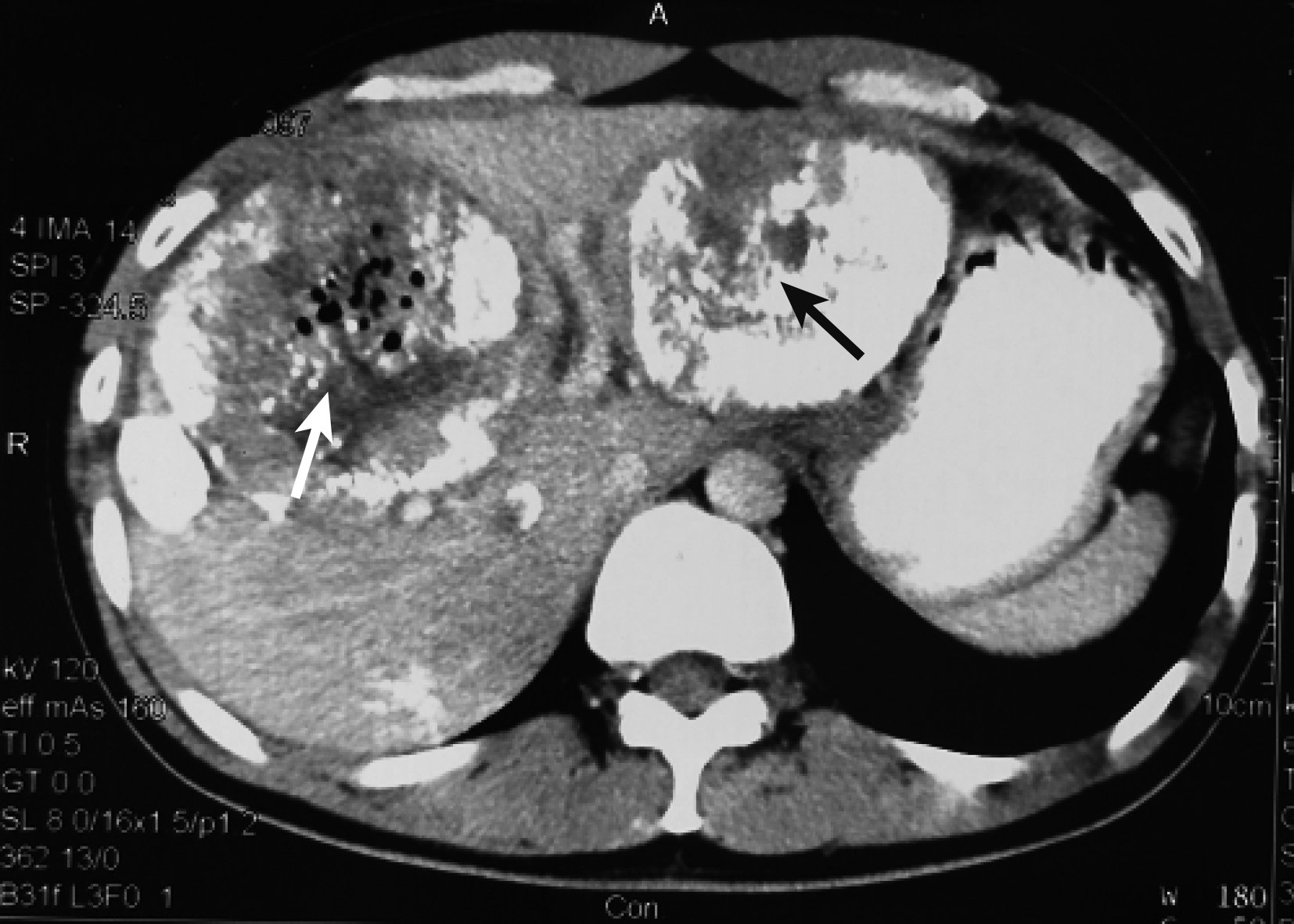
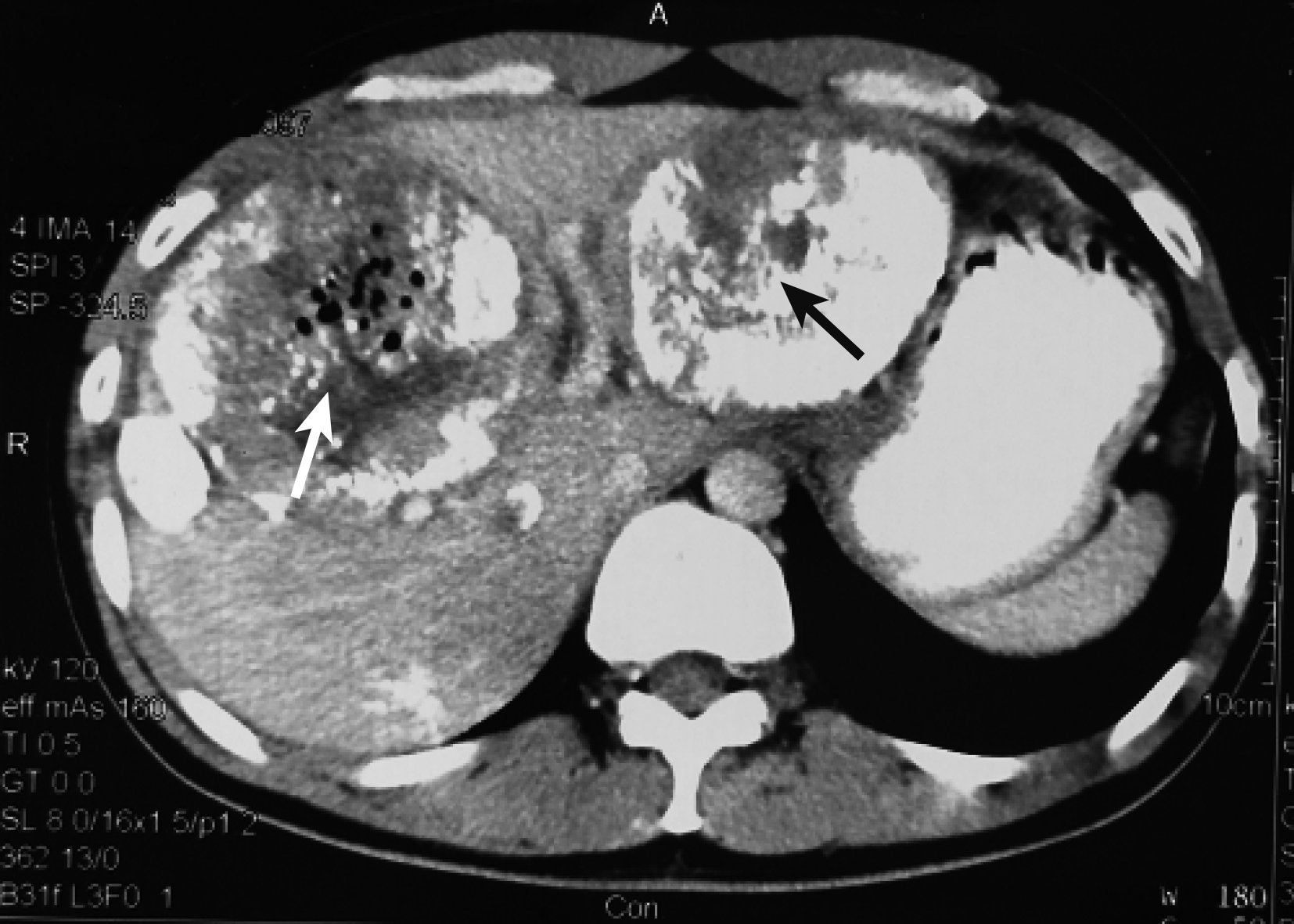 圖4
示第 3 次TACE栓塞左、右肝腫瘤后 1 個月CT掃描結果 見左(黑箭)、右(白箭)肝腫瘤體積均明顯縮小,健肝增大
圖4
示第 3 次TACE栓塞左、右肝腫瘤后 1 個月CT掃描結果 見左(黑箭)、右(白箭)肝腫瘤體積均明顯縮小,健肝增大
1.2.2 第 2 次MDT 第 3 次TACE術后 1 個月,召集行第 2 次MDT。復查情況:CT掃描(圖 4)示腫瘤體積明顯縮小(左肝腫瘤由615 mL降至301 mL,右肝腫瘤由661 mL降至402 mL),健肝體積增大(由905 mL增至1 180 mL)。AFP 345 μg/L,肝功Child A級,ICGR15為9.8%,HBV-DNA<1.0E3 IU/mL。MDT結論:經過抗病毒治療及多次TACE后,腫瘤體積明顯縮小,ICGR15顯示肝臟儲備功能增強,可耐受手術,擬手術切除腫瘤;術中行超聲造影檢查,對衛星病灶術中行微波消融治療。在第 3 次TACE術后 1 個月,即初次入院后 4 個月手術治療。術中見:腹腔內無腹水,肝臟呈小結節性肝硬變改變;肝左葉見約8 cm×8 cm×8 cm大腫瘤,與膈肌和胃致密粘連;門靜脈左支侵犯;右肝SⅤ、Ⅶ及Ⅷ段有一12 cm×10 cm×10 cm大腫瘤,其周圍可觸及 3 個直徑為 1~2 cm的小結節,經術中超聲造影證實為衛星病灶。肝門部有直徑為1.5 cm淋巴結,冰凍病理學檢查未見癌。手術方式:左半肝切除+右肝腫瘤切除+膽囊切除+術中肝多發腫瘤微波消融術。術后病理學檢查證實為低分化HCC (T3bN0M0, ⅢB期,UICC /AJCC)。術后第13天出院,患者術后恢復良好。
1.2.3 第 3 次MDT(術后 7 個月) 患者一般情況可,腫瘤已切除及消融,術后 6 個月CT復查未見異常,但同期超聲造影復查發現有 3 個直徑為0.5~2 cm的周圍衛星病灶存在。MDT結論:再次行TACE治療,聯合131I 美妥昔單抗(2.77×107Bq/kg,成都華神),對小病灶再次行微波消融治療。
1.3 結果
患者距初次治療目前已生存 5 年有余,多次增強CT、增強MRI及超聲造影交替復查未見腫瘤殘留及新生腫瘤(圖 5)。AFP 18.6 μg/L,肝功Child A級,HBV DNA<1.0E3 IU/mL。生活質量良好,完全恢復正常工作,目前仍在隨訪中。
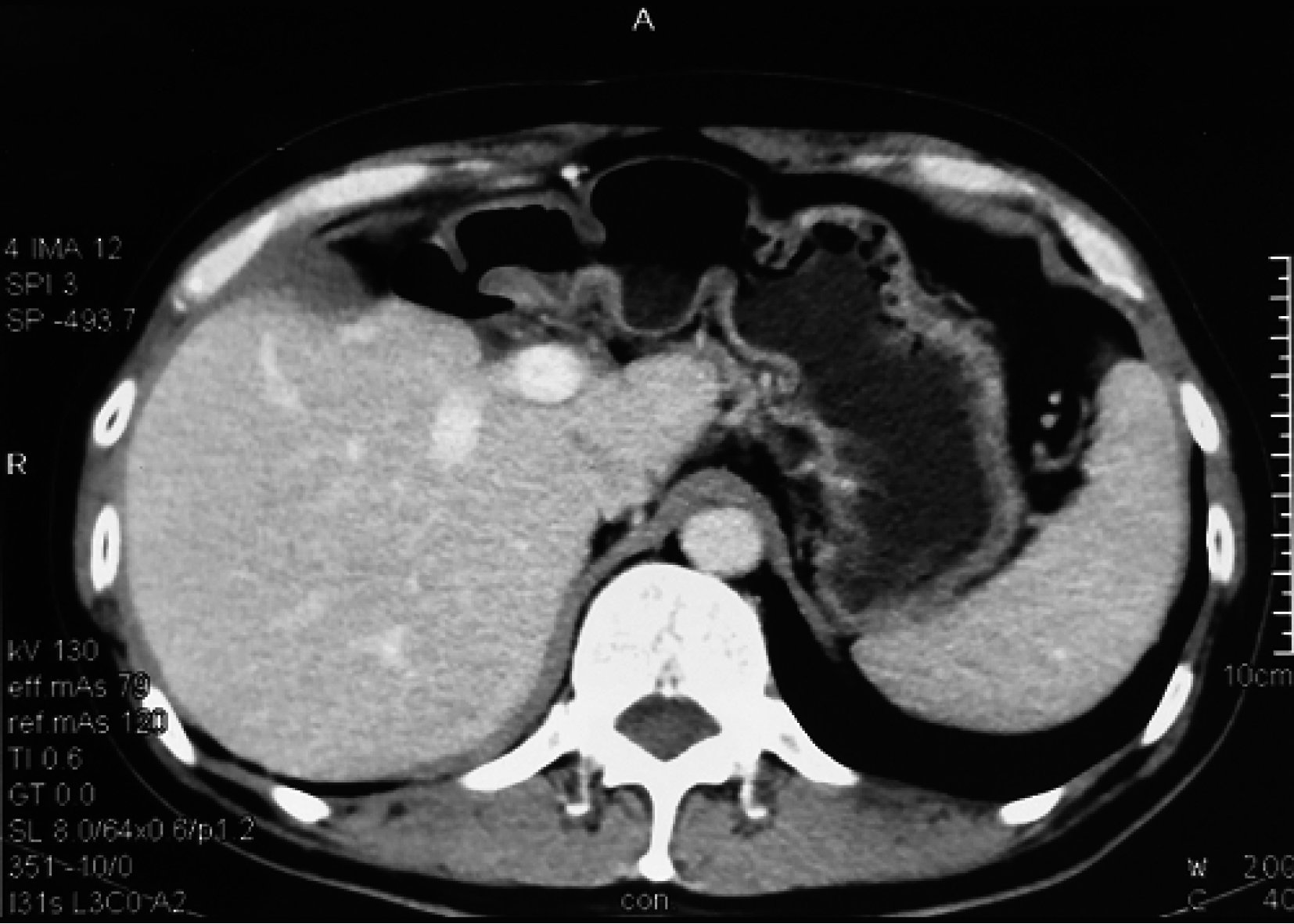 圖5
示治療后 5 年CT復查情況 肝臟未見殘余及新生腫瘤
圖5
示治療后 5 年CT復查情況 肝臟未見殘余及新生腫瘤
2 討論
2.1 MDT在HCC診療中的地位與作用
20世紀90 年代美國率先提出了MDT概念。腫瘤診療MDT符合循證醫學的診療理念[7],隨著科學技術的進步和人們對實體腫瘤的認識,MDT已成為國外治療腫瘤的新趨勢[8]。在英國[9],MDT已成為新入院腫瘤患者的必須程序之一。
目前,我國多數醫院仍采用以治療手段來分科,導致患者分散就醫,相關學科協同少,單一手段多。近30年來的臨床實踐證明,單一的肝切除術治療HCC已經走到極限,隨著手術技術的提高,5 年生存率并未提高。我們認為,MDT能有效地利用和組合醫療資源,最大程度地發揮各學科優勢,各學科相互融合,在技術、治療方法和治療理念上達成共識,可提高疾病的治療效果[10-12]。
本MDT病例是 1 例晚期HCC患者,在外院被認為已無治療價值。經MDT討論后初始評估認為腫瘤過大,且肝功能不佳,無法手術切除,也不適合肝移植。在經過正規的抗病毒及保肝治療后,病毒載量獲得有效控制,肝功能好轉,經 3 次TACE治療后腫瘤縮小,降期(down-stage)治療有效,贏得了手術切除腫瘤的機會;對于較小衛星病灶,微波消融也獲得良好效果。術后腫瘤復發被早期發現,采取了TACE聯合131I 美妥西單抗、微波消融等多種治療手段,最終達到長期無瘤生存的良好效果。筆者認為,在MDT機制下,采用多種手段綜合治療,制定個體化的治療方案與臨床路徑,患者生存獲益于此。
2.2 重視抗病毒治療在HCC治療中的作用
有研究[13]發現,經抗病毒治療,抑制HBV DNA復制,降低病毒載量,HCC的發生率將明顯低于未行抗病毒治療組。因高載量HBV DNA可導致肝臟炎癥反應加重,肝臟耐受手術打擊的能力下降,即使殘肝容量足夠,術后肝功能衰竭發生率也可能增高[14]。在藥物的選擇上,拉米夫定和替比夫定的耐藥率較高,阿德福韋抗病毒效果相對較差,HBV DNA轉陰率低,且有腎毒性; 而恩替卡韋和替諾福韋均屬速效、低耐藥性藥物,已被歐美肝病協會推薦為一線用藥。我國肝炎指南將上述4 種藥物均定為一線藥物,但推薦使用恩替卡韋[15]。本病例為乙肝病毒活動性感染,采用了恩替卡韋聯合抗乙肝免疫球蛋白,1 周后HBV DNA降到低水平,提高了TACE或手術治療的安全性,這也符合損傷控制理論(second-hit control)。
2.3 局部治療和手術治療聯合是取得療效的關鍵
外科手術肝切除是目前治療HCC的主要手段[16]。但因HCC早期癥狀不明顯,大多數患者確診較晚,僅少部分患者能接受肝切除手術。可切除的大肝癌或巨大肝癌術后5 年存活率僅為26.2%~38.7%[17-18]。不能切除晚期HCC的中位生存期僅有1~2個月。隨著局部治療和全身治療技術的進步,HCC降期治療變得可行。腫瘤降期治療(tumour down-staging)是通過姑息性的局部、全身或綜合治療,使HCC的分期降至相對早期(包括縮小肝癌體積、消除主體癌灶外的小癌灶和主門靜脈腫瘤栓塞、非腫瘤肝臟部分增生等),將降期前不可切除的HCC變為可切除。微波消融對直徑< 5.0 cm的肝癌療效較明確[19],TACE聯合消融治療可取得較好的降期效果[20-21]。有研究[22]認為,通過降期治療,8%~18%的患者可獲得降期后切除,5 年存活率為25%~57%。這將給晚期HCC患者帶來長期存活的希望[23]。
該例患者我們通過與放射介入科及核醫學科醫生共同制定方案,經3次TACE治療及全身綜合治療后,腫瘤體積明顯縮小,且健肝體積增大,肝功能好轉,成功達到降期目的,為后續的手術提供了安全保障。但降期后HCC細胞不會完全壞死,將會再生長;在HCC再增大或轉移前,僅有一段短的窗口期可進行肝切除手術治療[24]。
2.4 探索新的治療手段
該患者治療中我們使用了131I 美妥西單抗,這是我國自主研發的放射免疫治療藥物,美妥西單抗能與腫瘤細胞表面的CD147 分子特異性結合,131I 釋放的β射線能夠對腫瘤起到特異性的殺傷作用[25]。有研究[26]顯示,131I 美妥西單抗聯合TACE治療較單純TACE治療能夠顯著延長原發性HCC患者的生存時間。劉連新等[27]認為,三氧化二砷是一種低毒、有效的治療藥物,對于不能手術的原發性HCC患者有很好的效果,超選擇性肝動脈置管,連續區域化療是最佳的給藥方法。131I 美妥西單抗和三氧化二砷在HCC治療中的作用尚缺乏大規模的隨機對照試驗,但是應用是安全的,對于有條件的患者可以使用。
2.5 重視HCC術后規范化的隨訪
HCC治療后的影像學復查手段多樣,腹部彩超、增強CT、增強MRI、超聲造影等均在應用。由于檢查的原理不一樣而各有優缺點。有研究[28]認為,超聲造影對HCC的診斷性能優于增強CT,主要因兩種檢查方式的成像時間有差異:超聲造影為實時成像,而增強CT的掃描時間短,在確定病灶的退出時間方面會產生誤差。該例患者在復查時是超聲造影發現被CT掃描忽略了的小病灶,而得以及時治療。由此提示我們,復查手段的交叉應用,可早期發現小病灶,多學科的診斷手段也會給治療帶來獲益。
綜上,通過多學科的協作,制定個體化的方案,適時采取合理的、安全的治療手段,才能提高HCC的治療效果,從而使患者的生存獲益。筆者所在醫療組已對多例晚期HCC采用了MDT治療,仍在進一步的觀察之中。此報道病例已長期存活(>5年)。因此我們認為,將晚期HCC變成慢性疾病有可能性。我國乙肝、HCC的發病率高,積極開展MDT模式,進一步探索治療HCC的新途徑和新方法具有廣泛的現實意義。
肝細胞肝癌(HCC)病死率高居惡性腫瘤死因的第2位,全球每年近80萬人死于HCC[1],我國每年HCC發病率及病死率均占全球50%以上。因其起病隱匿,初期癥狀不明顯,又缺乏針對HCC高危人群的篩查制度,患者就診時多屬晚期,僅20%~30%有機會接受手術切除或肝移植治療[2-3]。肝切除治療HCC已有70多年的歷史,單一的治療手段效果差,生存期短。筆者所在醫院2010年建立了多學科診療(MDT)HCC的臨床路徑,擬提高HCC患者術后的生存期,已實施多例,現將一例晚期HCC患者無瘤生存5年的初步結果報道如下。
1 臨床資料
1.1 一般資料
患者,男,37歲,初次就診時間2010-09-28;主訴劍突下脹痛 1+月由外院轉入筆者所在醫院。患者既往有慢性乙肝病史10+年,未規范治療及隨訪復查。否認丙肝、黑便、嘔血史。入院評估體質量指數(body mass index,BMI)為21.9 kg /m2,營養風險評分[4]為 1 分,日常生活能力(activities of daily living,ADL) 評級[5]為Ⅰ級,體力狀態評分參照美國東部腫瘤協作組(Eastern Cooperative Oncology Group score standard,ECOG)評分標準[6]評分為 0 分。查體示生命體征平穩,皮膚鞏膜無黃染,全身淺表淋巴結未觸及明顯腫大,心肺無特殊;右肋下及劍突下3 cm可觸及質硬腫物,不可推動。腹壁靜脈無怒張,脾臟未觸及。實驗室檢查:HBsAg(+),HBeAg(+),HBcAb(+),Pre-S1Ag(+);HBV-DNA 5.1E3 IU/mL;ALT 108 U/L,AST 112 U/L,PT、ALB及TBIL正常,肝功能分級為Child A級;吲哚菁綠試驗15 min滯留率(indocyanine green retention rate test for 15 minutes,ICGR15)為22.4%(日本光電DDG-3300K); 血清AFP>2 000 μg/L(化學發光分析法)。肝臟超聲造影檢查顯示:肝臟多發腫瘤性占位伴多發衛星灶。胸腹部增強CT(圖 1)顯示:雙肺正常;左肝及右肝前葉見多發占位,最大直徑約16 cm,呈典型快進快出表現,考慮HCC伴肝內轉移,門靜脈左支受侵犯。腫瘤體積/全肝體積為1 270 mL/2 209 mL=57.4%。
 圖1
示初次就診時CT掃描結果 a:第 2 肝門幾乎為腫瘤占據(黑箭); b:腫瘤最大截面約16 cm2(黑箭)
圖1
示初次就診時CT掃描結果 a:第 2 肝門幾乎為腫瘤占據(黑箭); b:腫瘤最大截面約16 cm2(黑箭)
1.2 臨床路徑
1.2.1 第 1 次MDT 召集肝膽外科、感染科、腫瘤科、放射科、放射介入科、超聲介入科及核醫學科進行第 1 次MDT,討論后診斷:①原發性HCC(T3NXMX);②慢性乙型肝炎活動期。治療方案:①基礎治療。立即開始抗病毒治療,藥物選用恩替卡韋(0.5 mg,1 次/d,中美施貴寶),聯合抗乙肝免疫球蛋白(200 U,肌肉注射),治療 1 周后復查HBV-DNA<1.0E3 IU/mL,AST 62 U/L,ALT 53 U/L; 胸腺五肽(10 mg,皮下注射,1 次/d,武漢華龍生物) 調節免疫,三氧化二砷注射液系統化療及護肝治療(10 mg,靜脈滴注,1 次/d,北京雙鷺)。②分次、分部位行經皮肝動脈化療栓塞術(percutaneous hepatic arterial chemoem-bolization,TACE)。復查時根據碘油沉積情況及腫瘤反應決定TACE治療次數及是否手術切除腫瘤。TACE方案:奧沙利鉑+5-FU+絲裂霉素+三氧化二砷+超液化碘油+明膠海綿微粒(杭州艾力康醫藥)。復查CT結果顯示,分次TACE后碘油沉積良好,腫瘤體積縮小(圖 2–圖 4)。
 圖2
示第 1 次TACE超選栓塞左肝腫瘤后 1 個月CT掃描結果 見左肝腫瘤為栓塞劑填塞,體積較初次就診時縮小(黑箭)
圖2
示第 1 次TACE超選栓塞左肝腫瘤后 1 個月CT掃描結果 見左肝腫瘤為栓塞劑填塞,體積較初次就診時縮小(黑箭)
 圖3
示第 2 次TACE栓塞右肝腫瘤后 1 個月CT掃描結果見右肝腫瘤縮小(黑箭),健肝體積增大
圖3
示第 2 次TACE栓塞右肝腫瘤后 1 個月CT掃描結果見右肝腫瘤縮小(黑箭),健肝體積增大
 圖4
示第 3 次TACE栓塞左、右肝腫瘤后 1 個月CT掃描結果 見左(黑箭)、右(白箭)肝腫瘤體積均明顯縮小,健肝增大
圖4
示第 3 次TACE栓塞左、右肝腫瘤后 1 個月CT掃描結果 見左(黑箭)、右(白箭)肝腫瘤體積均明顯縮小,健肝增大
1.2.2 第 2 次MDT 第 3 次TACE術后 1 個月,召集行第 2 次MDT。復查情況:CT掃描(圖 4)示腫瘤體積明顯縮小(左肝腫瘤由615 mL降至301 mL,右肝腫瘤由661 mL降至402 mL),健肝體積增大(由905 mL增至1 180 mL)。AFP 345 μg/L,肝功Child A級,ICGR15為9.8%,HBV-DNA<1.0E3 IU/mL。MDT結論:經過抗病毒治療及多次TACE后,腫瘤體積明顯縮小,ICGR15顯示肝臟儲備功能增強,可耐受手術,擬手術切除腫瘤;術中行超聲造影檢查,對衛星病灶術中行微波消融治療。在第 3 次TACE術后 1 個月,即初次入院后 4 個月手術治療。術中見:腹腔內無腹水,肝臟呈小結節性肝硬變改變;肝左葉見約8 cm×8 cm×8 cm大腫瘤,與膈肌和胃致密粘連;門靜脈左支侵犯;右肝SⅤ、Ⅶ及Ⅷ段有一12 cm×10 cm×10 cm大腫瘤,其周圍可觸及 3 個直徑為 1~2 cm的小結節,經術中超聲造影證實為衛星病灶。肝門部有直徑為1.5 cm淋巴結,冰凍病理學檢查未見癌。手術方式:左半肝切除+右肝腫瘤切除+膽囊切除+術中肝多發腫瘤微波消融術。術后病理學檢查證實為低分化HCC (T3bN0M0, ⅢB期,UICC /AJCC)。術后第13天出院,患者術后恢復良好。
1.2.3 第 3 次MDT(術后 7 個月) 患者一般情況可,腫瘤已切除及消融,術后 6 個月CT復查未見異常,但同期超聲造影復查發現有 3 個直徑為0.5~2 cm的周圍衛星病灶存在。MDT結論:再次行TACE治療,聯合131I 美妥昔單抗(2.77×107Bq/kg,成都華神),對小病灶再次行微波消融治療。
1.3 結果
患者距初次治療目前已生存 5 年有余,多次增強CT、增強MRI及超聲造影交替復查未見腫瘤殘留及新生腫瘤(圖 5)。AFP 18.6 μg/L,肝功Child A級,HBV DNA<1.0E3 IU/mL。生活質量良好,完全恢復正常工作,目前仍在隨訪中。
 圖5
示治療后 5 年CT復查情況 肝臟未見殘余及新生腫瘤
圖5
示治療后 5 年CT復查情況 肝臟未見殘余及新生腫瘤
2 討論
2.1 MDT在HCC診療中的地位與作用
20世紀90 年代美國率先提出了MDT概念。腫瘤診療MDT符合循證醫學的診療理念[7],隨著科學技術的進步和人們對實體腫瘤的認識,MDT已成為國外治療腫瘤的新趨勢[8]。在英國[9],MDT已成為新入院腫瘤患者的必須程序之一。
目前,我國多數醫院仍采用以治療手段來分科,導致患者分散就醫,相關學科協同少,單一手段多。近30年來的臨床實踐證明,單一的肝切除術治療HCC已經走到極限,隨著手術技術的提高,5 年生存率并未提高。我們認為,MDT能有效地利用和組合醫療資源,最大程度地發揮各學科優勢,各學科相互融合,在技術、治療方法和治療理念上達成共識,可提高疾病的治療效果[10-12]。
本MDT病例是 1 例晚期HCC患者,在外院被認為已無治療價值。經MDT討論后初始評估認為腫瘤過大,且肝功能不佳,無法手術切除,也不適合肝移植。在經過正規的抗病毒及保肝治療后,病毒載量獲得有效控制,肝功能好轉,經 3 次TACE治療后腫瘤縮小,降期(down-stage)治療有效,贏得了手術切除腫瘤的機會;對于較小衛星病灶,微波消融也獲得良好效果。術后腫瘤復發被早期發現,采取了TACE聯合131I 美妥西單抗、微波消融等多種治療手段,最終達到長期無瘤生存的良好效果。筆者認為,在MDT機制下,采用多種手段綜合治療,制定個體化的治療方案與臨床路徑,患者生存獲益于此。
2.2 重視抗病毒治療在HCC治療中的作用
有研究[13]發現,經抗病毒治療,抑制HBV DNA復制,降低病毒載量,HCC的發生率將明顯低于未行抗病毒治療組。因高載量HBV DNA可導致肝臟炎癥反應加重,肝臟耐受手術打擊的能力下降,即使殘肝容量足夠,術后肝功能衰竭發生率也可能增高[14]。在藥物的選擇上,拉米夫定和替比夫定的耐藥率較高,阿德福韋抗病毒效果相對較差,HBV DNA轉陰率低,且有腎毒性; 而恩替卡韋和替諾福韋均屬速效、低耐藥性藥物,已被歐美肝病協會推薦為一線用藥。我國肝炎指南將上述4 種藥物均定為一線藥物,但推薦使用恩替卡韋[15]。本病例為乙肝病毒活動性感染,采用了恩替卡韋聯合抗乙肝免疫球蛋白,1 周后HBV DNA降到低水平,提高了TACE或手術治療的安全性,這也符合損傷控制理論(second-hit control)。
2.3 局部治療和手術治療聯合是取得療效的關鍵
外科手術肝切除是目前治療HCC的主要手段[16]。但因HCC早期癥狀不明顯,大多數患者確診較晚,僅少部分患者能接受肝切除手術。可切除的大肝癌或巨大肝癌術后5 年存活率僅為26.2%~38.7%[17-18]。不能切除晚期HCC的中位生存期僅有1~2個月。隨著局部治療和全身治療技術的進步,HCC降期治療變得可行。腫瘤降期治療(tumour down-staging)是通過姑息性的局部、全身或綜合治療,使HCC的分期降至相對早期(包括縮小肝癌體積、消除主體癌灶外的小癌灶和主門靜脈腫瘤栓塞、非腫瘤肝臟部分增生等),將降期前不可切除的HCC變為可切除。微波消融對直徑< 5.0 cm的肝癌療效較明確[19],TACE聯合消融治療可取得較好的降期效果[20-21]。有研究[22]認為,通過降期治療,8%~18%的患者可獲得降期后切除,5 年存活率為25%~57%。這將給晚期HCC患者帶來長期存活的希望[23]。
該例患者我們通過與放射介入科及核醫學科醫生共同制定方案,經3次TACE治療及全身綜合治療后,腫瘤體積明顯縮小,且健肝體積增大,肝功能好轉,成功達到降期目的,為后續的手術提供了安全保障。但降期后HCC細胞不會完全壞死,將會再生長;在HCC再增大或轉移前,僅有一段短的窗口期可進行肝切除手術治療[24]。
2.4 探索新的治療手段
該患者治療中我們使用了131I 美妥西單抗,這是我國自主研發的放射免疫治療藥物,美妥西單抗能與腫瘤細胞表面的CD147 分子特異性結合,131I 釋放的β射線能夠對腫瘤起到特異性的殺傷作用[25]。有研究[26]顯示,131I 美妥西單抗聯合TACE治療較單純TACE治療能夠顯著延長原發性HCC患者的生存時間。劉連新等[27]認為,三氧化二砷是一種低毒、有效的治療藥物,對于不能手術的原發性HCC患者有很好的效果,超選擇性肝動脈置管,連續區域化療是最佳的給藥方法。131I 美妥西單抗和三氧化二砷在HCC治療中的作用尚缺乏大規模的隨機對照試驗,但是應用是安全的,對于有條件的患者可以使用。
2.5 重視HCC術后規范化的隨訪
HCC治療后的影像學復查手段多樣,腹部彩超、增強CT、增強MRI、超聲造影等均在應用。由于檢查的原理不一樣而各有優缺點。有研究[28]認為,超聲造影對HCC的診斷性能優于增強CT,主要因兩種檢查方式的成像時間有差異:超聲造影為實時成像,而增強CT的掃描時間短,在確定病灶的退出時間方面會產生誤差。該例患者在復查時是超聲造影發現被CT掃描忽略了的小病灶,而得以及時治療。由此提示我們,復查手段的交叉應用,可早期發現小病灶,多學科的診斷手段也會給治療帶來獲益。
綜上,通過多學科的協作,制定個體化的方案,適時采取合理的、安全的治療手段,才能提高HCC的治療效果,從而使患者的生存獲益。筆者所在醫療組已對多例晚期HCC采用了MDT治療,仍在進一步的觀察之中。此報道病例已長期存活(>5年)。因此我們認為,將晚期HCC變成慢性疾病有可能性。我國乙肝、HCC的發病率高,積極開展MDT模式,進一步探索治療HCC的新途徑和新方法具有廣泛的現實意義。