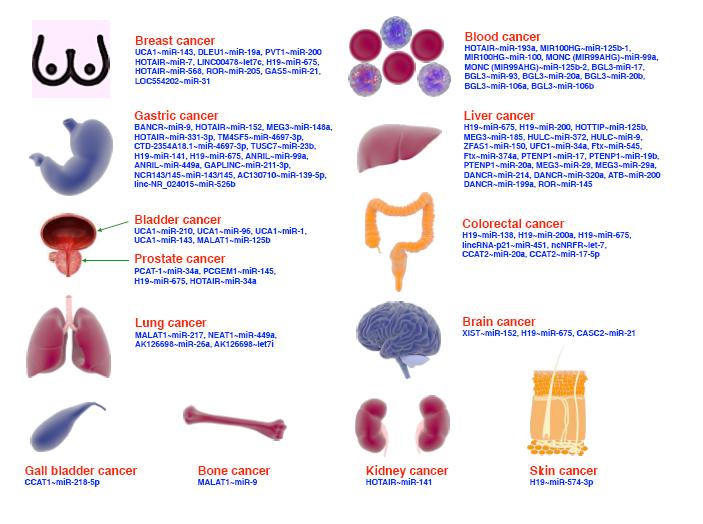
At the end of 2022, the National Medical Products Administration (NMPA), in conjunction with the National Cancer Center, Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College raised for the first time the important issue of clinical research globally: whether the source of the death time of clinical trials based on the simple follow-up records is credible, and proposed a consensus document on the source of the death time of clinical trials. The results were published in The Lancet Regional Health-Western Pacific, which attracted wide attention and recognition from the international industry. This is the first time that the China consensus on quality standards for clinical research has been ahead of the U.S. Food and Drug Administration and other international colleagues. The NMPA has been leading China in promoting the scientific development of clinical research, so as to constantly establish and improve the scientific regulatory system and ecological system, and promote China's full integration into the global pharmaceutical research and development system. China clinical research institutions and the whole industry are also gradually from standardized development to scientific development, high-quality development process. In this study, we summarized the scientific and subject-oriented development of China clinical research industry in recent years, and continuously strengthened the international competitiveness of China pharmaceutical industry. It is suggested that scientific thinking model should be used to deal with the normative problems in clinical research and promote the development of medical model to scientific model.
Citation: YU Anqi, LENG Ye, HUANG Huiyao, TANG Yu. Scientific supervision and subject-oriented development of China clinical research. Chinese Journal of Clinical Thoracic and Cardiovascular Surgery, 2023, 30(10): 1384-1389. doi: 10.7507/1007-4848.202302066 Copy
Copyright ? the editorial department of Chinese Journal of Clinical Thoracic and Cardiovascular Surgery of West China Medical Publisher. All rights reserved