引用本文: 沈師, 陳明學, 高爽, 郭維民, 王振勇, 李浩江, 李旭, 張彬, 鮮海, 張學亮, 劉舒云, 郝立波, 卓乃強, 郭全義. 3D 打印制備聚己內酯/Ⅰ型膠原組織工程半月板支架及其理化特性的研究. 中國修復重建外科雜志, 2018, 32(9): 1205-1210. doi: 10.7507/1002-1892.201803074 復制
半月板損傷是一種常見的運動損傷,隨著參與體育鍛煉的人越來越多,半月板損傷發病率呈逐年上升趨勢。由于半月板特殊的解剖學結構[1],臨床治療半月板損傷以部分或全部切除為主[2]。半月板切除能短暫恢復功能和緩解癥狀,但明顯增加骨關節炎的患病風險[3-5]。組織工程的發展為半月板損傷的再生修復提供了新希望。組織工程的關鍵要素包括支架材料、種子細胞及生物因子[6-7],因此選擇合適的支架材料非常重要。大量研究表明,Ⅰ型膠原有利于軟骨細胞黏附、增殖和分化,且有利于軟骨細胞最終形成纖維軟骨[8-9]。聚己內酯(polycaprolactone,PCL)具有較好的力學特性,但生物相容性較差,細胞親和力較低。
與傳統支架制造技術相比,3D 打印技術具有良好的重復性和對支架微觀結構和形狀的控制[10]。此外,低溫沉積技術 3D 打印可以實現 PCL、Ⅰ型膠原溶液一體化打印,并且不會破壞Ⅰ型膠原蛋白。為此,本課題組提出采用低溫沉積技術 3D 打印構建 PCL/Ⅰ型膠原組織工程半月板支架(以下簡稱 PCL/Ⅰ型膠原半月板支架),以期提供既具有良好力學支撐,又有利于半月板細胞黏附、增殖及維持表型的支架材料。我們前期預實驗發現 15%PCL/4%Ⅰ型膠原溶液黏性最佳,本次實驗在此基礎上通過低溫沉積技術 3D 打印制備 PCL/Ⅰ型型膠原半月板支架,觀察支架形態、微觀結構、理化性能以及細胞毒性,為其體內研究奠定基礎。
1 材料與方法
1.1 主要試劑及儀器
成年新西蘭大白兔 1 只,體質量 2.5 kg;3~4 周齡新西蘭大白兔 3 只,體質量 0.5~0.6 kg,均購自中國人民解放軍總醫院實驗動物中心。PCL、牛跟腱Ⅰ型膠原、膠原酶、0.25% 胰蛋白酶(Sigma 公司,美國);六氟異丙醇、1,4-二氧六環[阿拉丁試劑(中國)有限公司];FBS(HyClone 公司,美國);DMEM 培養基(Corning 公司,美國);細胞計數試劑盒 8(cell counting kit 8,CCK-8)試劑盒(同仁公司,日本);鏈霉素-青霉素雙抗(GIBCO 公司,美國)。
冷凍干燥機(北京博醫康技術有限公司);計算機輔助設計軟件 UG(Siemens 公司,德國);3D 生物打印機(青島尤尼科技有限公司);S-4800 型掃描電鏡(Hitachi 公司,日本);BOSE 5100 生物力學試驗機(BOSE 公司,美國);傅氏轉換紅外線光譜分析儀(Ettlingen 公司,德國);Nuona SL-200B 滴狀分析系統(美國科諾工業有限公司);CO2 培養箱(Heraeus 公司,德國);Micro-CT(GE Healthcare 公司,英國)。
1.2 實驗方法
1.2.1 PCL/Ⅰ型膠原溶液以及 PCL 溶液的制備
根據預實驗結果,稱取 1.5 g PCL,分別加入 10 mL 含不同濃度(0、4%)Ⅰ型膠原的 1,4-二氧六環與六氟異丙醇(比例為 9∶1)溶液中,制備 15%PCL 溶液和 15% PCL/4% Ⅰ型膠原溶液。
1.2.2 PCL/Ⅰ型膠原半月板支架及 PCL 半月板支架的制備
取 1 只成年新西蘭大白兔,空氣栓塞處死后,取出內側半月板并行 CT 掃描,將獲得的半月板數據導入計算機輔助設計軟件中,設計放射狀與環形交叉的楔形取向性的半月板支架模型。然后,將半月板支架模型數據以 STL 格式導入 3D 打印控制軟件中;打印參數:平臺成型溫度–20℃,打印層厚 0.1 mm,打印速度 10 mm/s。
將 1.2.1 中制備的兩種溶液分別加入 3D 生物打印機料筒中進行打印,半月板支架初步成型后,依次行以下處理:–20℃ 冰柜保存 4 h,冷凍干燥,乙基二甲基胺丙基碳化二亞胺交聯,再次冷凍干燥,75% 乙醇浸泡 24 h,去離子水浸泡 10 次、每次 5 min,60Co 滅菌。PCL/Ⅰ型膠原半月板支架及 PCL 半月板支架均常溫下保存備用。
1.3 觀測指標
1.3.1 支架形態及微觀結構觀測
取兩種支架大體觀察其形態,然后冷凍干燥、噴金后,掃描電鏡觀察支架微觀結構(大孔直徑>200 μm、微孔直徑<100 μm)。
1.3.2 支架力學性能檢測
采用 BOSE 5100 生物力學試驗機進行力學測試。① 壓縮力學測試:將兩種支架樣本制備為 10 mm×10 mm×5 mm 柱狀體,PBS 緩沖液浸潤后進行壓縮力學測試。預壓縮 5%,壓縮速率為 5 mm/min,壓縮 20 個循環后進行正式測試,最大壓縮 20%,獲得應力-應變曲線,計算壓縮模量。② 拉伸力學測試:將兩種支架制備為 16 mm×10 mm×2 mm 的長方體,PBS 緩沖液浸潤后進行拉伸力學測試。預拉伸 5%,拉伸 20 個循環后進行正式測試,獲得應力-應變曲線,計算拉伸模量。
1.3.3 紅外光譜分析
取 1.2.1 中制備的 PCL 溶液、PCL/Ⅰ型膠原溶液,冷凍干燥后獲得與兩種支架成分相同的樣品。將樣品切成 10 mm×10 mm 的正方形片,以反射模式進行紅外光譜分析,掃描范圍為 650~4 000 cm–1,鑒定支架的官能團。
1.3.4 表面接觸角檢測
取 1.2.1 中制備的 PCL 溶液、PCL/Ⅰ型膠原溶液,冷凍干燥后獲得與兩種支架成分相同的樣品。用 27G 鈍針微注射器將去離子水滴至樣品表面,滴狀分析系統捕獲去離子水下落圖像。根據水滴形狀計算表面接觸角,實驗重復 5 次。
1.3.5 支架體外細胞毒性評估
① 兔半月板細胞分離培養:取 3~4 周齡新西蘭大白兔半月板組織,參照本課題組前期研究方法[11]分離培養半月板細胞,并傳代。取第 3 代細胞進行實驗。② 支架浸提液制備及 CCK-8 細胞毒性實驗:根據 ISO 10993-12:2009 標準,將兩種支架樣品分別浸入 DMEM 培養基中,支架浸提比為 3 cm2/mL,于(37±1)℃ 條件下溫育 72 h。然后取浸提液用 100 μm 膜過濾,于浸提液中加入 FBS 至濃度為 10%(V/V)、雙抗至濃度為 1%(V/V),獲得兩種支架的浸提液培養基。將半月板細胞接種至 96 孔板,每孔含 3×103 個細胞。每組有 5 個平行樣本,對應加入 100 μL 浸提液培養基,于 37℃、5% CO2 培養箱內培養 1、3、5 d 后,分別加入 10 μL CCK-8 試劑,繼續孵育 2.5 h 后,用酶標儀測量 450 nm 處的吸光度(A)值。以正常培養基培養細胞作為對照。
③ 支架-細胞復合物制備及掃描電鏡觀察:將 1.3.2 中兩種支架的力學標準件剪裁成 5 mm×5 mm×2 mm 大小,60Co 滅菌消毒。于半月板細胞中加入 DMEM 培養基,制備成濃度為 1×106 個/mL 的細胞懸液后,分別接種至兩種支架上,每個支架 100 μL。置于 37℃、5% CO2 培養箱孵育 3 h 后,加入 DMEM 培養液,繼續培養 1 d 后取出支架-細胞復合物,置于 2.5% 戊二醛固定 3 d,梯度乙醇脫水后,臨界點干燥,樣品噴金后,掃描電鏡觀察細胞在支架表面黏附及生長情況。
1.4 統計學方法
采用 SPSS17.0 統計軟件進行分析。數據以均數±標準差表示,兩組間比較采用獨立樣本 t 檢驗;多組間比較采用單因素方差分析,兩兩比較采用 Bonferroni 檢驗;檢驗水準 α=0.05。
2 結果
2.1 支架形態及微觀結構觀測
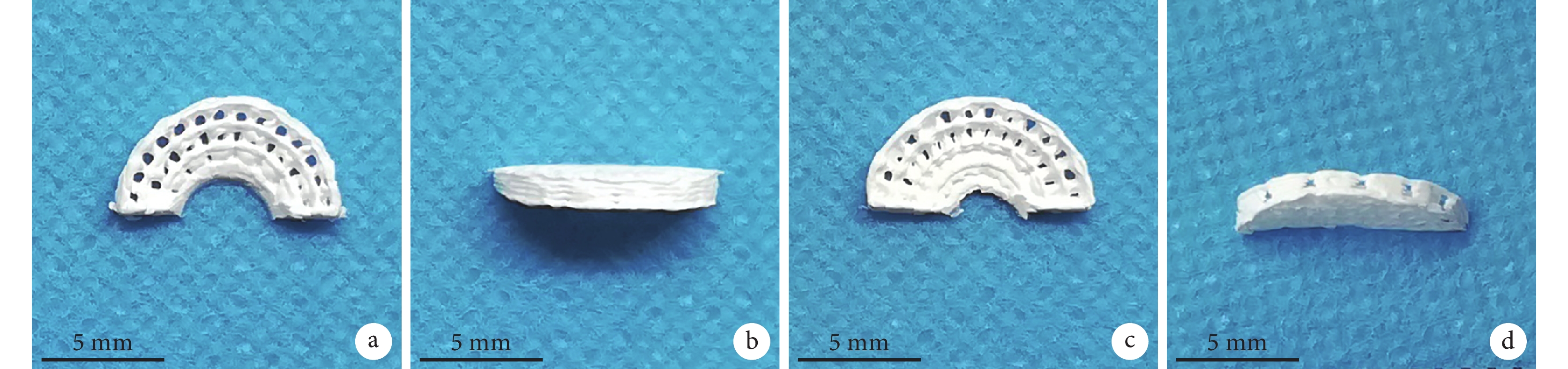
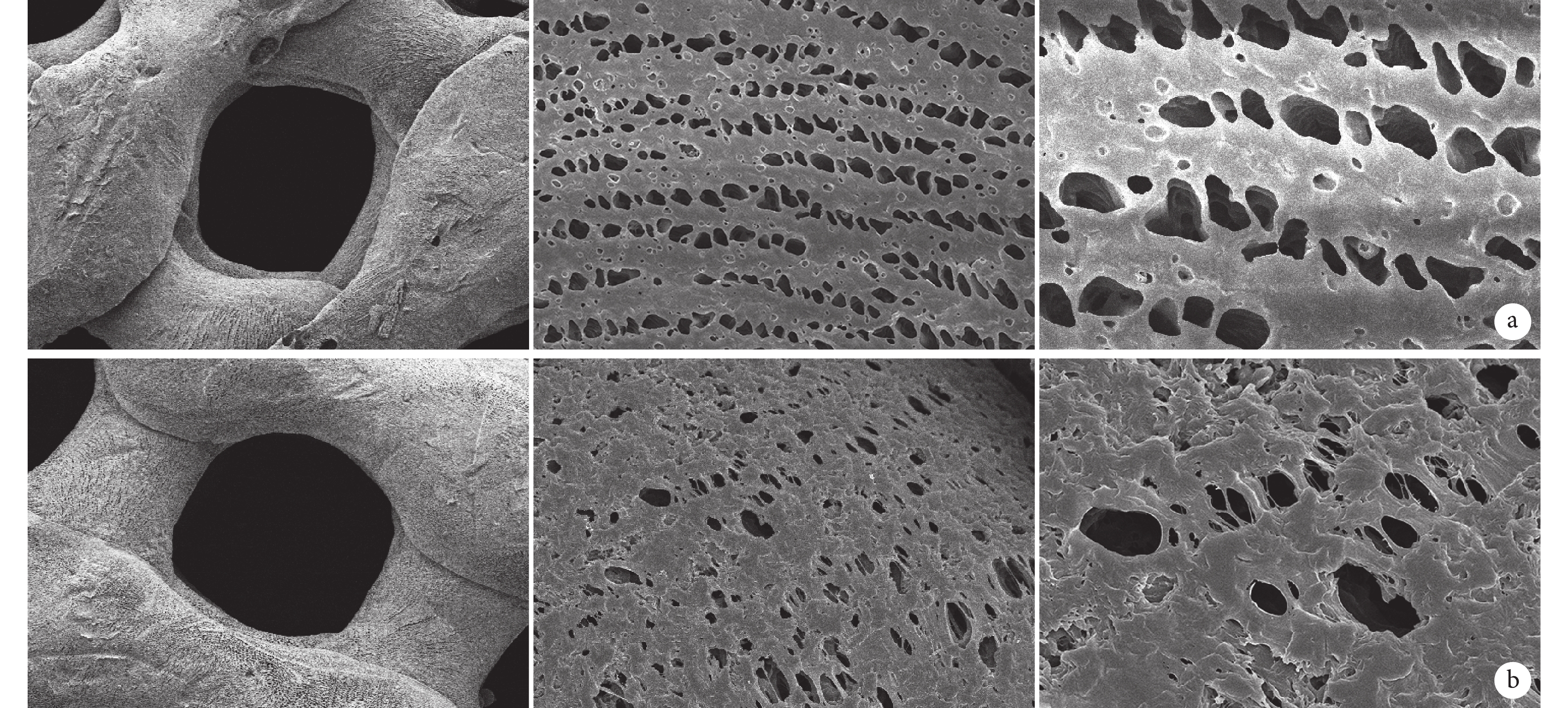
大體觀察,兩種支架形態呈環向與徑向交叉的楔形形狀。見圖 1。掃描電鏡觀察,兩種半月板支架表面均可見大孔及棱徑上的微孔,PCL/Ⅰ型膠原半月板支架表面較粗糙,而 PCL 半月板支架表面較光滑; PCL 半月板支架棱徑上的微孔中無纖維連接,而 PCL/Ⅰ型膠原半月板支架棱徑的微孔中有一些纖維連接。見圖 2。
2.2 支架力學性能檢測
PCL 半月板支架、PCL/Ⅰ型膠原半月板支架壓縮模量分別為(2 830.04±734.83)、(2 531.61±497.88)kPa,拉伸模量分別為(2 057.17±250.30)、(1 937.27±200.45)kPa,比較差異無統計學意義(t=0.752,P=0.474;t=0.836,P=0.427)。
2.3 紅外光譜分析
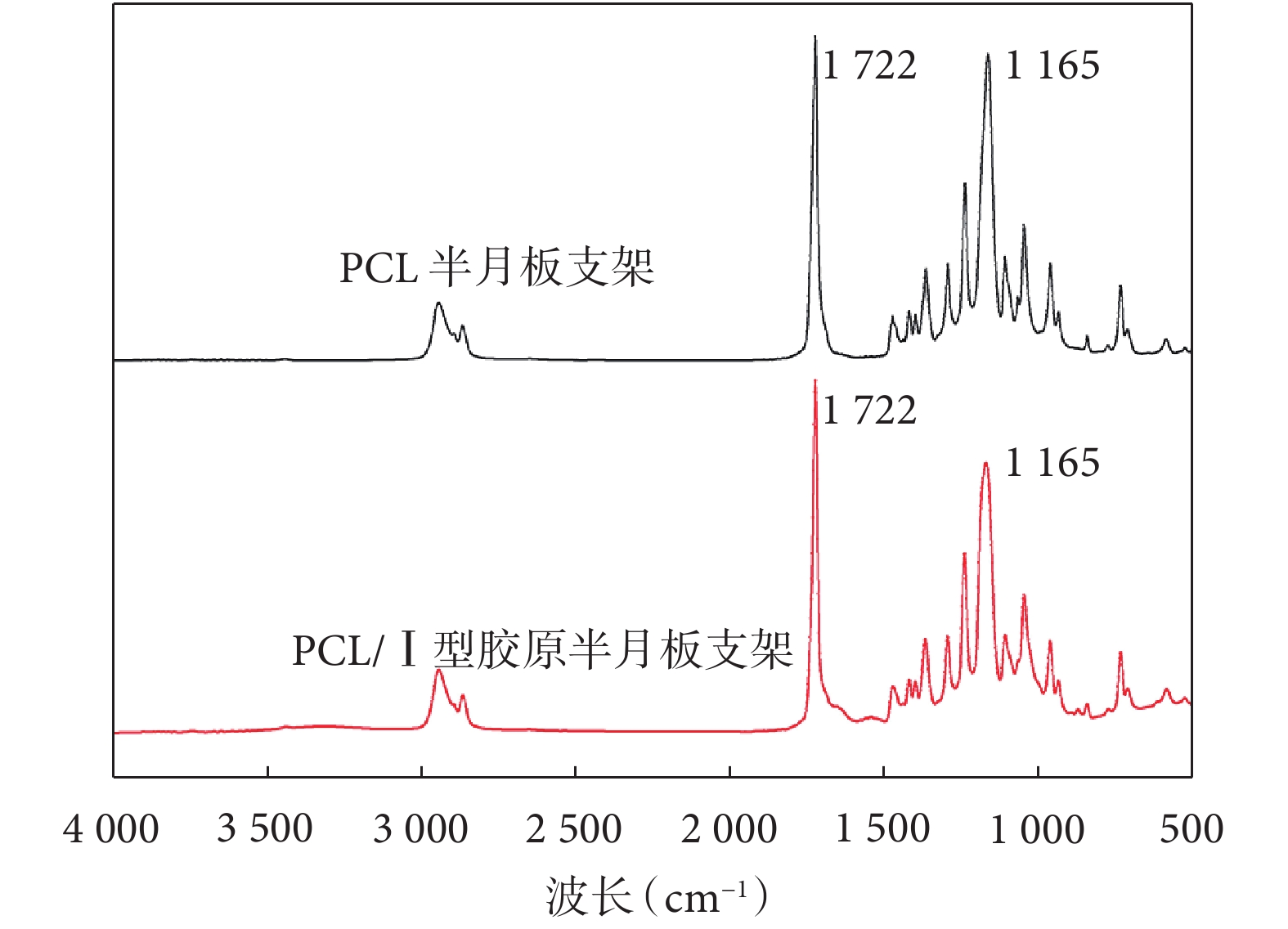
PCL 半月板支架光譜圖示,在約 1 722 cm–1處存在羰基特征峰,在約 1 165 cm –1處特征峰對應于 PCL 中的 C-O 鍵。PCL/Ⅰ型膠原半月板支架光譜圖示,約 1 165 cm –1處特征峰對應的 C-O 鍵較 PCL 半月板支架減少;而約 1 722 cm–1處特征峰增加。提示 PCL/Ⅰ型膠原半月板支架中 PCL 和Ⅰ型膠原成功混合。見圖 3。
2.4 表面接觸角檢測
PCL/Ⅰ型膠原半月板支架表面接觸角為(83.19±7.49)°,較 PCL 半月板支架的(111.13±5.70)° 顯著減小,差異有統計學意義(t=6.638,P=0.000);而且,水滴可以被 PCL/Ⅰ型膠原半月板支架吸收。
2.5 支架體外細胞毒性評估
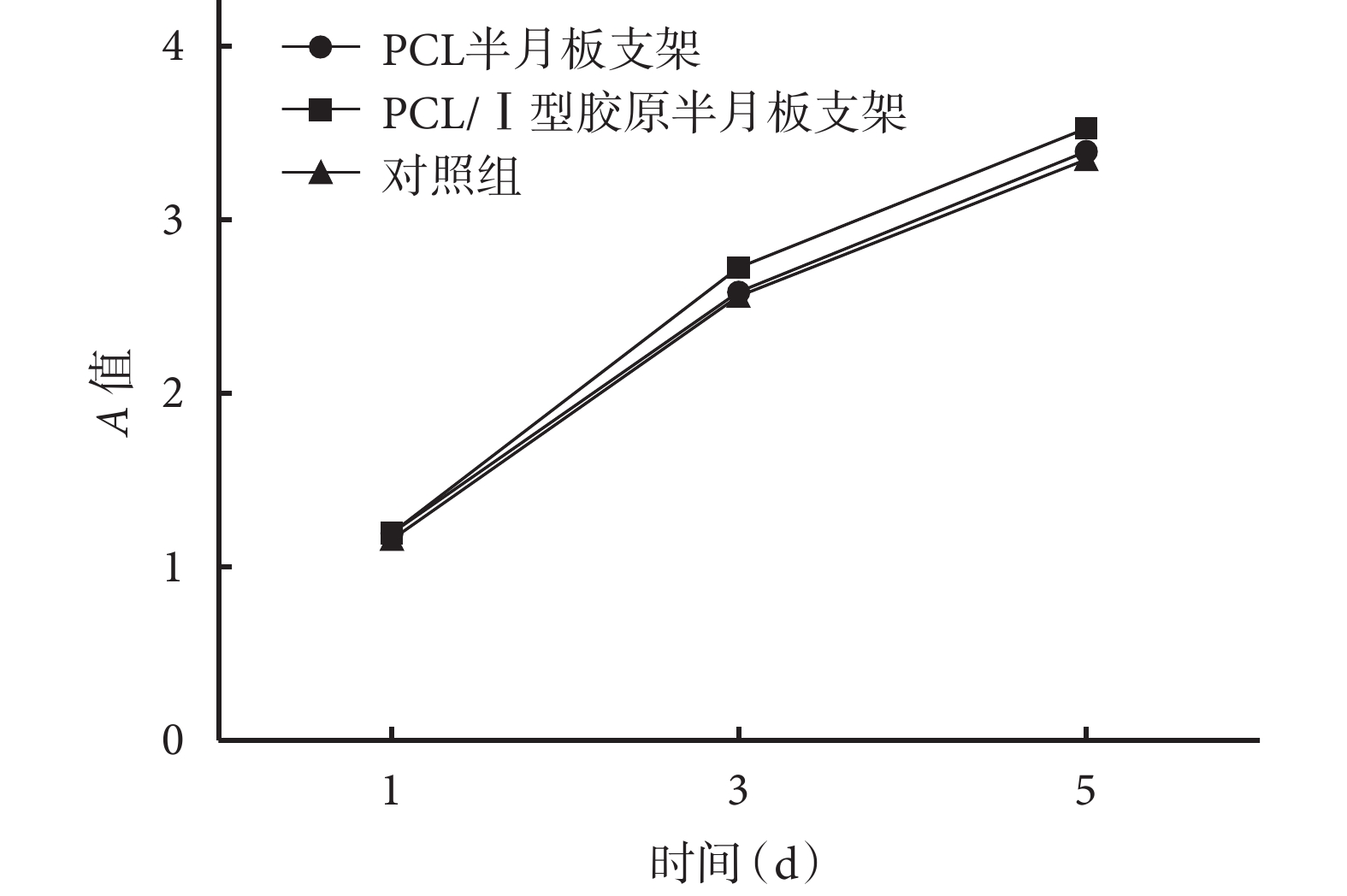
CCK-8 檢測顯示,隨時間推移,兩種支架浸提液培養的細胞數量呈遞增趨勢;各時間點與對照組比較差異均無統計學意義(P>0.05),提示兩種支架均無細胞毒性。見圖 4。
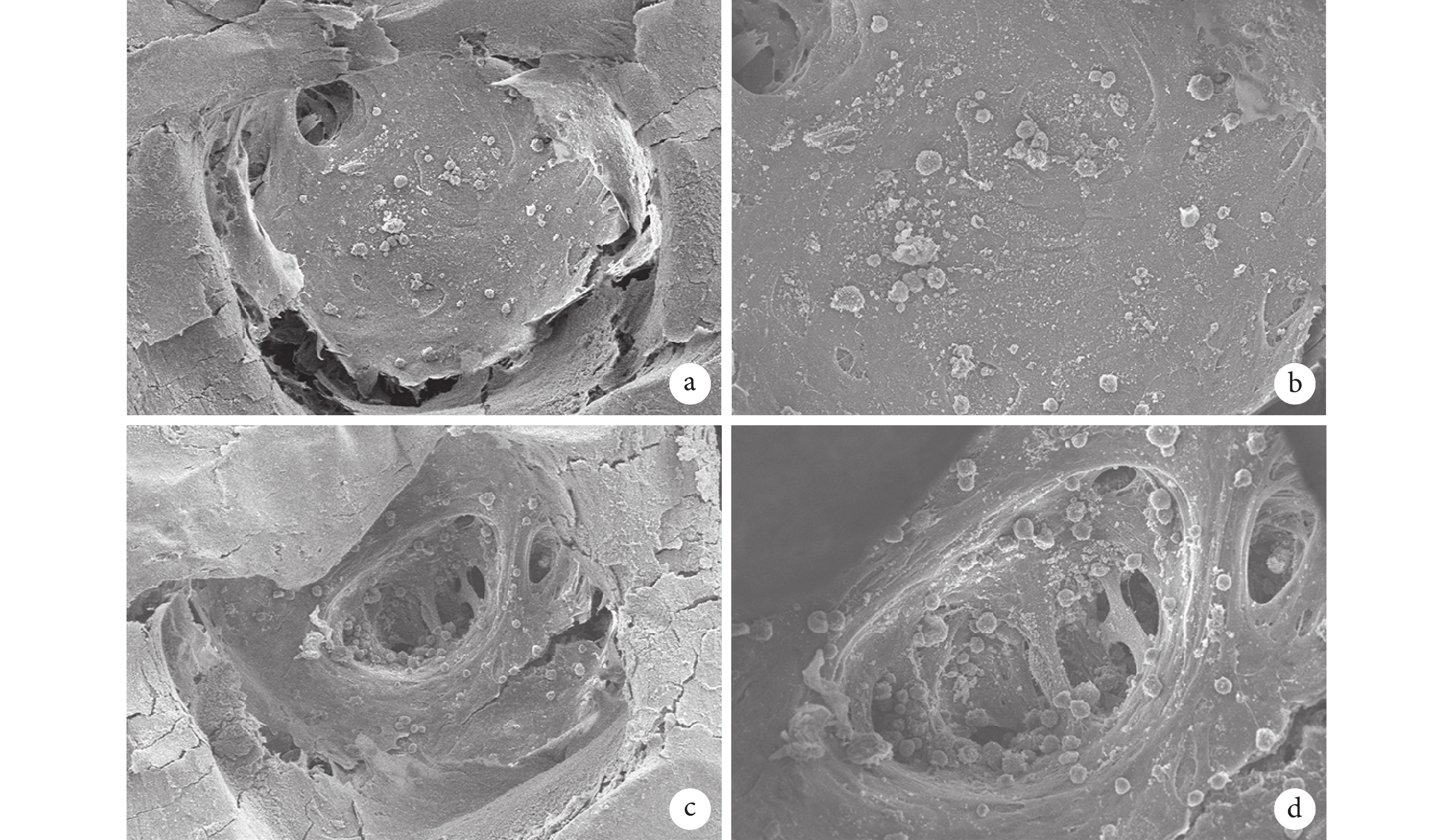
支架-細胞復合物掃描電鏡觀察半月板細胞均可在兩種支架表面黏附、生長,其中 PCL/Ⅰ型膠原半月板支架表面黏附的細胞多于 PCL 半月板支架。見圖 5。
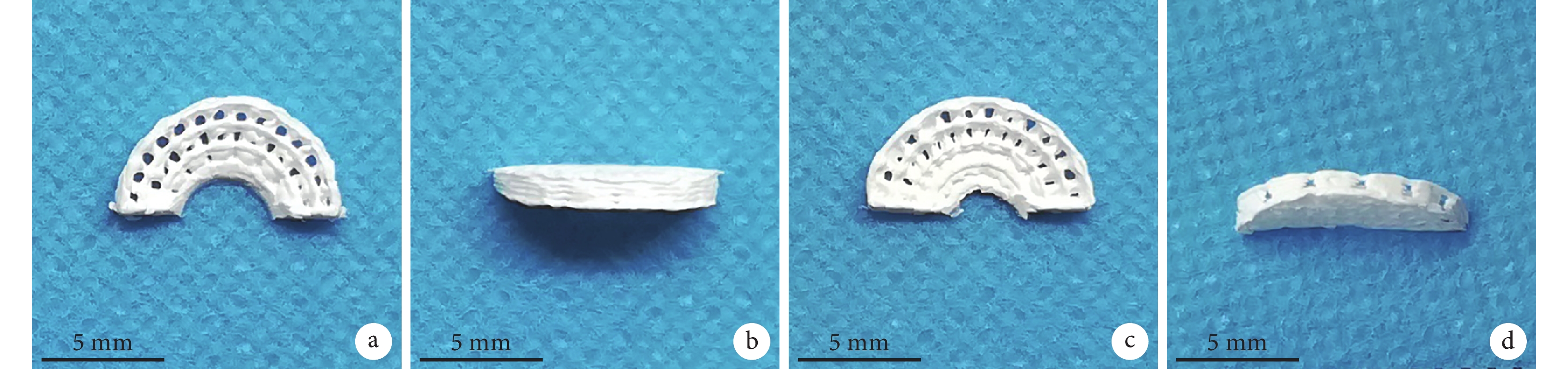 圖1
半月板支架大體觀察
圖1
半月板支架大體觀察
a、b. PCL 半月板支架;c、d. PCL/Ⅰ型膠原半月板支架
Figure1. Gross observation of the meniscus scaffoldsa, b. PCL meniscus scaffolds; c, d. PCL/COLⅠmeniscus scaffolds
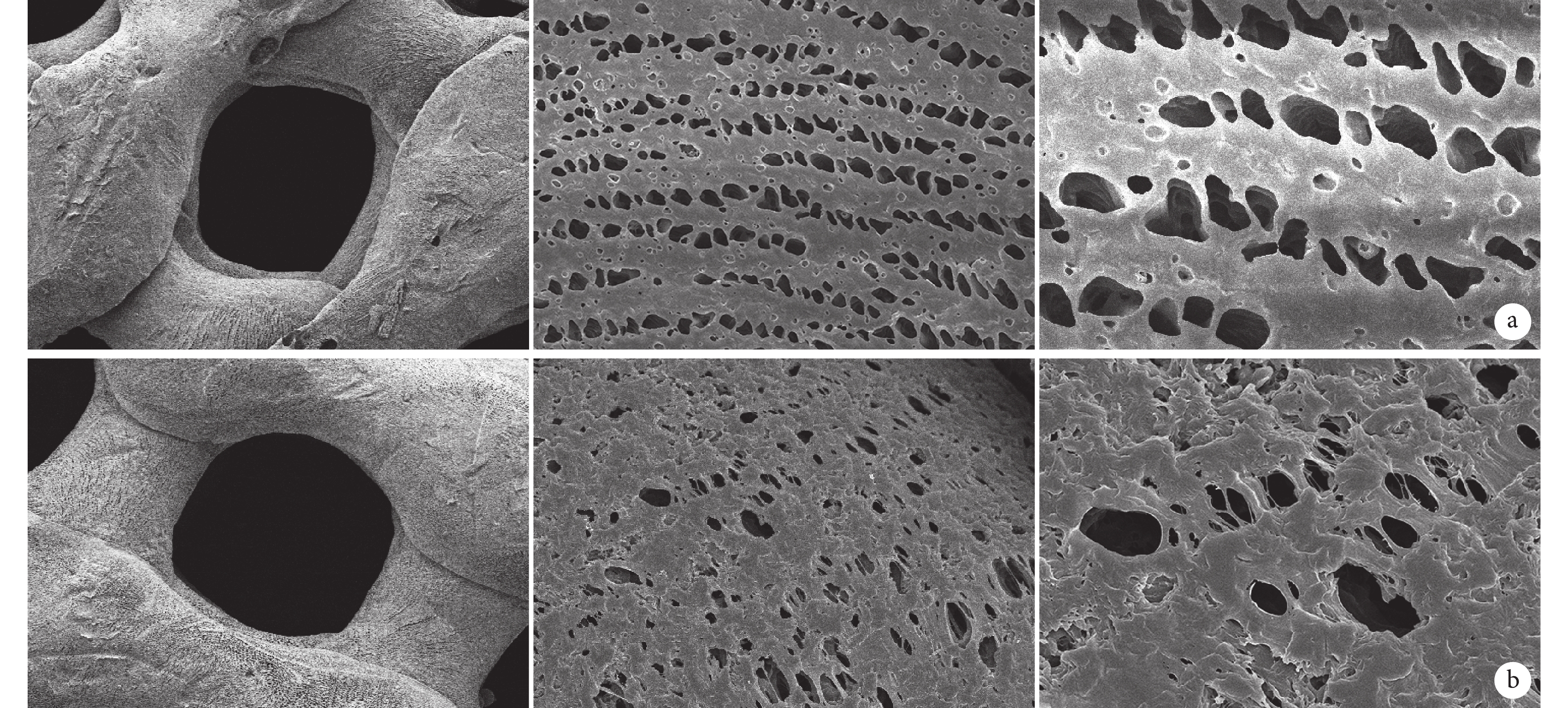 圖2
半月板支架掃描電鏡觀察
圖2
半月板支架掃描電鏡觀察
從左至右分別為放大 100、2 000、5 000 倍 a. PCL 半月板支架;b. PCL/Ⅰ型膠原半月板支架
Figure2. Scanning electron microscope observation of the meniscus scaffoldsFrom left to right for the magnifications of 100, 2 000, and 5 000 times, respectively a. PCL meniscus scaffold; b. PCL/COLⅠ meniscus scaffold
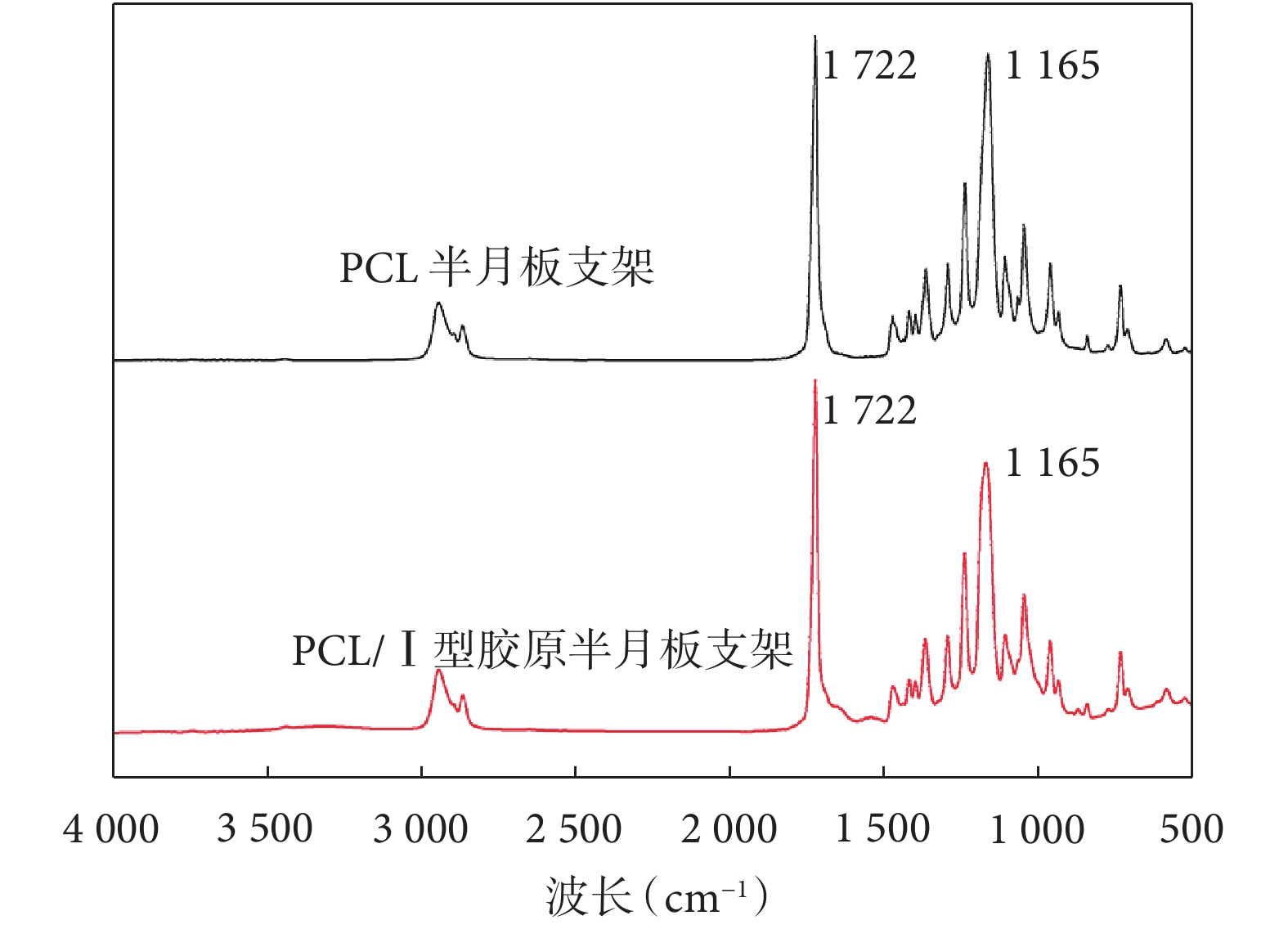 圖3
半月板支架紅外光譜圖
Figure3.
FTIR of the meniscus scaffolds
圖3
半月板支架紅外光譜圖
Figure3.
FTIR of the meniscus scaffolds
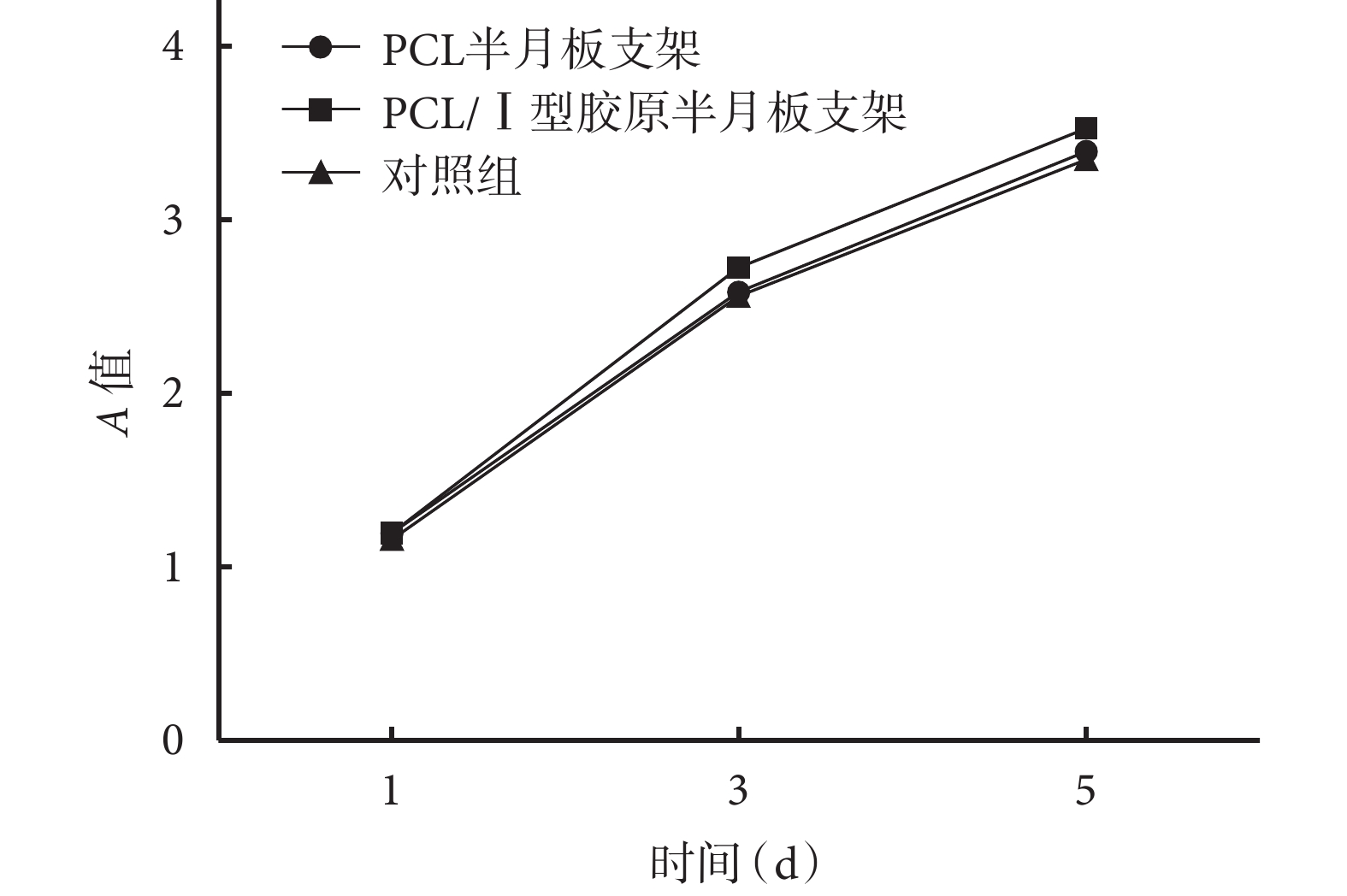 圖4
CCK-8 檢測半月支架細胞毒性
Figure4.
The cytotoxicity of the meniscus scaffolds by CCK-8
圖4
CCK-8 檢測半月支架細胞毒性
Figure4.
The cytotoxicity of the meniscus scaffolds by CCK-8
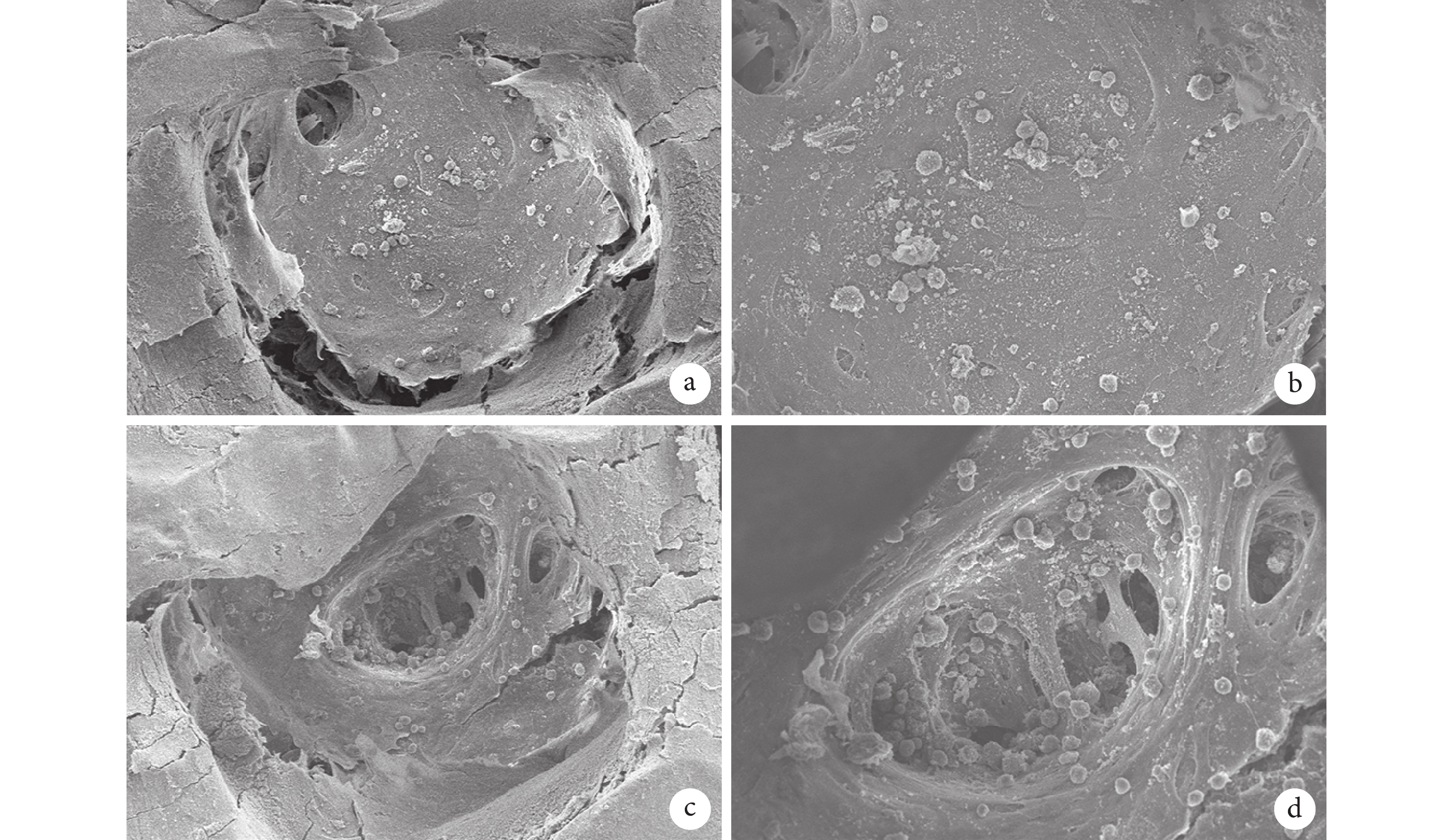 圖5
支架-細胞復合物掃描電鏡觀察
圖5
支架-細胞復合物掃描電鏡觀察
a、b. 放大 150、300 倍下 PCL 半月板支架-細胞復合物;c、d. 放大 150、300 倍下 PCL/Ⅰ型膠原半月板支架-細胞復合物
Figure5. Scanning electron microscope observation of scaffold-cell complexa, b. PCL meniscus scaffold-cell complex at the magnifications of 150 and 300 times; c, d. PCL/COL Ⅰ meniscus scaffold-cell complex at the magnifications of 150 and 300 times
3 討論
研究發現,半月板大多數膠原纖維束呈環周形排列,少量膠原纖維呈放射狀排列[12]。本研究以成年新西蘭大白兔半月板為支架模型,采用低溫沉積 3D 打印技術成功制備了具有環向與徑向交叉的楔形形態的半月板支架,與天然半月板的微觀結構一致。多孔徑孔隙支架有利于細胞增殖、分化[13-14],而且粗糙度高的材料比表面積大,可以增大細胞與材料的接觸面積,從而利于細胞黏附、生長[15-16]。本研究掃描電鏡結果顯示,兩種半月板支架均具有大孔及微孔,有利于營養的供給和代謝廢物的排出,而且 PCL/Ⅰ型膠原半月板支架表面比 PCL 半月板支架更粗糙,提示前者更有利于細胞黏附、生長。生物力學測試提示,PCL/Ⅰ型膠原半月板支架拉伸模量及壓縮模量與 PCL 半月板支架相比,差異均無統計學意義,但前者兩指標實際測量值小于后者,分析可能與單位體積內 PCL 含量降低有關。紅外光譜分析結果顯示,PCL/Ⅰ型膠原支架材料特征峰與 PCL 支架材料相比發生了變化,證明Ⅰ型膠原蛋白和 PCL 成功混合。因為Ⅰ型膠原蛋白有益于軟骨細胞的黏附、增殖和分化,且有利于軟骨細胞最終形成纖維軟骨[8, 17],所以我們認為 PCL/Ⅰ型膠原半月板支架比單純 PCL 半月板支架更適合半月板損傷的再生修復。
Ghosal 等[18]研究發現 PCL 和膠原蛋白結合后,其表面接觸角減小。本研究表面接觸角檢測結果示,當水滴滴向支架時,PCL/Ⅰ型膠原半月板支架表面接觸角顯著小于單純 PCL 半月板支架表面接觸角,提示Ⅰ型膠原的加入明顯增加了半月板支架的親水性,這與Ⅰ型膠原蛋白中存在親水基團密切相關。Kirchhof 等[19]提出通常情況下,親水性材料表面更益于細胞的黏附、生長。親水性分析結果也從一方面提示了 PCL/Ⅰ型膠原半月板支架的生物相容性優于 PCL 半月板支架。體外 CCK-8 細胞毒性實驗進一步表明,低溫沉積技術 3D 打印制備的 PCL/Ⅰ型膠原半月板支架及 PCL 半月板支架均無細胞毒性。體外支架-細胞復合物掃描電鏡觀察結果也驗證了 PCL/Ⅰ型膠原半月板支架材料較單純 PCL 半月板支架材料有利于細胞黏附、生長。
由于半月板整體及微觀結構和細胞外基質成分呈區域性變化,所以半月板是各向異性及不均一的組織,導致其生物力學也呈各向異性。本實驗利用低溫沉積 3D 打印技術制備的 PCL/Ⅰ型膠原半月板支架呈環向與徑向交叉的楔形形態,基本實現了半月板整體及微觀結構的仿生,一定程度實現了半月板生物力學的各向異性。但是構建結構和成分雙仿生的組織工程半月板,達到完全生物力學各向異性還需要進一步研究。此外,本研究結果提示該支架具有優良的理化學性能及細胞黏性能,無細胞毒性,下一步我們將繼續完善該支架材料的生物相容性評估及動物體內修復半月板的評價。
半月板損傷是一種常見的運動損傷,隨著參與體育鍛煉的人越來越多,半月板損傷發病率呈逐年上升趨勢。由于半月板特殊的解剖學結構[1],臨床治療半月板損傷以部分或全部切除為主[2]。半月板切除能短暫恢復功能和緩解癥狀,但明顯增加骨關節炎的患病風險[3-5]。組織工程的發展為半月板損傷的再生修復提供了新希望。組織工程的關鍵要素包括支架材料、種子細胞及生物因子[6-7],因此選擇合適的支架材料非常重要。大量研究表明,Ⅰ型膠原有利于軟骨細胞黏附、增殖和分化,且有利于軟骨細胞最終形成纖維軟骨[8-9]。聚己內酯(polycaprolactone,PCL)具有較好的力學特性,但生物相容性較差,細胞親和力較低。
與傳統支架制造技術相比,3D 打印技術具有良好的重復性和對支架微觀結構和形狀的控制[10]。此外,低溫沉積技術 3D 打印可以實現 PCL、Ⅰ型膠原溶液一體化打印,并且不會破壞Ⅰ型膠原蛋白。為此,本課題組提出采用低溫沉積技術 3D 打印構建 PCL/Ⅰ型膠原組織工程半月板支架(以下簡稱 PCL/Ⅰ型膠原半月板支架),以期提供既具有良好力學支撐,又有利于半月板細胞黏附、增殖及維持表型的支架材料。我們前期預實驗發現 15%PCL/4%Ⅰ型膠原溶液黏性最佳,本次實驗在此基礎上通過低溫沉積技術 3D 打印制備 PCL/Ⅰ型型膠原半月板支架,觀察支架形態、微觀結構、理化性能以及細胞毒性,為其體內研究奠定基礎。
1 材料與方法
1.1 主要試劑及儀器
成年新西蘭大白兔 1 只,體質量 2.5 kg;3~4 周齡新西蘭大白兔 3 只,體質量 0.5~0.6 kg,均購自中國人民解放軍總醫院實驗動物中心。PCL、牛跟腱Ⅰ型膠原、膠原酶、0.25% 胰蛋白酶(Sigma 公司,美國);六氟異丙醇、1,4-二氧六環[阿拉丁試劑(中國)有限公司];FBS(HyClone 公司,美國);DMEM 培養基(Corning 公司,美國);細胞計數試劑盒 8(cell counting kit 8,CCK-8)試劑盒(同仁公司,日本);鏈霉素-青霉素雙抗(GIBCO 公司,美國)。
冷凍干燥機(北京博醫康技術有限公司);計算機輔助設計軟件 UG(Siemens 公司,德國);3D 生物打印機(青島尤尼科技有限公司);S-4800 型掃描電鏡(Hitachi 公司,日本);BOSE 5100 生物力學試驗機(BOSE 公司,美國);傅氏轉換紅外線光譜分析儀(Ettlingen 公司,德國);Nuona SL-200B 滴狀分析系統(美國科諾工業有限公司);CO2 培養箱(Heraeus 公司,德國);Micro-CT(GE Healthcare 公司,英國)。
1.2 實驗方法
1.2.1 PCL/Ⅰ型膠原溶液以及 PCL 溶液的制備
根據預實驗結果,稱取 1.5 g PCL,分別加入 10 mL 含不同濃度(0、4%)Ⅰ型膠原的 1,4-二氧六環與六氟異丙醇(比例為 9∶1)溶液中,制備 15%PCL 溶液和 15% PCL/4% Ⅰ型膠原溶液。
1.2.2 PCL/Ⅰ型膠原半月板支架及 PCL 半月板支架的制備
取 1 只成年新西蘭大白兔,空氣栓塞處死后,取出內側半月板并行 CT 掃描,將獲得的半月板數據導入計算機輔助設計軟件中,設計放射狀與環形交叉的楔形取向性的半月板支架模型。然后,將半月板支架模型數據以 STL 格式導入 3D 打印控制軟件中;打印參數:平臺成型溫度–20℃,打印層厚 0.1 mm,打印速度 10 mm/s。
將 1.2.1 中制備的兩種溶液分別加入 3D 生物打印機料筒中進行打印,半月板支架初步成型后,依次行以下處理:–20℃ 冰柜保存 4 h,冷凍干燥,乙基二甲基胺丙基碳化二亞胺交聯,再次冷凍干燥,75% 乙醇浸泡 24 h,去離子水浸泡 10 次、每次 5 min,60Co 滅菌。PCL/Ⅰ型膠原半月板支架及 PCL 半月板支架均常溫下保存備用。
1.3 觀測指標
1.3.1 支架形態及微觀結構觀測
取兩種支架大體觀察其形態,然后冷凍干燥、噴金后,掃描電鏡觀察支架微觀結構(大孔直徑>200 μm、微孔直徑<100 μm)。
1.3.2 支架力學性能檢測
采用 BOSE 5100 生物力學試驗機進行力學測試。① 壓縮力學測試:將兩種支架樣本制備為 10 mm×10 mm×5 mm 柱狀體,PBS 緩沖液浸潤后進行壓縮力學測試。預壓縮 5%,壓縮速率為 5 mm/min,壓縮 20 個循環后進行正式測試,最大壓縮 20%,獲得應力-應變曲線,計算壓縮模量。② 拉伸力學測試:將兩種支架制備為 16 mm×10 mm×2 mm 的長方體,PBS 緩沖液浸潤后進行拉伸力學測試。預拉伸 5%,拉伸 20 個循環后進行正式測試,獲得應力-應變曲線,計算拉伸模量。
1.3.3 紅外光譜分析
取 1.2.1 中制備的 PCL 溶液、PCL/Ⅰ型膠原溶液,冷凍干燥后獲得與兩種支架成分相同的樣品。將樣品切成 10 mm×10 mm 的正方形片,以反射模式進行紅外光譜分析,掃描范圍為 650~4 000 cm–1,鑒定支架的官能團。
1.3.4 表面接觸角檢測
取 1.2.1 中制備的 PCL 溶液、PCL/Ⅰ型膠原溶液,冷凍干燥后獲得與兩種支架成分相同的樣品。用 27G 鈍針微注射器將去離子水滴至樣品表面,滴狀分析系統捕獲去離子水下落圖像。根據水滴形狀計算表面接觸角,實驗重復 5 次。
1.3.5 支架體外細胞毒性評估
① 兔半月板細胞分離培養:取 3~4 周齡新西蘭大白兔半月板組織,參照本課題組前期研究方法[11]分離培養半月板細胞,并傳代。取第 3 代細胞進行實驗。② 支架浸提液制備及 CCK-8 細胞毒性實驗:根據 ISO 10993-12:2009 標準,將兩種支架樣品分別浸入 DMEM 培養基中,支架浸提比為 3 cm2/mL,于(37±1)℃ 條件下溫育 72 h。然后取浸提液用 100 μm 膜過濾,于浸提液中加入 FBS 至濃度為 10%(V/V)、雙抗至濃度為 1%(V/V),獲得兩種支架的浸提液培養基。將半月板細胞接種至 96 孔板,每孔含 3×103 個細胞。每組有 5 個平行樣本,對應加入 100 μL 浸提液培養基,于 37℃、5% CO2 培養箱內培養 1、3、5 d 后,分別加入 10 μL CCK-8 試劑,繼續孵育 2.5 h 后,用酶標儀測量 450 nm 處的吸光度(A)值。以正常培養基培養細胞作為對照。
③ 支架-細胞復合物制備及掃描電鏡觀察:將 1.3.2 中兩種支架的力學標準件剪裁成 5 mm×5 mm×2 mm 大小,60Co 滅菌消毒。于半月板細胞中加入 DMEM 培養基,制備成濃度為 1×106 個/mL 的細胞懸液后,分別接種至兩種支架上,每個支架 100 μL。置于 37℃、5% CO2 培養箱孵育 3 h 后,加入 DMEM 培養液,繼續培養 1 d 后取出支架-細胞復合物,置于 2.5% 戊二醛固定 3 d,梯度乙醇脫水后,臨界點干燥,樣品噴金后,掃描電鏡觀察細胞在支架表面黏附及生長情況。
1.4 統計學方法
采用 SPSS17.0 統計軟件進行分析。數據以均數±標準差表示,兩組間比較采用獨立樣本 t 檢驗;多組間比較采用單因素方差分析,兩兩比較采用 Bonferroni 檢驗;檢驗水準 α=0.05。
2 結果
2.1 支架形態及微觀結構觀測
大體觀察,兩種支架形態呈環向與徑向交叉的楔形形狀。見圖 1。掃描電鏡觀察,兩種半月板支架表面均可見大孔及棱徑上的微孔,PCL/Ⅰ型膠原半月板支架表面較粗糙,而 PCL 半月板支架表面較光滑; PCL 半月板支架棱徑上的微孔中無纖維連接,而 PCL/Ⅰ型膠原半月板支架棱徑的微孔中有一些纖維連接。見圖 2。
2.2 支架力學性能檢測
PCL 半月板支架、PCL/Ⅰ型膠原半月板支架壓縮模量分別為(2 830.04±734.83)、(2 531.61±497.88)kPa,拉伸模量分別為(2 057.17±250.30)、(1 937.27±200.45)kPa,比較差異無統計學意義(t=0.752,P=0.474;t=0.836,P=0.427)。
2.3 紅外光譜分析
PCL 半月板支架光譜圖示,在約 1 722 cm–1處存在羰基特征峰,在約 1 165 cm –1處特征峰對應于 PCL 中的 C-O 鍵。PCL/Ⅰ型膠原半月板支架光譜圖示,約 1 165 cm –1處特征峰對應的 C-O 鍵較 PCL 半月板支架減少;而約 1 722 cm–1處特征峰增加。提示 PCL/Ⅰ型膠原半月板支架中 PCL 和Ⅰ型膠原成功混合。見圖 3。
2.4 表面接觸角檢測
PCL/Ⅰ型膠原半月板支架表面接觸角為(83.19±7.49)°,較 PCL 半月板支架的(111.13±5.70)° 顯著減小,差異有統計學意義(t=6.638,P=0.000);而且,水滴可以被 PCL/Ⅰ型膠原半月板支架吸收。
2.5 支架體外細胞毒性評估
CCK-8 檢測顯示,隨時間推移,兩種支架浸提液培養的細胞數量呈遞增趨勢;各時間點與對照組比較差異均無統計學意義(P>0.05),提示兩種支架均無細胞毒性。見圖 4。
支架-細胞復合物掃描電鏡觀察半月板細胞均可在兩種支架表面黏附、生長,其中 PCL/Ⅰ型膠原半月板支架表面黏附的細胞多于 PCL 半月板支架。見圖 5。
 圖1
半月板支架大體觀察
圖1
半月板支架大體觀察
a、b. PCL 半月板支架;c、d. PCL/Ⅰ型膠原半月板支架
Figure1. Gross observation of the meniscus scaffoldsa, b. PCL meniscus scaffolds; c, d. PCL/COLⅠmeniscus scaffolds
 圖2
半月板支架掃描電鏡觀察
圖2
半月板支架掃描電鏡觀察
從左至右分別為放大 100、2 000、5 000 倍 a. PCL 半月板支架;b. PCL/Ⅰ型膠原半月板支架
Figure2. Scanning electron microscope observation of the meniscus scaffoldsFrom left to right for the magnifications of 100, 2 000, and 5 000 times, respectively a. PCL meniscus scaffold; b. PCL/COLⅠ meniscus scaffold
 圖3
半月板支架紅外光譜圖
Figure3.
FTIR of the meniscus scaffolds
圖3
半月板支架紅外光譜圖
Figure3.
FTIR of the meniscus scaffolds
 圖4
CCK-8 檢測半月支架細胞毒性
Figure4.
The cytotoxicity of the meniscus scaffolds by CCK-8
圖4
CCK-8 檢測半月支架細胞毒性
Figure4.
The cytotoxicity of the meniscus scaffolds by CCK-8
 圖5
支架-細胞復合物掃描電鏡觀察
圖5
支架-細胞復合物掃描電鏡觀察
a、b. 放大 150、300 倍下 PCL 半月板支架-細胞復合物;c、d. 放大 150、300 倍下 PCL/Ⅰ型膠原半月板支架-細胞復合物
Figure5. Scanning electron microscope observation of scaffold-cell complexa, b. PCL meniscus scaffold-cell complex at the magnifications of 150 and 300 times; c, d. PCL/COL Ⅰ meniscus scaffold-cell complex at the magnifications of 150 and 300 times
3 討論
研究發現,半月板大多數膠原纖維束呈環周形排列,少量膠原纖維呈放射狀排列[12]。本研究以成年新西蘭大白兔半月板為支架模型,采用低溫沉積 3D 打印技術成功制備了具有環向與徑向交叉的楔形形態的半月板支架,與天然半月板的微觀結構一致。多孔徑孔隙支架有利于細胞增殖、分化[13-14],而且粗糙度高的材料比表面積大,可以增大細胞與材料的接觸面積,從而利于細胞黏附、生長[15-16]。本研究掃描電鏡結果顯示,兩種半月板支架均具有大孔及微孔,有利于營養的供給和代謝廢物的排出,而且 PCL/Ⅰ型膠原半月板支架表面比 PCL 半月板支架更粗糙,提示前者更有利于細胞黏附、生長。生物力學測試提示,PCL/Ⅰ型膠原半月板支架拉伸模量及壓縮模量與 PCL 半月板支架相比,差異均無統計學意義,但前者兩指標實際測量值小于后者,分析可能與單位體積內 PCL 含量降低有關。紅外光譜分析結果顯示,PCL/Ⅰ型膠原支架材料特征峰與 PCL 支架材料相比發生了變化,證明Ⅰ型膠原蛋白和 PCL 成功混合。因為Ⅰ型膠原蛋白有益于軟骨細胞的黏附、增殖和分化,且有利于軟骨細胞最終形成纖維軟骨[8, 17],所以我們認為 PCL/Ⅰ型膠原半月板支架比單純 PCL 半月板支架更適合半月板損傷的再生修復。
Ghosal 等[18]研究發現 PCL 和膠原蛋白結合后,其表面接觸角減小。本研究表面接觸角檢測結果示,當水滴滴向支架時,PCL/Ⅰ型膠原半月板支架表面接觸角顯著小于單純 PCL 半月板支架表面接觸角,提示Ⅰ型膠原的加入明顯增加了半月板支架的親水性,這與Ⅰ型膠原蛋白中存在親水基團密切相關。Kirchhof 等[19]提出通常情況下,親水性材料表面更益于細胞的黏附、生長。親水性分析結果也從一方面提示了 PCL/Ⅰ型膠原半月板支架的生物相容性優于 PCL 半月板支架。體外 CCK-8 細胞毒性實驗進一步表明,低溫沉積技術 3D 打印制備的 PCL/Ⅰ型膠原半月板支架及 PCL 半月板支架均無細胞毒性。體外支架-細胞復合物掃描電鏡觀察結果也驗證了 PCL/Ⅰ型膠原半月板支架材料較單純 PCL 半月板支架材料有利于細胞黏附、生長。
由于半月板整體及微觀結構和細胞外基質成分呈區域性變化,所以半月板是各向異性及不均一的組織,導致其生物力學也呈各向異性。本實驗利用低溫沉積 3D 打印技術制備的 PCL/Ⅰ型膠原半月板支架呈環向與徑向交叉的楔形形態,基本實現了半月板整體及微觀結構的仿生,一定程度實現了半月板生物力學的各向異性。但是構建結構和成分雙仿生的組織工程半月板,達到完全生物力學各向異性還需要進一步研究。此外,本研究結果提示該支架具有優良的理化學性能及細胞黏性能,無細胞毒性,下一步我們將繼續完善該支架材料的生物相容性評估及動物體內修復半月板的評價。