引用本文: 張楠, 劉娜, 孫楚, 朱劍峰, 王東旭, 戴云峰, 吳云峰, 王亞明, 李軍雷, 趙德偉, 閆景龍. 新型微弧氧化涂層鎂-鋅-鈣合金支架/自體顆粒骨修復兔臨界性骨缺損的研究. 中國修復重建外科雜志, 2018, 32(3): 298-305. doi: 10.7507/1002-1892.201710003 復制
臨界性骨缺損(critical size bone defect,CSD)是指由嚴重的創傷、感染、骨腫瘤切除、人工關節置換術后翻修、先天畸形等原因引起的,達到一定長度或范圍后不能自然愈合,又不能通過單純固定解決的骨缺損[1],一直是臨床骨科治療的難點。目前常用帶血管蒂骨移植修復大段骨缺損,但存在骨瓣營養血管位置不確定、手術創傷大、受局部血運影響大、學習曲線高、一旦失敗后果嚴重等問題[2-3]。自體顆粒骨移植雖然一直被認為是治療骨缺損的“金標準”[4],但也存在供骨量有限、供區并發癥、結構松散、易被機體吸收等缺陷,在修復長骨缺損時常需同時植入金屬鈦網給予支撐穩定。但金屬鈦網無誘導成骨能力,植入后易引起局部塌陷、慢性炎癥、異物反應等并發癥;同時,因其不可降解會在體內永久存留,進而對機體造成不良影響[5]。近年來,由于鎂(Mg)及其合金機械性能與人骨接近[6-7],Mg2+ 在維持細胞結構和功能方面具有重要作用[8-9],人體內約一半含量的 Mg 存在于骨組織中[10-11],而且 Mg 及其合金能夠促進局部鈣沉積,具有良好的骨傳導性和骨誘導性[12-14]。因此,Mg 合金作為一種潛在骨科內植物材料受到廣泛關注。
Mg 合金作為唯一具有可降解性的金屬生物材料,近年來雖然有研究將其作為骨替代物來嘗試修復骨缺損,并獲得良好效果[15-16],但是將 Mg 合金制備成支架修復大段長骨缺損依然鮮有報道。本研究采用 Mg-鋅(Zn)-鈣(Ca)合金為材料,首次設計制造了一種新型中空圓柱形支架,這種結構在降低支架質量(約 50%)同時,還能維持足夠機械強度,內部類似皮質骨的空間允許填充自體顆粒骨,表面均勻分布的網孔有助于骨痂長入。我們假設結合自體顆粒骨誘導成骨的特性,發揮 Mg 合金良好的骨誘導性、可降解性和力學性能,嘗試利用這種新型支架修復 CSD。同時為了增加這種支架在體內的抗腐蝕性和生物相容性,我們采用微弧氧化(micro-arc oxidation,MAO)技術在其表面添加一層 10 μm 厚生物陶瓷涂層,并通過動物實驗來評估這種支架修復 CSD 的效果,同時進一步評估 MAO 涂層對支架體內抗腐蝕性和生物相容性的影響。
1 材料與方法
1.1 Mg-Zn-Ca 合金支架材料
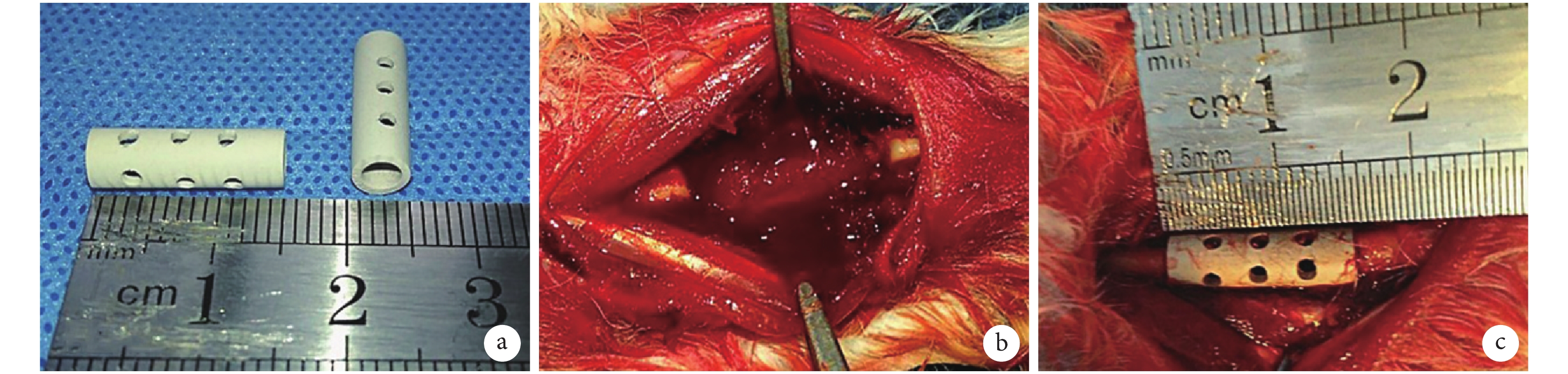
本研究采用的 Mg-Zn-Ca 合金支架由哈爾濱工業大學材料學院提供,以 Mg-Zn-Ca 合金為主要基質材料[2.5 wt%~3.0 wt% Ca,0.7 wt%~1.3 wt% Zn,0.2 wt%錳(Mn)和純 Mg],采用壓鑄工藝制備成圓柱形管狀支架(長 15 mm、內徑 3 mm、外徑 5 mm),表面均勻分布 12 個直徑 1 mm 的圓孔;并通過 MAO 技術對其表面改型,制備一層約 10 μm 厚的生物陶瓷涂層[17],主要成分為 MgO,此外還含有 Mg 和 Ca 的磷酸鹽。見圖 1a。所有支架在植入前均采用環氧乙烷氣體消毒。
1.2 實驗動物及主要試劑、儀器
成年新西蘭白兔 72 只,雌雄各半,體質量(2.71±0.32)kg,由齊齊哈爾醫學院動物實驗中心提供。
戊巴比妥鈉(北京普博斯生物科技有限公司);鈣黃綠素(Sigma-Aldrich 公司,美國);Van Gieson 染色液(上海博谷生物科技有限公司)。CR-IR 357 Capsula X 線機(富士公司,日本);Siemens Inveon Micro-CT、Inveon 軟件(Siemens 公司,德國);EXAKT00CP 型切片機、EXAKT00CS 磨片機、DM4000B 熒光顯微鏡(Leica 公司,德國);Hitachi 7600 自動生化分析儀(Hitachi 公司,日本);X71 光學顯微鏡及成像系統(Olympus 公司,日本)。
1.3 實驗分組及造模方法
將新西蘭白兔隨機分為 3 組,每組 24 只。A 組:無涂層 Mg-Zn-Ca 合金支架組;B 組:MAO 涂層 Mg-Zn-Ca 合金支架組;C 組:單純自體顆粒骨植骨對照組。所有動物以 3% 戊巴比妥鈉溶液(30 mg/kg)耳緣靜脈注射麻醉,四肢固定于手術臺上,雙側前肢剃毛備皮常規消毒。于前肢中段背側作 4 cm 弧形切口,切開皮膚分離組織顯露尺骨中段,用擺鋸截骨制備 15 mm 長 CSD 模型(圖 1b)。A、B 組將截取的尺骨咬碎制成顆粒骨(1~3 mm)填充于支架內,壓實后植入尺骨缺損處(圖 1c),生理鹽水反復沖洗后通過縫合肌肉及筋膜固定支架;C 組將自體顆粒骨原位植入至骨缺損部位。關閉切口后無菌包扎。造模后動物分籠飼養,可在無外固定情況下立即自由活動并充分飲食、水;預防性肌肉注射青霉素 80 萬 U 3 d,每天 2 次。術后 2、4、8、12 周每組各取 6 只動物進行研究。
1.4 觀測指標
1.4.1 大體觀察
觀察動物一般狀態、活動、攝入食水、體質量、切口愈合及炎性并發癥發生情況等;同時監測 A、B 組動物局部皮下積氣情況,利用無菌注射器局部穿刺收集局部皮下積氣,記錄積氣量。
1.4.2 X 線片觀察
利用 CR-IR 357 Capsula X 線機行側位 X 線掃描,投射條件:70 V,0.69 mA,1.5 s。掃描后由 3 位放射科醫師采用雙盲法對骨缺損愈合情況進行評分,采用 Lane-Sandhu 評分標準[18],范圍從 0 分(未治療)到 12 分(恢復正常骨結構),7 分以上認為骨缺損初步愈合。
1.4.3 Micro-CT 掃描
利用 Siemens Inveon Micro-CT 在電壓 80 kV、電流 500 μA 下掃描,利用 Inveon 軟件對數據進行處理。鑒于 C 組無支架,因此僅觀察 A、B 組術后支架降解情況及術后 12 周缺損部位新骨形態。按以下公式計算術后 4、8、12 周支架降解丟失體積百分比(ΔV)和降解速度(corrosion rate,CR),ΔV=(V0–Vx)/V0×100%,其中 V0 為支架初始體積,Vx 為不同時間點支架剩余體積;CR=(V0–Vx)/(A×t),其中 A 是支架初始面積,t 是術后時間(單位為年)。
1.4.4 血清學指標檢測
術后各時間點處死實驗動物前,清晨空腹耳緣靜脈采血,抗凝,將血樣置于室溫下靜止 1 h,以離心半徑 20 cm、3 500 r/min 離心 10 min,分離上清液,采用 Hitachi 7600 自動生化分析儀測量血清中 Mg2+ 和 Ca2+ 濃度。
1.4.5 Van Gieson 染色觀察
術后各時間點采用驅血法處死動物后收集前肢,去除皮膚軟組織剝離尺骨,70% 乙醇固定;梯度乙醇真空脫水、透明、脫脂、包埋,然后固定于 EXAKT00CP 型切片機切成 200 μm 厚硬組織切片,EXAKT00CS 磨片機依次以 800、1 200、2 500 目水砂紙打磨拋光獲得 50 μm 厚骨磨片;常規 Van Gieson 染色后,4 倍光鏡下觀察缺損部位新生骨組織形態。
1.4.6 組織病理學觀察
術后 12 周處死各組動物后收集腦、肝、腎和脾組織,常規行 HE 染色,20 倍光鏡下觀察組織結構。
1.5 統計學方法
采用 SPSS18.0 統計軟件進行分析。數據以均值±標準差表示,多組間比較采用單因素方差分析,兩兩比較采用 SNK 檢驗;兩組間比較采用獨立樣本t檢驗;檢驗水準 α=0.05。
2 結果
2.1 大體觀察
所有實驗動物均耐受手術,術后麻醉蘇醒后即可自由活動;術后 2 d 食欲較差,考慮麻醉或術后疼痛所致;2 d 后一般狀態可,患肢活動良好、體質量無明顯減輕,切口無炎性反應;術后 1 周左右切口愈合,10 d 后拆線。
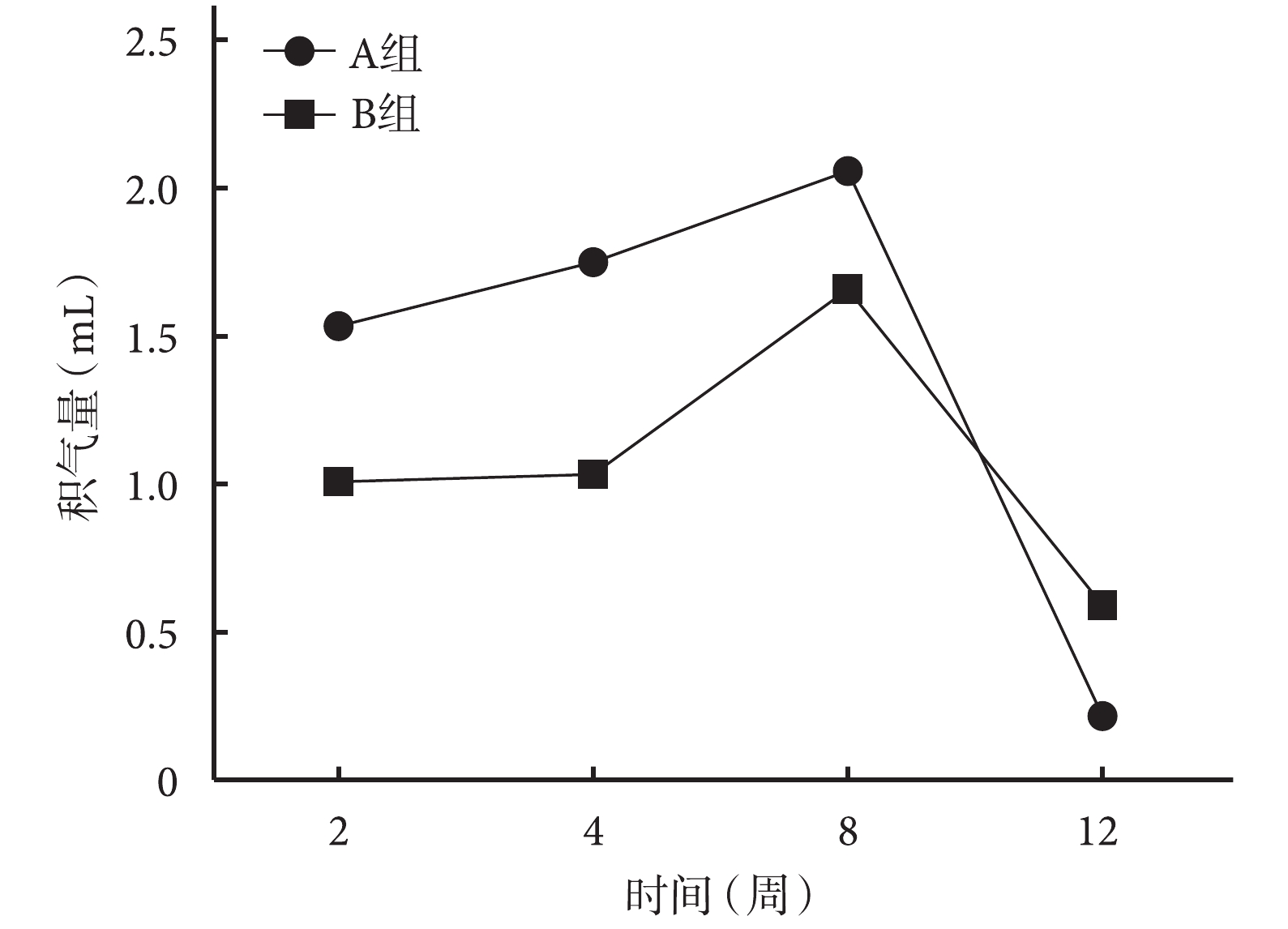
局部穿刺收集皮下積氣顯示,A、B 組皮下積氣量均隨植入時間延長而增加,于 8 周達高峰后迅速減少。術后 2、4、8 周 B 組皮下積氣量少于 A 組,2、4 周時兩組間比較差異有統計學意義(t=2.651,P=0.023;t=2.544,P=0.013),8周時差異無統計學意義(t=1.687,P=0.120);但術后 12 周時 B 組積氣量多于 A 組,差異亦有統計學意義(t=2.343,P=0.039)。見圖 2。
2.2 X 線片觀察
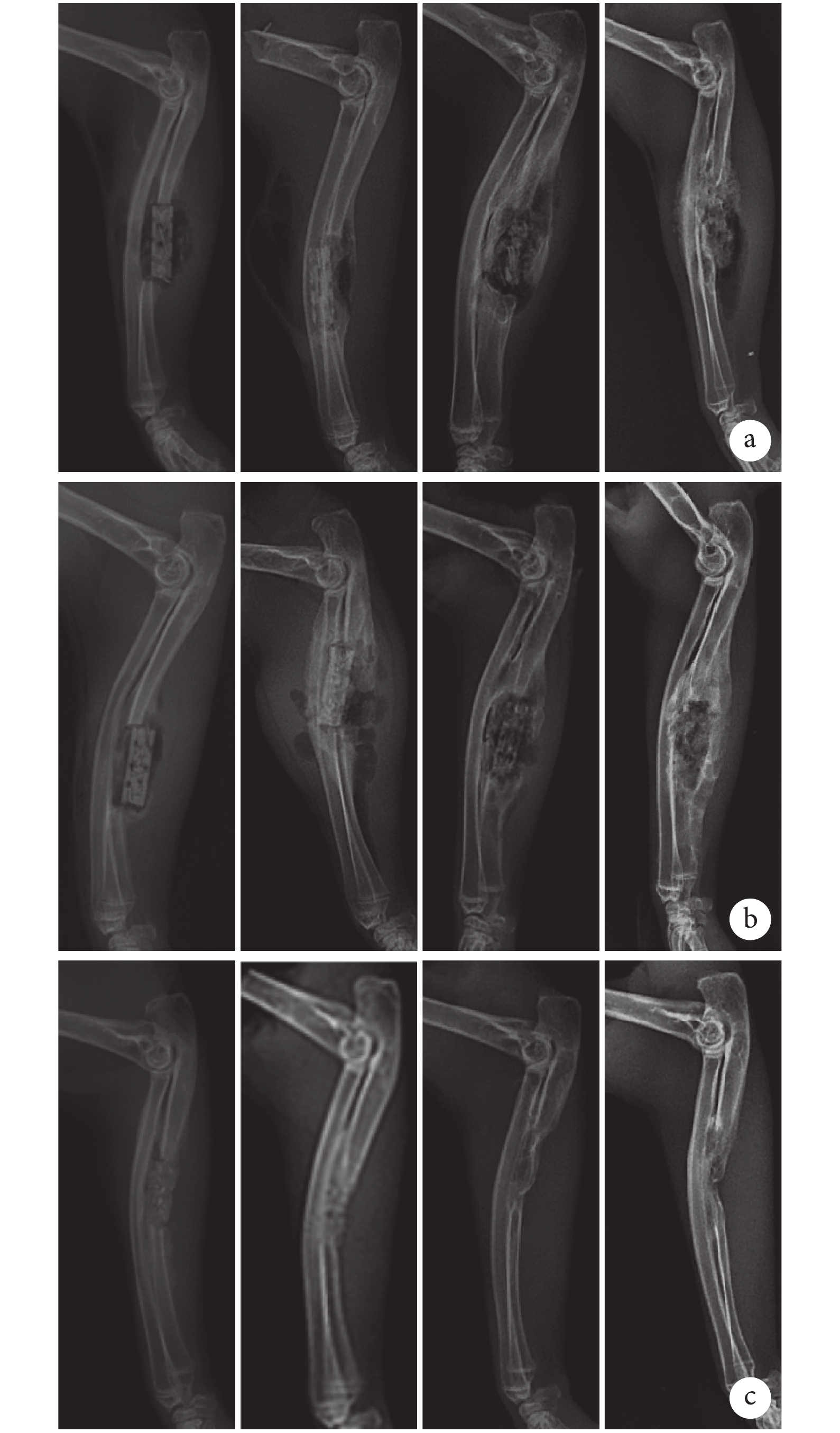
X 線片觀察示,術后 2 周時各組均未見明顯骨痂生成。2 周后 C 組骨缺損修復效果良好,僅 12 周時在局部存在一定程度的骨吸收。與 C 組比較,A、B 組術后 4 周植入物周圍僅可見少量骨痂生成,但隨后顯著增多,8 周時骨缺損部分修復,支架外可觀察到新生骨橋形成,12 周時缺損完全修復,同時可觀察到 B 組新生骨組織塑形明顯優于 A 組。見圖 3。
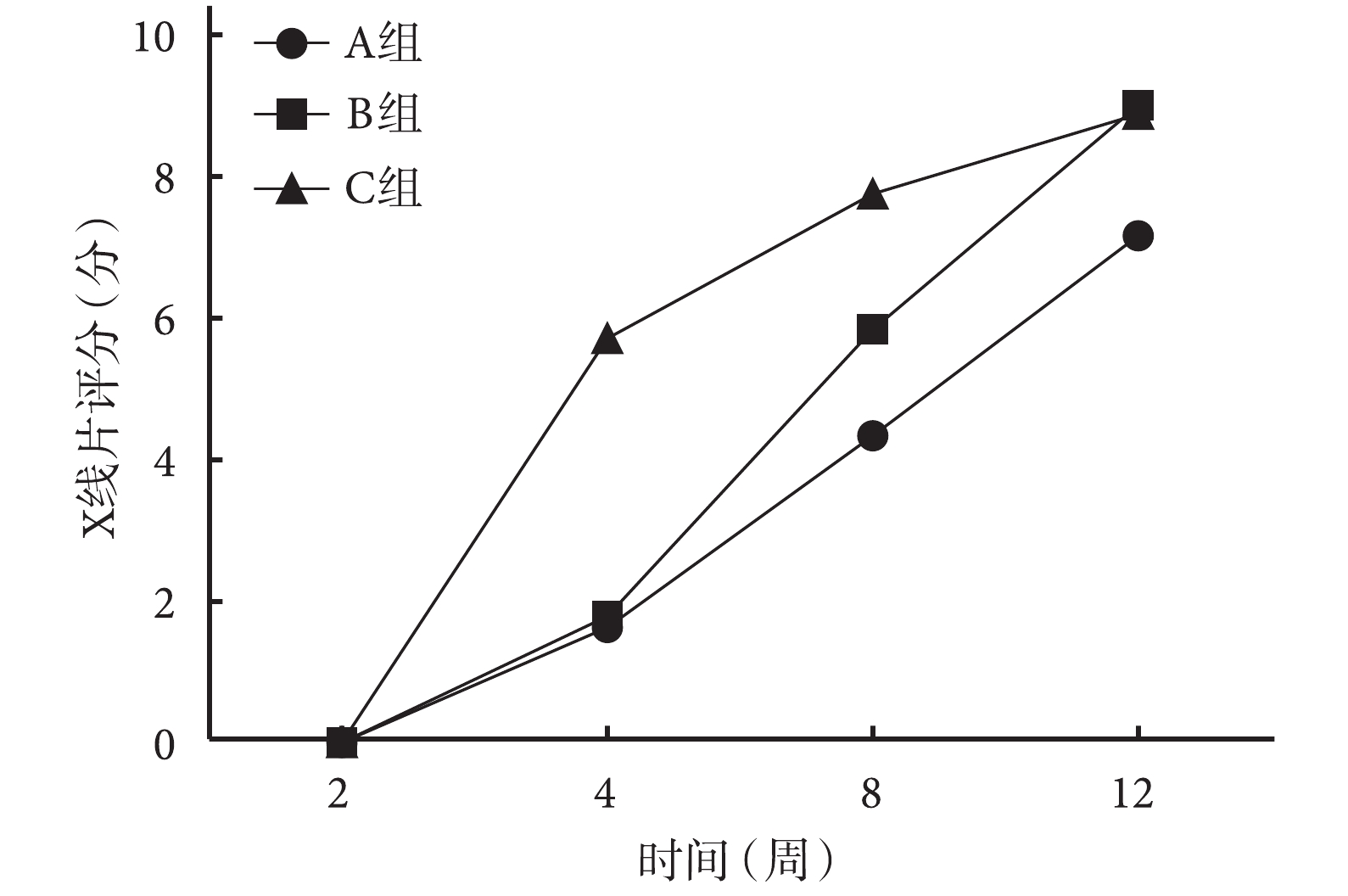
術后 4、8 周 C 組 X 線片評分顯著高于 A、B 組,差異有統計學意義(P<0.05);術后 8 周時 B 組顯著高于 A 組,差異有統計學意義(P<0.05)。術后 12 周 B、C 組顯著高于 A 組,差異有統計學意義(P<0.05);但 B、C 組間差異無統計學意義(P>0.05)。見圖 4。
2.3 Micro-CT 掃描
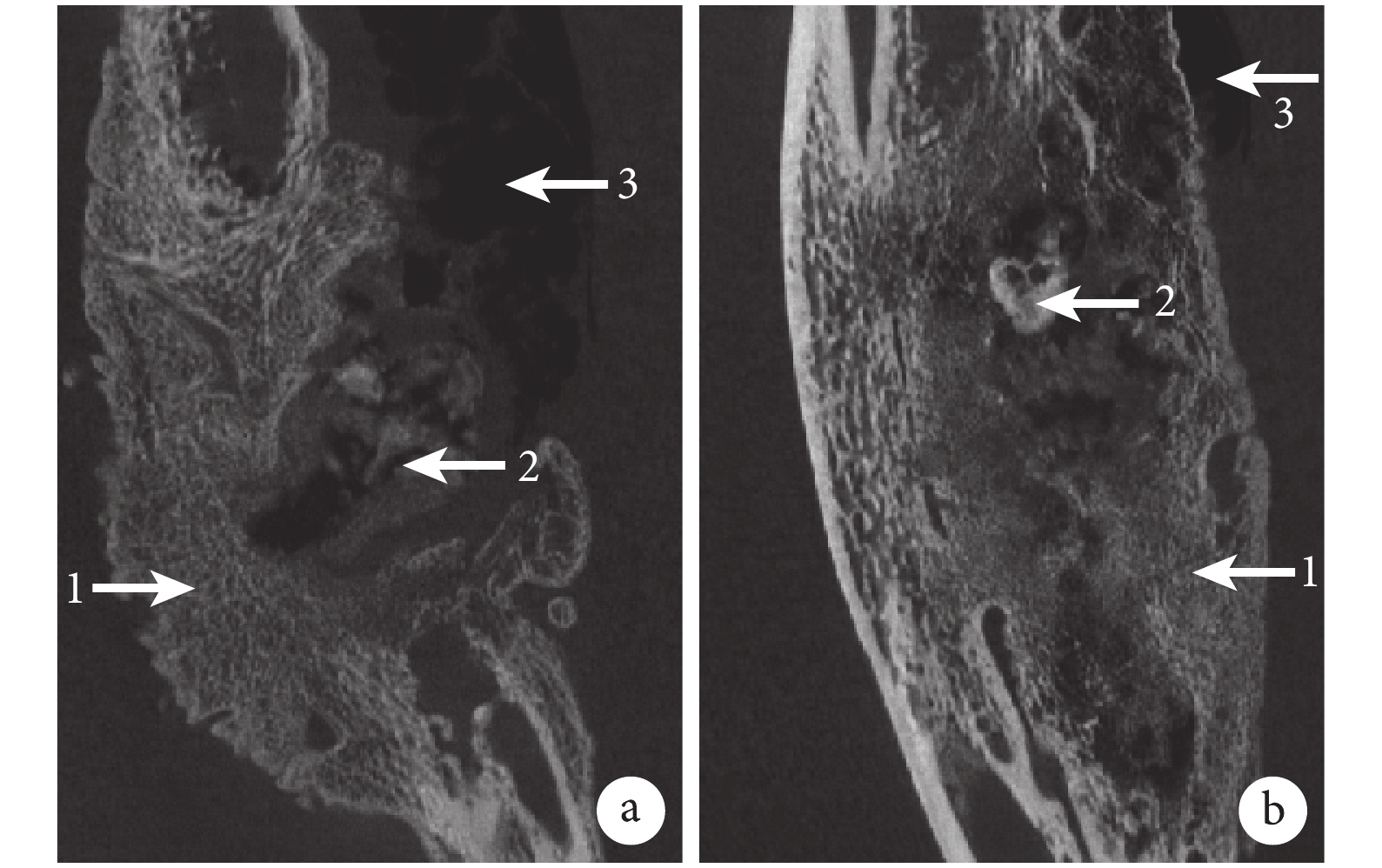
Micro-CT 掃描觀察示,術后 12 周,可見 A、B 組骨缺損部位由大量新生骨填充,但 A 組骨痂不規則,可見大量積氣,支架消失;而 B 組仍可觀察到少量殘余支架結構,骨缺損部位新生骨痂較 A 組致密,周圍積氣明顯較 A 組減少。見圖 5。
術后 4、8 周,B 組 CR 及ΔV 均顯著低于 A 組,差異有統計學意義(P<0.05);術后 12 周,A 組支架已完全降解消失。見表 1。
 )
Table1.
Comparison of ΔV and CR between groups A and B at different time points (n=6,
)
Table1.
Comparison of ΔV and CR between groups A and B at different time points (n=6,
 )
)
2.4 血清學指標檢測
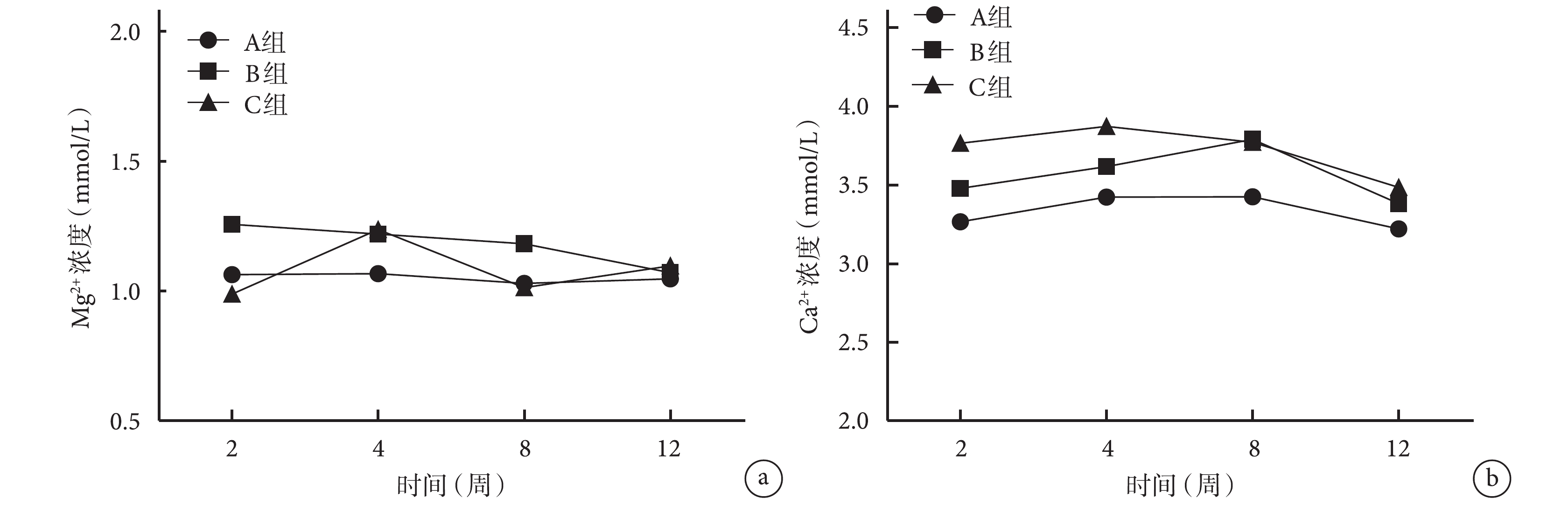
術后各時間點 3 組血清 Mg2+、Ca2+ 濃度比較,差異均無統計學意義(P>0.05)。見圖 6。
2.5 Van Gieson 染色觀察
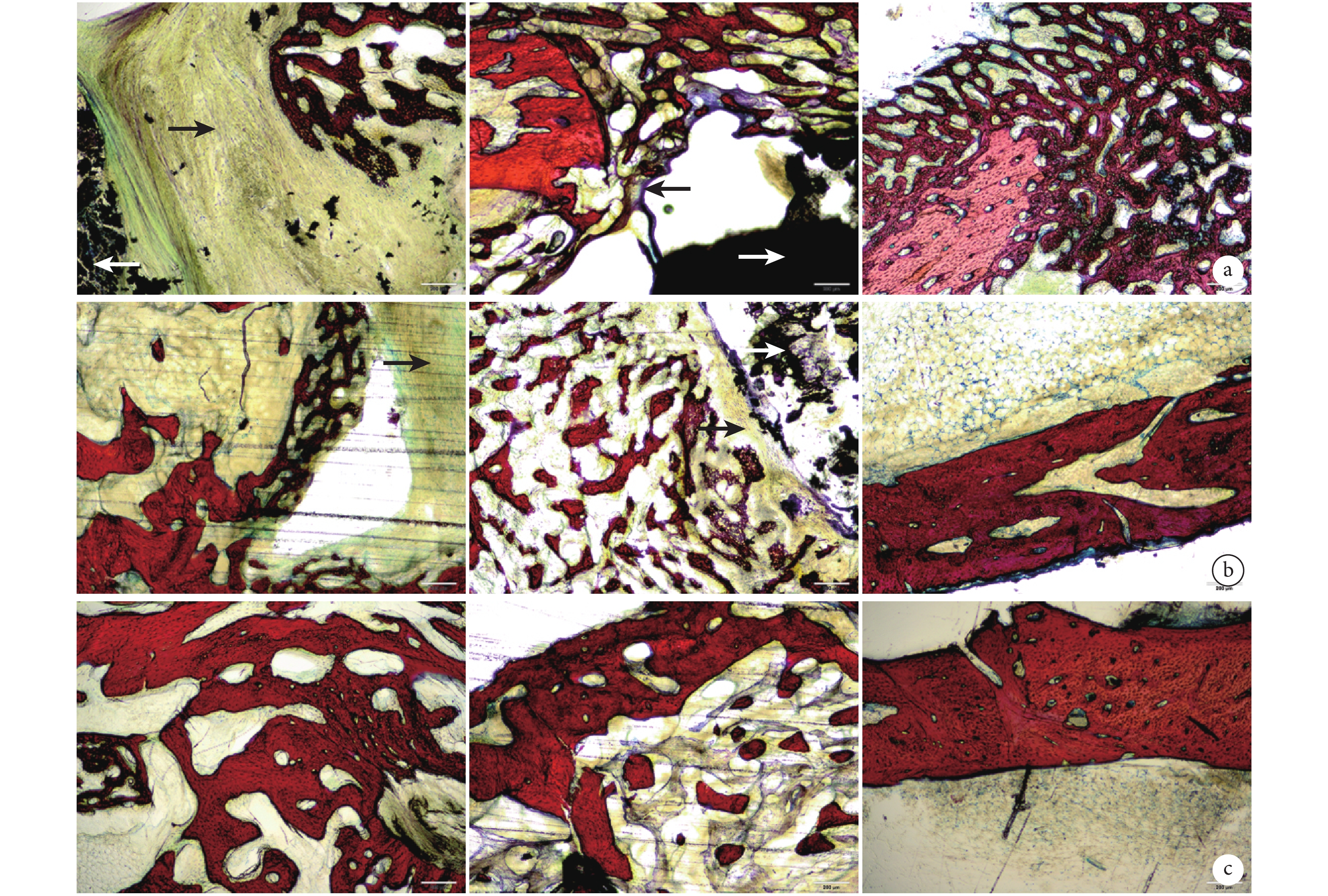
由于術后 2 周無明顯骨痂生成,因此收集術后 4、8、12 周骨缺損周圍新骨進行組織學檢測。術后 4 周,各組缺損部位周圍均可觀察到排列不規則、形態不成熟的骨細胞及大量軟骨細胞;A 組支架與新骨之間形成厚纖維結締組織膜,而 B 組支架周圍纖維結締組織膜明顯較薄。術后 8 周,各組缺損部位周圍均可觀察更多成熟骨細胞,且排列明顯較 4 周時規則,C 組軟骨細胞明顯少與其他兩組;A 組支架周圍纖維膜仍明顯厚于 B 組。術后 12 周,A、B 組支架周圍新生骨內成熟骨細胞進一步增多且排列更規整,周圍的纖維膜消失;B 組支架周圍觀察到少量軟骨細胞分布。見圖 7。
2.6 組織病理學觀察
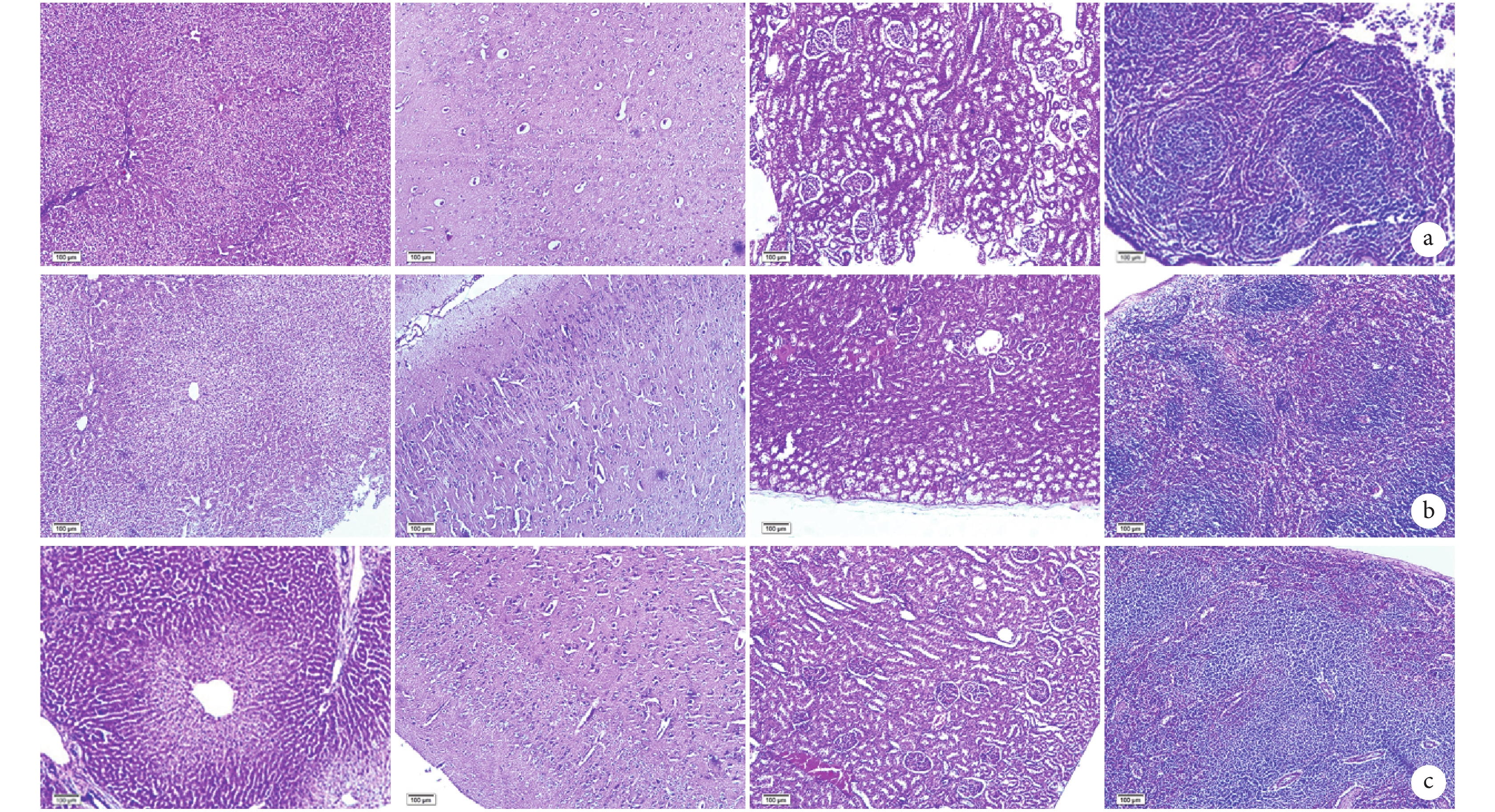
術后 12 周,3 組實驗動物的肝、腦、腎及脾組織 HE 染色均未見明顯病理改變。見圖 8。
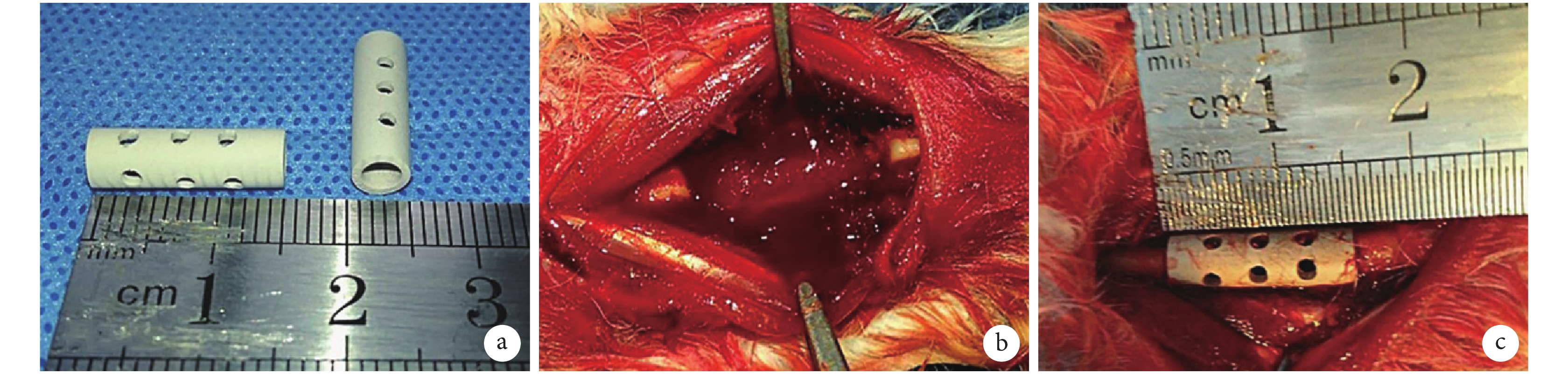 圖1
MAO 涂層 Mg-Zn-Ca 合金支架及動物模型制備過程示意圖
圖1
MAO 涂層 Mg-Zn-Ca 合金支架及動物模型制備過程示意圖
a. 支架外觀;b. 兔尺骨 CSD 模型;c. 支架植入骨缺損后
Figure1. Appearance of MAO coated Mg-Zn-Ca alloy scaffold and the schematic diagram of the operation processa. Appearance of the scaffold; b. Ulna CSD model of rabbit; c. After implanting the scaffold into defect
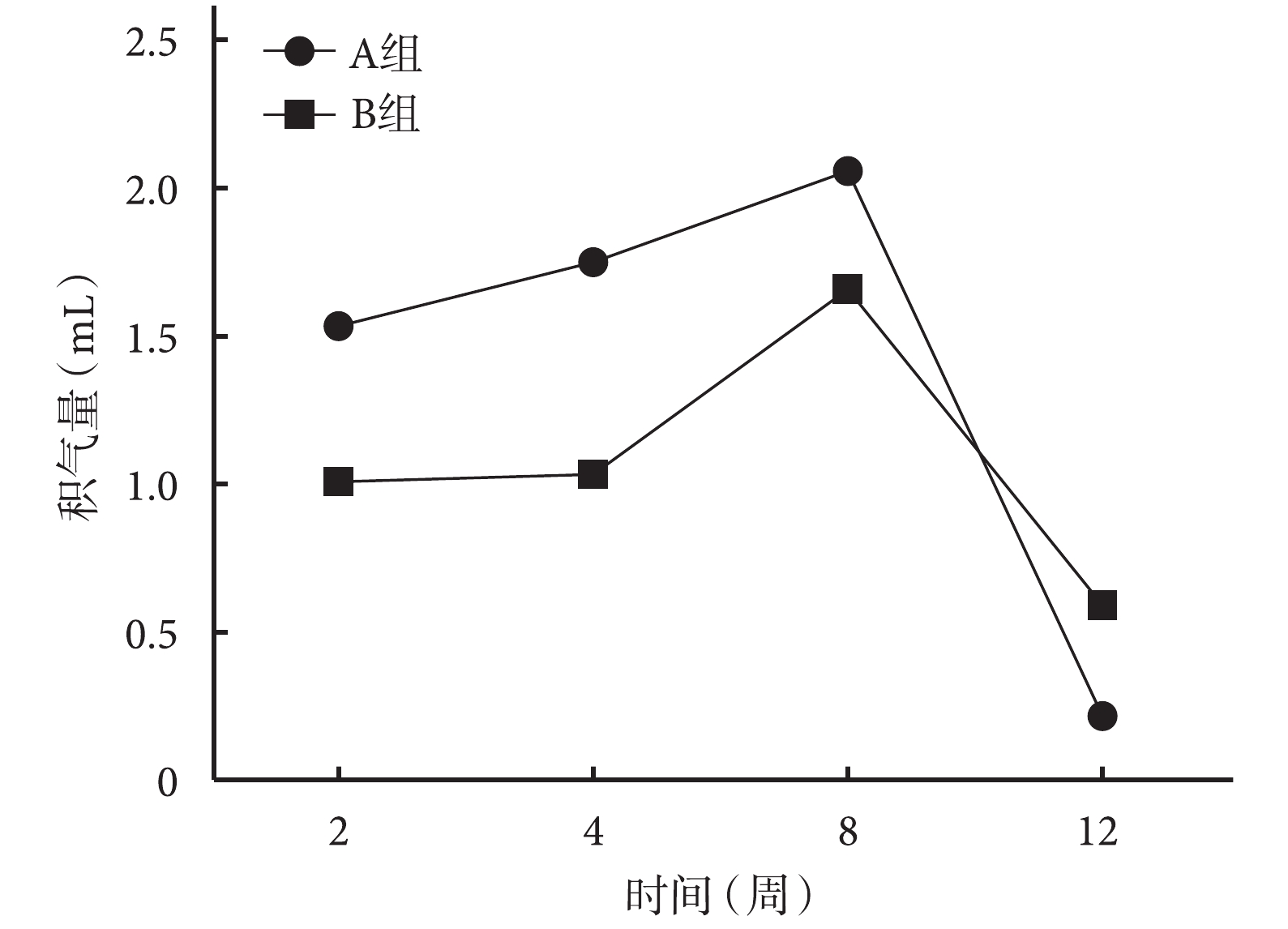 圖2
術后各時間點 A、B 組動物局部皮下積氣量比較
Figure2.
Comparison of local subcutaneous pneumatosis between groups A and B at different time points
圖2
術后各時間點 A、B 組動物局部皮下積氣量比較
Figure2.
Comparison of local subcutaneous pneumatosis between groups A and B at different time points
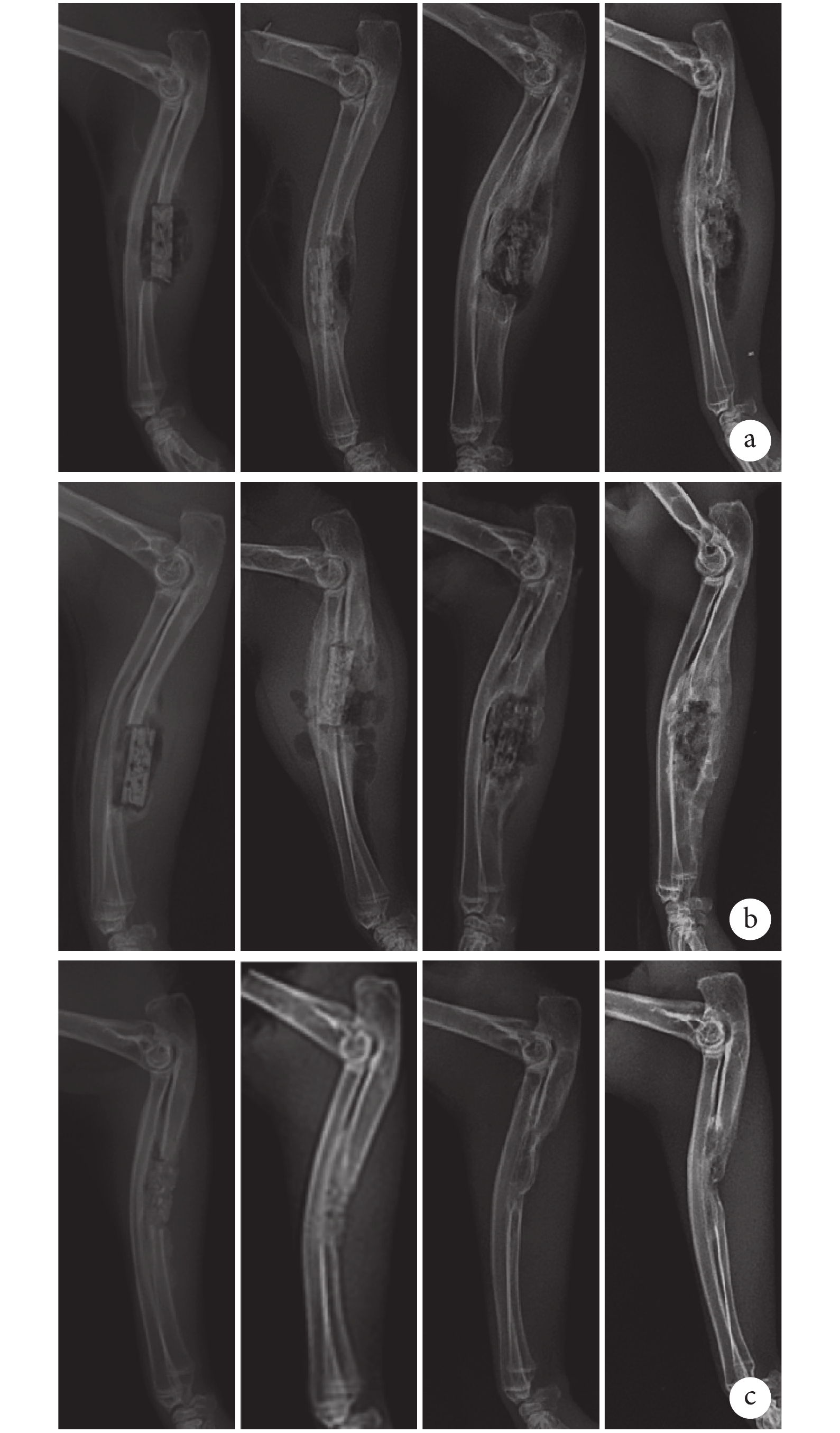 圖3
術后各時間點各組 X 線片觀察
圖3
術后各時間點各組 X 線片觀察
從左至右依次為術后 2、4、8、12 周 a. A 組;b. B 組;c. C 組
Figure3. X-ray films of 3 groups at different time pointsFrom left to right for postoperative at 2, 4, 8, and 12 weeks, respectivelya. Group A; b. Group B; c. Group C
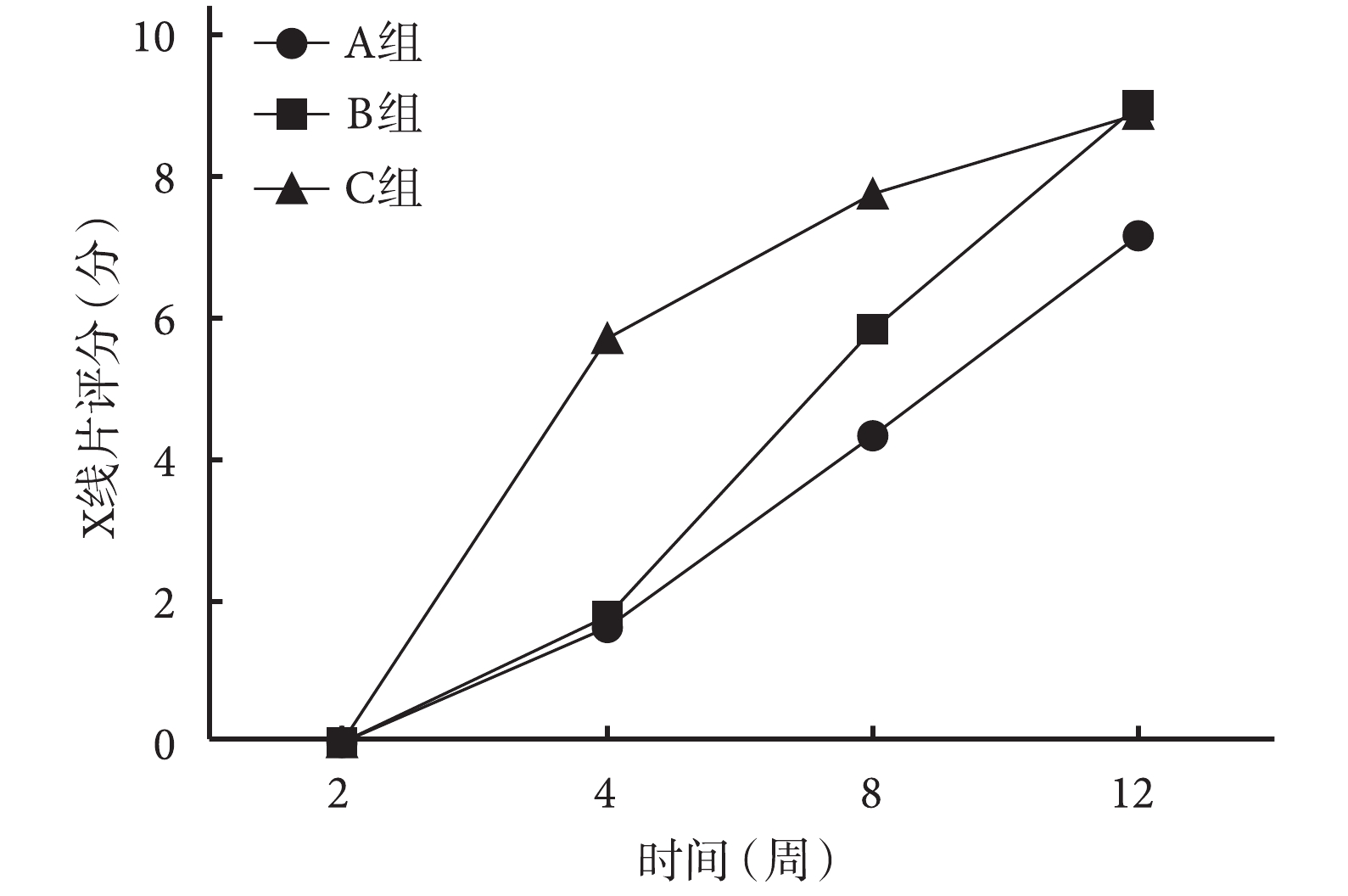 圖4
術后各時間點各組 X 線片評分比較
Figure4.
Comparison of X-ray scores between groups at different time points
圖4
術后各時間點各組 X 線片評分比較
Figure4.
Comparison of X-ray scores between groups at different time points
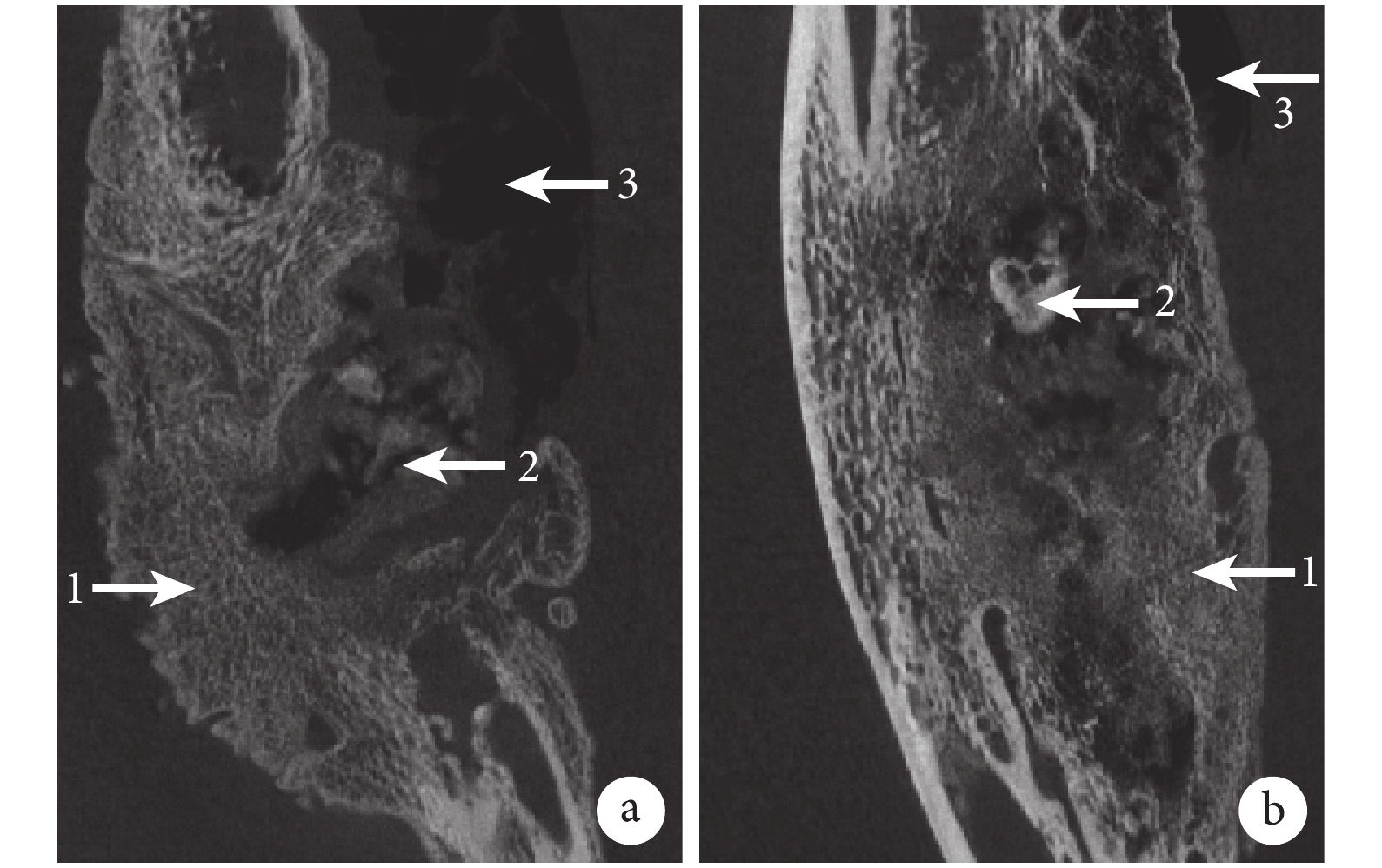 圖5
術后 12 周 A、B 組 Micro-CT 掃描觀察(×20)
圖5
術后 12 周 A、B 組 Micro-CT 掃描觀察(×20)
1:不規則的新生骨組織 2:剩余支架及降解產物 3:組織間積氣 a. A 組;b. B 組
Figure5. Micro-CT images of groups A and B at 12 weeks after surgery (×20)1: Irregular renew bone 2: Scaffold or degradable products 3: Pneumatosis a. Group A; b. Group B
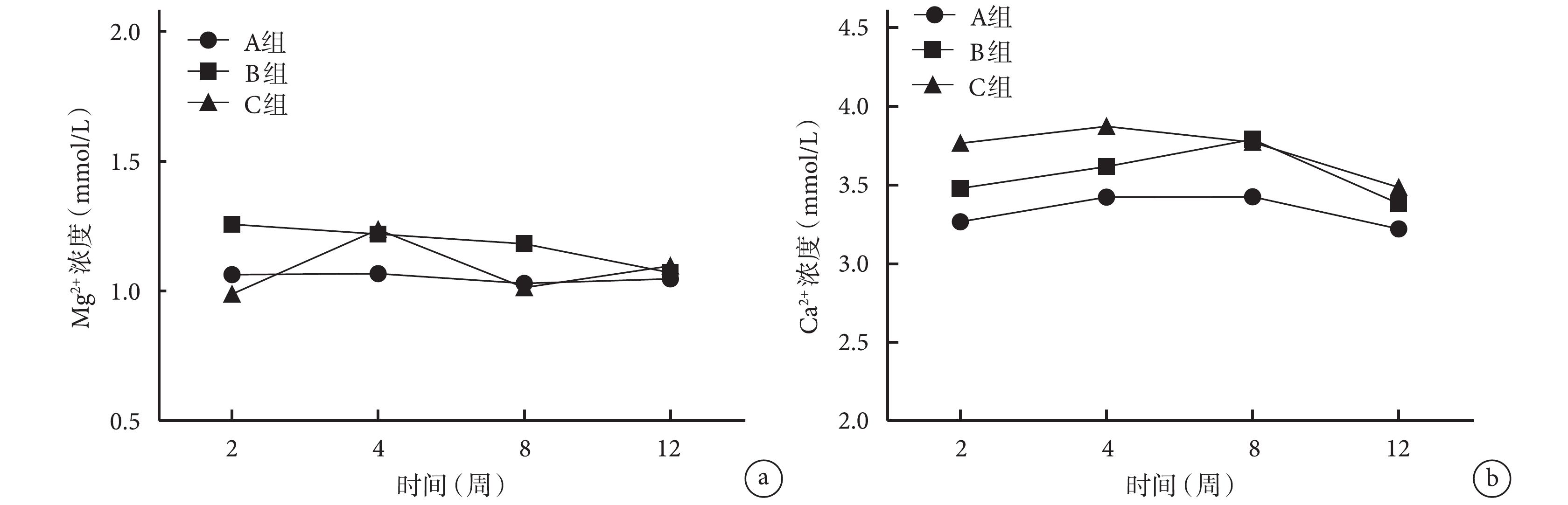 圖6
術后各時間點各組血清 Mg2+、Ca2+ 濃度比較
圖6
術后各時間點各組血清 Mg2+、Ca2+ 濃度比較
a. Mg2+;b. Ca2+
Figure6. Comparison of Mg2+ and Ca2+ concentrations between groups at different time pointsa. Mg2+; b. Ca2+
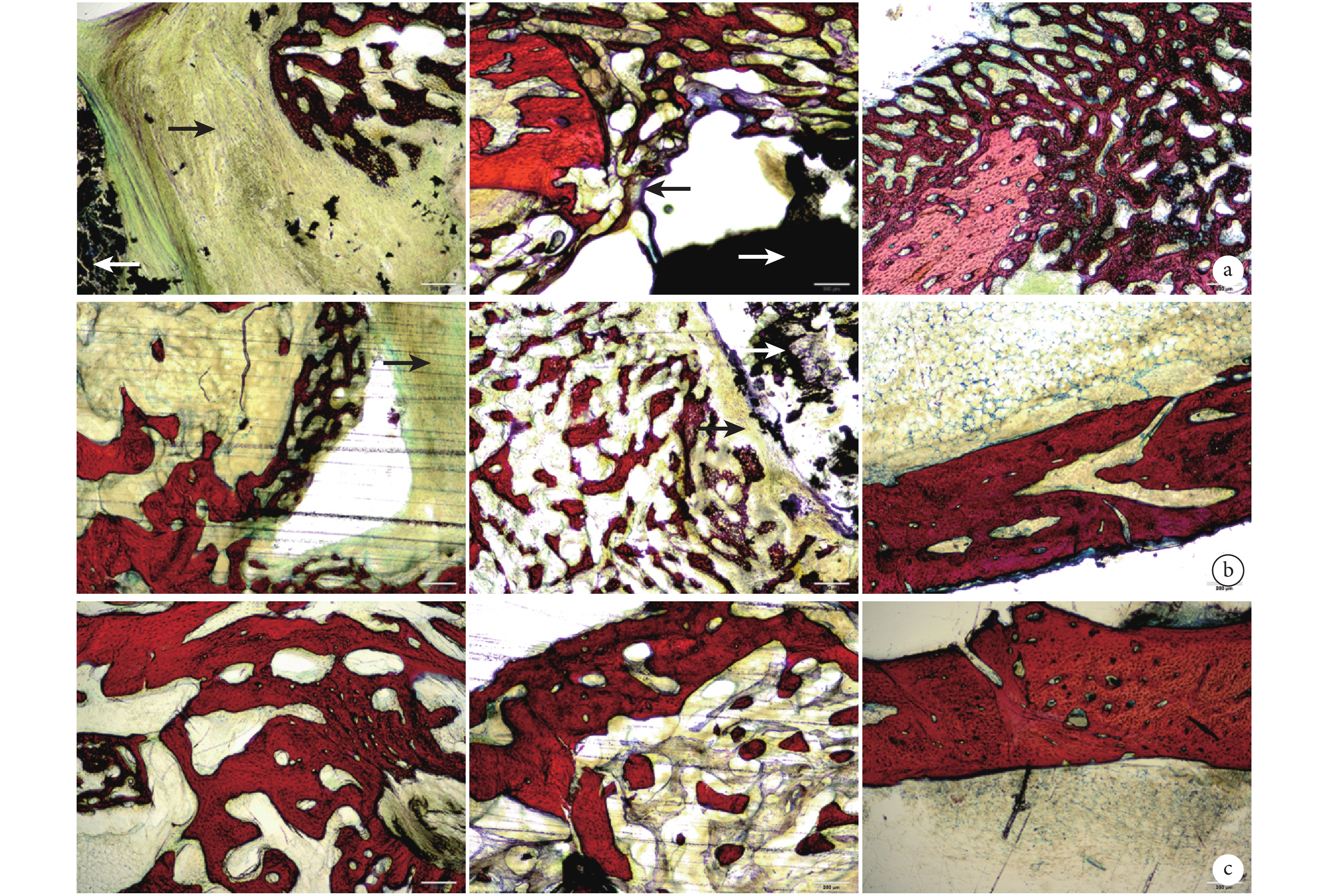 圖7
術后各時間點各組 Van Gieson 染色觀察(×4)
圖7
術后各時間點各組 Van Gieson 染色觀察(×4)
白箭頭示支架,黑箭頭示纖維結締組織膜 從左至右依次為 A 組、B 組、C 組a. 術后 4 周;b. 術后 8 周;c. 術后 12 周
Figure7. Van Gieson staining observation of 3 groups at different time points (×4)White arrow indicated the scaffold, black arrow indicated fibrous connective tissue membrane From left to right for groups A, B, and C, respectively a. Postoperative at 4 weeks; b. Postoperative at 8 weeks; c. Postoperative at 12 weeks
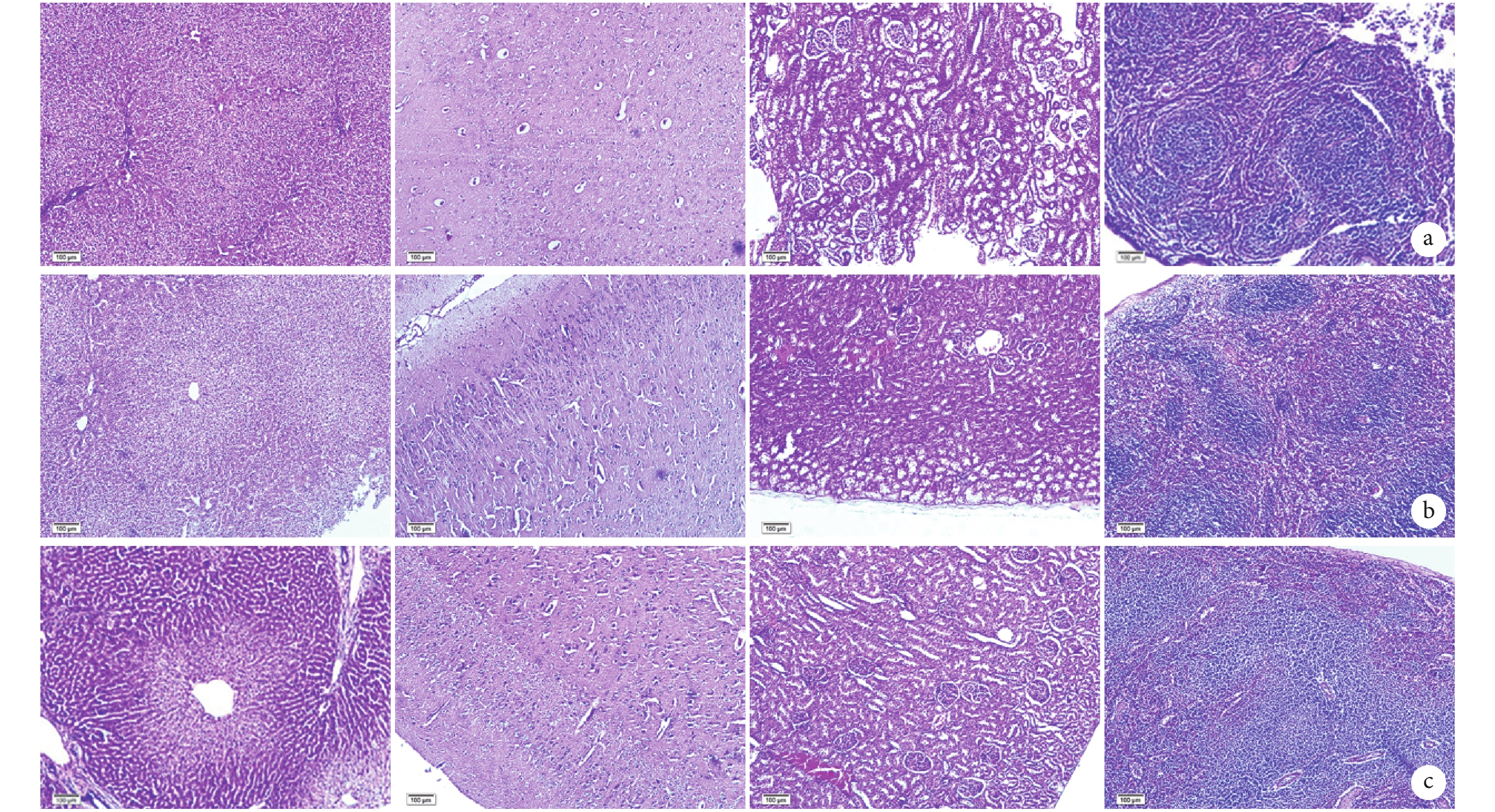 圖8
術后 12 周各組各器官組織病理學觀察(HE×20)
圖8
術后 12 周各組各器官組織病理學觀察(HE×20)
從左至右依次為肝、腦、腎及脾組織 a. A 組;b. B 組;c. C 組
Figure8. Histopathological observation of organs in each group at 12 weeks after surgery (HE×20)From left to right for liver, brain, kidney, and spleen, respectively a. Group A; b. Group B; c. Group C
3 討論
目前已有大量報道顯示,Mg-Zn-Ca 合金具有良好生物相容性、骨誘導性及抗腐蝕性。Fazel 等[19]通過體外細胞毒性實驗證實,采用 Mg-Zn-Ca 合金提取液培養的脂肪干細胞具有良好活性;Zhao 等[20]研究顯示,Mg-Zn-Ca 合金能夠誘導內植物周圍形成大量新骨組織,具有促進新骨形成的作用;Jang 等[21]的研究表明,經過等離子電解氧化處理的 Mg-Zn-Ca 合金在體內具有良好抗腐蝕性;Smith 等[15]將 AZ31 Mg 合金板卷成圓筒狀結構,并將其植入至兔尺骨 CSD 中,結果顯示植入 12 周后尺骨缺損能夠得到有效修復,力學檢測結果顯示經修復后的尺骨力學特征能夠達到正常尺骨標準;葛野等[16]利用 Mg-鍶(Sr)合金制備成多孔骨移植替代品修復 1.0 cm 橈骨缺損,結果也顯示 Mg-Sr 合金能夠有效修復骨缺損。本研究將 Mg-Zn-Ca 合金制備成金屬支架并填充自體顆粒骨來修復兔尺骨 CSD,該支架在早期能提供足夠支撐,降解釋放 Mg2+、Ca2+ 促進成骨細胞分化,抑制破骨細胞活性;同時,對移植的自體顆粒骨可起到穩定保護作用,避免其被機體二次吸收,有利于成骨因子的釋放及微血管長入,共同促進局部新骨生成。
本研究結果顯示,隨著植入時間延長,支架周圍均形成新骨并逐漸包裹支架,術后 12 周 X 線片示骨缺損部位由大量新生骨填充,尺骨連續性和完整性得到良好恢復,而同期 C 組則出現一定程度骨吸收。術后 12 周 Micro-CT 掃描也顯示,A、B 組在骨缺損部位均存在大量骨小梁不規則排列的新生骨組織,并完全填充缺損部位,未觀察到類似骨吸收現象。與 A 組術后 X 線片評分比較,B 組在實驗過程中均表現出更好的愈合效果,且術后 12 周 X 線片評分顯示 B 組骨愈合效果與 C 組并無顯著差異。我們認為這可能是 MAO 涂層所致,這種涂層含有 1 個致密內層和 1 個多孔外層,致密內層在植入初期能阻止體液對 Mg 基質的腐蝕及金屬離子向機體的游離,在某種程度上減少氫氣釋放,從而減小了對新骨再生的影響;多孔外層具有疏松孔徑,有利于成骨細胞附著及骨組織生長,也有利于植入材料與骨的機械嵌合。而 A 組支架沒有 MAO 涂層保護,導致體內降解速度過快,局部氫氣大量堆積以及力學性能快速丟失,都會影響到局部新骨再生。
為了驗證 MAO 涂層對支架耐腐蝕性的影響,我們利用 Micro-CT 對各組術后各時間點樣本進行掃描并計算ΔV 和 CR。結果顯示,A 組支架在術后 4 周即丟失了近一半體積,8 周時已幾乎降解消失;而 B 組支架術后 4、8 周時體積損失及降解速度均明顯小于 A 組,至術后 12 周時才基本降解消失;說明 10 μm MAO 涂層能有效提高 Mg-Zn-Ca 合金支架的耐腐蝕性,使其在體內較長時間保持一定的結構完整。皮下積氣量測量結果也間接證明了這個結果。Mg 合金在體內降解并釋放氫氣,當 Mg 金屬腐蝕速度過快和/或氣體吸收不充分,會導致局部氣體殘留形成皮下積氣。兩支架組皮下積氣量結果顯示,術后 2、4、8 周 B 組積氣量均明顯少于 A 組,但 12 周時 B 組積氣量卻多于 A 組,這可能是由于 A 組支架此時已基本降解消失,而 B 組支架依然持續產氣所致。值得注意的是,術后 8 周 A、B 組積氣量比較差異無統計學意義,提示 MAO 涂層可能在 8 周左右已基本被腐蝕吸收失去其保護功能。因此,B 組支架 CR 逐漸增加,說明 MAO 涂層在植入 8 周前能夠有效增加 Mg-Zn-Ca 合金在體內的抗腐蝕性。
Mg 合金的生物相容性已被大量體內及體外實驗所證實[19-21]。而 MAO 涂層被認為是一種仿生涂層,能夠有效增加 Mg 合金基質的生物相容性,減少機體排斥反應,使成骨細胞更容易增殖并黏附于支架表面[22-23]。也有研究報道 Mg 合金與新生物之間會形成一層纖維結締組織膜,這種纖維結締組織膜本質上是機體的一種異物排斥反應,它能夠誘導淋巴細胞和炎性因子滲出,從而限制骨細胞的形成[24]。本研究組織學結果顯示,實驗過程中在 A、B 組支架與新生骨之間存在一層纖維結締組織膜,而在 C 組并未發現類似纖維結締組織膜,但 B 組支架周圍的纖維結締組織膜明顯變薄且不連續,該結果說明 MAO 涂層能夠有效增加 Mg-Zn-Ca 合金的生物相容性。同時由于我們植入的 Mg-Zn-Ca 合金支架體積相對較大,單位時間降解后會釋放更多 Mg2+ 進入循環系統,可能會提高血清 Mg2+、Ca2+ 濃度,對肝、腦、腎及脾等器官造成不良影響。為了驗證這種 Mg-Zn-Ca 合金支架的生物安全性,我們進一步監測了實驗動物的各種生化指標及主要臟器的病理改變。結果顯示,與 C 組比較,A、B 組血清 Mg2+和 Ca2+ 均未出現明顯變化;病理學結果也顯示 A、B 組支架在降解過程中未對機體重要器官產生不良影響。進一步證明了這種新型 Mg-Zn-Ca 合金支架具有良好的生物相容性。
綜上述,本研究結果表明該新型 MAO 涂層 Mg-Zn-Ca 合金支架聯合自體顆粒骨能有效修復 CSD,降解產物對機體無不良影響;同時 10 μm MAO 涂層能夠有效改善 Mg-Zn-Ca 合金支架的生物相容性、抗腐蝕性能以及促成骨性。但本研究還存在一些不足,首先,這種 Mg-Zn-Ca 合金支架在降解過程中形成局部皮下積氣,這種皮下積氣量可能會對新骨形成產生不良影響,還需進一步研究來控制其在體內降解速度,使其與自然骨愈合過程匹配。其次,本研究未進行相關生物力學檢測,不能有效反映支架在體內機械性能的變化情況,也需要進一步研究完善。
臨界性骨缺損(critical size bone defect,CSD)是指由嚴重的創傷、感染、骨腫瘤切除、人工關節置換術后翻修、先天畸形等原因引起的,達到一定長度或范圍后不能自然愈合,又不能通過單純固定解決的骨缺損[1],一直是臨床骨科治療的難點。目前常用帶血管蒂骨移植修復大段骨缺損,但存在骨瓣營養血管位置不確定、手術創傷大、受局部血運影響大、學習曲線高、一旦失敗后果嚴重等問題[2-3]。自體顆粒骨移植雖然一直被認為是治療骨缺損的“金標準”[4],但也存在供骨量有限、供區并發癥、結構松散、易被機體吸收等缺陷,在修復長骨缺損時常需同時植入金屬鈦網給予支撐穩定。但金屬鈦網無誘導成骨能力,植入后易引起局部塌陷、慢性炎癥、異物反應等并發癥;同時,因其不可降解會在體內永久存留,進而對機體造成不良影響[5]。近年來,由于鎂(Mg)及其合金機械性能與人骨接近[6-7],Mg2+ 在維持細胞結構和功能方面具有重要作用[8-9],人體內約一半含量的 Mg 存在于骨組織中[10-11],而且 Mg 及其合金能夠促進局部鈣沉積,具有良好的骨傳導性和骨誘導性[12-14]。因此,Mg 合金作為一種潛在骨科內植物材料受到廣泛關注。
Mg 合金作為唯一具有可降解性的金屬生物材料,近年來雖然有研究將其作為骨替代物來嘗試修復骨缺損,并獲得良好效果[15-16],但是將 Mg 合金制備成支架修復大段長骨缺損依然鮮有報道。本研究采用 Mg-鋅(Zn)-鈣(Ca)合金為材料,首次設計制造了一種新型中空圓柱形支架,這種結構在降低支架質量(約 50%)同時,還能維持足夠機械強度,內部類似皮質骨的空間允許填充自體顆粒骨,表面均勻分布的網孔有助于骨痂長入。我們假設結合自體顆粒骨誘導成骨的特性,發揮 Mg 合金良好的骨誘導性、可降解性和力學性能,嘗試利用這種新型支架修復 CSD。同時為了增加這種支架在體內的抗腐蝕性和生物相容性,我們采用微弧氧化(micro-arc oxidation,MAO)技術在其表面添加一層 10 μm 厚生物陶瓷涂層,并通過動物實驗來評估這種支架修復 CSD 的效果,同時進一步評估 MAO 涂層對支架體內抗腐蝕性和生物相容性的影響。
1 材料與方法
1.1 Mg-Zn-Ca 合金支架材料
本研究采用的 Mg-Zn-Ca 合金支架由哈爾濱工業大學材料學院提供,以 Mg-Zn-Ca 合金為主要基質材料[2.5 wt%~3.0 wt% Ca,0.7 wt%~1.3 wt% Zn,0.2 wt%錳(Mn)和純 Mg],采用壓鑄工藝制備成圓柱形管狀支架(長 15 mm、內徑 3 mm、外徑 5 mm),表面均勻分布 12 個直徑 1 mm 的圓孔;并通過 MAO 技術對其表面改型,制備一層約 10 μm 厚的生物陶瓷涂層[17],主要成分為 MgO,此外還含有 Mg 和 Ca 的磷酸鹽。見圖 1a。所有支架在植入前均采用環氧乙烷氣體消毒。
1.2 實驗動物及主要試劑、儀器
成年新西蘭白兔 72 只,雌雄各半,體質量(2.71±0.32)kg,由齊齊哈爾醫學院動物實驗中心提供。
戊巴比妥鈉(北京普博斯生物科技有限公司);鈣黃綠素(Sigma-Aldrich 公司,美國);Van Gieson 染色液(上海博谷生物科技有限公司)。CR-IR 357 Capsula X 線機(富士公司,日本);Siemens Inveon Micro-CT、Inveon 軟件(Siemens 公司,德國);EXAKT00CP 型切片機、EXAKT00CS 磨片機、DM4000B 熒光顯微鏡(Leica 公司,德國);Hitachi 7600 自動生化分析儀(Hitachi 公司,日本);X71 光學顯微鏡及成像系統(Olympus 公司,日本)。
1.3 實驗分組及造模方法
將新西蘭白兔隨機分為 3 組,每組 24 只。A 組:無涂層 Mg-Zn-Ca 合金支架組;B 組:MAO 涂層 Mg-Zn-Ca 合金支架組;C 組:單純自體顆粒骨植骨對照組。所有動物以 3% 戊巴比妥鈉溶液(30 mg/kg)耳緣靜脈注射麻醉,四肢固定于手術臺上,雙側前肢剃毛備皮常規消毒。于前肢中段背側作 4 cm 弧形切口,切開皮膚分離組織顯露尺骨中段,用擺鋸截骨制備 15 mm 長 CSD 模型(圖 1b)。A、B 組將截取的尺骨咬碎制成顆粒骨(1~3 mm)填充于支架內,壓實后植入尺骨缺損處(圖 1c),生理鹽水反復沖洗后通過縫合肌肉及筋膜固定支架;C 組將自體顆粒骨原位植入至骨缺損部位。關閉切口后無菌包扎。造模后動物分籠飼養,可在無外固定情況下立即自由活動并充分飲食、水;預防性肌肉注射青霉素 80 萬 U 3 d,每天 2 次。術后 2、4、8、12 周每組各取 6 只動物進行研究。
1.4 觀測指標
1.4.1 大體觀察
觀察動物一般狀態、活動、攝入食水、體質量、切口愈合及炎性并發癥發生情況等;同時監測 A、B 組動物局部皮下積氣情況,利用無菌注射器局部穿刺收集局部皮下積氣,記錄積氣量。
1.4.2 X 線片觀察
利用 CR-IR 357 Capsula X 線機行側位 X 線掃描,投射條件:70 V,0.69 mA,1.5 s。掃描后由 3 位放射科醫師采用雙盲法對骨缺損愈合情況進行評分,采用 Lane-Sandhu 評分標準[18],范圍從 0 分(未治療)到 12 分(恢復正常骨結構),7 分以上認為骨缺損初步愈合。
1.4.3 Micro-CT 掃描
利用 Siemens Inveon Micro-CT 在電壓 80 kV、電流 500 μA 下掃描,利用 Inveon 軟件對數據進行處理。鑒于 C 組無支架,因此僅觀察 A、B 組術后支架降解情況及術后 12 周缺損部位新骨形態。按以下公式計算術后 4、8、12 周支架降解丟失體積百分比(ΔV)和降解速度(corrosion rate,CR),ΔV=(V0–Vx)/V0×100%,其中 V0 為支架初始體積,Vx 為不同時間點支架剩余體積;CR=(V0–Vx)/(A×t),其中 A 是支架初始面積,t 是術后時間(單位為年)。
1.4.4 血清學指標檢測
術后各時間點處死實驗動物前,清晨空腹耳緣靜脈采血,抗凝,將血樣置于室溫下靜止 1 h,以離心半徑 20 cm、3 500 r/min 離心 10 min,分離上清液,采用 Hitachi 7600 自動生化分析儀測量血清中 Mg2+ 和 Ca2+ 濃度。
1.4.5 Van Gieson 染色觀察
術后各時間點采用驅血法處死動物后收集前肢,去除皮膚軟組織剝離尺骨,70% 乙醇固定;梯度乙醇真空脫水、透明、脫脂、包埋,然后固定于 EXAKT00CP 型切片機切成 200 μm 厚硬組織切片,EXAKT00CS 磨片機依次以 800、1 200、2 500 目水砂紙打磨拋光獲得 50 μm 厚骨磨片;常規 Van Gieson 染色后,4 倍光鏡下觀察缺損部位新生骨組織形態。
1.4.6 組織病理學觀察
術后 12 周處死各組動物后收集腦、肝、腎和脾組織,常規行 HE 染色,20 倍光鏡下觀察組織結構。
1.5 統計學方法
采用 SPSS18.0 統計軟件進行分析。數據以均值±標準差表示,多組間比較采用單因素方差分析,兩兩比較采用 SNK 檢驗;兩組間比較采用獨立樣本t檢驗;檢驗水準 α=0.05。
2 結果
2.1 大體觀察
所有實驗動物均耐受手術,術后麻醉蘇醒后即可自由活動;術后 2 d 食欲較差,考慮麻醉或術后疼痛所致;2 d 后一般狀態可,患肢活動良好、體質量無明顯減輕,切口無炎性反應;術后 1 周左右切口愈合,10 d 后拆線。
局部穿刺收集皮下積氣顯示,A、B 組皮下積氣量均隨植入時間延長而增加,于 8 周達高峰后迅速減少。術后 2、4、8 周 B 組皮下積氣量少于 A 組,2、4 周時兩組間比較差異有統計學意義(t=2.651,P=0.023;t=2.544,P=0.013),8周時差異無統計學意義(t=1.687,P=0.120);但術后 12 周時 B 組積氣量多于 A 組,差異亦有統計學意義(t=2.343,P=0.039)。見圖 2。
2.2 X 線片觀察
X 線片觀察示,術后 2 周時各組均未見明顯骨痂生成。2 周后 C 組骨缺損修復效果良好,僅 12 周時在局部存在一定程度的骨吸收。與 C 組比較,A、B 組術后 4 周植入物周圍僅可見少量骨痂生成,但隨后顯著增多,8 周時骨缺損部分修復,支架外可觀察到新生骨橋形成,12 周時缺損完全修復,同時可觀察到 B 組新生骨組織塑形明顯優于 A 組。見圖 3。
術后 4、8 周 C 組 X 線片評分顯著高于 A、B 組,差異有統計學意義(P<0.05);術后 8 周時 B 組顯著高于 A 組,差異有統計學意義(P<0.05)。術后 12 周 B、C 組顯著高于 A 組,差異有統計學意義(P<0.05);但 B、C 組間差異無統計學意義(P>0.05)。見圖 4。
2.3 Micro-CT 掃描
Micro-CT 掃描觀察示,術后 12 周,可見 A、B 組骨缺損部位由大量新生骨填充,但 A 組骨痂不規則,可見大量積氣,支架消失;而 B 組仍可觀察到少量殘余支架結構,骨缺損部位新生骨痂較 A 組致密,周圍積氣明顯較 A 組減少。見圖 5。
術后 4、8 周,B 組 CR 及ΔV 均顯著低于 A 組,差異有統計學意義(P<0.05);術后 12 周,A 組支架已完全降解消失。見表 1。
 )
Table1.
Comparison of ΔV and CR between groups A and B at different time points (n=6,
)
Table1.
Comparison of ΔV and CR between groups A and B at different time points (n=6,
 )
)
2.4 血清學指標檢測
術后各時間點 3 組血清 Mg2+、Ca2+ 濃度比較,差異均無統計學意義(P>0.05)。見圖 6。
2.5 Van Gieson 染色觀察
由于術后 2 周無明顯骨痂生成,因此收集術后 4、8、12 周骨缺損周圍新骨進行組織學檢測。術后 4 周,各組缺損部位周圍均可觀察到排列不規則、形態不成熟的骨細胞及大量軟骨細胞;A 組支架與新骨之間形成厚纖維結締組織膜,而 B 組支架周圍纖維結締組織膜明顯較薄。術后 8 周,各組缺損部位周圍均可觀察更多成熟骨細胞,且排列明顯較 4 周時規則,C 組軟骨細胞明顯少與其他兩組;A 組支架周圍纖維膜仍明顯厚于 B 組。術后 12 周,A、B 組支架周圍新生骨內成熟骨細胞進一步增多且排列更規整,周圍的纖維膜消失;B 組支架周圍觀察到少量軟骨細胞分布。見圖 7。
2.6 組織病理學觀察
術后 12 周,3 組實驗動物的肝、腦、腎及脾組織 HE 染色均未見明顯病理改變。見圖 8。
 圖1
MAO 涂層 Mg-Zn-Ca 合金支架及動物模型制備過程示意圖
圖1
MAO 涂層 Mg-Zn-Ca 合金支架及動物模型制備過程示意圖
a. 支架外觀;b. 兔尺骨 CSD 模型;c. 支架植入骨缺損后
Figure1. Appearance of MAO coated Mg-Zn-Ca alloy scaffold and the schematic diagram of the operation processa. Appearance of the scaffold; b. Ulna CSD model of rabbit; c. After implanting the scaffold into defect
 圖2
術后各時間點 A、B 組動物局部皮下積氣量比較
Figure2.
Comparison of local subcutaneous pneumatosis between groups A and B at different time points
圖2
術后各時間點 A、B 組動物局部皮下積氣量比較
Figure2.
Comparison of local subcutaneous pneumatosis between groups A and B at different time points
 圖3
術后各時間點各組 X 線片觀察
圖3
術后各時間點各組 X 線片觀察
從左至右依次為術后 2、4、8、12 周 a. A 組;b. B 組;c. C 組
Figure3. X-ray films of 3 groups at different time pointsFrom left to right for postoperative at 2, 4, 8, and 12 weeks, respectivelya. Group A; b. Group B; c. Group C
 圖4
術后各時間點各組 X 線片評分比較
Figure4.
Comparison of X-ray scores between groups at different time points
圖4
術后各時間點各組 X 線片評分比較
Figure4.
Comparison of X-ray scores between groups at different time points
 圖5
術后 12 周 A、B 組 Micro-CT 掃描觀察(×20)
圖5
術后 12 周 A、B 組 Micro-CT 掃描觀察(×20)
1:不規則的新生骨組織 2:剩余支架及降解產物 3:組織間積氣 a. A 組;b. B 組
Figure5. Micro-CT images of groups A and B at 12 weeks after surgery (×20)1: Irregular renew bone 2: Scaffold or degradable products 3: Pneumatosis a. Group A; b. Group B
 圖6
術后各時間點各組血清 Mg2+、Ca2+ 濃度比較
圖6
術后各時間點各組血清 Mg2+、Ca2+ 濃度比較
a. Mg2+;b. Ca2+
Figure6. Comparison of Mg2+ and Ca2+ concentrations between groups at different time pointsa. Mg2+; b. Ca2+
 圖7
術后各時間點各組 Van Gieson 染色觀察(×4)
圖7
術后各時間點各組 Van Gieson 染色觀察(×4)
白箭頭示支架,黑箭頭示纖維結締組織膜 從左至右依次為 A 組、B 組、C 組a. 術后 4 周;b. 術后 8 周;c. 術后 12 周
Figure7. Van Gieson staining observation of 3 groups at different time points (×4)White arrow indicated the scaffold, black arrow indicated fibrous connective tissue membrane From left to right for groups A, B, and C, respectively a. Postoperative at 4 weeks; b. Postoperative at 8 weeks; c. Postoperative at 12 weeks
 圖8
術后 12 周各組各器官組織病理學觀察(HE×20)
圖8
術后 12 周各組各器官組織病理學觀察(HE×20)
從左至右依次為肝、腦、腎及脾組織 a. A 組;b. B 組;c. C 組
Figure8. Histopathological observation of organs in each group at 12 weeks after surgery (HE×20)From left to right for liver, brain, kidney, and spleen, respectively a. Group A; b. Group B; c. Group C
3 討論
目前已有大量報道顯示,Mg-Zn-Ca 合金具有良好生物相容性、骨誘導性及抗腐蝕性。Fazel 等[19]通過體外細胞毒性實驗證實,采用 Mg-Zn-Ca 合金提取液培養的脂肪干細胞具有良好活性;Zhao 等[20]研究顯示,Mg-Zn-Ca 合金能夠誘導內植物周圍形成大量新骨組織,具有促進新骨形成的作用;Jang 等[21]的研究表明,經過等離子電解氧化處理的 Mg-Zn-Ca 合金在體內具有良好抗腐蝕性;Smith 等[15]將 AZ31 Mg 合金板卷成圓筒狀結構,并將其植入至兔尺骨 CSD 中,結果顯示植入 12 周后尺骨缺損能夠得到有效修復,力學檢測結果顯示經修復后的尺骨力學特征能夠達到正常尺骨標準;葛野等[16]利用 Mg-鍶(Sr)合金制備成多孔骨移植替代品修復 1.0 cm 橈骨缺損,結果也顯示 Mg-Sr 合金能夠有效修復骨缺損。本研究將 Mg-Zn-Ca 合金制備成金屬支架并填充自體顆粒骨來修復兔尺骨 CSD,該支架在早期能提供足夠支撐,降解釋放 Mg2+、Ca2+ 促進成骨細胞分化,抑制破骨細胞活性;同時,對移植的自體顆粒骨可起到穩定保護作用,避免其被機體二次吸收,有利于成骨因子的釋放及微血管長入,共同促進局部新骨生成。
本研究結果顯示,隨著植入時間延長,支架周圍均形成新骨并逐漸包裹支架,術后 12 周 X 線片示骨缺損部位由大量新生骨填充,尺骨連續性和完整性得到良好恢復,而同期 C 組則出現一定程度骨吸收。術后 12 周 Micro-CT 掃描也顯示,A、B 組在骨缺損部位均存在大量骨小梁不規則排列的新生骨組織,并完全填充缺損部位,未觀察到類似骨吸收現象。與 A 組術后 X 線片評分比較,B 組在實驗過程中均表現出更好的愈合效果,且術后 12 周 X 線片評分顯示 B 組骨愈合效果與 C 組并無顯著差異。我們認為這可能是 MAO 涂層所致,這種涂層含有 1 個致密內層和 1 個多孔外層,致密內層在植入初期能阻止體液對 Mg 基質的腐蝕及金屬離子向機體的游離,在某種程度上減少氫氣釋放,從而減小了對新骨再生的影響;多孔外層具有疏松孔徑,有利于成骨細胞附著及骨組織生長,也有利于植入材料與骨的機械嵌合。而 A 組支架沒有 MAO 涂層保護,導致體內降解速度過快,局部氫氣大量堆積以及力學性能快速丟失,都會影響到局部新骨再生。
為了驗證 MAO 涂層對支架耐腐蝕性的影響,我們利用 Micro-CT 對各組術后各時間點樣本進行掃描并計算ΔV 和 CR。結果顯示,A 組支架在術后 4 周即丟失了近一半體積,8 周時已幾乎降解消失;而 B 組支架術后 4、8 周時體積損失及降解速度均明顯小于 A 組,至術后 12 周時才基本降解消失;說明 10 μm MAO 涂層能有效提高 Mg-Zn-Ca 合金支架的耐腐蝕性,使其在體內較長時間保持一定的結構完整。皮下積氣量測量結果也間接證明了這個結果。Mg 合金在體內降解并釋放氫氣,當 Mg 金屬腐蝕速度過快和/或氣體吸收不充分,會導致局部氣體殘留形成皮下積氣。兩支架組皮下積氣量結果顯示,術后 2、4、8 周 B 組積氣量均明顯少于 A 組,但 12 周時 B 組積氣量卻多于 A 組,這可能是由于 A 組支架此時已基本降解消失,而 B 組支架依然持續產氣所致。值得注意的是,術后 8 周 A、B 組積氣量比較差異無統計學意義,提示 MAO 涂層可能在 8 周左右已基本被腐蝕吸收失去其保護功能。因此,B 組支架 CR 逐漸增加,說明 MAO 涂層在植入 8 周前能夠有效增加 Mg-Zn-Ca 合金在體內的抗腐蝕性。
Mg 合金的生物相容性已被大量體內及體外實驗所證實[19-21]。而 MAO 涂層被認為是一種仿生涂層,能夠有效增加 Mg 合金基質的生物相容性,減少機體排斥反應,使成骨細胞更容易增殖并黏附于支架表面[22-23]。也有研究報道 Mg 合金與新生物之間會形成一層纖維結締組織膜,這種纖維結締組織膜本質上是機體的一種異物排斥反應,它能夠誘導淋巴細胞和炎性因子滲出,從而限制骨細胞的形成[24]。本研究組織學結果顯示,實驗過程中在 A、B 組支架與新生骨之間存在一層纖維結締組織膜,而在 C 組并未發現類似纖維結締組織膜,但 B 組支架周圍的纖維結締組織膜明顯變薄且不連續,該結果說明 MAO 涂層能夠有效增加 Mg-Zn-Ca 合金的生物相容性。同時由于我們植入的 Mg-Zn-Ca 合金支架體積相對較大,單位時間降解后會釋放更多 Mg2+ 進入循環系統,可能會提高血清 Mg2+、Ca2+ 濃度,對肝、腦、腎及脾等器官造成不良影響。為了驗證這種 Mg-Zn-Ca 合金支架的生物安全性,我們進一步監測了實驗動物的各種生化指標及主要臟器的病理改變。結果顯示,與 C 組比較,A、B 組血清 Mg2+和 Ca2+ 均未出現明顯變化;病理學結果也顯示 A、B 組支架在降解過程中未對機體重要器官產生不良影響。進一步證明了這種新型 Mg-Zn-Ca 合金支架具有良好的生物相容性。
綜上述,本研究結果表明該新型 MAO 涂層 Mg-Zn-Ca 合金支架聯合自體顆粒骨能有效修復 CSD,降解產物對機體無不良影響;同時 10 μm MAO 涂層能夠有效改善 Mg-Zn-Ca 合金支架的生物相容性、抗腐蝕性能以及促成骨性。但本研究還存在一些不足,首先,這種 Mg-Zn-Ca 合金支架在降解過程中形成局部皮下積氣,這種皮下積氣量可能會對新骨形成產生不良影響,還需進一步研究來控制其在體內降解速度,使其與自然骨愈合過程匹配。其次,本研究未進行相關生物力學檢測,不能有效反映支架在體內機械性能的變化情況,也需要進一步研究完善。