引用本文: 余盈盈, 趙明威, 苗恒. 基于房水病毒學和炎性細胞因子檢測的巨細胞病毒性視網膜炎治療模式的初步研究. 中華眼底病雜志, 2020, 36(1): 1-4. doi: 10.3760/cma.j.issn.1005-1015.2020.01.001 復制
目前異基因骨髓造血干細胞移植(Allo-HSCT)后巨細胞病毒(CMV)性視網膜炎(CMVR)診斷主要依據病史和眼科檢查[1];其治療和療效觀察也主要依賴于臨床體征,如視網膜炎病灶面積減小或血管周圍浸潤減輕則認為病情好轉[2-3]。但在臨床實踐過程中發現,臨床體征可能與實際病情的轉歸并非一致。部分眼底病灶已完全瘢痕化靜止的患者,其房水中仍可檢出CMV-DNA;而房水中CMV-DNA載量已經轉陰的患者,眼底則仍存在比較明顯的趨于瘢痕化的浸潤灶。隨著高通量和微量標本檢測技術的發展,房水病毒學和炎性細胞因子檢測是近年的研究熱點之一[4-5]。房水作為獲取較為方便且安全的眼內液,對多種眼內感染性疾病的診斷、治療和療效觀察均有重要價值[6]。房水中直接檢測到CMV-DNA的存在不但可為CMVR的診斷提供確切病原學依據,還可作為隨訪和療效觀察的重要指標察的重要指標[7]。IL-8是近年新發現與CMVR活動程度相關性較好的炎性細胞因子[7-8],相較房水CMV-DNA載量檢測,可能對CMVR的治療療效判斷和治療終點確定更為敏感[8]。為進一步個體化和量化Allo-HSCT后CMVR治療隨訪方案,安全有效地確定治療終點,我們檢測了一組Allo-HSCT后CMVR患者的房水CMV-DNA載量和IL-8水平。現將結果報道如下。
1 對象和方法
前瞻性病例系列研究。本研究經北京大學人民醫院倫理委員會審批(批準號:2018PHB196-01)。所有患者在接受治療前均已簽署書面知情同意書。
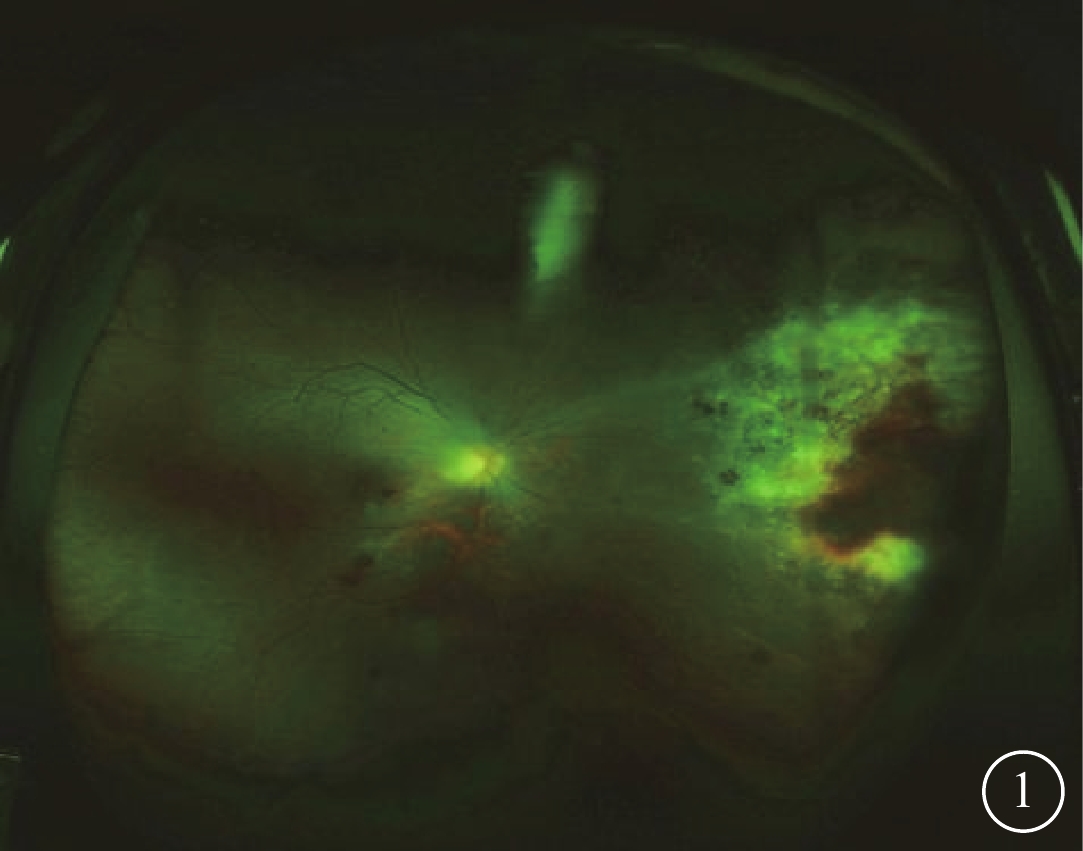
2016年1月至2018年12月于北京大學人民醫院眼科檢查確診的Allo-HSCT后CMVR患者14例22只眼納入研究。納入標準:(1)近1年內曾接受Allo-HSCT,移植前血清人類免疫缺陷病毒陰性;(2)視網膜存在出血和滲出灶混雜而成的“奶酪蕃茄醬”樣典型CMVR改變(圖1);(3)患眼房水檢測CMV-DNA陽性;(4)CMVR確診時血清CMV-DNA陰性。排除標準:(1)先天性青光眼、先天性角膜病變、先天性黃斑病變等其他可影響視功能疾病者;(2)既往有內眼手術史者;(3)CMVR確診時血清CMV-DNA載量陽性者。
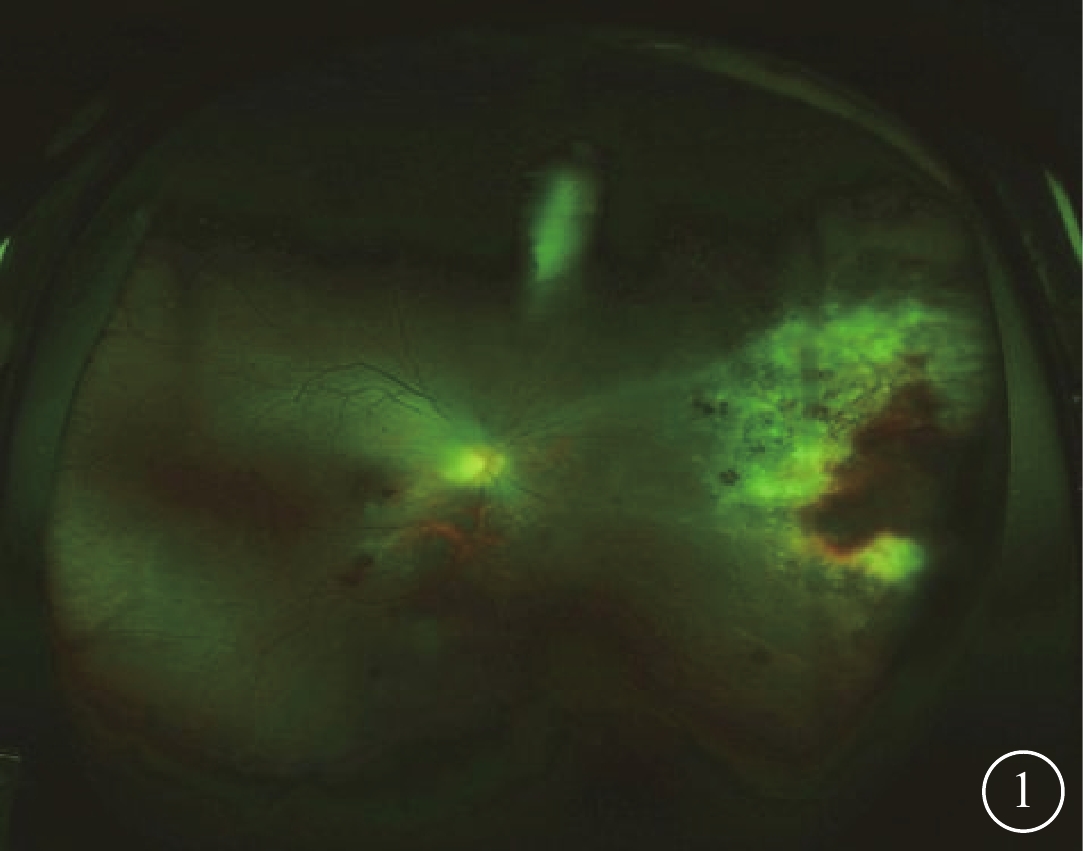 圖1
CMVR患者右眼彩色眼底像。鼻側周邊部可見“奶酪蕃茄醬”樣病灶,伴周圍血管白鞘
圖1
CMVR患者右眼彩色眼底像。鼻側周邊部可見“奶酪蕃茄醬”樣病灶,伴周圍血管白鞘
所有患者均給予玻璃體腔注射60 mg/ml更昔洛韋0.05 ml(含更昔洛韋3 mg)治療。負荷階段為2次/周,共4次;維持階段為1次/周。每周于首次更昔洛韋注射的同時抽取前房水,熒光定量PCR和酶聯免疫吸附試驗法測定其中CMV-DNA載量和IL-8水平。若房水中CMV-DNA載量轉陰(<103 拷貝/ml)或IL-8水平<30 pg/ml則終止更昔洛韋玻璃體腔注射,此后每2周隨診1次,至少6個月。隨訪中患者每3~4周重復監測血清CMV-DNA水平。
患者于每次玻璃體腔注射前和隨訪時均行BCVA、眼壓、裂隙燈顯微鏡、間接檢眼鏡以及彩色眼底照相檢查。采用國際標準視力表行BCVA檢查,統計時換算為logMAR視力。
采用SPSS 19.0軟件行統計學分析。呈正態分布的數據以均數±標準差( )表示。基線和末次隨訪時BCVA、眼壓比較采用Student t配對檢驗。P<0.05為差異有統計學意義。
)表示。基線和末次隨訪時BCVA、眼壓比較采用Student t配對檢驗。P<0.05為差異有統計學意義。
2 結果
14例22只眼中,男性5例,女性9例;單眼6例6只眼,雙眼8例16只眼。年齡5~49歲,中位年齡為25歲。Allo-HSCT后CMVR起病時間100~342 d,中位時間為158 d。CMVR確診時,患眼平均logMAR BCVA為0.814± 0.563;平均眼壓為(17.2±7.8)mmHg(1 mmHg=0.133 kPa);房水平均CMV-DNA載量為(3.43±4.96)×105 拷貝/ml,平均IL-8水平為(518±541)pg/ml。
眼局部治療終止時,玻璃體腔注射次數4~11次,中位注射次數為5次。房水CMV-DNA載量轉陰者9只眼,其中IL-8水平同時<30 pg/ml者7只眼;房水CMV-DNA載量陽性但IL-8水平<30 pg/ml者13只眼。22只眼中,眼底病灶完全瘢痕化靜止1只眼(4.5%);存在不同程度活動性炎癥如血管鞘(圖2A)等21只眼(95.5%)。
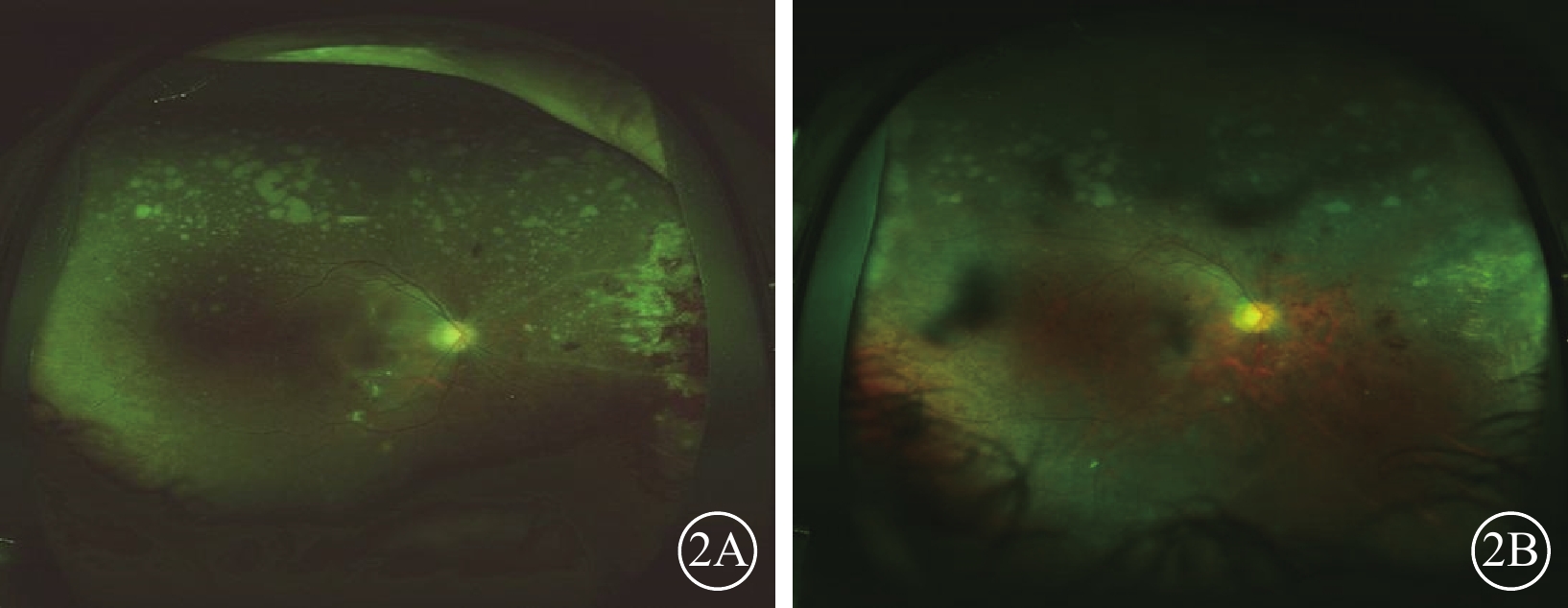 圖2
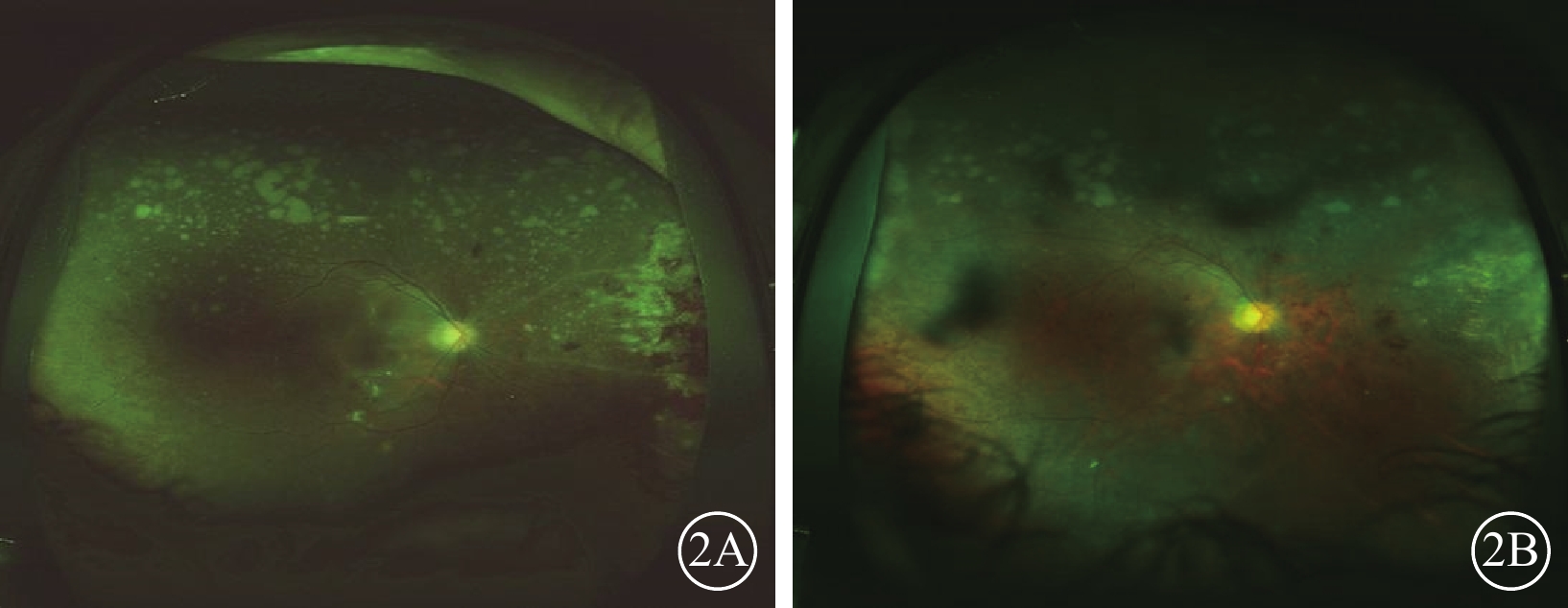
圖1同眼治療終止時及治療終止后6個月時彩色眼底像。2A示治療終止時,鼻側病灶面積明顯減小,但病灶附近視網膜血管鞘仍然存在;房水CMV-DNA載量為2.52×103 拷貝/ml,IL-8水平20.5 pg/ml。2B示治療終止6個月時,鼻側病灶完全瘢痕化,僅殘留少許視網膜出血
圖2
圖1同眼治療終止時及治療終止后6個月時彩色眼底像。2A示治療終止時,鼻側病灶面積明顯減小,但病灶附近視網膜血管鞘仍然存在;房水CMV-DNA載量為2.52×103 拷貝/ml,IL-8水平20.5 pg/ml。2B示治療終止6個月時,鼻側病灶完全瘢痕化,僅殘留少許視網膜出血
眼局部治療終止后6個月,患眼平均logMAR BCVA為0.812±0.691;平均眼壓為(14.8±5.4)mmHg。與基線時logMAR BCVA、眼壓比較,差異均無統計學意義(t=-0.107、1.517,P=0.916、0.137)。因系統性Epstein-Barr 病毒 (EBV)感染(EBV性腸炎和肺炎)致CMVR復發1只眼(4.5%),但房水中僅檢測到CMV-DNA,EBV-DNA載量陰性;眼底視網膜病灶完全瘢痕化(圖2B)21只眼(95.5%)。隨訪過程中所有患者血清CMV-DNA載量均呈陰性。眼部治療期間移植后用藥均為口服環孢素A和更昔洛韋,用藥劑量未行調整。
22只眼中,因治療過程中血小板計數過低(<30×109個/ml)而發生醫源性玻璃體積血4只眼(18.2%);眼局部終止治療6個月時,積血吸收眼底清晰可見。CMVR確診時發現晶狀體后囊下混濁2只眼(9%),結合病史考慮可能為Allo-HSCT后系統性糖皮質激素治療所致。
3 討論
傳統CMVR治療的療效隨訪和治療終點判定完全依靠眼科檢查。單純依靠眼科臨床查體結果評估病情變化常受到諸多因素限制:(1)眼內活動性CMV感染可能在視網膜的病理性改變完全緩解前已被清除,此時若僅依據眼科臨床檢查結果繼續予抗病毒治療則存在過度治療所致的諸多藥物性負面效應;(2)CMVR患者因混濁地玻璃體和積血妨礙眼底觀察,嚴重者甚至無法觀察到視網膜,進而難以對病情轉歸進行評估;(3)房水中CMV-DNA載量陽性僅表明眼內存在CMV,但不能反映眼內組織發生CMV感染的嚴重程度和免疫反應的活動程度[9-10]。因此,CMVR治療的療效判斷不能完全依靠臨床檢查所見和房水CMV-DNA載量檢測,而多種指標并聯應用可能更為科學合理。
近年隨著高通量和微量標本檢測技術的發展,房水炎性細胞因子的檢測開始應用于臨床 [7, 11]。已有研究結果證實,CMVR患眼注射抗病毒藥物時,其房水中IL-8水平呈持續下降趨勢,且與房水中CMV-DNA載量和臨床觀察到的病情轉歸相關[8];且當眼底病灶完全靜止后,房水IL-8水平多<30 pg/ml[8, 12]。IL-8主要由單核巨噬細胞分泌,是一種趨化因子,與免疫反應的活動強度有關[13]。因此,房水中IL-8水平很有可能成為繼房水CMV-DNA載量之外,另一個可以定量描述CMVR活動程度和轉歸的實驗室指標,其值<30 pg/ml也可能作為停止局部治療的定量指標。
本研究結果顯示,眼局部終止治療時,95.5%(21/22)的患眼視網膜炎性病灶尚未完全瘢痕化;而至終止治療后6個月時,除1只眼復發外,其余20只眼眼底病灶完全瘢痕化靜止。若按照傳統通過眼底檢查確定治療終點的隨診方案,此20只眼將全部被視為炎癥仍處于活動狀態而給予過度治療。房水中CMV-DNA載量和IL-8水平可很好地反應CMVR眼內病灶的活動程度,當CMV-DNA載量和IL-8水平任一“轉陰”時即停止局部抗病毒治療是一種有效的隨診方案。雖然患者在接受眼內注藥的過程中額外接受了前房穿刺和房水采集的操作,但其本身并不增加患者經濟負擔,也不會給患者帶來額外痛苦,且就總體而言,此種方案可為絕大多數患者(96%)減少總眼內注藥次數,進而減少過度治療帶來的經濟負擔和身體不適,總體收益依然是增加的。
至終止眼局部治療6個月時,僅1只眼CMVR復發。本例患者復發前數日突然發生EBV性腸炎和肺炎,但復發時房水中僅檢測到CMV-DNA,未檢測到EBV-DNA。因此,我們推測患者復發是系統性免疫功能下降所致,而非本研究隨訪方案所致。
雖然玻璃體腔注射通常是安全且有效的給藥途徑,但對Allo-HSCT后患者仍存在較多風險。其主要原因是患者血小板計數普遍偏低,或計數正常但功能不佳。本組患眼中,4只眼在抽取房水和玻璃體腔注射藥物過程中發生玻璃體積血,但隨訪至6個月時積血均吸收眼底清晰可見。提示此類并發癥并不影響疾病預后,本研究隨診方案安全性較好。
本研究存在的局限性:(1)納入的樣本數較少且隨訪時間較短,統計分析可能存在一定偏倚。(2)Allo-HSCT后CMVR的發生和發展受患者免疫狀態影響,而影響患者免疫重建的因素也同樣種類繁多。本研究雖然盡可能選取基線和隨訪中臨床表現和用藥情況一致的患者,但由于本病臨床較為少見,仍難以將除眼部外其他因素完全一致化,如供體-受體匹配程度、移植前用藥等因素對本隨診方案結果的影響尚無法排除。(3)本研究為前瞻性單臂研究,未設置對照組,因此結果的可靠性受到影響。未來我們將開展前瞻性隨機對照臨床研究,以通過更詳實豐富的數據進一步明確該隨訪方案的安全性和有效性。
目前異基因骨髓造血干細胞移植(Allo-HSCT)后巨細胞病毒(CMV)性視網膜炎(CMVR)診斷主要依據病史和眼科檢查[1];其治療和療效觀察也主要依賴于臨床體征,如視網膜炎病灶面積減小或血管周圍浸潤減輕則認為病情好轉[2-3]。但在臨床實踐過程中發現,臨床體征可能與實際病情的轉歸并非一致。部分眼底病灶已完全瘢痕化靜止的患者,其房水中仍可檢出CMV-DNA;而房水中CMV-DNA載量已經轉陰的患者,眼底則仍存在比較明顯的趨于瘢痕化的浸潤灶。隨著高通量和微量標本檢測技術的發展,房水病毒學和炎性細胞因子檢測是近年的研究熱點之一[4-5]。房水作為獲取較為方便且安全的眼內液,對多種眼內感染性疾病的診斷、治療和療效觀察均有重要價值[6]。房水中直接檢測到CMV-DNA的存在不但可為CMVR的診斷提供確切病原學依據,還可作為隨訪和療效觀察的重要指標察的重要指標[7]。IL-8是近年新發現與CMVR活動程度相關性較好的炎性細胞因子[7-8],相較房水CMV-DNA載量檢測,可能對CMVR的治療療效判斷和治療終點確定更為敏感[8]。為進一步個體化和量化Allo-HSCT后CMVR治療隨訪方案,安全有效地確定治療終點,我們檢測了一組Allo-HSCT后CMVR患者的房水CMV-DNA載量和IL-8水平。現將結果報道如下。
1 對象和方法
前瞻性病例系列研究。本研究經北京大學人民醫院倫理委員會審批(批準號:2018PHB196-01)。所有患者在接受治療前均已簽署書面知情同意書。
2016年1月至2018年12月于北京大學人民醫院眼科檢查確診的Allo-HSCT后CMVR患者14例22只眼納入研究。納入標準:(1)近1年內曾接受Allo-HSCT,移植前血清人類免疫缺陷病毒陰性;(2)視網膜存在出血和滲出灶混雜而成的“奶酪蕃茄醬”樣典型CMVR改變(圖1);(3)患眼房水檢測CMV-DNA陽性;(4)CMVR確診時血清CMV-DNA陰性。排除標準:(1)先天性青光眼、先天性角膜病變、先天性黃斑病變等其他可影響視功能疾病者;(2)既往有內眼手術史者;(3)CMVR確診時血清CMV-DNA載量陽性者。
 圖1
CMVR患者右眼彩色眼底像。鼻側周邊部可見“奶酪蕃茄醬”樣病灶,伴周圍血管白鞘
圖1
CMVR患者右眼彩色眼底像。鼻側周邊部可見“奶酪蕃茄醬”樣病灶,伴周圍血管白鞘
所有患者均給予玻璃體腔注射60 mg/ml更昔洛韋0.05 ml(含更昔洛韋3 mg)治療。負荷階段為2次/周,共4次;維持階段為1次/周。每周于首次更昔洛韋注射的同時抽取前房水,熒光定量PCR和酶聯免疫吸附試驗法測定其中CMV-DNA載量和IL-8水平。若房水中CMV-DNA載量轉陰(<103 拷貝/ml)或IL-8水平<30 pg/ml則終止更昔洛韋玻璃體腔注射,此后每2周隨診1次,至少6個月。隨訪中患者每3~4周重復監測血清CMV-DNA水平。
患者于每次玻璃體腔注射前和隨訪時均行BCVA、眼壓、裂隙燈顯微鏡、間接檢眼鏡以及彩色眼底照相檢查。采用國際標準視力表行BCVA檢查,統計時換算為logMAR視力。
采用SPSS 19.0軟件行統計學分析。呈正態分布的數據以均數±標準差( )表示。基線和末次隨訪時BCVA、眼壓比較采用Student t配對檢驗。P<0.05為差異有統計學意義。
)表示。基線和末次隨訪時BCVA、眼壓比較采用Student t配對檢驗。P<0.05為差異有統計學意義。
2 結果
14例22只眼中,男性5例,女性9例;單眼6例6只眼,雙眼8例16只眼。年齡5~49歲,中位年齡為25歲。Allo-HSCT后CMVR起病時間100~342 d,中位時間為158 d。CMVR確診時,患眼平均logMAR BCVA為0.814± 0.563;平均眼壓為(17.2±7.8)mmHg(1 mmHg=0.133 kPa);房水平均CMV-DNA載量為(3.43±4.96)×105 拷貝/ml,平均IL-8水平為(518±541)pg/ml。
眼局部治療終止時,玻璃體腔注射次數4~11次,中位注射次數為5次。房水CMV-DNA載量轉陰者9只眼,其中IL-8水平同時<30 pg/ml者7只眼;房水CMV-DNA載量陽性但IL-8水平<30 pg/ml者13只眼。22只眼中,眼底病灶完全瘢痕化靜止1只眼(4.5%);存在不同程度活動性炎癥如血管鞘(圖2A)等21只眼(95.5%)。
 圖2
圖1同眼治療終止時及治療終止后6個月時彩色眼底像。2A示治療終止時,鼻側病灶面積明顯減小,但病灶附近視網膜血管鞘仍然存在;房水CMV-DNA載量為2.52×103 拷貝/ml,IL-8水平20.5 pg/ml。2B示治療終止6個月時,鼻側病灶完全瘢痕化,僅殘留少許視網膜出血
圖2
圖1同眼治療終止時及治療終止后6個月時彩色眼底像。2A示治療終止時,鼻側病灶面積明顯減小,但病灶附近視網膜血管鞘仍然存在;房水CMV-DNA載量為2.52×103 拷貝/ml,IL-8水平20.5 pg/ml。2B示治療終止6個月時,鼻側病灶完全瘢痕化,僅殘留少許視網膜出血
眼局部治療終止后6個月,患眼平均logMAR BCVA為0.812±0.691;平均眼壓為(14.8±5.4)mmHg。與基線時logMAR BCVA、眼壓比較,差異均無統計學意義(t=-0.107、1.517,P=0.916、0.137)。因系統性Epstein-Barr 病毒 (EBV)感染(EBV性腸炎和肺炎)致CMVR復發1只眼(4.5%),但房水中僅檢測到CMV-DNA,EBV-DNA載量陰性;眼底視網膜病灶完全瘢痕化(圖2B)21只眼(95.5%)。隨訪過程中所有患者血清CMV-DNA載量均呈陰性。眼部治療期間移植后用藥均為口服環孢素A和更昔洛韋,用藥劑量未行調整。
22只眼中,因治療過程中血小板計數過低(<30×109個/ml)而發生醫源性玻璃體積血4只眼(18.2%);眼局部終止治療6個月時,積血吸收眼底清晰可見。CMVR確診時發現晶狀體后囊下混濁2只眼(9%),結合病史考慮可能為Allo-HSCT后系統性糖皮質激素治療所致。
3 討論
傳統CMVR治療的療效隨訪和治療終點判定完全依靠眼科檢查。單純依靠眼科臨床查體結果評估病情變化常受到諸多因素限制:(1)眼內活動性CMV感染可能在視網膜的病理性改變完全緩解前已被清除,此時若僅依據眼科臨床檢查結果繼續予抗病毒治療則存在過度治療所致的諸多藥物性負面效應;(2)CMVR患者因混濁地玻璃體和積血妨礙眼底觀察,嚴重者甚至無法觀察到視網膜,進而難以對病情轉歸進行評估;(3)房水中CMV-DNA載量陽性僅表明眼內存在CMV,但不能反映眼內組織發生CMV感染的嚴重程度和免疫反應的活動程度[9-10]。因此,CMVR治療的療效判斷不能完全依靠臨床檢查所見和房水CMV-DNA載量檢測,而多種指標并聯應用可能更為科學合理。
近年隨著高通量和微量標本檢測技術的發展,房水炎性細胞因子的檢測開始應用于臨床 [7, 11]。已有研究結果證實,CMVR患眼注射抗病毒藥物時,其房水中IL-8水平呈持續下降趨勢,且與房水中CMV-DNA載量和臨床觀察到的病情轉歸相關[8];且當眼底病灶完全靜止后,房水IL-8水平多<30 pg/ml[8, 12]。IL-8主要由單核巨噬細胞分泌,是一種趨化因子,與免疫反應的活動強度有關[13]。因此,房水中IL-8水平很有可能成為繼房水CMV-DNA載量之外,另一個可以定量描述CMVR活動程度和轉歸的實驗室指標,其值<30 pg/ml也可能作為停止局部治療的定量指標。
本研究結果顯示,眼局部終止治療時,95.5%(21/22)的患眼視網膜炎性病灶尚未完全瘢痕化;而至終止治療后6個月時,除1只眼復發外,其余20只眼眼底病灶完全瘢痕化靜止。若按照傳統通過眼底檢查確定治療終點的隨診方案,此20只眼將全部被視為炎癥仍處于活動狀態而給予過度治療。房水中CMV-DNA載量和IL-8水平可很好地反應CMVR眼內病灶的活動程度,當CMV-DNA載量和IL-8水平任一“轉陰”時即停止局部抗病毒治療是一種有效的隨診方案。雖然患者在接受眼內注藥的過程中額外接受了前房穿刺和房水采集的操作,但其本身并不增加患者經濟負擔,也不會給患者帶來額外痛苦,且就總體而言,此種方案可為絕大多數患者(96%)減少總眼內注藥次數,進而減少過度治療帶來的經濟負擔和身體不適,總體收益依然是增加的。
至終止眼局部治療6個月時,僅1只眼CMVR復發。本例患者復發前數日突然發生EBV性腸炎和肺炎,但復發時房水中僅檢測到CMV-DNA,未檢測到EBV-DNA。因此,我們推測患者復發是系統性免疫功能下降所致,而非本研究隨訪方案所致。
雖然玻璃體腔注射通常是安全且有效的給藥途徑,但對Allo-HSCT后患者仍存在較多風險。其主要原因是患者血小板計數普遍偏低,或計數正常但功能不佳。本組患眼中,4只眼在抽取房水和玻璃體腔注射藥物過程中發生玻璃體積血,但隨訪至6個月時積血均吸收眼底清晰可見。提示此類并發癥并不影響疾病預后,本研究隨診方案安全性較好。
本研究存在的局限性:(1)納入的樣本數較少且隨訪時間較短,統計分析可能存在一定偏倚。(2)Allo-HSCT后CMVR的發生和發展受患者免疫狀態影響,而影響患者免疫重建的因素也同樣種類繁多。本研究雖然盡可能選取基線和隨訪中臨床表現和用藥情況一致的患者,但由于本病臨床較為少見,仍難以將除眼部外其他因素完全一致化,如供體-受體匹配程度、移植前用藥等因素對本隨診方案結果的影響尚無法排除。(3)本研究為前瞻性單臂研究,未設置對照組,因此結果的可靠性受到影響。未來我們將開展前瞻性隨機對照臨床研究,以通過更詳實豐富的數據進一步明確該隨訪方案的安全性和有效性。