引用本文: 韓曉蕾, 郝玉華, 周娜磊, 丁恩亮. 特發性黃斑裂孔患眼手術前后黃斑區脈絡膜毛細血管血流面積和密度的初步觀察. 中華眼底病雜志, 2019, 35(6): 588-592. doi: 10.3760/cma.j.issn.1005-1015.2019.06.014 復制
特發性黃斑裂孔(IMH)廣泛接受的形成機制是Gass[1]提出的玻璃體切向牽引理論。但有學者提出,玻璃體后脫離所產生的牽引力并非是裂孔形成的唯一因素[2],其IMH發生可能存在其他影響因素。有研究者認為脈絡膜厚度的變化與脈絡膜血供及炎癥有關[3-4]。黃斑中心凹血液供應來自于脈絡膜層,脈絡膜血流變化可能會對黃斑微結構產生影響。近年有學者將IMH發病機制的研究聚焦于脈絡膜厚度,觀察其與IMH的關系[5-7]。但由于脈絡膜厚度測量方法的不一致性,其各項研究結果存在一定爭議性。隨著OCT血管成像(OCTA)技術的出現,使得脈絡膜血流的量化分析成為可能[8-10]。本研究采用OCTA測量了一組IMH患者黃斑區脈絡膜毛細血管血流面積(CBFA)和血流密度。觀察脈絡膜血液循環狀況在IMH發生中的作用。現將結果報道如下。
1 對象和方法
前瞻性臨床病例對照研究。本項研究經倫理委員會審核批準,患者均知情并簽署書面同意書。
2017年2月至2018年3月于河北醫科大學第二醫院眼科連續就診的單眼IMH患者30例60只眼(病例組)納入研究。納入標準:(1)頻域OCT(SD-OCT)及FFA檢查確診為IMH;(2)無高血壓、糖尿病、心血管疾病史以及其他嚴重全身病史者。排除標準:(1)近視屈光度>6 D,眼軸長度(AL)>26.0 mm;(2)已行任何形式的眼內手術;(3)眼壓>21 mmHg(1 mmHg=0.133 kPa);(4)屈光間質不清楚;(5)既往有眼部外傷史;(6)合并糖尿病視網膜病變、青光眼、葡萄膜炎、視網膜血管閉塞和視網膜和脈絡膜炎癥性疾病等其他眼部疾病;(7)合并糖尿病、腎衰竭等對眼部有影響的全身疾病。
所有受檢眼均行BCVA、裂隙燈顯微鏡、間接檢眼鏡、眼底彩色照相、SD-OCT、OCTA、FFA檢查。所有檢查均由同一位操作熟練地檢查者完成。IMH分期根據Gass[11]分期標準。采用對數視力表行BCVA檢查;采用非接觸式眼壓計行眼壓測量;采用眼光學生物測量儀測量AL。
患者中,男性8例16只眼,女性22例44只眼。平均年齡(65.2±11.5)歲;平均發病時間(5.53±3.09)個月。Ⅱ、Ⅲ、Ⅳ期裂孔分別為5、14、11只眼。將病例組患眼、對側健康眼分別設為患眼組、對側眼組,均為30只眼。隨機選取性別、年齡匹配的健康人30名30只眼作為正常對照組,以受檢者左眼進行數據采集。其中,男性8名8只眼,女性22名22只眼;平均年齡(64±11)歲。再依據裂孔直徑大小將患眼組分為裂孔直徑≤500 μm組、>500 μm組,分別為11、19只眼。病例組、正常對照組受檢者之間平均年齡(t=-0.692)、性別構成比(χ2=0.000)比較,差異均無統計學意義(P=0.492、1.000)。患眼組、對側眼組、正常對照組受檢眼之間AL(F=0.907)、眼壓(F=0.591)比較,差異均無統計學意義(P>0.05)(表1)。
 )
)
采用德國Heidelberg公司Spectralis OCT儀測量患眼黃斑裂孔直徑大小。采用日本Nidek公司RS-3000 Advance OCTA儀測量受檢眼黃斑區CBFA、血流密度。掃描模式Angio-Retina,掃描范圍3 mm×3 mm,獲得脈絡膜層的血流信號。應用設備自帶測量系統測量CBFA和以黃斑中心凹為中心,半徑1 mm圓形范圍內的血流密度(圖1)。脈絡膜毛細血管為RPE或Bruch膜下4~63 μm[12]。
 圖1
黃斑區CBFA、血流密度測量示意圖。1A、1B分別示CBFA、血流密度(白色線圈內)
圖1
黃斑區CBFA、血流密度測量示意圖。1A、1B分別示CBFA、血流密度(白色線圈內)
患眼均行經睫狀體平坦部標準三通道PPV,徹底切除中軸及周邊部玻璃體及其皮質,行氣液交換,粘彈劑覆蓋裂孔以保護裸露的RPE,0.25% 吲哚青綠輔助染色內界膜(ILM),停留10 s,剝除ILM,再行氣液交換,無菌空氣填充。手術后囑患者保持面朝下低頭體位。
手術后3個月采用手術前相同設備和方法行相關檢查。比較患眼組、對側眼組、正常對照組受檢眼之間以及患眼組手術前后CBFA、血流密度差異;患眼組黃斑裂孔閉合情況。SD-OCT檢查顯示黃斑裂孔消失,周圍脫離的神經上皮層完全平復,與RPE層粘合,中心凹形態大體恢復正常,視為黃斑裂孔閉合。
采用SPSS 21.0軟件行統計學分析處理。呈正態分布的計量資料以均數±標準差表示( ),采用參數檢驗;不服從正態分布的計量資料,采用非參數檢驗。病例組與正常對照組性別構成比行χ2檢驗,年齡比較行獨立樣本 t 檢驗。手術前患眼組、對側眼組、正常對照組受檢眼眼壓、AL以及黃斑區CBFA、血流密度比較行單變量方差分析。患眼組患眼手術前后黃斑區CBFA、血流密度比較行配對 t 檢驗組、>500 μm組手術前黃斑區CBFA、血流密度比較行獨立樣本 t 檢驗。裂孔直徑與黃斑區CBFA、血流密度的相關性行Spearman相關性分析。P<0.05為差異有統計學意義。
),采用參數檢驗;不服從正態分布的計量資料,采用非參數檢驗。病例組與正常對照組性別構成比行χ2檢驗,年齡比較行獨立樣本 t 檢驗。手術前患眼組、對側眼組、正常對照組受檢眼眼壓、AL以及黃斑區CBFA、血流密度比較行單變量方差分析。患眼組患眼手術前后黃斑區CBFA、血流密度比較行配對 t 檢驗組、>500 μm組手術前黃斑區CBFA、血流密度比較行獨立樣本 t 檢驗。裂孔直徑與黃斑區CBFA、血流密度的相關性行Spearman相關性分析。P<0.05為差異有統計學意義。
2 結果
手術前,患眼組患眼黃斑中心凹下脈絡膜毛細血管丟失,血流密度減少,CBFA亦降低;對側眼組、正常對照組受檢眼黃斑中心凹下脈絡膜毛細血管密度均勻(圖2)。患眼組、對側眼組、正常對照組受檢眼黃斑區CBFA、血流密度比較,差異均有統計意義(P<0.05)(表2)。組間兩兩比較,患眼組和對側眼組、患眼組和正常對照組之間的差異有統計學意義(P=0.000、0.000、0.000、0.000);對側眼組、正常對照組之間的差異無統計學意義(P=0.332、0.994)。
 圖2
患眼組、對側眼組、正常對照組受檢眼OCTA像。2A示患眼組,黃斑中心凹下脈絡膜毛細血管丟失,血流信號稀疏不均勻,血流密度減少;CBFA亦降低。2B、2C分別示對側眼組、正常對照組,黃斑中心凹下脈絡膜毛細血管血流信號均勻
圖2
患眼組、對側眼組、正常對照組受檢眼OCTA像。2A示患眼組,黃斑中心凹下脈絡膜毛細血管丟失,血流信號稀疏不均勻,血流密度減少;CBFA亦降低。2B、2C分別示對側眼組、正常對照組,黃斑中心凹下脈絡膜毛細血管血流信號均勻
 )
)
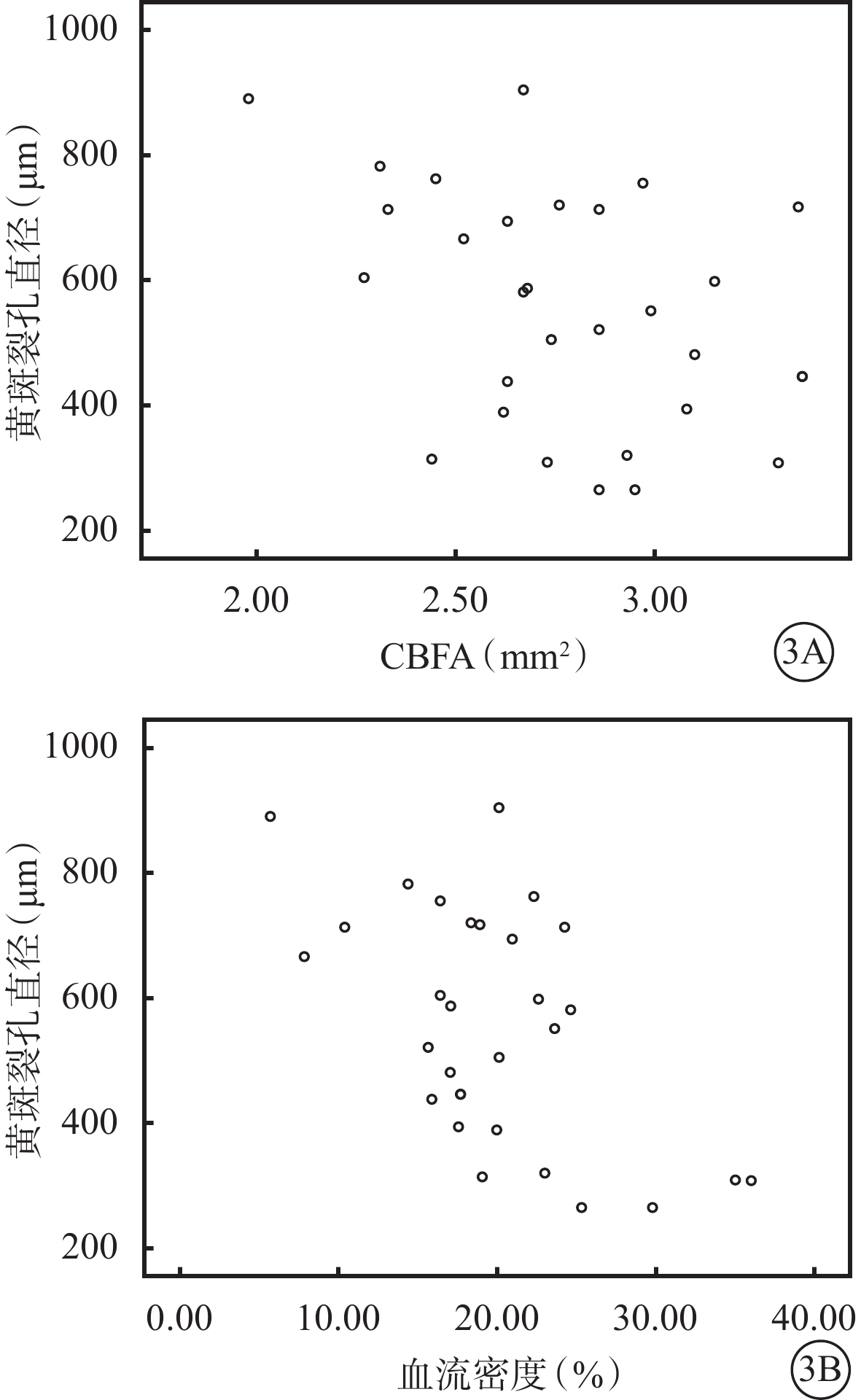
裂孔直徑≤500 μm組、>500 μm組患眼黃斑區CBFA分別為(2.95±0.32)、(2.68±0.34)mm2,血流密度分別為(22.83±7.49)%、(17.77±5.47)%;兩組患眼間CBFA、血流密度比較,差異均有統計學意義(t=2.230、2.202,P=0.034、0.036)。兩組患眼CBFA( t =3.491、6.960)、血流密度(t =5.418、9.531)與正常對照組比較,差異均有統計學意義(P=0.001、0.000、0.000、0.000)。相關性分析結果顯示,黃斑裂孔直徑大小與黃斑區CBFA、血流密度呈負相關(r=-0.377、-0.477,P=0.044、0.009)(圖3)。
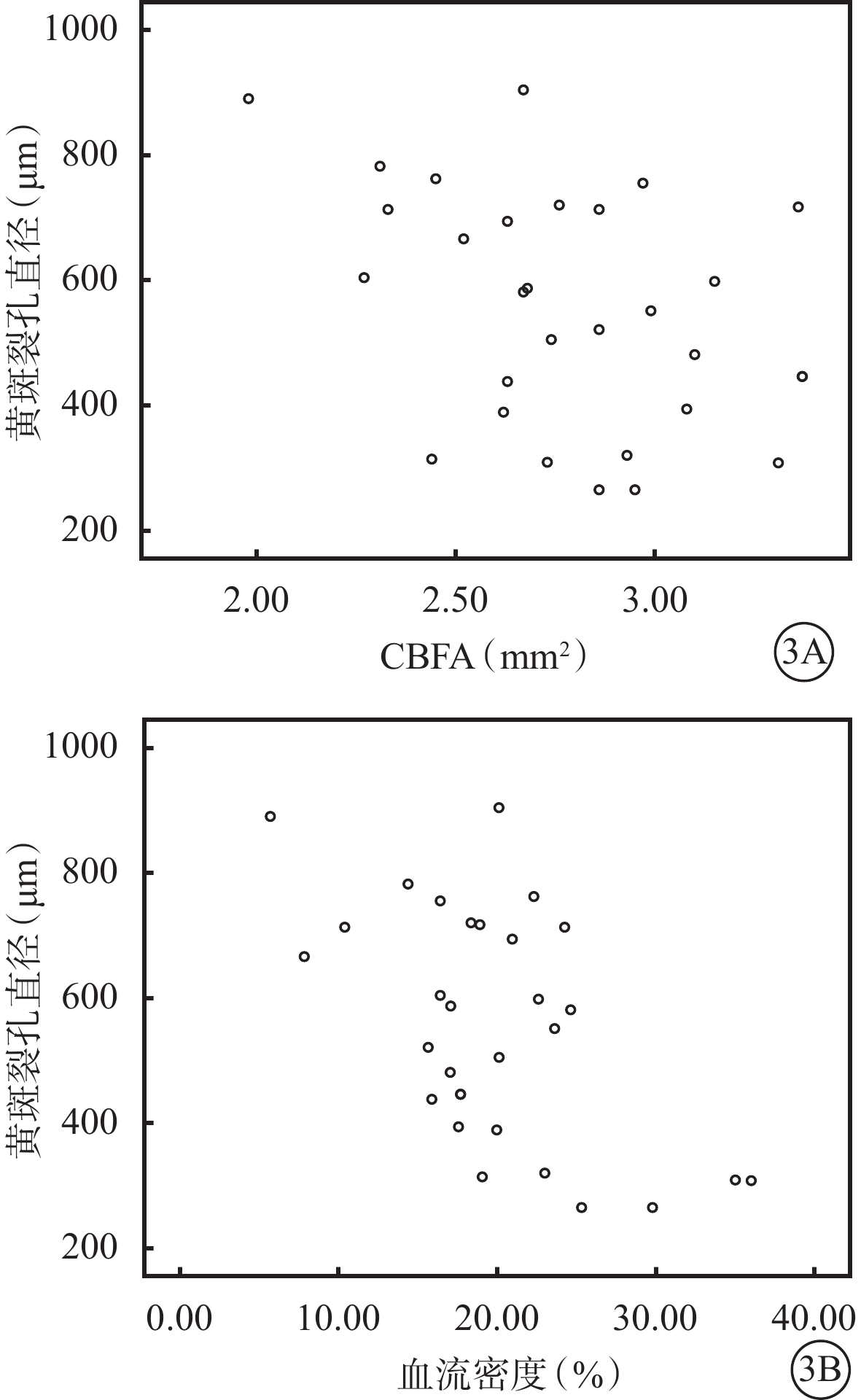 圖3
黃斑裂孔直徑與黃斑區CBFA、血流密度散點圖。3A、3B分別示CBFA、血流密度
圖3
黃斑裂孔直徑與黃斑區CBFA、血流密度散點圖。3A、3B分別示CBFA、血流密度
手術后3個月,患眼組30只眼黃斑裂孔均閉合。OCTA檢查結果顯示,黃斑區脈絡膜淺層毛細血管血流信號分布較前均勻,CBFA、血流密度較前增加(圖4)。黃斑區CBFA、血流密度分別為(3.07±0.34)mm2和(27.58±9.26)%;與手術前比較,CBFA、血流密度均明顯提高,差異有統計學意義(t=-4.126、-4.912,P=0.000、0.000)。
 圖4
圖2A同眼手術后3個月OCTA像。黃斑中心凹下脈絡膜毛細血管血流信號較前均勻,CBFA、血流密度較前增加
圖4
圖2A同眼手術后3個月OCTA像。黃斑中心凹下脈絡膜毛細血管血流信號較前均勻,CBFA、血流密度較前增加
3 討論
脈絡膜血流灌注是黃斑生理的重要解剖學因素。由于缺乏測量脈絡膜血流的技術手段,IMH發病機制多集中于脈絡膜厚度的變化[5-7]。但由于脈絡膜厚度測量方法的不一致性,其各項研究結果具有一定爭議性。隨著OCTA的出現,脈絡膜血流的量化分析成為可能。
既往研究表明,IMH患眼脈絡膜厚度較對側健康眼、正常對照組均降低,對側健康眼較正常對照組亦有一定程度降低[5-7]。推測其原因是脈絡膜厚度的降低可能會影響黃斑代謝,可能有助于黃斑裂孔形成。本研究結果顯示,患眼組手術前黃斑區CBFA、血流密度均較對側眼組、正常對照組受檢眼降低,而對側眼組與正常對照組差異無統計學意義。結果進一步證實脈絡膜循環障礙在黃斑裂孔形成過程中起一定作用。而PPV后3個月,患眼組黃斑區CBFA、血流密度均較手術前明顯提高;說明IMH患眼黃斑區脈絡膜循環具有可逆性。我們推測這種可逆性改變可能是由于手術前后黃斑區組織結構的改變而引起。首先,PPV并不能提高IMH患眼視盤及視網膜、脈絡膜血流量[13];其次,手術后早期由于手術對黃斑裂孔區域的干擾,可能造成脈絡膜一過性炎癥反應,脈絡膜增厚。但本研究中患眼組PPV后3個月黃斑區CBFA、血流密度仍高于手術前,此時由手術引起的炎癥反應已恢復。已有研究表明,IMH患眼行PPV后3個月,黃斑區組織結構恢復,脈絡膜厚度仍較手術前增厚[14]。因此,脈絡膜微循環的改變更可能是由于黃斑裂孔組織結構的恢復,非PPV引起的炎癥反應所致,而更可能與脈絡膜的自身調節功能有關。有文獻報道,脈絡膜具有自動調節能力使脈絡膜血流灌注壓維持在正常水平,且脈絡膜的大、中血管灌注壓與脈絡膜厚度之間存在正相關性[15-16]。推測黃斑裂孔閉合后,黃斑區視網膜需氧量增加,脈絡膜通過自身調節,增加大、中血管的灌注壓,最終致脈絡膜毛細血管血流增加,脈絡膜厚度增加。
本研究結果顯示,手術前裂孔直徑≤500 μm組患眼黃斑區CBFA、血流密度均高于裂孔直徑>500 μm組;黃斑裂孔直徑大小與黃斑區CBFA和血流密度呈負相關性。提示較大的黃斑裂孔常伴有較低的CBFA、血流密度。其原因可能是由于脈絡膜血流下降程度不同,導致淺層視網膜神經組織不同程度的缺血、缺氧,從而引起組織破壞,產生大小不等的黃斑裂孔。但其因果關系尚需進一步深入研究。
本研究尚存在一些不足之處,樣本量較小并且隨訪時間短。其結果仍需大樣本,隨訪時間更長地臨床研究結果加以證實。
特發性黃斑裂孔(IMH)廣泛接受的形成機制是Gass[1]提出的玻璃體切向牽引理論。但有學者提出,玻璃體后脫離所產生的牽引力并非是裂孔形成的唯一因素[2],其IMH發生可能存在其他影響因素。有研究者認為脈絡膜厚度的變化與脈絡膜血供及炎癥有關[3-4]。黃斑中心凹血液供應來自于脈絡膜層,脈絡膜血流變化可能會對黃斑微結構產生影響。近年有學者將IMH發病機制的研究聚焦于脈絡膜厚度,觀察其與IMH的關系[5-7]。但由于脈絡膜厚度測量方法的不一致性,其各項研究結果存在一定爭議性。隨著OCT血管成像(OCTA)技術的出現,使得脈絡膜血流的量化分析成為可能[8-10]。本研究采用OCTA測量了一組IMH患者黃斑區脈絡膜毛細血管血流面積(CBFA)和血流密度。觀察脈絡膜血液循環狀況在IMH發生中的作用。現將結果報道如下。
1 對象和方法
前瞻性臨床病例對照研究。本項研究經倫理委員會審核批準,患者均知情并簽署書面同意書。
2017年2月至2018年3月于河北醫科大學第二醫院眼科連續就診的單眼IMH患者30例60只眼(病例組)納入研究。納入標準:(1)頻域OCT(SD-OCT)及FFA檢查確診為IMH;(2)無高血壓、糖尿病、心血管疾病史以及其他嚴重全身病史者。排除標準:(1)近視屈光度>6 D,眼軸長度(AL)>26.0 mm;(2)已行任何形式的眼內手術;(3)眼壓>21 mmHg(1 mmHg=0.133 kPa);(4)屈光間質不清楚;(5)既往有眼部外傷史;(6)合并糖尿病視網膜病變、青光眼、葡萄膜炎、視網膜血管閉塞和視網膜和脈絡膜炎癥性疾病等其他眼部疾病;(7)合并糖尿病、腎衰竭等對眼部有影響的全身疾病。
所有受檢眼均行BCVA、裂隙燈顯微鏡、間接檢眼鏡、眼底彩色照相、SD-OCT、OCTA、FFA檢查。所有檢查均由同一位操作熟練地檢查者完成。IMH分期根據Gass[11]分期標準。采用對數視力表行BCVA檢查;采用非接觸式眼壓計行眼壓測量;采用眼光學生物測量儀測量AL。
患者中,男性8例16只眼,女性22例44只眼。平均年齡(65.2±11.5)歲;平均發病時間(5.53±3.09)個月。Ⅱ、Ⅲ、Ⅳ期裂孔分別為5、14、11只眼。將病例組患眼、對側健康眼分別設為患眼組、對側眼組,均為30只眼。隨機選取性別、年齡匹配的健康人30名30只眼作為正常對照組,以受檢者左眼進行數據采集。其中,男性8名8只眼,女性22名22只眼;平均年齡(64±11)歲。再依據裂孔直徑大小將患眼組分為裂孔直徑≤500 μm組、>500 μm組,分別為11、19只眼。病例組、正常對照組受檢者之間平均年齡(t=-0.692)、性別構成比(χ2=0.000)比較,差異均無統計學意義(P=0.492、1.000)。患眼組、對側眼組、正常對照組受檢眼之間AL(F=0.907)、眼壓(F=0.591)比較,差異均無統計學意義(P>0.05)(表1)。
 )
)
采用德國Heidelberg公司Spectralis OCT儀測量患眼黃斑裂孔直徑大小。采用日本Nidek公司RS-3000 Advance OCTA儀測量受檢眼黃斑區CBFA、血流密度。掃描模式Angio-Retina,掃描范圍3 mm×3 mm,獲得脈絡膜層的血流信號。應用設備自帶測量系統測量CBFA和以黃斑中心凹為中心,半徑1 mm圓形范圍內的血流密度(圖1)。脈絡膜毛細血管為RPE或Bruch膜下4~63 μm[12]。
 圖1
黃斑區CBFA、血流密度測量示意圖。1A、1B分別示CBFA、血流密度(白色線圈內)
圖1
黃斑區CBFA、血流密度測量示意圖。1A、1B分別示CBFA、血流密度(白色線圈內)
患眼均行經睫狀體平坦部標準三通道PPV,徹底切除中軸及周邊部玻璃體及其皮質,行氣液交換,粘彈劑覆蓋裂孔以保護裸露的RPE,0.25% 吲哚青綠輔助染色內界膜(ILM),停留10 s,剝除ILM,再行氣液交換,無菌空氣填充。手術后囑患者保持面朝下低頭體位。
手術后3個月采用手術前相同設備和方法行相關檢查。比較患眼組、對側眼組、正常對照組受檢眼之間以及患眼組手術前后CBFA、血流密度差異;患眼組黃斑裂孔閉合情況。SD-OCT檢查顯示黃斑裂孔消失,周圍脫離的神經上皮層完全平復,與RPE層粘合,中心凹形態大體恢復正常,視為黃斑裂孔閉合。
采用SPSS 21.0軟件行統計學分析處理。呈正態分布的計量資料以均數±標準差表示( ),采用參數檢驗;不服從正態分布的計量資料,采用非參數檢驗。病例組與正常對照組性別構成比行χ2檢驗,年齡比較行獨立樣本 t 檢驗。手術前患眼組、對側眼組、正常對照組受檢眼眼壓、AL以及黃斑區CBFA、血流密度比較行單變量方差分析。患眼組患眼手術前后黃斑區CBFA、血流密度比較行配對 t 檢驗組、>500 μm組手術前黃斑區CBFA、血流密度比較行獨立樣本 t 檢驗。裂孔直徑與黃斑區CBFA、血流密度的相關性行Spearman相關性分析。P<0.05為差異有統計學意義。
),采用參數檢驗;不服從正態分布的計量資料,采用非參數檢驗。病例組與正常對照組性別構成比行χ2檢驗,年齡比較行獨立樣本 t 檢驗。手術前患眼組、對側眼組、正常對照組受檢眼眼壓、AL以及黃斑區CBFA、血流密度比較行單變量方差分析。患眼組患眼手術前后黃斑區CBFA、血流密度比較行配對 t 檢驗組、>500 μm組手術前黃斑區CBFA、血流密度比較行獨立樣本 t 檢驗。裂孔直徑與黃斑區CBFA、血流密度的相關性行Spearman相關性分析。P<0.05為差異有統計學意義。
2 結果
手術前,患眼組患眼黃斑中心凹下脈絡膜毛細血管丟失,血流密度減少,CBFA亦降低;對側眼組、正常對照組受檢眼黃斑中心凹下脈絡膜毛細血管密度均勻(圖2)。患眼組、對側眼組、正常對照組受檢眼黃斑區CBFA、血流密度比較,差異均有統計意義(P<0.05)(表2)。組間兩兩比較,患眼組和對側眼組、患眼組和正常對照組之間的差異有統計學意義(P=0.000、0.000、0.000、0.000);對側眼組、正常對照組之間的差異無統計學意義(P=0.332、0.994)。
 圖2
患眼組、對側眼組、正常對照組受檢眼OCTA像。2A示患眼組,黃斑中心凹下脈絡膜毛細血管丟失,血流信號稀疏不均勻,血流密度減少;CBFA亦降低。2B、2C分別示對側眼組、正常對照組,黃斑中心凹下脈絡膜毛細血管血流信號均勻
圖2
患眼組、對側眼組、正常對照組受檢眼OCTA像。2A示患眼組,黃斑中心凹下脈絡膜毛細血管丟失,血流信號稀疏不均勻,血流密度減少;CBFA亦降低。2B、2C分別示對側眼組、正常對照組,黃斑中心凹下脈絡膜毛細血管血流信號均勻
 )
)
裂孔直徑≤500 μm組、>500 μm組患眼黃斑區CBFA分別為(2.95±0.32)、(2.68±0.34)mm2,血流密度分別為(22.83±7.49)%、(17.77±5.47)%;兩組患眼間CBFA、血流密度比較,差異均有統計學意義(t=2.230、2.202,P=0.034、0.036)。兩組患眼CBFA( t =3.491、6.960)、血流密度(t =5.418、9.531)與正常對照組比較,差異均有統計學意義(P=0.001、0.000、0.000、0.000)。相關性分析結果顯示,黃斑裂孔直徑大小與黃斑區CBFA、血流密度呈負相關(r=-0.377、-0.477,P=0.044、0.009)(圖3)。
 圖3
黃斑裂孔直徑與黃斑區CBFA、血流密度散點圖。3A、3B分別示CBFA、血流密度
圖3
黃斑裂孔直徑與黃斑區CBFA、血流密度散點圖。3A、3B分別示CBFA、血流密度
手術后3個月,患眼組30只眼黃斑裂孔均閉合。OCTA檢查結果顯示,黃斑區脈絡膜淺層毛細血管血流信號分布較前均勻,CBFA、血流密度較前增加(圖4)。黃斑區CBFA、血流密度分別為(3.07±0.34)mm2和(27.58±9.26)%;與手術前比較,CBFA、血流密度均明顯提高,差異有統計學意義(t=-4.126、-4.912,P=0.000、0.000)。
 圖4
圖2A同眼手術后3個月OCTA像。黃斑中心凹下脈絡膜毛細血管血流信號較前均勻,CBFA、血流密度較前增加
圖4
圖2A同眼手術后3個月OCTA像。黃斑中心凹下脈絡膜毛細血管血流信號較前均勻,CBFA、血流密度較前增加
3 討論
脈絡膜血流灌注是黃斑生理的重要解剖學因素。由于缺乏測量脈絡膜血流的技術手段,IMH發病機制多集中于脈絡膜厚度的變化[5-7]。但由于脈絡膜厚度測量方法的不一致性,其各項研究結果具有一定爭議性。隨著OCTA的出現,脈絡膜血流的量化分析成為可能。
既往研究表明,IMH患眼脈絡膜厚度較對側健康眼、正常對照組均降低,對側健康眼較正常對照組亦有一定程度降低[5-7]。推測其原因是脈絡膜厚度的降低可能會影響黃斑代謝,可能有助于黃斑裂孔形成。本研究結果顯示,患眼組手術前黃斑區CBFA、血流密度均較對側眼組、正常對照組受檢眼降低,而對側眼組與正常對照組差異無統計學意義。結果進一步證實脈絡膜循環障礙在黃斑裂孔形成過程中起一定作用。而PPV后3個月,患眼組黃斑區CBFA、血流密度均較手術前明顯提高;說明IMH患眼黃斑區脈絡膜循環具有可逆性。我們推測這種可逆性改變可能是由于手術前后黃斑區組織結構的改變而引起。首先,PPV并不能提高IMH患眼視盤及視網膜、脈絡膜血流量[13];其次,手術后早期由于手術對黃斑裂孔區域的干擾,可能造成脈絡膜一過性炎癥反應,脈絡膜增厚。但本研究中患眼組PPV后3個月黃斑區CBFA、血流密度仍高于手術前,此時由手術引起的炎癥反應已恢復。已有研究表明,IMH患眼行PPV后3個月,黃斑區組織結構恢復,脈絡膜厚度仍較手術前增厚[14]。因此,脈絡膜微循環的改變更可能是由于黃斑裂孔組織結構的恢復,非PPV引起的炎癥反應所致,而更可能與脈絡膜的自身調節功能有關。有文獻報道,脈絡膜具有自動調節能力使脈絡膜血流灌注壓維持在正常水平,且脈絡膜的大、中血管灌注壓與脈絡膜厚度之間存在正相關性[15-16]。推測黃斑裂孔閉合后,黃斑區視網膜需氧量增加,脈絡膜通過自身調節,增加大、中血管的灌注壓,最終致脈絡膜毛細血管血流增加,脈絡膜厚度增加。
本研究結果顯示,手術前裂孔直徑≤500 μm組患眼黃斑區CBFA、血流密度均高于裂孔直徑>500 μm組;黃斑裂孔直徑大小與黃斑區CBFA和血流密度呈負相關性。提示較大的黃斑裂孔常伴有較低的CBFA、血流密度。其原因可能是由于脈絡膜血流下降程度不同,導致淺層視網膜神經組織不同程度的缺血、缺氧,從而引起組織破壞,產生大小不等的黃斑裂孔。但其因果關系尚需進一步深入研究。
本研究尚存在一些不足之處,樣本量較小并且隨訪時間短。其結果仍需大樣本,隨訪時間更長地臨床研究結果加以證實。