引用本文: 肖靜, 張曉敏, 邵先鋒, 肖夢然, 楊付花, 張慧, EaVicki L, 李筱榮. 4-羥基壬稀酸刺激人視網膜微血管內皮細胞的定量蛋白質組學研究. 中華眼底病雜志, 2019, 35(5): 488-493. doi: 10.3760/cma.j.issn.1005-1015.2019.05.012 復制
糖尿病視網膜病變(DR)發生與氧化應激密切相關。既往研究發現,DR患者血液中脂質氧化應激產物4-羥基壬稀酸(4-HNE)的水平較眼底未發生視網膜病變者升高且與DR發生相關[1-3]。但研究集中于4-HNE對單一通路的變化進行探索[4]。本研究應用4-HNE刺激人視網膜微血管內皮細胞(hRMECs),模擬氧化應激狀態下內皮細胞增生環境,應用定量蛋白質組學技術檢測hRMECs在4-HNE刺激后蛋白表達變化情況,并結合基因注釋(GO)分析和通路富集對差異蛋白進行分析。現將結果報道如下。
1 材料和方法
1.1 材料
hRMECs(美國Angioproteomie公司);內皮細胞培養基(ECM,美國Science Cell公司);青霉素、鏈霉素、Dulbecco's DPS (美國Gibco公司);二喹啉甲酸蛋白定量試劑盒(中國索萊寶公司);CCK-8細胞計數試劑盒(日本Dojindo公司);細胞培養孵箱(日本Sanyo公司);胰蛋白酶(美國Promega公司);4-HNE、甲醇、水(美國Merck公司);相對分子質量10×103 過濾管(美國Sartorius公司);蛋白酶抑制劑、磷酸酶抑制劑(瑞士Roche公司);尿素、釩酸鈉、氟化鈉、脫氧膽酸鈉、DL-二硫蘇糖醇、吲哚乙酸(美國Sigma公司);質譜儀器、液相(美國AB SCIEX公司)。
1.2 CCK-8增生分析法檢測不同濃度4-HNE對hRMECs增生的影響
ECM培養對數生長期hRMECs,待細胞生長融合度80%~90%時,胰酶將細胞消化成懸液,細胞密度1×103個/孔接種到96孔板中。hRMECs分為4-HNE刺激組和陰性對照組。細胞貼壁生長24 h后,4-HNE刺激組加入濃度為5、10、20、50 μmol/L 4-HNE培養基,并據此再分為不同濃度亞組;陰性對照組培養基加入等體積無水乙醇(4-HNE溶劑)。刺激24 h后加入CCK-8孵育4 h,酶標儀上以450 nm波長測定不同濃度組和陰性對照組細胞的吸光度[A,舊稱光密度(OD)]值。
1.3 制樣及細胞質譜分析
體外培養處于對數生長期的hRMECs,當細胞融合度為40%~50%時,4-HNE刺激組加入含10 μmol/L 4-HNE培養基,陰性對照組加入等體積無水乙醇培養基。24 h后收集兩組細胞各5盤。基于超濾輔助樣品制備酶切方法提取細胞蛋白,行液相串聯質譜分析。采用非數據依賴采集模式(SWATH-MS)方法進行檢測。應用ProteinPilot(5.0)軟件對獲得的原始質譜數據進行數據庫搜索。將搜庫后產生的ProteinPilot文件導入Peakview軟件內置的SWATH插件中,選擇對應的SWATH原始數據。在進程設置里每個肽段的翻譯數和每個蛋白的肽段數均為5,排除翻譯后修飾的肽段和同源肽段,肽段可信度≥90%,假陽性率≤1%。
1.4 統計學分析
使用R語言(版本3.5.3)psych包對數據進行生物信息學分析,包括樣本間的Pearson相關性分析、差異蛋白篩選、GO分析、通路富集分析等。蛋白-蛋白相互作用分析使用STRING數據庫。采用SPSS 22.0統計軟件對CCK-8結果和差異蛋白篩選行單因素方差分析。差異蛋白篩選通過方差分析某個蛋白在兩組間的表達,當差異倍數大于1.5倍以上,并且具有統計學意義,被認為是差異表達蛋白。所有統計檢驗均為雙側,P< 0.05為差異有統計學意義。
2 結果
?
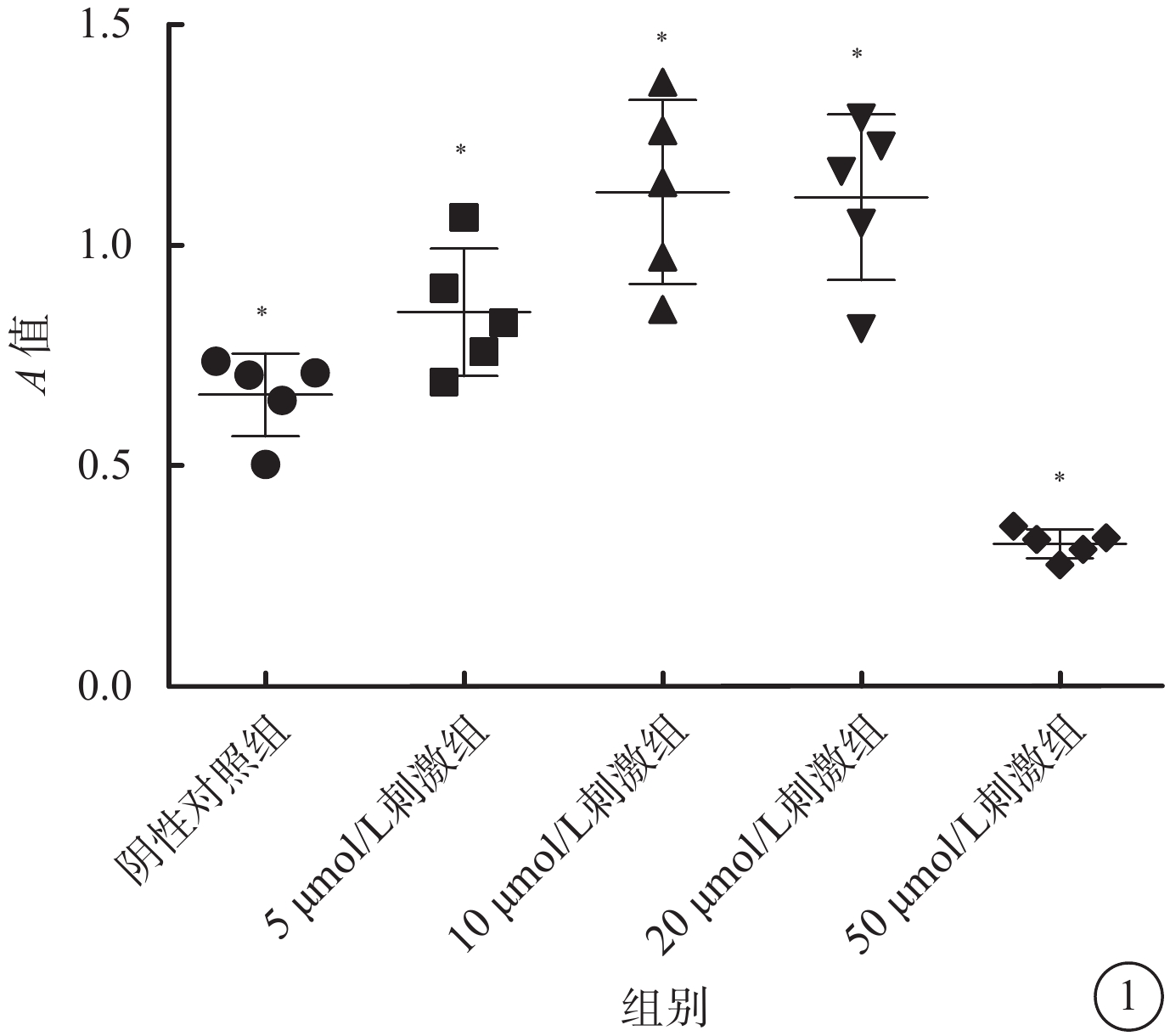
CCK-8增生分析法結果顯示,陰性對照組以及5、10、20、50 μmol/L 4-HNE刺激組A值分別為0.66±0.09、0.85±0.14、1.12±0.20、1.11±0.19、0.32±0.03。10、20 μmol/L 4-HNE刺激組A值高于陰性對照組和5 μmol/L4-HNE刺激組,差異有統計學意義(F=25.42,P<0.05);50 μmol/L 4-HNE刺激組A值低于其他濃度刺激組,差異有統計學意義(F=25.42,P<0.05)。10、20 μmol/L 4-HNE刺激組之間A值差異無統計學意義(P>0.05)(圖1)。
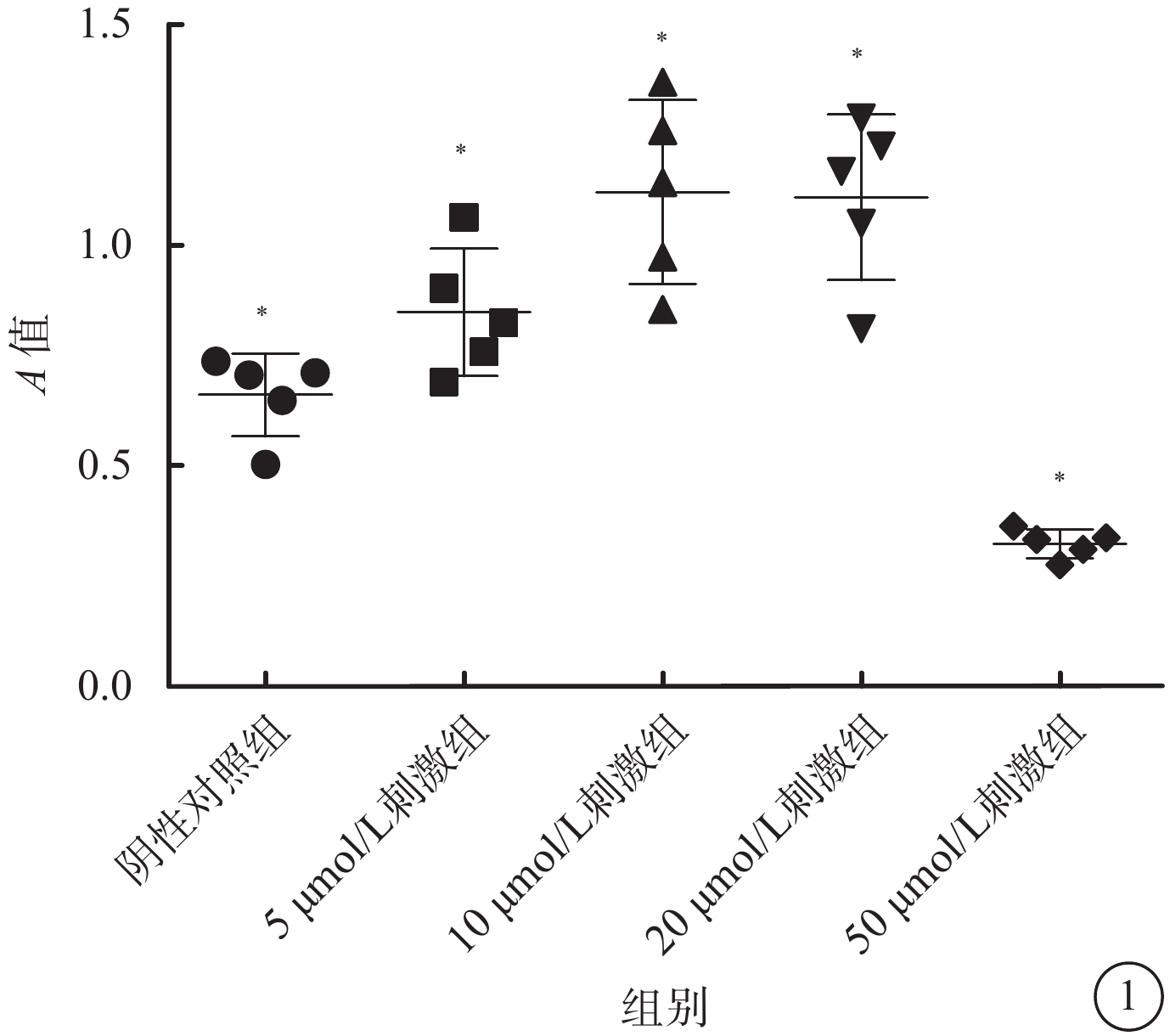 圖1
不同濃度4-HNE刺激組、陰性對照組細胞A值比較。*P<0.05
圖1
不同濃度4-HNE刺激組、陰性對照組細胞A值比較。*P<0.05
?
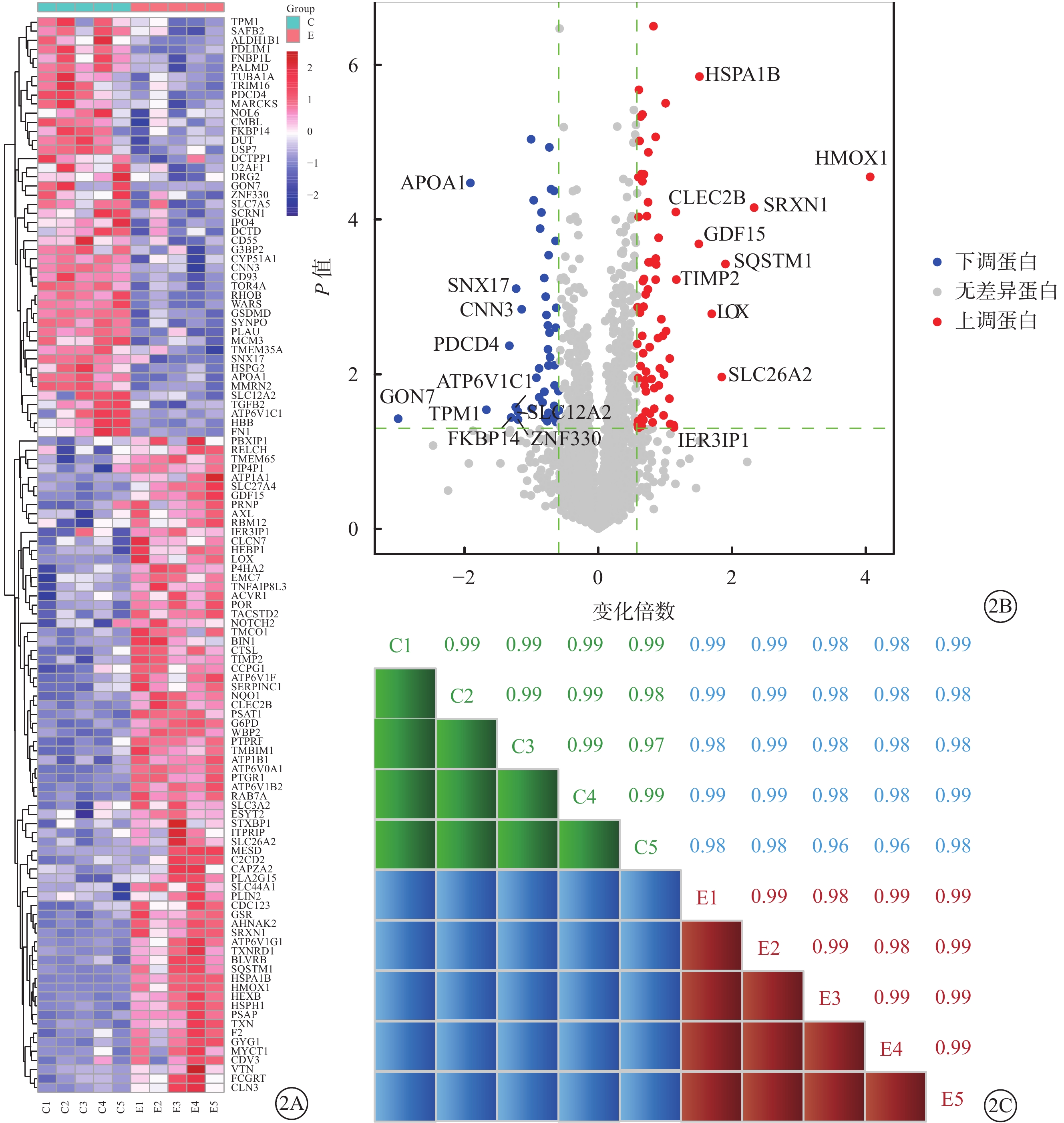
細胞質譜分析共鑒定出2710個可定量蛋白。與陰性對照組比較,10 μmol/L 4-HNE刺激組差異表達倍數大于1.5倍的蛋白118個,差異有統計學意義(P <0.05)(圖2A)。118個蛋白中,上調蛋白72個,下調蛋白46個(圖2B)。上調蛋白中變化明顯的有血紅素氧合酶1(HMOX1)、磺胺嘧啶1(SRXN1)、硫氧還蛋白還原酶1(TXNRD1)、谷胱甘肽還原酶(GSR)、熱休克蛋白A1B等;下調蛋白中變化明顯的有載脂蛋白A1(ApoA1)、程序性細胞凋亡因子4(PDCD4)等。Pearson相關性分析結果顯示,10 μmol/L 4-HNE刺激組、陰性對照組相關性系數均≥0.97(圖2C)。
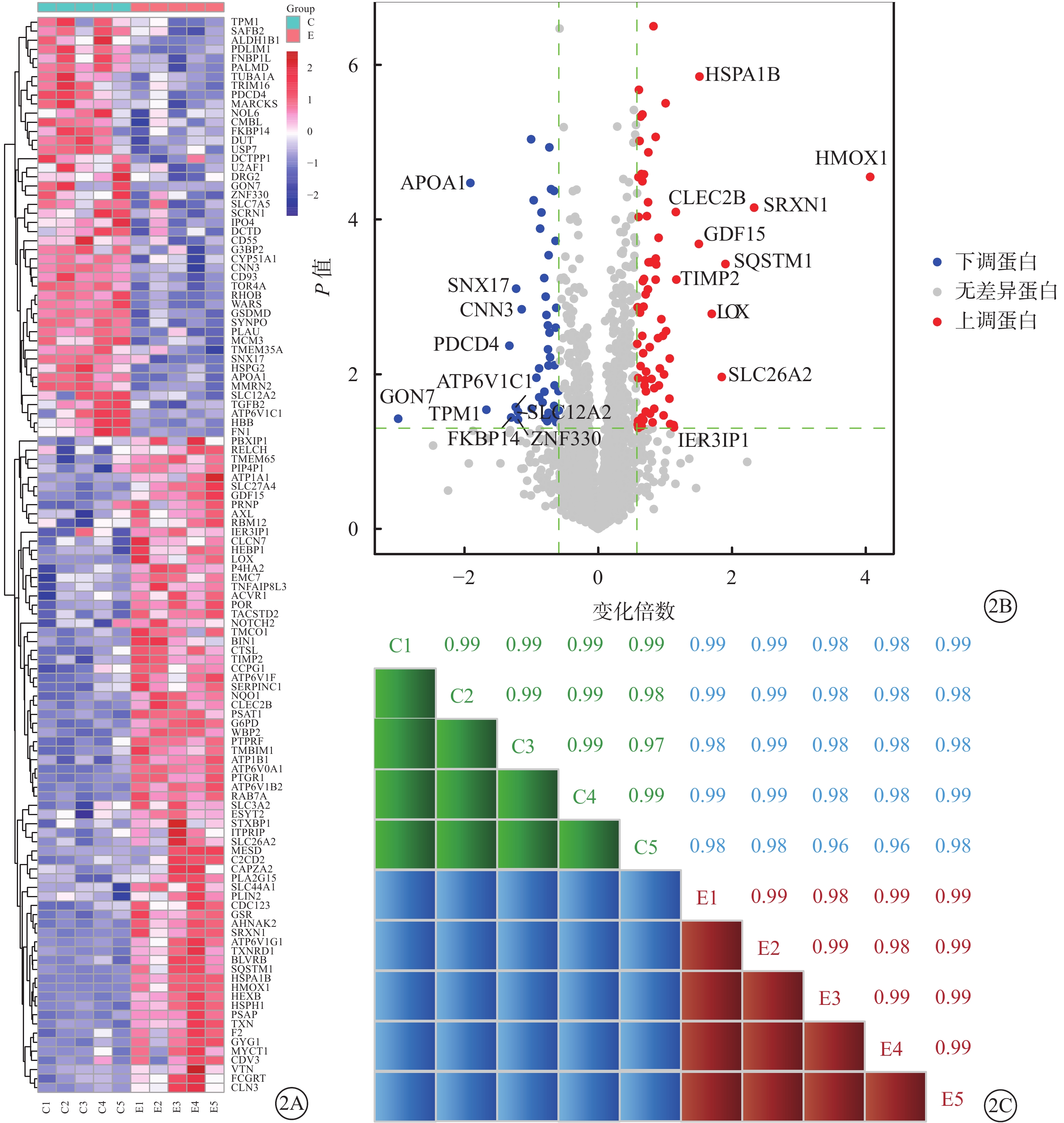 圖2
定量蛋白質組學結果。2A示差異表達蛋白基因熱圖,右側為差異蛋白基因,紅色方格表示4-HNE刺激后上調蛋白,藍色方格表示4-HNE刺激后下調蛋白。E:10 μmol/L 4-HNE刺激組,C:陰性對照組。2B示火山圖,4-HNE刺激后差異變化倍數較高的多種蛋白;紅點表示上調蛋白,藍點表示下調蛋白。2C示兩組Pearson相關分析組內相關系數。E:10 μmol/L 4-HNE刺激組,C:陰性對照組
圖2
定量蛋白質組學結果。2A示差異表達蛋白基因熱圖,右側為差異蛋白基因,紅色方格表示4-HNE刺激后上調蛋白,藍色方格表示4-HNE刺激后下調蛋白。E:10 μmol/L 4-HNE刺激組,C:陰性對照組。2B示火山圖,4-HNE刺激后差異變化倍數較高的多種蛋白;紅點表示上調蛋白,藍點表示下調蛋白。2C示兩組Pearson相關分析組內相關系數。E:10 μmol/L 4-HNE刺激組,C:陰性對照組
?
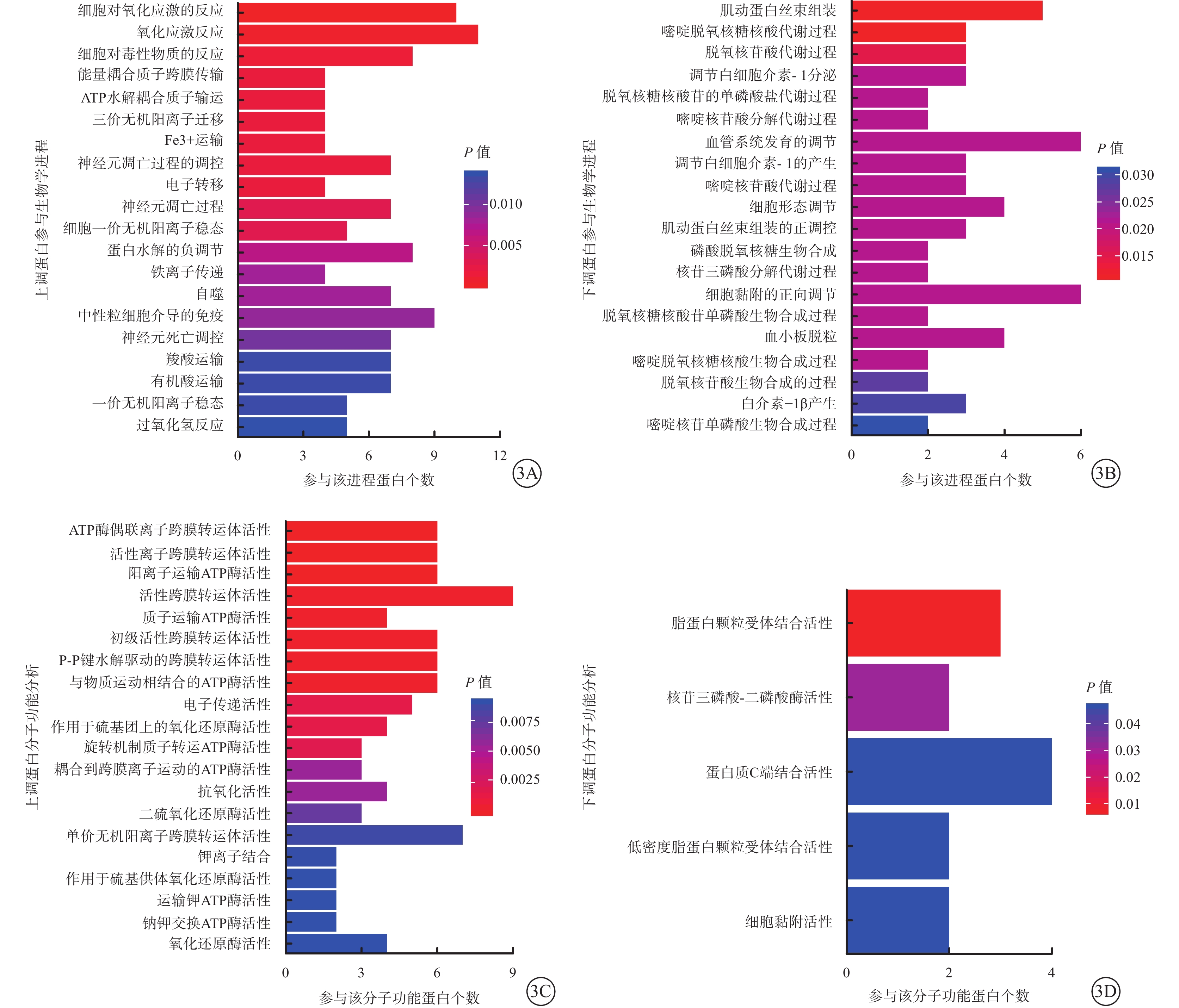
GO分析結果顯示,10 μmol/L 4-HNE刺激組上調蛋白主要參與氧化應激反應、細胞解毒、三磷酸腺苷(ATP)水解偶聯等生物學進程(圖3A);下調蛋白主要參與血管系統發育調節、細胞黏附的正向調節和IL-1產生與分泌調節等生物學進程(圖3B)。上調蛋白參與的分子功能包括多種離子跨膜轉運體活性(圖3C);參與的蛋白主要有ATP酶、GSR和TXNRD1等。下調蛋白參與的分子功能有蛋白質C端結合和脂蛋白顆粒受體結合等(圖3D);參與的主要蛋白有纖連蛋白、ApoA1和金屬蛋白酶抑制劑等。
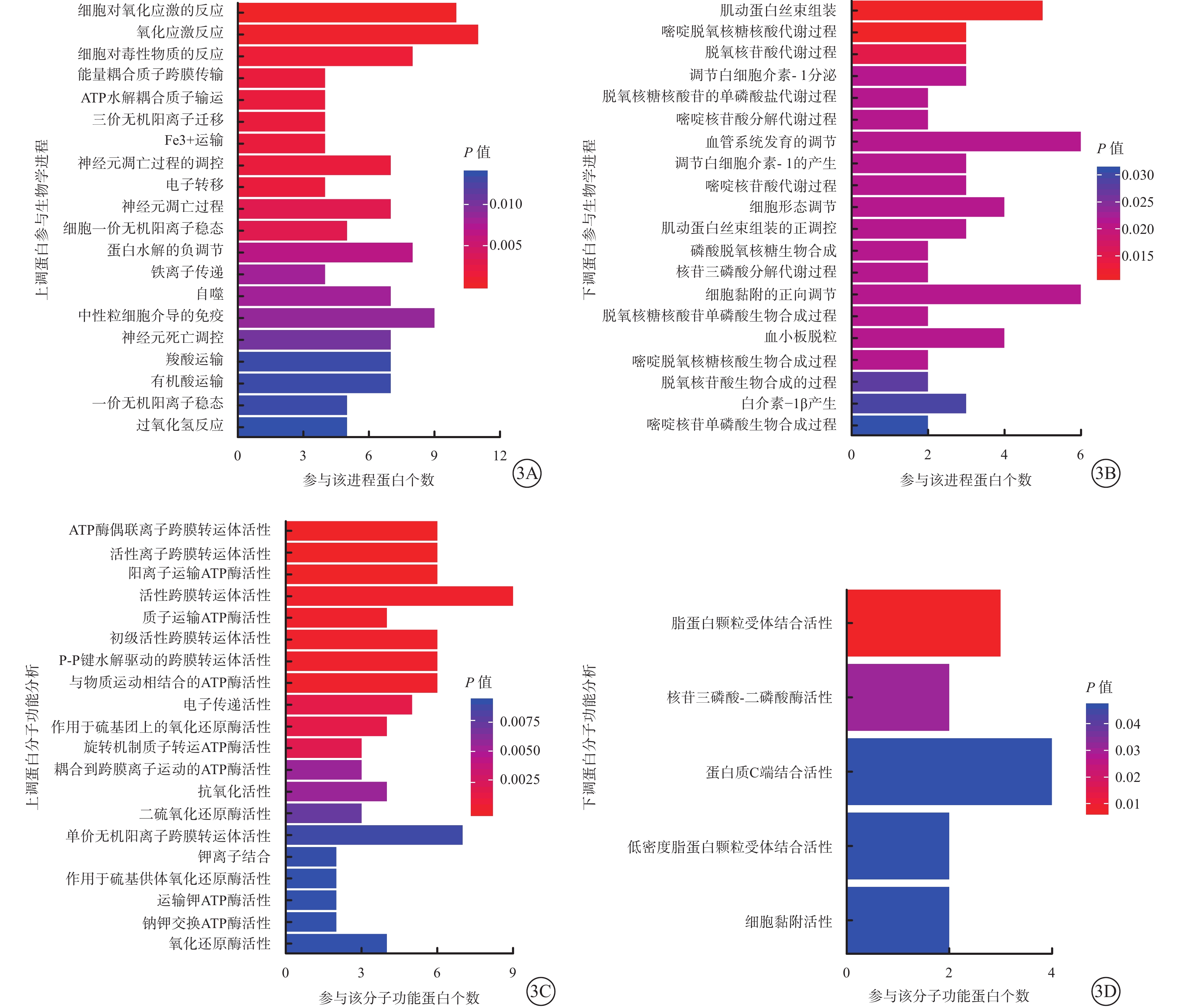 圖3
10 μmol/L 4-HNE刺激組差異蛋白參與的生物學進程和功能分析結果。3A、3B分別示上調、下調蛋白參與的生物學進程分析結果;3C、3D分別示上調、下調蛋白分子功能分析結果
圖3
10 μmol/L 4-HNE刺激組差異蛋白參與的生物學進程和功能分析結果。3A、3B分別示上調、下調蛋白參與的生物學進程分析結果;3C、3D分別示上調、下調蛋白分子功能分析結果
?
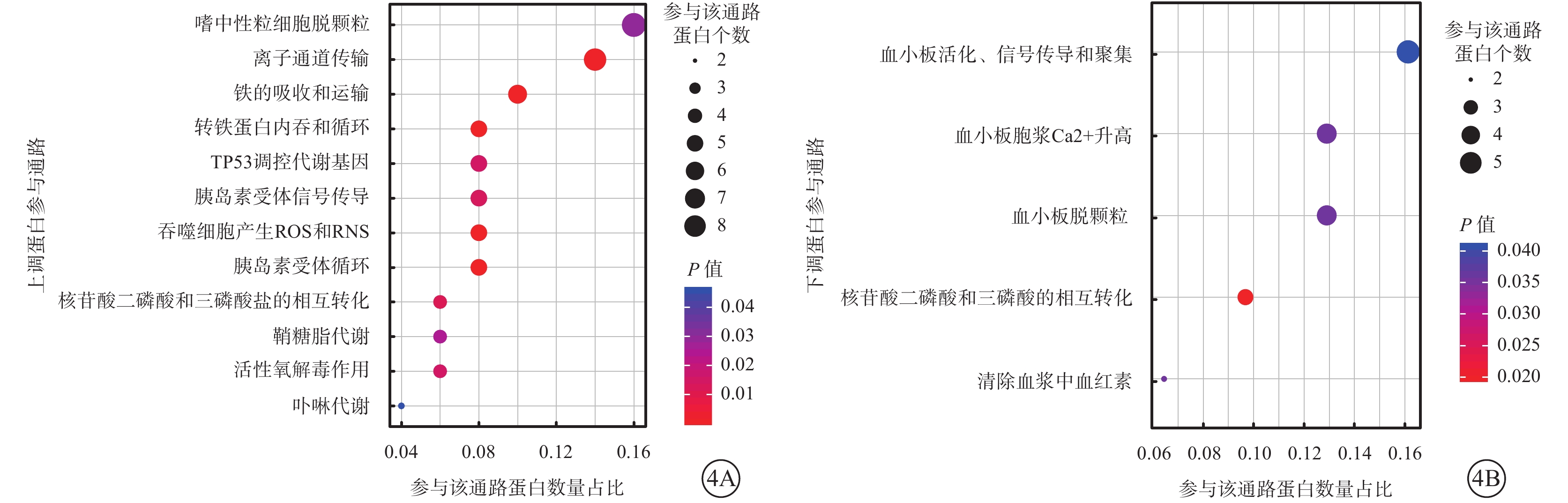
富集分析結果顯示,10 μmol/L 4-HNE刺激組上調蛋白參與中性粒細胞脫顆粒和離子通道傳輸等通路(圖4A);下調蛋白參與主要有血小板活化、信號傳導和聚集等通路(圖4B)。
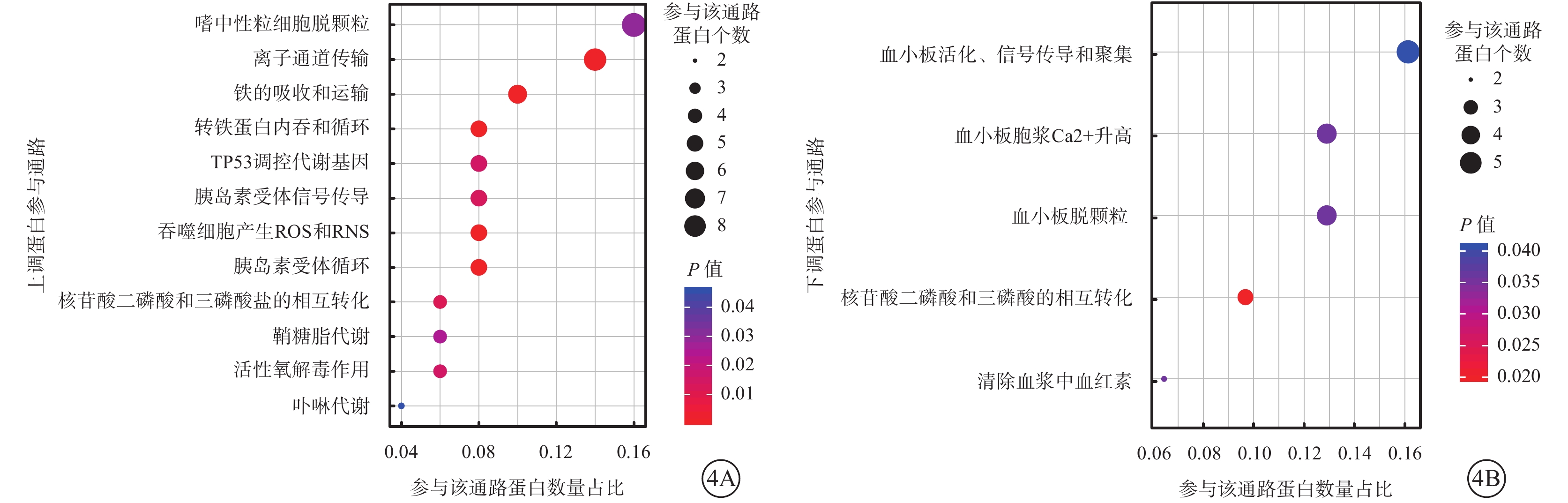 圖4
差異蛋白參與通路氣泡圖。4A、4B分別示10 μmol/L 4-HNE組上調、下調蛋白參與通路
圖4
差異蛋白參與通路氣泡圖。4A、4B分別示10 μmol/L 4-HNE組上調、下調蛋白參與通路
?
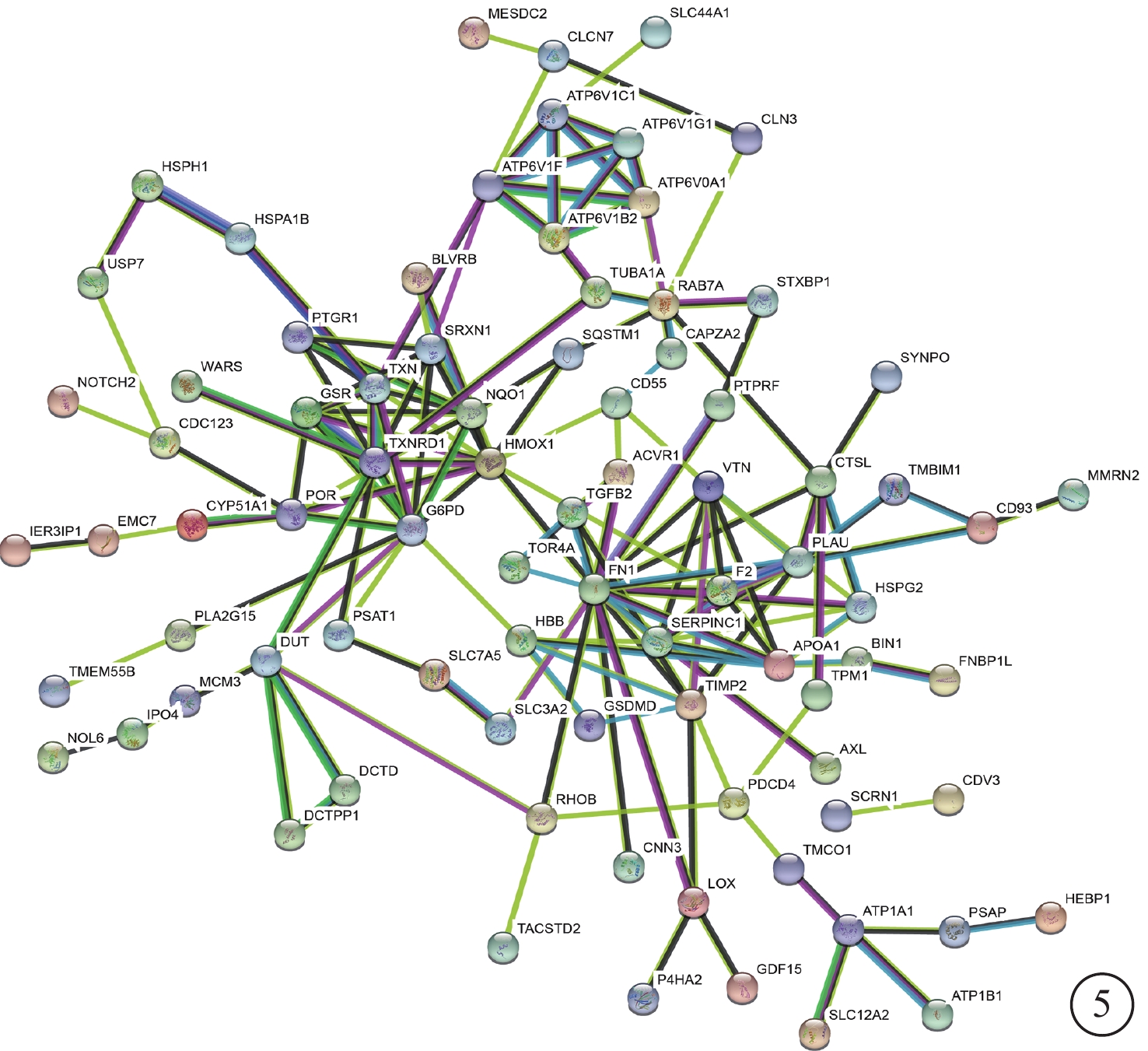
蛋白與蛋白相互作用分析結果顯示,上調蛋白中與其他差異蛋白具有較多相互作用的有ATP酶、GSR和TXNRD1等;下調蛋白中具有較多相互作用的蛋白有纖連蛋白、玻連蛋白、凝血酶原等(圖5)。
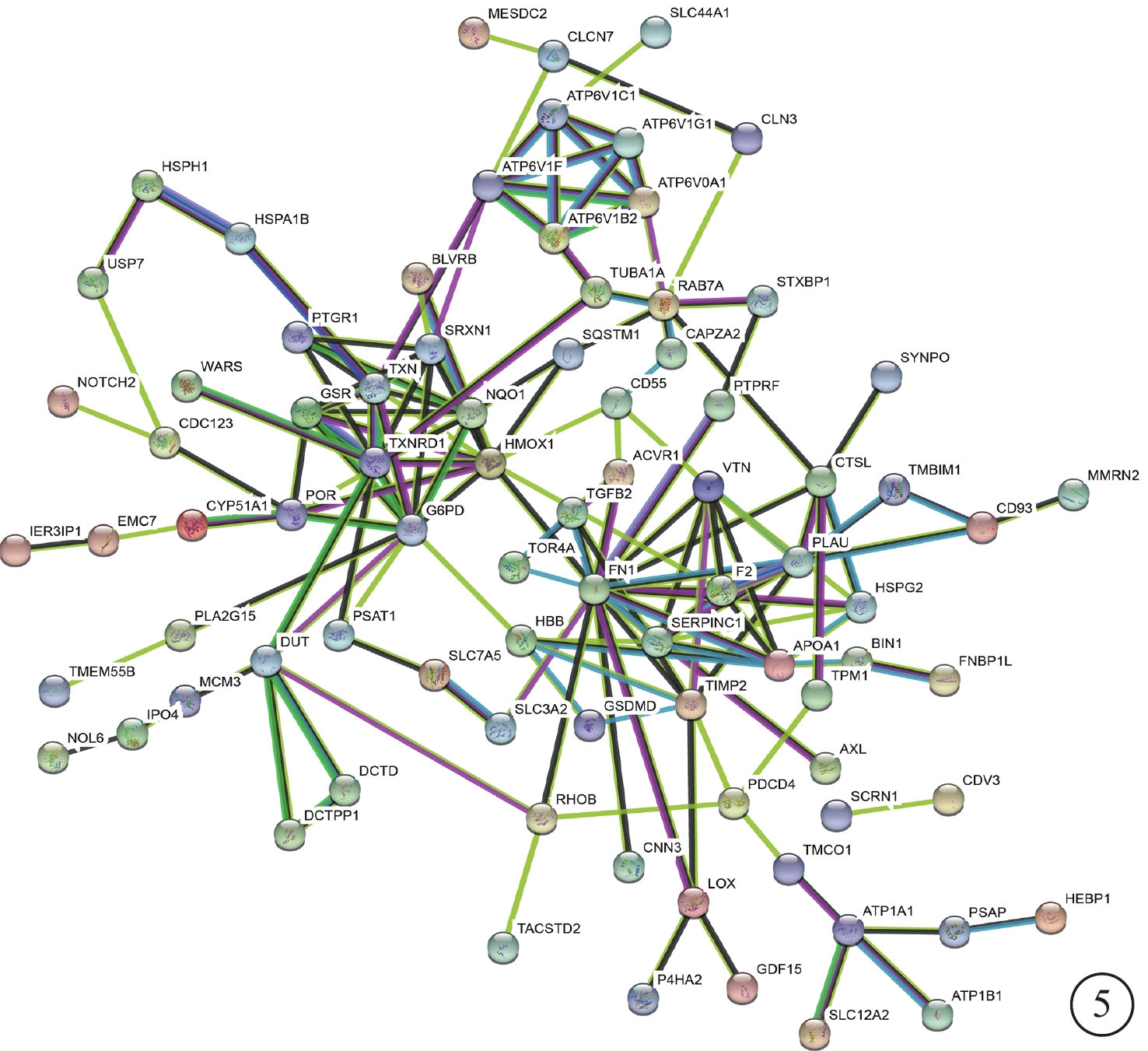 圖5
蛋白與蛋白相互作用網絡圖。差異蛋白及其相互作用以節點和邊緣的形式顯示,沒有連接的蛋白質則未顯示
圖5
蛋白與蛋白相互作用網絡圖。差異蛋白及其相互作用以節點和邊緣的形式顯示,沒有連接的蛋白質則未顯示
3 討論
蛋白質組學技術在DR的應用涉及多個方面,既往研究通過檢測DR患者的視網膜、玻璃體、房水、血液,甚至淚液中差異表達的蛋白質,尋找DR相關的生物學標記物[5]。本研究主要觀察4-HNE刺激hRMECs增生的蛋白變化情況。結果顯示,不同濃度的4-HNE對細胞增生影響不同,10、20 μmol/L 4-HNE促進細胞增生,而濃度為50 μmol/L時,則抑制細胞增生。既往研究發現4-HNE調控細胞的生長與濃度相關,低濃度促進細胞的增生、生長[6],高濃度導致細胞壞死或凋亡[7]。
DR患者視網膜中4-HNE表達升高。4-HNE主要的靶點是蛋白質和DNA,調控細胞信號從而在疾病中發揮作用[8]。本研究結果顯示,4-HNE刺激hRMECs后,上調蛋白中變化明顯的有HMOX1、SRXN1、TXNRD1、GSR、熱休克蛋白A1B等,下調蛋白中變化明顯的有ApoA1、PDCD4等。其中HMOX1在上調蛋白中升高最明顯,具有抗氧化和抗炎作用[9],同時減輕糖尿病大鼠血管內皮損傷[10];SRXN1也是重要的解毒蛋白,通過上調細胞外調節蛋白激酶/核因子E2相關因子2(Nrf2)信號通路,增強細胞抗氧化應激和生存能力[11-12];TXNRD1不僅調控體內氧化還原平衡,還受Nrf2/Kelch樣環氧氯丙烷相關蛋白-1通路調控,調節細胞生長和轉化[13]。
4-HNE刺激hRMECs導致ATP酶的相關亞基如ATP6V1B2、ATP6V1F、ATP6V01A和ATP6V1G1等表達增加。ATP酶是一種膜結合的多亞基酶,由ATP驅動的質子泵,參與膜離子轉運、蛋白質加工和降解,對維持pH和離子穩態至關重要。既往研究證明高表達ATP酶促進腫瘤細胞內pH穩定[14];反之則促進細胞發生自噬,降低其增生能力[15]。ATP酶激活雷帕霉素靶蛋白1和Notch信號通路,以此調節細胞生長和代謝[16]。其他上調蛋白如凝血酶原是參與凝血的上游蛋白,通過激動下游凝血因子Ⅶ、Ⅷ、Ⅺ和Ⅻ形成血栓,導致白細胞停滯和炎癥的產生。當凝血酶原轉變為凝血酶時,可促進血管內皮細胞增生[17]。既往研究發現增生型DR(PDR)患者玻璃體內凝血酶原表達水平升高[18]。本研究結果顯示,hRMECs在氧化應激情況下凝血酶原表達升高,與玻璃體變化趨勢相同。此外,玻連蛋白在4-HNE刺激后表達升高。玻連蛋白是細胞黏附的重要物質,定位于DR新生血管中毛細血管基底側和周細胞內側的空間,調控內皮細胞遷移和生長。既往研究表明PDR患者玻璃體腔內玻連蛋白表達增加[19],血漿樣品顯示患有PDR的2型糖尿病患者的玻連蛋白表達顯著增加[20]。玻連蛋白受體拮抗劑可抑制視網膜新生血管形成[21],說明玻連蛋白在DR新生血管形成中具有關鍵作用。
4-HNE刺激hRMECs后表達降低明顯的蛋白為ApoA1和PDCD4。ApoA1表達降低可下調金屬酶蛋白9的表達,抑制新生血管生成[22]。既往研究發現血清ApoA1升高與DR發生率降低相關[23]。同時,PDR患者血液中ApoA1水平降低,可能是發生PDR的原因之一,目前仍缺少其在DR中的機制研究[24-25]。本研究結果發現PDCD4在4-HNE刺激后表達降低。PDCD4是一種定位于增生細胞細胞核的蛋白質,具有抑制細胞增生和促進凋亡的作用[26],通過調控血管生成素-2、VEGF和成纖維細胞生長因子表達,影響血管重塑[27]。
本研究存在的不足,4-HNE模型尚不能完全模擬DR新生血管形成過程;蛋白質組學技術高度依賴質譜儀器的精準度,目前的質譜儀器不能檢測細胞中部分低峰度蛋白;檢測出的蛋白存在假陽性的可能。
糖尿病視網膜病變(DR)發生與氧化應激密切相關。既往研究發現,DR患者血液中脂質氧化應激產物4-羥基壬稀酸(4-HNE)的水平較眼底未發生視網膜病變者升高且與DR發生相關[1-3]。但研究集中于4-HNE對單一通路的變化進行探索[4]。本研究應用4-HNE刺激人視網膜微血管內皮細胞(hRMECs),模擬氧化應激狀態下內皮細胞增生環境,應用定量蛋白質組學技術檢測hRMECs在4-HNE刺激后蛋白表達變化情況,并結合基因注釋(GO)分析和通路富集對差異蛋白進行分析。現將結果報道如下。
1 材料和方法
1.1 材料
hRMECs(美國Angioproteomie公司);內皮細胞培養基(ECM,美國Science Cell公司);青霉素、鏈霉素、Dulbecco's DPS (美國Gibco公司);二喹啉甲酸蛋白定量試劑盒(中國索萊寶公司);CCK-8細胞計數試劑盒(日本Dojindo公司);細胞培養孵箱(日本Sanyo公司);胰蛋白酶(美國Promega公司);4-HNE、甲醇、水(美國Merck公司);相對分子質量10×103 過濾管(美國Sartorius公司);蛋白酶抑制劑、磷酸酶抑制劑(瑞士Roche公司);尿素、釩酸鈉、氟化鈉、脫氧膽酸鈉、DL-二硫蘇糖醇、吲哚乙酸(美國Sigma公司);質譜儀器、液相(美國AB SCIEX公司)。
1.2 CCK-8增生分析法檢測不同濃度4-HNE對hRMECs增生的影響
ECM培養對數生長期hRMECs,待細胞生長融合度80%~90%時,胰酶將細胞消化成懸液,細胞密度1×103個/孔接種到96孔板中。hRMECs分為4-HNE刺激組和陰性對照組。細胞貼壁生長24 h后,4-HNE刺激組加入濃度為5、10、20、50 μmol/L 4-HNE培養基,并據此再分為不同濃度亞組;陰性對照組培養基加入等體積無水乙醇(4-HNE溶劑)。刺激24 h后加入CCK-8孵育4 h,酶標儀上以450 nm波長測定不同濃度組和陰性對照組細胞的吸光度[A,舊稱光密度(OD)]值。
1.3 制樣及細胞質譜分析
體外培養處于對數生長期的hRMECs,當細胞融合度為40%~50%時,4-HNE刺激組加入含10 μmol/L 4-HNE培養基,陰性對照組加入等體積無水乙醇培養基。24 h后收集兩組細胞各5盤。基于超濾輔助樣品制備酶切方法提取細胞蛋白,行液相串聯質譜分析。采用非數據依賴采集模式(SWATH-MS)方法進行檢測。應用ProteinPilot(5.0)軟件對獲得的原始質譜數據進行數據庫搜索。將搜庫后產生的ProteinPilot文件導入Peakview軟件內置的SWATH插件中,選擇對應的SWATH原始數據。在進程設置里每個肽段的翻譯數和每個蛋白的肽段數均為5,排除翻譯后修飾的肽段和同源肽段,肽段可信度≥90%,假陽性率≤1%。
1.4 統計學分析
使用R語言(版本3.5.3)psych包對數據進行生物信息學分析,包括樣本間的Pearson相關性分析、差異蛋白篩選、GO分析、通路富集分析等。蛋白-蛋白相互作用分析使用STRING數據庫。采用SPSS 22.0統計軟件對CCK-8結果和差異蛋白篩選行單因素方差分析。差異蛋白篩選通過方差分析某個蛋白在兩組間的表達,當差異倍數大于1.5倍以上,并且具有統計學意義,被認為是差異表達蛋白。所有統計檢驗均為雙側,P< 0.05為差異有統計學意義。
2 結果
?
CCK-8增生分析法結果顯示,陰性對照組以及5、10、20、50 μmol/L 4-HNE刺激組A值分別為0.66±0.09、0.85±0.14、1.12±0.20、1.11±0.19、0.32±0.03。10、20 μmol/L 4-HNE刺激組A值高于陰性對照組和5 μmol/L4-HNE刺激組,差異有統計學意義(F=25.42,P<0.05);50 μmol/L 4-HNE刺激組A值低于其他濃度刺激組,差異有統計學意義(F=25.42,P<0.05)。10、20 μmol/L 4-HNE刺激組之間A值差異無統計學意義(P>0.05)(圖1)。
 圖1
不同濃度4-HNE刺激組、陰性對照組細胞A值比較。*P<0.05
圖1
不同濃度4-HNE刺激組、陰性對照組細胞A值比較。*P<0.05
?
細胞質譜分析共鑒定出2710個可定量蛋白。與陰性對照組比較,10 μmol/L 4-HNE刺激組差異表達倍數大于1.5倍的蛋白118個,差異有統計學意義(P <0.05)(圖2A)。118個蛋白中,上調蛋白72個,下調蛋白46個(圖2B)。上調蛋白中變化明顯的有血紅素氧合酶1(HMOX1)、磺胺嘧啶1(SRXN1)、硫氧還蛋白還原酶1(TXNRD1)、谷胱甘肽還原酶(GSR)、熱休克蛋白A1B等;下調蛋白中變化明顯的有載脂蛋白A1(ApoA1)、程序性細胞凋亡因子4(PDCD4)等。Pearson相關性分析結果顯示,10 μmol/L 4-HNE刺激組、陰性對照組相關性系數均≥0.97(圖2C)。
 圖2
定量蛋白質組學結果。2A示差異表達蛋白基因熱圖,右側為差異蛋白基因,紅色方格表示4-HNE刺激后上調蛋白,藍色方格表示4-HNE刺激后下調蛋白。E:10 μmol/L 4-HNE刺激組,C:陰性對照組。2B示火山圖,4-HNE刺激后差異變化倍數較高的多種蛋白;紅點表示上調蛋白,藍點表示下調蛋白。2C示兩組Pearson相關分析組內相關系數。E:10 μmol/L 4-HNE刺激組,C:陰性對照組
圖2
定量蛋白質組學結果。2A示差異表達蛋白基因熱圖,右側為差異蛋白基因,紅色方格表示4-HNE刺激后上調蛋白,藍色方格表示4-HNE刺激后下調蛋白。E:10 μmol/L 4-HNE刺激組,C:陰性對照組。2B示火山圖,4-HNE刺激后差異變化倍數較高的多種蛋白;紅點表示上調蛋白,藍點表示下調蛋白。2C示兩組Pearson相關分析組內相關系數。E:10 μmol/L 4-HNE刺激組,C:陰性對照組
?
GO分析結果顯示,10 μmol/L 4-HNE刺激組上調蛋白主要參與氧化應激反應、細胞解毒、三磷酸腺苷(ATP)水解偶聯等生物學進程(圖3A);下調蛋白主要參與血管系統發育調節、細胞黏附的正向調節和IL-1產生與分泌調節等生物學進程(圖3B)。上調蛋白參與的分子功能包括多種離子跨膜轉運體活性(圖3C);參與的蛋白主要有ATP酶、GSR和TXNRD1等。下調蛋白參與的分子功能有蛋白質C端結合和脂蛋白顆粒受體結合等(圖3D);參與的主要蛋白有纖連蛋白、ApoA1和金屬蛋白酶抑制劑等。
 圖3
10 μmol/L 4-HNE刺激組差異蛋白參與的生物學進程和功能分析結果。3A、3B分別示上調、下調蛋白參與的生物學進程分析結果;3C、3D分別示上調、下調蛋白分子功能分析結果
圖3
10 μmol/L 4-HNE刺激組差異蛋白參與的生物學進程和功能分析結果。3A、3B分別示上調、下調蛋白參與的生物學進程分析結果;3C、3D分別示上調、下調蛋白分子功能分析結果
?
富集分析結果顯示,10 μmol/L 4-HNE刺激組上調蛋白參與中性粒細胞脫顆粒和離子通道傳輸等通路(圖4A);下調蛋白參與主要有血小板活化、信號傳導和聚集等通路(圖4B)。
 圖4
差異蛋白參與通路氣泡圖。4A、4B分別示10 μmol/L 4-HNE組上調、下調蛋白參與通路
圖4
差異蛋白參與通路氣泡圖。4A、4B分別示10 μmol/L 4-HNE組上調、下調蛋白參與通路
?
蛋白與蛋白相互作用分析結果顯示,上調蛋白中與其他差異蛋白具有較多相互作用的有ATP酶、GSR和TXNRD1等;下調蛋白中具有較多相互作用的蛋白有纖連蛋白、玻連蛋白、凝血酶原等(圖5)。
 圖5
蛋白與蛋白相互作用網絡圖。差異蛋白及其相互作用以節點和邊緣的形式顯示,沒有連接的蛋白質則未顯示
圖5
蛋白與蛋白相互作用網絡圖。差異蛋白及其相互作用以節點和邊緣的形式顯示,沒有連接的蛋白質則未顯示
3 討論
蛋白質組學技術在DR的應用涉及多個方面,既往研究通過檢測DR患者的視網膜、玻璃體、房水、血液,甚至淚液中差異表達的蛋白質,尋找DR相關的生物學標記物[5]。本研究主要觀察4-HNE刺激hRMECs增生的蛋白變化情況。結果顯示,不同濃度的4-HNE對細胞增生影響不同,10、20 μmol/L 4-HNE促進細胞增生,而濃度為50 μmol/L時,則抑制細胞增生。既往研究發現4-HNE調控細胞的生長與濃度相關,低濃度促進細胞的增生、生長[6],高濃度導致細胞壞死或凋亡[7]。
DR患者視網膜中4-HNE表達升高。4-HNE主要的靶點是蛋白質和DNA,調控細胞信號從而在疾病中發揮作用[8]。本研究結果顯示,4-HNE刺激hRMECs后,上調蛋白中變化明顯的有HMOX1、SRXN1、TXNRD1、GSR、熱休克蛋白A1B等,下調蛋白中變化明顯的有ApoA1、PDCD4等。其中HMOX1在上調蛋白中升高最明顯,具有抗氧化和抗炎作用[9],同時減輕糖尿病大鼠血管內皮損傷[10];SRXN1也是重要的解毒蛋白,通過上調細胞外調節蛋白激酶/核因子E2相關因子2(Nrf2)信號通路,增強細胞抗氧化應激和生存能力[11-12];TXNRD1不僅調控體內氧化還原平衡,還受Nrf2/Kelch樣環氧氯丙烷相關蛋白-1通路調控,調節細胞生長和轉化[13]。
4-HNE刺激hRMECs導致ATP酶的相關亞基如ATP6V1B2、ATP6V1F、ATP6V01A和ATP6V1G1等表達增加。ATP酶是一種膜結合的多亞基酶,由ATP驅動的質子泵,參與膜離子轉運、蛋白質加工和降解,對維持pH和離子穩態至關重要。既往研究證明高表達ATP酶促進腫瘤細胞內pH穩定[14];反之則促進細胞發生自噬,降低其增生能力[15]。ATP酶激活雷帕霉素靶蛋白1和Notch信號通路,以此調節細胞生長和代謝[16]。其他上調蛋白如凝血酶原是參與凝血的上游蛋白,通過激動下游凝血因子Ⅶ、Ⅷ、Ⅺ和Ⅻ形成血栓,導致白細胞停滯和炎癥的產生。當凝血酶原轉變為凝血酶時,可促進血管內皮細胞增生[17]。既往研究發現增生型DR(PDR)患者玻璃體內凝血酶原表達水平升高[18]。本研究結果顯示,hRMECs在氧化應激情況下凝血酶原表達升高,與玻璃體變化趨勢相同。此外,玻連蛋白在4-HNE刺激后表達升高。玻連蛋白是細胞黏附的重要物質,定位于DR新生血管中毛細血管基底側和周細胞內側的空間,調控內皮細胞遷移和生長。既往研究表明PDR患者玻璃體腔內玻連蛋白表達增加[19],血漿樣品顯示患有PDR的2型糖尿病患者的玻連蛋白表達顯著增加[20]。玻連蛋白受體拮抗劑可抑制視網膜新生血管形成[21],說明玻連蛋白在DR新生血管形成中具有關鍵作用。
4-HNE刺激hRMECs后表達降低明顯的蛋白為ApoA1和PDCD4。ApoA1表達降低可下調金屬酶蛋白9的表達,抑制新生血管生成[22]。既往研究發現血清ApoA1升高與DR發生率降低相關[23]。同時,PDR患者血液中ApoA1水平降低,可能是發生PDR的原因之一,目前仍缺少其在DR中的機制研究[24-25]。本研究結果發現PDCD4在4-HNE刺激后表達降低。PDCD4是一種定位于增生細胞細胞核的蛋白質,具有抑制細胞增生和促進凋亡的作用[26],通過調控血管生成素-2、VEGF和成纖維細胞生長因子表達,影響血管重塑[27]。
本研究存在的不足,4-HNE模型尚不能完全模擬DR新生血管形成過程;蛋白質組學技術高度依賴質譜儀器的精準度,目前的質譜儀器不能檢測細胞中部分低峰度蛋白;檢測出的蛋白存在假陽性的可能。