病理性近視(PM)是眼科學領域最具研究挑戰的臨床病種之一,其疾病的準確定義、標準分級、發生演進機制、預防治療策略都尚在探索研究中。人工智能的發展和應用為PM眼底病相關資料的解析提供了強力工具。通過PM患者眼底影像資料標準化采集輔助、眼底生理結構的自動化分割和定量分析、PM經典病灶的自動化檢測、分析和PM臨床診療決策輔助多個方面,人工智能使得臨床醫師在PM的臨床工作和臨床研究中獲得更多、更精確的數據信息,幫助眼科醫師深入理解PM的發生及演進過程。
引用本文: 許迅, 余奇. 人工智能在病理性近視眼底資料解析中的應用和展望. 中華眼底病雜志, 2019, 35(5): 427-431. doi: 10.3760/cma.j.issn.1005-1015.2019.05.001 復制
近年來,隨著近視患者在全球范圍尤其是東亞和東南亞地區蔓延增長,高度近視及病理性近視(PM)患病率也同樣逐年遞增。近期薈萃分析研究數據預測,至2050年,全球人口近視的患病率將達到50%,而高度近視的患病率也將達到10%。對于PM及其相關的不可逆視力損傷的防控已經成為重要的國際公共衛生議題[1-2]。
1 PM典型眼底改變及臨床分級
PM是眼科學領域最具研究挑戰的臨床病種之一,其疾病的準確定義、標準分級、發生演進機制、預防治療策略都尚在探索研究中。PM比較公認的定義為高度近視同時伴有鞏膜、脈絡膜、RPE病理性改變和視力損傷。PM的典型改變包括脈絡膜視網膜斑片狀萎縮、漆裂紋、脈絡膜新生血管(CNV)、Fuchs斑、近視拉伸線、鞏膜葡萄腫、放射狀線條、穹頂狀黃斑等。隨著眼底成像技術拍攝角度的拓廣以及掃描深度的增加,PM眼底改變得到了更好且更細節化的展現[3-5]。
2015年,關于PM的薈萃分析(META-PM)將PM黃斑病變分為無眼底病變(0級)、豹紋狀眼底(1級)、彌漫性萎縮(2級)、斑片狀萎縮(3級)和黃斑萎縮(4級)共5級,以及漆裂紋、CNV和Fuchs斑3個附加病變。其中,2級及以上或伴隨附加病變可診斷為PM[6]。Ruiz-Medrano等[7]2019年將PM黃斑病變分為萎縮性部分(A)、牽引性部分(T)、新生血管部分(N)三大部分,并在此基礎上提出了新的PM黃斑病變ATN分級系統。該新分級系統整合了患者彩色眼底像及OCT圖像中的病變信息,較META-PM分級系統增加了黃斑區因牽引力產生的結構改變,如黃斑劈裂、黃斑脫離、黃斑裂孔,并對3種類型的病變均做了嚴重程度的分級。
2 人工智能
2.1 人工智能的發展歷史
人工智能是計算機科學的一個亞專業領域,是研究、開發用于模擬、延伸和擴展人的智能的理論、方法、技術及應用的技術科學。自1956年達特茅斯研討會人工智能元年至今,已逾一個甲子。人工智能算法及技術日益強大并融入不同專業領域。醫學是人工智能交叉應用的前沿學科,眼科學則是其中的熱點領域[8-10]。
近年,機器學習算法的迅猛發展使之成為人工智能領域的熱點。其中,計算機神經網絡算法通過模擬生物神經網絡行為特征,通過調整內部節點間關聯關系,進行分布式的并行信息處理。從古老的感知機模型(perceptron)、前饋神經網絡(feed forward)等經典網絡模型,到全卷積神經網絡等深度學習算法的發展,允許復雜多層計算模型學習多重抽象類別數據。神經網絡算法極大地改進了圖像識別、目標檢測和諸如藥物發現和基因組學等許多領域的最新技術,并在這些領域取得了突破性的應用和進展[11]。
2.2 人工智能在眼底病領域的應用現狀
眼底病尤其是眼底病影像領域是人工智能應用的理想研究領域,諸多團隊從不同的病種及診療目的切入點進行深入研究。
其中,有學者應用128 175幅專科醫師標記的彩色眼底像作為深度卷積神經網絡的訓練集合,實現對糖尿病視網膜病變的計算機自動篩查,并在進一步的研究工作中應用深度神經網絡挖掘出同眼底形態特征密切相關的先驗知識不能判斷的參數,如年齡、性別、體重指數、收縮壓、舒張壓等,并實現僅僅基于彩色眼底像對患者這些參數進行估判[12-13]。
Kemany等[14]在黃斑區OCT圖像庫中,將眼科醫師的疾病診斷信息作為輸入信息訓練卷積神經網絡,實現了對正常、玻璃膜疣、糖尿病黃斑水腫、CNV 4種診斷類別的自動化判斷,多次驗證測試其算法結果的靈敏度及特異性均超過90%。
Burlina等[15-16]基于1992年至2005年年齡相關性眼病研究(AREDS)積累的大量影像學資料,應用深度卷積神經網絡實現了對老年性黃斑變性患者彩色眼底像的AREDS 9級精確評分及5年風險預后預測。
3 人工智能在PM眼底影像資料解析中的應用
PM的眼底改變作為繼發于屈光疾病的眼底病變,其疾病的發生發展具有獨特的時間和空間的延續性,五維甚至更高維的精確數據隨訪能夠讓眼科醫生更好的理解PM的發生機制和演進特征。對于復雜高維數據進行直接解讀并非眼科醫生的擅長領域,人工智能為眼科醫生提供強有力的助力。
3.1 PM影像資料的標準化采集輔助
PM的影像資料采集由于患者眼部屈光狀態的特殊性,無論是眼底彩色照相、眼底血管造影等二維圖像的采集,或者是OCT等三維圖像的采集,均需要依據患者的屈光狀態進行較多的拍攝調整。類似于人工智能的另外一個熱點應用領域——自動駕駛,人工智能輔助拍攝技術可以根據PM患者特殊的屈光和間質信息以及臨床醫生的觀察側重,在影像采集伊始進行相關參數和模式的配置,以獲得優化的影像學資料。
人工智能輔助影像拍攝技術的優勢在于可以根據患者的個體化屈光和解剖特征進行自動化、個性化參數調整,可以排除技師手動設置的差異性,可以根據醫生的需求進行目標區域的準確掃描,同時還可以增加掃描過程的穩定性和掃描效率。相關技術已經在放射科CT、MRI等影像資料的采集中獲得了臨床應用,其在圖像采集的效率、準確性、穩定性、降噪等方面較技師手工調整顯著提升,并為進一步定量分析和重建等后處理工作奠定基礎[17]。眼底病該領域技術在初步應用及進一步的研發中。
3.2 PM影像中生理結構的自動化分割及定量分析
PM的病理改變廣泛累及視網膜、脈絡膜和鞏膜的多個層次。PM患眼鞏膜厚度與眼軸長度呈負相關,且后鞏膜葡萄腫高度與鞏膜厚度呈負相關。同時,在PM患者中,區域脈絡膜總面積、脈絡膜血管管腔區域、脈絡膜基質區域等脈絡膜層的形態參數及脈絡膜血管形態參數與PM患者眼軸延長、疾病演進同樣具有顯著相關性[18-22]。
在近年PM影像學多因素分析研究中,更多的精確形態學結構被研究者所關注。視盤周圍萎縮灶尤其是細化分區中γ區病灶,是高度近視眼軸增長并最終演進為PM的相關性分析系數最高的形態學指標。黃斑區域視網膜毛細血管密度的區域性異常也被發現與PM的發展顯著相關[23-25]。
這些定量數據的獲取在傳統方法學中,眼科醫生需要通過手工點對點測量或者圖像輔助分析軟件的幫助下手工測量,工作量較大,存在操作偏移,且只能對一定目標區域進行測量。而對于PM眼底影像資料中這些生理結構的自動化分割和定量分析正是人工智能技術中基于不同算法的圖像識別技術的擅長領域。
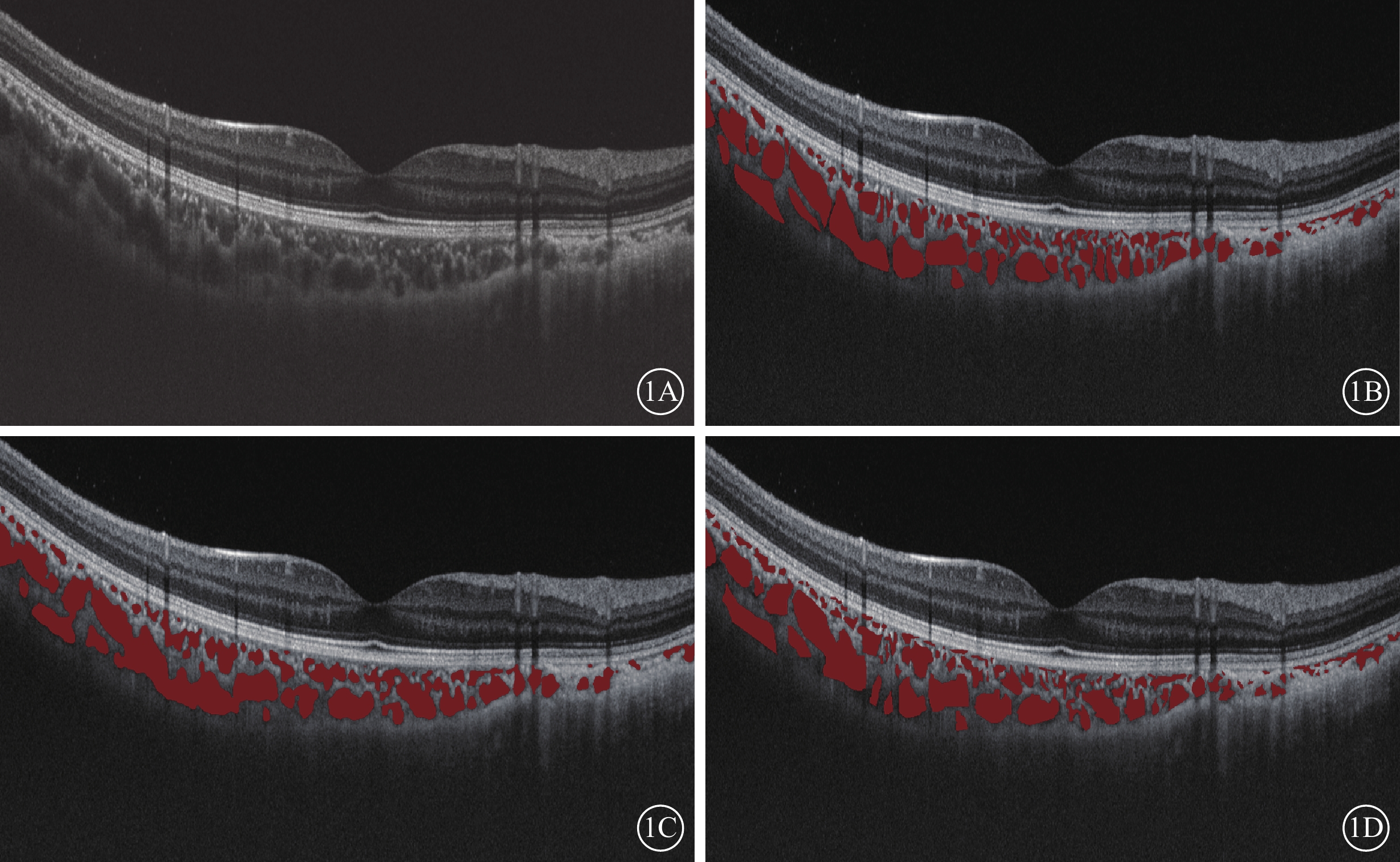
Antony等[26]運用基于成本函數的圖論方法框架對頻域OCT圖像中視網膜層次分別進行5層、7層和10層的自動化分層分割,其與金標準相比較的誤差分別僅為(3.35±0.62)、(6.45±1.87)、(9.75±3.18)μm。Liu等[27]通過應用深度學習改良神經網絡算法RefineNet模型,實現對廣度掃描OCT圖像中脈絡膜血管結構非劣效于專科醫師手工標記的自動化識別、分割和定量分析(圖1)。
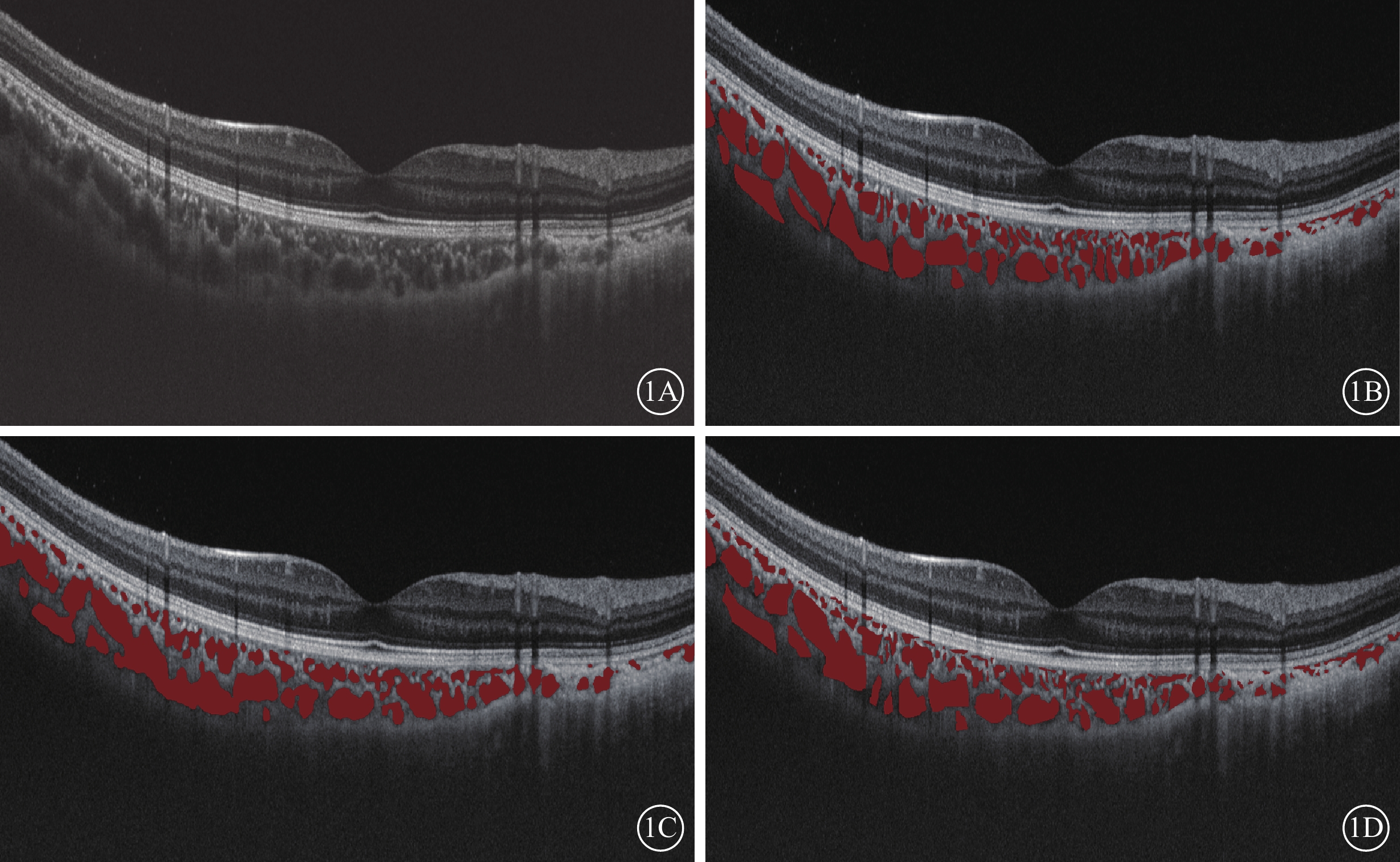 圖1
通過RefineNet神經網絡模型實現對脈絡膜血管分割的示例圖。1A示例圖原圖;1B示通過RefineNet算法分割標記脈絡膜血管;1C示眼科醫師一標記脈絡膜血管;1D示眼科醫師二標記脈絡膜血管
圖1
通過RefineNet神經網絡模型實現對脈絡膜血管分割的示例圖。1A示例圖原圖;1B示通過RefineNet算法分割標記脈絡膜血管;1C示眼科醫師一標記脈絡膜血管;1D示眼科醫師二標記脈絡膜血管
3.3 PM影像中典型病灶的自動化檢測和分析
脈絡膜視網膜萎縮、CNV、漆裂紋等PM典型眼底均可基于其形態學特征,通過人工智能圖像識別算法實現自動化檢測并進行進一步準確分析。
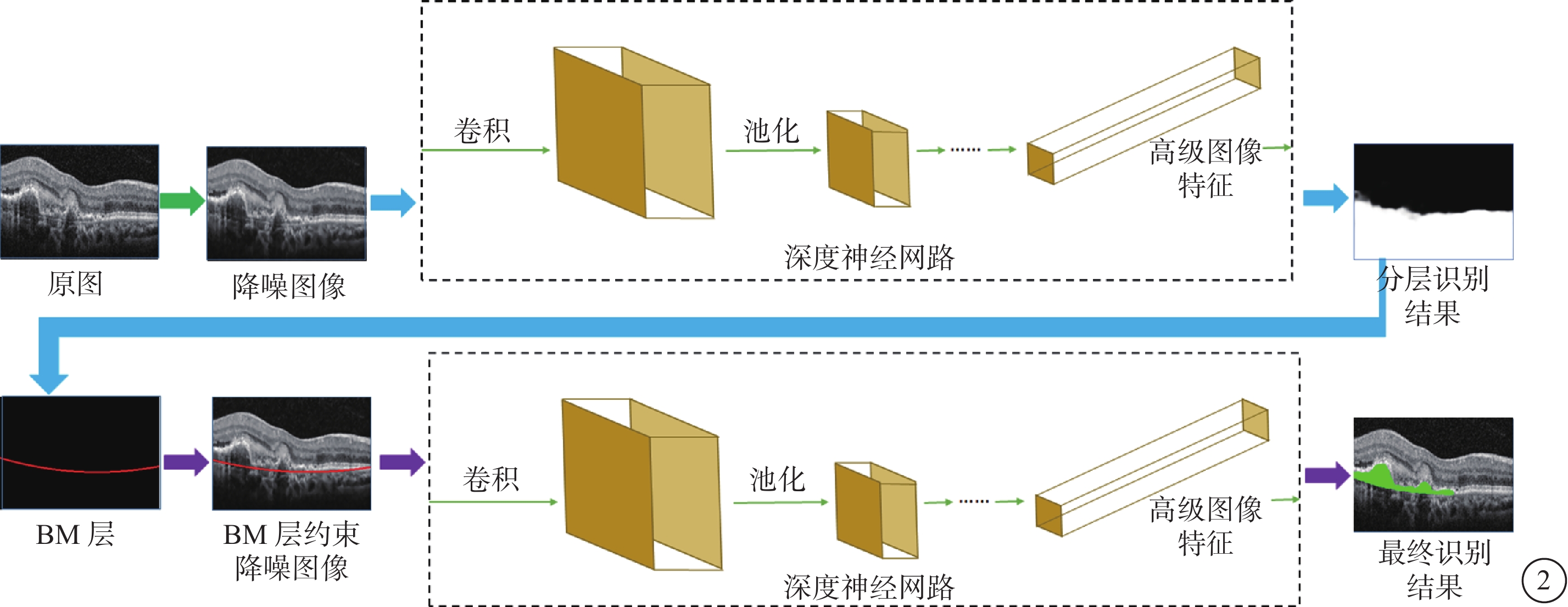
Cheng等[28]聯合應用Hough轉換及邊緣濾波器等實現對視盤周圍萎縮病灶的自動化檢測、區域分割和面積讀取。Xu等[29]通過雙階段卷積神經網絡算法實現對OCT圖像中CNV病灶的自動化分割及定量分析,并進一步應用條件生成對抗網絡實現對PM的ICGA圖像中漆裂紋病灶的自動化分割提取和定量分析(圖2)。
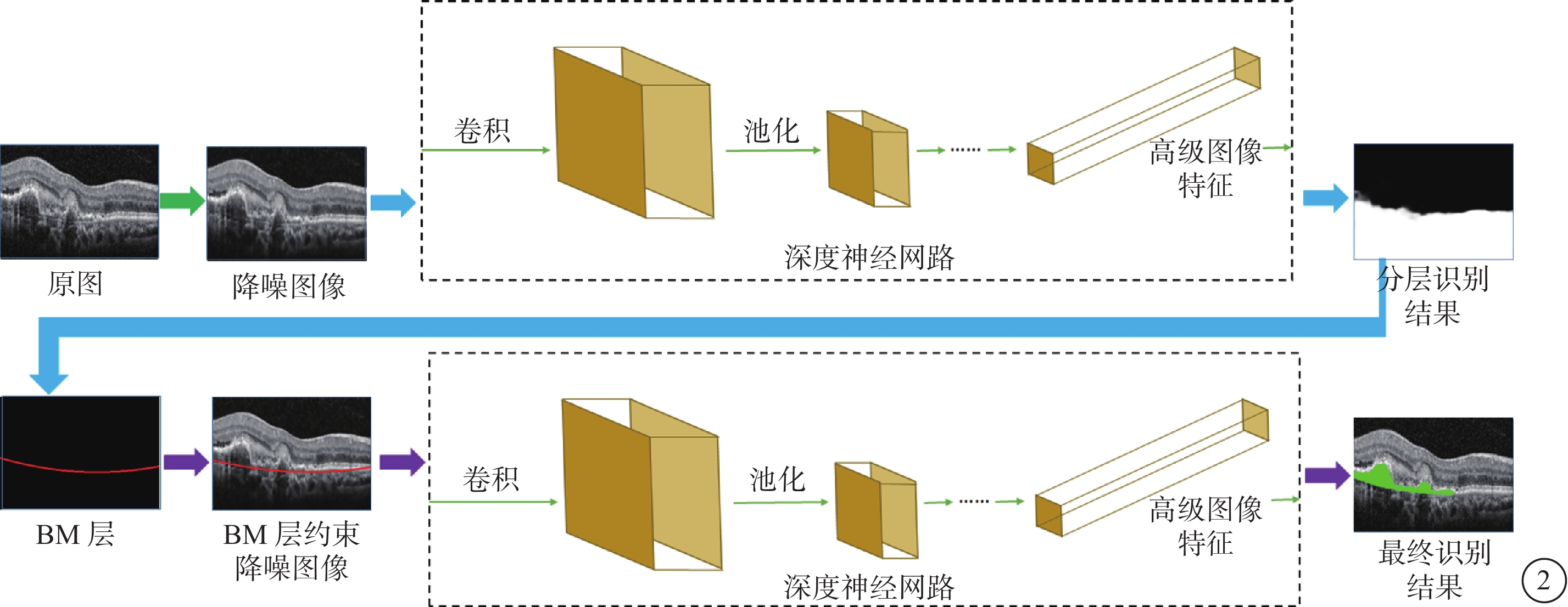 圖2
通過神經網絡模型實現對CNV病灶分割的算法流程圖
圖2
通過神經網絡模型實現對CNV病灶分割的算法流程圖
3.4 PM的臨床診療決策輔助
在對于PM患者影像資料中目標特征進行自動化解析的同時,通過基于整合患者人口學信息、屈光信息、診療及預后信息的大數據平臺,應用機器學習算法可以進一步實現對于患者目前疾病診斷及分級程度的自動化判斷,對于目前病情治療策略的推薦建議,以及對于患者病情預后的預測判斷。人工智能為臨床醫生的臨床診療提供實時輔助,為個性化、精準化醫療的實現助力,并在臨床數據積累的同時不斷優化[30-31]。
4 小結及展望
在人工智能算法的開發、驗證和改進過程中,均高度依賴于大量訓練數據。如何獲得、積累、存儲、使用以及共享準確、標準化的海量PM患者影像資料和臨床數據,需要臨床醫生、計算機科學家以及不同機構單位之間的協力合作[32]。同時,人工智能相關技術目前大多尚處于臨床研究前期階段,如何規范化地將數字實驗室的研究成果通過臨床試驗驗證轉化到臨床實踐,需要眼科臨床工作者和相關研究人員的集成智慧。
隨著機器學習領域前沿算法的優化、計算機硬件運算能力的增強、眼底影像設備拍攝范圍及圖像精準度的提高、PM臨床資料和數據的不斷積累,人工智能在PM臨床診療及臨床研究的價值將愈加凸顯。
近年來,隨著近視患者在全球范圍尤其是東亞和東南亞地區蔓延增長,高度近視及病理性近視(PM)患病率也同樣逐年遞增。近期薈萃分析研究數據預測,至2050年,全球人口近視的患病率將達到50%,而高度近視的患病率也將達到10%。對于PM及其相關的不可逆視力損傷的防控已經成為重要的國際公共衛生議題[1-2]。
1 PM典型眼底改變及臨床分級
PM是眼科學領域最具研究挑戰的臨床病種之一,其疾病的準確定義、標準分級、發生演進機制、預防治療策略都尚在探索研究中。PM比較公認的定義為高度近視同時伴有鞏膜、脈絡膜、RPE病理性改變和視力損傷。PM的典型改變包括脈絡膜視網膜斑片狀萎縮、漆裂紋、脈絡膜新生血管(CNV)、Fuchs斑、近視拉伸線、鞏膜葡萄腫、放射狀線條、穹頂狀黃斑等。隨著眼底成像技術拍攝角度的拓廣以及掃描深度的增加,PM眼底改變得到了更好且更細節化的展現[3-5]。
2015年,關于PM的薈萃分析(META-PM)將PM黃斑病變分為無眼底病變(0級)、豹紋狀眼底(1級)、彌漫性萎縮(2級)、斑片狀萎縮(3級)和黃斑萎縮(4級)共5級,以及漆裂紋、CNV和Fuchs斑3個附加病變。其中,2級及以上或伴隨附加病變可診斷為PM[6]。Ruiz-Medrano等[7]2019年將PM黃斑病變分為萎縮性部分(A)、牽引性部分(T)、新生血管部分(N)三大部分,并在此基礎上提出了新的PM黃斑病變ATN分級系統。該新分級系統整合了患者彩色眼底像及OCT圖像中的病變信息,較META-PM分級系統增加了黃斑區因牽引力產生的結構改變,如黃斑劈裂、黃斑脫離、黃斑裂孔,并對3種類型的病變均做了嚴重程度的分級。
2 人工智能
2.1 人工智能的發展歷史
人工智能是計算機科學的一個亞專業領域,是研究、開發用于模擬、延伸和擴展人的智能的理論、方法、技術及應用的技術科學。自1956年達特茅斯研討會人工智能元年至今,已逾一個甲子。人工智能算法及技術日益強大并融入不同專業領域。醫學是人工智能交叉應用的前沿學科,眼科學則是其中的熱點領域[8-10]。
近年,機器學習算法的迅猛發展使之成為人工智能領域的熱點。其中,計算機神經網絡算法通過模擬生物神經網絡行為特征,通過調整內部節點間關聯關系,進行分布式的并行信息處理。從古老的感知機模型(perceptron)、前饋神經網絡(feed forward)等經典網絡模型,到全卷積神經網絡等深度學習算法的發展,允許復雜多層計算模型學習多重抽象類別數據。神經網絡算法極大地改進了圖像識別、目標檢測和諸如藥物發現和基因組學等許多領域的最新技術,并在這些領域取得了突破性的應用和進展[11]。
2.2 人工智能在眼底病領域的應用現狀
眼底病尤其是眼底病影像領域是人工智能應用的理想研究領域,諸多團隊從不同的病種及診療目的切入點進行深入研究。
其中,有學者應用128 175幅專科醫師標記的彩色眼底像作為深度卷積神經網絡的訓練集合,實現對糖尿病視網膜病變的計算機自動篩查,并在進一步的研究工作中應用深度神經網絡挖掘出同眼底形態特征密切相關的先驗知識不能判斷的參數,如年齡、性別、體重指數、收縮壓、舒張壓等,并實現僅僅基于彩色眼底像對患者這些參數進行估判[12-13]。
Kemany等[14]在黃斑區OCT圖像庫中,將眼科醫師的疾病診斷信息作為輸入信息訓練卷積神經網絡,實現了對正常、玻璃膜疣、糖尿病黃斑水腫、CNV 4種診斷類別的自動化判斷,多次驗證測試其算法結果的靈敏度及特異性均超過90%。
Burlina等[15-16]基于1992年至2005年年齡相關性眼病研究(AREDS)積累的大量影像學資料,應用深度卷積神經網絡實現了對老年性黃斑變性患者彩色眼底像的AREDS 9級精確評分及5年風險預后預測。
3 人工智能在PM眼底影像資料解析中的應用
PM的眼底改變作為繼發于屈光疾病的眼底病變,其疾病的發生發展具有獨特的時間和空間的延續性,五維甚至更高維的精確數據隨訪能夠讓眼科醫生更好的理解PM的發生機制和演進特征。對于復雜高維數據進行直接解讀并非眼科醫生的擅長領域,人工智能為眼科醫生提供強有力的助力。
3.1 PM影像資料的標準化采集輔助
PM的影像資料采集由于患者眼部屈光狀態的特殊性,無論是眼底彩色照相、眼底血管造影等二維圖像的采集,或者是OCT等三維圖像的采集,均需要依據患者的屈光狀態進行較多的拍攝調整。類似于人工智能的另外一個熱點應用領域——自動駕駛,人工智能輔助拍攝技術可以根據PM患者特殊的屈光和間質信息以及臨床醫生的觀察側重,在影像采集伊始進行相關參數和模式的配置,以獲得優化的影像學資料。
人工智能輔助影像拍攝技術的優勢在于可以根據患者的個體化屈光和解剖特征進行自動化、個性化參數調整,可以排除技師手動設置的差異性,可以根據醫生的需求進行目標區域的準確掃描,同時還可以增加掃描過程的穩定性和掃描效率。相關技術已經在放射科CT、MRI等影像資料的采集中獲得了臨床應用,其在圖像采集的效率、準確性、穩定性、降噪等方面較技師手工調整顯著提升,并為進一步定量分析和重建等后處理工作奠定基礎[17]。眼底病該領域技術在初步應用及進一步的研發中。
3.2 PM影像中生理結構的自動化分割及定量分析
PM的病理改變廣泛累及視網膜、脈絡膜和鞏膜的多個層次。PM患眼鞏膜厚度與眼軸長度呈負相關,且后鞏膜葡萄腫高度與鞏膜厚度呈負相關。同時,在PM患者中,區域脈絡膜總面積、脈絡膜血管管腔區域、脈絡膜基質區域等脈絡膜層的形態參數及脈絡膜血管形態參數與PM患者眼軸延長、疾病演進同樣具有顯著相關性[18-22]。
在近年PM影像學多因素分析研究中,更多的精確形態學結構被研究者所關注。視盤周圍萎縮灶尤其是細化分區中γ區病灶,是高度近視眼軸增長并最終演進為PM的相關性分析系數最高的形態學指標。黃斑區域視網膜毛細血管密度的區域性異常也被發現與PM的發展顯著相關[23-25]。
這些定量數據的獲取在傳統方法學中,眼科醫生需要通過手工點對點測量或者圖像輔助分析軟件的幫助下手工測量,工作量較大,存在操作偏移,且只能對一定目標區域進行測量。而對于PM眼底影像資料中這些生理結構的自動化分割和定量分析正是人工智能技術中基于不同算法的圖像識別技術的擅長領域。
Antony等[26]運用基于成本函數的圖論方法框架對頻域OCT圖像中視網膜層次分別進行5層、7層和10層的自動化分層分割,其與金標準相比較的誤差分別僅為(3.35±0.62)、(6.45±1.87)、(9.75±3.18)μm。Liu等[27]通過應用深度學習改良神經網絡算法RefineNet模型,實現對廣度掃描OCT圖像中脈絡膜血管結構非劣效于專科醫師手工標記的自動化識別、分割和定量分析(圖1)。
 圖1
通過RefineNet神經網絡模型實現對脈絡膜血管分割的示例圖。1A示例圖原圖;1B示通過RefineNet算法分割標記脈絡膜血管;1C示眼科醫師一標記脈絡膜血管;1D示眼科醫師二標記脈絡膜血管
圖1
通過RefineNet神經網絡模型實現對脈絡膜血管分割的示例圖。1A示例圖原圖;1B示通過RefineNet算法分割標記脈絡膜血管;1C示眼科醫師一標記脈絡膜血管;1D示眼科醫師二標記脈絡膜血管
3.3 PM影像中典型病灶的自動化檢測和分析
脈絡膜視網膜萎縮、CNV、漆裂紋等PM典型眼底均可基于其形態學特征,通過人工智能圖像識別算法實現自動化檢測并進行進一步準確分析。
Cheng等[28]聯合應用Hough轉換及邊緣濾波器等實現對視盤周圍萎縮病灶的自動化檢測、區域分割和面積讀取。Xu等[29]通過雙階段卷積神經網絡算法實現對OCT圖像中CNV病灶的自動化分割及定量分析,并進一步應用條件生成對抗網絡實現對PM的ICGA圖像中漆裂紋病灶的自動化分割提取和定量分析(圖2)。
 圖2
通過神經網絡模型實現對CNV病灶分割的算法流程圖
圖2
通過神經網絡模型實現對CNV病灶分割的算法流程圖
3.4 PM的臨床診療決策輔助
在對于PM患者影像資料中目標特征進行自動化解析的同時,通過基于整合患者人口學信息、屈光信息、診療及預后信息的大數據平臺,應用機器學習算法可以進一步實現對于患者目前疾病診斷及分級程度的自動化判斷,對于目前病情治療策略的推薦建議,以及對于患者病情預后的預測判斷。人工智能為臨床醫生的臨床診療提供實時輔助,為個性化、精準化醫療的實現助力,并在臨床數據積累的同時不斷優化[30-31]。
4 小結及展望
在人工智能算法的開發、驗證和改進過程中,均高度依賴于大量訓練數據。如何獲得、積累、存儲、使用以及共享準確、標準化的海量PM患者影像資料和臨床數據,需要臨床醫生、計算機科學家以及不同機構單位之間的協力合作[32]。同時,人工智能相關技術目前大多尚處于臨床研究前期階段,如何規范化地將數字實驗室的研究成果通過臨床試驗驗證轉化到臨床實踐,需要眼科臨床工作者和相關研究人員的集成智慧。
隨著機器學習領域前沿算法的優化、計算機硬件運算能力的增強、眼底影像設備拍攝范圍及圖像精準度的提高、PM臨床資料和數據的不斷積累,人工智能在PM臨床診療及臨床研究的價值將愈加凸顯。