引用本文: 李夢洋, 錢彤, 黎曉新, 孫國盛, 胡潔, 王宗沂, 趙明威, 曲進鋒. 急性黃斑旁中心中層視網膜病變患眼臨床特征及多模式影像特征觀察. 中華眼底病雜志, 2019, 35(4): 322-326. doi: 10.3760/cma.j.issn.1005-1015.2019.04.002 復制
急性黃斑旁中心中層視網膜病變(PAMM)由Sarraf等[1]于2013年首次報道,并將其歸為急性黃斑區神經視網膜病變(AMN)的一個亞型。其后因兩者OCT表現不同且累及的人群亦有差異,PAMM被認為是血管性疾病在眼部的一種臨床表現[2]。本病多單眼發病,表現為不同程度急性視力下降,合并或不合并眼前暗影;眼底病變隱匿,彩色眼底像及FFA缺乏特異性改變,僅紅外眼底像表現為病灶對應區域的弱反射。急性期頻域OCT表現為黃斑區視網膜內核層(INL)帶狀強反射。其發病機制不明,多數研究者認為與視網膜深層毛細血管叢(DCP)低灌注或缺血相關[3-4]。隨著橫斷面(en-face)結構OCT及OCT血管成像(OCTA)在臨床的廣泛應用,使得對PAMM有了更深入的認識。盡管國內外均有關于該病的相關報道[5-6],但目前基于多模式影像觀察的研究尚少。我們回顧分析了一組PAMM患者的臨床表現和多模式影像特征,以期為PAMM的臨床診療提供更多依據。現將結果報道如下。
1 對象和方法
回顧性臨床觀察性研究。2014年1月至2018年8月在北京大學人民醫院檢查確診的急性PAMM患者12例12只眼納入本研究。其中,男性9例,女性3例;左、右眼分別為7、5只眼。均為單眼發病。年齡29~83歲,平均年齡57歲。出現癥狀至就診時間1~45 d,平均時間11.3 d。均主訴視力下降,其中伴中心暗影5例。高血壓8例(66.7%),糖尿病4例(33.3%),高脂血癥2例(16.7%),重度阻塞性睡眠呼吸暫停綜合征(OSAHS)1例(8.3%),頸動脈硬化1例(8.3%)。急性PAMM診斷標準:結構OCT B-scan像可見黃斑旁中心視網膜INL帶狀強反射[1]。納入標準:(1)3個月內出現急性視力下降,伴或不伴眼前暗影;(2)OCT表現為典型黃斑區視網膜INL帶狀強反射[1, 3]。排除標準:(1)嚴重屈光間質混濁影響眼底觀察;(2)重復測量后仍然無法得到符合分析要求的OCT圖像。
所有患者均行BCVA、眼壓、裂隙燈顯微鏡、間接檢眼鏡、眼底彩色照相、OCT、FFA檢查。行OCTA檢查10只眼;行視野檢查5只眼,均為伴眼前暗影者;行近紅外和多光譜眼底照相1只眼。采用美國Optovue公司Avanti RTVue-XR OCT、德國Carl Zeiss公司Cirrus 5000 HD-OCT儀對患眼及對側眼行OCT、OCTA檢查,同一臺設備由同一名檢查者獲取圖像,典型圖像存盤進行分析。采用Avanti RTVue-XR OCT設備檢查時,以中心凹為中心對患眼行常規Cross line和Raster斷層掃描;采用Zeiss Cirrus OCT檢查時,以中心凹為中心獲取HD 21 lines和Radial掃描。OCTA檢查,掃描范圍3 mm × 3 mm,獲得視網膜層的血流信號,選取成像清晰的圖像儲存于計算機。系統自動處理圖像后提供視網膜淺層毛細血管叢(SCP)、DCP、外層視網膜毛細血管叢的en-face像和B-scan像,同時觀察黃斑區毛細血管拱環形態和黃斑中心凹無血管區(FAZ)面積變化。其中,SCP定義為視網膜內界膜(ILM)至內叢狀層(IPL)之間的毛細血管,DCP定義為INL至外叢狀層(OPL)之間的毛細血管[7]。
患者確診后按原發疾病治療原則進行干預。回顧分析患者臨床資料和OCT、OCTA影像特征。
2 結果
12只眼中,BCVA 0.05~0.1者 5只眼,0.3~0.5者4只眼,0.6~1.0者3只眼。眼前節檢查未見異常。視網膜中央動脈阻塞(CRAO)1只眼,視網膜分支動脈阻塞(BRAO)7只眼。BRAO 7只眼中,BRAO合并視網膜中央靜脈阻塞(CRVO)、非動脈炎性前部缺血性視神經病變、糖尿病視網膜病變(DR)各1只眼,陳舊性BRAO 3只眼,單純BRAO 1只眼;單純CRVO 4只眼,其中非缺血型CRVO 3只眼。
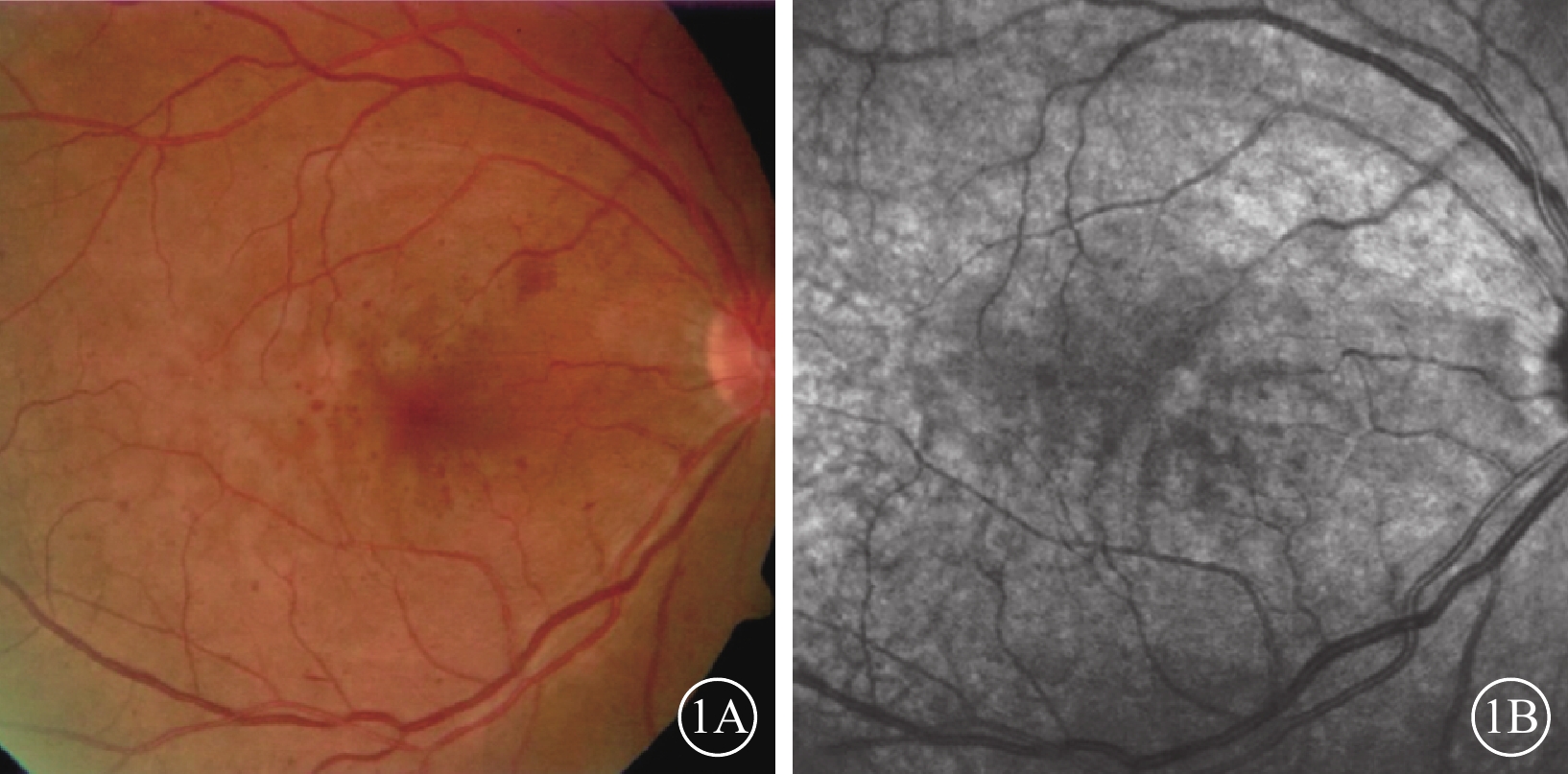
眼底彩色照相可見散在小的點片狀出血,靜脈輕度擴張,未見視網膜灰白水腫及出血(圖1A)。行紅外照相的1只眼,可見后極部沿小靜脈分布的弱反射病灶,邊界欠清晰(圖1B)。
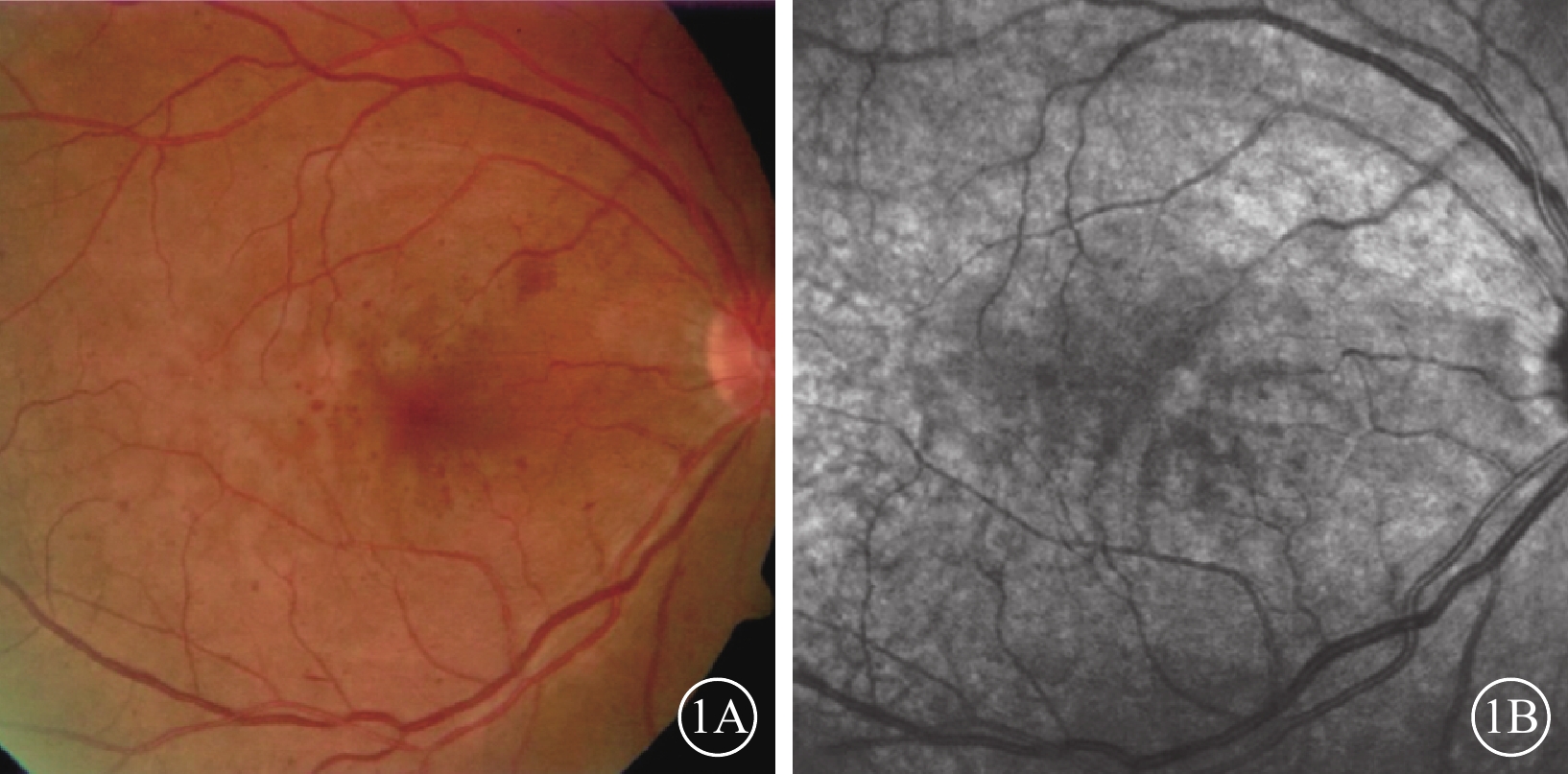 圖1
PAMM患眼彩色、紅外眼底像。1A示彩色眼底像,散在小的點片狀出血,靜脈輕度擴張;1B示1A同眼紅外眼底像,后極部沿小靜脈分布的弱反射病灶,邊界欠清晰
圖1
PAMM患眼彩色、紅外眼底像。1A示彩色眼底像,散在小的點片狀出血,靜脈輕度擴張;1B示1A同眼紅外眼底像,后極部沿小靜脈分布的弱反射病灶,邊界欠清晰
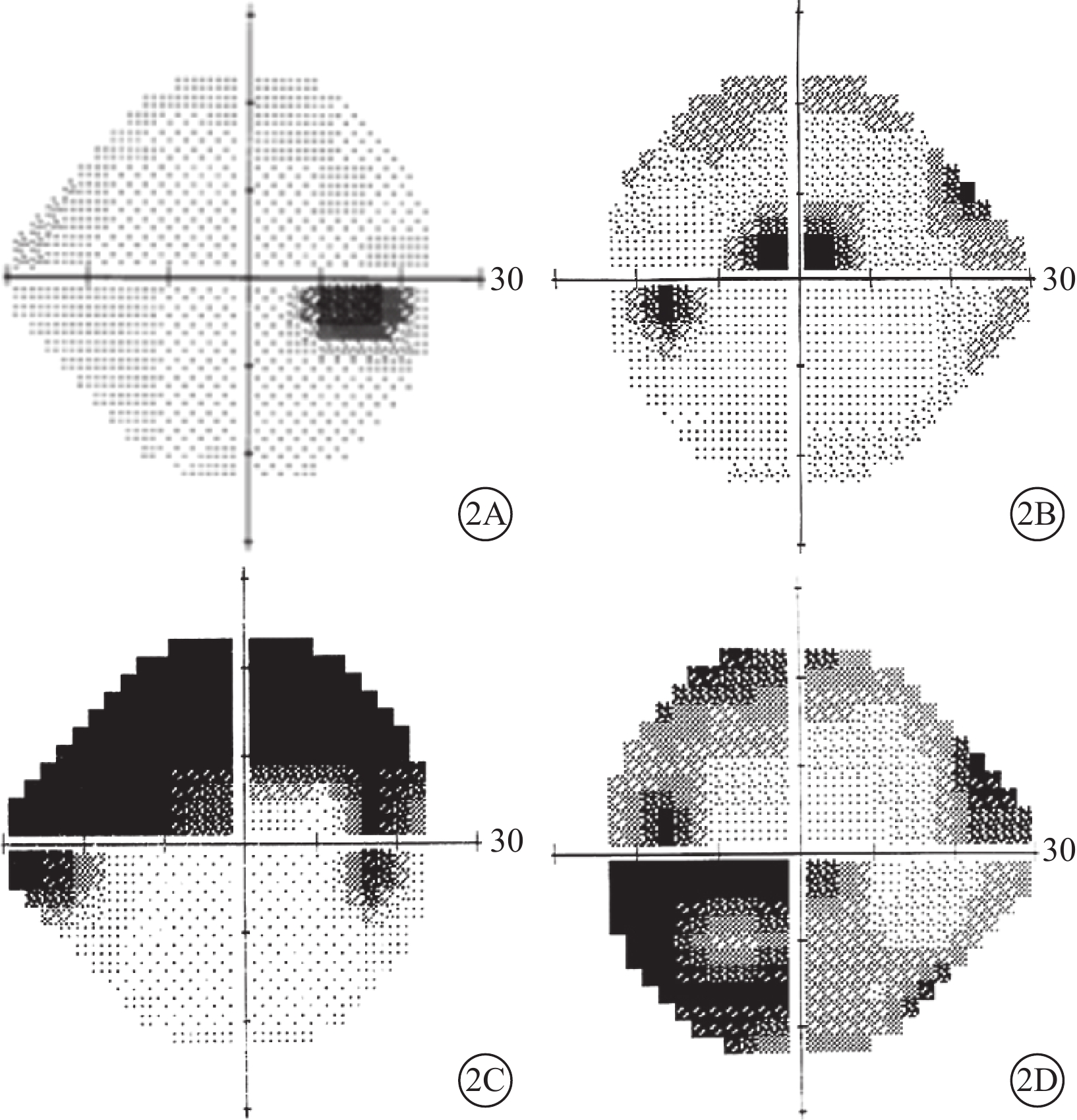
行視野檢查的5只眼中,合并CRVO的1只眼,表現為整體視敏度輕度下降和生理盲點擴大(圖2A);合并BRAO的 4只眼,表現為視網膜動脈阻塞(RAO)區域對應的視野缺損(圖2B~2D)。
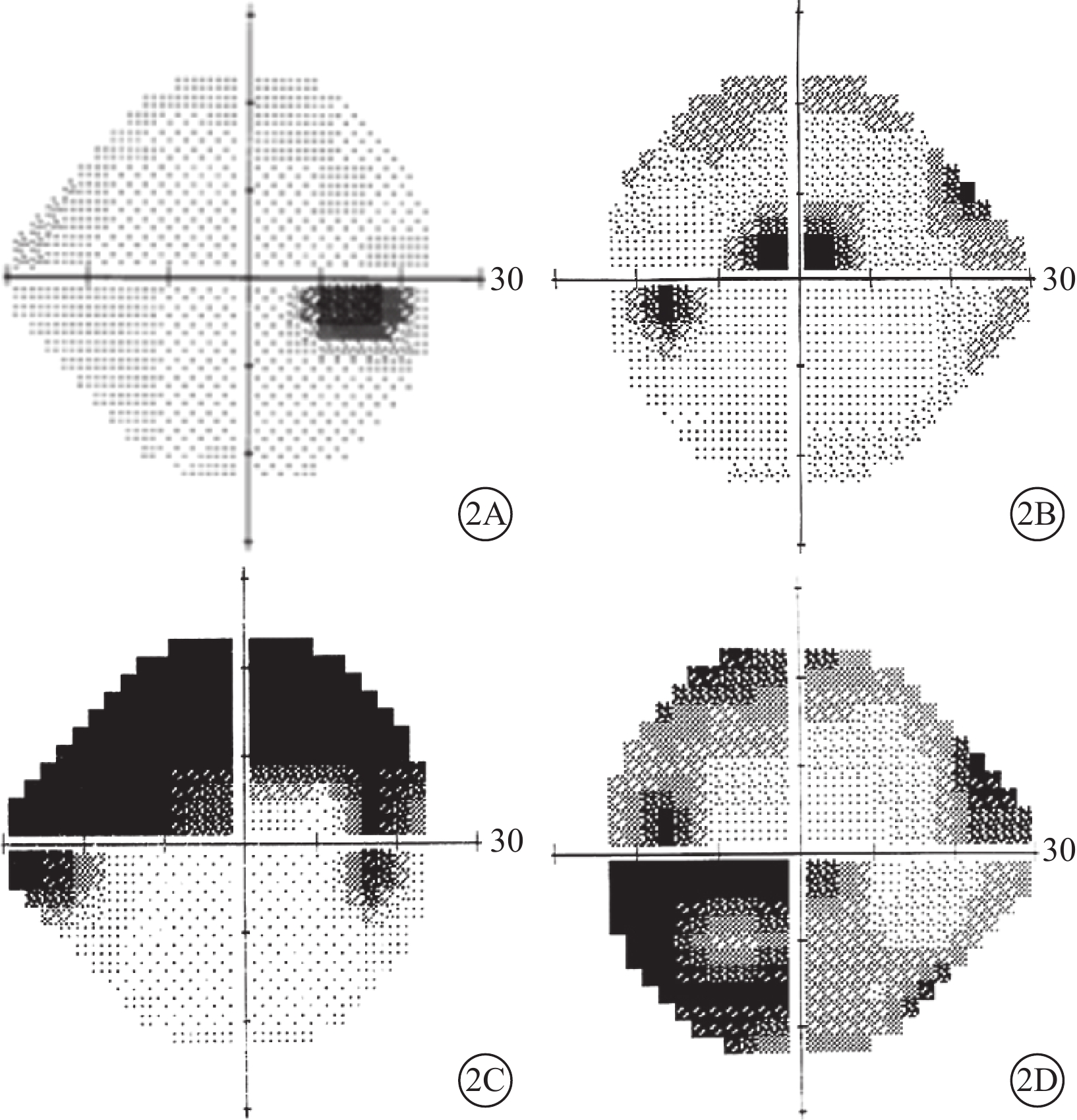 圖2
PAMM患眼視野檢查像。2A示生理盲點擴大,伴彌漫的視敏度輕微下降;2B~2D分別示上半側視野暗點、與BRAO分布一致的弓形暗點和鼻下方暗點
圖2
PAMM患眼視野檢查像。2A示生理盲點擴大,伴彌漫的視敏度輕微下降;2B~2D分別示上半側視野暗點、與BRAO分布一致的弓形暗點和鼻下方暗點
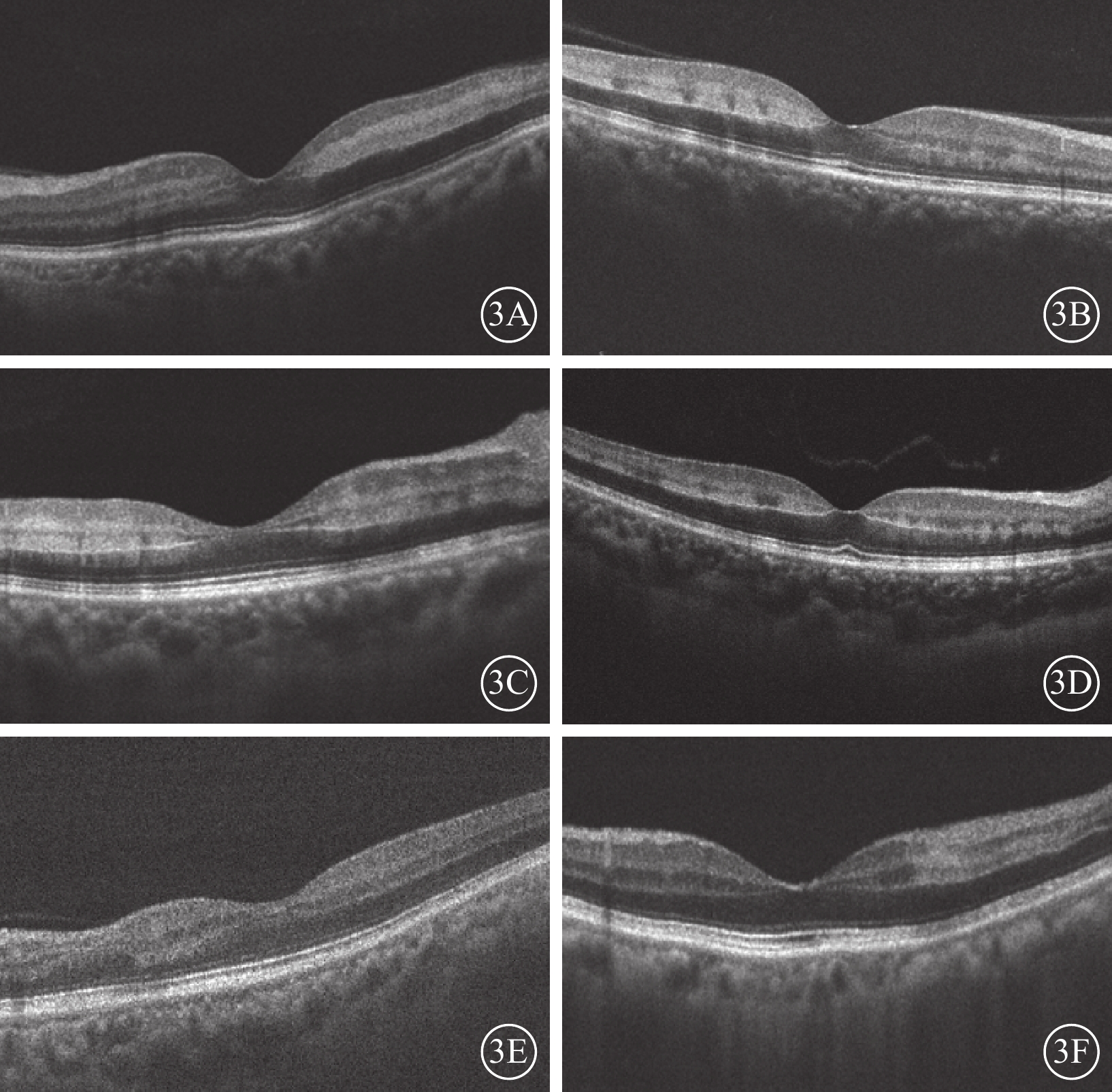
結構OCT檢查發現,所有患眼B-scan像可見黃斑旁中心視網膜INL局限性帶狀強反射,范圍不等。12只患眼中,5只眼中強反射條帶在INL與IPL交界處以及INL與OPL交界處反射更為增強,而在INL處相對較弱,呈“雙軌征”樣外觀(圖3A)。3只眼中強反射呈較為均一形態,在INL與IPL交界處以及INL與OPL交界處無明顯強化(圖3B)。2只眼INL強反射向上延伸累及節細胞層(圖3C),3只眼向下延伸累及Helen纖維層(圖3D)。合并陳舊性BRAO 3只眼,可見局限的節細胞層及神經纖維層變薄(圖3E),合并BRAO及CRAO的5只眼可見與動脈阻塞對應部位的視網膜外核層反射不同程度降低(圖3F)。合并CRVO的5只眼均表現為多個并排排列的INL強反射條帶(圖3D)。所有患眼均未出現外界膜或橢圓體帶損傷。
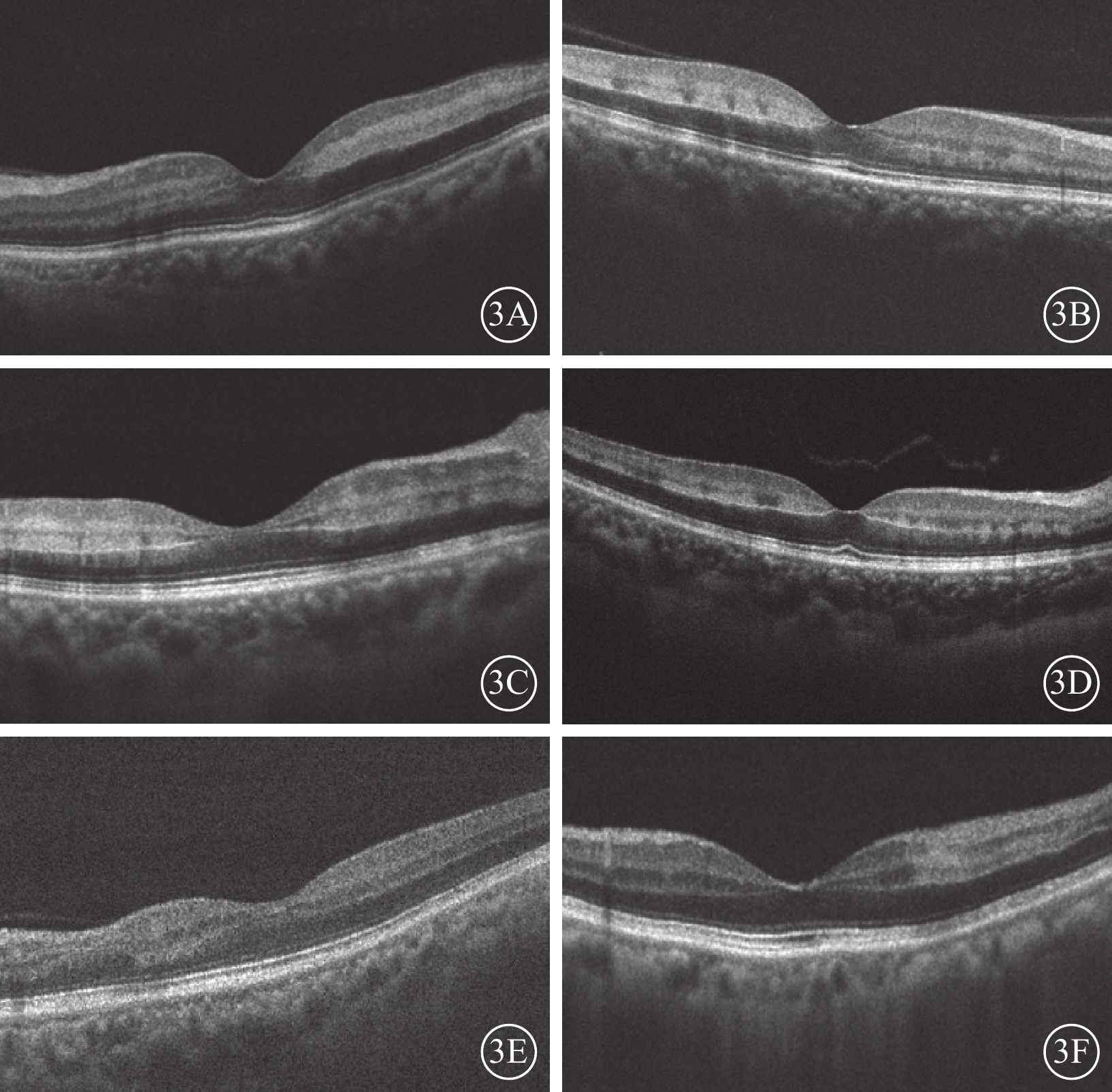 圖3
PAMM患眼OCT B-scan像。3A示中強反射條帶在INL與IPL交界處以及INL與OPL交界處反射相對增強,呈“雙軌征“樣外觀;3B示強反射較為均一;3C示強反射向上累及節細胞層;3D示強反射向下累及Helen纖維層,以及條帶成多個并排排列;3E示局限節細胞層及神經纖維層變薄;3F示外核層反射降低
圖3
PAMM患眼OCT B-scan像。3A示中強反射條帶在INL與IPL交界處以及INL與OPL交界處反射相對增強,呈“雙軌征“樣外觀;3B示強反射較為均一;3C示強反射向上累及節細胞層;3D示強反射向下累及Helen纖維層,以及條帶成多個并排排列;3E示局限節細胞層及神經纖維層變薄;3F示外核層反射降低
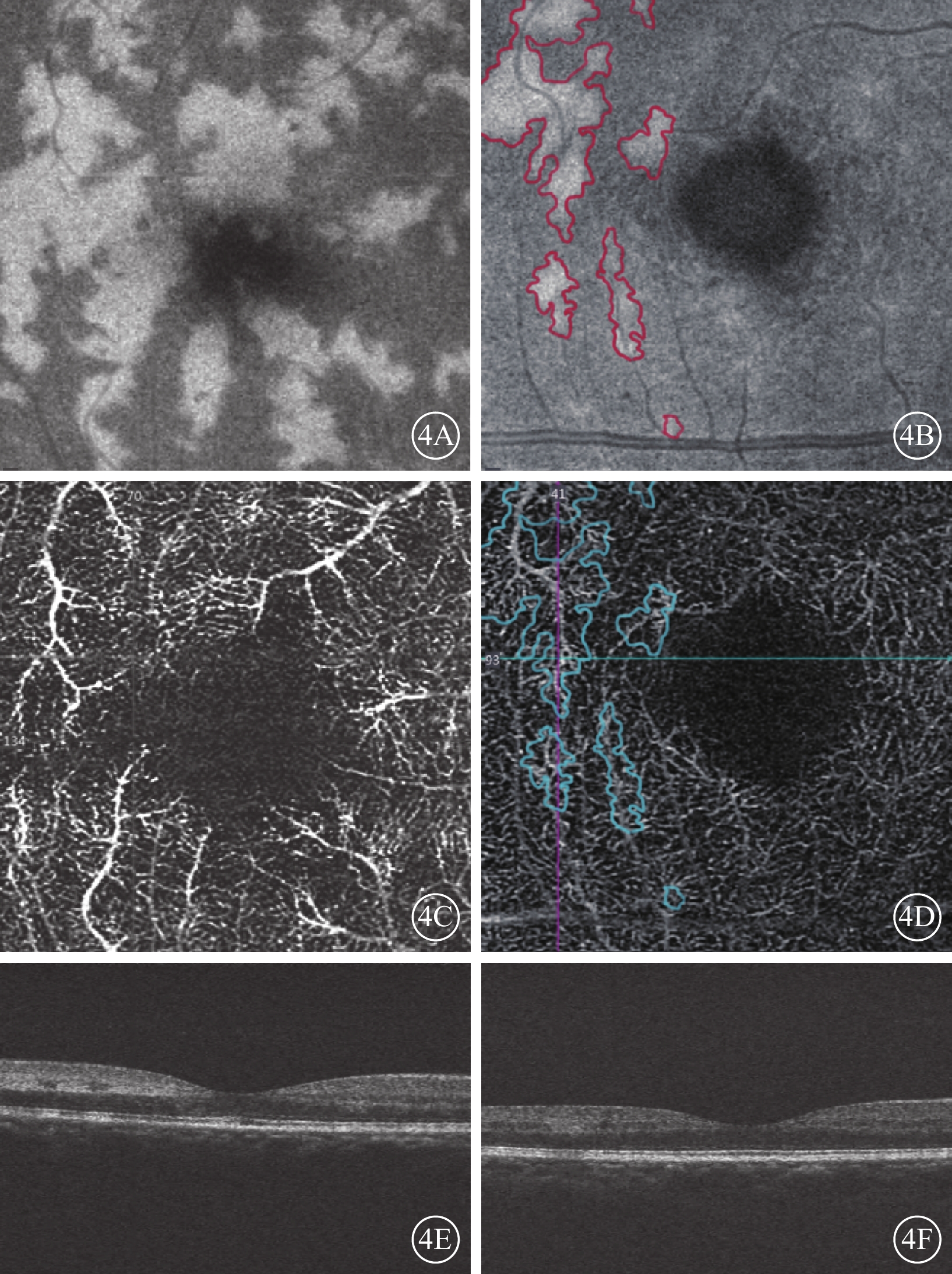
OCTA檢查發現,可見DCP大小不等的斑片狀強反射病灶(圖4A~4C)。其中,合并CRVO的2只眼,強反射區沿視網膜小靜脈走形分布,呈現典型“蕨類植物”樣外觀(圖4A)。與對側眼比較,所有患眼均可見DCP局部血流密度下降、拱環形態異常和FAZ面積擴大(圖4D)。對應B-scan像可見INL長節段強反射病灶(圖4E,4F)。部分患眼由于病灶處組織反射增強,上方SCP投射偽影在病灶處也有所增強(圖4D)。
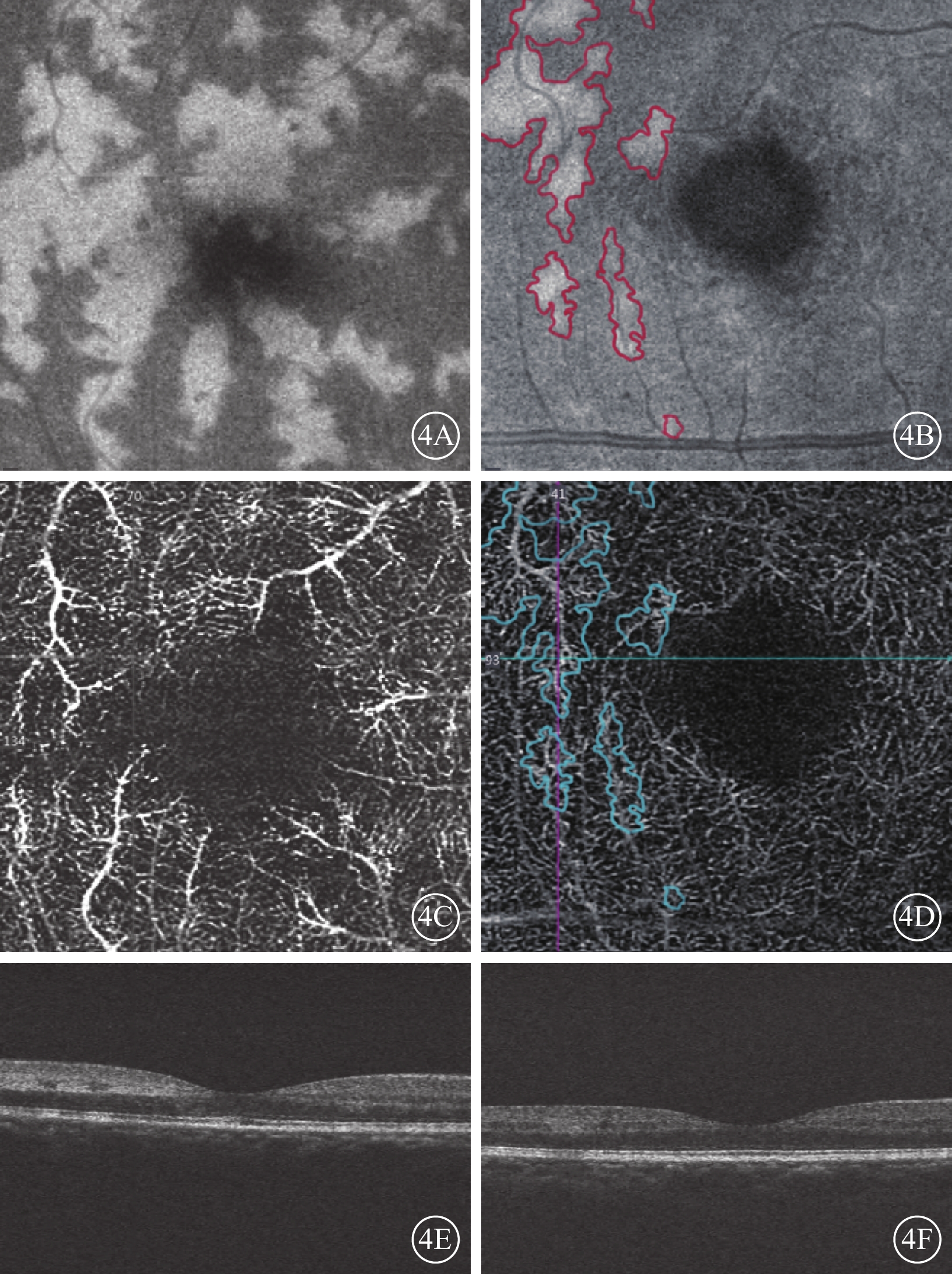 圖4
PAMM患眼OCTA像。4A、4B示en-face像,黃斑旁中心多發大小不等斑片狀強反射病灶。4A示病灶沿視網膜小靜脈走形分布,呈蕨類植物樣外觀;4B示較小病灶。4C、4D示OCTA像,DCP血流密度降低;4E、4F分別示4C、4D對應B-scan像,可見INL長節段強反射病灶
圖4
PAMM患眼OCTA像。4A、4B示en-face像,黃斑旁中心多發大小不等斑片狀強反射病灶。4A示病灶沿視網膜小靜脈走形分布,呈蕨類植物樣外觀;4B示較小病灶。4C、4D示OCTA像,DCP血流密度降低;4E、4F分別示4C、4D對應B-scan像,可見INL長節段強反射病灶
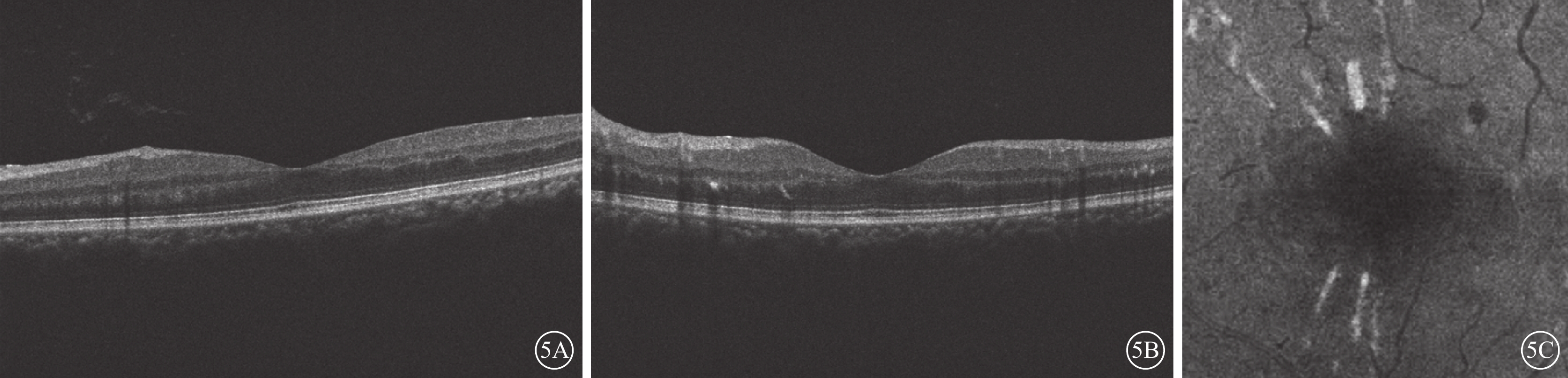
合并非缺血性CRVO的1只眼,治療后隨訪9個月時,OCT檢查可見INL強反射條帶消失,INL萎縮變薄;en-face OCT像可見強反射病灶消退(圖5)。
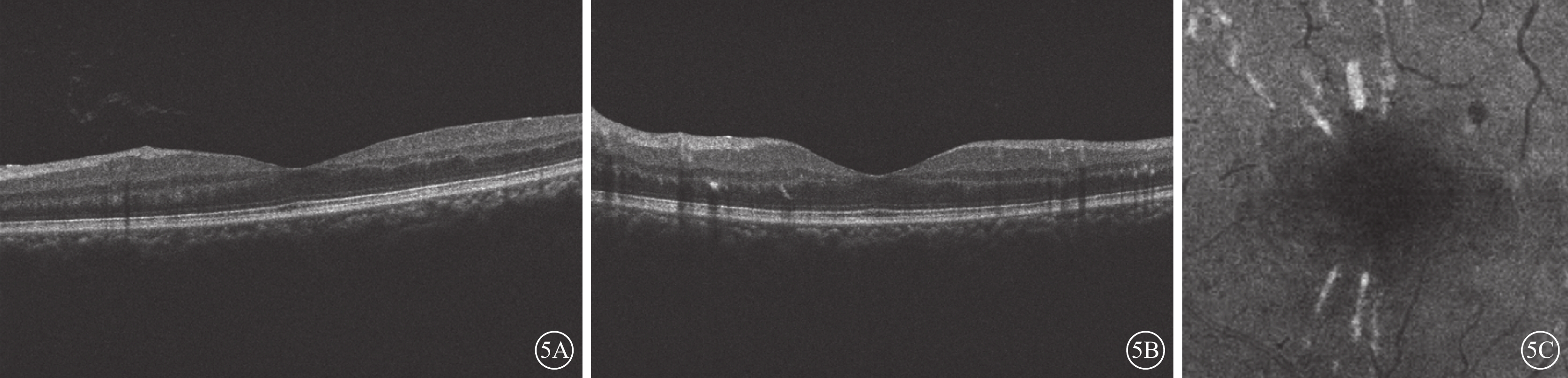 圖5
PAMM患眼OCT像。5A、5B示B-scan像,強反射條帶消失,INL萎縮變薄;5C示en-face像,病灶消退
圖5
PAMM患眼OCT像。5A、5B示B-scan像,強反射條帶消失,INL萎縮變薄;5C示en-face像,病灶消退
3 討論
PAMM并不是一種獨立的疾病而是一種征象,可見于多種視網膜血管疾病如RAO、視網膜靜脈阻塞(RVO)、眼缺血綜合征、DR、高血壓視網膜病變、Purtscher視網膜病變等[2, 6];也有上呼吸道感染、偏頭痛、大量飲用咖啡因、流感疫苗注射后發生PAMM的個案報道[8]。另有研究發現,白內障手術后部分視力不佳的患者存在PAMM[9];而增生型DR患者玻璃體切割手術后2周發生PAMM的幾率可達3.6%,其原因可能與麻醉、手術操作和手術中眼內壓波動對動脈血流的影響和組織缺氧有關[10]。本組所有患眼PAMM均繼發于RAO或RVO,其中1例合并重度OSAHS。目前尚無OSAHS患者中觀察到原發PAMM的發生,兩者之間的關系需進一步研究。
PAMM的發病機制尚不完全明確,隨著對視網膜毛細血管層認識的不斷深入[11],多數學者推測PAMM與視網膜中層及DCP的級聯缺血效應有關[12]。解剖學上,黃斑區視網膜有淺層、中層、深層毛細血管。淺層位于神經纖維層,中層位于INL與IPL的交界面,深層位于INL與OPL及Helen纖維層的交界面。但目前多數OCTA設備尚無法區分中層及深層視網膜毛細血管,因此將其合并為DCP。INL供氧主要來源于視網膜中層及深層毛細血管,少部分來源于外層視網膜組織內氧擴散,由于黃斑旁視網膜組織最厚,來源于外層的氧擴散較為困難,因此極易受到視網膜毛細血管缺血造成的影響,容易發生缺血缺氧導致的細胞內水腫,從而在OCT上呈現出急性期特征性的INL處的強反射條帶,但不累及橢圓體帶和嵌合體帶,慢性期PAMM的特征為發生對應部位INL變薄萎縮[1, 8]。此點與AMN不同,AMN急性期OCT表現為視網膜外核層的強反射斑塊病灶,累及橢圓體帶和嵌合體帶,慢性期發生外核層變薄萎縮,橢圓體帶及嵌合體帶的損傷可能持續存在[13-14],借助OCT可以很好地將兩者區分。因此,目前大部分學者不再將PAMM稱為AMN的1型,而更傾向于將其認為是獨立于AMN的一種征象。但這兩者有類似的誘發因素和臨床癥狀,是同一大類疾病還是不同的獨立疾病,目前尚有爭議。
PAMM在en-face OCT像上表現出的清晰的強反射病灶成為其另一特征性影像表現。小片病灶通常表現為獨立的、清晰的強反射,而合并CRVO的病灶則表現為沿黃斑周圍小靜脈分布,呈黑白相間的“蕨類植物”樣外觀[15]。本組合并CRVO的2只眼,其病灶在en-face OCT像上即可見典型的“蕨類植物”樣改變。En-face OCT像比B-scan能更直觀地顯示出病灶在黃斑旁的分布,具有重要的診斷價值。
盡管FFA是視網膜缺血性疾病診斷的金標準,但因其只能清晰顯示視網膜大血管以及部分淺層毛細血管細節,因此PAMM患眼難以發現黃斑旁視網膜深層毛細血管的缺血[16]。而OCTA在分層顯示視網膜血管方面具有獨特優勢。本研究所使用的德國Zeiss公司加載有AngioPlex血流成像功能的Cirrus 5000 HD-OCT對SCP的定義是ILM到IPL,顯示的是視網膜淺層毛細血管,DCP指INL到OPL[7],實際顯示的是視網膜中層及深層毛細血管。有研究利用AngioVue對DCP進行定量分析顯示,PAMM患眼的DCP血流密度較對側健康眼下降19%[3],但部分未使用投影移除技術的PAMM的OCTA研究中,DCP血流密度降低可能會因為此處組織強反射造成的淺層血管投攝偽影而被掩蓋,導致分析困難[8, 15]。Chu等[14]利用最新OCTA投影移除算法處理圖像后,發現PAMM患眼的視網膜中層毛細血管和DCP血流密度均出現下降,少數患眼SCP血流密度也出現下降。隨著OCTA分層和偽影消除技術的進展以及OCTA分辨率的進一步提升,對PAMM發病機制研究也將取得進一步進展。
Sarraf等[1]發現PAMM病灶在近紅外眼底像上呈現為“苜蓿葉”或“花瓣”樣邊界清晰的暗區。PAMM在彩色眼底像上往往缺乏明確且易于辨別的改變,需借助其他影像檢查以明確病灶。本組患眼中合并CRVO的1只眼行紅外眼底照相,表現為沿小靜脈分布的邊界較為清楚的暗區。其原因是由于紅外眼底像的反射主要來源于RPE,反射被視網膜中層的強反射病灶遮擋,從而在相應區域出現暗區。
PAMM傳統彩色眼底像難以發現特征性改變,常常容易被同時合并的RAO或RVO的改變所掩蓋,仔細觀察時可能會發現后極部黃斑旁視網膜呈淺灰色改變。FFA雖然也缺乏特征性改變,但可以發現是否合并視網膜血管灌注延遲、周邊缺血性改變、眼底表現不夠明顯的輕至中度非增生型DR或視盤改變等。
本研究存在一定局限性。由于初診醫生對于疾病的特征表現不熟悉,僅有1例患者行紅外眼底照相,2例患者未接受OCTA檢查。由于本研究使用的OCTA設備尚不具備3D去偽影功能,因此DCP的血流密度容易受到上方SCP的偽影干擾,因此未進行定量分析。本研究局限于PAMM的形態學分析,由于缺乏多焦ERG等電生理檢查,對其引起的功能性改變研究不足。另外,由于多數患者隨訪困難,沒能搜集到足夠的縱向觀察資料,沒有進行更多此方面分析及討論。最后,本研究納入的病例數有限,其臨床特點和發病規律還需要今后積累更多的資料進行深入分析。
急性黃斑旁中心中層視網膜病變(PAMM)由Sarraf等[1]于2013年首次報道,并將其歸為急性黃斑區神經視網膜病變(AMN)的一個亞型。其后因兩者OCT表現不同且累及的人群亦有差異,PAMM被認為是血管性疾病在眼部的一種臨床表現[2]。本病多單眼發病,表現為不同程度急性視力下降,合并或不合并眼前暗影;眼底病變隱匿,彩色眼底像及FFA缺乏特異性改變,僅紅外眼底像表現為病灶對應區域的弱反射。急性期頻域OCT表現為黃斑區視網膜內核層(INL)帶狀強反射。其發病機制不明,多數研究者認為與視網膜深層毛細血管叢(DCP)低灌注或缺血相關[3-4]。隨著橫斷面(en-face)結構OCT及OCT血管成像(OCTA)在臨床的廣泛應用,使得對PAMM有了更深入的認識。盡管國內外均有關于該病的相關報道[5-6],但目前基于多模式影像觀察的研究尚少。我們回顧分析了一組PAMM患者的臨床表現和多模式影像特征,以期為PAMM的臨床診療提供更多依據。現將結果報道如下。
1 對象和方法
回顧性臨床觀察性研究。2014年1月至2018年8月在北京大學人民醫院檢查確診的急性PAMM患者12例12只眼納入本研究。其中,男性9例,女性3例;左、右眼分別為7、5只眼。均為單眼發病。年齡29~83歲,平均年齡57歲。出現癥狀至就診時間1~45 d,平均時間11.3 d。均主訴視力下降,其中伴中心暗影5例。高血壓8例(66.7%),糖尿病4例(33.3%),高脂血癥2例(16.7%),重度阻塞性睡眠呼吸暫停綜合征(OSAHS)1例(8.3%),頸動脈硬化1例(8.3%)。急性PAMM診斷標準:結構OCT B-scan像可見黃斑旁中心視網膜INL帶狀強反射[1]。納入標準:(1)3個月內出現急性視力下降,伴或不伴眼前暗影;(2)OCT表現為典型黃斑區視網膜INL帶狀強反射[1, 3]。排除標準:(1)嚴重屈光間質混濁影響眼底觀察;(2)重復測量后仍然無法得到符合分析要求的OCT圖像。
所有患者均行BCVA、眼壓、裂隙燈顯微鏡、間接檢眼鏡、眼底彩色照相、OCT、FFA檢查。行OCTA檢查10只眼;行視野檢查5只眼,均為伴眼前暗影者;行近紅外和多光譜眼底照相1只眼。采用美國Optovue公司Avanti RTVue-XR OCT、德國Carl Zeiss公司Cirrus 5000 HD-OCT儀對患眼及對側眼行OCT、OCTA檢查,同一臺設備由同一名檢查者獲取圖像,典型圖像存盤進行分析。采用Avanti RTVue-XR OCT設備檢查時,以中心凹為中心對患眼行常規Cross line和Raster斷層掃描;采用Zeiss Cirrus OCT檢查時,以中心凹為中心獲取HD 21 lines和Radial掃描。OCTA檢查,掃描范圍3 mm × 3 mm,獲得視網膜層的血流信號,選取成像清晰的圖像儲存于計算機。系統自動處理圖像后提供視網膜淺層毛細血管叢(SCP)、DCP、外層視網膜毛細血管叢的en-face像和B-scan像,同時觀察黃斑區毛細血管拱環形態和黃斑中心凹無血管區(FAZ)面積變化。其中,SCP定義為視網膜內界膜(ILM)至內叢狀層(IPL)之間的毛細血管,DCP定義為INL至外叢狀層(OPL)之間的毛細血管[7]。
患者確診后按原發疾病治療原則進行干預。回顧分析患者臨床資料和OCT、OCTA影像特征。
2 結果
12只眼中,BCVA 0.05~0.1者 5只眼,0.3~0.5者4只眼,0.6~1.0者3只眼。眼前節檢查未見異常。視網膜中央動脈阻塞(CRAO)1只眼,視網膜分支動脈阻塞(BRAO)7只眼。BRAO 7只眼中,BRAO合并視網膜中央靜脈阻塞(CRVO)、非動脈炎性前部缺血性視神經病變、糖尿病視網膜病變(DR)各1只眼,陳舊性BRAO 3只眼,單純BRAO 1只眼;單純CRVO 4只眼,其中非缺血型CRVO 3只眼。
眼底彩色照相可見散在小的點片狀出血,靜脈輕度擴張,未見視網膜灰白水腫及出血(圖1A)。行紅外照相的1只眼,可見后極部沿小靜脈分布的弱反射病灶,邊界欠清晰(圖1B)。
 圖1
PAMM患眼彩色、紅外眼底像。1A示彩色眼底像,散在小的點片狀出血,靜脈輕度擴張;1B示1A同眼紅外眼底像,后極部沿小靜脈分布的弱反射病灶,邊界欠清晰
圖1
PAMM患眼彩色、紅外眼底像。1A示彩色眼底像,散在小的點片狀出血,靜脈輕度擴張;1B示1A同眼紅外眼底像,后極部沿小靜脈分布的弱反射病灶,邊界欠清晰
行視野檢查的5只眼中,合并CRVO的1只眼,表現為整體視敏度輕度下降和生理盲點擴大(圖2A);合并BRAO的 4只眼,表現為視網膜動脈阻塞(RAO)區域對應的視野缺損(圖2B~2D)。
 圖2
PAMM患眼視野檢查像。2A示生理盲點擴大,伴彌漫的視敏度輕微下降;2B~2D分別示上半側視野暗點、與BRAO分布一致的弓形暗點和鼻下方暗點
圖2
PAMM患眼視野檢查像。2A示生理盲點擴大,伴彌漫的視敏度輕微下降;2B~2D分別示上半側視野暗點、與BRAO分布一致的弓形暗點和鼻下方暗點
結構OCT檢查發現,所有患眼B-scan像可見黃斑旁中心視網膜INL局限性帶狀強反射,范圍不等。12只患眼中,5只眼中強反射條帶在INL與IPL交界處以及INL與OPL交界處反射更為增強,而在INL處相對較弱,呈“雙軌征”樣外觀(圖3A)。3只眼中強反射呈較為均一形態,在INL與IPL交界處以及INL與OPL交界處無明顯強化(圖3B)。2只眼INL強反射向上延伸累及節細胞層(圖3C),3只眼向下延伸累及Helen纖維層(圖3D)。合并陳舊性BRAO 3只眼,可見局限的節細胞層及神經纖維層變薄(圖3E),合并BRAO及CRAO的5只眼可見與動脈阻塞對應部位的視網膜外核層反射不同程度降低(圖3F)。合并CRVO的5只眼均表現為多個并排排列的INL強反射條帶(圖3D)。所有患眼均未出現外界膜或橢圓體帶損傷。
 圖3
PAMM患眼OCT B-scan像。3A示中強反射條帶在INL與IPL交界處以及INL與OPL交界處反射相對增強,呈“雙軌征“樣外觀;3B示強反射較為均一;3C示強反射向上累及節細胞層;3D示強反射向下累及Helen纖維層,以及條帶成多個并排排列;3E示局限節細胞層及神經纖維層變薄;3F示外核層反射降低
圖3
PAMM患眼OCT B-scan像。3A示中強反射條帶在INL與IPL交界處以及INL與OPL交界處反射相對增強,呈“雙軌征“樣外觀;3B示強反射較為均一;3C示強反射向上累及節細胞層;3D示強反射向下累及Helen纖維層,以及條帶成多個并排排列;3E示局限節細胞層及神經纖維層變薄;3F示外核層反射降低
OCTA檢查發現,可見DCP大小不等的斑片狀強反射病灶(圖4A~4C)。其中,合并CRVO的2只眼,強反射區沿視網膜小靜脈走形分布,呈現典型“蕨類植物”樣外觀(圖4A)。與對側眼比較,所有患眼均可見DCP局部血流密度下降、拱環形態異常和FAZ面積擴大(圖4D)。對應B-scan像可見INL長節段強反射病灶(圖4E,4F)。部分患眼由于病灶處組織反射增強,上方SCP投射偽影在病灶處也有所增強(圖4D)。
 圖4
PAMM患眼OCTA像。4A、4B示en-face像,黃斑旁中心多發大小不等斑片狀強反射病灶。4A示病灶沿視網膜小靜脈走形分布,呈蕨類植物樣外觀;4B示較小病灶。4C、4D示OCTA像,DCP血流密度降低;4E、4F分別示4C、4D對應B-scan像,可見INL長節段強反射病灶
圖4
PAMM患眼OCTA像。4A、4B示en-face像,黃斑旁中心多發大小不等斑片狀強反射病灶。4A示病灶沿視網膜小靜脈走形分布,呈蕨類植物樣外觀;4B示較小病灶。4C、4D示OCTA像,DCP血流密度降低;4E、4F分別示4C、4D對應B-scan像,可見INL長節段強反射病灶
合并非缺血性CRVO的1只眼,治療后隨訪9個月時,OCT檢查可見INL強反射條帶消失,INL萎縮變薄;en-face OCT像可見強反射病灶消退(圖5)。
 圖5
PAMM患眼OCT像。5A、5B示B-scan像,強反射條帶消失,INL萎縮變薄;5C示en-face像,病灶消退
圖5
PAMM患眼OCT像。5A、5B示B-scan像,強反射條帶消失,INL萎縮變薄;5C示en-face像,病灶消退
3 討論
PAMM并不是一種獨立的疾病而是一種征象,可見于多種視網膜血管疾病如RAO、視網膜靜脈阻塞(RVO)、眼缺血綜合征、DR、高血壓視網膜病變、Purtscher視網膜病變等[2, 6];也有上呼吸道感染、偏頭痛、大量飲用咖啡因、流感疫苗注射后發生PAMM的個案報道[8]。另有研究發現,白內障手術后部分視力不佳的患者存在PAMM[9];而增生型DR患者玻璃體切割手術后2周發生PAMM的幾率可達3.6%,其原因可能與麻醉、手術操作和手術中眼內壓波動對動脈血流的影響和組織缺氧有關[10]。本組所有患眼PAMM均繼發于RAO或RVO,其中1例合并重度OSAHS。目前尚無OSAHS患者中觀察到原發PAMM的發生,兩者之間的關系需進一步研究。
PAMM的發病機制尚不完全明確,隨著對視網膜毛細血管層認識的不斷深入[11],多數學者推測PAMM與視網膜中層及DCP的級聯缺血效應有關[12]。解剖學上,黃斑區視網膜有淺層、中層、深層毛細血管。淺層位于神經纖維層,中層位于INL與IPL的交界面,深層位于INL與OPL及Helen纖維層的交界面。但目前多數OCTA設備尚無法區分中層及深層視網膜毛細血管,因此將其合并為DCP。INL供氧主要來源于視網膜中層及深層毛細血管,少部分來源于外層視網膜組織內氧擴散,由于黃斑旁視網膜組織最厚,來源于外層的氧擴散較為困難,因此極易受到視網膜毛細血管缺血造成的影響,容易發生缺血缺氧導致的細胞內水腫,從而在OCT上呈現出急性期特征性的INL處的強反射條帶,但不累及橢圓體帶和嵌合體帶,慢性期PAMM的特征為發生對應部位INL變薄萎縮[1, 8]。此點與AMN不同,AMN急性期OCT表現為視網膜外核層的強反射斑塊病灶,累及橢圓體帶和嵌合體帶,慢性期發生外核層變薄萎縮,橢圓體帶及嵌合體帶的損傷可能持續存在[13-14],借助OCT可以很好地將兩者區分。因此,目前大部分學者不再將PAMM稱為AMN的1型,而更傾向于將其認為是獨立于AMN的一種征象。但這兩者有類似的誘發因素和臨床癥狀,是同一大類疾病還是不同的獨立疾病,目前尚有爭議。
PAMM在en-face OCT像上表現出的清晰的強反射病灶成為其另一特征性影像表現。小片病灶通常表現為獨立的、清晰的強反射,而合并CRVO的病灶則表現為沿黃斑周圍小靜脈分布,呈黑白相間的“蕨類植物”樣外觀[15]。本組合并CRVO的2只眼,其病灶在en-face OCT像上即可見典型的“蕨類植物”樣改變。En-face OCT像比B-scan能更直觀地顯示出病灶在黃斑旁的分布,具有重要的診斷價值。
盡管FFA是視網膜缺血性疾病診斷的金標準,但因其只能清晰顯示視網膜大血管以及部分淺層毛細血管細節,因此PAMM患眼難以發現黃斑旁視網膜深層毛細血管的缺血[16]。而OCTA在分層顯示視網膜血管方面具有獨特優勢。本研究所使用的德國Zeiss公司加載有AngioPlex血流成像功能的Cirrus 5000 HD-OCT對SCP的定義是ILM到IPL,顯示的是視網膜淺層毛細血管,DCP指INL到OPL[7],實際顯示的是視網膜中層及深層毛細血管。有研究利用AngioVue對DCP進行定量分析顯示,PAMM患眼的DCP血流密度較對側健康眼下降19%[3],但部分未使用投影移除技術的PAMM的OCTA研究中,DCP血流密度降低可能會因為此處組織強反射造成的淺層血管投攝偽影而被掩蓋,導致分析困難[8, 15]。Chu等[14]利用最新OCTA投影移除算法處理圖像后,發現PAMM患眼的視網膜中層毛細血管和DCP血流密度均出現下降,少數患眼SCP血流密度也出現下降。隨著OCTA分層和偽影消除技術的進展以及OCTA分辨率的進一步提升,對PAMM發病機制研究也將取得進一步進展。
Sarraf等[1]發現PAMM病灶在近紅外眼底像上呈現為“苜蓿葉”或“花瓣”樣邊界清晰的暗區。PAMM在彩色眼底像上往往缺乏明確且易于辨別的改變,需借助其他影像檢查以明確病灶。本組患眼中合并CRVO的1只眼行紅外眼底照相,表現為沿小靜脈分布的邊界較為清楚的暗區。其原因是由于紅外眼底像的反射主要來源于RPE,反射被視網膜中層的強反射病灶遮擋,從而在相應區域出現暗區。
PAMM傳統彩色眼底像難以發現特征性改變,常常容易被同時合并的RAO或RVO的改變所掩蓋,仔細觀察時可能會發現后極部黃斑旁視網膜呈淺灰色改變。FFA雖然也缺乏特征性改變,但可以發現是否合并視網膜血管灌注延遲、周邊缺血性改變、眼底表現不夠明顯的輕至中度非增生型DR或視盤改變等。
本研究存在一定局限性。由于初診醫生對于疾病的特征表現不熟悉,僅有1例患者行紅外眼底照相,2例患者未接受OCTA檢查。由于本研究使用的OCTA設備尚不具備3D去偽影功能,因此DCP的血流密度容易受到上方SCP的偽影干擾,因此未進行定量分析。本研究局限于PAMM的形態學分析,由于缺乏多焦ERG等電生理檢查,對其引起的功能性改變研究不足。另外,由于多數患者隨訪困難,沒能搜集到足夠的縱向觀察資料,沒有進行更多此方面分析及討論。最后,本研究納入的病例數有限,其臨床特點和發病規律還需要今后積累更多的資料進行深入分析。