引用本文: 楚艷華, 劉玉燕, 王瑩, 韓泉洪. 增生型糖尿病視網膜病變患眼玻璃體切割手術后玻璃體再積血原因及預后觀察分析. 中華眼底病雜志, 2017, 33(4): 391-395. doi: 10.3760/cma.j.issn.1005-1015.2017.04.015 復制
增生型糖尿病視網膜病變(PDR)玻璃體切割手術(PPV)后玻璃體再積血(PVH)的發生率為5%~45%[1-3]。PVH可分為手術后持續積血和手術后再積血兩種。手術后持續積血是指從手術后第1天即存在的玻璃體積血,通常由于基底部殘存的積血釋放,手術中止血不徹底造成。手術后再積血是指手術后已經廓清的玻璃體腔再次積血,常因殘存的纖維血管膜、鞏膜切口處或玻璃體基底部新生纖維血管膜增生導致[3-6]。近年來微創手術的開展和抗血管內皮生長因子(VEGF)藥物的應用改變了PDR的手術過程,但PVH仍然是影響手術后預后的重要并發癥,關于其危險因素和處理方式的研究也從未終止[1-3, 7]。我們回顧分析了一組接受PPV治療的PDR患者的臨床資料,對PVH發生的原因和預后進行了觀察分析。現將結果報道如下。
1 對象和方法
回顧性研究。2014年1月至2016年1月在天津市眼科醫院臨床確診為PDR并行PPV治療的160例患者171只眼納入本研究。其中,男性85例92只眼,女性75例79只眼。年齡33~73歲,平均年齡(56.40±8.97)歲。
所有患者均采用親和色譜微柱法檢測糖化血紅蛋白(HbA1c),全自動分析儀酶法測定血肌酐水平。患者HbA1c為6.3%~8.1%,平均HbA1c為(7.4±1.7)%。血肌酐水平為71~114 μmol/L,平均血肌酐水平為(83.5±7.3)μmol/L。所有患眼均行矯正視力、眼壓、裂隙燈顯微鏡聯合前置鏡及間接檢眼鏡檢查;根據患眼視網膜可見度選擇行眼底彩色照相、光相干斷層掃描(OCT)及B型超聲檢查。根據眼底及B型超聲檢查結果判斷患眼是否合并牽拉性視網膜脫離(TRD)及進行性纖維血管增生(FVP)。根據OCT檢查結果判斷患眼是否合并黃斑水腫。眼底不能窺見者于手術中進一步核實。患眼矯正視力為眼前手動~0.3。眼壓均低于21 mmHg(1 mmHg=0.133 kPa),平均眼壓為(14.8±3.7)mmHg。171只眼中,合并TRD 69只眼,合并FVP 102只眼;合并黃斑水腫42只眼。
納入標準:(1)符合PDR的診斷標準[8];(2)存在超過3個月不吸收的玻璃體積血;(3)TRD、FVP累及或危及黃斑;(4)手術后至少隨訪6個月,硅油填充者則在硅油取出手術后至少隨訪6個月。排除標準:(1)白內障之外的其他內眼手術史;(2)隨訪時間<6個月;(3)至隨訪結束時,首次手術所填充硅油仍未取出者。
所有患眼均在非接觸廣角鏡及吊頂燈輔助下行25G PPV治療。所有手術由同一醫生完成。對于范圍超過3個時鐘位且與視網膜呈寬基底粘連的FVP 37只眼,手術前3 d給予玻璃體腔注射雷珠單抗或康柏西普等抗VEGF藥物治療。50歲以上有晶狀體混濁者首先行白內障超聲乳化吸除手術,無需硅油填充者一期植入人工晶狀體;50歲以下者盡量保留晶狀體。共82只眼聯合行白內障超聲乳化吸除手術。手術中頂壓充分切除周邊玻璃體,存在大范圍寬基底纖維血管膜者在吊頂燈輔助下雙手操作剝除視網膜前膜,曲安奈德輔助下盡量剝除劈裂殘留玻璃體皮質。手術中通過升高灌注壓,直接壓迫積血點及電凝充分止血。手術結束時在眼壓20 mmHg狀態下觀察有無活動性積血。周邊頂壓狀態下全視網膜激光光凝(PRP)至鋸齒緣。手術前未行激光治療者均一次完成PRP,激光點數1700~2500點。激光點數超過1000點和(或)合并黃斑水腫的126只眼于氣液交換后玻璃體腔注入1 mg曲安奈德。根據患眼視網膜脫離程度、是否合并醫源性裂孔、激光數量及全身狀況等綜合考慮選擇填充物。其中,硅油填充43只眼,C3F8填充63只眼,灌注液或空氣填充65只眼。手術后3~6個月,硅油填充者行硅油取出手術,矯正視力提高的無晶狀體眼行二期人工晶狀體植入手術,合并白內障者行白內障超聲乳化吸除手術。
根據文獻[3]的標準,將PPV或硅油取出玻璃體腔廓清后再次積血導致視力下降,間接檢眼鏡下視網膜細節不能窺見定義為PVH。不包括手術后第1天積血未吸收即手術后持續積血者。PVH發生者予以云南白藥口服2周,遵內科醫囑嚴格控制血壓血糖,排查頸動脈疾患。每周隨訪。對于積血6周不吸收或觀察過程中出現不能控制的眼壓升高、虹膜新生血管(NVI)及新生血管性青光眼(NVG)者再給予PPV、玻璃體腔注射抗VEGF藥物、補充PRP、經鞏膜二極管激光睫狀體激光光凝(TCP)等相應治療,手術完畢時根據情況行C3F8或硅油填充。如發現NVI和(或)NVG則急診入院盡快手術。
觀察患眼PVH的發生率。對比分析是否發生PVH者年齡、視力、HbA1c、血肌酐水平、手術前眼底病變的嚴重程度、是否接受抗VEGF藥物治療、是否聯合白內障超聲乳化吸除手術等基線資料。觀察分析PVH的發生原因及預后。以視力提高或下降2行及以上為視力提高或下降;視力變化在1行以內為視力無變化。
采用SPSS 22.0統計軟件進行統計學分析處理。發生與未發生PVH者之間年齡、HbA1c、血肌酐水平比較采用 t 檢驗;手術前合并TRD、FVP的眼數以及接受抗VEGF藥物治療、聯合白內障超聲乳化吸除手術的眼數比較采用χ2檢驗;是否合并NVI、NVG者隨訪結束時視力比較采用Fisher檢驗。P<0.05為差異有統計學意義。
2 結果
患眼首次手術后矯正視力為眼前數指~1.0。
160例171只眼中,發生PVH 15例15只眼,占患眼的8.77%;未發生PVH 145例156只眼,占患眼的91.23%。發生與未發生PVH者年齡以及手術前合并TRD、合并FVP、接受抗VEGF藥物治療的眼數比較,差異均有統計學意義(P<0.05);HbA1c、血肌酐水平以及聯合白內障超聲乳化吸除手術的眼數比較,差異無統計學意義(P>0.05)(表1)。
PVH發生時間為手術后2周~6個月,其中11只眼發生于手術后4~6周。發生PVH的15只眼中,積血1次6只眼,積血2次及以上9只眼。合并NVI 1只眼,合并NVG 4只眼。積血自行吸收7只眼;因就診時視力無光感而自愿放棄治療1只眼,為NVG者;因積血不吸收再次治療7只眼,其中行PPV治療6只眼,行玻璃體腔注射雷珠單抗治療1只眼。合并NVI或NVG的4只眼均接受玻璃體腔注射雷珠單抗治療,其中聯合PPV治療3只眼,聯合TCP治療2只眼。
行再次PPV治療的6只眼中,手術中可見呈多點粘連狀態的視網膜前膜(ERM)2只眼,ERM上無明顯血管;上方切口附近纖維血管膜2只眼(圖1);未發現明確原因2只眼,其中1只眼發生PVH前3個月發生過前部缺血性視神經病變。行再次玻璃體腔注射雷珠單抗的1只眼,眼底檢查無異常。積血自行吸收的7只眼中,因反復積血行熒光素眼底血管造影檢查,未發現視網膜新生血管及大片無灌注區2只眼,其中1只眼可見后極部小片狀ERM;經眼底檢查發現ERM 4只眼,其上均無血管擴張;眼底無明顯異常1只眼。自愿放棄治療者手術后曾因口服卡托普利出現持續性干咳。
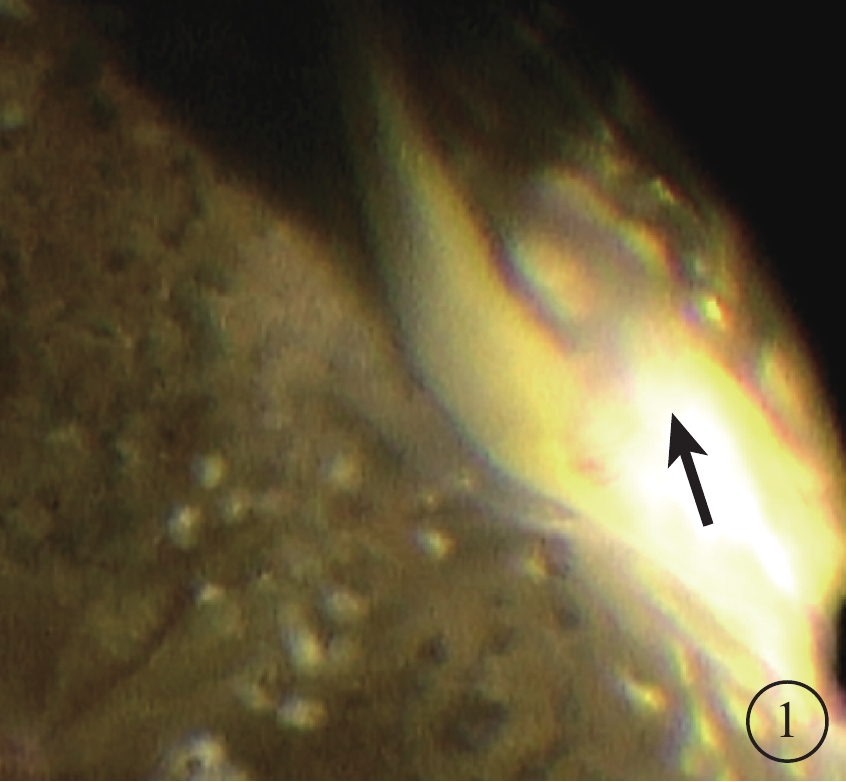
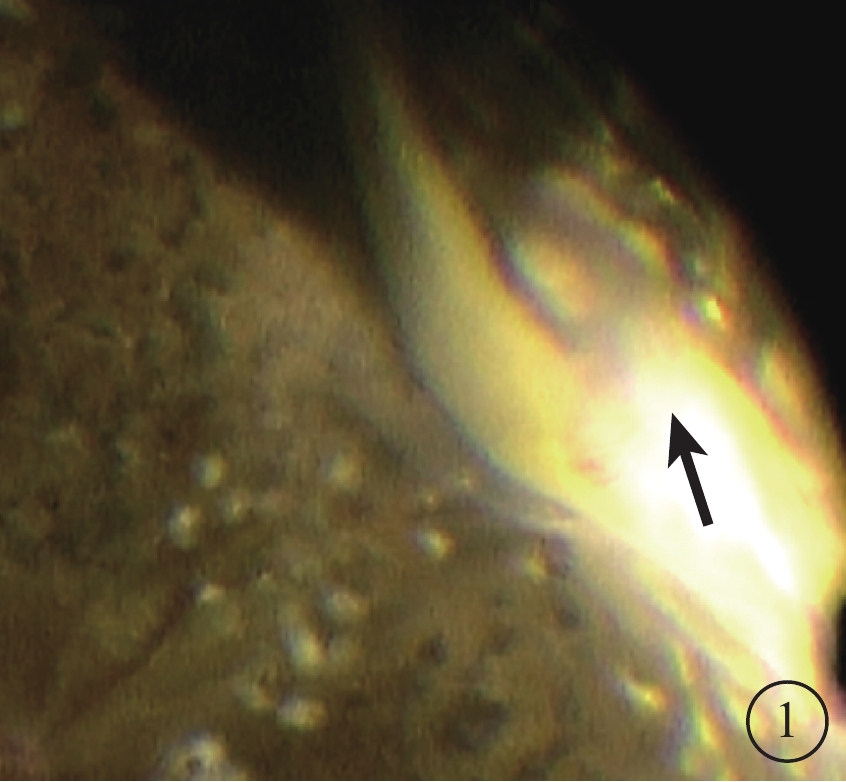 圖1
再次PPV視頻截圖。切口附近纖維血管膜,可見纖維血管膜與基底部玻璃體相連(黑箭)
圖1
再次PPV視頻截圖。切口附近纖維血管膜,可見纖維血管膜與基底部玻璃體相連(黑箭)
至隨訪結束時,除自愿放棄治療的1只眼外,其余14只眼積血均被吸收。患眼末次隨訪時矯正視力為無光感~1.0。與首次手術后矯正視力比較,視力無變化12只眼;視力下降3只眼,均為NVG患眼。合并NVI或NVG者矯正視力較未合并NVI或NVG者明顯降低,差異有統計學意義(P=0.022)。發生NVI或NVG并接受治療的4只眼,經治療后眼壓得以控制3只眼,仍需局部降眼壓藥物控制眼壓1只眼。
3 討論
很多研究對PDR手術后PVH的危險因素進行了分析,主要關注點在于患者的全身狀況及眼底病變活躍程度,結果各異[9-11]。有研究發現,手術前PRP不充分、合并NVI是PVH的危險因素[9]。另有研究發現,手術后4周內的再積血與眼底病變嚴重程度相關,而手術后4周以后的再積血更易發生于血糖控制較差者[10]。本研究結果顯示,與未發生PVH者比較,發生PVH者年齡更小,手術前合并TRD、FVP以及手術前接受抗VEGF藥物治療的眼數更多。這4個因素都與PDR的嚴重活躍程度相關。年輕人及合并TRD、FVP的PDR可能更加急進,有更大范圍的無灌注區;且其在手術時有更大機會殘余玻璃體后皮質及新生血管膜,殘余玻璃體的收縮和繼而引起的纖維血管膜收縮可能會導致再積血[10]。而發生PVH者手術前應用抗VEGF藥物的眼數明顯高于未發生PVH者這一結果與既往抗VEGF藥物治療圍手術期應用的研究結果相悖[1, 2, 12]。FVP活躍廣泛是手術前抗VEGF藥物治療的指征,所以我們分析抗VEGF藥物應用的高比例同樣說明PVH發生與PDR嚴重程度相關,而并非是抗VEGF藥物本身增加了PVH的風險。我們還發現,HbA1c、血肌酐水平以及是否聯合白內障超聲乳化吸除手術在發生PVH與未發生PVH者之間無明顯差異。關于這些全身危險因素是否與PVH的發生有關,研究結果也不盡相同[8-10]。我們認為,受樣本量和發病率影響,很多因素的相關性在一個研究中不一定完全顯現。
本組發生PVH的15只眼中,6只眼接受了再次PPV治療。手術中發現2只眼存在多點粘連的ERM,2只眼切口處纖維血管膜增生。而在積血自行吸收的7只眼中,5只眼存在ERM,此外并未發現其他導致PVH的危險因素。我們分析認為,殘余或再生纖維血管膜和切口處纖維血管膜長入是本組患眼發生PVH的重要原因。Yan等[13]發現,切口處纖維血管膜長入和復發ERM的患者分別占28.13%和9.38%。Bhende等[14]應用超聲生物顯微鏡觀察到手術后6~8周在鞏膜切口位置出現纖維血管膜的機會很高。殘留玻璃體支架、缺血區視網膜血管生長因子的釋放、新鮮或陳舊積血本身包含的各種生長因子以及手術操作帶來的各種因子綜合在一起,可能形成纖維血管膜再生的合適環境[13]。基于上述認識,應強調手術中應用曲安奈德輔助仔細清除玻璃體后皮質及纖維血管膜,盡量徹底清除基底部玻璃體,充分視網膜激光光凝可能是防止纖維血管膜再生的有效方法。同時再次手術應重點關注有無ERM及睫狀膜的存在。經PRP治療后,殘余或再生的纖維血管膜常沒有明顯的血管擴張,難以分辨。這可能是部分患眼雖經玻璃體腔灌洗但找不到明確原因,此后仍反復積血的重要原因。臨床應特別關注難于吸除的視網膜前陳舊積血,這常提示是ERM存在的位置。
本組發生PVH的15只眼中,除自愿放棄治療的1只眼外,其余14只眼積血均被吸收,且矯正視力與發生PVH之前相當。對這些患眼而言,PVH延長了視力恢復過程,但是最終視力未受影響。目前抗VEGF藥物的應用在很大程度上改善了NVG患眼的預后[15]。但本研究結果顯示,合并NVI或NVG者矯正視力較未合并NVI或NVG者明顯降低。這說明抗VEGF藥物或聯合手術雖然是NVG的有效治療方法,但仍有部分患眼雖經及時治療依然出現預后不良的現象。
本研究結果表明,PDR手術后PVH的發生與眼底病變嚴重程度密切相關;手術中應重點關注殘存或再生的纖維血管膜;NVI及NVG是影響預后的重要因素,一經發現應盡快手術處理。但由于本研究為回顧性研究,患者在手術后未例行熒光素眼底血管造影及切口區域的超聲生物顯微鏡檢查,導致在PVH原因判斷上存在一定局限性,其研究結果有待今后更為完善的研究進一步驗證。
增生型糖尿病視網膜病變(PDR)玻璃體切割手術(PPV)后玻璃體再積血(PVH)的發生率為5%~45%[1-3]。PVH可分為手術后持續積血和手術后再積血兩種。手術后持續積血是指從手術后第1天即存在的玻璃體積血,通常由于基底部殘存的積血釋放,手術中止血不徹底造成。手術后再積血是指手術后已經廓清的玻璃體腔再次積血,常因殘存的纖維血管膜、鞏膜切口處或玻璃體基底部新生纖維血管膜增生導致[3-6]。近年來微創手術的開展和抗血管內皮生長因子(VEGF)藥物的應用改變了PDR的手術過程,但PVH仍然是影響手術后預后的重要并發癥,關于其危險因素和處理方式的研究也從未終止[1-3, 7]。我們回顧分析了一組接受PPV治療的PDR患者的臨床資料,對PVH發生的原因和預后進行了觀察分析。現將結果報道如下。
1 對象和方法
回顧性研究。2014年1月至2016年1月在天津市眼科醫院臨床確診為PDR并行PPV治療的160例患者171只眼納入本研究。其中,男性85例92只眼,女性75例79只眼。年齡33~73歲,平均年齡(56.40±8.97)歲。
所有患者均采用親和色譜微柱法檢測糖化血紅蛋白(HbA1c),全自動分析儀酶法測定血肌酐水平。患者HbA1c為6.3%~8.1%,平均HbA1c為(7.4±1.7)%。血肌酐水平為71~114 μmol/L,平均血肌酐水平為(83.5±7.3)μmol/L。所有患眼均行矯正視力、眼壓、裂隙燈顯微鏡聯合前置鏡及間接檢眼鏡檢查;根據患眼視網膜可見度選擇行眼底彩色照相、光相干斷層掃描(OCT)及B型超聲檢查。根據眼底及B型超聲檢查結果判斷患眼是否合并牽拉性視網膜脫離(TRD)及進行性纖維血管增生(FVP)。根據OCT檢查結果判斷患眼是否合并黃斑水腫。眼底不能窺見者于手術中進一步核實。患眼矯正視力為眼前手動~0.3。眼壓均低于21 mmHg(1 mmHg=0.133 kPa),平均眼壓為(14.8±3.7)mmHg。171只眼中,合并TRD 69只眼,合并FVP 102只眼;合并黃斑水腫42只眼。
納入標準:(1)符合PDR的診斷標準[8];(2)存在超過3個月不吸收的玻璃體積血;(3)TRD、FVP累及或危及黃斑;(4)手術后至少隨訪6個月,硅油填充者則在硅油取出手術后至少隨訪6個月。排除標準:(1)白內障之外的其他內眼手術史;(2)隨訪時間<6個月;(3)至隨訪結束時,首次手術所填充硅油仍未取出者。
所有患眼均在非接觸廣角鏡及吊頂燈輔助下行25G PPV治療。所有手術由同一醫生完成。對于范圍超過3個時鐘位且與視網膜呈寬基底粘連的FVP 37只眼,手術前3 d給予玻璃體腔注射雷珠單抗或康柏西普等抗VEGF藥物治療。50歲以上有晶狀體混濁者首先行白內障超聲乳化吸除手術,無需硅油填充者一期植入人工晶狀體;50歲以下者盡量保留晶狀體。共82只眼聯合行白內障超聲乳化吸除手術。手術中頂壓充分切除周邊玻璃體,存在大范圍寬基底纖維血管膜者在吊頂燈輔助下雙手操作剝除視網膜前膜,曲安奈德輔助下盡量剝除劈裂殘留玻璃體皮質。手術中通過升高灌注壓,直接壓迫積血點及電凝充分止血。手術結束時在眼壓20 mmHg狀態下觀察有無活動性積血。周邊頂壓狀態下全視網膜激光光凝(PRP)至鋸齒緣。手術前未行激光治療者均一次完成PRP,激光點數1700~2500點。激光點數超過1000點和(或)合并黃斑水腫的126只眼于氣液交換后玻璃體腔注入1 mg曲安奈德。根據患眼視網膜脫離程度、是否合并醫源性裂孔、激光數量及全身狀況等綜合考慮選擇填充物。其中,硅油填充43只眼,C3F8填充63只眼,灌注液或空氣填充65只眼。手術后3~6個月,硅油填充者行硅油取出手術,矯正視力提高的無晶狀體眼行二期人工晶狀體植入手術,合并白內障者行白內障超聲乳化吸除手術。
根據文獻[3]的標準,將PPV或硅油取出玻璃體腔廓清后再次積血導致視力下降,間接檢眼鏡下視網膜細節不能窺見定義為PVH。不包括手術后第1天積血未吸收即手術后持續積血者。PVH發生者予以云南白藥口服2周,遵內科醫囑嚴格控制血壓血糖,排查頸動脈疾患。每周隨訪。對于積血6周不吸收或觀察過程中出現不能控制的眼壓升高、虹膜新生血管(NVI)及新生血管性青光眼(NVG)者再給予PPV、玻璃體腔注射抗VEGF藥物、補充PRP、經鞏膜二極管激光睫狀體激光光凝(TCP)等相應治療,手術完畢時根據情況行C3F8或硅油填充。如發現NVI和(或)NVG則急診入院盡快手術。
觀察患眼PVH的發生率。對比分析是否發生PVH者年齡、視力、HbA1c、血肌酐水平、手術前眼底病變的嚴重程度、是否接受抗VEGF藥物治療、是否聯合白內障超聲乳化吸除手術等基線資料。觀察分析PVH的發生原因及預后。以視力提高或下降2行及以上為視力提高或下降;視力變化在1行以內為視力無變化。
采用SPSS 22.0統計軟件進行統計學分析處理。發生與未發生PVH者之間年齡、HbA1c、血肌酐水平比較采用 t 檢驗;手術前合并TRD、FVP的眼數以及接受抗VEGF藥物治療、聯合白內障超聲乳化吸除手術的眼數比較采用χ2檢驗;是否合并NVI、NVG者隨訪結束時視力比較采用Fisher檢驗。P<0.05為差異有統計學意義。
2 結果
患眼首次手術后矯正視力為眼前數指~1.0。
160例171只眼中,發生PVH 15例15只眼,占患眼的8.77%;未發生PVH 145例156只眼,占患眼的91.23%。發生與未發生PVH者年齡以及手術前合并TRD、合并FVP、接受抗VEGF藥物治療的眼數比較,差異均有統計學意義(P<0.05);HbA1c、血肌酐水平以及聯合白內障超聲乳化吸除手術的眼數比較,差異無統計學意義(P>0.05)(表1)。
PVH發生時間為手術后2周~6個月,其中11只眼發生于手術后4~6周。發生PVH的15只眼中,積血1次6只眼,積血2次及以上9只眼。合并NVI 1只眼,合并NVG 4只眼。積血自行吸收7只眼;因就診時視力無光感而自愿放棄治療1只眼,為NVG者;因積血不吸收再次治療7只眼,其中行PPV治療6只眼,行玻璃體腔注射雷珠單抗治療1只眼。合并NVI或NVG的4只眼均接受玻璃體腔注射雷珠單抗治療,其中聯合PPV治療3只眼,聯合TCP治療2只眼。
行再次PPV治療的6只眼中,手術中可見呈多點粘連狀態的視網膜前膜(ERM)2只眼,ERM上無明顯血管;上方切口附近纖維血管膜2只眼(圖1);未發現明確原因2只眼,其中1只眼發生PVH前3個月發生過前部缺血性視神經病變。行再次玻璃體腔注射雷珠單抗的1只眼,眼底檢查無異常。積血自行吸收的7只眼中,因反復積血行熒光素眼底血管造影檢查,未發現視網膜新生血管及大片無灌注區2只眼,其中1只眼可見后極部小片狀ERM;經眼底檢查發現ERM 4只眼,其上均無血管擴張;眼底無明顯異常1只眼。自愿放棄治療者手術后曾因口服卡托普利出現持續性干咳。
 圖1
再次PPV視頻截圖。切口附近纖維血管膜,可見纖維血管膜與基底部玻璃體相連(黑箭)
圖1
再次PPV視頻截圖。切口附近纖維血管膜,可見纖維血管膜與基底部玻璃體相連(黑箭)
至隨訪結束時,除自愿放棄治療的1只眼外,其余14只眼積血均被吸收。患眼末次隨訪時矯正視力為無光感~1.0。與首次手術后矯正視力比較,視力無變化12只眼;視力下降3只眼,均為NVG患眼。合并NVI或NVG者矯正視力較未合并NVI或NVG者明顯降低,差異有統計學意義(P=0.022)。發生NVI或NVG并接受治療的4只眼,經治療后眼壓得以控制3只眼,仍需局部降眼壓藥物控制眼壓1只眼。
3 討論
很多研究對PDR手術后PVH的危險因素進行了分析,主要關注點在于患者的全身狀況及眼底病變活躍程度,結果各異[9-11]。有研究發現,手術前PRP不充分、合并NVI是PVH的危險因素[9]。另有研究發現,手術后4周內的再積血與眼底病變嚴重程度相關,而手術后4周以后的再積血更易發生于血糖控制較差者[10]。本研究結果顯示,與未發生PVH者比較,發生PVH者年齡更小,手術前合并TRD、FVP以及手術前接受抗VEGF藥物治療的眼數更多。這4個因素都與PDR的嚴重活躍程度相關。年輕人及合并TRD、FVP的PDR可能更加急進,有更大范圍的無灌注區;且其在手術時有更大機會殘余玻璃體后皮質及新生血管膜,殘余玻璃體的收縮和繼而引起的纖維血管膜收縮可能會導致再積血[10]。而發生PVH者手術前應用抗VEGF藥物的眼數明顯高于未發生PVH者這一結果與既往抗VEGF藥物治療圍手術期應用的研究結果相悖[1, 2, 12]。FVP活躍廣泛是手術前抗VEGF藥物治療的指征,所以我們分析抗VEGF藥物應用的高比例同樣說明PVH發生與PDR嚴重程度相關,而并非是抗VEGF藥物本身增加了PVH的風險。我們還發現,HbA1c、血肌酐水平以及是否聯合白內障超聲乳化吸除手術在發生PVH與未發生PVH者之間無明顯差異。關于這些全身危險因素是否與PVH的發生有關,研究結果也不盡相同[8-10]。我們認為,受樣本量和發病率影響,很多因素的相關性在一個研究中不一定完全顯現。
本組發生PVH的15只眼中,6只眼接受了再次PPV治療。手術中發現2只眼存在多點粘連的ERM,2只眼切口處纖維血管膜增生。而在積血自行吸收的7只眼中,5只眼存在ERM,此外并未發現其他導致PVH的危險因素。我們分析認為,殘余或再生纖維血管膜和切口處纖維血管膜長入是本組患眼發生PVH的重要原因。Yan等[13]發現,切口處纖維血管膜長入和復發ERM的患者分別占28.13%和9.38%。Bhende等[14]應用超聲生物顯微鏡觀察到手術后6~8周在鞏膜切口位置出現纖維血管膜的機會很高。殘留玻璃體支架、缺血區視網膜血管生長因子的釋放、新鮮或陳舊積血本身包含的各種生長因子以及手術操作帶來的各種因子綜合在一起,可能形成纖維血管膜再生的合適環境[13]。基于上述認識,應強調手術中應用曲安奈德輔助仔細清除玻璃體后皮質及纖維血管膜,盡量徹底清除基底部玻璃體,充分視網膜激光光凝可能是防止纖維血管膜再生的有效方法。同時再次手術應重點關注有無ERM及睫狀膜的存在。經PRP治療后,殘余或再生的纖維血管膜常沒有明顯的血管擴張,難以分辨。這可能是部分患眼雖經玻璃體腔灌洗但找不到明確原因,此后仍反復積血的重要原因。臨床應特別關注難于吸除的視網膜前陳舊積血,這常提示是ERM存在的位置。
本組發生PVH的15只眼中,除自愿放棄治療的1只眼外,其余14只眼積血均被吸收,且矯正視力與發生PVH之前相當。對這些患眼而言,PVH延長了視力恢復過程,但是最終視力未受影響。目前抗VEGF藥物的應用在很大程度上改善了NVG患眼的預后[15]。但本研究結果顯示,合并NVI或NVG者矯正視力較未合并NVI或NVG者明顯降低。這說明抗VEGF藥物或聯合手術雖然是NVG的有效治療方法,但仍有部分患眼雖經及時治療依然出現預后不良的現象。
本研究結果表明,PDR手術后PVH的發生與眼底病變嚴重程度密切相關;手術中應重點關注殘存或再生的纖維血管膜;NVI及NVG是影響預后的重要因素,一經發現應盡快手術處理。但由于本研究為回顧性研究,患者在手術后未例行熒光素眼底血管造影及切口區域的超聲生物顯微鏡檢查,導致在PVH原因判斷上存在一定局限性,其研究結果有待今后更為完善的研究進一步驗證。