玻璃體是由復雜分子結構形成的透明凝膠狀組織,占眼球體積的80%;除了支撐作用外,玻璃體還具有調節眼發育、屈光、細胞屏障和參與眼內氧代謝等功能并且參與視網膜等疾病的發生發展過程。年齡、近視和全身病等因素對玻璃體功能均有影響。玻璃體注藥和手術等均可能會干擾玻璃體功能,破壞眼內代謝平衡。因此,需要重視玻璃體代謝功能,審慎進行玻璃體干預,以便更好地維持眼內代謝平衡和視功能。
引用本文: 高前應. 重視玻璃體代謝功能 審慎進行玻璃體干預. 中華眼底病雜志, 2017, 33(4): 336-340. doi: 10.3760/cma.j.issn.1005-1015.2017.04.003 復制
玻璃體是眼內最大的屈光成分并且與視網膜、晶狀體和睫狀體相鄰,因而在眼的結構和功能方面具有非常獨特的地位和作用。但既往對玻璃體功能以及在眼病發生發展過程中的作用認識不多,尤其是對玻璃體的眼內氧代謝功能重視不夠。面對日新月異的新技術應用以及臨床診斷治療的困惑,必須重視玻璃體代謝功能研究,審慎評估對待針對玻璃體的各種干預。
1 玻璃體的結構與功能
玻璃體是一種透明凝膠狀物質,填充于晶狀體和視網膜之間,占據眼球體積的80%[1]。由玻璃體膜、玻璃體皮質以及玻璃體核等組成。玻璃體膜由周邊部的致密膠原纖維構成;玻璃體皮質位于玻璃體膜與玻璃體核之間;玻璃體核占據中間大部分空間,中央是一條由血管組織退化的Cloquet管。玻璃體在視網膜基底部、黃斑和視盤處與視網膜連接最緊密[1, 2],玻璃體后界膜和視網膜內界膜(ILM)共同構成玻璃體視網膜界面。
玻璃體主要由水、膠原纖維和粘多糖等構成,還含有多種代謝產物、蛋白質和細胞等[1, 2]。其中,水占玻璃體總重量的98%~99%。15%~20%的水與透明質酸、硫酸軟骨素和硫酸乙酰肝素等粘多糖相結合[1]。膠原纖維以Ⅱ型膠原纖維為主,約占60%~75%;其次為Ⅸ型膠原纖維、Ⅴ和(或)Ⅺ型膠原纖維、Ⅳ型膠原纖維,分別占25%、10%~25%、<10%[3]。透明質酸與膠原纖維共同構成三維網狀結構,從而使玻璃體呈凝膠狀[4]。玻璃體中的主要代謝產物有葡萄糖、乳酸等。動物玻璃體中,葡糖糖濃度為血漿中的一半,而乳酸濃度則高于血漿[3]。蛋白質組學研究顯示,玻璃體中含有超過1200種蛋白成分,并且其蛋白成分隨年齡增加而變化[5]。其中,最多的為白蛋白,約占40%;其次為鐵結合蛋白,約占30%。玻璃體內的細胞包括玻璃體細胞、成纖維細胞和巨噬細胞等[3],主要分布在靠近視網膜內界膜的玻璃體表面[6]。成纖維細胞約占10%并參與玻璃體內膠原的形成。此外,玻璃體內還有抗壞血酸(維生素C)、脂肪酸、前列腺素,擁有代謝活性的多種酶類。
玻璃體具有復雜的分子網絡空間結構,是其擁有精細生物學功能的基礎。玻璃體的主要功能有:(1)參與眼球發育。原始玻璃體從妊娠3周開始發育,原始玻璃體血管和血管叢逐漸形成,為晶狀體等眼內結構提供營養。二級玻璃體在胚胎發育的第2個月形成,其中含有一些可在后期發育成視網膜的波浪形膠原纖維。眼和視網膜色素上皮(RPE)的生長取決于玻璃體的生長[7]。(2)支撐眼球。由于玻璃體是三維網狀結構,粘彈性好。因此能夠維持眼內張力,減輕或吸收日常眼球運動產生的摩擦、機械應力和震蕩等[3, 8]。(3)屈光。玻璃體是眼內的主要屈光介質之一,光折射率約為1.33[1],可透過90%以上的可見光和近紅外光。與晶狀體后囊表面相接觸,在一定程度上也參與了屈光調節[3]。(4)眼內屏障作用。玻璃體是各種生物化學物質和細胞的屏障,是血眼屏障的重要組成部分。玻璃體中的活性物質可以起到抗炎、抗增生與抗新生血管等作用[5]。(5)眼內營養代謝。玻璃體是周邊組織代謝營養物質的儲存庫,營養物質通過玻璃體的運輸可能影響周圍組織的代謝[3]。玻璃體能主動參與眼內營養物質代謝過程,保持眼內代謝環境穩定[9]。
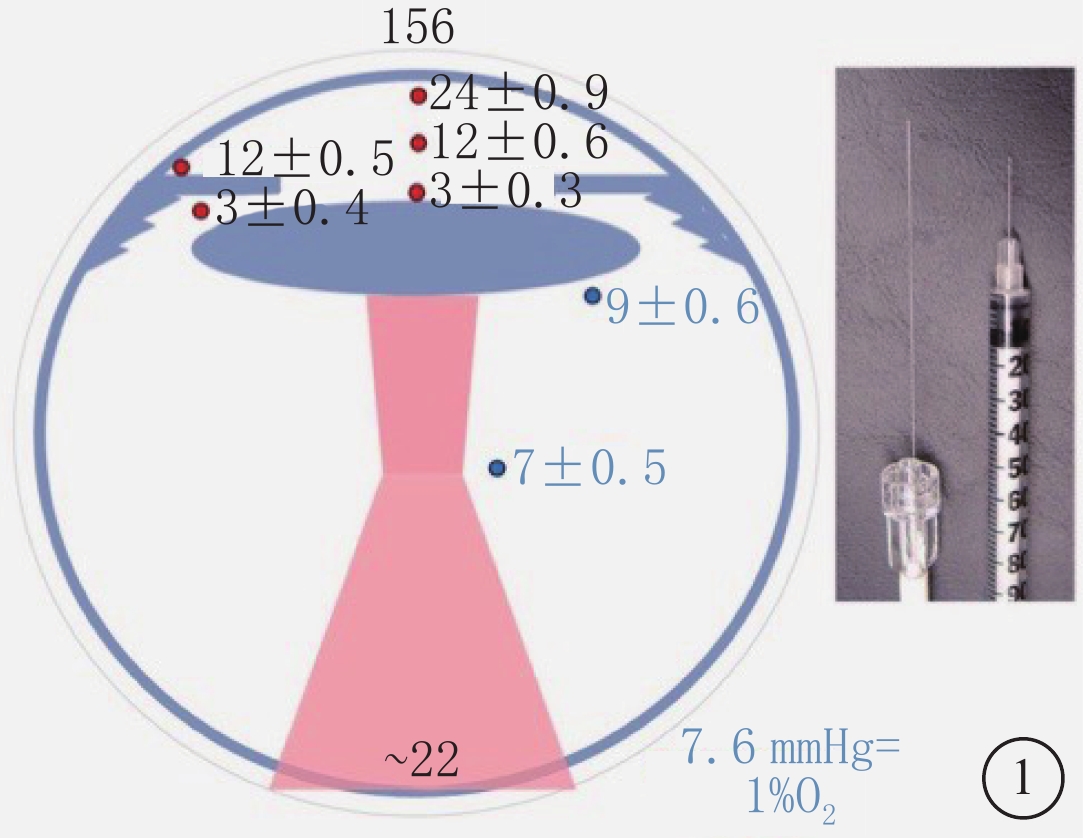
新的研究方法和儀器加深了人們對玻璃體功能的認識和理解。近年來,一種探測腫瘤組織中氧分壓(PO2)的光學纖維探針被用于探測眼內不同部位PO2,使得玻璃體PO2的檢測更加準確、方便和微創[10]。研究發現,玻璃體內處于低氧環境,氧濃度呈現出從視網膜到晶狀體逐漸降低的梯度分布(圖1)[11]。說明氧在玻璃體內不是以單純擴散的方式分布。還有研究證實,玻璃體主動消耗氧,不同部位的玻璃體具有不同的氧消耗速率,后極部氧消耗速率大于中間部[12-14]。這對于維護晶狀體低氧環境,減少活性氧損傷,保持晶狀體透明具有重要意義[3, 12]。進一步研究發現,玻璃體這種主動氧消耗是依賴于抗壞血酸途徑完成的[12]。此外,蛋白質組學的應用也拓展了對于玻璃體的認識。玻璃體內種類繁多的蛋白質成分提示玻璃體具有重要、復雜的生理功能,參與多種眼部疾病的發生和發展[4]。
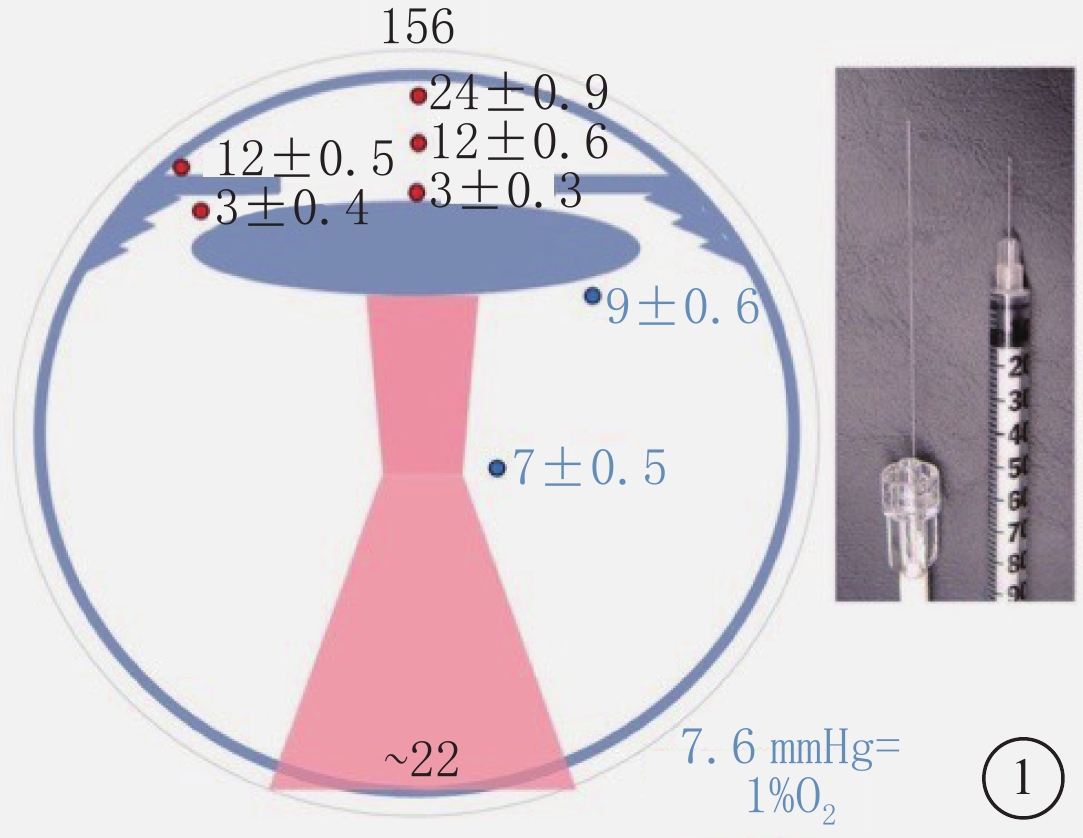 圖1
眼前部和后部區域正常氧分布示意圖。從角膜內皮至晶狀體表面氧濃度迅速降低,以及晶狀體赤道部和睫狀體之間的低氧環境。圖中右圖顯示用于測量眼內氧濃度的光纖探頭,并與30G注射器針頭對比
圖1
眼前部和后部區域正常氧分布示意圖。從角膜內皮至晶狀體表面氧濃度迅速降低,以及晶狀體赤道部和睫狀體之間的低氧環境。圖中右圖顯示用于測量眼內氧濃度的光纖探頭,并與30G注射器針頭對比
2 玻璃體結構功能的影響因素
玻璃體在健康狀態下呈凝膠狀,隨著年齡、近視和全身病等因素的變化,其結構和功能會發生相應的改變。
2.1 年齡、眼病及全身病導致的玻璃體改變
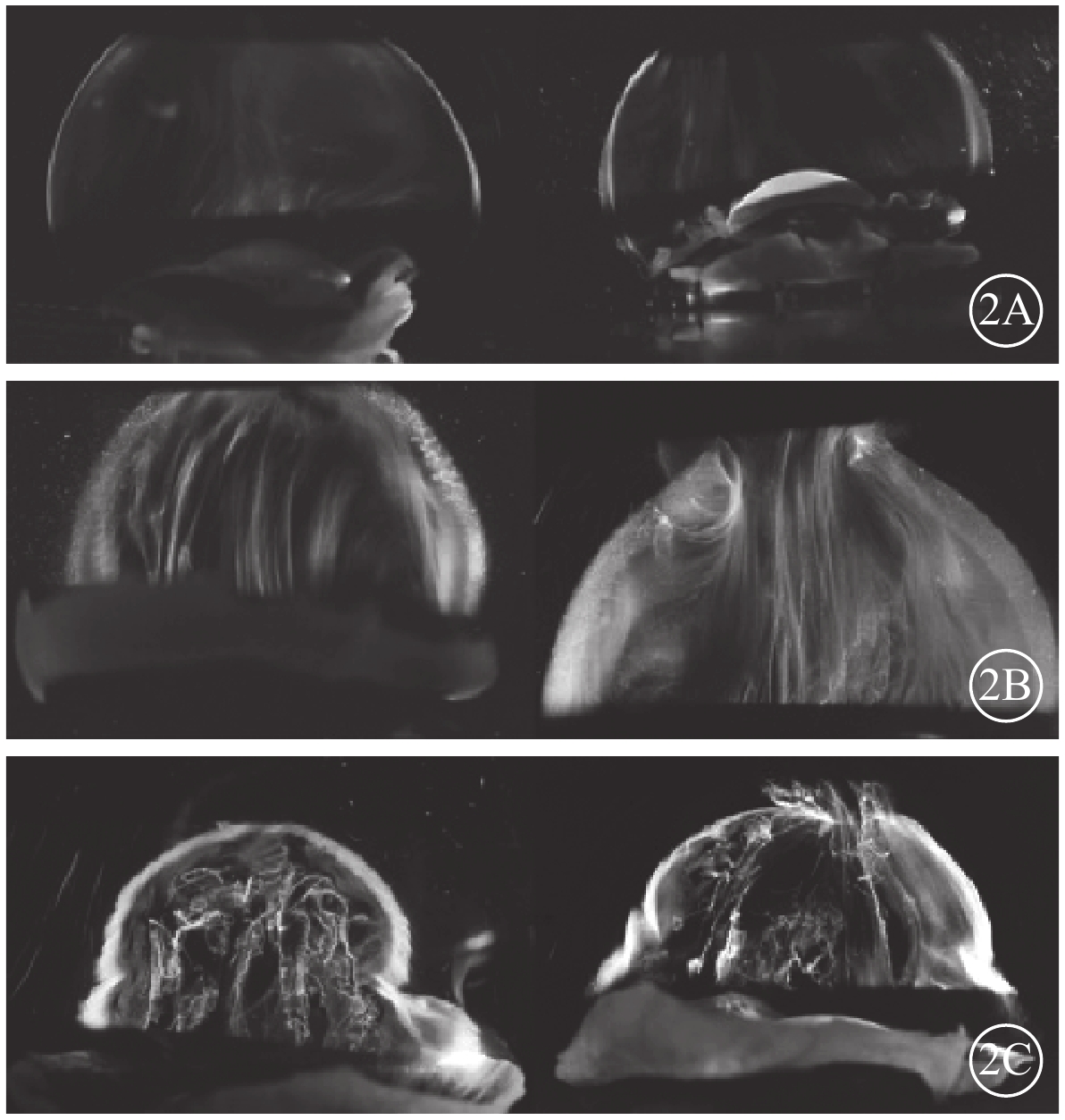
幼年時玻璃體呈凝膠狀,隨著年齡增長開始出現液化跡象(圖2)[15]。青少年期玻璃體液化可達到玻璃體腔的20%,至70歲時玻璃體液化達到50%[16]。玻璃體液化與玻璃體內膠原纖維重組有關[17]。玻璃體Ⅸ型膠原纖維隨著年齡增長逐漸丟失,導致黏性更高的Ⅱ型膠質纖維相互貼近融合、聚合,留下的空隙被水替代形成液化。隨著玻璃體液化的加重,與視網膜ILM的黏附力開始減弱,形成玻璃體后脫離(PVD);年齡50~59歲時PVD發病率可達71%[18]。
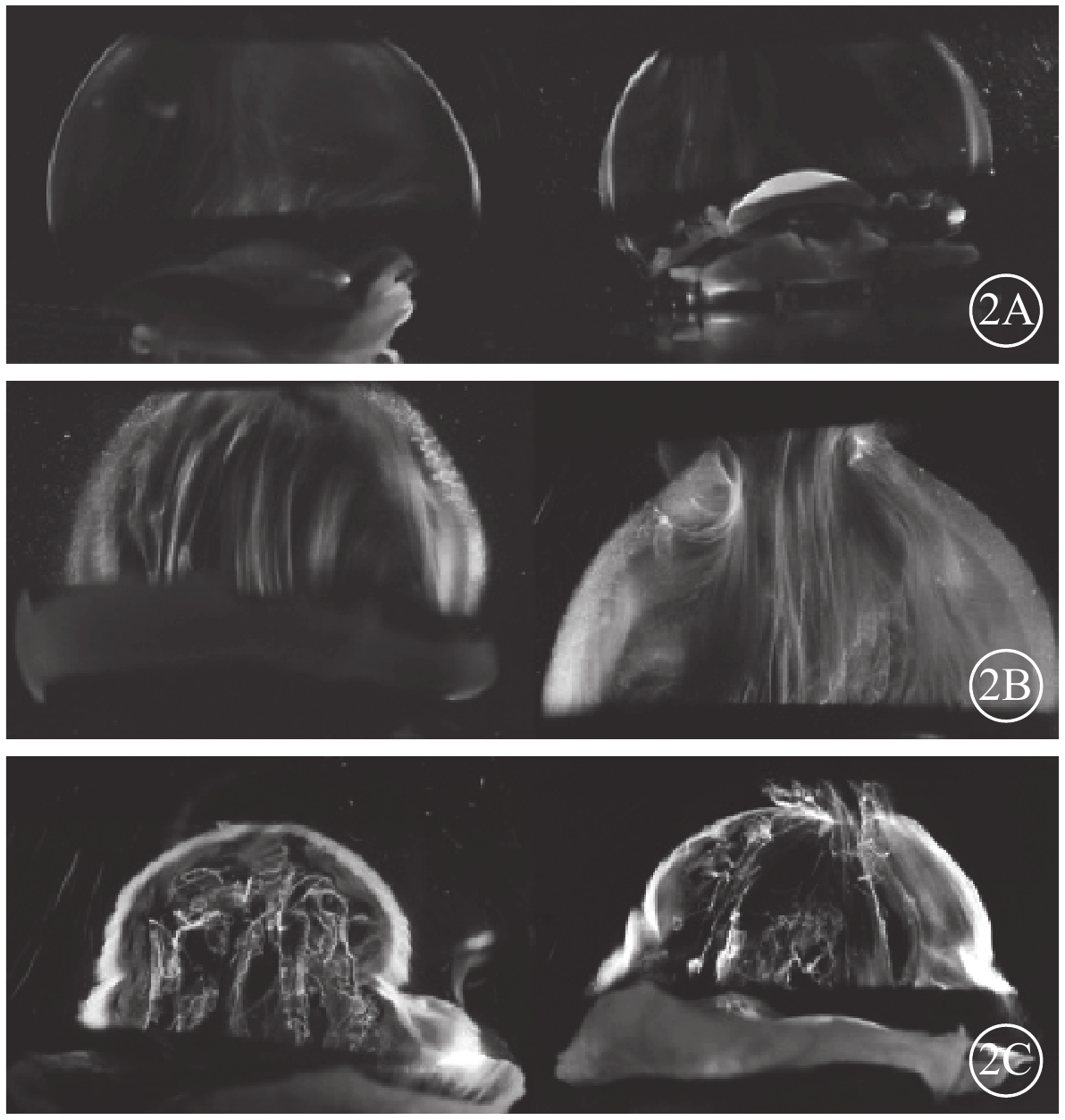 圖2
玻璃體年齡相關液化過程圖。2A. 幼年玻璃體;2B. 成年玻璃體;2C. 老年玻璃體
圖2
玻璃體年齡相關液化過程圖。2A. 幼年玻璃體;2B. 成年玻璃體;2C. 老年玻璃體
近視不僅增加了玻璃體對視網膜的牽拉力量,容易引發視網膜脫離及黃斑裂孔的發生,同時加大了玻璃體視網膜交界面的剪切應力,干擾了玻璃體膠原纖維的代謝過程。研究發現,在交界面剪切力變化的影響下,玻璃體Ⅸ型膠原纖維濃度明顯降低,而Ⅱ型膠原纖維萎縮崩塌,最終導致正常玻璃體膠原纖維的網架結構破壞,從而引發早期玻璃體液化和PVD的發生[19]。
老年性黃斑變性患者玻璃體中,血管內皮生長因子(VEGF)、VEGF受體、轉化生長因子-β和白細胞介素-1β蛋白的含量均上調,色素上皮衍生因子下調[19]。另有研究發現了19種蛋白上調,蛋白種類除血漿源性的外,涵蓋有生物及離子運輸相關蛋白,急性期炎癥反應相關蛋白及凝血因子等[19]。
糖尿病(DM)對玻璃體的損傷可能先于DM視網膜病變(DR),組織學上常可發現DM早期的玻璃體液化改變。通過蛋白質譜分析,比較DM患者與正常人的玻璃體蛋白表達量,發現DM患者玻璃體蛋白含量及種類都明顯增多,并以血漿成分蛋白增多為主[20] ,其他糖酵解和糖異生相關蛋白、補體系統相關蛋白、縫隙連接蛋白和炎癥因子等表達均有升高[21]。考慮這與DM早期血視網膜屏障破壞,血管通透性改變,血漿滲漏入玻璃體腔有關。同時,玻璃體蛋白種類增多和表達增強打破了玻璃體自身代謝的平衡,部分蛋白還與正常玻璃體的膠原纖維和透明質酸進行非酶誘導的糖基化反應,重組膠原纖維結構,削弱正常玻璃體與視網膜的黏附[22]。
高血壓對眼部血管系統結構功能產生長期影響,小動脈病變是高血壓最重要的病理改變。玻璃體周圍組織的小動脈在病變早期血視網膜屏障被破壞,血漿成分滲入玻璃體腔,影響玻璃體代謝平衡。當血壓控制不佳,大量出血進入玻璃體腔形成玻璃體積血,可引起玻璃體內增生性反應,形成有新生血管的纖維血管性增生膜,導致嚴重的并發癥,如視網膜裂孔、視網膜脫離等[23]。
2.2 玻璃體結構功能改變與眼病的相關性
玻璃體主動參與白內障和視網膜等眼病的發生發展。玻璃體位于晶狀體后,發揮了維持晶狀體周邊低氧環境,防止過氧損傷,保持其透明性的重要功能。解剖上,將晶狀體及富含血管的視網膜和脈絡膜隔開,并形成梯度遞減的氧濃度結構,增加了氧彌散至晶狀體的距離。功能上,玻璃體具有眼內分子氧的代謝調節作用。抗壞血酸直接與玻璃體內氧分子進行反應,從而代謝了氧分子,降低了玻璃體內及晶狀體周圍的氧濃度[14]。當玻璃體損傷,晶狀體暴露于大量氧中,白內障病程發展就會加快[20]。 玻璃體液化所導致的PVD隨年齡增長而加重,但黃斑區及視盤區因為與玻璃體后界膜緊密黏附,導致此處的PVD晚于視網膜其他位置,形成不完全性PVD。這種差異性的PVD逐漸形成對黃斑區及視盤區視網膜前后方向的牽拉,引起視網膜扭曲、水腫、劈裂、裂孔甚至脫離[24]。在增生性玻璃體視網膜病變(PVR)中,玻璃體膠原纖維既為PVR提供了纖維支架,又可促使遷移進玻璃體的細胞纖維化。而逃逸于玻璃體的細胞又通過分泌多種蛋白因子刺激成纖維細胞增生,產生膠原纖維和纖維連接蛋白,導致增生膜的形成。目前研究者通過蛋白質譜分析發現,PVR患者玻璃體內組織蛋白酶、補體蛋白C4b、甲狀腺素運載蛋白、胰島素樣結合蛋白等均表達明顯增高[25-27]。自然玻璃體的功能遠比我們看到和想象的要復雜得多[9]。對于維持眼的正常功能至關重要,很多眼病的發生都與玻璃體的液化和變性有關。
2.3 各種干預措施對玻璃體的影響
玻璃體的干預措施主要包括激光光凝、藥物注射和玻璃體切割手術(PPV)。應用摻釹釔鋁石榴石高能量脈沖激光消融治療玻璃體混濁[28],總有效率為0%~100%[15],但對于年齡<30歲的年輕飛蚊癥患者,癥狀顯著改善的幾率不高。此類干預措施會引起玻璃體蛋白質含量、屈光指數及流變特性改變,干擾玻璃體凝膠狀態[29],手術后白內障形成[30, 31]。安全性和有效性有待評估[15]。
玻璃體腔藥物注射是目前治療許多眼底病的主要方式。藥物誘導的玻璃體溶解手術對自然玻璃體結構功能改變應納入手術前的考慮范疇之內[32]。反復玻璃體腔注射抗VEGF藥物會引起許多并發癥[33],如青光眼、RPE萎縮,血管直徑變窄,需要更長期的研究評估其安全性和有效性[34]。為了評估藥物對玻璃體氧濃度的影響,我們誘導成功兔視網膜新生血管模型,2周內,視網膜新生血管會降低晶狀體后表面、玻璃體中間部的氧濃度,而視網膜血管邊緣處玻璃體內氧濃度不變;提示其眼內氧濃度梯度增加。2周后,形成的新生血管會增加眼內氧濃度,晶狀體后表面尤為明顯。而玻璃體腔注射藥物雖然會逆轉這一趨勢,但在注藥后4~8周較長觀察時間內,玻璃體內氧濃度梯度仍明顯高于正常水平。這說明病理性新生血管狀態打破了眼內氧代謝平衡,玻璃體腔藥物注射可短期緩解,但不能從根本上恢復玻璃體自然的氧代謝平衡。
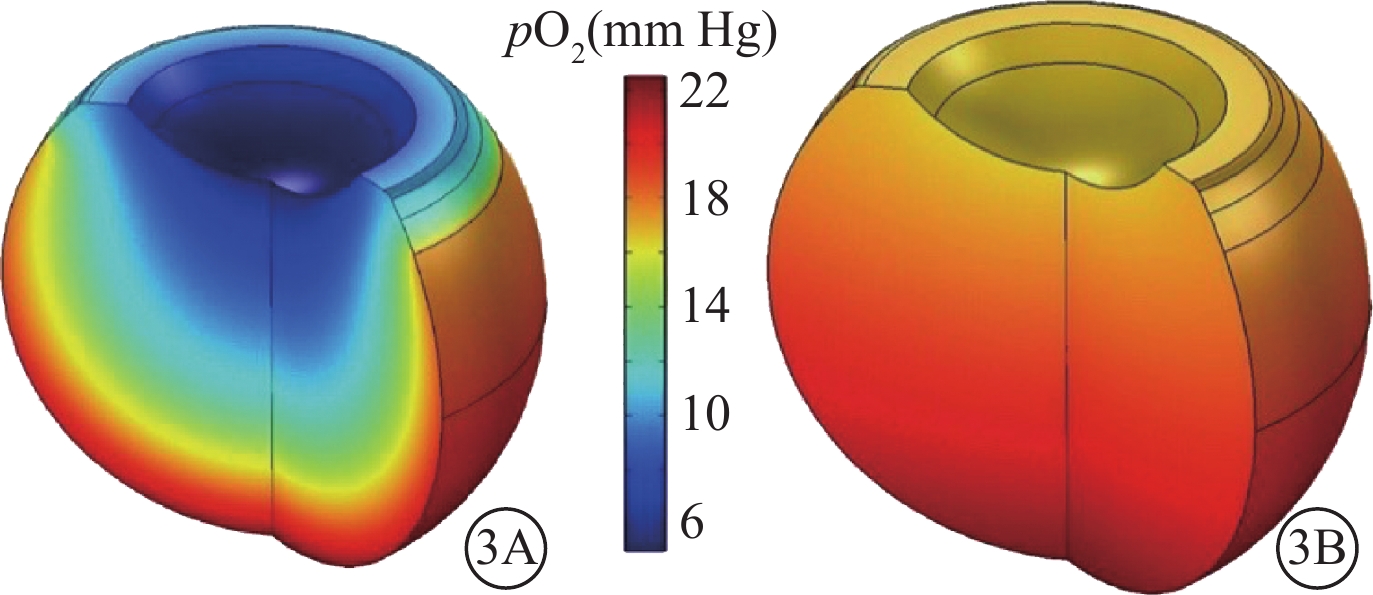
PPV是現代眼科學發展的里程碑,是目前許多玻璃體視網膜疾病的主要治療手段。但切除了全部自然玻璃體,也就喪失了自然玻璃體的調節功能,可能對眼的正常代謝造成潛在影響(圖3)[17]。這已在不少臨床研究中得到證實。如PPV后白內障、青光眼、視神經萎縮的發生率明顯升高[13, 35, 36];而視網膜脫離外路復位手術的視力預后明顯好于內路手術。盡管導致這些結果的原因很多,但自然玻璃體調控氧和相關因子的代謝功能受影響或許是其中的重要因素之一。Holekamp等[13]使用PO2探針檢測到PPV后玻璃體腔內從視網膜表面到晶狀體后表面的氧濃度梯度消失,晶狀體后表面的氧濃度從(8.7±0.6)mmHg(1 mmHg=0.133 kPa)升高至(69.6±4.8)mmHg。這種不正常的高氧可能導致白內障的發生。Shui等[14]發現,玻璃體腔中的抗壞血酸可以降低晶狀體周圍的氧濃度,保護透明晶狀體免受氧化反應。Lange等[37]檢測到增生型DR患者視網膜前的氧濃度較正常對照組明顯升高,并且與玻璃體液中檢測到的VEGF和炎癥因子的表達量成正相關。Siegfried等[35]發現,PPV后前房角的PO2明顯升高,可能會損傷小梁網細胞,與青光眼的發生有關。
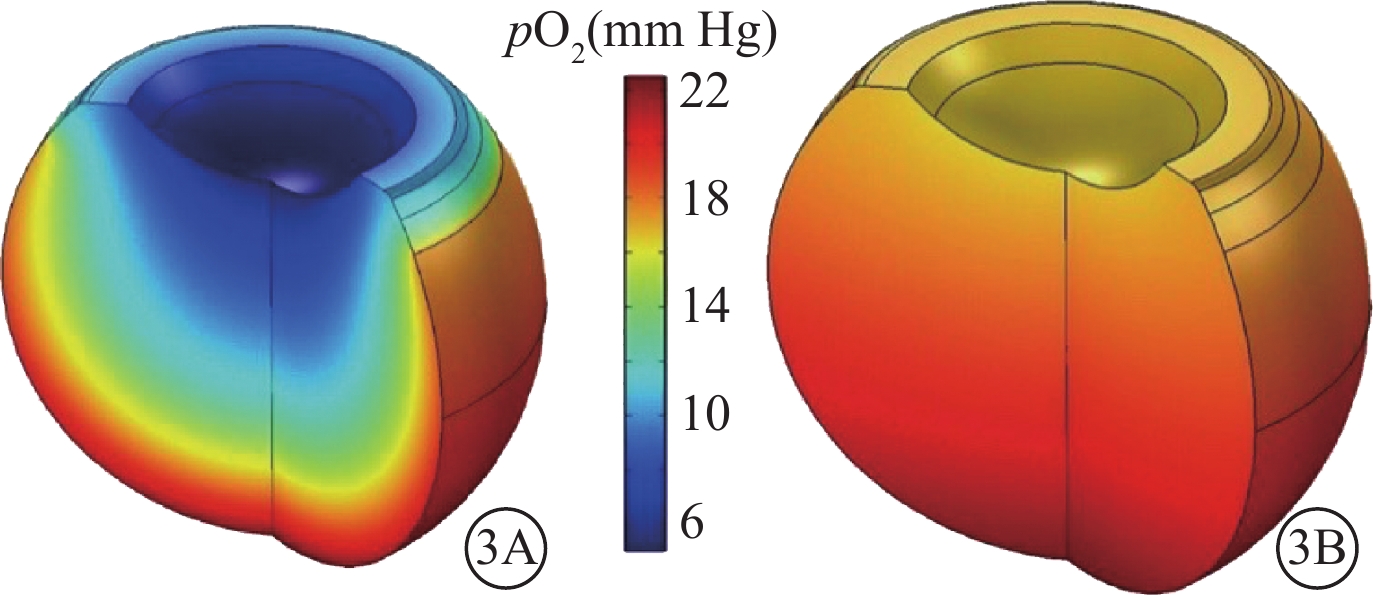 圖3
眼內氧分布模型。3A. 完整玻璃體;3B. PPV后,玻璃體腔內正常的氧梯度分布被流體循環破壞
圖3
眼內氧分布模型。3A. 完整玻璃體;3B. PPV后,玻璃體腔內正常的氧梯度分布被流體循環破壞
玻璃體不可再生,PPV后必須使用玻璃體替代物。但目前的玻璃體替代物都無法代替自然玻璃體功能并且常伴有并發癥發生。如氣體填充后白內障發生率明顯升高,而硅油填充后常有不能解釋的視神經萎縮[36, 38];長期硅油填充會影響睫狀體的分泌功能[39],造成低眼壓。玻璃體替代物對眼功能的長期影響需要進一步觀察。
3 玻璃體研究值得關注的一些問題
玻璃體結構復雜、功能精細,不可再生,難以替代。未來研究應重點關注:(1)自然玻璃體蛋白的功能。玻璃體含有1200多種不同的蛋白[22],但對其功能的研究較少。(2)自然玻璃體的氧代謝機制。我們提出假說[40],玻璃體中有序的膠原纖維網絡可能是輸送視網膜、脈絡膜血管中氧分子到眼前節的管道,保證了眼內氧濃度梯度和平衡,當發生玻璃體液化和PVD時,平衡被打破,導致眼內某部位局部的氧濃度異常積聚,引起相關眼病發生。但需要進一步的實驗證實。(3)玻璃體生物標志物作用和視網膜疾病的關系。玻璃體是全身許多疾病眼部病變的代謝物儲存庫,同時又是一些視網膜疾病的啟動觀察窗口。(4)玻璃體替代物的研究。能維持眼內代謝平衡的玻璃體替代物是眼科領域最有挑戰的課題之一。
總之,自然玻璃體并非被動存在,而是主動參與眼內代謝的功能組織。玻璃體病變是很多眼病的啟動因素。在我們沒有完全理解玻璃體功能之前,應該審慎干預,充分把握玻璃體激光消融、藥物注射、切除等治療的適應證,權衡患者的受益和風險,盡量減少對自然玻璃體結構的破壞,最大限度的保留其調控眼內代謝的功能,為未來的治療留下更多的選擇。
志謝 付月、李成和馮蕭蕭博士參與本文的資料收集和撰寫
玻璃體是眼內最大的屈光成分并且與視網膜、晶狀體和睫狀體相鄰,因而在眼的結構和功能方面具有非常獨特的地位和作用。但既往對玻璃體功能以及在眼病發生發展過程中的作用認識不多,尤其是對玻璃體的眼內氧代謝功能重視不夠。面對日新月異的新技術應用以及臨床診斷治療的困惑,必須重視玻璃體代謝功能研究,審慎評估對待針對玻璃體的各種干預。
1 玻璃體的結構與功能
玻璃體是一種透明凝膠狀物質,填充于晶狀體和視網膜之間,占據眼球體積的80%[1]。由玻璃體膜、玻璃體皮質以及玻璃體核等組成。玻璃體膜由周邊部的致密膠原纖維構成;玻璃體皮質位于玻璃體膜與玻璃體核之間;玻璃體核占據中間大部分空間,中央是一條由血管組織退化的Cloquet管。玻璃體在視網膜基底部、黃斑和視盤處與視網膜連接最緊密[1, 2],玻璃體后界膜和視網膜內界膜(ILM)共同構成玻璃體視網膜界面。
玻璃體主要由水、膠原纖維和粘多糖等構成,還含有多種代謝產物、蛋白質和細胞等[1, 2]。其中,水占玻璃體總重量的98%~99%。15%~20%的水與透明質酸、硫酸軟骨素和硫酸乙酰肝素等粘多糖相結合[1]。膠原纖維以Ⅱ型膠原纖維為主,約占60%~75%;其次為Ⅸ型膠原纖維、Ⅴ和(或)Ⅺ型膠原纖維、Ⅳ型膠原纖維,分別占25%、10%~25%、<10%[3]。透明質酸與膠原纖維共同構成三維網狀結構,從而使玻璃體呈凝膠狀[4]。玻璃體中的主要代謝產物有葡萄糖、乳酸等。動物玻璃體中,葡糖糖濃度為血漿中的一半,而乳酸濃度則高于血漿[3]。蛋白質組學研究顯示,玻璃體中含有超過1200種蛋白成分,并且其蛋白成分隨年齡增加而變化[5]。其中,最多的為白蛋白,約占40%;其次為鐵結合蛋白,約占30%。玻璃體內的細胞包括玻璃體細胞、成纖維細胞和巨噬細胞等[3],主要分布在靠近視網膜內界膜的玻璃體表面[6]。成纖維細胞約占10%并參與玻璃體內膠原的形成。此外,玻璃體內還有抗壞血酸(維生素C)、脂肪酸、前列腺素,擁有代謝活性的多種酶類。
玻璃體具有復雜的分子網絡空間結構,是其擁有精細生物學功能的基礎。玻璃體的主要功能有:(1)參與眼球發育。原始玻璃體從妊娠3周開始發育,原始玻璃體血管和血管叢逐漸形成,為晶狀體等眼內結構提供營養。二級玻璃體在胚胎發育的第2個月形成,其中含有一些可在后期發育成視網膜的波浪形膠原纖維。眼和視網膜色素上皮(RPE)的生長取決于玻璃體的生長[7]。(2)支撐眼球。由于玻璃體是三維網狀結構,粘彈性好。因此能夠維持眼內張力,減輕或吸收日常眼球運動產生的摩擦、機械應力和震蕩等[3, 8]。(3)屈光。玻璃體是眼內的主要屈光介質之一,光折射率約為1.33[1],可透過90%以上的可見光和近紅外光。與晶狀體后囊表面相接觸,在一定程度上也參與了屈光調節[3]。(4)眼內屏障作用。玻璃體是各種生物化學物質和細胞的屏障,是血眼屏障的重要組成部分。玻璃體中的活性物質可以起到抗炎、抗增生與抗新生血管等作用[5]。(5)眼內營養代謝。玻璃體是周邊組織代謝營養物質的儲存庫,營養物質通過玻璃體的運輸可能影響周圍組織的代謝[3]。玻璃體能主動參與眼內營養物質代謝過程,保持眼內代謝環境穩定[9]。
新的研究方法和儀器加深了人們對玻璃體功能的認識和理解。近年來,一種探測腫瘤組織中氧分壓(PO2)的光學纖維探針被用于探測眼內不同部位PO2,使得玻璃體PO2的檢測更加準確、方便和微創[10]。研究發現,玻璃體內處于低氧環境,氧濃度呈現出從視網膜到晶狀體逐漸降低的梯度分布(圖1)[11]。說明氧在玻璃體內不是以單純擴散的方式分布。還有研究證實,玻璃體主動消耗氧,不同部位的玻璃體具有不同的氧消耗速率,后極部氧消耗速率大于中間部[12-14]。這對于維護晶狀體低氧環境,減少活性氧損傷,保持晶狀體透明具有重要意義[3, 12]。進一步研究發現,玻璃體這種主動氧消耗是依賴于抗壞血酸途徑完成的[12]。此外,蛋白質組學的應用也拓展了對于玻璃體的認識。玻璃體內種類繁多的蛋白質成分提示玻璃體具有重要、復雜的生理功能,參與多種眼部疾病的發生和發展[4]。
 圖1
眼前部和后部區域正常氧分布示意圖。從角膜內皮至晶狀體表面氧濃度迅速降低,以及晶狀體赤道部和睫狀體之間的低氧環境。圖中右圖顯示用于測量眼內氧濃度的光纖探頭,并與30G注射器針頭對比
圖1
眼前部和后部區域正常氧分布示意圖。從角膜內皮至晶狀體表面氧濃度迅速降低,以及晶狀體赤道部和睫狀體之間的低氧環境。圖中右圖顯示用于測量眼內氧濃度的光纖探頭,并與30G注射器針頭對比
2 玻璃體結構功能的影響因素
玻璃體在健康狀態下呈凝膠狀,隨著年齡、近視和全身病等因素的變化,其結構和功能會發生相應的改變。
2.1 年齡、眼病及全身病導致的玻璃體改變
幼年時玻璃體呈凝膠狀,隨著年齡增長開始出現液化跡象(圖2)[15]。青少年期玻璃體液化可達到玻璃體腔的20%,至70歲時玻璃體液化達到50%[16]。玻璃體液化與玻璃體內膠原纖維重組有關[17]。玻璃體Ⅸ型膠原纖維隨著年齡增長逐漸丟失,導致黏性更高的Ⅱ型膠質纖維相互貼近融合、聚合,留下的空隙被水替代形成液化。隨著玻璃體液化的加重,與視網膜ILM的黏附力開始減弱,形成玻璃體后脫離(PVD);年齡50~59歲時PVD發病率可達71%[18]。
 圖2
玻璃體年齡相關液化過程圖。2A. 幼年玻璃體;2B. 成年玻璃體;2C. 老年玻璃體
圖2
玻璃體年齡相關液化過程圖。2A. 幼年玻璃體;2B. 成年玻璃體;2C. 老年玻璃體
近視不僅增加了玻璃體對視網膜的牽拉力量,容易引發視網膜脫離及黃斑裂孔的發生,同時加大了玻璃體視網膜交界面的剪切應力,干擾了玻璃體膠原纖維的代謝過程。研究發現,在交界面剪切力變化的影響下,玻璃體Ⅸ型膠原纖維濃度明顯降低,而Ⅱ型膠原纖維萎縮崩塌,最終導致正常玻璃體膠原纖維的網架結構破壞,從而引發早期玻璃體液化和PVD的發生[19]。
老年性黃斑變性患者玻璃體中,血管內皮生長因子(VEGF)、VEGF受體、轉化生長因子-β和白細胞介素-1β蛋白的含量均上調,色素上皮衍生因子下調[19]。另有研究發現了19種蛋白上調,蛋白種類除血漿源性的外,涵蓋有生物及離子運輸相關蛋白,急性期炎癥反應相關蛋白及凝血因子等[19]。
糖尿病(DM)對玻璃體的損傷可能先于DM視網膜病變(DR),組織學上常可發現DM早期的玻璃體液化改變。通過蛋白質譜分析,比較DM患者與正常人的玻璃體蛋白表達量,發現DM患者玻璃體蛋白含量及種類都明顯增多,并以血漿成分蛋白增多為主[20] ,其他糖酵解和糖異生相關蛋白、補體系統相關蛋白、縫隙連接蛋白和炎癥因子等表達均有升高[21]。考慮這與DM早期血視網膜屏障破壞,血管通透性改變,血漿滲漏入玻璃體腔有關。同時,玻璃體蛋白種類增多和表達增強打破了玻璃體自身代謝的平衡,部分蛋白還與正常玻璃體的膠原纖維和透明質酸進行非酶誘導的糖基化反應,重組膠原纖維結構,削弱正常玻璃體與視網膜的黏附[22]。
高血壓對眼部血管系統結構功能產生長期影響,小動脈病變是高血壓最重要的病理改變。玻璃體周圍組織的小動脈在病變早期血視網膜屏障被破壞,血漿成分滲入玻璃體腔,影響玻璃體代謝平衡。當血壓控制不佳,大量出血進入玻璃體腔形成玻璃體積血,可引起玻璃體內增生性反應,形成有新生血管的纖維血管性增生膜,導致嚴重的并發癥,如視網膜裂孔、視網膜脫離等[23]。
2.2 玻璃體結構功能改變與眼病的相關性
玻璃體主動參與白內障和視網膜等眼病的發生發展。玻璃體位于晶狀體后,發揮了維持晶狀體周邊低氧環境,防止過氧損傷,保持其透明性的重要功能。解剖上,將晶狀體及富含血管的視網膜和脈絡膜隔開,并形成梯度遞減的氧濃度結構,增加了氧彌散至晶狀體的距離。功能上,玻璃體具有眼內分子氧的代謝調節作用。抗壞血酸直接與玻璃體內氧分子進行反應,從而代謝了氧分子,降低了玻璃體內及晶狀體周圍的氧濃度[14]。當玻璃體損傷,晶狀體暴露于大量氧中,白內障病程發展就會加快[20]。 玻璃體液化所導致的PVD隨年齡增長而加重,但黃斑區及視盤區因為與玻璃體后界膜緊密黏附,導致此處的PVD晚于視網膜其他位置,形成不完全性PVD。這種差異性的PVD逐漸形成對黃斑區及視盤區視網膜前后方向的牽拉,引起視網膜扭曲、水腫、劈裂、裂孔甚至脫離[24]。在增生性玻璃體視網膜病變(PVR)中,玻璃體膠原纖維既為PVR提供了纖維支架,又可促使遷移進玻璃體的細胞纖維化。而逃逸于玻璃體的細胞又通過分泌多種蛋白因子刺激成纖維細胞增生,產生膠原纖維和纖維連接蛋白,導致增生膜的形成。目前研究者通過蛋白質譜分析發現,PVR患者玻璃體內組織蛋白酶、補體蛋白C4b、甲狀腺素運載蛋白、胰島素樣結合蛋白等均表達明顯增高[25-27]。自然玻璃體的功能遠比我們看到和想象的要復雜得多[9]。對于維持眼的正常功能至關重要,很多眼病的發生都與玻璃體的液化和變性有關。
2.3 各種干預措施對玻璃體的影響
玻璃體的干預措施主要包括激光光凝、藥物注射和玻璃體切割手術(PPV)。應用摻釹釔鋁石榴石高能量脈沖激光消融治療玻璃體混濁[28],總有效率為0%~100%[15],但對于年齡<30歲的年輕飛蚊癥患者,癥狀顯著改善的幾率不高。此類干預措施會引起玻璃體蛋白質含量、屈光指數及流變特性改變,干擾玻璃體凝膠狀態[29],手術后白內障形成[30, 31]。安全性和有效性有待評估[15]。
玻璃體腔藥物注射是目前治療許多眼底病的主要方式。藥物誘導的玻璃體溶解手術對自然玻璃體結構功能改變應納入手術前的考慮范疇之內[32]。反復玻璃體腔注射抗VEGF藥物會引起許多并發癥[33],如青光眼、RPE萎縮,血管直徑變窄,需要更長期的研究評估其安全性和有效性[34]。為了評估藥物對玻璃體氧濃度的影響,我們誘導成功兔視網膜新生血管模型,2周內,視網膜新生血管會降低晶狀體后表面、玻璃體中間部的氧濃度,而視網膜血管邊緣處玻璃體內氧濃度不變;提示其眼內氧濃度梯度增加。2周后,形成的新生血管會增加眼內氧濃度,晶狀體后表面尤為明顯。而玻璃體腔注射藥物雖然會逆轉這一趨勢,但在注藥后4~8周較長觀察時間內,玻璃體內氧濃度梯度仍明顯高于正常水平。這說明病理性新生血管狀態打破了眼內氧代謝平衡,玻璃體腔藥物注射可短期緩解,但不能從根本上恢復玻璃體自然的氧代謝平衡。
PPV是現代眼科學發展的里程碑,是目前許多玻璃體視網膜疾病的主要治療手段。但切除了全部自然玻璃體,也就喪失了自然玻璃體的調節功能,可能對眼的正常代謝造成潛在影響(圖3)[17]。這已在不少臨床研究中得到證實。如PPV后白內障、青光眼、視神經萎縮的發生率明顯升高[13, 35, 36];而視網膜脫離外路復位手術的視力預后明顯好于內路手術。盡管導致這些結果的原因很多,但自然玻璃體調控氧和相關因子的代謝功能受影響或許是其中的重要因素之一。Holekamp等[13]使用PO2探針檢測到PPV后玻璃體腔內從視網膜表面到晶狀體后表面的氧濃度梯度消失,晶狀體后表面的氧濃度從(8.7±0.6)mmHg(1 mmHg=0.133 kPa)升高至(69.6±4.8)mmHg。這種不正常的高氧可能導致白內障的發生。Shui等[14]發現,玻璃體腔中的抗壞血酸可以降低晶狀體周圍的氧濃度,保護透明晶狀體免受氧化反應。Lange等[37]檢測到增生型DR患者視網膜前的氧濃度較正常對照組明顯升高,并且與玻璃體液中檢測到的VEGF和炎癥因子的表達量成正相關。Siegfried等[35]發現,PPV后前房角的PO2明顯升高,可能會損傷小梁網細胞,與青光眼的發生有關。
 圖3
眼內氧分布模型。3A. 完整玻璃體;3B. PPV后,玻璃體腔內正常的氧梯度分布被流體循環破壞
圖3
眼內氧分布模型。3A. 完整玻璃體;3B. PPV后,玻璃體腔內正常的氧梯度分布被流體循環破壞
玻璃體不可再生,PPV后必須使用玻璃體替代物。但目前的玻璃體替代物都無法代替自然玻璃體功能并且常伴有并發癥發生。如氣體填充后白內障發生率明顯升高,而硅油填充后常有不能解釋的視神經萎縮[36, 38];長期硅油填充會影響睫狀體的分泌功能[39],造成低眼壓。玻璃體替代物對眼功能的長期影響需要進一步觀察。
3 玻璃體研究值得關注的一些問題
玻璃體結構復雜、功能精細,不可再生,難以替代。未來研究應重點關注:(1)自然玻璃體蛋白的功能。玻璃體含有1200多種不同的蛋白[22],但對其功能的研究較少。(2)自然玻璃體的氧代謝機制。我們提出假說[40],玻璃體中有序的膠原纖維網絡可能是輸送視網膜、脈絡膜血管中氧分子到眼前節的管道,保證了眼內氧濃度梯度和平衡,當發生玻璃體液化和PVD時,平衡被打破,導致眼內某部位局部的氧濃度異常積聚,引起相關眼病發生。但需要進一步的實驗證實。(3)玻璃體生物標志物作用和視網膜疾病的關系。玻璃體是全身許多疾病眼部病變的代謝物儲存庫,同時又是一些視網膜疾病的啟動觀察窗口。(4)玻璃體替代物的研究。能維持眼內代謝平衡的玻璃體替代物是眼科領域最有挑戰的課題之一。
總之,自然玻璃體并非被動存在,而是主動參與眼內代謝的功能組織。玻璃體病變是很多眼病的啟動因素。在我們沒有完全理解玻璃體功能之前,應該審慎干預,充分把握玻璃體激光消融、藥物注射、切除等治療的適應證,權衡患者的受益和風險,盡量減少對自然玻璃體結構的破壞,最大限度的保留其調控眼內代謝的功能,為未來的治療留下更多的選擇。
志謝 付月、李成和馮蕭蕭博士參與本文的資料收集和撰寫