引用本文: 張惟, 姜鑒洪, 陳松, 何廣輝, 楊婧, 馬映雪, 陳莉, 宋建. 精氨酸酶抑制劑對體外高糖培養的恒河猴視網膜微血管內皮細胞的保護作用. 中華眼底病雜志, 2017, 33(3): 281-285. doi: 10.3760/cma.j.issn.1005-1015.2017.03.014 復制
氧化應激在糖尿病視網膜病變(DR)的發生發展過程中起關鍵的調控作用,抑制DR過程中的氧化應激反應可能成為治療DR的重要方法[1]。精氨酸酶(Arg)是一種雙錳核金屬酶,是氧化應激產生的上游關鍵靶點[2]。研究表明,高糖能誘導視網膜ArgⅠ水平升高,減少一氧化氮(NO)分泌,抑制內皮依賴血管舒張功能,使內皮細胞功能失代償,從而引發DR進展[3]。Arg抑制劑可改善內皮功能失調導致的白細胞瘀滯與黏附因子表達增加,抑制局部炎癥環境改善微循環[4]。但Arg抑制劑對于視網膜血管內皮細胞的具體作用及機制尚不十分清楚。為此,本研究通過觀察恒河猴視網膜微血管內皮細胞(RF/6A細胞)經Arg特異性抑制劑N羥基-正-L精氨酸(nor-NOHA)干預后視網膜氧化應激相關因子的表達,探討了nor-NOHA對RF/6A細胞的保護作用,以期為DR的臨床防治提供實驗依據。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料、細胞培養與分組
RF/6A細胞(中國科學院細胞生化研究所);Dulbecco改良Eagle培養基(DMEM)、高糖培養基、胎牛血清(FBS)(美國Gibco公司);Trizol試劑、逆轉錄試劑盒、熒光定量聚合酶鏈反應(RT-PCR)試劑盒(大連寶生物工程技術服務有限公司);NO和白細胞介素(IL)-1b酶鏈免疫吸附測定試驗(ELISA)試劑盒(上海依科賽生物技術公司);Matrigel基質膠(美國BD公司)。
RF/6A細胞株接種于含10% FBS、100×103 U/ml青霉素、100 mg/ml鏈霉素的DMEM培養液中,置于37℃、5%CO2的培養箱中培養,每3~4天換液傳代,取對數生長期3~6代細胞用于實驗。以細胞密度10×105個/孔分別接種于6孔板中,培養24 h后棄上清液,每孔加入無血清DMEM培養液饑餓培養24 h后,將細胞分為正常對照組(A組)、高糖對照組(B組)、高糖+nor-NOHA處理組(C組)、高糖+二甲基亞砜(DMSO)對照組(D組)。A~D組細胞分別以5.5 mmol/L葡萄糖、25.0 mmol/L葡萄糖、25.0 mmol/L葡萄糖及125 mg/L的nor-NOHA、25.0 mmol/L葡萄糖及1%DMSO繼續培養24 h。
1.2 RF/6A細胞增生、遷移及管腔形成能力檢測
參照文獻[5]的方法行RF/6A細胞增生、遷移及管腔形成能力檢測。采用噻唑藍(MTT)比色法檢測各組RF/6A細胞的增生能力。收集各組RF/6A細胞,調整細胞濃度為2×108個/L,將細胞接種到包被有纖維粘連蛋白的96孔培養板,每孔加細胞懸液100 μl培養12 h使細胞貼壁。每孔加5 g/L的MTT 10 μl,培養4 h后以150 μl/孔的劑量加入DMSO,微量震蕩器震搖10 min,置于酶標儀上于波長490 nm處測量吸光度[A,舊稱光密度(OD)]值。
采用Transwell小室法檢測各組RF/6A細胞的遷移能力。收集各組RF/6A細胞,將1200 μl培養液和50 μg/L的血管內皮生長因子加入遷移小室的下室,將含有2×104個RF/6A細胞的200 μl培養液注入上室,培養24 h后,去除濾膜上面的未移動細胞,用40 g/L多聚甲醛固定,4,6-聯脒-2-苯基吲哚熒光染色,倒置顯微鏡下隨機選擇3個200倍顯微鏡視野計數遷移到底層的細胞。
采用體外成管實驗檢測各組RF/6A細胞的管腔形成能力。將Matrigel基質膠室溫下放置2 h使其完全溶解,用預冷的200 μl加樣槍頭將Matrigel基質膠均勻鋪在預冷的96孔板內,每孔30 μl,37℃培養箱內放置1 h,使其完全凝固。含10%FBS的DMEM高糖培養液懸浮RF/6A細胞,等量接種到Matrigel基質膠上。置于37℃、5%CO2、飽和濕度的培養箱中培養8 h,光學顯微鏡400倍鏡下每組隨機取4個視野,雙盲法計數閉合管的個數。
1.3 RT-PCR及ELISA檢測
參照文獻[6]的方法采用RT-PCR檢測ArgⅠ、內皮型NO合酶(eNOS)及誘導型NO合酶(iNOS)的mRNA相對表達量。采用Trizol一步法提取細胞總RNA,紫外線吸收法測定RNA純度,按逆轉錄試劑盒的操作說明逆轉錄合成cDNA,以cDNA為模板進行擴增,總反應體系為50 μl。運用Primer Premier 5.0軟件設計引物。ArgⅠ:上游引物5′-TTCACCCGGAGCAG TGAT-3′,下游引物5′-GCCTCCAGAATTGTGTTTGAG-3′,擴增片段長度為143堿基對(bp);eNOS:上游引物5′-CTATGCAGATCATGCGGATCA-3′,下游引物5′-TATGCTG CAGGAAGCTCATCTC-3′,擴增片段長度為172 bp;iNOS:上游引物5′-GGGAGCCAGAGCAGTACAAG-3′ ,下游引物5′-CATGGTGAACACGTTCTTGG-3′,擴增片段長度為113 bp;β-肌動蛋白(β-actin):上游引物5′-TGACGTGGACATCCGCAAAG -3′,下游引物5′-CTGGAAGGTGGACAGCGAGG-3′,擴增片段長度為102 bp。反應條件:95℃ 15 s,57℃ 30 s,74℃ 30 s。變性、退火、延伸重復45個循環。將得到的各組循環閾值(CT)數據分別與各自內參照分析處理后,采用2–△△CT法計算目的基因mRNA相對表達量。
采用ELISA檢測各組RF/6A細胞培養上清液中NO、IL-1b的分泌量。取細胞培養上清液,以離心半徑4.5 cm、轉速6000 r/min離心5 min,每組設3個副孔。采用雙抗體夾心ELISA法,按照NO和IL-1b ELISA試劑盒說明書在室溫條件下完成所有操作,樣品測定時未進行稀釋。酶標儀450 nm波長讀取A值,待測樣本的A值在標準曲線上查出該樣本的NO和IL-1b水平對應值。實驗重復3次,取平均值。
1.4 統計學方法
采用SPSS 10.0軟件進行統計學分析,計量數據以均數±標準差( )表示。多組間比較應用單因素方差分析;組間兩兩比較,若方差齊應用最小顯著差法t 檢驗;若方差不齊,應用Dunnett-t檢驗。P<0.05為差異有統計學意義。
2 結果
4組間RF/6A細胞增生、凋亡及管腔形成能力比較,差異均有統計學意義(F=23.42、40.15、32.53,P=0.000、0.000、0.000)(表1)。組間兩兩比較,B組RF/6A細胞增生、凋亡及管腔形成能力較A組明顯降低,差異有統計學意義(t=2.367、5.633、7.045,P<0.05);C組RF/6A細胞增生、凋亡及管腔形成能力較B組提高,差異有統計學意義(t=5.260、6.952、8.875,P<0.05);D組與B組RF/6A細胞增生、凋亡及管腔形成能力比較,差異無統計學意義(t=-0.112、0.614、0.742,P>0.05)。
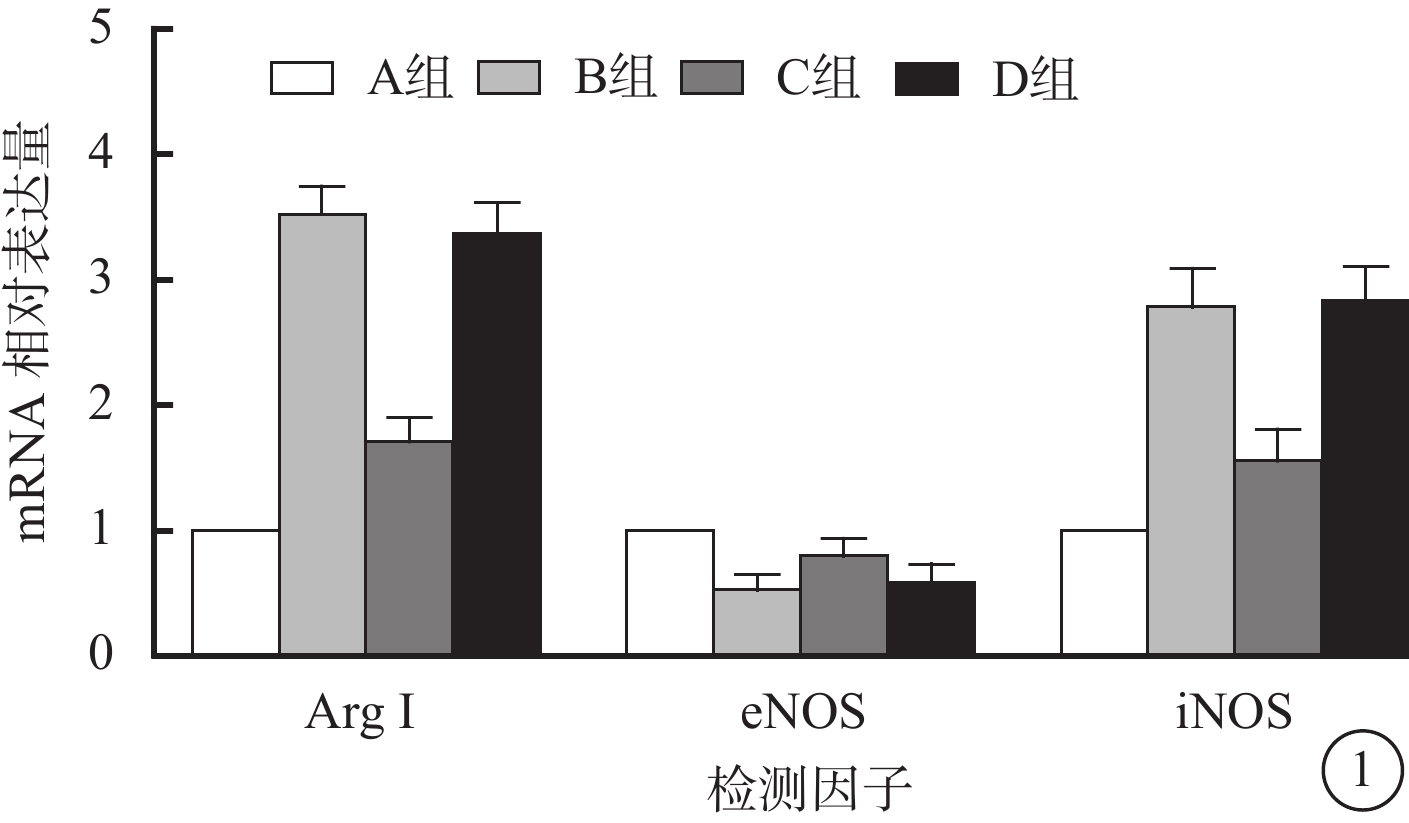
RT-PCR檢測結果顯示,與A組比較,B組RF/6A細胞中ArgⅠ、iNOS mRNA相對表達量升高(t=6.836、3.342),C組RF/6A細胞中ArgⅠ、iNOS mRNA相對表達量降低(t=4.904、7.192),差異均有統計學意義(P<0.05)。與A組比較,B組RF/6A細胞中eNOS mRNA相對表達量降低,C組RF/6A細胞中eNOS mRNA相對表達量升高,差異均有統計學意義(t=4.165、6.594,P<0.05)。D組與B組RF/6A細胞中ArgⅠ、eNOS、iNOS mRNA相對表達量比較,差異均無統計學意義(t=–1.735、0.897、0.318,P>0.05)(圖1)。
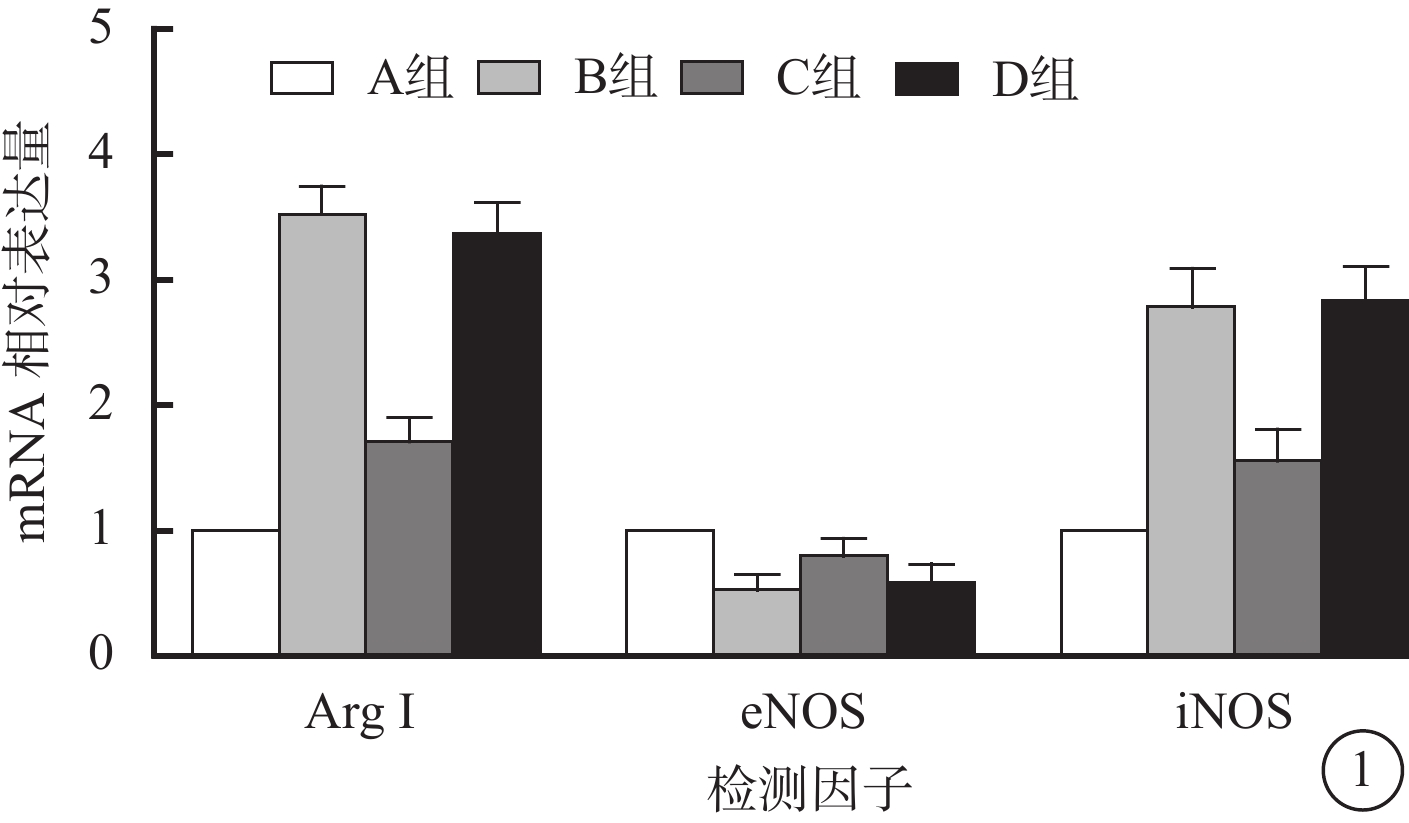 圖1
4組RF/6A細胞中Arg、eNOS、iNOS mRNA相對表達量比較
圖1
4組RF/6A細胞中Arg、eNOS、iNOS mRNA相對表達量比較
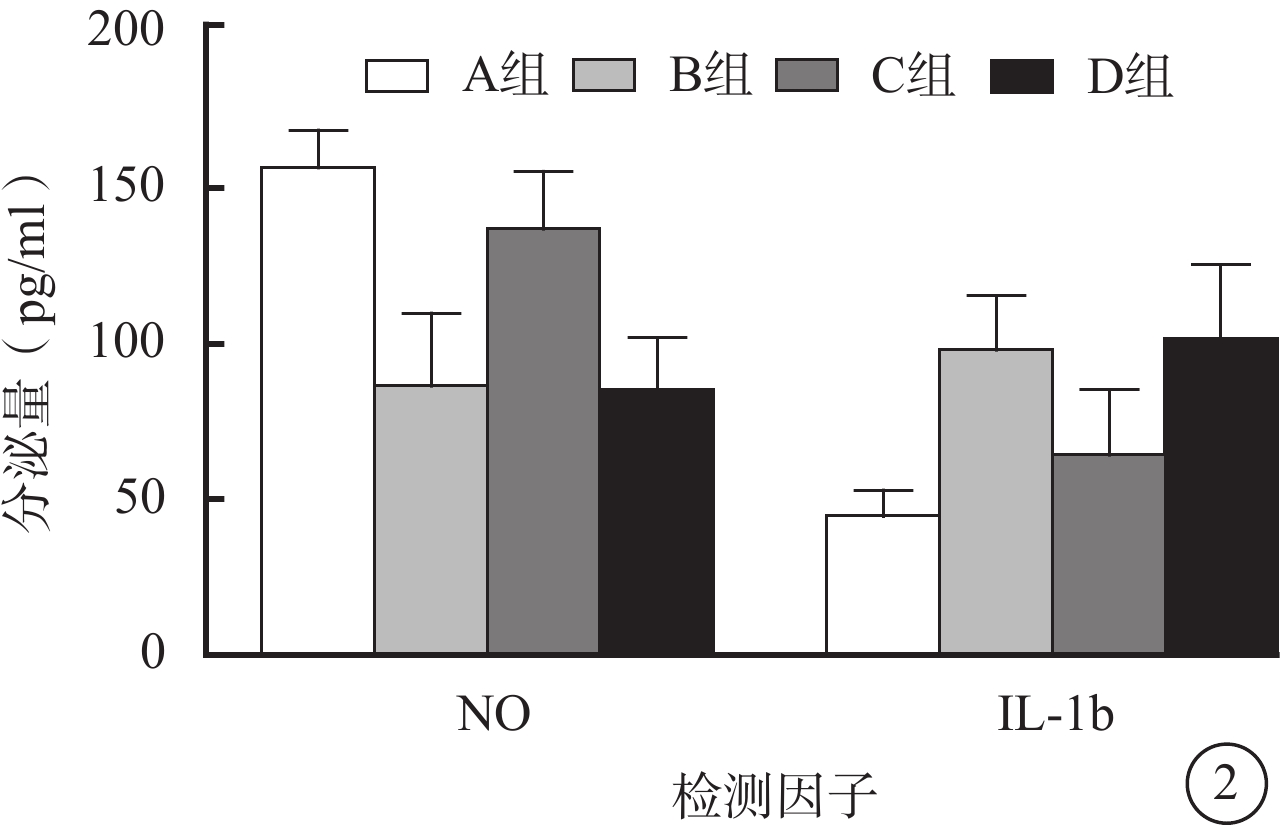
ELISA檢測結果顯示,與A組比較,B組RF/6A細胞培養上清液中NO分泌量減少,C組RF/6A細胞培養上清液中NO分泌量增多,差異均有統計學意義(t=4.925、5.368,P<0.05);B組RF/6A細胞培養上清液中IL-1b分泌量增多,C組RF/6A細胞培養上清液中IL-1b分泌量減少,差異均有統計學意義(t=5.032、7.792,P<0.05)。D組與B組RF/6A細胞培養上清液中NO、IL-1b分泌量比較,差異均無統計學意義(t=0.625、-0.147,P>0.05)(圖2)。
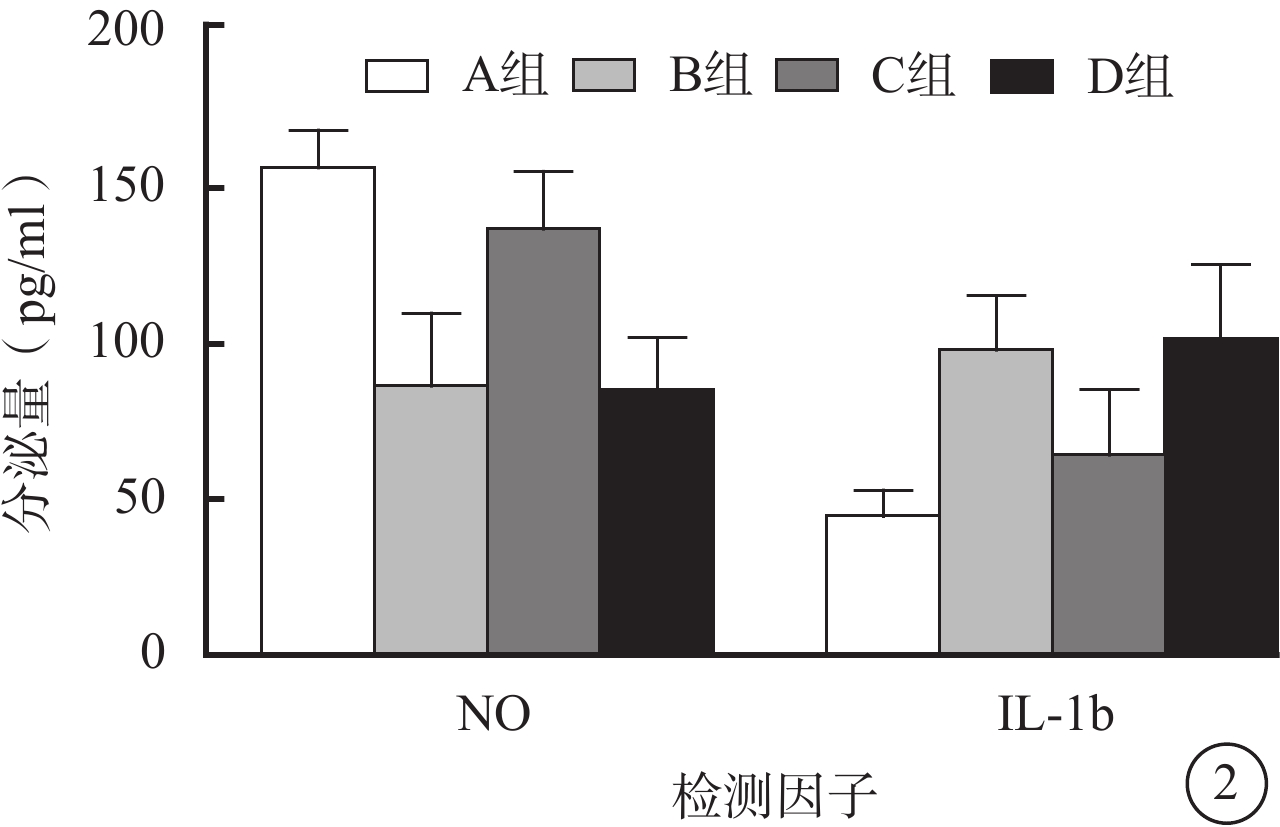 圖2
4組RF/6A細胞培養上清液中NO、IL-1b分泌量比較
圖2
4組RF/6A細胞培養上清液中NO、IL-1b分泌量比較
3 討論
Arg通過與NOS競爭底物L-精氨酸,對調節NO的釋放具有重要意義;與血管功能紊亂及由此發生的疾病有密切關系[7]。根據Arg的亞細胞定位、組織分布及免疫反應性的不同,Arg可分為Ⅰ型和Ⅱ型,兩者的氨基酸序列約有60%的同源性。ArgⅠ主要位于細胞質中,在肝臟中表達很高,可將精氨酸代謝為鳥氨酸和尿素對體內氨解毒起重要作用[8]。ArgⅡ主要在多種組織包括腸、腎、腦、內皮、乳腺以及巨噬細胞中表達。研究表明,ArgⅠ可與eNOS競爭L-精氨酸,從而影響eNOS/NO通路中NO的合成[9]。Elms等[10]發現,DR能誘導視網膜ArgⅠ水平升高,并且在視網膜血管內皮細胞、神經節細胞等可見大量ArgⅠ表達,增多的ArgⅠ減少NO分泌量抑制內皮依賴血管舒張功能,使內皮細胞功能失代償引發DR進展。Romero等[11]發現,ArgⅠ基因敲除鼠發生DR的幾率降低,證明抑制ArgⅠ表達可以減輕DR的病變程度。Patel等[12]發現,DR時期視網膜ArgⅠ表達增高,而ArgⅡ表達未見明顯增加;阻斷ArgⅠ即可阻止視網膜氧化損傷和血管內皮細胞凋亡,表明ArgⅠ在促進氧化應激反應中起到至關重要的作用。本研究結果顯示,高糖環境RF/6A細胞中ArgⅠ表達升高,eNOS/iNOS表達失衡,進而發現RF/6A細胞增生、遷移及管腔形成能力受損,與既往研究結果相符。說明高糖環境誘發ArgⅠ表達上調后激發氧化應激反應,破壞RF/6A細胞功能。
nor-NOHA是根據Arg的晶體結構和其活性部位合成的Arg強效選擇性競爭抑制劑,其特點是有N-羥基-胍鹽側鏈。有研究應用X衍射分析其晶體結構,發現nor-NOHA通過N-羥基團取代Arg的金屬橋接氫氧根離子來抑制Arg表達,其抑制Arg效果比nor-NOHA高40倍[13]。本研究通過預實驗發現,濃度為125 mg/L的nor-NOHA作用24 h后可以抑制細胞活性氧表達增高。因此本研究選擇濃度為125 mg/L的nor-NOHA對體外高糖培養的RF/6A細胞進行干預,結果顯示nor-NOHA能提高RF/6A細胞增生、遷移及管腔形成功能,并抑制炎性因子IL-1b的分泌,促進血管保護因子NO的分泌。這說明nor-NOHA可以增強高糖環境下RF/6A的抗氧化活性;RF/6A細胞的增生、遷移及管腔形成功能與其參與修復受損血管直接相關。表明nor-NOHA對RF/6A細胞有直接的保護調節作用。
K?vamees等[14]發現,nor-NOHA可治療冠心病患者缺血再灌注誘導的血管內皮損傷,改善血管阻力的反應性,提示nor-NOHA可作為血管重塑治療的一個新靶點。DR的特性之一就是NO介導的內皮依賴性血管舒張功能減退,伴隨正常的抗凝、抗細胞黏附和抗氧化的機能減弱。nor-NOHA能介導Arg-NOS靶點促進NO生成,抑制氧化應激反應,使細胞因子和趨化因子生成減少,抑制免疫細胞聚集到血管壁[15]。已有研究表明,nor-NOHA在功能化血管重塑中起重要促進作用[16]。本研究結果顯示,nor-NOHA可下調ArgⅠ的表達抑制氧化應激反應,介導eNOS/iNOS信號通路促進視網膜血管內皮細胞修復。這提示nor-NOHA與視網膜功能化血管重塑有重要關系。
本研究結果表明,nor-NOHA可通過平衡Arg/NOS的表達抑制氧化應激反應,對RF/6A細胞發揮保護作用。但本研究由于條件限制樣本量較小,宜再擴大樣本量、延長觀察時間進行下一步的研究以排除誤差對實驗結果的影響。此外,nor-NOHA對RF/6A細胞保護作用的分子生物學機制尚需進一步的研究和探討。
讀者?作者?編者 關于志謝著錄的注意事項 在文后志謝是表示感謝并記錄在案的意思。對給予實質性幫助而又不能列為作者的單位或個人應在文后給予志謝。被志謝者包括:(1)對研究提供資助的單位和個人、合作單位。(2)協助完成研究工作和提供便利條件的組織和個人。(3)協助診斷和提出重要建議的人。(4)給予轉載和引用權的資料、圖片、文獻、研究思想和設想的所有者。(5)做出貢獻但不能成為作者的人,如提供技術幫助和給予財力、物力支持的人,闡明其支援的性質。(6)其他需志謝者。 志謝必須征得被志謝人的書面同意。志謝應避免的傾向:(1)對確實給予了幫助的單位或個人,甚至用了他人的方法、思路、資料,為了搶先發表,而不公開志謝和說明。(2)出于某種考慮,將應被志謝人放在作者的位置上,混淆了作者和被志謝者的權利和義務。(3)以名人、知名專家包裝自己的論文,抬高論文的身份,將未曾參與工作的,也未閱讀過該論文的知名專家寫在志謝中。 關于參考文獻著錄的要求 1 參考文獻為中文時,雙語著錄 用雙語著錄參考文獻時,首先應用信息資源的原語種,然后用其他語種著錄。中文刊名使用其刊名的英文簡稱,不使用漢語拼音名稱,無規范英文簡稱者著錄全部英文刊名。 示例: [1]馬楠,陳有信,鞏迪,等. 息肉樣脈絡膜血管病變吲哚青綠血管造影與光相干斷層掃描血管成像圖像特征對比觀察[J].中華眼底病雜志, 2015, 31(5): 421-424. Ma Nan, Chen Youxin, Gong Di, et al. Comparative observation of indocyanine green angiography and optical coherence tomography angiography in polypoidal choroidal vasculopathy[J]. Chin J Ocul Fundus Dis, 2015, 31(5): 421-424. 2 有DOI編碼的文章必須著錄DOI,列于該條文獻末尾 示例: [1]馬楠,陳有信,鞏迪,等. 息肉樣脈絡膜血管病變吲哚青綠血管造影與光相干斷層掃描血管成像圖像特征對比觀察[J]. 中華眼底病雜志, 2015, 31(5): 421-424. DOI: 10.3760/ cma.j.issn.1005-1015.2015.05.003. 本刊編輯部
氧化應激在糖尿病視網膜病變(DR)的發生發展過程中起關鍵的調控作用,抑制DR過程中的氧化應激反應可能成為治療DR的重要方法[1]。精氨酸酶(Arg)是一種雙錳核金屬酶,是氧化應激產生的上游關鍵靶點[2]。研究表明,高糖能誘導視網膜ArgⅠ水平升高,減少一氧化氮(NO)分泌,抑制內皮依賴血管舒張功能,使內皮細胞功能失代償,從而引發DR進展[3]。Arg抑制劑可改善內皮功能失調導致的白細胞瘀滯與黏附因子表達增加,抑制局部炎癥環境改善微循環[4]。但Arg抑制劑對于視網膜血管內皮細胞的具體作用及機制尚不十分清楚。為此,本研究通過觀察恒河猴視網膜微血管內皮細胞(RF/6A細胞)經Arg特異性抑制劑N羥基-正-L精氨酸(nor-NOHA)干預后視網膜氧化應激相關因子的表達,探討了nor-NOHA對RF/6A細胞的保護作用,以期為DR的臨床防治提供實驗依據。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料、細胞培養與分組
RF/6A細胞(中國科學院細胞生化研究所);Dulbecco改良Eagle培養基(DMEM)、高糖培養基、胎牛血清(FBS)(美國Gibco公司);Trizol試劑、逆轉錄試劑盒、熒光定量聚合酶鏈反應(RT-PCR)試劑盒(大連寶生物工程技術服務有限公司);NO和白細胞介素(IL)-1b酶鏈免疫吸附測定試驗(ELISA)試劑盒(上海依科賽生物技術公司);Matrigel基質膠(美國BD公司)。
RF/6A細胞株接種于含10% FBS、100×103 U/ml青霉素、100 mg/ml鏈霉素的DMEM培養液中,置于37℃、5%CO2的培養箱中培養,每3~4天換液傳代,取對數生長期3~6代細胞用于實驗。以細胞密度10×105個/孔分別接種于6孔板中,培養24 h后棄上清液,每孔加入無血清DMEM培養液饑餓培養24 h后,將細胞分為正常對照組(A組)、高糖對照組(B組)、高糖+nor-NOHA處理組(C組)、高糖+二甲基亞砜(DMSO)對照組(D組)。A~D組細胞分別以5.5 mmol/L葡萄糖、25.0 mmol/L葡萄糖、25.0 mmol/L葡萄糖及125 mg/L的nor-NOHA、25.0 mmol/L葡萄糖及1%DMSO繼續培養24 h。
1.2 RF/6A細胞增生、遷移及管腔形成能力檢測
參照文獻[5]的方法行RF/6A細胞增生、遷移及管腔形成能力檢測。采用噻唑藍(MTT)比色法檢測各組RF/6A細胞的增生能力。收集各組RF/6A細胞,調整細胞濃度為2×108個/L,將細胞接種到包被有纖維粘連蛋白的96孔培養板,每孔加細胞懸液100 μl培養12 h使細胞貼壁。每孔加5 g/L的MTT 10 μl,培養4 h后以150 μl/孔的劑量加入DMSO,微量震蕩器震搖10 min,置于酶標儀上于波長490 nm處測量吸光度[A,舊稱光密度(OD)]值。
采用Transwell小室法檢測各組RF/6A細胞的遷移能力。收集各組RF/6A細胞,將1200 μl培養液和50 μg/L的血管內皮生長因子加入遷移小室的下室,將含有2×104個RF/6A細胞的200 μl培養液注入上室,培養24 h后,去除濾膜上面的未移動細胞,用40 g/L多聚甲醛固定,4,6-聯脒-2-苯基吲哚熒光染色,倒置顯微鏡下隨機選擇3個200倍顯微鏡視野計數遷移到底層的細胞。
采用體外成管實驗檢測各組RF/6A細胞的管腔形成能力。將Matrigel基質膠室溫下放置2 h使其完全溶解,用預冷的200 μl加樣槍頭將Matrigel基質膠均勻鋪在預冷的96孔板內,每孔30 μl,37℃培養箱內放置1 h,使其完全凝固。含10%FBS的DMEM高糖培養液懸浮RF/6A細胞,等量接種到Matrigel基質膠上。置于37℃、5%CO2、飽和濕度的培養箱中培養8 h,光學顯微鏡400倍鏡下每組隨機取4個視野,雙盲法計數閉合管的個數。
1.3 RT-PCR及ELISA檢測
參照文獻[6]的方法采用RT-PCR檢測ArgⅠ、內皮型NO合酶(eNOS)及誘導型NO合酶(iNOS)的mRNA相對表達量。采用Trizol一步法提取細胞總RNA,紫外線吸收法測定RNA純度,按逆轉錄試劑盒的操作說明逆轉錄合成cDNA,以cDNA為模板進行擴增,總反應體系為50 μl。運用Primer Premier 5.0軟件設計引物。ArgⅠ:上游引物5′-TTCACCCGGAGCAG TGAT-3′,下游引物5′-GCCTCCAGAATTGTGTTTGAG-3′,擴增片段長度為143堿基對(bp);eNOS:上游引物5′-CTATGCAGATCATGCGGATCA-3′,下游引物5′-TATGCTG CAGGAAGCTCATCTC-3′,擴增片段長度為172 bp;iNOS:上游引物5′-GGGAGCCAGAGCAGTACAAG-3′ ,下游引物5′-CATGGTGAACACGTTCTTGG-3′,擴增片段長度為113 bp;β-肌動蛋白(β-actin):上游引物5′-TGACGTGGACATCCGCAAAG -3′,下游引物5′-CTGGAAGGTGGACAGCGAGG-3′,擴增片段長度為102 bp。反應條件:95℃ 15 s,57℃ 30 s,74℃ 30 s。變性、退火、延伸重復45個循環。將得到的各組循環閾值(CT)數據分別與各自內參照分析處理后,采用2–△△CT法計算目的基因mRNA相對表達量。
采用ELISA檢測各組RF/6A細胞培養上清液中NO、IL-1b的分泌量。取細胞培養上清液,以離心半徑4.5 cm、轉速6000 r/min離心5 min,每組設3個副孔。采用雙抗體夾心ELISA法,按照NO和IL-1b ELISA試劑盒說明書在室溫條件下完成所有操作,樣品測定時未進行稀釋。酶標儀450 nm波長讀取A值,待測樣本的A值在標準曲線上查出該樣本的NO和IL-1b水平對應值。實驗重復3次,取平均值。
1.4 統計學方法
采用SPSS 10.0軟件進行統計學分析,計量數據以均數±標準差( )表示。多組間比較應用單因素方差分析;組間兩兩比較,若方差齊應用最小顯著差法t 檢驗;若方差不齊,應用Dunnett-t檢驗。P<0.05為差異有統計學意義。
2 結果
4組間RF/6A細胞增生、凋亡及管腔形成能力比較,差異均有統計學意義(F=23.42、40.15、32.53,P=0.000、0.000、0.000)(表1)。組間兩兩比較,B組RF/6A細胞增生、凋亡及管腔形成能力較A組明顯降低,差異有統計學意義(t=2.367、5.633、7.045,P<0.05);C組RF/6A細胞增生、凋亡及管腔形成能力較B組提高,差異有統計學意義(t=5.260、6.952、8.875,P<0.05);D組與B組RF/6A細胞增生、凋亡及管腔形成能力比較,差異無統計學意義(t=-0.112、0.614、0.742,P>0.05)。
RT-PCR檢測結果顯示,與A組比較,B組RF/6A細胞中ArgⅠ、iNOS mRNA相對表達量升高(t=6.836、3.342),C組RF/6A細胞中ArgⅠ、iNOS mRNA相對表達量降低(t=4.904、7.192),差異均有統計學意義(P<0.05)。與A組比較,B組RF/6A細胞中eNOS mRNA相對表達量降低,C組RF/6A細胞中eNOS mRNA相對表達量升高,差異均有統計學意義(t=4.165、6.594,P<0.05)。D組與B組RF/6A細胞中ArgⅠ、eNOS、iNOS mRNA相對表達量比較,差異均無統計學意義(t=–1.735、0.897、0.318,P>0.05)(圖1)。
 圖1
4組RF/6A細胞中Arg、eNOS、iNOS mRNA相對表達量比較
圖1
4組RF/6A細胞中Arg、eNOS、iNOS mRNA相對表達量比較
ELISA檢測結果顯示,與A組比較,B組RF/6A細胞培養上清液中NO分泌量減少,C組RF/6A細胞培養上清液中NO分泌量增多,差異均有統計學意義(t=4.925、5.368,P<0.05);B組RF/6A細胞培養上清液中IL-1b分泌量增多,C組RF/6A細胞培養上清液中IL-1b分泌量減少,差異均有統計學意義(t=5.032、7.792,P<0.05)。D組與B組RF/6A細胞培養上清液中NO、IL-1b分泌量比較,差異均無統計學意義(t=0.625、-0.147,P>0.05)(圖2)。
 圖2
4組RF/6A細胞培養上清液中NO、IL-1b分泌量比較
圖2
4組RF/6A細胞培養上清液中NO、IL-1b分泌量比較
3 討論
Arg通過與NOS競爭底物L-精氨酸,對調節NO的釋放具有重要意義;與血管功能紊亂及由此發生的疾病有密切關系[7]。根據Arg的亞細胞定位、組織分布及免疫反應性的不同,Arg可分為Ⅰ型和Ⅱ型,兩者的氨基酸序列約有60%的同源性。ArgⅠ主要位于細胞質中,在肝臟中表達很高,可將精氨酸代謝為鳥氨酸和尿素對體內氨解毒起重要作用[8]。ArgⅡ主要在多種組織包括腸、腎、腦、內皮、乳腺以及巨噬細胞中表達。研究表明,ArgⅠ可與eNOS競爭L-精氨酸,從而影響eNOS/NO通路中NO的合成[9]。Elms等[10]發現,DR能誘導視網膜ArgⅠ水平升高,并且在視網膜血管內皮細胞、神經節細胞等可見大量ArgⅠ表達,增多的ArgⅠ減少NO分泌量抑制內皮依賴血管舒張功能,使內皮細胞功能失代償引發DR進展。Romero等[11]發現,ArgⅠ基因敲除鼠發生DR的幾率降低,證明抑制ArgⅠ表達可以減輕DR的病變程度。Patel等[12]發現,DR時期視網膜ArgⅠ表達增高,而ArgⅡ表達未見明顯增加;阻斷ArgⅠ即可阻止視網膜氧化損傷和血管內皮細胞凋亡,表明ArgⅠ在促進氧化應激反應中起到至關重要的作用。本研究結果顯示,高糖環境RF/6A細胞中ArgⅠ表達升高,eNOS/iNOS表達失衡,進而發現RF/6A細胞增生、遷移及管腔形成能力受損,與既往研究結果相符。說明高糖環境誘發ArgⅠ表達上調后激發氧化應激反應,破壞RF/6A細胞功能。
nor-NOHA是根據Arg的晶體結構和其活性部位合成的Arg強效選擇性競爭抑制劑,其特點是有N-羥基-胍鹽側鏈。有研究應用X衍射分析其晶體結構,發現nor-NOHA通過N-羥基團取代Arg的金屬橋接氫氧根離子來抑制Arg表達,其抑制Arg效果比nor-NOHA高40倍[13]。本研究通過預實驗發現,濃度為125 mg/L的nor-NOHA作用24 h后可以抑制細胞活性氧表達增高。因此本研究選擇濃度為125 mg/L的nor-NOHA對體外高糖培養的RF/6A細胞進行干預,結果顯示nor-NOHA能提高RF/6A細胞增生、遷移及管腔形成功能,并抑制炎性因子IL-1b的分泌,促進血管保護因子NO的分泌。這說明nor-NOHA可以增強高糖環境下RF/6A的抗氧化活性;RF/6A細胞的增生、遷移及管腔形成功能與其參與修復受損血管直接相關。表明nor-NOHA對RF/6A細胞有直接的保護調節作用。
K?vamees等[14]發現,nor-NOHA可治療冠心病患者缺血再灌注誘導的血管內皮損傷,改善血管阻力的反應性,提示nor-NOHA可作為血管重塑治療的一個新靶點。DR的特性之一就是NO介導的內皮依賴性血管舒張功能減退,伴隨正常的抗凝、抗細胞黏附和抗氧化的機能減弱。nor-NOHA能介導Arg-NOS靶點促進NO生成,抑制氧化應激反應,使細胞因子和趨化因子生成減少,抑制免疫細胞聚集到血管壁[15]。已有研究表明,nor-NOHA在功能化血管重塑中起重要促進作用[16]。本研究結果顯示,nor-NOHA可下調ArgⅠ的表達抑制氧化應激反應,介導eNOS/iNOS信號通路促進視網膜血管內皮細胞修復。這提示nor-NOHA與視網膜功能化血管重塑有重要關系。
本研究結果表明,nor-NOHA可通過平衡Arg/NOS的表達抑制氧化應激反應,對RF/6A細胞發揮保護作用。但本研究由于條件限制樣本量較小,宜再擴大樣本量、延長觀察時間進行下一步的研究以排除誤差對實驗結果的影響。此外,nor-NOHA對RF/6A細胞保護作用的分子生物學機制尚需進一步的研究和探討。
讀者?作者?編者 關于志謝著錄的注意事項 在文后志謝是表示感謝并記錄在案的意思。對給予實質性幫助而又不能列為作者的單位或個人應在文后給予志謝。被志謝者包括:(1)對研究提供資助的單位和個人、合作單位。(2)協助完成研究工作和提供便利條件的組織和個人。(3)協助診斷和提出重要建議的人。(4)給予轉載和引用權的資料、圖片、文獻、研究思想和設想的所有者。(5)做出貢獻但不能成為作者的人,如提供技術幫助和給予財力、物力支持的人,闡明其支援的性質。(6)其他需志謝者。 志謝必須征得被志謝人的書面同意。志謝應避免的傾向:(1)對確實給予了幫助的單位或個人,甚至用了他人的方法、思路、資料,為了搶先發表,而不公開志謝和說明。(2)出于某種考慮,將應被志謝人放在作者的位置上,混淆了作者和被志謝者的權利和義務。(3)以名人、知名專家包裝自己的論文,抬高論文的身份,將未曾參與工作的,也未閱讀過該論文的知名專家寫在志謝中。 關于參考文獻著錄的要求 1 參考文獻為中文時,雙語著錄 用雙語著錄參考文獻時,首先應用信息資源的原語種,然后用其他語種著錄。中文刊名使用其刊名的英文簡稱,不使用漢語拼音名稱,無規范英文簡稱者著錄全部英文刊名。 示例: [1]馬楠,陳有信,鞏迪,等. 息肉樣脈絡膜血管病變吲哚青綠血管造影與光相干斷層掃描血管成像圖像特征對比觀察[J].中華眼底病雜志, 2015, 31(5): 421-424. Ma Nan, Chen Youxin, Gong Di, et al. Comparative observation of indocyanine green angiography and optical coherence tomography angiography in polypoidal choroidal vasculopathy[J]. Chin J Ocul Fundus Dis, 2015, 31(5): 421-424. 2 有DOI編碼的文章必須著錄DOI,列于該條文獻末尾 示例: [1]馬楠,陳有信,鞏迪,等. 息肉樣脈絡膜血管病變吲哚青綠血管造影與光相干斷層掃描血管成像圖像特征對比觀察[J]. 中華眼底病雜志, 2015, 31(5): 421-424. DOI: 10.3760/ cma.j.issn.1005-1015.2015.05.003. 本刊編輯部