引用本文: 曹丹, 費文雷, 楊大衛, 張良. 異基因骨髓造血干細胞移植手術后巨細胞病毒視網膜炎一例. 中華眼底病雜志, 2017, 33(2): 195-196. doi: 10.3760/cma.j.issn.1005-1015.2017.02.021 復制
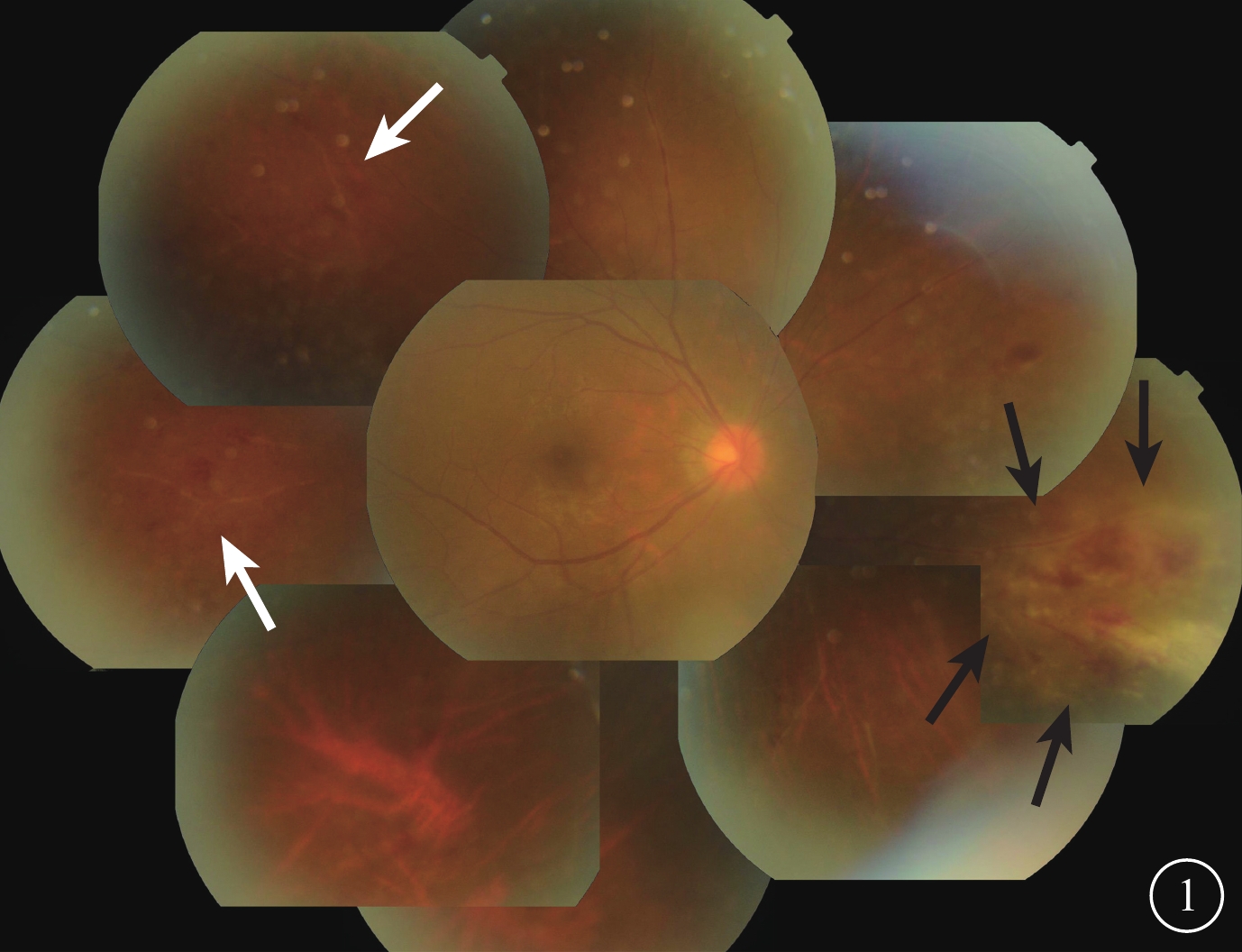
患者男,26歲。2015年8月在我院診斷為急性淋巴細胞性白血病(B細胞型)。2016年2月在我院行異基因骨髓造血干細胞移植手術;其父親作為單倍體供者,人類白細胞抗原配型5/10相合。移植手術前患者及供體血清巨細胞病毒(CMV)DNA檢測均為陰性。患者骨髓移植手術前眼科檢查雙眼眼底未見異常。2月27日回輸4/6相合女嬰臍帶血;2月27~29日連續3 d回輸其父親半相合外周干細胞210 ml。3月7、9日即骨髓移植手術后8、10 d血小板、白細胞分別植入。3月2日患者出現口腔潰瘍并逐漸加重,伴發熱,給予全身抗感染治療后感染癥狀好轉。3月24日常規行血清及尿CMV-DNA檢測,血清CMV-DNA陰性,尿CMV-DNA載量為1730 拷貝/ml;考慮為CMV尿癥,給予更昔洛韋250 mg靜脈滴注,1次/12 h。3月28日復查尿CMV-DNA載量下降至932 拷貝/ml。4月1日患者出現右眼紅、視力下降。眼部檢查:右眼最佳矯正視力(BCVA)0.3,左眼BCVA 1.0;眼壓:右眼20 mmHg(1 mmHg=0.133 kPa),左眼18 mmHg。右眼角膜后沉著物(+),房水閃輝(+);玻璃體混濁(++)。眼底視盤邊界清楚,杯盤比0.3;鼻側、鼻下方周邊部視網膜可見沿血管分布片狀黃白色病灶伴出血,顳上方及顳側周邊部視網膜血管白鞘,黃斑中心凹反光不清(圖1)。左眼眼前后節檢查未見異常。診斷:右眼CMV視網膜炎(CMVR)。
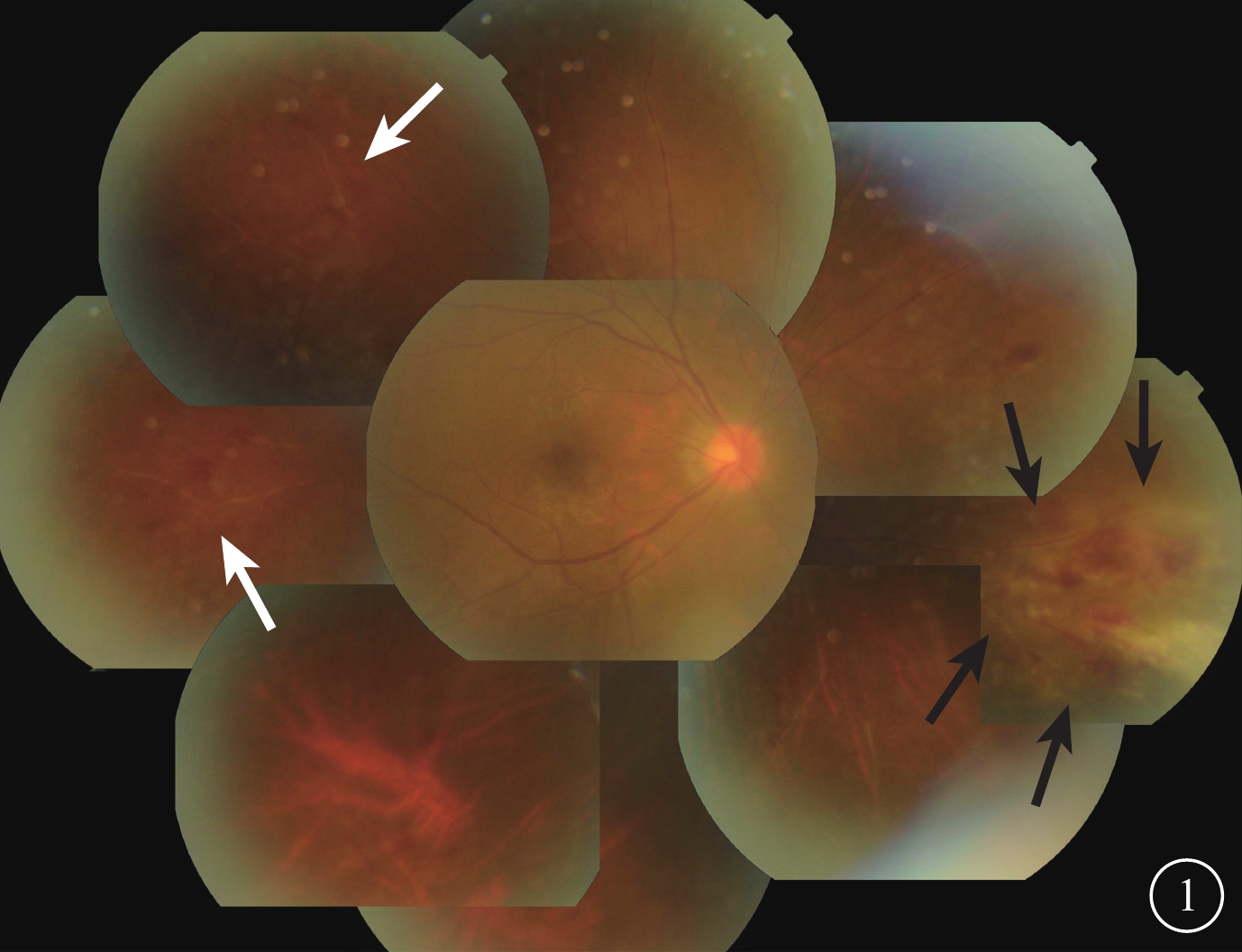 圖1
右眼彩色眼底像。鼻側、鼻下方周邊部視網膜可見片狀黃白色滲出及出血,病灶沿血管分布、鄰近視網膜水腫(黑箭),顳上方及顳側周邊部視網膜血管白鞘(白箭)
圖1
右眼彩色眼底像。鼻側、鼻下方周邊部視網膜可見片狀黃白色滲出及出血,病灶沿血管分布、鄰近視網膜水腫(黑箭),顳上方及顳側周邊部視網膜血管白鞘(白箭)
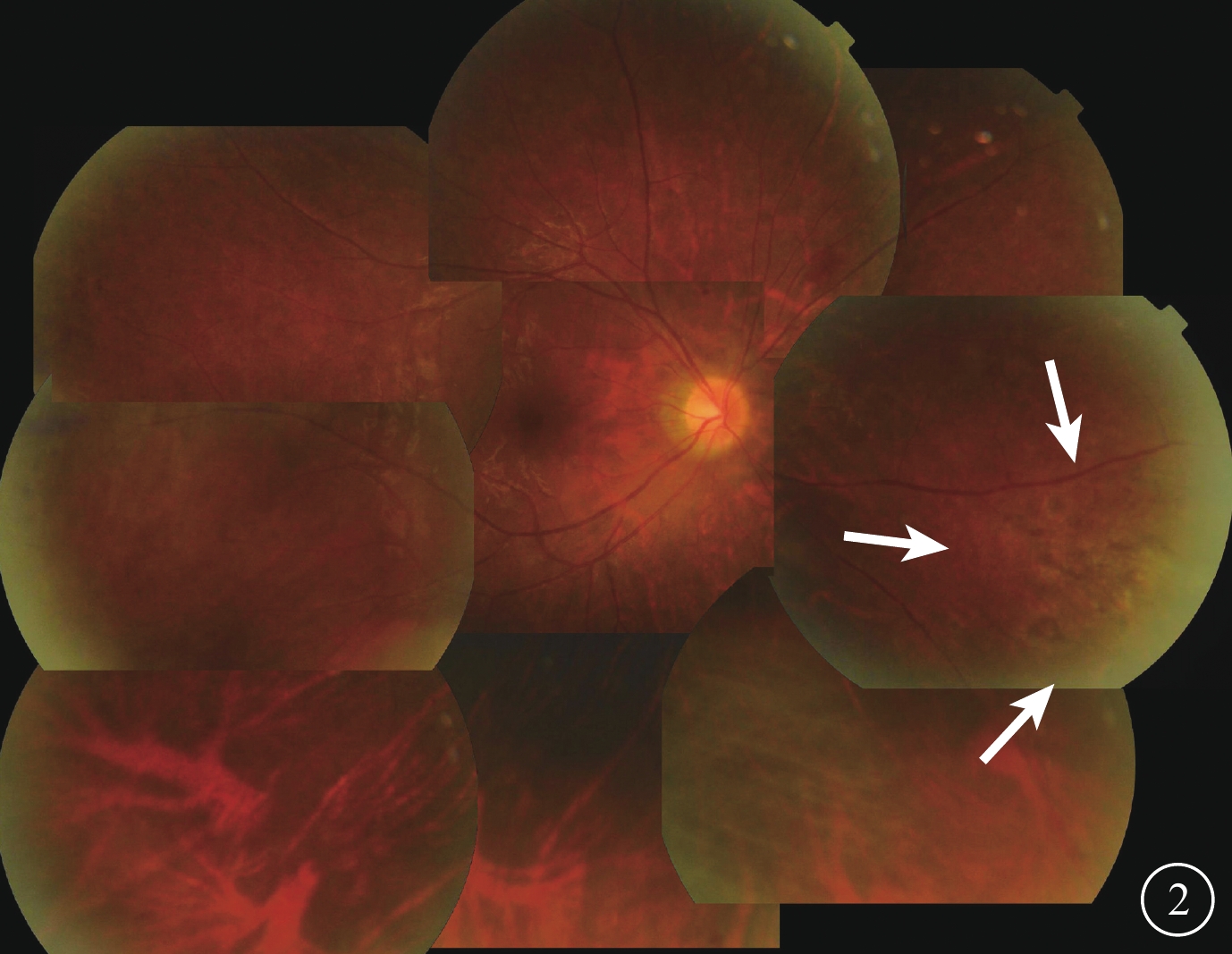
全身抗病毒治療改為更昔洛韋500 mg靜脈滴注,1次/12 h。4月1日給予右眼玻璃體腔注射40 mg/ml的更昔洛韋0.1 ml(含更昔洛韋4 mg)。治療前前房穿刺抽取前房水行CMV-DNA檢測,CMV-DNA載量為7630 拷貝/ml。4月7日復查,右眼BCVA 0.6;房水色素顆粒(+);玻璃體混濁減輕。眼底鼻側、鼻下及顳上方周邊部視網膜沿血管分布的黃白色病灶及出血明顯吸收,血管白鞘范圍較治療前縮小;視網膜水腫減輕。繼續玻璃體腔注射相同劑量的更昔洛韋治療,1次/周,同時復查前房水CMV-DNA,連續注射至前房水CMV-DNA轉陰(DNA載量<500 拷貝/ml)后1周。4月1日至5月13日共計注射7次,5月13日前房水CMV-DNA載量下降至106 拷貝/ml。玻璃體腔注射治療期間4月15日停用更昔洛韋靜脈用藥,改為口服鹽酸纈更昔洛韋900 mg,1次/d。4月28日因出現血粒細胞減少,鹽酸纈更昔洛韋減量為450 mg,1次/d;5月15日停用全身抗病毒藥物治療。6月13日復查,右眼BCVA 1.0;眼壓18 mmHg。眼前節檢查未見異常;玻璃體清晰。眼底周邊部視網膜血管白鞘消失,沿血管分布的黃白色病灶及出血灶吸收,殘留少許灰色瘢痕(圖2)。
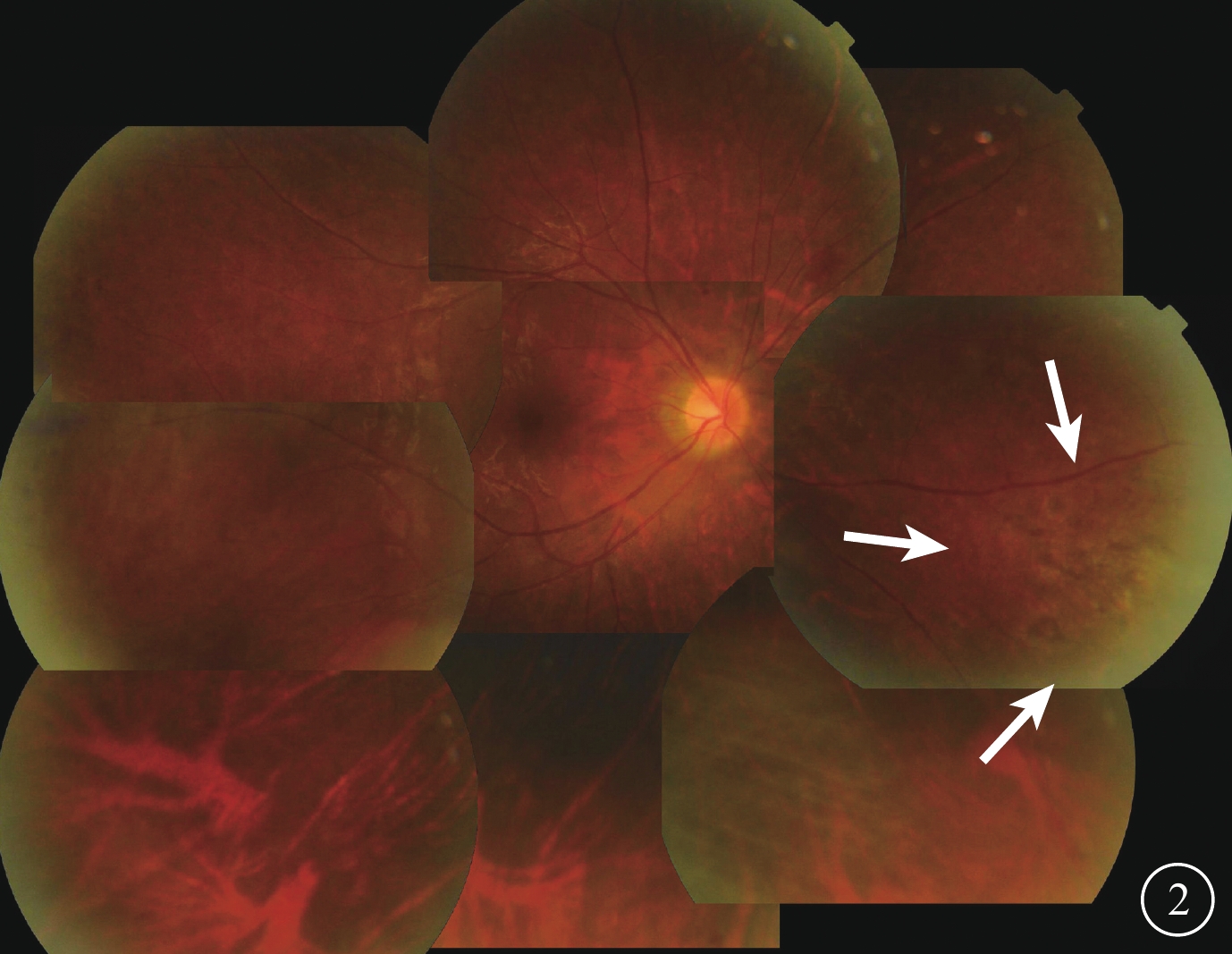 圖2
6月13日隨訪時右眼彩色眼底像。周邊部視網膜血管白鞘消失、出血吸收,鼻側周邊部視網膜病灶面積縮小,殘留少許灰色瘢痕(白箭)
圖2
6月13日隨訪時右眼彩色眼底像。周邊部視網膜血管白鞘消失、出血吸收,鼻側周邊部視網膜病灶面積縮小,殘留少許灰色瘢痕(白箭)
討論 CMVR是骨髓移植手術后少見的嚴重并發癥,多數發生于骨髓移植手術后3~6個月[1]。移植前患者或供體血清CMV抗體陽性、慢性移植物抗宿主排斥反應、移植后100 d內出現CMV活動性感染、淋巴細胞延遲植入等均是骨髓移植手術后發生CMVR的主要危險因素。CMVR按其典型特征可分為爆發型和顆粒型。爆發型表現為大片融合的灰黃色視網膜壞死灶,伴有出血及血管炎,多位于眼底后極部;顆粒型表現為沿血管周圍散在分布,其邊緣不清呈黃白色顆粒的視網膜壞死灶,多位于周邊部,視網膜有不同程度的水腫,出血較少[2]。本例患者于骨髓移植手術后100 d內出現CMV活動性感染(CMV尿癥),存在發生CMVR的高危因素;眼底表現為顆粒型CMVR改變。
CMVR全身用藥分為誘導階段和維持階段,誘導階段推薦更昔洛韋5 mg/kg靜脈滴注,1次/12 h;維持階段更昔洛韋5 mg/kg靜脈滴注,1 次/d。口服纈更昔洛韋與靜脈滴注更昔洛韋在治療CMVR時療效相似,纈更昔洛韋是更昔洛韋的前體藥物,其口服吸收的生物利用度是口服更昔洛韋的10倍。玻璃體腔注射抗病毒藥物避開了血視網膜屏障,使視網膜直接與藥物接觸并使眼內藥物迅速達到治療濃度。更昔洛韋玻璃體腔注射治療骨髓移植后CMVR劑量為(2~5)mg/0.1 ml[3];注射次數可以分為誘導階段,2次/周,直至病灶穩定;維持階段,1次/周,直至病灶萎縮;或1次/周。本例患者采用4 mg/0.1 ml更昔洛韋玻璃體腔注射,1次/周,連續7周,取得較好療效。證實更昔洛韋玻璃體腔注射治療骨髓移植后CMVR有效,且重復治療安全性好。但對于更昔洛韋玻璃體腔注射的劑量和頻次還需要大樣本前瞻性對照研究觀察結果加以確定。
局部和全身聯合用藥可以更有效地控制CMV感染,顯著降低其他器官發生CMV感染的可能性,減少對側眼發生CMVR的危險。本例患者為單眼CMVR,因此抗病毒治療采用全身用藥聯合玻璃體腔注藥,取得了較好的療效。
患者男,26歲。2015年8月在我院診斷為急性淋巴細胞性白血病(B細胞型)。2016年2月在我院行異基因骨髓造血干細胞移植手術;其父親作為單倍體供者,人類白細胞抗原配型5/10相合。移植手術前患者及供體血清巨細胞病毒(CMV)DNA檢測均為陰性。患者骨髓移植手術前眼科檢查雙眼眼底未見異常。2月27日回輸4/6相合女嬰臍帶血;2月27~29日連續3 d回輸其父親半相合外周干細胞210 ml。3月7、9日即骨髓移植手術后8、10 d血小板、白細胞分別植入。3月2日患者出現口腔潰瘍并逐漸加重,伴發熱,給予全身抗感染治療后感染癥狀好轉。3月24日常規行血清及尿CMV-DNA檢測,血清CMV-DNA陰性,尿CMV-DNA載量為1730 拷貝/ml;考慮為CMV尿癥,給予更昔洛韋250 mg靜脈滴注,1次/12 h。3月28日復查尿CMV-DNA載量下降至932 拷貝/ml。4月1日患者出現右眼紅、視力下降。眼部檢查:右眼最佳矯正視力(BCVA)0.3,左眼BCVA 1.0;眼壓:右眼20 mmHg(1 mmHg=0.133 kPa),左眼18 mmHg。右眼角膜后沉著物(+),房水閃輝(+);玻璃體混濁(++)。眼底視盤邊界清楚,杯盤比0.3;鼻側、鼻下方周邊部視網膜可見沿血管分布片狀黃白色病灶伴出血,顳上方及顳側周邊部視網膜血管白鞘,黃斑中心凹反光不清(圖1)。左眼眼前后節檢查未見異常。診斷:右眼CMV視網膜炎(CMVR)。
 圖1
右眼彩色眼底像。鼻側、鼻下方周邊部視網膜可見片狀黃白色滲出及出血,病灶沿血管分布、鄰近視網膜水腫(黑箭),顳上方及顳側周邊部視網膜血管白鞘(白箭)
圖1
右眼彩色眼底像。鼻側、鼻下方周邊部視網膜可見片狀黃白色滲出及出血,病灶沿血管分布、鄰近視網膜水腫(黑箭),顳上方及顳側周邊部視網膜血管白鞘(白箭)
全身抗病毒治療改為更昔洛韋500 mg靜脈滴注,1次/12 h。4月1日給予右眼玻璃體腔注射40 mg/ml的更昔洛韋0.1 ml(含更昔洛韋4 mg)。治療前前房穿刺抽取前房水行CMV-DNA檢測,CMV-DNA載量為7630 拷貝/ml。4月7日復查,右眼BCVA 0.6;房水色素顆粒(+);玻璃體混濁減輕。眼底鼻側、鼻下及顳上方周邊部視網膜沿血管分布的黃白色病灶及出血明顯吸收,血管白鞘范圍較治療前縮小;視網膜水腫減輕。繼續玻璃體腔注射相同劑量的更昔洛韋治療,1次/周,同時復查前房水CMV-DNA,連續注射至前房水CMV-DNA轉陰(DNA載量<500 拷貝/ml)后1周。4月1日至5月13日共計注射7次,5月13日前房水CMV-DNA載量下降至106 拷貝/ml。玻璃體腔注射治療期間4月15日停用更昔洛韋靜脈用藥,改為口服鹽酸纈更昔洛韋900 mg,1次/d。4月28日因出現血粒細胞減少,鹽酸纈更昔洛韋減量為450 mg,1次/d;5月15日停用全身抗病毒藥物治療。6月13日復查,右眼BCVA 1.0;眼壓18 mmHg。眼前節檢查未見異常;玻璃體清晰。眼底周邊部視網膜血管白鞘消失,沿血管分布的黃白色病灶及出血灶吸收,殘留少許灰色瘢痕(圖2)。
 圖2
6月13日隨訪時右眼彩色眼底像。周邊部視網膜血管白鞘消失、出血吸收,鼻側周邊部視網膜病灶面積縮小,殘留少許灰色瘢痕(白箭)
圖2
6月13日隨訪時右眼彩色眼底像。周邊部視網膜血管白鞘消失、出血吸收,鼻側周邊部視網膜病灶面積縮小,殘留少許灰色瘢痕(白箭)
討論 CMVR是骨髓移植手術后少見的嚴重并發癥,多數發生于骨髓移植手術后3~6個月[1]。移植前患者或供體血清CMV抗體陽性、慢性移植物抗宿主排斥反應、移植后100 d內出現CMV活動性感染、淋巴細胞延遲植入等均是骨髓移植手術后發生CMVR的主要危險因素。CMVR按其典型特征可分為爆發型和顆粒型。爆發型表現為大片融合的灰黃色視網膜壞死灶,伴有出血及血管炎,多位于眼底后極部;顆粒型表現為沿血管周圍散在分布,其邊緣不清呈黃白色顆粒的視網膜壞死灶,多位于周邊部,視網膜有不同程度的水腫,出血較少[2]。本例患者于骨髓移植手術后100 d內出現CMV活動性感染(CMV尿癥),存在發生CMVR的高危因素;眼底表現為顆粒型CMVR改變。
CMVR全身用藥分為誘導階段和維持階段,誘導階段推薦更昔洛韋5 mg/kg靜脈滴注,1次/12 h;維持階段更昔洛韋5 mg/kg靜脈滴注,1 次/d。口服纈更昔洛韋與靜脈滴注更昔洛韋在治療CMVR時療效相似,纈更昔洛韋是更昔洛韋的前體藥物,其口服吸收的生物利用度是口服更昔洛韋的10倍。玻璃體腔注射抗病毒藥物避開了血視網膜屏障,使視網膜直接與藥物接觸并使眼內藥物迅速達到治療濃度。更昔洛韋玻璃體腔注射治療骨髓移植后CMVR劑量為(2~5)mg/0.1 ml[3];注射次數可以分為誘導階段,2次/周,直至病灶穩定;維持階段,1次/周,直至病灶萎縮;或1次/周。本例患者采用4 mg/0.1 ml更昔洛韋玻璃體腔注射,1次/周,連續7周,取得較好療效。證實更昔洛韋玻璃體腔注射治療骨髓移植后CMVR有效,且重復治療安全性好。但對于更昔洛韋玻璃體腔注射的劑量和頻次還需要大樣本前瞻性對照研究觀察結果加以確定。
局部和全身聯合用藥可以更有效地控制CMV感染,顯著降低其他器官發生CMV感染的可能性,減少對側眼發生CMVR的危險。本例患者為單眼CMVR,因此抗病毒治療采用全身用藥聯合玻璃體腔注藥,取得了較好的療效。