引用本文: 謝國麗, 傅強, 趙露, 王艷玲. 眼缺血綜合征大鼠視網膜凋亡相關蛋白的表達研究. 中華眼底病雜志, 2015, 31(6): 571-574. doi: 10.3760/cma.j.issn.1005-1015.2015.06.015 復制
眼缺血綜合征(OIS)所致視網膜缺血損傷的發病機制目前尚不十分清楚。Yamamoto等[1]對慢性頸動脈阻塞大鼠模型研究發現,亞鐵血紅素氧化酶-1和凋亡蛋白酶-3活化先于視網膜神經節細胞(RGC)死亡出現,隨后出現神經退行性波。由此推測對大鼠雙側頸總動脈結扎(BCCAO)后,慢性視網膜血管閉塞誘導RGC凋亡可能是導致RGC死亡的主要機制。為更好的了解OIS導致的視網膜缺血損傷過程中凋亡分子的變化,我們觀察了大鼠BCCAO后視網膜中半胱氨酸蛋白酶(Caspase)-3、Caspase-8、B細胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相關X蛋白(Bax)的表達;初步探討OIS的發生機制,現將結果報道如下。
1 材料和方法
純種系雄性Brown Norway大鼠30只,10~12周齡,體重250~300 g,清潔級,北京維通利華公司動物實驗室提供。喂養環境控制室溫在18~25℃,濕度50%~70%;自由攝食、飲水。適應性喂養7 d后納入實驗。將大鼠按照隨機數字表法隨機分為實驗組、對照組。兩組均為15只大鼠。每組大鼠隨機編號。兩組大鼠均按40 mg/kg的劑量腹腔注射1%戊巴比妥鈉,無菌條件下頸前肌肉和側方肌肉間隙鈍性分離頸總動脈,顯露并游離雙側頸總動脈。實驗組大鼠5-0的絲線結扎頸總動脈建立OIS動物模型[2]。建模后3個月處死大鼠,摘除雙側眼球。
蘇木精-伊紅(HE)染色觀察視網膜厚度及RGC數量。眼球摘除后4%多聚甲醛固定液固定24 h,作平行視神經矢狀軸的視網膜石蠟切片。室溫脫水,石蠟包埋,切片厚度約3 μm,脫蠟至水。蘇木精染色2 min,分化液、返藍液中浸潤各30 s,沖洗后80%酒精脫水2 min,伊紅染色2 min,脫水透明后封片觀察并采集圖像。為了避免各種偏倚對視網膜厚度檢測可靠性的干擾,實驗中兩組視網膜的脫水程度與時間嚴格控制在同一條件下進行。計數每個視網膜標本的RGC層(RGCL)中RGC數量,選擇在100倍高倍視野下兩組視網膜同一位置的5個不同區域,應用Image-proplus 6.0軟件分別測量5個相應區域面積,計算RGC單位面積密度,取其平均值作為最后結果。應用同一軟件分別測量中央視網膜內叢狀層(IPL)、內核層(INL)、外叢狀層(OPL)、外核層(ONL)以及視網膜總厚度(TRT)。取距視盤上方邊緣200μm處視網膜為測量標準,分別測量5次,取平均值作為視網膜厚度。
蛋白質免疫印跡法(Western blot)檢測大鼠視網膜組織凋亡相關蛋白表達。沿角膜緣冠狀面剪開眼球,棄去角膜、虹膜、晶狀體,完整剝離視網膜,-80℃冰箱中保存。按二喹啉甲酸蛋白檢測試劑盒說明書測定每個視網膜組織提取上清液的蛋白濃度。取視網膜組織蛋白上清液40 μl,加入5倍上樣緩沖液10μl,100℃水浴5 min。十二烷基硫酸鈉聚丙烯酰胺凝膠電泳將等量蛋白質(30 μg上樣)分離;300 mA、50 min轉移至聚偏二氟乙烯膜上;磷酸鹽緩沖液(PBS)配制的質量分數5%脫脂牛奶室溫下封閉1.5 h;兔抗鼠Caspase-3一抗(1∶500)、兔抗鼠Caspase-8一抗(1∶500)、羊抗鼠Bax一抗(1∶100)、羊抗鼠Bcl-2一抗(1∶100)4℃孵育過夜;洗膜緩沖液(PBST, pH7.5)洗膜3次,5 min/次;辣根過氧化物酶標記山羊抗兔IgG二抗(1∶2000)室溫孵育1.0 h;PBST洗膜3次,5 min/次;增強化學發光法試劑盒檢測。采用凝膠成像分析系統及Quontity One軟件分析結果。
實時定量熒光聚合酶鏈反應(RT-PCR)測定視網膜凋亡相關蛋白的mRNA表達。視網膜勻漿,按照酚-異硫氰酸胍(Trizol) RNA提取試劑盒抽提總RNA。微量紫外分光光度計測定總RNA濃度和純度。每個標本取200 ng總RNA,按逆轉錄試劑盒說明在20 μl體系中合成cDNA。根據NCBI數據庫中的Caspase-3、Caspase-8、Bax、Bcl-2以及β-肌動蛋白(β-actin)基因序列,以Primer Premier 5.0軟件設計引物,由北京賽百盛基因技術有限公司合成(表 1)。熒光定量聚合酶鏈反應(PCR)儀進行RT-PCR反應,20 μl PCR反應體系中含2倍SYBR Green PCR Master Mix 10 μl,cDNA 2 μl,上游引物1 μl,下游引物1 μl。擴增條件95℃5 min變性,94℃30 s,54℃30 s,72℃1 min,共40個循環,最后72℃5 min延伸。反應結束后,根據測得的樣品Ct值,以2-△△cT表示目的基因mRNA表達的相對值。
SPSS 19.0統計學軟件進行統計學分析處理。數據以均數±標準差(
2 結果
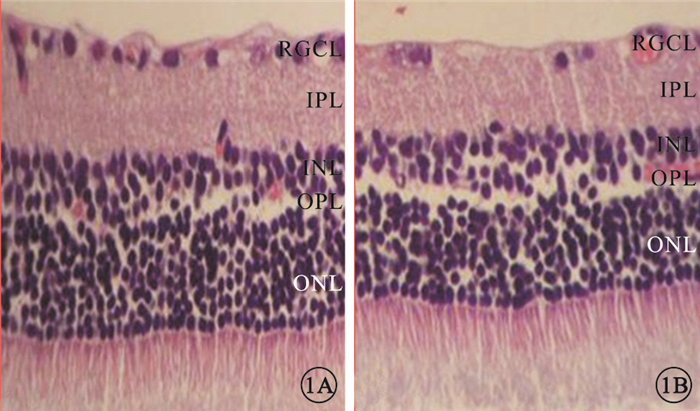
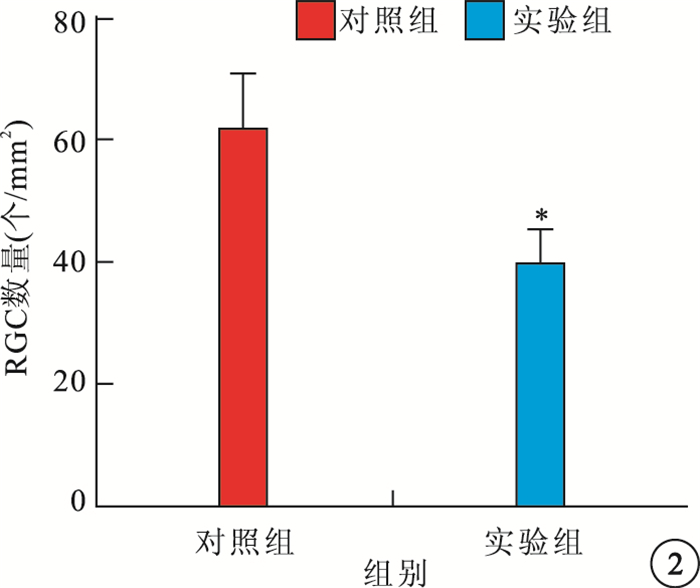
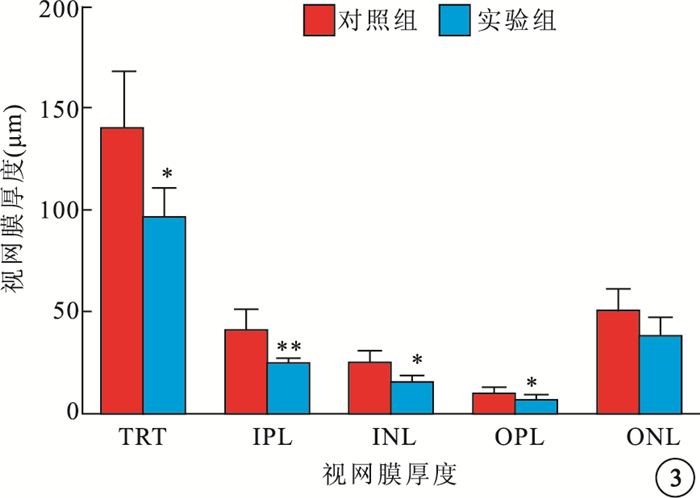
光學顯微鏡觀察發現,與對照組相比,實驗組大鼠視網膜RGC數量減少,視網膜厚度變薄(圖 1)。實驗組、對照組大鼠視網膜單位面積RGC數量分別為(38.1±5.98)、(61.97±9.07)個/mm2。實驗組大鼠RGC數量較對照組顯著降低,差異有統計學意義(t=3.059,P<0.05)(圖 2)。與對照組相比,實驗組大鼠TRT明顯變薄,差異有統計學意義(t=3.036,P<0.05);IPL(t=3.715)、INL(t=3.339)、OPL(t=3.341)厚度均變薄,差異有統計學意義(P<0.05);ONL厚度差異無統計學意義(t=2.000,P>0.05)(圖 3)。
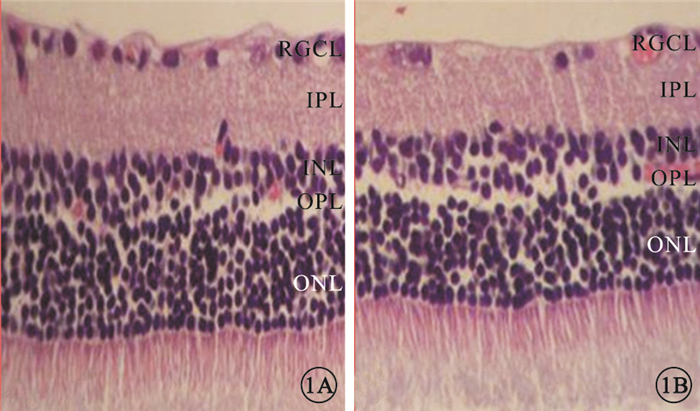 圖1
對照組、實驗組組大鼠視網膜組織光學顯微鏡像。1A.對照組;1B.實驗組。與對照組比較,實驗組大鼠視網膜RGC數量減少,視網膜厚度變薄HE標尺:50μm
圖1
對照組、實驗組組大鼠視網膜組織光學顯微鏡像。1A.對照組;1B.實驗組。與對照組比較,實驗組大鼠視網膜RGC數量減少,視網膜厚度變薄HE標尺:50μm
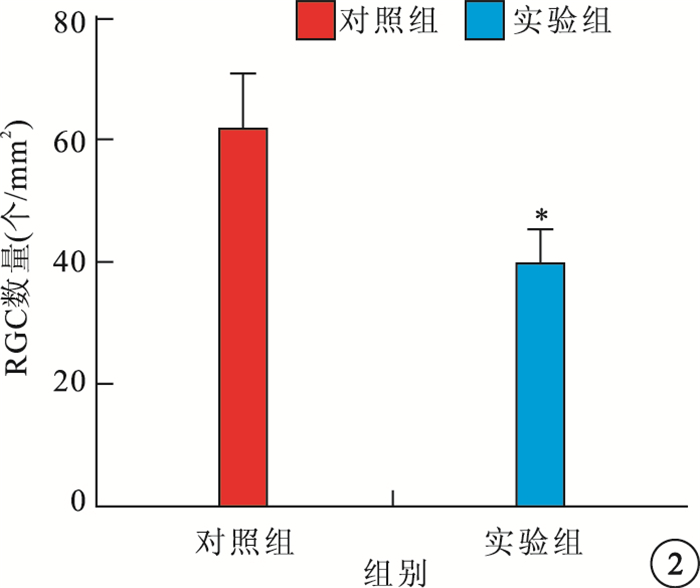 圖2
對照組、實驗組大鼠視網膜單位面積RGC數量比較。n=10, *P<0.01
圖2
對照組、實驗組大鼠視網膜單位面積RGC數量比較。n=10, *P<0.01
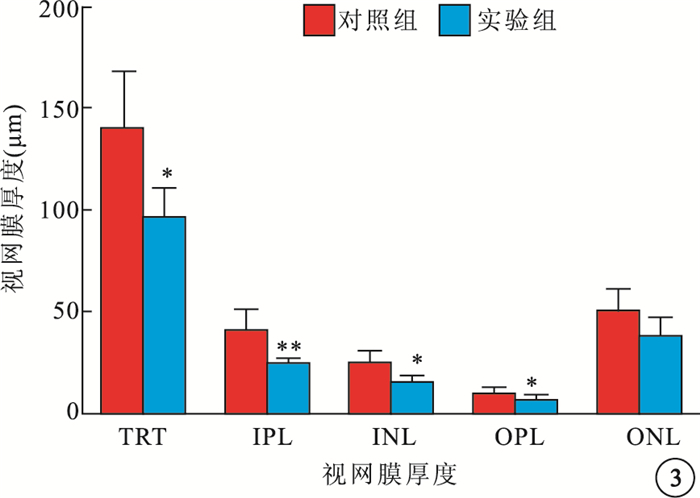 圖3
對照組、實驗組大鼠視網膜各層厚度比較。n=10;*P<0.05,**<0.01
圖3
對照組、實驗組大鼠視網膜各層厚度比較。n=10;*P<0.05,**<0.01
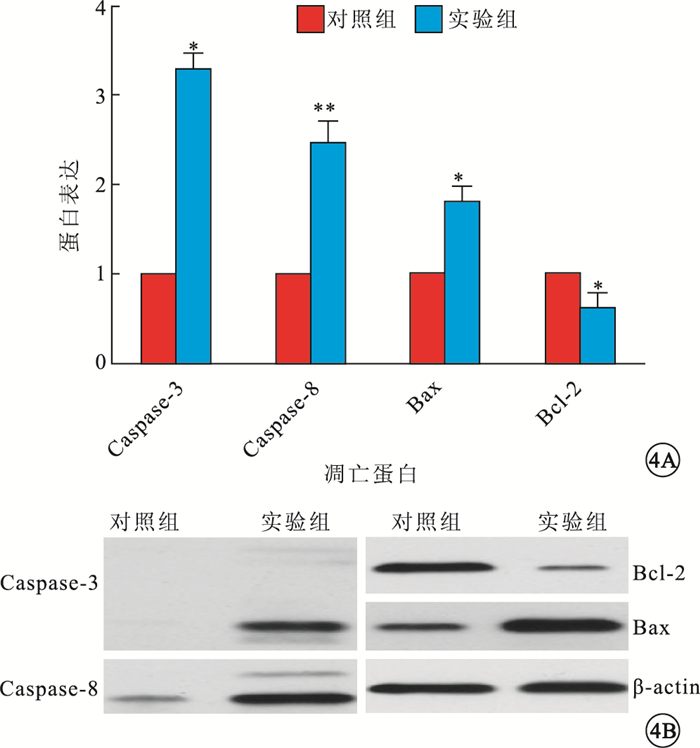
Western blot檢測結果顯示,大鼠視網膜Caspase-3、Caspase-8、Bax以及Bcl-2蛋白表達,對照組分別為0.233±0.107、0.343±0.154、0.583±0.137、0.823±0.106,實驗組分別為0.763±0.195、0.840±0.265、1.040±0.190、0.443±0.176。實驗組大鼠視網膜Caspase-3(F=17.036)、Caspase-8(F=7.878)、Bax蛋白(F=10.298)表達均高于對照組,Bcl-2蛋白(F=11.431)表達低于對照組,差異均有統計學意義(P<0.05)(圖 4)。
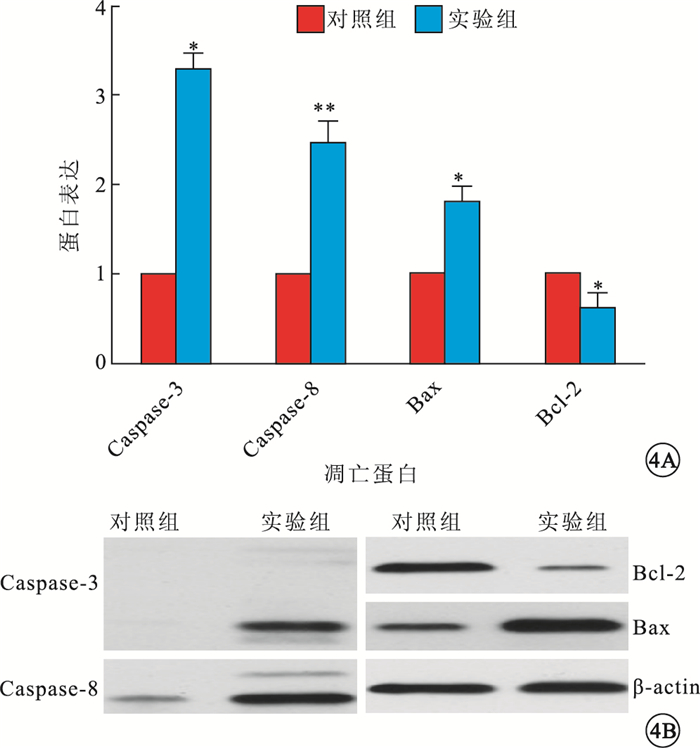 圖4
對照組、實驗組大鼠視網膜中凋亡相關蛋白表達比較。4A.蛋白表達量,n=10;*P<0.05,**P<0.01。4B.凋亡相關蛋白凝膠電泳圖
圖4
對照組、實驗組大鼠視網膜中凋亡相關蛋白表達比較。4A.蛋白表達量,n=10;*P<0.05,**P<0.01。4B.凋亡相關蛋白凝膠電泳圖
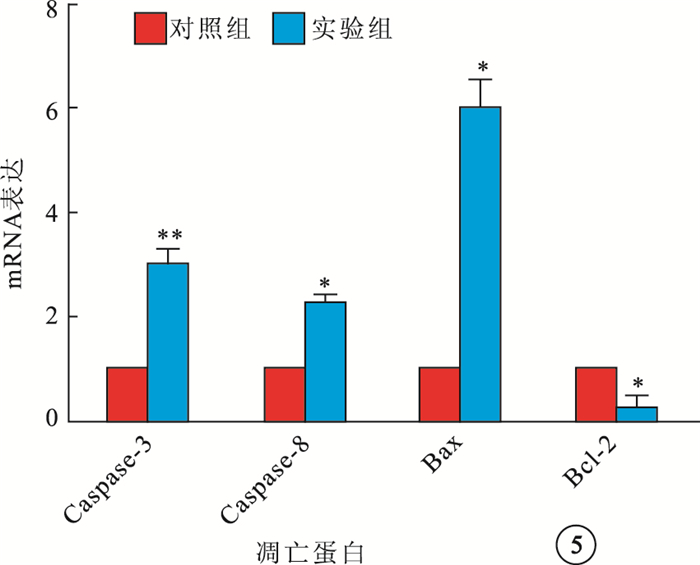
RT-PCR檢測結果顯示,大鼠視網膜Caspase-3、Caspase-8、Bax以及Bcl-2 mRNA表達,對照組分別為10.347±0.578、5.667±0.279、9.590±0.440、14.910±0.383,實驗組分別為11.710±0.406、8.230±1.016、12.123±1.176、12.703±1.033。實驗組大鼠視網膜Caspase-3(F=11.162)、Caspase-8(F=17.763)、Bax mRNA(F=12.183)表達均高于對照組,差異有統計學意義(P<0.05);Bcl-2 mRNA表達低于對照組,差異有統計學意義(F=12.047,P<0.05)(圖 5)。
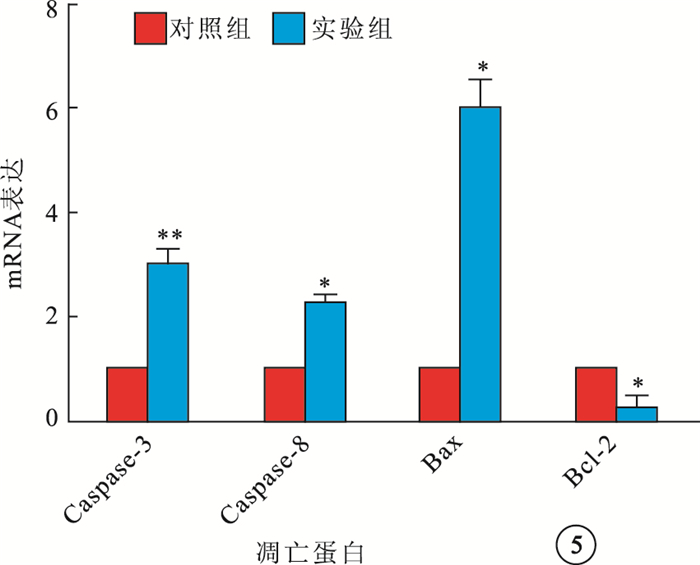 圖5
實驗組、對照組大鼠視網膜凋亡相關蛋白mRNA表達。n=10;*P<0.05,**P<0.01
圖5
實驗組、對照組大鼠視網膜凋亡相關蛋白mRNA表達。n=10;*P<0.05,**P<0.01
3 討論
本研究結果顯示,BCCAO后90 d大鼠視網膜IPL、INL與OPL厚度變薄。Lavinsky等[2]觀察到BCCAO后1個月僅IPL損傷, 并首次提出利用BCCAO可以嘗試制作OIS模型;Yamamoto等[1]研究發現BCCAO后,中周部、周邊部視網膜INL分別在2、4個月時發生退行性改變。上述文獻結果與本研究結果相符。本研究結果發現,對大鼠BCCAO后,內層視網膜受損,主要表現為RGC減少及IPL明顯變薄。Stevens等[3]分別在BCCAO后15、30、90 d觀察到一致的研究結果。其原因主要在于內層視網膜的血液供應來自于視網膜中央動脈。視網膜中央動脈為眼動脈分支的終末動脈,無任何血管分支與之相吻合,當頸總動脈的分支眼動脈血供顯著減少時,內層視網膜對缺血損傷較為敏感,可能導致RGC以及其他細胞的凋亡,使其視網膜發生萎縮變薄。
細胞凋亡(apoptosis)是細胞主動的、通過基因嚴密調控的程序性死亡。Caspase家族是細胞凋亡過程中的關鍵元件,其激活與超常表達均引起細胞凋亡。在已發現的14個家族成員中,Caspase-3處于凋亡有序級聯反應的下游,其活化是凋亡進入不可逆階段的標志[4]。而活化的Caspase-8凋亡蛋白酶通過Caspase募集結構域作用激活下游的效應Caspase3,導致細胞凋亡[5]。Bcl-2即B細胞淋巴瘤/白血病-2原癌基因,通過其所編碼Bcl-2蛋白而發揮其抑制細胞凋亡的功能,它是一個多基因家族,Bcl-2和Bax蛋白是此家族的兩個主要成員,Bcl-2有抗凋亡的作用,而Bax則有促凋亡作用[6]。本研究結果發現,OIS大鼠視網膜凋亡相關蛋白在缺血狀態下被激活,Caspase3、Caspase8以及Bax表達增加,而Bcl-2表達下降。說明在視網膜長期缺血狀態下,其促凋亡基因表達占優勢,且抗凋亡基因Bcl-2表達受到抑制,凋亡參與調節OIS視網膜的缺血損傷。
BCCAO后大鼠RGC數量減少,視網膜厚度變薄;并且可以激活視網膜凋亡相關蛋白過表達,促使細胞凋亡。凋亡相關蛋白的激活參與OIS大鼠視網膜損傷的發生發展,而細胞凋亡機制通路復雜,其調控OIS大鼠視網膜缺血損傷的具體凋亡機制尚待進一步探討。
本研究通過BCCAO引起眼部血管的長期低灌注,從而造成眼組織的慢性缺血狀態,以此模擬臨床上OIS眼部病理狀態,并觀察凋亡相關蛋白在大鼠視網膜中的表達改變,以期為該疾病的防治研究提供新的思路和作用靶點。
眼缺血綜合征(OIS)所致視網膜缺血損傷的發病機制目前尚不十分清楚。Yamamoto等[1]對慢性頸動脈阻塞大鼠模型研究發現,亞鐵血紅素氧化酶-1和凋亡蛋白酶-3活化先于視網膜神經節細胞(RGC)死亡出現,隨后出現神經退行性波。由此推測對大鼠雙側頸總動脈結扎(BCCAO)后,慢性視網膜血管閉塞誘導RGC凋亡可能是導致RGC死亡的主要機制。為更好的了解OIS導致的視網膜缺血損傷過程中凋亡分子的變化,我們觀察了大鼠BCCAO后視網膜中半胱氨酸蛋白酶(Caspase)-3、Caspase-8、B細胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相關X蛋白(Bax)的表達;初步探討OIS的發生機制,現將結果報道如下。
1 材料和方法
純種系雄性Brown Norway大鼠30只,10~12周齡,體重250~300 g,清潔級,北京維通利華公司動物實驗室提供。喂養環境控制室溫在18~25℃,濕度50%~70%;自由攝食、飲水。適應性喂養7 d后納入實驗。將大鼠按照隨機數字表法隨機分為實驗組、對照組。兩組均為15只大鼠。每組大鼠隨機編號。兩組大鼠均按40 mg/kg的劑量腹腔注射1%戊巴比妥鈉,無菌條件下頸前肌肉和側方肌肉間隙鈍性分離頸總動脈,顯露并游離雙側頸總動脈。實驗組大鼠5-0的絲線結扎頸總動脈建立OIS動物模型[2]。建模后3個月處死大鼠,摘除雙側眼球。
蘇木精-伊紅(HE)染色觀察視網膜厚度及RGC數量。眼球摘除后4%多聚甲醛固定液固定24 h,作平行視神經矢狀軸的視網膜石蠟切片。室溫脫水,石蠟包埋,切片厚度約3 μm,脫蠟至水。蘇木精染色2 min,分化液、返藍液中浸潤各30 s,沖洗后80%酒精脫水2 min,伊紅染色2 min,脫水透明后封片觀察并采集圖像。為了避免各種偏倚對視網膜厚度檢測可靠性的干擾,實驗中兩組視網膜的脫水程度與時間嚴格控制在同一條件下進行。計數每個視網膜標本的RGC層(RGCL)中RGC數量,選擇在100倍高倍視野下兩組視網膜同一位置的5個不同區域,應用Image-proplus 6.0軟件分別測量5個相應區域面積,計算RGC單位面積密度,取其平均值作為最后結果。應用同一軟件分別測量中央視網膜內叢狀層(IPL)、內核層(INL)、外叢狀層(OPL)、外核層(ONL)以及視網膜總厚度(TRT)。取距視盤上方邊緣200μm處視網膜為測量標準,分別測量5次,取平均值作為視網膜厚度。
蛋白質免疫印跡法(Western blot)檢測大鼠視網膜組織凋亡相關蛋白表達。沿角膜緣冠狀面剪開眼球,棄去角膜、虹膜、晶狀體,完整剝離視網膜,-80℃冰箱中保存。按二喹啉甲酸蛋白檢測試劑盒說明書測定每個視網膜組織提取上清液的蛋白濃度。取視網膜組織蛋白上清液40 μl,加入5倍上樣緩沖液10μl,100℃水浴5 min。十二烷基硫酸鈉聚丙烯酰胺凝膠電泳將等量蛋白質(30 μg上樣)分離;300 mA、50 min轉移至聚偏二氟乙烯膜上;磷酸鹽緩沖液(PBS)配制的質量分數5%脫脂牛奶室溫下封閉1.5 h;兔抗鼠Caspase-3一抗(1∶500)、兔抗鼠Caspase-8一抗(1∶500)、羊抗鼠Bax一抗(1∶100)、羊抗鼠Bcl-2一抗(1∶100)4℃孵育過夜;洗膜緩沖液(PBST, pH7.5)洗膜3次,5 min/次;辣根過氧化物酶標記山羊抗兔IgG二抗(1∶2000)室溫孵育1.0 h;PBST洗膜3次,5 min/次;增強化學發光法試劑盒檢測。采用凝膠成像分析系統及Quontity One軟件分析結果。
實時定量熒光聚合酶鏈反應(RT-PCR)測定視網膜凋亡相關蛋白的mRNA表達。視網膜勻漿,按照酚-異硫氰酸胍(Trizol) RNA提取試劑盒抽提總RNA。微量紫外分光光度計測定總RNA濃度和純度。每個標本取200 ng總RNA,按逆轉錄試劑盒說明在20 μl體系中合成cDNA。根據NCBI數據庫中的Caspase-3、Caspase-8、Bax、Bcl-2以及β-肌動蛋白(β-actin)基因序列,以Primer Premier 5.0軟件設計引物,由北京賽百盛基因技術有限公司合成(表 1)。熒光定量聚合酶鏈反應(PCR)儀進行RT-PCR反應,20 μl PCR反應體系中含2倍SYBR Green PCR Master Mix 10 μl,cDNA 2 μl,上游引物1 μl,下游引物1 μl。擴增條件95℃5 min變性,94℃30 s,54℃30 s,72℃1 min,共40個循環,最后72℃5 min延伸。反應結束后,根據測得的樣品Ct值,以2-△△cT表示目的基因mRNA表達的相對值。
SPSS 19.0統計學軟件進行統計學分析處理。數據以均數±標準差(
2 結果
光學顯微鏡觀察發現,與對照組相比,實驗組大鼠視網膜RGC數量減少,視網膜厚度變薄(圖 1)。實驗組、對照組大鼠視網膜單位面積RGC數量分別為(38.1±5.98)、(61.97±9.07)個/mm2。實驗組大鼠RGC數量較對照組顯著降低,差異有統計學意義(t=3.059,P<0.05)(圖 2)。與對照組相比,實驗組大鼠TRT明顯變薄,差異有統計學意義(t=3.036,P<0.05);IPL(t=3.715)、INL(t=3.339)、OPL(t=3.341)厚度均變薄,差異有統計學意義(P<0.05);ONL厚度差異無統計學意義(t=2.000,P>0.05)(圖 3)。
 圖1
對照組、實驗組組大鼠視網膜組織光學顯微鏡像。1A.對照組;1B.實驗組。與對照組比較,實驗組大鼠視網膜RGC數量減少,視網膜厚度變薄HE標尺:50μm
圖1
對照組、實驗組組大鼠視網膜組織光學顯微鏡像。1A.對照組;1B.實驗組。與對照組比較,實驗組大鼠視網膜RGC數量減少,視網膜厚度變薄HE標尺:50μm
 圖2
對照組、實驗組大鼠視網膜單位面積RGC數量比較。n=10, *P<0.01
圖2
對照組、實驗組大鼠視網膜單位面積RGC數量比較。n=10, *P<0.01
 圖3
對照組、實驗組大鼠視網膜各層厚度比較。n=10;*P<0.05,**<0.01
圖3
對照組、實驗組大鼠視網膜各層厚度比較。n=10;*P<0.05,**<0.01
Western blot檢測結果顯示,大鼠視網膜Caspase-3、Caspase-8、Bax以及Bcl-2蛋白表達,對照組分別為0.233±0.107、0.343±0.154、0.583±0.137、0.823±0.106,實驗組分別為0.763±0.195、0.840±0.265、1.040±0.190、0.443±0.176。實驗組大鼠視網膜Caspase-3(F=17.036)、Caspase-8(F=7.878)、Bax蛋白(F=10.298)表達均高于對照組,Bcl-2蛋白(F=11.431)表達低于對照組,差異均有統計學意義(P<0.05)(圖 4)。
 圖4
對照組、實驗組大鼠視網膜中凋亡相關蛋白表達比較。4A.蛋白表達量,n=10;*P<0.05,**P<0.01。4B.凋亡相關蛋白凝膠電泳圖
圖4
對照組、實驗組大鼠視網膜中凋亡相關蛋白表達比較。4A.蛋白表達量,n=10;*P<0.05,**P<0.01。4B.凋亡相關蛋白凝膠電泳圖
RT-PCR檢測結果顯示,大鼠視網膜Caspase-3、Caspase-8、Bax以及Bcl-2 mRNA表達,對照組分別為10.347±0.578、5.667±0.279、9.590±0.440、14.910±0.383,實驗組分別為11.710±0.406、8.230±1.016、12.123±1.176、12.703±1.033。實驗組大鼠視網膜Caspase-3(F=11.162)、Caspase-8(F=17.763)、Bax mRNA(F=12.183)表達均高于對照組,差異有統計學意義(P<0.05);Bcl-2 mRNA表達低于對照組,差異有統計學意義(F=12.047,P<0.05)(圖 5)。
 圖5
實驗組、對照組大鼠視網膜凋亡相關蛋白mRNA表達。n=10;*P<0.05,**P<0.01
圖5
實驗組、對照組大鼠視網膜凋亡相關蛋白mRNA表達。n=10;*P<0.05,**P<0.01
3 討論
本研究結果顯示,BCCAO后90 d大鼠視網膜IPL、INL與OPL厚度變薄。Lavinsky等[2]觀察到BCCAO后1個月僅IPL損傷, 并首次提出利用BCCAO可以嘗試制作OIS模型;Yamamoto等[1]研究發現BCCAO后,中周部、周邊部視網膜INL分別在2、4個月時發生退行性改變。上述文獻結果與本研究結果相符。本研究結果發現,對大鼠BCCAO后,內層視網膜受損,主要表現為RGC減少及IPL明顯變薄。Stevens等[3]分別在BCCAO后15、30、90 d觀察到一致的研究結果。其原因主要在于內層視網膜的血液供應來自于視網膜中央動脈。視網膜中央動脈為眼動脈分支的終末動脈,無任何血管分支與之相吻合,當頸總動脈的分支眼動脈血供顯著減少時,內層視網膜對缺血損傷較為敏感,可能導致RGC以及其他細胞的凋亡,使其視網膜發生萎縮變薄。
細胞凋亡(apoptosis)是細胞主動的、通過基因嚴密調控的程序性死亡。Caspase家族是細胞凋亡過程中的關鍵元件,其激活與超常表達均引起細胞凋亡。在已發現的14個家族成員中,Caspase-3處于凋亡有序級聯反應的下游,其活化是凋亡進入不可逆階段的標志[4]。而活化的Caspase-8凋亡蛋白酶通過Caspase募集結構域作用激活下游的效應Caspase3,導致細胞凋亡[5]。Bcl-2即B細胞淋巴瘤/白血病-2原癌基因,通過其所編碼Bcl-2蛋白而發揮其抑制細胞凋亡的功能,它是一個多基因家族,Bcl-2和Bax蛋白是此家族的兩個主要成員,Bcl-2有抗凋亡的作用,而Bax則有促凋亡作用[6]。本研究結果發現,OIS大鼠視網膜凋亡相關蛋白在缺血狀態下被激活,Caspase3、Caspase8以及Bax表達增加,而Bcl-2表達下降。說明在視網膜長期缺血狀態下,其促凋亡基因表達占優勢,且抗凋亡基因Bcl-2表達受到抑制,凋亡參與調節OIS視網膜的缺血損傷。
BCCAO后大鼠RGC數量減少,視網膜厚度變薄;并且可以激活視網膜凋亡相關蛋白過表達,促使細胞凋亡。凋亡相關蛋白的激活參與OIS大鼠視網膜損傷的發生發展,而細胞凋亡機制通路復雜,其調控OIS大鼠視網膜缺血損傷的具體凋亡機制尚待進一步探討。
本研究通過BCCAO引起眼部血管的長期低灌注,從而造成眼組織的慢性缺血狀態,以此模擬臨床上OIS眼部病理狀態,并觀察凋亡相關蛋白在大鼠視網膜中的表達改變,以期為該疾病的防治研究提供新的思路和作用靶點。