引用本文: 李云琴, 肖麗波, 康劍書, 張潔瑩, 周圓, 鄒悅. 人臍血干細胞移植對大鼠外傷性視神經損傷后神經節細胞的保護作用. 中華眼底病雜志, 2015, 31(3): 285-288. doi: 10.3760/cma.j.issn.1005-1015.2015.03.017 復制
視網膜神經節細胞(RGC)和上級神經元依靠軸索和神經突觸相互聯系,視神經損傷后RGC數目減少速度明顯增快[1]。干細胞可替代壞死或受損的神經元并具有修復周圍神經缺損的能力[2]。采用移植干細胞治療視神經損傷已在動物實驗中取得了一定進展[3]。人臍血干細胞(hUCBSC)因移植成活率高、移植物抗宿主病低、取材方便等優勢,已成功應用于數十種疾病的治療[4, 5]。但目前關于hUCBSC移植治療視神經損傷的效果還不太明確。為此,我們給予視神經鉗夾傷模型大鼠球周注射hUCBSC懸液,應用熒光金(FG)神經逆行標記RGC計數技術及蘇木精-伊紅(HE)染色方法觀察了人臍血干細胞對大鼠外傷性視神經損傷后RGC的保護作用。現將結果報道如下。
1 材料和方法
視神經夾(夾持力約40 g,日本國立公司),手術顯微鏡(蘇州六六視覺股份有限公司),顯微手術器械(上海醫用器械廠),hUCBSC(深圳北科生物公司),1μl微量注射器(上海醫用激光器械廠),腦立體定位儀(YZ20P型,蘇州醫療器械廠),倒置熒光顯微鏡DX60(日本Olympus公司),FG(美國sigma公司),多聚甲醛粉劑(北京中山公司)。石蠟包埋、切片機(廣州三元科技有限公司)。HE(北京中山公司)。
雄性健康成年Sprague-Dawley大鼠48只,體重200~300 g,昆明醫學院動物實驗室提供。眼前節及眼底檢查均正常。飼養環境為12 h光照/12 h黑暗,左眼為損傷眼,右眼為對照眼。大鼠麻醉后固定于手術臺,在上眼瞼緣中央做垂直、橫行切口各1 cm,剪開穹窿部結膜,鈍性分離暴露視神經,在球后2 mm處用微型視神經夾垂直于視神經水平軸的視神經鉗夾30 s,并同時觀察。大鼠實驗眼瞳孔散大,直接對光反射消失,間接對光反射存在,視網膜血管無出血或梗死,鉗夾傷后5 min內血流完全恢復者納入實驗。大鼠建模后隨機分為A、B組,均為24只大鼠。A組大鼠左眼球周注射0.1 ml磷酸鹽緩沖液(PBS);B組大鼠左眼球周注射0.1 ml hUCBSC懸液。建模后7 d,大鼠腹腔注射10%水合氯醛麻醉,自下眶切跡垂直進針注射進針約0.5 cm。注射后注射處涂四環素眼膏。
處死前7 d,大鼠麻醉后固定于大腦定位儀操作架上,沿正中線切開顱頂皮膚,暴露矢狀縫及頂間縫,確定前囟部Bregma點。參照Paxinas圖譜以Bregma點為零點,再后移6.5 mm,在兩側旁開中線1.5 mm處對稱選點,用牙科鉆造2個直徑約l mm的骨孔。顯微鑷撕開骨孔處的硬腦膜,在距前囟后6.3、6.8 mm處的骨孔內,用微量注射器注入5%的FG 0.8μl,5 min內注射完畢,深度分別為3.6、4.0 mm,留針5 min。另側上丘同樣操作。
FG逆行標記后7、14、21、28 d,兩組分別隨機選取6只大鼠行視網膜鋪片。摘除眼球,5-0縫線標記大鼠眼球鼻側。沿角鞏膜緣剪去角膜,去除晶狀體、玻璃體,置于4%多聚甲醛中,4℃固定l h。在鞏膜周邊剪開4~6個放射狀切口,取完整視網膜,PBS漂洗1次。在視網膜3、6、9點時鐘位各剪一小口,將視網膜平鋪于明膠玻片上,玻璃體面朝上,清除視網膜上殘余玻璃體,避光保存,4℃冰箱干燥過夜。750 g/L甘油封片。倒置熒光顯微鏡下觀察視網膜鋪片。以視盤為中心,以背腹、鼻顳方向為坐標將視網膜分為4個象限。每個象限從距視盤l/6、1/2、5/6視網膜半徑處選取3個區域,200倍視野下進行熒光照相,計數每個視野視網膜上標記的細胞數,以12個區每個視野平均細胞數為RGC數。根據4個象限RGC數的總和計算RGC標識率。標識率=每只大鼠損傷眼RGC/對照眼RGC×100%。
視神經損傷2周后再次麻醉大鼠,開胸行左心室插管,剪開右心耳,4℃預冷的生理鹽水灌注至流出液基本清亮。40 g/L多聚甲醛150 ml持續灌注20 min后,至大鼠全身變硬。取眼球并用5-0縫線標記大鼠眼球鼻側。沿角鞏膜緣剪去角膜,去除晶狀體、玻璃體,再置于40 g/L多聚甲醛中4℃固定l2 h后常規梯度酒精脫水,二甲苯透明,石蠟包埋。沿矢狀位方向行視網膜全層切片,片厚4μm,60℃烤片2 h后備用。常規HE染色,光學顯微鏡下觀察視網膜的形態學變化;取3個視野,計算平均RGC數。
采用SPSS 13.0統計軟件進行統計學分析處理,數據以均數±標準差(
2 結果
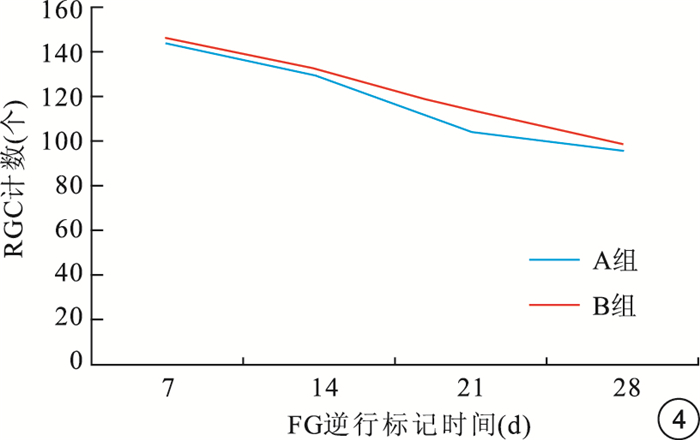
倒置熒光顯微鏡觀察發現,A、B組對照眼均可見大量FG標記的存活RGC,損傷眼FG標記的存活RGC明顯減少(圖 1~3)。隨注射時間延長,A、B組大鼠RGC計數均呈下降趨勢,B組大鼠損傷眼RGC計數下降幅度明顯較A組平緩(圖 4)。A、B組大鼠損傷眼RGC計數均低于對照眼,差異有統計學意義(t=3.24、3.15,P<0.05)。FG逆行標記后7、14、21、28 d,A、B組大鼠損傷眼RGC計數比較,差異均有統計學意義(t=4.78、4.70、3.98、3.27,P<0.05)(表 1, 2)。
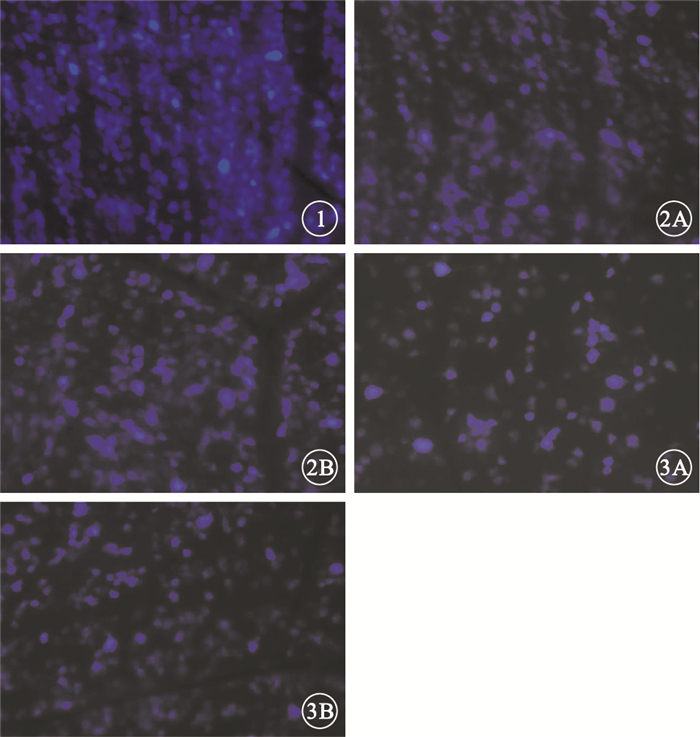
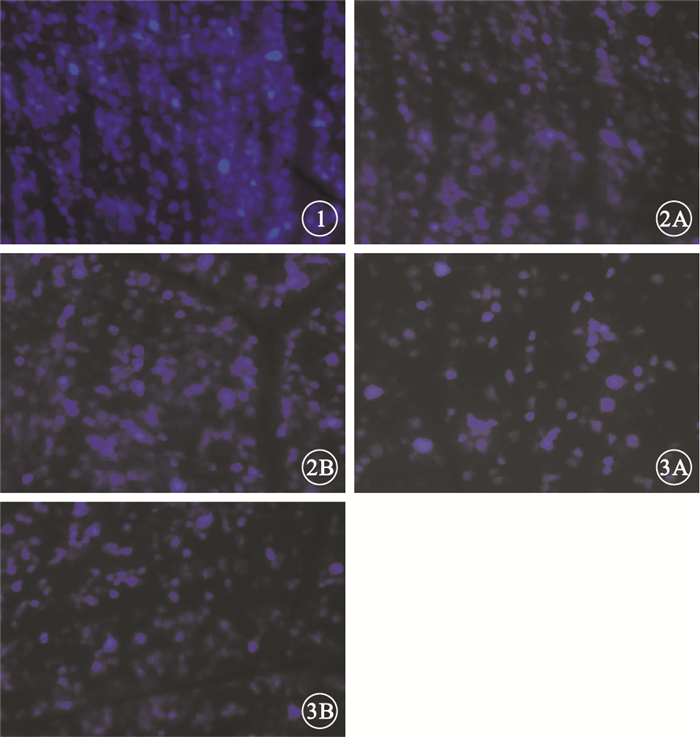 圖1
對照眼倒置相差顯微鏡像。可見大量視網膜內熒光金標記的存活RGC×200??圖 2?損傷眼FG逆行標記后7 d倒置相差顯微鏡像。2A.A組;2B.B組。可見視網膜內熒光金標記的存活RGC×200??圖 3?損傷眼FG逆行標記后28 d倒置相差顯微鏡像。3A.A組;3B.B組。可見視網膜內熒光金標記的存活RGC×200
圖1
對照眼倒置相差顯微鏡像。可見大量視網膜內熒光金標記的存活RGC×200??圖 2?損傷眼FG逆行標記后7 d倒置相差顯微鏡像。2A.A組;2B.B組。可見視網膜內熒光金標記的存活RGC×200??圖 3?損傷眼FG逆行標記后28 d倒置相差顯微鏡像。3A.A組;3B.B組。可見視網膜內熒光金標記的存活RGC×200
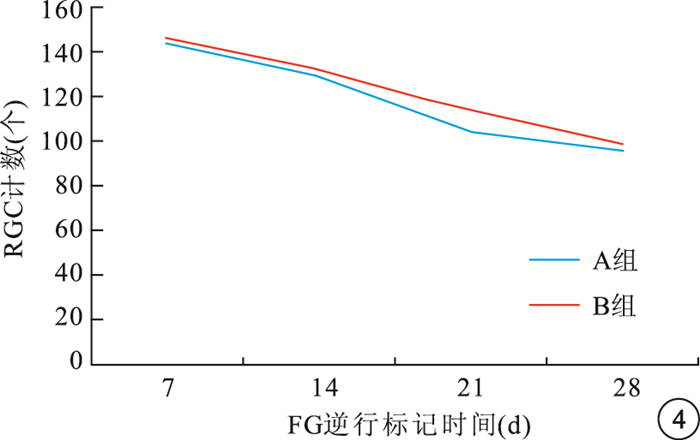 圖4
FG逆行標記后不同時間點兩組大鼠損傷眼RGC計數變化趨勢
圖4
FG逆行標記后不同時間點兩組大鼠損傷眼RGC計數變化趨勢
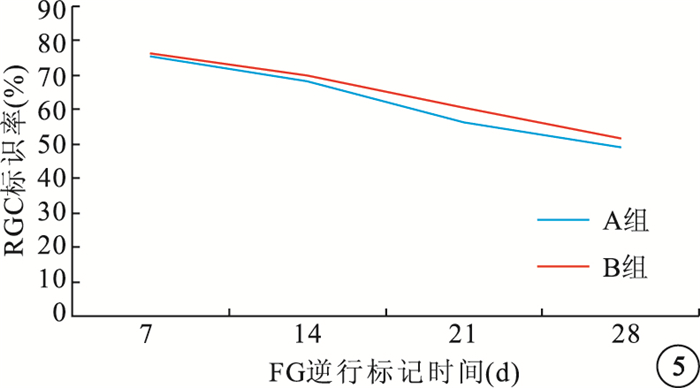
隨注射時間延長,A、B組大鼠RGC標識率均呈下降趨勢(圖 5)。FG逆行標記后7、14、21、28 d,A、B組組內大鼠RGC標識率比較,差異均有統計學意義(P<0.05);B組大鼠標識率較A組明顯提高,差異均有統計學意義(t=4.39、4.21、4.36、5.07,P<0.05)(表 3)。
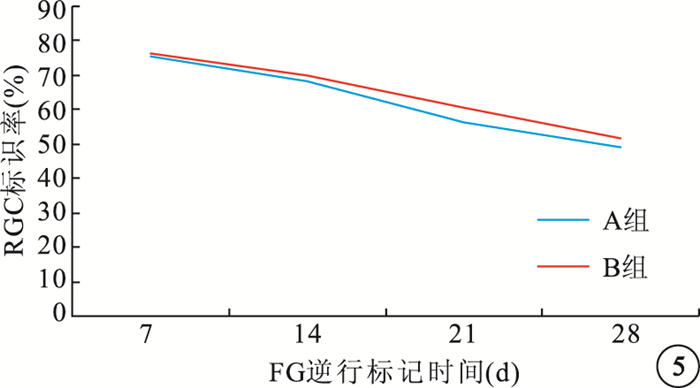 圖5
FG逆行標記后不同時間點兩組大鼠損傷眼RGC標識率變化趨勢
圖5
FG逆行標記后不同時間點兩組大鼠損傷眼RGC標識率變化趨勢
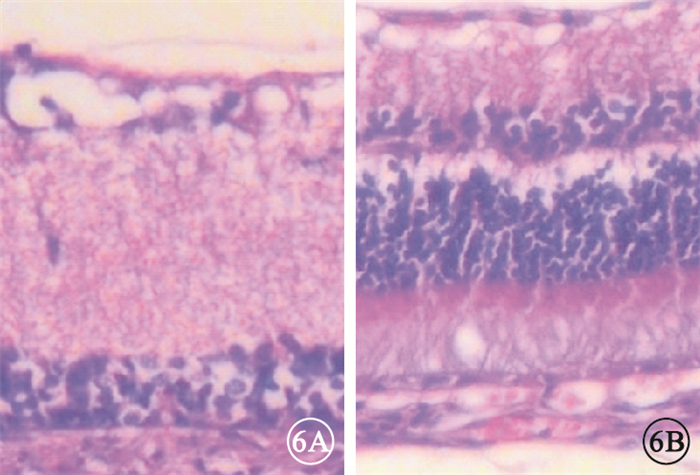
光學顯微鏡觀察發現,大鼠對照眼視網膜組織結構清晰,RGC層細胞排列規整。A、B組大鼠損傷眼視網膜各層變薄,RGC層核固縮、空泡樣變性、細胞排列紊亂,RGC數量減少;損傷處視神經腫脹、出血,膠質細胞排列紊亂,空泡樣變性,隨損傷后時間延長而加重(圖 6)。A組較B組病理改變更嚴重。
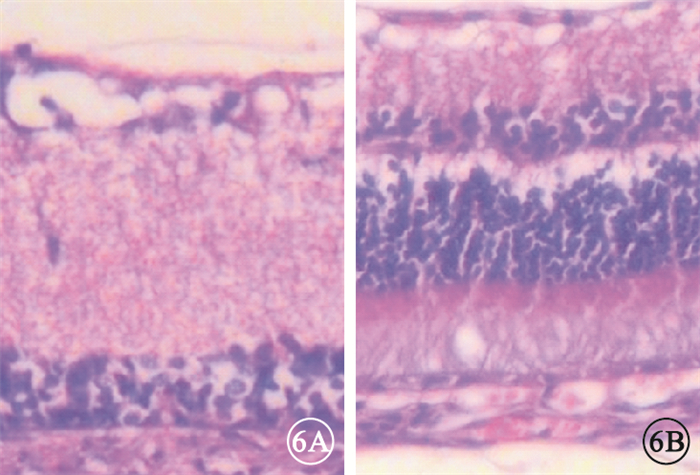 圖6
視神經損傷后2周大鼠損傷眼光學顯微鏡像。6A. A組;6B. B組。視網膜各層變薄,RGC層核固縮、空泡樣變性、細胞排列紊亂,RGC數量減少?HE×200
圖6
視神經損傷后2周大鼠損傷眼光學顯微鏡像。6A. A組;6B. B組。視網膜各層變薄,RGC層核固縮、空泡樣變性、細胞排列紊亂,RGC數量減少?HE×200
3 討論
RGC是視網膜的第三級神經元,其軸突即視神經纖維匯集成視神經。大鼠視神經損傷后,RGC失去營養供給,通過應激反應刺激節細胞發生急劇的生化反應發生以凋亡為主的繼發性改變[6]。這種反應也可通過神經元突觸等方式傳遞給一、二級神經元,使視網膜光感受器細胞層和內核層細胞也隨之減少,同時視神經夾阻礙了視網膜的血供,造成了視網膜的缺血樣改變,也會加劇光感受器細胞層和內核層細胞繼發死亡,導致視功能的下降[7]。我們通過建立視神經鉗夾傷大鼠模型,采用球周注射hUCBSC懸液,觀察hUCBSC對RGC的可能保護作用。結果顯示,隨注射時間延長,A、B組大鼠RGC計數均呈下降趨勢,B組大鼠損傷眼RGC計數下降幅度明顯較A組平緩;A、B組大鼠均可見視網膜各層變薄,RGC層核固縮、空泡樣變性、細胞排列紊亂等病理改變,且以B組程度更重。說明視神經損傷時球周注射hUCBSC可以有效的保護受損的RGC。但有關hUCBSC促進神經恢復的作用機制尚不明確。我們分析認為,這一方面可能與干細胞在局部微環境的刺激下,向受損組織細胞分化并替代受損細胞,與周圍細胞建立聯系,促進神經功能的恢復有關。另一方面,可能與干細胞通過自分泌的形式產生各種細胞因子有關[8-10]。這些細胞因子可作為細胞傳遞信號,調節細胞的增生與分化,并對神經細胞起到營養支持作用,限制損傷的范圍和促進功能的恢復。
但本研究觀察指標單一,未能進行凋亡相關蛋白、原位末端標記法以及視網膜電生理等功能學實驗檢查,有關hUCBSC移植對視神經損傷后RGC的具體保護作用和確切機制還有待進一步研究。
視網膜神經節細胞(RGC)和上級神經元依靠軸索和神經突觸相互聯系,視神經損傷后RGC數目減少速度明顯增快[1]。干細胞可替代壞死或受損的神經元并具有修復周圍神經缺損的能力[2]。采用移植干細胞治療視神經損傷已在動物實驗中取得了一定進展[3]。人臍血干細胞(hUCBSC)因移植成活率高、移植物抗宿主病低、取材方便等優勢,已成功應用于數十種疾病的治療[4, 5]。但目前關于hUCBSC移植治療視神經損傷的效果還不太明確。為此,我們給予視神經鉗夾傷模型大鼠球周注射hUCBSC懸液,應用熒光金(FG)神經逆行標記RGC計數技術及蘇木精-伊紅(HE)染色方法觀察了人臍血干細胞對大鼠外傷性視神經損傷后RGC的保護作用。現將結果報道如下。
1 材料和方法
視神經夾(夾持力約40 g,日本國立公司),手術顯微鏡(蘇州六六視覺股份有限公司),顯微手術器械(上海醫用器械廠),hUCBSC(深圳北科生物公司),1μl微量注射器(上海醫用激光器械廠),腦立體定位儀(YZ20P型,蘇州醫療器械廠),倒置熒光顯微鏡DX60(日本Olympus公司),FG(美國sigma公司),多聚甲醛粉劑(北京中山公司)。石蠟包埋、切片機(廣州三元科技有限公司)。HE(北京中山公司)。
雄性健康成年Sprague-Dawley大鼠48只,體重200~300 g,昆明醫學院動物實驗室提供。眼前節及眼底檢查均正常。飼養環境為12 h光照/12 h黑暗,左眼為損傷眼,右眼為對照眼。大鼠麻醉后固定于手術臺,在上眼瞼緣中央做垂直、橫行切口各1 cm,剪開穹窿部結膜,鈍性分離暴露視神經,在球后2 mm處用微型視神經夾垂直于視神經水平軸的視神經鉗夾30 s,并同時觀察。大鼠實驗眼瞳孔散大,直接對光反射消失,間接對光反射存在,視網膜血管無出血或梗死,鉗夾傷后5 min內血流完全恢復者納入實驗。大鼠建模后隨機分為A、B組,均為24只大鼠。A組大鼠左眼球周注射0.1 ml磷酸鹽緩沖液(PBS);B組大鼠左眼球周注射0.1 ml hUCBSC懸液。建模后7 d,大鼠腹腔注射10%水合氯醛麻醉,自下眶切跡垂直進針注射進針約0.5 cm。注射后注射處涂四環素眼膏。
處死前7 d,大鼠麻醉后固定于大腦定位儀操作架上,沿正中線切開顱頂皮膚,暴露矢狀縫及頂間縫,確定前囟部Bregma點。參照Paxinas圖譜以Bregma點為零點,再后移6.5 mm,在兩側旁開中線1.5 mm處對稱選點,用牙科鉆造2個直徑約l mm的骨孔。顯微鑷撕開骨孔處的硬腦膜,在距前囟后6.3、6.8 mm處的骨孔內,用微量注射器注入5%的FG 0.8μl,5 min內注射完畢,深度分別為3.6、4.0 mm,留針5 min。另側上丘同樣操作。
FG逆行標記后7、14、21、28 d,兩組分別隨機選取6只大鼠行視網膜鋪片。摘除眼球,5-0縫線標記大鼠眼球鼻側。沿角鞏膜緣剪去角膜,去除晶狀體、玻璃體,置于4%多聚甲醛中,4℃固定l h。在鞏膜周邊剪開4~6個放射狀切口,取完整視網膜,PBS漂洗1次。在視網膜3、6、9點時鐘位各剪一小口,將視網膜平鋪于明膠玻片上,玻璃體面朝上,清除視網膜上殘余玻璃體,避光保存,4℃冰箱干燥過夜。750 g/L甘油封片。倒置熒光顯微鏡下觀察視網膜鋪片。以視盤為中心,以背腹、鼻顳方向為坐標將視網膜分為4個象限。每個象限從距視盤l/6、1/2、5/6視網膜半徑處選取3個區域,200倍視野下進行熒光照相,計數每個視野視網膜上標記的細胞數,以12個區每個視野平均細胞數為RGC數。根據4個象限RGC數的總和計算RGC標識率。標識率=每只大鼠損傷眼RGC/對照眼RGC×100%。
視神經損傷2周后再次麻醉大鼠,開胸行左心室插管,剪開右心耳,4℃預冷的生理鹽水灌注至流出液基本清亮。40 g/L多聚甲醛150 ml持續灌注20 min后,至大鼠全身變硬。取眼球并用5-0縫線標記大鼠眼球鼻側。沿角鞏膜緣剪去角膜,去除晶狀體、玻璃體,再置于40 g/L多聚甲醛中4℃固定l2 h后常規梯度酒精脫水,二甲苯透明,石蠟包埋。沿矢狀位方向行視網膜全層切片,片厚4μm,60℃烤片2 h后備用。常規HE染色,光學顯微鏡下觀察視網膜的形態學變化;取3個視野,計算平均RGC數。
采用SPSS 13.0統計軟件進行統計學分析處理,數據以均數±標準差(
2 結果
倒置熒光顯微鏡觀察發現,A、B組對照眼均可見大量FG標記的存活RGC,損傷眼FG標記的存活RGC明顯減少(圖 1~3)。隨注射時間延長,A、B組大鼠RGC計數均呈下降趨勢,B組大鼠損傷眼RGC計數下降幅度明顯較A組平緩(圖 4)。A、B組大鼠損傷眼RGC計數均低于對照眼,差異有統計學意義(t=3.24、3.15,P<0.05)。FG逆行標記后7、14、21、28 d,A、B組大鼠損傷眼RGC計數比較,差異均有統計學意義(t=4.78、4.70、3.98、3.27,P<0.05)(表 1, 2)。
 圖1
對照眼倒置相差顯微鏡像。可見大量視網膜內熒光金標記的存活RGC×200??圖 2?損傷眼FG逆行標記后7 d倒置相差顯微鏡像。2A.A組;2B.B組。可見視網膜內熒光金標記的存活RGC×200??圖 3?損傷眼FG逆行標記后28 d倒置相差顯微鏡像。3A.A組;3B.B組。可見視網膜內熒光金標記的存活RGC×200
圖1
對照眼倒置相差顯微鏡像。可見大量視網膜內熒光金標記的存活RGC×200??圖 2?損傷眼FG逆行標記后7 d倒置相差顯微鏡像。2A.A組;2B.B組。可見視網膜內熒光金標記的存活RGC×200??圖 3?損傷眼FG逆行標記后28 d倒置相差顯微鏡像。3A.A組;3B.B組。可見視網膜內熒光金標記的存活RGC×200
 圖4
FG逆行標記后不同時間點兩組大鼠損傷眼RGC計數變化趨勢
圖4
FG逆行標記后不同時間點兩組大鼠損傷眼RGC計數變化趨勢
隨注射時間延長,A、B組大鼠RGC標識率均呈下降趨勢(圖 5)。FG逆行標記后7、14、21、28 d,A、B組組內大鼠RGC標識率比較,差異均有統計學意義(P<0.05);B組大鼠標識率較A組明顯提高,差異均有統計學意義(t=4.39、4.21、4.36、5.07,P<0.05)(表 3)。
 圖5
FG逆行標記后不同時間點兩組大鼠損傷眼RGC標識率變化趨勢
圖5
FG逆行標記后不同時間點兩組大鼠損傷眼RGC標識率變化趨勢
光學顯微鏡觀察發現,大鼠對照眼視網膜組織結構清晰,RGC層細胞排列規整。A、B組大鼠損傷眼視網膜各層變薄,RGC層核固縮、空泡樣變性、細胞排列紊亂,RGC數量減少;損傷處視神經腫脹、出血,膠質細胞排列紊亂,空泡樣變性,隨損傷后時間延長而加重(圖 6)。A組較B組病理改變更嚴重。
 圖6
視神經損傷后2周大鼠損傷眼光學顯微鏡像。6A. A組;6B. B組。視網膜各層變薄,RGC層核固縮、空泡樣變性、細胞排列紊亂,RGC數量減少?HE×200
圖6
視神經損傷后2周大鼠損傷眼光學顯微鏡像。6A. A組;6B. B組。視網膜各層變薄,RGC層核固縮、空泡樣變性、細胞排列紊亂,RGC數量減少?HE×200
3 討論
RGC是視網膜的第三級神經元,其軸突即視神經纖維匯集成視神經。大鼠視神經損傷后,RGC失去營養供給,通過應激反應刺激節細胞發生急劇的生化反應發生以凋亡為主的繼發性改變[6]。這種反應也可通過神經元突觸等方式傳遞給一、二級神經元,使視網膜光感受器細胞層和內核層細胞也隨之減少,同時視神經夾阻礙了視網膜的血供,造成了視網膜的缺血樣改變,也會加劇光感受器細胞層和內核層細胞繼發死亡,導致視功能的下降[7]。我們通過建立視神經鉗夾傷大鼠模型,采用球周注射hUCBSC懸液,觀察hUCBSC對RGC的可能保護作用。結果顯示,隨注射時間延長,A、B組大鼠RGC計數均呈下降趨勢,B組大鼠損傷眼RGC計數下降幅度明顯較A組平緩;A、B組大鼠均可見視網膜各層變薄,RGC層核固縮、空泡樣變性、細胞排列紊亂等病理改變,且以B組程度更重。說明視神經損傷時球周注射hUCBSC可以有效的保護受損的RGC。但有關hUCBSC促進神經恢復的作用機制尚不明確。我們分析認為,這一方面可能與干細胞在局部微環境的刺激下,向受損組織細胞分化并替代受損細胞,與周圍細胞建立聯系,促進神經功能的恢復有關。另一方面,可能與干細胞通過自分泌的形式產生各種細胞因子有關[8-10]。這些細胞因子可作為細胞傳遞信號,調節細胞的增生與分化,并對神經細胞起到營養支持作用,限制損傷的范圍和促進功能的恢復。
但本研究觀察指標單一,未能進行凋亡相關蛋白、原位末端標記法以及視網膜電生理等功能學實驗檢查,有關hUCBSC移植對視神經損傷后RGC的具體保護作用和確切機制還有待進一步研究。